Method Article
Preparación, Imaging, y cuantificación de la superficie bacteriana Motilidad ensayos
En este artículo
Resumen
Swarming motility is influenced by physical and environmental factors. We describe a two-phase protocol and guidelines to circumvent the challenges commonly associated with swarm assay preparation and data collection. A macroscopic imaging technique is employed to obtain detailed information on swarm behavior that is not provided by current analysis techniques.
Resumen
La motilidad superficie bacteriana, tales como enjambre, se examina comúnmente en el laboratorio usando los ensayos de placa que requieren concentraciones específicas de agar y, a veces inclusión de nutrientes específicos en el medio de crecimiento. La preparación de tales medios y condiciones de crecimiento explícitas superficie sirve para proporcionar las condiciones favorables que permiten no sólo el crecimiento de bacterias, pero la motilidad coordinada de las bacterias más de estas superficies dentro de películas líquidas delgadas. La reproducibilidad de la placa de enjambre y otros ensayos de placa de motilidad superficie puede ser un gran desafío. Especialmente para los más "enjambres templados" que muestran la motilidad sólo dentro de los rangos de agar de 0,4% -0,8% (p / v), cambios menores en el protocolo o entorno de laboratorio puede influir mucho en los resultados del ensayo de enjambre. "Humectabilidad", o contenido de agua en la interfase líquido-sólido-aire de estos ensayos de placa, a menudo es una variable clave para ser controlado. Un reto adicional en la evaluación de la enjambrazón es cómo cuantificar observed diferencias entre dos (o más) experimentos. A continuación te detallamos un protocolo de dos fases versátil para preparar y ensayos imagen enjambre. Incluimos directrices para eludir los retos comúnmente asociados con la preparación de medios de ensayo de enjambre y cuantificación de los datos de estos ensayos. En especial, demostramos nuestro método utilizando bacterias que expresan los periodistas genéticas fluorescentes o bioluminiscentes como proteína verde fluorescente (GFP), luciferasa (operón lux), o manchas celulares para permitir imágenes ópticas-time lapse. Además, demuestran la capacidad de nuestro método para rastrear competir especies que pululan en el mismo experimento.
Introducción
Muchas bacterias se mueven sobre superficies utilizando diversos medios de auto-propulsión. Algunos fenotipos de motilidad se pueden investigar en el laboratorio usando los ensayos de placa que se ven afectados por el medio líquido asociado con la composición de ensayo de placa de semi-sólido. Un subconjunto de la superficie útil ensayos de placa motilidad implica además un aire de gas fase típicamente habitación. En consecuencia, el resultado de cualquier ensayo de la motilidad superficie en particular, exige un cuidadoso control de la interfaz de tres fases: la superficie sólida ambiental local, el medio ambiente líquido y propiedades de entorno gas.
El modo de la motilidad más comúnmente estudiado en un ensayo de este tipo de tres fases se conoce como un enjambre. Motilidad enjambre es el movimiento grupo coordinado de las células bacterianas que son impulsados por sus flagelos a través de películas líquidas delgadas sobre superficies 1. Se estudia normalmente en laboratorios utilizando los ensayos de placa semi-sólidos que contienen 0,4% -0,8% (p / v) de agar 1. Una serie depatógenos humanos explotan este comportamiento motilidad para explorar y colonizar el huésped humano. Por ejemplo, Proteus mirabilis utiliza la motilidad enjambre de ascender en la uretra, alcanzando y colonizar la vejiga y los riñones 2. Motilidad enjambrazón es generalmente considerado como un paso precursor de la formación del biofilm, la causa principal de la patogénesis de muchos patógenos humanos 3.
El fenotipo enjambre es muy variada entre las especies bacterianas; el éxito experimental y reproducibilidad dependen en gran medida de factores tales como la composición de nutrientes, el tipo de agar y la composición, el protocolo de esterilización (por ejemplo, esterilización en autoclave), semi-sólida de curado medios de comunicación, y de la humedad ambiente (por ejemplo, cambios estacionales), entre otros 3-5. La variabilidad de las respuestas de la motilidad de superficie hace hincapié en los problemas encontrados en estos estudios y los medios de influencia significativa y el medio ambiente pueden ejercer. Para algunas especies que pululan, como Pseudomonas, mot enjambreility puede ocurrir en una variedad de composiciones de medios, aunque el fenotipo observado y acompañando tasa de expansión enjambre variarán en gran medida 3. Combinados, estos factores pueden hacer estudios de motilidad superficie extremadamente desafiante. La variabilidad estacional dentro de un laboratorio puede influir en estos ensayos de tres fases: ensayos pueden funcionar mejor en el aire húmedo del verano y peor en el aire seco del invierno. Aquí presentamos las pautas generales para evitar algunos de los desafíos más notables cuando se realizan estudios de superficie de la placa de la motilidad.
Para algunos estudios de la motilidad de la superficie, el desarrollo de fenotipos específicos es de gran interés. La mayoría, aunque no en todos los estudios publicados para examinar enjambre de P. aeruginosa muestran la formación de zarcillos o fractales que irradian desde un centro de inoculación 3-9. Las diferencias entre P. aeruginosa cepas se han documentado 5,8, pero gran parte de la presencia o ausencia de zarcillos pueden ser atribuidos a la especific medio y el protocolo usado para estos ensayos de placa de la motilidad enjambre. Aquí se incluyen los detalles sobre cómo promover enjambres zarcillo de formación para P. aeruginosa. Debido P. aeruginosa es sólo una de las muchas bacterias que pululan, también incluimos detalles de nuestro método para examinar enjambre de Bacillus subtilis y vuelo sin motor de Myxococcus xanthus. Como P. aeruginosa, la investigación actual sobre B. subtilis y M. xanthus abarca una variedad de temas como los investigadores están trabajando para discernir los aspectos de la esporulación, la motilidad, la respuesta al estrés, y el comportamiento de transición 1,10. Hay una necesidad de cuantificar los patrones y la dinámica del comportamiento específico (s) para estas células en grupos enjambre.
Adquisición de datos de la motilidad de superficie, el análisis y la interpretación puede ser engorroso y cualitativa. Hemos desarrollado un protocolo para el análisis macroscópico detallada de enjambres bacterianas que ofrece además a pulular morfología de zona y size (por ejemplo, diámetro), información dinámica cuantitativa sobre tasa de expansión enjambre y distribución bacteriana o la densidad de bioproductos 7. Además, este método puede tomar ventaja de las proteínas fluorescentes disponibles, luminiscencia, y colorantes para obtener una visión global de las interacciones bacterianas 8, así como para realizar un seguimiento de la síntesis de bioproductos (por ejemplo, P. aeruginosa ramnolípido 7,8) dentro de un enjambre.
Protocolo
1. Swarm Ensayo Preparación de Medios y Inoculación 4,5,7,8,11
- Preparación de Medios
NOTA: La composición del medio descrito a continuación es aplicable a P. aeruginosa estudios de formación zarcillo. Por favor, consulte las especificaciones de los medios de comunicación en la Tabla 1 para P. aeruginosa, B. subtilis, y M. ensayos de movilidad superficie xanthus.- Mezclar 200 ml de FAB-menos (NH 4) 2 SO 4 medianas enjambre (Tabla de Materiales), 0,9 g de agar Noble, y 0,2 g de ácidos Casamino (Tabla 1) por agitación con una barra de agitación magnética. Use pequeños volúmenes (100-300 ml) para mejorar la coherencia entre los experimentos.
- Autoclave la mezcla de 200 ml de agar / media utilizando un tiempo de exposición de 22 min, temperatura de exposición de 121,1 ° C, y una opción de ventilación rápida. Los ajustes de autoclave permiten la esterilización adecuada y la fusión de agar, pero evitar la caramelización agar.
NOTA: agar Noble es propenso a caramelozación; la motilidad bacteriana se altera en agar caramelizado. - Inmediatamente después de que el ciclo de esterilización ha finalizado, cierre la tapa de la botella de medios para evitar la pérdida de agua por evaporación. Sin embargo, tenga en cuenta que taponado apretado puede causar un "vacío de sellado" efecto -como en la botella.
- Enfriar los medios de comunicación a 50 ° C mientras se agitaba a temperatura ambiente (RT) y añadir 2 ml de solución estéril de glucosa 1,2 M. Como alternativa, coloque los medios de comunicación en una incubadora o baño de agua a 60 ° C hasta su utilización (hasta 15 horas más tarde), y proceder como se indica. Para evitar la formación de burbujas en los medios de comunicación, mezclar bien usando la barra de agitación magnética; burbujas en la superficie del agar impedirá incluso enjambre.
NOTA: Para otros ensayos, añadir en este paso componentes sensibles al calor que no pueden ser esterilizados en autoclave, tales como nutrientes o colorantes adicionales, según sea necesario (por ejemplo, la adición de 8 l Invitrogen Syto 63 colorante por 100 ml de agar se fundió a la imagen de M. xanthus como se muestra en RepresentatiResultados ve, a continuación). La adición de algunos tintes puede afectar el comportamiento de enjambre de línea de base, que debe cotejarse con un control sin tinte. - En una campana de laboratorio, alícuota de 7,5 ml de medio estéril por 60 mm de diámetro de poliestireno plato Petri y mantener las placas en una sola capa (no apiladas). Para mayor superficie enjambre, alícuota de 25 ml de medio por 100 mm de diámetro placa de Petri. Es importante llenar los platos sobre una superficie plana horizontal. Utilice altura de los ojos de buey para comprobar si la superficie está nivelada.
NOTA: Para P. ensayos aeruginosa, utilizando un volumen de medios específicos por placa mejorarán la coherencia y la reproducibilidad. Para B. subtilis y M. ensayos xanthus, vertiendo mano da resultados comparables a alícuotas de volumen específicos.
- Curado Plate
- Para platos pequeños (60 mm), permita que el medio de agar fundido para curar (tanto ajustado a semi-sólida y seca el exceso de líquido) en la campana al descubierto (es decir, sin tapas) durante 30 min. Ampliarplacas (100 mm) requieren un tiempo de curado más largo (véase la discusión).
NOTA: Como alternativa, algunos ensayos pueden requerir placas para curar durante la noche en el banco de la parte superior (20-24 hr) cubierto (es decir, las tapas en) en una sola capa (Tabla 1). La enjambrazón es sensible tanto exceso y la insuficiencia de humedad. La humedad, flujo de aire, y la temperatura de cualquier laboratorio dado pueden requerir variación a la placa de curado para promover enjambre óptima de ustedes bacteria. - Inocular las placas inmediatamente después del período de secado ha terminado. No guarde las placas para su uso posterior.
- Realice la "prueba de propagación de la tinta" mediante la detección de una placa de ensayo con la mezcla de 10 l de 0,50% (vol / vol) India Ink Higgins Impermeable Negro y inóculo bacteriano 11. Si la mezcla de tinta / inóculo se propaga fácilmente (es decir, no conserva la forma de gota) en la superficie de los medios de comunicación, los medios de comunicación si necesitan más tiempo para secarse.
NOTA: Para las especies que son particularmente sensibles a la humedad ( por ejemplo, P. aeruginosa), realice un rápido "prueba de propagación de la tinta" 11 para determinar si las placas son lo suficientemente seco.
- Realice la "prueba de propagación de la tinta" mediante la detección de una placa de ensayo con la mezcla de 10 l de 0,50% (vol / vol) India Ink Higgins Impermeable Negro y inóculo bacteriano 11. Si la mezcla de tinta / inóculo se propaga fácilmente (es decir, no conserva la forma de gota) en la superficie de los medios de comunicación, los medios de comunicación si necesitan más tiempo para secarse.
- Para platos pequeños (60 mm), permita que el medio de agar fundido para curar (tanto ajustado a semi-sólida y seca el exceso de líquido) en la campana al descubierto (es decir, sin tapas) durante 30 min. Ampliarplacas (100 mm) requieren un tiempo de curado más largo (véase la discusión).
- Enjambre ensayo Inoculación
- Inocular 6 ml de medios de cultivo de caldo (véase la Tabla 1 para más detalles) con una colonia aislada de una (<5 días de edad si se deja a temperatura ambiente) Lisogenia Broth (LB) cultivo en placa fresca. Incubar caldos de cultivo durante la noche (≤18 h) a 30 ° C o 37 ° C con agitación horizontal (240 rpm).
- Inocular placas enjambre manchando con 1.5 l de caldo de cultivo durante la noche, o por "meter" el agar con un diente estéril recoger o aguja de inoculación de alambre.
NOTA: Preferimos el último método, ya que disminuye la probabilidad de salpicando el inóculo y evita la adición de humedad adicional a la superficie enjambre.
- Enjambre Ensayo Incubación
- Para el ensayo en general, incubar las placas de ensayo enjambre a 30ºC o 37 ° C (o incluso 42 ° C para B. subtilis, Tabla 1): ésta es la bacteria específica. Invertir las placas durante la incubación de manera que el exceso de humedad se condensa en la tapa, no el agar.
NOTA: La temperatura puede afectar el fenotipo, así como la cinética. Para P. enjambres aeruginosa, la incubación a 37 ° C conduce a un crecimiento más rápido y el enjambre de expansión de la incubación a 30 ° C; sin embargo, la morfología de estos enjambres a menudo difiere con este cambio en la temperatura. - Para time-lapse, incubar las placas enjambre a la temperatura adecuada antes de la transferencia en la estación de formación de imágenes (ver Tabla 1 para más detalles).
NOTA: Esta incubación previa de imagen permite enjambres para iniciar su desarrollo y se establezcan antes de ser trasladado a un nuevo ambiente, que pueden o no ser óptimo para la motilidad enjambre.
- Para el ensayo en general, incubar las placas de ensayo enjambre a 30ºC o 37 ° C (o incluso 42 ° C para B. subtilis, Tabla 1): ésta es la bacteria específica. Invertir las placas durante la incubación de manera que el exceso de humedad se condensa en la tapa, no el agar.
2. Imagen macroscópica de la superficie Motilidad Ensayos 7,8
- Para time-lapse, después de las pre-imágenes placas de ensayo enjambre período de incubación lugar en una placa de imagen clara dentro de un in vivo estación comercial de imágenes. Imagen hasta seis, 60 mm de diámetro o cuatro, 100 placas mm de diámetro a la vez. Dado que la cámara captura imágenes de debajo del plano de la imagen, invertir las placas de manera que la trayectoria óptica no está obstruido 8. Alternativamente, se incuban a 30 ° C o 37 ° C (Tabla 1) para la duración del experimento, y eliminar las placas para obtener imágenes de la incubadora a intervalos de tiempo establecidos.
- Colocar las tapas de las placas de Petri en posición vertical sobre la parte superior de la contraparte placa que contiene el medio inoculado. Llenar las tapas de las cajas de Petri con agua para evitar el secado excesivo durante la exploración, y adjuntar toda la puesta en marcha usando otra bandeja clara para mantener la humedad durante todo el experimento.
- Uso de Imagen Molecular (MI) de software 12, ensayo (s) de gestión a temperatura ambiente usando la imenvejecimiento ajustes que se describen en la Tabla 2. Para time-lapse, establecer un protocolo con las medidas y especificaciones necesarias.
3. Procesamiento e Interpretación de Datos 7,8
- Procesamiento De Imágenes
- Utilice software de MI para exportar imágenes por lotes como archivos TIFF de 16 bits: Archivo> Exportar o exportar varios> Seleccionar archivo (s) para exportar y ubicación de exportación.
- Utilice ImageJ para abrir una sola imagen o importar una serie de lapso de tiempo:
- Abrir una sola imagen: Archivo> Abrir
- Importación de lapso de tiempo de secuencia de imagen: Archivo> Secuencia de importación, y seleccione "Ordenar nombres numéricamente".
- Para los archivos de lapso de tiempo de mayor tamaño, seleccione "Usar pila virtual" en la ventana "Importar Secuencia" apilar las imágenes exportadas en las categorías adecuadas (es decir, GFP, RFP, etc.).
- Si es necesario, cambiar las imágenes de archivos de 16 bits en archivos de 8 bits: Imagen> Tipo> 8-bit
NOTA: Algunas herramientas ImageJ requieren imágenes de 8 bits. - Determinar si la señal de intensidad para una secuencia de imágenes o de lapso de tiempo necesita ser invertida. Coloque el cursor en un punto brillante en la imagen (por ejemplo, el crecimiento de la etiqueta fluorescente) y tenga en cuenta la intensidad de la señal "Valor" de la barra de herramientas ImageJ. Luego, coloque el cursor en un punto oscuro fuera del área de la placa y tomar nota de la intensidad de la señal. Si la intensidad de la señal para el punto oscuro es mayor que la intensidad de la mancha, la intensidad de señal de imagen necesita ser invertida (siga subetapas 1-2 abajo).
- Invierta las señales de intensidad: Editar> Invertir
- Invierta la tabla de búsqueda: Imagen> Tablas de búsqueda> Invertir LUT
- Reste el fondo: Proceso> Reste fondo, y utilizar un "Rodando radio de la bola" con un radio de píxeles que es la mitad de una de las dimensiones de la imagen (por ejemplo, 1.000 píxeles para una p 2.000 x 2.000Ixel imagen).
- Artificialmente colorear una secuencia de imágenes o time-lapse: Imagen> tablas de búsqueda, y seleccione el color apropiado de las opciones de la lista.
- Para las películas con dos o más canales, combinar y equilibrar los colores antes de guardar como una película (Image Processing, Paso 8). Para fusionar imágenes juntas, abierto todas las pilas de imagen en ImageJ, a continuación, seleccione Imagen> Color> Combinar Canales, y asignar cada pila a un canal de color.
- Guardar secuencia de lapso de tiempo como AVI o QuickTime Movie: Archivo> Guardar como, y elegir el formato y las especificaciones que desee.
- Análisis De Los Datos
- La adquisición de Zona de Crecimiento de la superficie bacteriana para cuantificar Expansión Tarifa
- Abrir imagen (s) en ImageJ
- Para calcular el diámetro de la placa en píxeles, dibujar una línea a través del centro de una placa de ensayo con la herramienta "Straight" de la y medir su longitud: Analizar> Medida
- La unidad de medida predeterminada en ImageJ es la pixel. Obtener un factor de conversión dividiendo el diámetro de la placa de ensayo (por ejemplo, 60 para una placa de 60 mm) por la longitud de píxel obtenido en la etapa anterior.
- Cambie la unidad de medida de píxel a mm: Imagen> Propiedades
- Cambie la "Unidad de longitud" a "mm", y el "Pixel Ancho", "Pixel Altura" y "Profundidad Voxel" para el factor de conversión calculado en el paso anterior. Seleccione la casilla de "Global" para mantener este factor de conversión a través de múltiples imágenes.
NOTA: Si ImageJ se cierra y vuelve a abrir, o el campo de visión de una imagen se cambia (es decir, una imagen se ha ampliado más que otro), el factor de conversión debe ser recalculado. Alternativamente, lleve a cabo todos los análisis en píxeles y después se convierte en mm.
- Cambie la "Unidad de longitud" a "mm", y el "Pixel Ancho", "Pixel Altura" y "Profundidad Voxel" para el factor de conversión calculado en el paso anterior. Seleccione la casilla de "Global" para mantener este factor de conversión a través de múltiples imágenes.
- Para cada cuadro, rastrear y medir el área enjambre con la función "Selección a mano alzada" en la barra de herramientas para rastrear el ouTLINE del enjambre y medir el área usando: Analizar> Medida. Esto generará un registro de las mediciones que se pueden guardar para su posterior análisis en Microsoft Excel o programas similares: Archivo> Guardar como
- Adquirir bacteriana Intensidad Crecimiento superficial para cuantificar la superficie Tasa de Crecimiento
- Una vez que el fondo se resta (Image Processing, Paso 5), utilice el último fotograma de la secuencia para determinar el área máxima de enjambre (Análisis de Datos, paso 1).
- Utilice la opción "Oval" herramienta de selección de la barra de herramientas para dibujar un cuadro alrededor de la superficie de crecimiento bacteriano.
- Establecer la medida de intensidad de los píxeles de la caja utilizando decir: Analizar> Medidas Set y seleccione "Mean valor de gris".
- Para obtener mediciones de la señal de intensidad para cada fotograma de la secuencia de lapso de tiempo, mientras que en el primer fotograma de la secuencia de ir a: Analizar> Medida. Esto generará un registro de las mediciones que se pueden guardar para su posterior análisis en Microsoft Excel o programas similares: Archivo> Guardar como
- Alternativa a la sección anterior (Análisis de Datos Paso 2). Utilice el plugin ImageJ Macros de configurar y ejecutar un crecimiento en superficie guión medida de intensidad en Macros.
- Configuración de un script de medición automatizada para analizar varios fotogramas simultáneamente: Plugin> Nuevo> Macro y pegue el guión previsto (abajo) en la caja y guardar como archivo de texto ImageJ Macros: Archivo> Guardar y guarde en la carpeta de aplicaciones ImageJ bajo " macros ".
numberOfFrames = N
for (i = 0; i ejecutar ('Medida');
ejecutar ('Next rebanada [>]');
}
NOTA: Aquí la variable "N" está para un número indefinido de marcos. - Editar los "numberOfFrames" en el plugin macros para cada experimento para reflejar el número de fotogramas en la secuencia de imágenes antes de ejecutar el script. Uso: Plugin> Macros>Editar, e introduzca el número correcto de los fotogramas de la secuencia y guardar (Archivo> Guardar).
- Siga subetapas 1-3 en Análisis de Datos Paso 2, y si bien en el primer fotograma de la secuencia de ejecutar el complemento de Macros: Plugin> Macros> Ejecutar. Esto generará un registro de las mediciones que se pueden guardar para su posterior análisis en Microsoft Excel o programas similares: Archivo> Guardar como
- Configuración de un script de medición automatizada para analizar varios fotogramas simultáneamente: Plugin> Nuevo> Macro y pegue el guión previsto (abajo) en la caja y guardar como archivo de texto ImageJ Macros: Archivo> Guardar y guarde en la carpeta de aplicaciones ImageJ bajo " macros ".
- La adquisición de Zona de Crecimiento de la superficie bacteriana para cuantificar Expansión Tarifa
Resultados
La variación en la placa preparación puede influir mucho en la motilidad enjambre. El curado o secado tiempo tras verter sobre medio de agar fundido afecta la delgada película de líquido presente en ensayos de movilidad de superficie y la motilidad bacteriana a través del tiempo. Los cambios en la composición de nutrientes también afectan enjambre de varias bacterias. La Figura 1A muestra un efecto a corto plazo de tiempo de secado sobre difusión de tinta de la India y difusión de un inóculo inicial de Bacillus subtilis 11. La Figura 1B muestra el efecto del tiempo de secado y espectáculos Figura 1C los efectos del sulfato de amonio [(NH4) 2 SO 4] sobre el desarrollo zarcillo posterior por un enjambre P. aeruginosa 5.
Datos cuantificables se pueden obtener a partir de imágenes de punto final de la motilidad superficie utilizando múltiples estrategias de formación de imágenes. La figura 2 muestra los resultados de crecimiento de superficie representativos de P. su imagen GFP fluorescencia asociada aeruginosa enjambre y; B. subtilis enjambre y su imagen bioluminiscencia asociada; y la imagen de fluorescencia rojo asociado de SYTO crecimiento superficie Myxococcus xanthus y las células teñidas-64.
La expansión de adquisición de datos más allá de la inspección y de formación de imágenes de los resultados de punto final permite el estudio del comportamiento dinámico (s) para las bacterias que crecen en la superficie. Figura 3 7 muestra un ejemplo de P. aeruginosa agrupan (fotografiada para las células que expresan GFP) y su producción ramnolípido asociado (imagen usando Rojo Nilo mancha de lípidos) -la cuantificación de los datos de estas imágenes también se muestra para mostrar la velocidad de expansión de P. aeruginosa enjambre. Video 1 muestra un time-lapse de B. subtilis enjambre imagen usando la luminiscencia de una cepa expresando lux. Video 2 8 muestra un time-lapse de P. aeruginosa Typhimurium (verde-expresando GFP) y Salmonella enterica serovar (lux-rojo expresar) en un ensayo de enjambre competitivo.
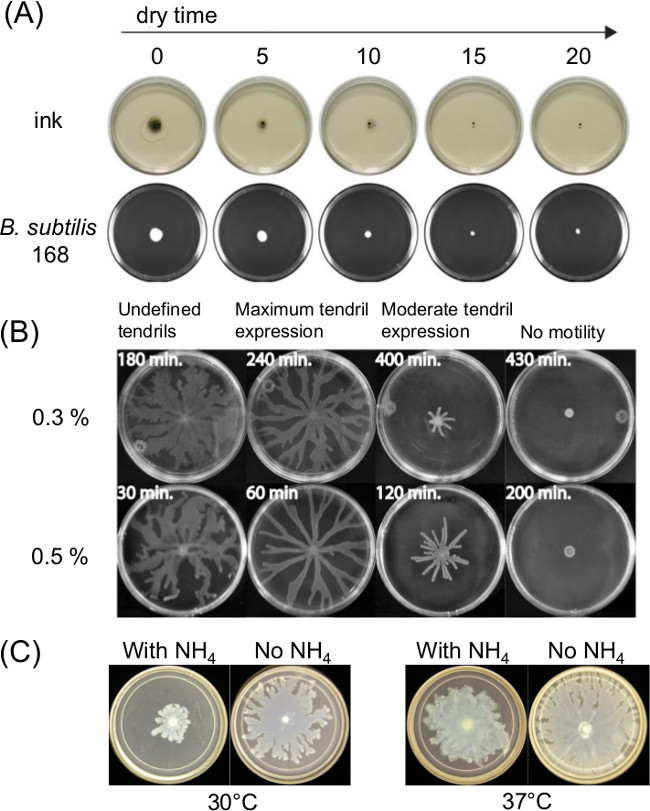
Figura 1: Ejemplos de factores en la preparación de ensayo de la motilidad superficie que afectan los resultados de ensayo Efecto de (A) el tiempo de secado agar en humedad de la superficie de agar y difusión de inóculo para B.. subtilis (Ref 8), (B) de tiempo de secado agar en P. aeruginosa agrupan (Reproducido de la referencia 5 con permiso), y (C) la presencia o ausencia de sulfato de amonio en P. aeruginosa enjambre y formación zarcillo.
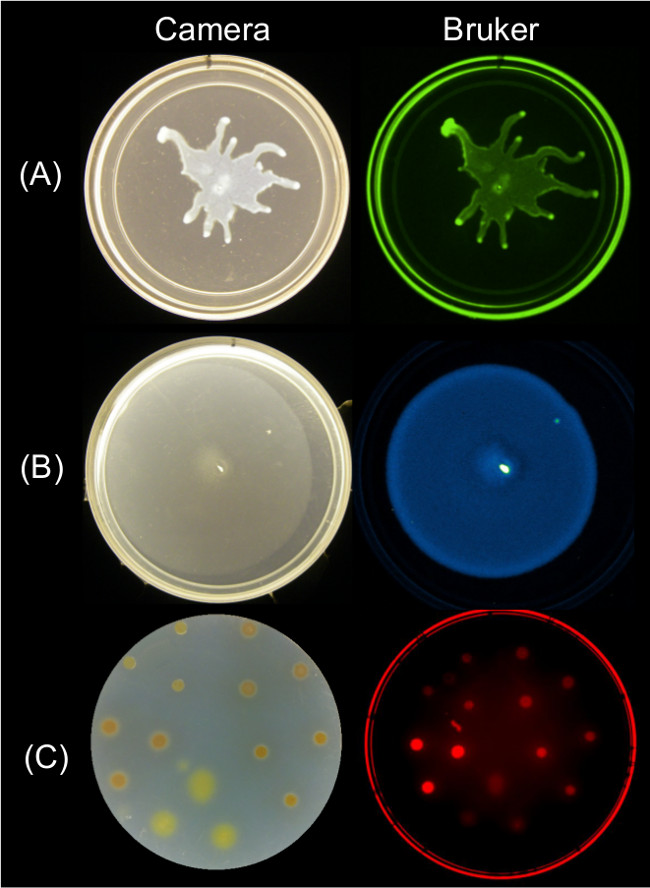
Figura 2: Alternaticinco enfoques para el crecimiento superficial de imágenes y la motilidad de las bacterias usando un Bruker imagen (derecha) Estación de imágenes Bruker. Side imagen de la cara de una cámara (izquierda) por y mostrando (A) P. aeruginosa expresar (B) B. GFP-fotografiado usando los ajustes de fluorescencia verde, subtilis expresan bioluminiscencia lux reportero-fotografiado usando la configuración de luminiscencia, y (C) M. xanthus teñidas con SYTO 64 Imaged-utilizando la configuración de Red Fluorescencia II. Ver Tabla 2 para ajustar detalles.
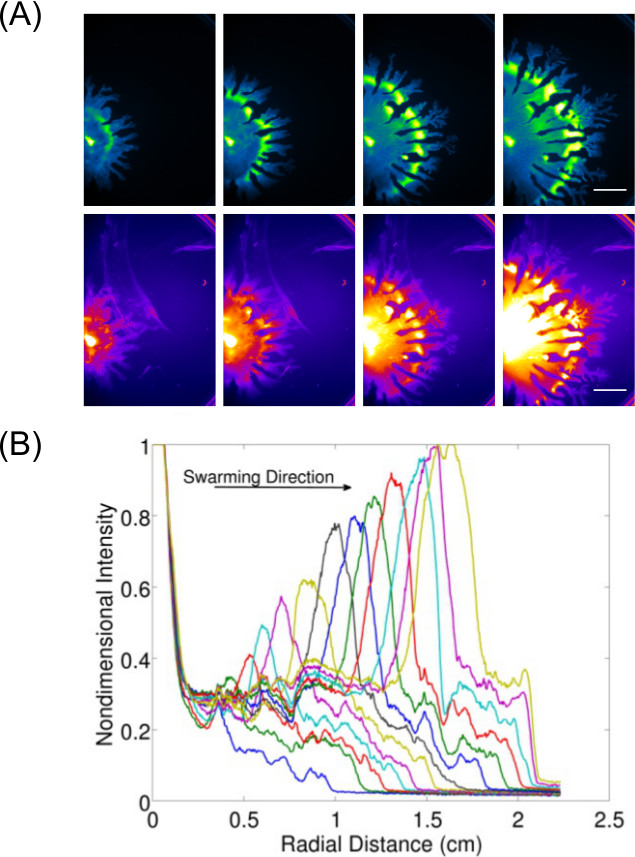
Figura 3:. El análisis cualitativo y cuantitativo de un ensayo de la motilidad superficie (A) Time-lapse análisis de la distribución de la densidad celular, la producción ramnolípido (mancha de lípidos Rojo Nilo imagen usando la fluorescencia rojaYo ajustes; barra de escala = 15 mm), y (B) la cuantificación de la tasa de expansión a partir de imágenes de distribución de la densidad celular de un P. enjambre aeruginosa. (Reproducido de la referencia 6 con el permiso.)
Video 1. Time-lapse de una B. subtilis enjambre. B. subtilis expresar lux y grabado con los ajustes de luminiscencia. Ver Tabla 2 para ajustar detalles.
Video 2. la competencia entre especies visualizado por time-lapse. Enjambres de P. aeruginosa (verde; expresando GFP y grabado con los ajustes de fluorescencia verde) y S. enterica serovar Typhimurium (rojo; exprescantar lux y grabado con los ajustes de luminiscencia). Ver Tabla 2 para ajustar detalles. (Reimpresión con permiso de la Ref. 7)
| P. aeruginosa | P. aeruginosa estudios de formación zarcillo | B. subtilis | M. xanthus | |
| Caldo durante la noche medios de cultivo | FAB más 30 mM de glucosa | FAB más 30 mM de glucosa | LIBRAS | CTT |
| Caldo durante la noche la temperatura de incubación cultura | 37 ° C | 37 ° C | 37 ° C | 30 horas a 30 ° C |
| Medios Swarm | FAB | FAB menos (NH 4) 2 SO 4 | 2% (peso / vol) LB | CTT |
| Medios Swarm: componentes adicionales | 12 mM de glucosa una | 10% (p / v) CAA, 12 mM de glucosa una | n / a | SYTO® 64 un |
| Tipo de Agar | Agar, Noble | Agar, Noble | Agar granulado | Agar, Noble Affymetrix |
| Agar concentración (peso / vol) | 0,45% | 0,45% | 0,60% | 1,50% |
| Tamaño de la placa Swarm | 60 mm | 60 mm | 100 mm | 150 mm |
| Volumen de los medios por placa | 7,5 ml | 7,5 ml | Vertido Mano | Vertido Mano |
| Ajuste del soporte Swarm método / secado | Capucha; placas descubiertas | Capucha; placas descubiertas | Mesas de trabajo; placas cubiertas | Mesas de trabajo; placas cubiertas |
| Ajuste del soporte Swarm / tiempo de secado | 30 min | 30 min | Durante la noche (20 -24 h) | Durante la noche (20 -24 h) |
| Enjambre de la temperatura de incubación de ensayo | 30 o 37 ° C | 30 ° C | 37 ° C | 30 ° C |
| La incubación para la imagen de lapso de tiempo | 30 ° C durante al menos 4 hr | 30 ° C durante al menos 4 hr | 37 ° C durante 2 horas | RT durante 12 horas |
| Time-lapse longitud de captura | 24 hr | 24 hr | 10 hr | 66 hr |
| Ajuste Time-lapse | 1 cuadro / 10 min | 1 cuadro / 10 min | 1 cuadro / 6 min | 1 cuadro / 10 min |
| un añadido después de la esterilización en autoclave. | ||||
Tabla 1:. Especificaciones para Surface Motilidad Preparación muestra Incluye superficieespecificaciones de preparación de ensayo de la motilidad de P. aeruginosa, B. subtilis, y M. xanthus.
| Señal | La fluorescencia verde | Red de fluorescencia I | Red Fluorescencia II | Luminiscencia |
| La proteína o el tinte | Proteína de fluorescencia verde (GFP) | proteína mCherry o Rojo Nilo ramnolípido mancha | SYTO® 64 | Luciferasa de operón lux |
| Longitud de onda de excitación (nm) | 480 ± 10 | 540 ± 10 | 590 ± 10 | De Descuento |
| Longitud de onda de emisión (nm) | 535 ± 17.5 | 600 ± 17,5 | 670 ± 17.5 | Sin filtro |
| Tiempo de exposición (s) | 30 | 60 | 60 | 240 |
| parada f- | 4.0 | 4.0 | 2.5 | 1.1 |
| FOV (mm) | 190 | 190 | 140 | 120 |
| Plano focal (mm) | 27.5 | 27.5 | 12.2 | 4 |
| Agrupación (píxeles) | Ninguno | 2 x 2 | Ninguno | 8 x 8 |
Tabla 2: Imágenes Especificación especificaciones de la estación de formación de imágenes Bruker para fluorescencia roja y verde, y las imágenes de luminiscencia de crecimiento de superficie bacteriana..
Discusión
El logro de la enjambrazón reproducible en un laboratorio puede ser un reto, como ensayos de enjambres son muy sensibles a los factores ambientales, como la humedad y los nutrientes disponibles. El aspecto más crítico de una superficie de ensayo de placa de la motilidad es la humedad en la superficie del agar. Antes de la inoculación, los medios de enjambre deben ser lo suficientemente seco para evitar que las células bacterianas de nadar a través de la superficie del líquido, pero no tan seco como para inhibir la motilidad enjambre 5. La incubación debe tener lugar en un entorno suficientemente húmedo: demasiado poca humedad puede dar lugar a la desecación de ensayo durante la incubación, mientras que el exceso de humedad puede conducir a la superficie artificial o artefactos difusión. A menos que una incubadora con control de humedad está a la mano, incubadora y humedad de laboratorio pueden variar dramáticamente. En consecuencia, un depósito adicional de agua, un humidificador, o un deshumidificador dentro de la incubadora podrían ser necesarias para evitar el exceso de secado o la acumulación de exceso de humedad mientras se mantiene la relative humedad cercana al 80%. El mantenimiento de esta humedad ideal puede resultar difícil si los cambios de humedad estacionales son significativos. Si este es el caso, el protocolo de ensayo enjambre requerirá algunos ajustes para tener en cuenta los cambios estacionales de humedad. Hemos encontrado que la modificación del tiempo de secado medios enjambre es la forma más sencilla para ajustar los cambios de humedad estacionales. Vigilancia de la humedad constante, tanto dentro como fuera de la incubadora, se recomienda. Además, se recomienda que los investigadores calibrar y validar sus instrumentos, incubadoras, escalas, etc. errores como de menor importancia en la temperatura, volumen o cantidades de los componentes del medio pueden afectar la reproducibilidad de estos ensayos.
También debe tenerse en cuenta que el tipo y tamaño de la placa usada en el ensayo pueden afectar a la humedad placa, y por lo tanto enjambre. Placas herméticos no ventilar el exceso de humedad, favoreciendo así la natación motilidad. En contraste, las placas de libro abierto permiten demasiada humedad se escape. Un plato Petriproporciona un entorno ideal, ya que ventila fuera suficiente exceso de humedad para evitar que el líquido se acumule, pero retiene la humedad suficiente para evitar que los medios de comunicación se sequen. Este método detalla un protocolo de ensayo de la motilidad superficie que permite la formación de imágenes de alta calidad. Para mantenerse separado para platos de imágenes de 60 mm de diámetro están llenas de 7,5 ml de medio de agar agar. Si no se requiere formación de imágenes se detalla, volúmenes de hasta 20 ml también pueden proporcionar resultados reproducibles.
Mientras que la motilidad enjambre se puede lograr en una amplia gama de concentraciones de agar, el rango óptimo de agar requerido para enjambre depende de la especie. En general, las concentraciones más altas de agar inhiben la motilidad enjambre, y por consiguiente el tiempo necesario para producir una imagen-listo enjambre aumenta. P. aeruginosa general pulula sobre las concentraciones de agar entre 0,4-0,7% 1, sin embargo, nos encontramos con que la enjambrazón óptima se produce en un rango mucho más estrecho (0,4-0,5%). Otros, como el B. subtilis y S. entéricoun enjambre en el 0,6% de agar, y Vibrio parahaemolyticus en el 1,5% de agar 10. La concentración de agar requerido se determina por el tipo y marca de agar. Agares de mayor pureza, como agar Noble, mejoran fuertemente pululando en P. aeruginosa y se prefieren sobre agar granulado 13,14. Sin embargo, estas versiones purificadas de agar también son más propensos a la caramelización durante el ciclo de esterilización en autoclave; dependiendo del instrumento, una secuencia abreviada / modificado esterilización (para alterar posiblemente el ciclo de escape para evitar la exposición prolongada al calor) puede ser necesaria para preparar los medios enjambre utilizando agar Noble.
Composición de los medios de comunicación también juega un papel en el fenotipo observado enjambre 3. P. aeruginosa estudios de motilidad enjambre se realizan generalmente utilizando medios nutrientes mínimos. Preferimos FAB medio de 4,8 (Tabla de Materiales), pero otros medios, como la M9, LB, o ligeras variaciones a estos medios de comunicación comunes,se han utilizado con éxito 9,15,16. Formación Tendril se logra mejor en FAB medio mínimo suplementado con glucosa como fuente de carbono y casaminoácidos (CAA), pero sin una fuente de nitrógeno adicional (es decir, (NH 4) 2 SO 4) 6,13. Si la formación zarcillo o la morfología no es el foco principal del estudio, a continuación, FAB medio mínimo (Tabla de Materiales; Tabla 1) carente de CAA se recomienda de manera que los efectos de las fuentes de carbono específicas y / o nutrientes adicionales pueden ser estudiados en detalle. Otras especies, tales como B. subtilis (presentada aquí), son enjambres versátiles, capaces de enjambre en LB y agar granulado. Estas especies pululan fácilmente, requiriendo sólo ~ 10 horas para desarrollar un enjambre completo. Esta tasa enjambre rápido hace siguiendo la progresión del enjambre potencialmente difícil, pero nuestro protocolo hace que tal seguimiento muy factible. La capacidad de realizar time-lapse enjambre proporciona una Sustanciacial facilidad en la adquisición de datos enjambre, particularmente de tales enjambres ávidos.
Se introduce un e integral, el protocolo de dos fases sólida y directrices encaminadas a mejorar la ejecución y la reproducibilidad de la investigación motilidad superficie bacteriana y hemos hecho hincapié principalmente aspectos importante examinar enjambre flagelar mediada. Este protocolo de ensayo enjambre detalla aspectos importantes de la composición de los medios y la manipulación de placas de motilidad superficie para proporcionar una mayor consistencia y reproducibilidad dentro y entre los grupos de investigación. Esto mejorará la base de la comparación entre los diferentes estudios de investigación. Además, el enfoque presentado y el protocolo proporciona los medios para hacer que la investigación en enjambre y la superficie de la motilidad menos susceptible a las variaciones ambientales haciendo investigadores conscientes de que tales factores afectan a su trabajo y proporcionar posibles soluciones (por ejemplo, ¿cómo pequeños cambios en agar afectan enjambre 4,5 ). Además, el protocolo proporciona acuantificar aspectos macroscópicos de enjambrazón, proporciona una oportunidad para medir muchos atributos de crecimiento de la superficie bacteriana que antes eran imposible de cuantificar.
No hemos examinado todas las bacterias móviles de superficie en el desarrollo de este protocolo. Como tal, se espera que se requerirán modificaciones de protocolo para las especies no se presentan aquí. La eficacia de este protocolo está restringido por los límites inherentes de los equipos y materiales empleados. Por ejemplo, los estudios relacionados con la temperatura hasta el momento con la estación de formación de imágenes Bruker no son posibles, ya que el control de temperatura no es una característica del equipo. Además, el uso de colorantes (tales como Rojo Nilo para teñir ramnolípidos) puede tener limitaciones cinéticas y de concentración 8. Esta técnica se basa fuertemente en el procesamiento y análisis de imágenes digitales; mejora de automatización de análisis de datos (por ejemplo, usando macros adicionales en función de script ImageJ) reduciría el tiempo necesario para el análisisy expandir la utilidad de los datos. Por último, debido a la robustez del protocolo de imágenes, aplicaciones futuras deberían tener como objetivo la ampliación de esta técnica para examinar las superficies de crecimiento menos uniformes que son más relevantes para las superficies colonizadas por bacterias ambientales y patógenos.
Divulgaciones
Las tasas de publicación de este artículo fueron parcialmente patrocinado por Bruker Corporation.
Agradecimientos
Apoyo parcial de este trabajo fue proporcionado por el Instituto Nacional de Salud (R01GM100470 y 1R01GM095959-01A1; a MA y JDS) y una donación del Fondo Core del Instituto de Ciencias clínica y traslacional Indiana (financiado en parte por el NIH subvención # TR000006 UL1; a JDS).
Materiales
| Name | Company | Catalog Number | Comments |
| Reagentsa | |||
| FAB Minimal Media: | Prepare every ~4 weeks. Top to 1 L with nanopure H2O. | ||
| (NH4)2SO4 | Sigma | A4418 | 2 g. Not used in P. aeruginosa tendril formation studies. |
| Na2HPO4 x 7H2O | Sigma-Aldrich | S9390 | 9 g |
| KH2PO4 | Sigma | P5655 | 3 g |
| NaCl | BDH | BDH8014 | 3 g |
| MgCl2 x 6H2O solution (198 g/L) | Fisher Scientific | M33 | 1 ml |
| CaCl2 x 2H2O solution (14 g/L) | Fisher Scientific | C79 | 1 ml |
| Trace metal solution (see below) | n/a | n/a | 1 ml |
| Trace Metal Solution: | Top to 1 L with nanopure H2O. Maintain in a glass bottle, stirring and covered with foil. | ||
| CaSO4 x 2H2O | Sigma-Aldrich | 255548 | 200 mg |
| MnSO4 x H2O | Sigma-Aldrich | M7634 | 20 mg |
| CuSO4 x 5H2O | Fisher Scientific | C493 | 20 mg |
| ZnSO4 x 7H2O | Sigma-Aldrich | Z4750 | 20 mg |
| CoSO4 x 7H2O | Sigma-Aldrich | C6768 | 10 mg |
| NaMoO4 x 2H2O | Sigma | S6646 | 10 mg |
| H3BO3 | Fisher Scientific | A74 | 5 mg |
| FeSO4 x 7H2O | Sigma-Aldrich | F7002 | 200 mg |
| CTT Media: | Prepare as needed. Top to 100 ml with nanopure H2O. | ||
| Tris-HCl, 1 M solution (adjust to pH 8.0) | Amresco | 0234 | 1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 8.0 and filter sterilize (0.2 μm pore). |
| K2HPO4, 1 M solution (adjust to pH 7.6) | Sigma-Aldrich | P3786 | 0.1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 7.6 and filter sterilize (0.2 μm pore). |
| MgSO4 solution | Fisher Scientific | M65 | 0.8 ml. Prepare a 1 M stock solution in nano pure H2O. Filter sterilize (0.2 μm pore). |
| Casitone | BD Diagnostics | 225930 | 1 g |
| Additional Reagents: | |||
| LB Broth, Lennox | BD Diagnostics | 240230 | 2% (wt/vol) |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | 30 mM for overnight broth cultures; 12 mM for swarm media. Prepare a 1.2 M filter sterilized stock solution in nano pure H2O. Add to media after autoclaving. |
| Casamino acids (CAA) | Amresco | J851 | 0.10% (wt/vol). Recommended for P. aeruginosa tendril formation studies. Add to media prior to autoclaving. |
| Agar, Noble | Sigma-Aldrich | A5431 | 0.45% (wt/vol). Preferred Noble agar for P. aeruginosa surface motility studies. Add to media prior to autoclaving. |
| Agar, Noble | Affymetrix | 10907 | 1.50% (wt/vol). Used in M. xanthus surface motility studies. Not recommended for P. aeruginosa motility studies. Add to media prior to autoclaving. |
| Agar, Granulated | Fisher Scientific | BP1423 | 0.60% (wt/vol) |
| Higgins Waterproof Black India Ink | Higgins | HIG44201 | 0.50% (vol/vol). Mix ink with inoculum to test swarm media surface moisture. |
| SYTO® 64 Red Fluorescent Nucleic Acid Stain | Invitrogen | S-11346 | Use 4 μl (for P. aeruginosa) or 8 μl (for M. xanthus) of SYTO® 64 per 100 ml of molten agar (added after autoclaving). |
| Relevant Materials and Equipment | |||
| Petri dish, sterile, 150 mm x 15 mm (Dia. x H) | VWR | 25384-326 | |
| Petri dish, sterile, 100 mm x 15 mm (Dia. x H) | VWR | 25384-342 | |
| Petri dish, sterile, 60 mm x 15 mm (Dia. x H) | VWR | 25384-092 | |
| In-Vivo Xtream | Bruker | Use for the macroscopic imaging of surface motility studies. http://www.bruker.com/products/preclinical-imaging/opticalx-ray-imaging/in-vivo-xtreme/overview.html | |
| Bruker MI software | Bruker | http://www.bruker.com/fileadmin/user_upload/8-PDF-Docs/PreclinicalImaging/Brochures/MI-software-brochure.pdf | |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| aSee MSDS of reagents for handeling and disposal information. | |||
Referencias
- Kearns, D. B. A field guide to bacterial swarming motility. Nature Reviews: Microbiology. 8 (9), 634-644 (2010).
- Burall, L. S., et al. et al.Proteus mirabilis. genes that contribute to pathogenesis of urinary tract infection: Identification of 25 signature-tagged mutants attenuated at least 100-fold. Infection and Immunity. 72 (5), 2922-2938 (2004).
- Shrout, J. D., et al. The impact of quorum sensing and swarming motility on Pseudomonas aeruginosa. biofilm formation is nutritionally conditional. Mol Microbiol. 62 (5), 1264-1277 (2006).
- Kamatkar, N. G., Shrout, J. D. Surface hardness impairment of quorum sensing and swarming for Pseudomonas aeruginosa. PLoS One. 6 (6), e20888 (2011).
- Tremblay, J., Déziel, E. Improving the reproducibility of Pseudomonas aeruginosa. swarming motility assays. Journal of Basic Microbiology. 48 (6), 509-515 (2008).
- Caiazza, N. C., Shanks, R. M., O'Toole, G. A. Rhamnolipids modulate swarming motility patterns of Pseudomonas aeruginosa. Journal of Bacteriology. 187 (21), 7351-7361 (2005).
- Du, H., et al. High density waves of the bacterium Pseudomonas aeruginosa. in propagating swarms result in efficient colonization of surfaces. Biophysical Journal. 103 (3), 601-609 (2012).
- Morris, J. D., et al. Imaging and analysis of Pseudomonas aeruginosa. swarming and rhamnolipid production. Appl Environ Microbiol. 77 (23), 8310-8317 (2011).
- Tremblay, J., Richardson, A. P., Lépine, F., Déziel, E. Self-produced extracellular stimuli modulate the Pseudomonas aeruginosa. swarming motility behaviour. Environmental Microbiology. 9 (10), 2622-2630 (2007).
- Partridge, J. D., Harshey, R. M. Swarming: flexible roaming plans. J Bacteriol. 195 (5), 909-918 (2013).
- Patrick, J. E., Kearns, D. B. Laboratory strains of Bacillus subtilis .do not exhibit swarming motility. Journal of Bacteriology. 191 (22), 7129-7133 (2009).
- . . Molecular Imaging. , (2014).
- Harshey, R. M., Matsuyama, T. Dimorphic transition in Escherichia coli. and Salmonella typhimurium.: surface-induced differentiation into hyperflagellate swarmer cells. Proceedings of the National Academy of Sciences, USA. 91 (18), 8631-8635 (1994).
- Rashid, M. H., Kornberg, A. Inorganic polyphosphate is needed for swimming, swarming, and twitching motilities of Pseudomonas aeruginosa. Proc Nat Acad Sci U.S.A.. 97 (9), 4885-4890 (2000).
- Caiazza, N. C., Merritt, J. H., Brothers, K. M., O'Toole, G. A. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa. PA14. Journal of Bacteriology. 189 (9), 3603-3612 (2007).
- Kuchma, S. L., et al. Cyclic-di-GMP-mediated repression of swarming motility by Pseudomonas aeruginosa.: the pilY1. gene and its impact on surface-associated behaviors. J Bacteriol. 192 (12), 2950-2964 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados