Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Monitoreo en tiempo real de reacciones realizadas Utilizando Procesamiento de flujo continuo: La Preparación de 3-Acetylcoumarin como ejemplo
En este artículo
Resumen
Monitoreo en tiempo real permite la optimización rápida de las reacciones realizadas utilizando el procesamiento de flujo continuo. Aquí la preparación de 3-acetylcoumarin se utiliza como un ejemplo. El aparato para realizar in situ monitoreo Raman se describe, al igual que los pasos necesarios para optimizar la reacción.
Resumen
Mediante el uso de monitoreo en línea, es posible optimizar reacciones realizadas mediante el procesamiento de flujo continuo de una manera simple y rápida. También es posible para garantizar la calidad del producto consistente en el tiempo utilizando esta técnica. Aquí mostramos cómo conectar una unidad de flujo disponible comercialmente con un espectrómetro Raman. La celda de flujo Raman se coloca después del regulador de contrapresión, lo que significa que puede ser operado a presión atmosférica. Además, el hecho de que la corriente de producto pasa a través de un tramo de tubo antes de entrar en la celda de flujo significa que el material es a TA. Es importante que los espectros se adquirió en condiciones isotérmicas desde intensidad de la señal Raman es dependiente de la temperatura. Después de haber montado el aparato, que a continuación mostramos cómo monitorizar una reacción química, la síntesis catalizada de piperidina 3-acetylcoumarin de salicilaldehído y acetoacetato de etilo se utiliza como un ejemplo. La reacción puede llevarse a cabo en un rango de caudales de unatemperaturas d, la herramienta de monitoreo in situ que se utilizan para optimizar las condiciones de manera sencilla.
Introducción
Mediante el uso de procesamiento de flujo continuo, los químicos están descubriendo que pueden realizar una serie de reacciones químicas de manera segura, eficaz y con facilidad 1,2. Como resultado, el equipo de la química flujo se está convirtiendo en una herramienta integral para el funcionamiento de las reacciones tanto en entornos industriales, así como laboratorios de investigación en las instituciones académicas. Una amplia variedad de transformaciones de química sintética han llevado a cabo en reactores de flujo 3,4. En casos seleccionados, reacciones que no funcionan en el lote se ha demostrado que proceder sin problemas en condiciones de flujo continuo 5. Por tanto la optimización de reacción y control de calidad, la incorporación de monitoreo de reacción en línea con el procesamiento de flujo ofrece ventajas significativas. En línea monitoreo proporciona un análisis continuo con respuesta en tiempo real a las condiciones reales de la muestra. Esto es más rápido y, en algunos casos, más fiable que las técnicas comparables fuera de línea. Un número de técnicas analíticas en línea se han interconectado con fbajos reactores 7. Los ejemplos incluyen infrarrojo 8,9, UV-Visible 10,11, 12,13 RMN, espectroscopía Raman 14,15, 16,17 y espectrometría de masas.
Nuestro grupo de investigación ha interconectado un espectrómetro Raman con una unidad de microondas científica 18. El uso de este, una serie de reacciones han sido controlados, tanto desde el cualitativo y cuantitativo 20 19 punto de vista. Sobre la base de este éxito, hemos interconectado recientemente nuestro espectrómetro Raman con una de nuestras unidades de flujo continuo y empleado para la vigilancia de reacción en la línea de una serie de transformaciones orgánicas clave-medicinalmente relevante. 21 En cada caso se pudo controlar la reacciones y también en un ejemplo, por medio de una curva de calibración, pudimos determinar la conversión del producto a partir de datos espectrales Raman. En Aquí se describe cómo configurar el aparato y lo utilizan para controlar las reacciones. Utilizamos la síntesis piperidina catalizado de 3-acetylcoumarin (1) a partir de salicilaldehído con acetoacetato de etilo (Figura 1) como la reacción modelo aquí.
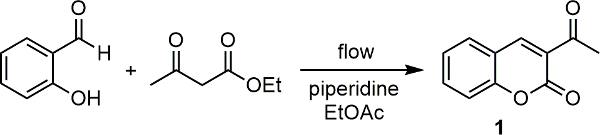
Figura 1. Base reacción catalizada por condensación entre salicilaldehído y acetoacetato de etilo para dar 3-acetylcoumarin (1). Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Busque señales adecuadas para el Monitoreo de Reacción
- Obtener espectros Raman para todos los materiales de partida y el producto.
- Superposición de los espectros e identificar una banda intensa que es única para el producto.
- Utilice esta banda Raman para monitorizar el progreso de la reacción. Una banda a 1.608 cm-1 fue seleccionado en este caso.
2. Configure la celda de flujo
- Obtener una celda de flujo adecuado. Aquí utilizar uno con las siguientes dimensiones: ancho de 6,5 mm, altura de 20 mm, y una longitud de trayectoria de 5 mm (Figura 2A).
- Coloque la celda de flujo en un contenedor que ofrece un ambiente libre de la luz ambiente.
- Conectar los tubos a la entrada y la salida de la celda de flujo (en este caso 1 mm tubo de ID PFA).
3. Interfaz del Espectrómetro Raman con la celda de flujo
- Obtener un espectrómetro Raman adecuado con un conjunto óptico flexible que se puede colocar en cperder proximidad a la celda de flujo.
- Coloque el conjunto óptico a través de una abertura de tamaño adecuado en la caja que contiene el conjunto de celda de flujo (Figura 2B).
- Deslice el conjunto óptico hasta que toque la celda de flujo y tire de ella hacia atrás dejando un espacio de ~ 2 mm.
- Llenar la celda de flujo con 100% de acetona.
- Encienda el espectrómetro Raman y adquirir espectros en modo de escaneo continuo.
- Enfoque el láser moviendo suavemente el tubo de luz de una fracción a la vez. Manténgase en movimiento el tubo de luz hasta que la señal se encuentra en su mayor intensidad y los picos son nítidas y bien definidas.

Figura 2. (A) de flujo de células y la interfaz (B) Raman utilizado. Haga clic aquí para ver una grande versión de esta figura.
4. Preparar el reactivo y soluciones solventes
- Añadir salicilaldehído (6,106 g, 50 mmol, 1 equiv) y acetoacetato de etilo (6,507 g, 50 mmol, 1 equiv) a un matraz aforado de 50 ml.
- Añadir acetato de etilo hasta un volumen total de 50 ml y luego mezclar completamente los contenidos.
- Transferir una alícuota de 10 ml de la solución madre a un vial de vidrio de 20 ml que contenía una barra de agitación magnética. Etiquetar este "reactivo". Vial
- En una botella de 100 ml lugar 90 ml de acetato de etilo. Etiquetar esta botella "solvente". En una botella de 100 ml lugar 90 ml de acetona. Etiquetar esta botella "interceptar solvente".
5. Prepare el aparato de flujo
- Asegúrese de que la unidad de flujo tiene al menos dos bombas y etiquetarlos "P1" y "P2". Identificar líneas de entrada de disolventes y reactivos para cada bomba. Coloque las líneas de salida de los y las líneas de "cobrar", "residuos" en dos ibotellas ndividual 100 ml etiquetados como "producto" y "residuos", respectivamente.
- Como reactor, utilice una capacidad de bobina de 10 ml PFA capaz de ser calentado.
- Conectar el tubo que sale de P1 a la entrada de la bobina reactor PFA.
- Instale una de tres puertos poliéter éter cetona (PEEK) tee-mezclador después de la bobina del reactor.
- Conecte el tubo de salida de P2 a la T-mezclador, 180 ° de la tubería de salida de la bobina del reactor. Conecte un trozo de tubo al tercer puerto del Tee-mezclador. En el otro extremo de este tubo colocar un regulador de contrapresión.
- Conectar una línea desde la salida del regulador de presión de retorno a la entrada de la celda de flujo. Conecte una línea desde la salida de la celda de flujo a la "recoger / residuos" interruptor.
- Primer las líneas disolvente tanto P1 y P2, así como la línea de reactivo para P1 con disolvente. Mueva la línea de reactivo para P1 de la botella de disolvente a la botella de reactivo.
- Usando P1, pasar acetato de etilo a través del reactorbobina a 2 ml min hasta que se llena /. Pasar a través de P2 acetona a una velocidad de flujo de 2 ml / min durante 2 min.
- Ajuste las tasas de flujo de disolvente tanto para P1 y P2 a 1 ml / min. Ajuste el regulador de presión de retorno a una presión de 7 bar. Ajuste la temperatura de la bobina del reactor a la temperatura deseada.
- Haga doble comprobar el equipo está configurado como se muestra en el esquema de la Figura 3.
- Una vez que el sistema alcanza la temperatura y la presión constante, revise si hay fugas y vuelva a ejecutar la reacción.
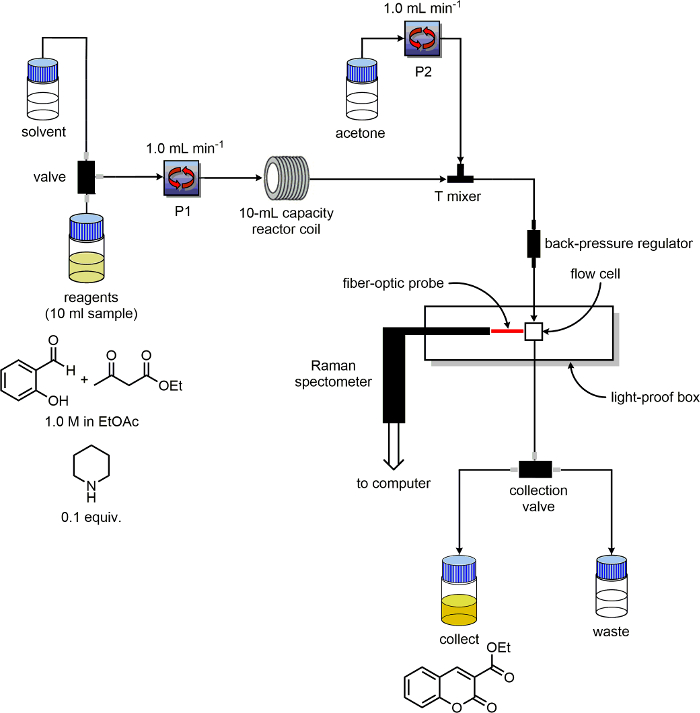
Figura 3. Esquema de la configuración de los equipos utilizados para los experimentos de seguimiento de reacción. Haga clic aquí para ver una versión más grande de esta figura.
6. Supervisar la Reacción
- Takea exploración de fondo del sistema disolvente de acetato de etilo / acetona, ya que pasa a través de la celda de flujo. Esto se restará automáticamente de todos los análisis posteriores.
- Configurar el espectrómetro de tomar las exploraciones cada 15 segundos (en este caso el espectrómetro Raman se establece en un tiempo de integración de 10 segundos, furgón = 3, y Media = 1).
- Inyectar piperidina (0,05 ml, 0,05 mmol, 0,1 equiv) de una vez en el vial de vidrio con la etiqueta "reactivo".
- Después de mezclar a fondo, cambiar P1 de "solvente" para "reactivo". Ajuste la corriente de salida a "recoger".
- Cuando todo el material se ha cargado por completo, el interruptor P1 de "reactivo" de nuevo a "solvente". Continúa fluyendo disolvente a través de la bobina del reactor durante otros 30 minutos. Una vez transcurrido este tiempo, apague la calefacción.
- Bombas Turn P1 y P2 apaga cuando la temperatura de la bobina reactor se ha enfriado por debajo de 50 ° C.
7. Analizar los Datos
- Exportar los datos del espectrómetro Raman a una hoja de cálculo y la trama intensidad Raman a 1608 cm-1 vs. hora.
- Para optimizar las condiciones, realizar la reacción a través de un número de velocidades de flujo y las temperaturas del reactor de manera iterativa.
- Parcelas de superposición de intensidad Raman de 1608 cm-1 vs. hora.
Nota: Superior intensidad Raman se correlaciona con una mayor conversión del producto.
8. Ejecute la reacción usando condiciones optimizadas
- Tener proyectadas varias condiciones (tasas de flujo variables / temperaturas del reactor), ejecute la reacción usando las condiciones optimizadas para proporcionar el más alto de conversión del producto.
9. Aislar el producto
- Tome el contenido del matraz de producto y se vierte en un vaso de precipitados que contiene 100 ml de hielo y 20 ml de HCl 2 M.
- Lavar el matraz producto con una cantidad mínima de acetato de etilo (2 ml) y la transferencia al vaso de precipitados.
- Revuelva la mezcla de heladohasta que todo el hielo se derrita por completo.
- Establecer un sistema de filtración con un embudo Hirsch, frasco de brazo lateral, collar de goma y una longitud de tubo de vacío de goma.
- Se filtra el precipitado resultante al vacío, enjuague con éter dietílico frío (10 ml) y deje que se seque bajo una lámpara de calor (2-3 horas) o O seco / N al vacío.
- Confirmar la identidad del producto por 1 H resonancia magnética (RMN) nuclear usando CDCl3 como disolvente. Para un espectrómetro de RMN 500 MHz, los datos de 1H NMR de 3-acetylcoumarin es el siguiente: δ = 2,73 (s, 3 H) 7,31 - 7,40 (m, 2 H) 7,65 (ddd, J = 7,53, 4,37, 2,60 Hz , 2 H) 8,51 (s, 1 H) ppm, 13 de datos C RMN: δ = 30,84 (CH 3) 117,00 (CH) 118,56 (C) 124,86 (CH) 125,27 (CH) 130,51 (CH) 134,68 (C) 147,74 (CH) 155,64 (C) 159,52 (C) 195,77 (C) ppm.
Resultados
La preparación de flujo continuo de 3-acetylcoumarin fue elegido como una reacción representante para la monitorización en línea. En lotes, la reacción procede bien cuando usando acetato de etilo como disolvente. Sin embargo, el producto (1) no es completamente soluble a temperatura ambiente. Para evitar la obstrucción del potencial regulador de contrapresión, así como mitigar el riesgo de tener partículas sólidas en la celda de flujo que perturbar adquisición de la señal, se utilizó una t?...
Discusión
La facilidad con la que el espectrómetro Raman se puede interconectar con la unidad de flujo hace que esta técnica valiosa para la monitorización en línea de reacción. Un número de variables de reacción se puede probar de una manera acelerada, que permite al usuario llegar a condiciones de reacción optimizadas más rápido que cuando se utilizan métodos fuera de línea. La aplicación de las técnicas descritas en este documento también permite la monitorización de la formación de productos secundarios, supo...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Financial support provided by National Science Foundation (CAREER award CHE-0847262. We thank Vapourtec Ltd and Enwave Optronics for equipment support, and Daniel Daleb of the University of Connecticut for his assistance in construction of the flow cell apparatus.
Materiales
| Name | Company | Catalog Number | Comments |
| Salicylaldehyde | Sigma-Aldrich | S356 | Reagent Grade, 98% |
| Ethyl acetoacetate | Acros Organics | 117970010 | 99% |
| Piperidine | Sigma-Aldrich | 104094 | Reagent Plus, 99% |
| Hydrochloric acid | Sigma-Aldrich | 320331 | ACS Reagent, 37% |
| Ethyl acetate | Sigma-Aldrich | 34858 | CHROMASOLV, for HPLC, >99.7% |
| Acetone | Sigma-Aldrich | 650501 | CHROMASOLV, for HPLC, >99.9% |
| Flow cell | Starna Cells | 583.65.65-Q-5/Z20 | |
| Flow unit | Vapourtec | E-series system | |
| Raman spectrometer | Enwave Optronics Inc | Model EZRaman-L |
Referencias
- Wiles, C., Watts, P. . Micro Reaction Technology in Organic Synthesis. , (2011).
- van den Broek, S. A. M. W., et al. Continuous Flow Production of Thermally Unstable Intermediates in a Microreactor with Inline IR-Analysis: Controlled Vilsmeier–Haack Formylation of Electron-Rich Arenes. Org. Process Res. Dev. 16 (5), 934-938 (2012).
- Baxendale, I. R. The integration of flow reactors into synthetic organic chemistry. J. Chem. Technol. Biotechnol. 88 (4), 519-552 (2013).
- Malet-Sanz, L., Susanne, F. Continuous Flow Synthesis. A Pharma Perspective J. Med. Chem. 55 (9), 4062-4098 (2012).
- Hartwig, J., Metternich, J. B., Nikzad, N., Kirschning, A., Ley, S. V. Continuous flow chemistry: a discovery tool for new chemical reactivity patterns. Org. Biomol. Chem. 12 (22), 3611-3615 (2014).
- De Beer, T., et al. Near infrared and Raman spectroscopy for the in-process monitoring of pharmaceutical production processes. Int. J. Pharm. 417, 32-47 (2001).
- McMullen, J. P., Jensen, K. F. Integrated microreactors for reaction automation: New approaches to reaction development. Annu. Rev. Anal. Chem. 3, 19-42 (2010).
- Moore, J. S., Jensen, K. F. Automated multitrajectory method for reaction optimization in a microfluidic system using online IR analysis. Org. Process Res. Dev. 16 (8), 1409-1415 (2012).
- Carter, C. F., et al. ReactIR Flow Cell: A New Analytical Tool for Continuous Flow Chemical Processing. Org. Process Res. Dev. 14 (2), 393-404 (2010).
- Ferstl, W., et al. Inline Analysis in Microreaction Technology: A Suitable Tool for Process Screening and Optimization. Chem. Eng. Technol. 30 (3), 370-378 (2007).
- Benito-Lopez, F., et al. Optical fiber-based on-line UV/Vis spectroscopic monitoring of chemical reaction kinetics under high pressure in a capillary microreactor. Chem. Commun. (22), 2857-2859 (2005).
- Gökay, O., Albert, K. From single to multiple microcoil flow probe NMR and related capillary techniques: a review. Anal. Bioanal. Chem. 402 (2), 647-669 (2012).
- Jones, C. J., Larive, C. K. Could smaller really be better? Current and future trends in high-resolution microcoil NMR spectroscopy. Anal. Bioanal. Chem. 402 (1), 61-68 (2012).
- Mozharov, S., et al. Improved Method for Kinetic Studies in Microreactors Using Flow Manipulation and Noninvasive Raman Spectrometry. J. Am. Chem. Soc. 133 (10), 3601-3608 (2011).
- Chaplain, G., Haswell, S. J., Fletcher, P. D. I., Kelly, S. M., Mansfield, A. Development and evaluation of a Raman flow cell for monitoring continuous flow reactions. Aust. J. Chem. 66 (2), 208-212 (2013).
- Browne, D. L., et al. Continuous flow reaction monitoring using an on-line miniature mass spectrometer. Rapid Comm. Mass. Spectrosc. 26 (17), (1999).
- Koster, S., Verpoorte, E. A decade of microfluidic analysis coupled with electrospray mass spectrometry: An overview. Lab Chip. 7 (11), 1394-1412 (2007).
- Leadbeater, N. E., Schmink, J. R., Hamlin, T. A., de la Hoz, A., Loupy, A. Tools for Monitoring Reactions Performed Using Microwave Heating. Microwaves in Organic Synthesis. 1, 327-376 (2012).
- Leadbeater, N. E., Schmink, J. R. Use of Raman spectroscopy as a tool for in situ. monitoring of microwave-promoted reactions. Nature Protoc. 3 (1), 1-7 (2008).
- Schmink, J. R., Holcomb, J. L., Leadbeater, N. E. Use of Raman spectroscopy as an In Situ. Tool to Obtain Kinetic Data for Organic Transformations. Chem. Eur. J. 14 (32), 9943-9950 (2008).
- Hamlin, T. A., Leadbeater, N. E. Raman spectroscopy as a tool for monitoring mesoscale continuous-flow organic synthesis: Equipment interface and assessment in four medicinally-relevant reactions. Beilstein J. Org. Chem. 9, 1843-1852 (2013).
- Kelly, C. B., Lee, C., Leadbeater, N. E. An approach for continuous-flow processing of reactions that involve the in situ. formation of organic products. Tetrahedron Lett. 52 (2), 263-265 (2011).
- Wren, S. N., Donaldson, D. J. Glancing-angle Raman spectroscopic probe for reaction kinetics at water surfaces. Phys. Chem. Chem. Phys. 12, 2648-2654 (2010).
- Leadbeater, N. E., Smith, R. J. Real-Time Monitoring of Microwave-Promoted Suzuki Coupling Reactions Using in Situ. Raman Spectroscopy. Org. Lett. 8 (20), 4589-4591 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados