Method Article
Un supramolecular hidrogel inyectable de Drogas y cargadas para Inyección local catéter en el corazón de cerdo
* Estos autores han contribuido por igual
En este artículo
Resumen
Hydrogelators supramoleculares basados en ureido-pirimidinonas permiten un control total sobre las propiedades macroscópicas de gel y el comportamiento de conmutación de sol-gel utilizando pH. A continuación, presentamos un protocolo para la formulación y la inyección de un hydrogelator tales supramolecular a través de un sistema de suministro de catéter para la entrega local directamente en áreas relevantes en el corazón de cerdo.
Resumen
La regeneración del miocardio perdido es un objetivo importante para las futuras terapias debido a la creciente aparición de insuficiencia cardíaca isquémica crónica y el limitado acceso a los corazones de donantes. Un ejemplo de un tratamiento para recuperar la función del corazón consiste en la administración local de fármacos y compuestos bioactivos a partir de un hidrogel. En este trabajo se presenta un método para formular e inyectar un hidrogel cargado con la droga de forma no invasiva y en el corazón de cerdo usando un catéter largo y flexible específica a lado. El uso de 3-D mapeo electromecánico y la inyección a través de un catéter permite un tratamiento específico del lado del miocardio. Para proporcionar un hidrogel compatible con este catéter, un hidrogel supramolecular se utiliza debido a la conmutación conveniente de un gel a un estado de solución utilizando los desencadenantes ambientales. Poli A pH básico este ureido-pirimidinona modificado (etilenglicol) actúa como un fluido newtoniano que se puede inyectar fácilmente, pero a pH fisiológico la solución cambia rápidamente enun gel. Estas condiciones de conmutación suaves permiten la incorporación de fármacos bioactivos y especies bioactivas, tales como factores de crecimiento y exosomas como se presenta aquí en tanto in vitro como en experimentos in vivo. Los experimentos in vitro dan una indicación sobre golpe de derecha de la estabilidad del gel y la liberación del fármaco, lo que permite realizar un ajuste del gel y suelte propiedades antes de la posterior aplicación in vivo. Esta combinación permite la sintonización óptima del gel a los compuestos bioactivos utilizados y especies, y el sistema de inyección.
Introducción
Aunque el tratamiento del infarto agudo de miocardio ha mejorado significativamente las tasas de supervivencia, la insuficiencia cardíaca isquémica crónica es un problema importante de salud pública que progresa con el envejecimiento de la población. Hay aproximadamente 6 millones de pacientes con insuficiencia cardiaca en los EE.UU. con un estimado de 25% de aumento en la prevalencia en 2030 1,2. Pérdida inicial de tejido miocárdico conduce a la remodelación cardiaca y eventualmente causa la insuficiencia cardíaca crónica. Excepto para el trasplante de corazón, no existe un tratamiento real para este grupo de pacientes. La creciente deficiencia de corazones de donantes hace hincapié en la necesidad de desarrollar nuevas terapias disponibles para revertir este proceso de remodelación. Por lo tanto, un objetivo para futuras terapias es la regeneración de miocardio perdido.
Los hidrogeles son materiales interesantes en el campo de la medicina regenerativa debido a su biocompatibilidad, y su sensibilidad a los factores desencadenantes externos 3. Hidrogeles inyectables ofrecen adventajas más de hidrogeles no inyectables en su uso en cirugía mínimamente invasiva 4. Estos hidrogeles inyectables pueden ser aplicados a través de una jeringa a causa de su alterna distintas dentro de condiciones fisiológicas 5, y, en principio, permiten la inyección con catéter enfoques 6. Diferentes estrategias se han utilizado para materiales inyectables, que van desde la reticulación química después de la inyección de la reticulación física por cualquiera de temperatura, pH y comportamiento 4,7,8 reofluidificante. Aunque varios sistemas han demostrado fácil inyectabilidad a través de una jeringa de 9,10, con el catéter plena compatibilidad no se ha demostrado a menudo 6.
Los hidrogeles preparados a partir de polímeros supramoleculares se forman por interacciones no covalentes que se puede cambiar convenientemente de un gel a un estado de solución, y viceversa utilizando los desencadenantes del medio ambiente 11. Además, los precursores de bajo peso molecular permiten una fácil procesabilidad 12,13 . Las condiciones suaves requeridas para la conmutación permite la adición de varios componentes activos biológicos tales como a menudo difícil de manejar factores de crecimiento.
Redes transitorios supramoleculares en agua a base de poli (etilenglicol) (PEG), modificados en sus extremos con ureido-pirimidinona (UPY) restos 14 han demostrado los beneficios de interacciones no covalentes en combinación con aplicaciones biomédicas y se han utilizado como sistema de administración de fármacos en el corazón y 6 bajo la cápsula renal 15. Estas redes se forman por la dimerización de los UPY-grupos blindados desde el entorno acuoso por espaciadores alquilo que forman un bolsillo hidrofóbico. Enlaces de hidrógeno Urea facilita la posterior apilamiento de estos dímeros en nanofibras. Debido a la interacción reversible del dímero UPY-UPY, disparadores, tales como el pH y la temperatura se pueden utilizar para cambiar a partir de soluciones a los geles. El uso de un motivo sintética permite para el diseño de las propiedades de moléculas y de gel para el examen porlongitud tuning ple de las cadenas de PEG y espaciadores alquilo 14,16.
Por otra parte, varios componentes bioactivos pueden incorporarse simplemente mezclando la solución hydrogelator supramolecular antes de la inyección, con las drogas o especies bioactivas, tales como factores de crecimiento o exosomas, respectivamente. Los exosomas son pequeñas vesículas de membrana que contienen derivados citosólicas. Ellos son secretadas por muchas células y están implicadas en la comunicación intercelular. Los exosomas derivados de células progenitoras de cardiomiocitos se sugieren para desempeñar un papel en la protección cardiaca 17.
Aquí se describe el protocolo de formulación, y en el infarto de inyección in vivo de un hidrogel supramolecular tales bioactivo. Experimentos in vitro que se describen en dar golpe de derecha una indicación de la estabilidad de gel y la liberación del fármaco, lo que permite realizar un ajuste del gel y liberar propiedades antes aplicación in vivo.
Protocolo
NOTA: Todos los experimentos in vivo se realizaron de conformidad con la Guía para el Cuidado y Uso de Animales de Laboratorio por el Instituto de Recursos Animales de Laboratorio. Los experimentos fueron aprobados por el Comité de Experimentación Animal de la Facultad de Medicina de la Universidad de Utrecht, Países Bajos.
1. Formulación del hidrogel
- Para preparar 1 ml del gel 10% en peso, disolver 100 mg de la UPY-hydrogelator en un vial en 900 l de PBS pH 11,7 por agitación a 70 ° C durante 1 h usando un agitador magnético. Después enfriar la solución viscosa a temperatura ambiente. La solución debe ahora tener un pH de aproximadamente 9,0. Esta solución se puede almacenar durante varios días.
- Pipetear la cantidad apropiada de fármaco o biomolécula que se disuelve en PBS neutral en la solución viscosa y se agita durante 10 min para alcanzar una distribución uniforme. Si la solución se vuelve demasiado viscoso, poco se caliente con agua caliente.
- Coloque la solución durante 1 h bajo una lámpara de UV para esterilizar.
2. Análisis de hidrogel
- Evaluación reológica de la solución
- Antes de cargar el gel, montar la geometría de placa-placa de 25 mm en el reómetro, ajustar la temperatura a 20 ° C y cargar la placa con agua para evitar la evaporación del gel durante la medición.
- Pipetear 300 l de la solución sobre una geometría de placa-placa de 25 mm en un reómetro se mantuvo a 20 ° C e inferior de las placas para obtener una distancia de separación 0,5 mm.
- Viscosidad de cizallamiento Record como función de la tensión de cizallamiento de 0,1 a 500 Pa con 10 puntos por década.
- Evaluación reológicas del gel
- Pipetear 300 l de la solución sobre la placa y la pipeta un total de 4,2 l de HCl 1 M en diferentes lugares en la solución para inducir la formación de gel.
- Bajar las placas a una distancia de separación de 0,5 mm y dejar que el gel curado durante aproximadamente 30 min. Durante este proceso de curado, medir el almacenamiento y módulos de pérdidas a baja frecuencia y la tensión, por ejemplo, respectivamente, 1 rad / sec y 0,5%.
- Después de que el gel se haya curado (después de aproximadamente 30 min), el almacenamiento de registros y de pérdida de módulos como función de la frecuencia (0,1-100 rad / seg) y, posteriormente, como función de la deformación (0,1-1.000%).
3. Erosión y la versión Experimentos
- Transferir 100 l de la solución viscosa que contiene el fármaco o biomolécula en un poli (tereftalato de etileno) que cuelgan inserto de cultivo celular para 24-pocillos de la placa con tamaño de poro 8,0 micras. Para evitar la fuga de la solución de polímero mientras que en la fase líquida, cubrir el fondo de los insertos con Parafilm (Figura 2A).
- Inmediatamente después de la pipeta 1,4 l de HCl 1 M en la parte superior de la solución viscosa para reducir el pH a aproximadamente 7,0-7,2 y permiten la cura gel interior de la inserción durante aproximadamente 30 min.
- Retire el Parafilm from los insertos, colocar el inserto en una placa de 24 pocillos y llenar el pozo con 800 l de PBS pH 7,4. Incubar la placa a 37 ° C con balanceo lento o movimiento de agitación. Para evitar la evaporación del disolvente, llenar restante pocillos vacíos con PBS y sellar la placa de 24 pocillos con Parafilm (Figura 2B).
- Periódicamente refrescar la PBS y analizar la PBS eliminado lanzado producto de la erosión UPY o fármaco / biomolécula.
- Cuantificar productos de erosión UPY o pirfenidona midiendo la absorbancia UV a 265 nm o 320 nm, respectivamente. Por proteína fluorescente mRuby2 emisión de fluorescencia medida en 587 nm después de la excitación a 559 nm.
- Traducir los valores de absorción / emisión medidos a través de las concentraciones de las curvas de calibración predeterminados.
- Preparar las curvas de calibración de disolución una serie de concentraciones conocidas del analito en tampón y se mide la absorbancia UV o emisión fluorescente de estas muestras. Interpolar los datos mediante una función lineal a detARMIÑO la concentración de las muestras desconocidas. Para las proteínas no fluorescentes utilizar la detección ELISA 6.
4. Inyección local a través de un catéter
- La inducción de infarto de miocardio
- Después de 12 h de ayuno, excluyendo el agua, sedar al cerdo en su estable mediante la inyección de midazolam 0,4 mg / kg, la ketamina 10 mg / kg de atropina y 0.014 mg / kg por vía intramuscular.
- Administrar tiopental de sodio 5 mg / kg por vía intravenosa para inducir la anestesia y intubar al cerdo con un tubo endotraqueal. Realizar globo de ventilación a una velocidad de 12 / min si es necesario, mientras que el transporte de los animales a la sala de operaciones.
- A la llegada a la sala de operaciones comenzar inmediatamente la ventilación con presión positiva mecánica con FiO2 0,50, 10 ml / kg de volumen corriente, y una frecuencia de 12 / min bajo capnografía continua. Use ungüento veterinario en los ojos para evitar la sequedad.
- Iniciar anestesia equilibrada por intraven continuaous infusión de midazolam 0,5 mg / kg / h, sufentanilo 2,5 mg / kg / hr y bromuro de pancuronio 0,1 mg / kg / h. Para asegurar la anestesia adecuadas monitorean continuamente ECG, presión arterial, temperatura y capnografía.
- Por vía intravenosa infundir 4,3 mg / kg amiodarona y colocar el catéter desfibrilación intracardiaca en el ventrículo derecho mediante el Sheeth venosa 18.
- Ocluir el distal izquierda descendente anterior (LAD) a la segunda rama diagonal por la oclusión con balón intracoronario, durante 90 minutos, de acuerdo con el protocolo descrito previamente 18.
- Mapeo electromecánico
- A las cuatro semanas después de un infarto de miocardio, planificar el procedimiento de asignación. Prepare el sistema (Figura 4) en el laboratorio de cateterismo para el mapeo electromecánico 3D (EMM) del ventrículo izquierdo. Con este sistema de miocardio viable, hibernación y infartado se puede identificar sin guía fluoroscópica. Para construir una EM-mapa como adquirir una seRies de puntos en varias ubicaciones en la superficie endocárdica LV mediante el uso de una fuente de energía de campo magnético ultrabaja y un catéter con punta de sensor 19,20.
- Anestesiar el cerdo, siguiendo el protocolo pasos 4.1.1-4.1.4.
- Coloque el parche de referencia externo en la parte posterior del cerdo.
- Asegurar el acceso vascular (arteria femoral) según el protocolo 18.
- Después de obtener un biplano izquierda angiografía ventricular en el 25 ° oblicua anterior derecha (RAO) y 40 ° izquierda oblicua anterior (LA) vista para estimar el tamaño del ventrículo izquierdo, dar 75 U / kg de heparina.
- Avanzar un 8 Francés-mapping (D o curva F) bajo guía fluoroscópica catéter a la aorta descendente, arco aórtico y a través de la válvula aórtica en el ventrículo izquierdo (LV).
- Orientar la punta del catéter hasta el ápice de la LV para adquirir los primeros datos, seguido de tracto de salida, lateral y puntos posteriores para formar una silueta 3D, la definición de las fronteras de la Ventricle.
- Obtener puntos subsiguientes hasta que todos los segmentos endocárdicos se han muestreado arrastrando el catéter de mapeo sobre el endocardio y de forma secuencial la adquisición de la localización de la punta mientras está en contacto con el endocardio 21,22.
- Definir la zona de destino, que es donde la actividad eléctrica es (casi) deteriora el movimiento normal y mecánica, denominada miocardio hibernado (Figura 6).
- Inyección intramiocárdica
- Sustituir el catéter de mapeo por el catéter de inyección intramiocárdica que se compone de una aguja de calibre 27 y un lumen de núcleo dentro de un catéter francés 8 (Figura 5A y B). Para entregar cantidades específicas, cargar una jeringa graduada de volumen con aproximadamente 2 ml de la solución de hidrogel y colocarlo en una bomba de jeringa.
- Ajustar la extensión de la aguja a 0 ° y 90 ° de flexión y colocar 0,1 ml de la solución de hidrogel para llenar el espacio muerto de la aguja. Luego, coloque elpunta del catéter de inyección a través de la válvula aórtica y en la zona de destino.
- Conozca a los siguientes criterios para una posición de inyección dentro de la zona de destino determinado en 4.2.9: (1) la posición perpendicular del catéter a la pared del VI; (2) una excelente estabilidad de bucle (<4 mm) calculado por el sistema-EMM; y (3) la tensión subyacente> 6,9 mV 21.
- Avanzar la aguja en el miocardio, (4) confirmada por una contracción ventricular prematura de la LV, e inyectar 0,1-0,3 ml del hidrogel en un bolo a una velocidad constante de aproximadamente 0,4-0,5 ml / min utilizando la bomba de jeringa. Repita esto en 6-10 posiciones diferentes como difuso posible. El pH natural del tejido va a neutralizar la solución después de la inyección, sobre la que se forma el hidrogel.
- Sacrificio
- Después de la cirugía, con humanidad sacrifica el animal por desangramiento. Cortar la vena cava inferior y eliminar la sangre con un dispositivo de succión. Inducir ventricularfibrilación mediante la colocación de una batería de 9 V en el ápice.
Resultados
Los resultados típicos obtenidos a partir de las mediciones reológicas oscilatorias tanto en la solución y el gel se muestran en la Figura 1. Para la inyección a través de un catéter de largo, con un fluido newtoniano de baja viscosidad es deseable. La viscosidad se midió como función de la velocidad de cizallamiento, mostrando que a pH 8,5 la solución es el adelgazamiento de cizalladura pero a pH 9.0 y 9.5 las soluciones se comportan como fluidos newtonianos como se evidencia por la viscosidad constante de 0,54 y 0,36 Pa · seg, respectivamente (Figura 1A) . Después de neutralizar las muestras, las muestras muestran una respuesta de tipo sólido observado por un módulo de almacenamiento G 'que es mayor que el módulo de pérdida G "y por lo tanto un tanδ = G' / G '<1 (Figura 1B). El gel obtiene su resistencia final dentro de los 30 minutos. Mediciones reológicas oscilatorias muestran una respuesta sólida como típico con G 'casi independiente de la frec angularuidez y G '> G "para todas las frecuencias medidas (Figura 1C).
Esencial para el uso como sistema de administración de fármacos es la erosión del hidrogel en el tiempo. Las interacciones supramoleculares son inherentemente dinámico y permiten una lenta erosión del gel in vitro. Erosión y liberación experimentos se realizaron a 37 ° C utilizando insertos así porosos (Figura 2A y B). Al ajustar la longitud del bloque hidrófobo e hidrófilo 14, un gel que se erosiona durante un período de varias semanas puede ser obtenido (Figura 3A). El gel se erosiona 25% en 2 semanas con una erosión inicial de 10% en el primer día, presumiblemente debido a la hinchazón inicial del hidrogel. Como ejemplo, se estudió tanto la liberación de un fármaco de molécula pequeña (pirfenidona), y la liberación de una proteína modelo fluorescente (mRuby2). Una proteína fluorescente modelo permite una lectura fácil; Sin embargo, in vitro Experimentos de liberación también se pueden realizar en otras proteínas usando ELISA para la cuantificación 6. El fármaco de molécula pequeña es liberado dentro de un día, mientras que las moléculas más grandes como las proteínas se liberan gradualmente durante 1 semana (Figura 3B). Montaje del perfil de liberación de mRuby2 hasta 60% de liberación con el modelo Korsmeyer-Peppas semi-empírica indica la liberación debido a la difusión (n = 0,44) 23. La ausencia de un desplazamiento en el (adaptado) modelo Korsmeyer-Peppas muestra que no hay liberación de ráfaga presente para mRuby2 24. Debido a la limitada cantidad de puntos de datos con un comunicado inferior al 60% de pirfenidona, ningún ajuste se realizó en este perfil de liberación.
El sistema de navegación del catéter consta de una consola unidad de comunicación, una estación de trabajo (Figura 4), una almohadilla de localización triangular (la generación de un campo magnético bajo) con un parche de referencia externo, y dos catéteres, el mapeo sensor de punta y la injection catéter (Figura 5).
Después de un análisis post-procesamiento se ha filtrado puntos inestables la reconstrucción 3D del endocardio del VI se actualiza en tiempo real con la adquisición de cada nuevo punto de datos y se muestra de forma continua como potenciales de tensión unipolares y bipolares en una escala graduada de color (Figura 6A). La función de acortamiento lineal local (LLS) cuantifica la motilidad regional mediante la obtención de la variación media de la distancia entre el sitio de la muestra y puntos adyacentes al final de la sístole y al final de la diástole. Los valores de tensión media y LLS se calculan para cada segmento y se muestran en el mapa polar. (Figura 6B). La presencia de un potencial anormal o baja unipolar (≤6 mV) y la actividad mecánica alterada (LLS ≤4%) caracteriza las zonas infartadas 22.
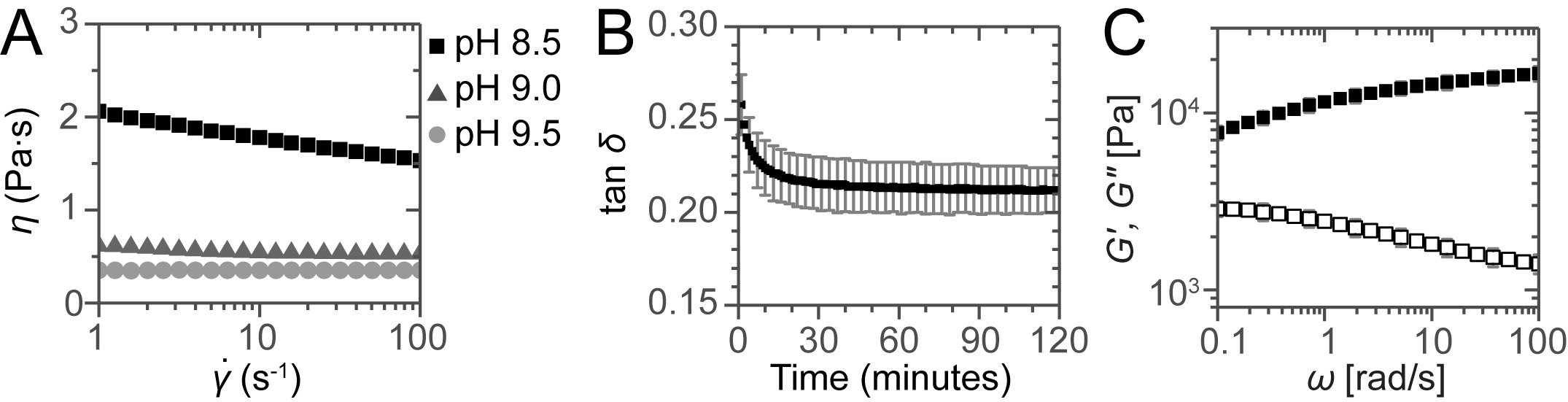
Figura 1 :. evaluación reológica de las soluciones y geles. (A) Viscosidad como una función de la velocidad de cizallamiento para las soluciones a diferentes pH. Para la muestra a pH 8,5 dilución por cizallamiento se observa pero para las muestras a pH 9,0 y 9,5 se obtienen viscosidades constantes, que muestra el comportamiento newtoniano de estas soluciones. De curado (B) Gel seguido por el trazado de tan δ como una función del tiempo. Barrido (C) Frecuencia para una muestra neutralizada después del curado de 2 horas. Las barras de error muestran las desviaciones estándar de 3 mediciones independientes, lo que indica un error típico experimental.

Figura 2:. De configuración para la degradación y liberación de experimentos (A) poli (tereftalato de etileno) así inserto cubiertos con Parafilm para evitar fugas during preparación. (B) 24-pocillos de la placa con inserciones, envuelto con Parafilm para evitar la evaporación del disolvente.

Figura 3:. La erosión y la liberación (A) La erosión del hidrogel en el tiempo. Se observa la erosión gradual del gel durante al menos 2 semanas. (B) La liberación de un fármaco de molécula pequeña y una proteína modelo. Mientras que la pequeña molécula es liberada dentro de un día, la proteína modelo se libera gradualmente a lo largo de una semana sin una liberación significativa de ráfaga. La línea muestra el ajuste del modelo Korsmeyer-Peppas a la etapa inicial de la liberación.

Figura 4: El sistema de navegación del catéter. consola de unidad de comunicación con NOGA XP sistema de navegación cardiaca.
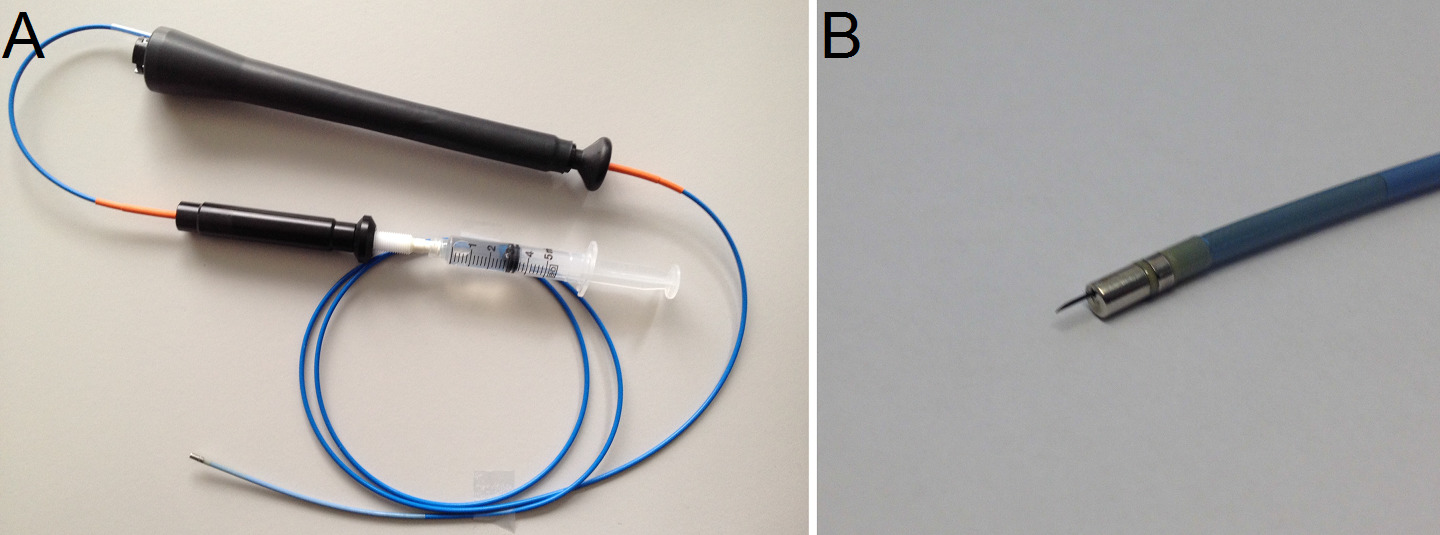
Figura 5: (A) El catéter de inyección intramiocárdica con jeringa unida. (B) Detalle de la aguja de inyección.
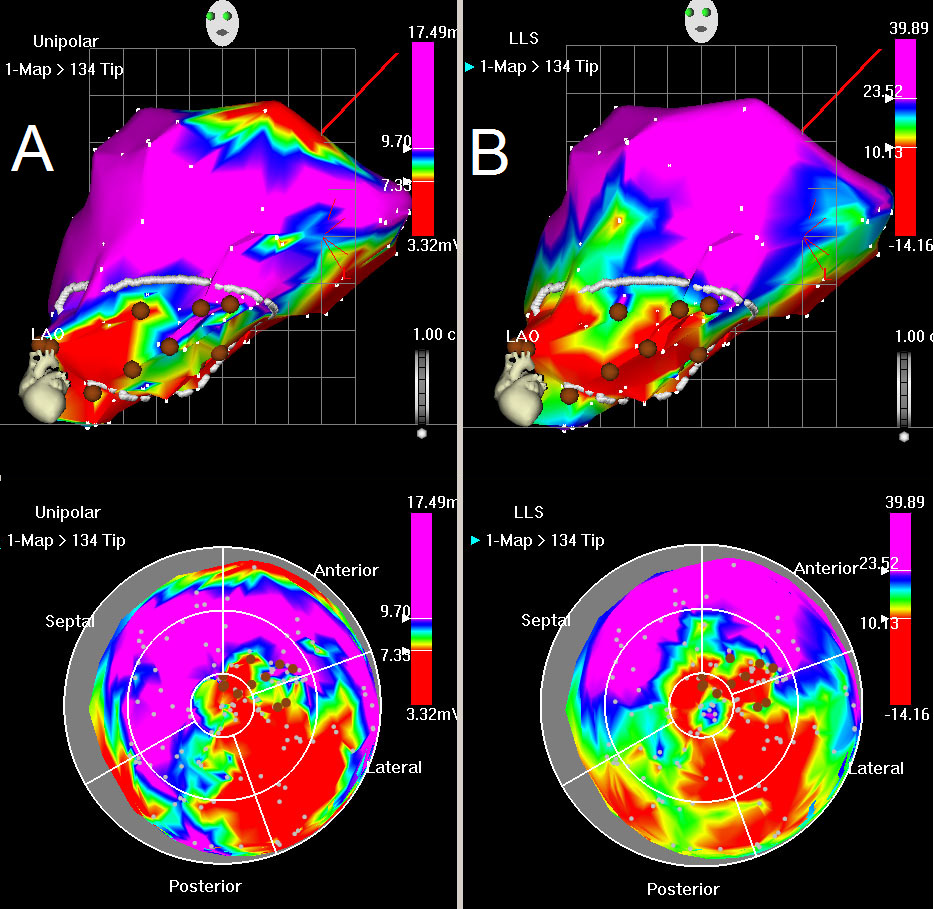
Figura 6: tensión Unipolar y mapa de LLS. (A) mapa Unipolar, OAI (arriba) y ojo de buey (abajo). El color rojo indica valores de tensión unipolares bajas en la base de miocardio (normal) con pérdida de actividad posterolateral eléctrica. El color azul indica miocardio normal, mientras que los colores verde y amarillo indican disminuyeron la viabilidad. (B) Mapa de LLS, OAI (arriba) y ojo de buey (abajo). Indica el color rojotes acinesia de la pared posterolateral, verde y amarillo indican disminución de movimiento de la pared. Los puntos de mapeo se muestran con puntos blancos. La línea blanca dibujada muestra el área de interés, que se caracteriza por tensiones unipolares disminuido y los movimientos de la pared con discapacidad. Puntos marrones representan los puntos de inyección.
Discusión
Un desafío clave es obtener una solución que es inyectable a través de un catéter de largo mientras se mantiene la solución compatible con los compuestos bioactivos. Aunque el pH se debe aumentar para aumentar inyectabilidad, compuestos bioactivos, tales como factores de crecimiento son moléculas frágiles que deben ser manejados con cuidado. Monitoreamos el pH de la solución cuidadosamente utilizando un medidor de pH después de añadir el hydrogelator para confirmar que es pH 9,0 antes de agregar cualquier componentes bioactivos. Inicialmente, varias rondas de ajustar el pH inicial de la PBS eran necesarias para acabar con el pH adecuado. Además, debido a que usamos soluciones relativamente viscosos y un catéter largo y delgado, una gran caída de presión está presente (en el orden de 0,5 MPa, dependiendo de la velocidad de la inyección). Por lo tanto, la atención especial se debe tomar en la selección de las conexiones adecuadas entre la jeringa y el catéter. Una inyección de soportes de la bomba de jeringa controlada, ya que la aplicación de dichas fuerzas a mano es un reto. Porque en vitro experimentos, la solución se gelifica mediante la neutralización de la solución con HCl, mientras que in vivo esto se hace por el pH natural del tejido. Por lo tanto, es importante añadir la cantidad correcta de HCl para evitar un sobreimpulso en el pH. La difusión de este ácido es probablemente el factor limitante en la gelificación del hidrogel en experimentos in vitro; sin embargo, en vivo el líquido tendría un área de superficie de alta el contacto con la neutralización de los tejidos, lo que se traducirá probablemente en un más rápido y de manera más uniforme en comparación con la gelificación gota a gota adición de ácido concentrado. Por otra parte, la conmutación gel es mucho más rápido con este procedimiento leve en comparación con los métodos utilizados anteriormente (0,5 vs hr 2 hr 25). Usando pH natural del cuerpo para la conmutación de las propiedades del material es muy atractiva desde la transición es rápida, reversible, no puede ocurrir en el interior del catéter y es in vivo totalmente automático. Estas propiedades dan ventajas sobre por ejemplo swit térmicaChable geles 26, donde el riesgo de gelificación en un catéter debido a los cambios de temperatura está presente, geles que requieren polimerización fotoinducida, que es un reto debido a la penetración de la luz y la limitada formación de radicales 27, o geles que requieren co-inyección de un iniciador de polimerización o aceleradora 28.
El éxito de la liberación de un fármaco desde el hidrogel depende en gran medida el tamaño de la droga. Como se muestra, el fármaco de molécula pequeña se libera inmediatamente, mientras que la liberación gradual de la proteína modelo más de 1 semana muestra la promesa de estos hidrogeles como sistemas de administración para factores de crecimiento. En general, los hidrogeles son más prometedores como herramienta de entrega para los objetos más grandes, tales como proteínas, exosomas y células 29,30.
El procedimiento de asignación y la inyección electromecánico 3-D ofrece un enfoque de entrega basado en catéter clínicamente validado por diversas terapias regenerativas del miocardio, como hidrogeles. El Added valor de esta tecnología en comparación con otras técnicas de administración no quirúrgico es la planificación del tratamiento, por lo que es posible diferenciar lo normal, infartado y miocardio hibernado y guiar terapias en el área de interés. Los inconvenientes de este enfoque se refieren a los conocimientos técnicos necesarios y el tiempo y procedimiento caro 20. En el modelo porcino presentado de mapeo electromecánico infarto de miocardio fue seguido por inyecciones intramiocárdicos guiadas con el supramolecular bioactivo UPY-hidrogel. Otras combinaciones con terapias regenerativas tienen que ser probados in vitro e in vivo para ganar más éxito en este campo emergente. Por otra parte, la optimización de los procedimientos de inyectabilidad y esterilización tienes que estar realizado de traducir con éxito este método para un entorno clínico.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Este trabajo fue financiado por el Ministerio de Educación, Cultura y Ciencia (programa Gravedad 024.001.035), la Organización Holandesa para la Investigación Científica (NWO), el Consejo Europeo de Investigación (FP7 / 2007-2013) Acuerdo de subvención del CEI 308.045 y llevado a cabo dentro de la marco LSH TKI. Esta investigación forma parte del proyecto P1.03 PENT del programa de investigación de la Biomédica Materiales instituto, co-financiado por el Ministerio de Economía holandés. Este proyecto fue apoyado por ICIN - Instituto Holandés corazón ( www.icin.nl ) y el "Wijnand M. Pom Stichting". Los autores desean agradecer a Henk Janssen y Joris Peters para la síntesis de la UPY-hydrogelator y Remco Artes para la prestación del mRuby2. Damos las gracias a Bert Meijer, Tonny Bosman, Roxanne Kieltyka, Stijn Kramer, Joost Sluijter, Imo Hoefer y Frebus van Slochteren por las muchas discusiones útiles y Marlijn Jansen, Joyce Visser, Grace Croft y Martijn van Nieuwburg de teasistencia té cn ica.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 M HCl | |||
| 1 M NaOH | |||
| Polystyrene 24-well plate | Falcon | 353047 | |
| Amiodarone | Cordaron I.V. (Sanofini) | ||
| Anton Paar Physica MCR501 | Anton Paar GmbH | Equipped with a parallel-plate geometry (25 mm) | |
| Atropine | PCH | ||
| Balloon ventilator | |||
| Cary 50 Scan UV-Visible Spectrophotometer | Varian | ||
| Cary Eclipse Fluorescence Spectrophotometer | Varian | ||
| Defibrillation patches | |||
| DMSO | Biosolve | 44705 | |
| Endotracheal tube | Covidien | ||
| Heparin | |||
| Ketamine | Narketan 10 Vétoquinol | ||
| Mapping catheter 115 cm | Biosense Webster | ||
| Midazolam | Actavis | ||
| MilliQ | MD Milipore MilliQ Integral Water Purification System | ||
| mRuby2 | |||
| NaCl 0.9% 500 cc | Braun | ||
| NOGA guided Myostar injection catheter | Biosense Webster | ||
| NOGA-RefStar EFO-patch | Biosense Webster | ||
| Pancuronium bromide | |||
| Parafilm | VWR | IKAA3801100 | |
| PBS | Sigma Aldrich | P4417 | |
| PET millicel | Millipore | PIEP12R48 | |
| Pirfenidone | Sigma Aldrich | P2116 | Used from 100 mM stock in DMSO |
| Sodiumthiopental | Inresa | ||
| Sufentanil | Sufentanil-Hameln | ||
| Tegaderm | |||
| UPy-PEG10k | |||
| UV-Lamp | |||
| Vet ointment | |||
| Visipaque contrastfluid 100 cc |
Referencias
- Levy, D., et al. Long-Term Trends in the Incidence of and Survival with Heart Failure. The New England Journal of Medicine. 347 (18), 1397-1402 (2002).
- Roger, V. L., et al. Heart disease and stroke statistics—2012 update: a report from the American Heart Association. Circulation. 120 (1), 2-220 (2012).
- Peppas, N. A., Huang, Y., Torres-Lugo, M., Ward, J. H., Zhang, J. Physicochemical foundations and structural design of hydrogels in medicine and biology. Annual Review of Biomedical Engineering. 2 (1), 9-29 (2000).
- Olsen, B. D., Kornfield, J. A., Tirrell, D. A. Yielding Behavior in Injectable Hydrogels from Telechelic Proteins. Macromolecules. 43 (21), 9094-9099 (2010).
- Guvendiren, M., Lu, H. D., Burdick, J. A. Shear-thinning hydrogels for biomedical applications. Soft Matter. 8 (2), 260 (2012).
- Bastings, M., et al. A Fast pH-Switchable and Self-Healing Supramolecular Hydrogel Carrier for Guided, Local Catheter Injection in the Infarcted Myocardium. Advanced Healthcare Materials. 3 (1), 70-78 (2014).
- Pawar, G. M., et al. Injectable Hydrogels from Segmented PEG-Bisurea Copolymers. Biomacromolecules. 13 (12), 3966-3976 (2012).
- Yoon, H. -. J., Jang, W. -. D. Polymeric supramolecular systems for drug delivery. Journal of Materials Chemistry. 20 (2), 211-222 (2009).
- Christman, K. L., Lee, R. J. Biomaterials for the treatment of myocardial infarction. Journal of the American College of Cardiology. 48 (5), 907-913 (2006).
- Yu, L., Ding, J. Injectable hydrogels as unique biomedical materials. Chemical Society Reviews. 37 (8), 1473-1481 (2008).
- Krieg, E., Rybtchinski, B. Noncovalent Water-Based Materials: Robust yet Adaptive. Chemistry – A European Journal. 17 (33), 9016-9026 (2011).
- Davis, M. E., et al. Injectable self-assembling peptide nanofibers create intramyocardial microenvironments for endothelial cells. Circulation. 111 (4), 442-450 (2005).
- Li, J., Ni, X., Leong, K. W. Injectable drug-delivery systems based on supramolecular hydrogels formed by poly(ethylene oxide)s and alpha-cyclodextrin. Journal of Biomedical Materials Research. Part A. 65 (2), 196-202 (2003).
- Dankers, P. Y. W., et al. Hierarchical formation of supramolecular transient networks in water: a modular injectable delivery system. Advanced materials. 24 (20), 2703-2709 (2012).
- Dankers, P. Y. W., et al. Development and in-vivo characterization of supramolecular hydrogels for intrarenal drug delivery. Biomaterials. 33 (20), 5144-5155 (2012).
- Kieltyka, R. E., et al. Mesoscale modulation of supramolecular ureidopyrimidinone-based poly(ethylene glycol) transient networks in water. Journal of the American Chemical Society. 135 (30), 11159-11164 (2013).
- Vrijsen, K. R., et al. Cardiomyocyte progenitor cell-derived exosomes stimulate migration of endothelial cells. Journal of Cellular and Molecular Medicine. 14 (5), 1064-1070 (2010).
- Koudstaal, S., et al. Myocardial infarction and functional outcome assessment in pigs. Journal of Visualized Experiments. (86), (2014).
- Koudstaal, S., et al. Sustained delivery of insulin-like growth factor-1/hepatocyte growth factor stimulates endogenous cardiac repair in the chronic infarcted pig heart. Journal of Cardiovascular Translational Research. 7 (2), 232-241 (2014).
- Spoel, T. I., et al. Non-surgical stem cell delivery strategies and in vivo cell tracking to injured myocardium. International Journal of Cardiovascular Imaging. 27 (3), 367-383 (2011).
- Gepstein, L., Hayam, G., Shpun, S., Ben-Haim, S. A. Hemodynamic evaluation of the heart with a nonfluoroscopic electromechanical mapping technique. Circulation. 96 (10), 3672-3680 (1997).
- Gyöngyösi, M., Dib, N. Diagnostic and prognostic value of 3D NOGA mapping in ischemic heart disease. Nature Reviews Cardiology. 8 (7), 393-404 (2011).
- Siepmann, J., Siepmann, F. Modeling of diffusion controlled drug delivery. Journal of Controlled Release Official Journal of the Controlled Release Society. 161 (2), 351-362 (2012).
- Kim, H., Fassihi, R. Application of binary polymer system in drug release rate modulation. 2. Influence of formulation variables and hydrodynamic conditions on release kinetics. Journal of Pharmaceutical Sciences. 86 (3), 323-328 (1997).
- Pape, A. C. H., et al. Mesoscale characterization of supramolecular transient networks using SAXS and rheology. International Journal Of Molecular Sciences. 15 (1), 1096-1111 (2014).
- Lee, B. H., Vernon, B. . In Situ-Gelling, Erodible N-Isopropylacrylamide Copolymers. Macromolecular Bioscience. 5 (7), 629-635 (2005).
- Annabi, N., et al. 25th Anniversary Article: Rational Design and Applications of Hydrogels in Regenerative Medicine. Advanced Materials. 26 (1), 85-124 (2014).
- Asai, D., et al. Protein polymer hydrogels by in situ, rapid and reversible self-gelation. Biomaterials. 33 (21), 5451-5458 (2012).
- Peppas, N. A., Hilt, J. Z., Khademhosseini, A., Langer, R. Hydrogels in Biology and Medicine: From Molecular Principles to Bionanotechnology. Advanced Materials. 18 (11), (2006).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nature Biotechnology. 23 (1), 47-55 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados