Method Article
Ingeniería 3D Cellularized colágeno Geles para Vascular Regeneración Tisular
En este artículo
Resumen
In this work, we present a technique for the rapid fabrication of living vascular tissues by direct culturing of collagen, smooth muscle cells and endothelial cells. In addition, a new protocol for the mechanical characterization of engineered vascular tissues is described.
Resumen
Los materiales sintéticos son conocidos para iniciar complicaciones clínicas tales como la inflamación, la estenosis, y las infecciones cuando se implanta como sustitutos vasculares. El colágeno se ha utilizado ampliamente para una amplia gama de aplicaciones biomédicas y se considera una alternativa válida a los materiales sintéticos debido a su biocompatibilidad inherente (es decir, baja antigenicidad, la inflamación y respuestas citotóxicas). Sin embargo, las propiedades mecánicas limitadas y la mano baja-capacidad de los geles de colágeno relacionados han obstaculizado su uso como materiales de andamios para la ingeniería de tejido vascular. Por lo tanto, la razón de ser de este trabajo fue el primero en diseñar geles de colágeno cellularized en una geometría de forma tubular y el segundo para mejorar las células musculares lisas de reorganización impulsado de matriz de colágeno para obtener tejidos suficientemente rígidas para ser manipulados.
La estrategia descrita aquí se basa en el montaje directo de colágeno y células musculares lisas (construir) en un cyli 3Dgeometría ndrical con el uso de una técnica de moldeo. Este proceso requiere un período de maduración, durante el cual los constructos son cultivadas en un biorreactor bajo condiciones estáticas (sin limitaciones mecánicas dinámicas externa aplicada) para 1 o 2 semanas. El "biorreactor estático" proporciona un ambiente estéril vigilado y controlado (pH, temperatura, intercambio de gases, suministro de nutrientes y la eliminación de residuos) a los constructos. Durante período de cultivo, se realizaron mediciones de espesor para evaluar la remodelación de la matriz de colágeno células-conducido, y el consumo de glucosa y las tasas de producción de lactato se midieron para monitorear las células la actividad metabólica. Por último, las propiedades mecánicas y viscoelásticas fueron evaluados para las construcciones tubulares resultantes. Para este fin, los protocolos específicos y un know-how centrado (manipulación, agarre, trabajando en el entorno hidratado, y así sucesivamente) se han desarrollado para caracterizar los tejidos de ingeniería.
Introducción
La ingeniería de tejidos Vascular prevé diferentes estrategias destinadas a la fabricación de recipientes de ingeniería, incluyendo injertos basados en andamios sintéticos, los vasos sanguíneos de ingeniería tisular basados hoja de células (TEBVs), y la matriz extracelular (ECM) componentes basados en TEBVs. Entre estos enfoques, polímeros sintéticos presentan buenas propiedades mecánicas, pero comparten un inconveniente común ya que carecen de bioactividad 1. El método basado hoja de células permite la producción de sustitutos vasculares de ingeniería con altas propiedades mecánicas, pero el tiempo requerido para producir tales injertos es de aproximadamente 28 semanas 2. Biopolímeros naturales de la ECM, tales como colágeno, elastina, fibrina 3 o una combinación de los mismos, siendo los materiales estándar de oro para los andamios de ingeniería de tejidos. Esto se debe principalmente por la razón de que estos materiales poseen un general buena biocompatibilidad mismo tiempo ser capaz de inducir respuestas celulares funcionales 4-5. Entre estos biopolímeros, colágeno de tipo I es uno de la proteína de soporte de carga más abundante y predominante de la ECM en muchos tejidos tales como la piel, vasos sanguíneos y tendones. Mucho trabajo se ha realizado sobre las propiedades mecánicas del colágeno 6-8, pero ha habido pocos estudios sobre la remodelación celular de geles de colágeno durante la maduración estática. Remodelación celular se refiere a las modificaciones estructurales de la matriz de colágeno inducida por las células que podrían afectar a la estabilidad de la red de fibrillas de colágeno 9. Como un andamio natural, relativamente grandes cantidades de colágeno de tipo I pueden ser aislados, esterilizan y se almacenan a partir de diferentes fuentes tales como tendones de cola de rata 10. La comprensión de las interacciones celulares con colágeno y los comportamientos mecánicos generales relacionados de los andamios de colágeno cellularized (construcciones) es un paso esencial para la construcción de los tejidos. TEBVs a base de colágeno pueden ser procesados por mezcla directa de las células con colágenodurante la preparación del gel y moldeado en formas más específicas, tales como tubular y plana 11. Células vasculares dentro de los geles proliferan y tipo remodelación I colágeno 12. Por lo tanto, este método evita la necesidad de macroporosidad específico que representa uno de los problemas significativos en el desarrollo de los andamios para aplicaciones de ingeniería de tejidos. Sin embargo, los principales inconvenientes de geles de colágeno son sus propiedades mecánicas bajas en comparación con los materiales sintéticos 13.
En este estudio, un tejido viable con distribución homogénea de las células fue diseñado por mezcla directa de colágeno con células en un proceso de un solo paso. "biorreactores estáticas" se utilizaron para los 1 o 2 semanas de maduración estática de los geles de colágeno cellularized (sin limitaciones mecánicas dinámicas externas aplicadas). Durante el cultivo, se produjo remodelación de la matriz de colágeno, lo que proporciona un refuerzo estructural de las construcciones. Además, estas construcciones eran ready para ser transferidos a un biorreactor de rotación de la pared y se logró un endotelio homogénea. Además, en este trabajo también se propone un protocolo específico de ensayos mecánicos para proporcionar un enfoque novedoso apropiado en la caracterización de las propiedades mecánicas de los tejidos tubulares blandos.
En resumen, este trabajo presenta un método para la fabricación y la maduración de los tejidos vasculares que son lo suficientemente fuertes como para ser manejado no sólo para caracterizaciones biológicas y mecánicas, sino también para la ulterior acondicionamiento mecánico dinámico en un biorreactor, que se considera una importante rápida in vitro paso en la regeneración de los tejidos.
Protocolo
1. Fabricación y Asamblea del biorreactor estático
- La fabricación del embalse
- Preparar 50 ml tubos de centrifugación como un depósito medio de cultivo para el biorreactor.
- Hacer dos puertos mediante la perforación de dos diámetros de agujeros 5 mm a 20 mm desde la parte inferior y la parte superior del depósito, respectivamente. A continuación, inserte dos accesorios de montaje en tubos de silicona de longitud 5 mm. Prensa-encaja estos accesorios de montaje a través de los agujeros, y sellar todas las conexiones con pegamento de silicona de grado médico.
- Introduzca un filtro en el puerto superior del depósito (Figura 1A) 0,22 micras.
- Insertar un septum luer en el puerto inferior del depósito (Figura 1A).
- Asamblea Mandril-cap
- Perforar un agujero de diámetro 4,5 mm en el centro de la tapa ventilada del tubo de depósito sin dañar la membrana de filtro que cubre los orificios de aireación.
- Preparar una barra de agitación (diámetro = 4,5 mm, longitud = 100 mm) Como un mandril para la construcción.
- Prepare dos tapones cónicos de silicona (longitud = 10 mm, diámetro agujero medio = 4,5 mm).
- Montar el mandril y la tapa (complejo mandril-cap) como se describe en la Figura 1B.
- Prensa-encaja el mandril en el agujero. Inserte los tapones 2 sobre el mandril de modo que la tapa se instala entre ellos. Ajuste la posición del mandril de manera que su longitud útil es de 78 mm.
- Aplicar una imprimación y luego pegamento de silicona de calidad médica a las superficies que estarán en contacto antes de unirse a la tapa y los tapones cónicos de silicona juntos. Retire el exceso de pegamento en la tapa.
- Deje que se seque a temperatura ambiente durante 1-3 días.
- La fabricación de los apretones de gasa-
- Preparar 3 tubos de silicona (tubo 1: diámetro interno = 6,4 mm, longitud = 5 mm; tubo 2: diámetro = 6,4 mm, longitud = 10 mm, y el tubo 3: diámetro = 3,1 mm, longitud = 12 mm).
- Montar las gasas-apretones como describird en la Figura 1C.
- Tubo Cut 1 longitudinalmente, y abrirlo sobre el tubo 2. Pegue ellos junto con el pegamento de silicona.
- Cortar gasa quirúrgica estéril para 5 cm x 7 cm de hoja, y luego rodar firmemente la gasa sobre el tubo 3 a lo largo del lado más largo de la gasa. Inserte el tubo complejo 1-tubo 2 sobre la gasa.
- Añadir pegamento de silicona a pegarse la gasa, el complejo de tubo de 1-tubo 2 y el tubo 3. Corte la gasa en una longitud de 8 mm.
- Asamblea y Esterilización
- Montar el complejo mandril-tapa y las gasas-apretones como se describe en la figura 2.
- Escudo del mandril con grasa de grado médico (Figura 2). Coloque las gasas-apretones sobre el mandril (Figura 2B). Distancia los agarres a valor fijo de 35 mm entre sí.
- Preparar un molde tubular mediante la eliminación de la parte inferior de una jeringa de 10 ml usando una sierra de mesa (final de longitud = 8 mm) ( Figura 2B).
- Inserte el molde sobre el conjunto de mandril-cap gasa apretones equipada (complejo de viviendas molde), complemento de montar el moho en el tapón de silicona (Figura 2C).
- Autoclave el depósito y el complejo de viviendas-molde.
Nota: Tenga cuidado de mantener en el tapón de silicona con fuerza al insertar el molde para evitar su desprendimiento.
- Montar el complejo mandril-tapa y las gasas-apretones como se describe en la figura 2.
2. Ingeniería de células musculares lisas constructos basados en gel de colágeno y estático Maduración
- Las construcciones de ingeniería
- Expandir las células porcinas de aorta de músculo liso (pSMCs) en 175 matraces de cultivo cm 2 llenos con 20 ml de medio de cultivo completo que consiste en Medio Eagle Modificado de Dulbecco suplementado con 10% (v / v) de suero porcino (PS), 10% (v / v ) de suero fetal bovino (FBS), 1% (v / v) de penicilina-estreptomicina (pen-strep).
- En ≈90% de confluencia, separar pSMCs (paso 4.2) mediante la eliminación del medio de cultivo de lamatraz de pSMCs, añadiendo 5 ml de solución de tripsina (1x en solución salina tamponada con fosfato, PBS), e incubando durante 10 min (T = 37 ° C, 5% de CO 2, 100% de humedad).
- Resuspender las pSMCs a una concentración de 4 x 10 6 células / ml en medio de cultivo completo.
- Prepare la solución de colágeno como se describió anteriormente 10.
- Extraer y recoger haces de colágeno de los tendones de cola de rata en una solución de PBS.
- Transferencia de las fibras de colágeno posteriormente en acetona (5 min), isopropanol 70% (v / v) (5 min) y ácido acético (0,02 N, 48 h, 4 ° C) soluciones.
- Mezcle la solución viscosa y congelar a -20 ° C durante 3 días.
- Liofilizar la solución congelada para obtener esponjas de colágeno.
- Solubilizar el esponjas de colágeno en solución de ácido acético (0,02 N) a una concentración de 4 g / L y se centrifuga a 29.581 g durante 45 min fuerza.
- Esterilizar la solución de colágeno a través del proceso de diálisis contra s posterioresoluciones de ácido acético (0,02 N, 1 hr), cloroformo 1% (v / v, 1 hr) y ácido acético (0,02 N, solución estéril cambió cada 2 días durante 1 semana).
- Recoger la solución de colágeno estéril (4 g / L) en una campana de cultivo celular estéril.
- Preparar geles de colágeno cellularized como se muestra en la Figura 3.
- Preparar 50 ml de solución tampón estéril mediante la mezcla de 35 ml de DMEM (5x), 4 ml de HEPES (1 N), 3 ml de NaOH (1 N) en 8 ml de agua desionizada estéril.
- Preparar las células y la mezcla de gel de colágeno en un recipiente colocado en hielo mediante la mezcla de 50% (v / v) de solución de colágeno estéril (4 g / L de ácido acético 0,02 N) con 25% (v / v) de solución tampón y 25% (v / v) de la suspensión de pSMCs en medio de cultivo completo.
- Medir el pH de la mezcla y asegúrese de que está entre 7.0 y 7.4.
- Verter suavemente 9 ml de mezcla de colágeno células-y-en el complejo antes mencionado vivienda / molde (paso 1.4.3, Figura 3A-B ).
- Que gel a temperatura ambiente durante 1 hr bajo la campana de cultivo de células (Figura 3B).
- Maduración en estático Bioreactor
- Retire el molde (Figura 3C) y transferir cuidadosamente el constructo en el depósito, que contiene 35 ml de medio de cultivo (Figura 3D).
- Incubar el constructo (T = 37 ° C, 5% de CO 2, 100% de humedad) en posición vertical para 1 o 2 semanas de maduración estática.
- Instalar una cámara web (sellado con el fin de garantizar el aislamiento) dentro de la incubadora en frente de la construcción.
- Cambiar el medio de cultivo cada 2 días por aspiración de la vieja medio desde el puerto luer septum y volver a llenar el depósito con una cantidad equivalente de medio de cultivo fresco.
- Medición de espesor y metabólico Actividad de CML-colágeno constructos Gel-basa Durante estático Cultura
- Coloque el interferómetro láser de barrido en el cultu celularre capucha y darle la vuelta a la vertical a la posición horizontal usando un nivel de burbuja.
- Transferir el biorreactor en la campana de cultivo de células y eliminar el constructo desde el depósito.
- Transferir el constructo (todavía montado en el mandril) en la vía del haz de láser, y colocarlo estrictamente ortogonalmente con respecto al eje del haz (como se muestra en la Figura 4).
- Leer el valor visualizado en la pantalla del interferómetro láser de exploración, correspondiente al diámetro externo de la construcción.
- Calcular el espesor de la pared de la construcción sobre la base de su diámetro externo e interno (es decir, el diámetro del mandril).
Nota: Repita los pasos 2.3.1 al 2.3.5 cada hora durante las primeras 12 horas y luego cada 24 horas. - Usar 1 ml de medio de cultivo viejo (muestreada al cambiar el medio de cultivo, paso 2.2.4) para medir las concentraciones de lactato y glucosa con el analizador de gases en sangre.
- Usar 1 ml de lamedio de cultivo fresco como un nivel de línea de base para las mediciones de las concentraciones de glucosa y de lactato 14.
Nota: Repita los pasos 2.3.6 y 2.3.7 cada 2 días después de medio de cultivo para cambiar pañales.
- Construya cosecha para más Ccharacterizations mecánicos y biológicos
- Después de 1 o 2 semanas de período de maduración estática, transferir el biorreactor estático en la campana de cultivo celular.
- Transferencia suavemente el constructo madura de su mandril (Video Suplementaria 1) a una placa de Petri de 100 mm de diámetro que contiene 40 ml de medio de cultivo fresco (Figura 5 y la Figura 7a).
3. Caracterización mecánica de las construcciones en la longitudinal y circunferencial
- Instalar el montaje experimental que consiste en el probador de micromecánica equipado con una célula de 5 o 10 N de carga y un baño que contiene PBS a 37 ° C para mantener las muestras unacondiciones pseudo-fisiológica t (Figura 6).
- Balance de la célula de carga y el extensómetro.
Nota: Balancing es una función integrada en el probador micromecánica que consiste en restablecer el valor de extensión indicado y el valor de la carga que se muestra mientras que ninguna muestra se monta en la máquina. Esta función permite definir la referencia para ambas mediciones. - Montaje de las construcciones tubulares en el aparato mecánico: dirección longitudinal.
Nota: Realice pruebas de fatiga longitudinales directamente sobre la totalidad de los construcciones tubulares. Uso en-casa-construido dispositivos de agarre para conectar las mordazas de gasa de las construcciones de la célula de carga y a la base del baño de PBS.- Montar construir el tubular en los dispositivos de sujeción (Figura 7B), siguiendo el procedimiento de recolección (sección 2.4).
- Envolver los dispositivos de agarre y las empuñaduras de gasa juntos con cinta de teflón para evitar cualquier deslizamiento de los agarres de gasa durante la prueba.Montar la muestra en el probador micromecánica (Figura 7C).
- Montaje de las construcciones en forma de anillo en el aparato mecánico: dirección circunferencial.
Nota: Realice pruebas de fatiga circunferenciales en muestras en forma de anillo de sección de las construcciones tubulares. Utilice dos barras de acero inoxidable como agarres para fijar las muestras.- Montar construir el tubular en un tubo de plástico como soporte marcado con 5 lagunas mm (Figura 7B), a raíz de la cosecha (sección 2.4).
- Cortar 10 mm anillos de la construcción tubular.
- Medir la longitud de la muestra utilizando un calibrador vernier para los análisis adicionales.
- Montar la pieza en forma de anillo en las barras de acero inoxidable del probador micromecánica (Figura 7C). Asegúrese de colocar la muestra en el centro de las barras.
Nota: El tubo de plástico en el paso 3.4.1 y un sistema de corte como se muestra en la Figura 7B se utilizan para evitar cualquier daño a la construcción durante el corte.
- Prueba de fatiga en construcciones en la dirección longitudinal o circunferencial.
- Estire la construcción de su longitud inicial de calibre.
- Mantener la construcción en esta posición durante 10 minutos en el entorno pseudo-fisiológica.
- Aplicar 10% de deformación cíclica de la longitud de referencia inicial (30 ciclos) para la construcción en el 5% / seg velocidad de deformación.
- Repita el paso 3.5.3 en pasos incrementales de tensión cíclica 10% hasta fracaso de la muestra.
Nota: El uso del medio ambiente pseudo-fisiológica requiere teniendo en cuenta la flotabilidad y la inercia del sistema de sujeción que afecta a la medición de la carga aplicada. - Registre el fondo de la siguiente manera:
- Mueva el bastidor de carga a la longitud inicial de calibre.
- Repetir el 3.5.3 y 3.5.4 sin pasos montado cualquier muestra, y de mantenimiento de los dispositivos de agarre conectados a la célula de carga (sólo 1 ciclo es requirojo).
4. Luminal endotelización de constructos
Nota: Después de seguir el protocolo de recolección (sección 2.4), las construcciones resistan la manipulación para ser montado en el biorreactor de rotación de pared para el ulterior endotelialización.
- Rotación de pared biorreactor Diseño
- Perforar un agujero de diámetro 4,5 mm en el centro de la tapa ventilada del tubo de depósito sin dañar la membrana de filtro que cubre los orificios de aireación.
- Prensa-encaja un mandril (diámetro = 4,5 mm, longitud = 40 mm) en el agujero y fijar el mandril como se describe en el paso 1.1.2.
- Preparar dos soporte de silicona en forma de C para el diámetro externo de construcción = 14 mm; diámetro interno = 8 mm).
- Posicionar un motor que gira en un extremo del biorreactor giratorio de pared y un cojinete en el otro extremo (Figura 8B).
- Lumen endotelización
- Expandir umbílica humanaal vena células endoteliales (HUVEC) en matraces de cultivo de 25 cm 2 con 5 ml de medio de cultivo M199 suplementado con 10% (v / v) PS, 10% (v / v) FBS, 1% (v / v) pen-strep en placa de Petri en el interior de una incubadora (T = 37 ° C, 5% de CO 2, 100% de humedad) hasta 90% de confluencia.
- Preparar 1,5 ml de la solución de revestimiento proteína por constructo requerido para la adhesión celular óptima mediante la dilución de la mezcla de concentrado de proteína a 10,5 ng / ml en medio de cultivo celular endotelial libre de suero.
- Medir la longitud de la construcción utilizando un pie de rey.
- Calcular el volumen luminal V y el área luminal A de la construcción como: V = D en 2 L / 4 y A = D en L respectivamente (donde D es en el diámetro interior correspondiente al diámetro del mandril, y L es la longitud de la construcción).
- Coloque la construcción en el centro de la reserva siguiendo el procedimiento de recolección (sección 2.4).Utilice apoyo de silicona en forma de C para fijar la construcción en ambos extremos para el depósito (Figura 8A).
- Llene el depósito con 35 ml de medio de cultivo.
- Llenar 75% del volumen luminal calculado de la construcción (V) con la solución de recubrimiento de proteína preparada en la etapa 4.2.2. Cierre ambos de los extremos de la construcción para evitar cualquier fuga de la solución de recubrimiento de proteína (Figura 8A).
- Montar el sistema de biorreactor de rotación de pared interior de la campana de cultivo de células.
- Coloque el biorreactor en un 37 ° C incubadora y comenzar la rotación del biorreactor en 4,02 x 10 -5 g de fuerza durante 1 hora para permitir que el revestimiento luminal como se muestra en la Figura 8B.
- Abra la extremidad superior de la construcción y aspirar la solución de recubrimiento de proteína desde el lumen.
- Separar HUVECs (pasaje 2-3) mediante la eliminación del medio de cultivo del matraz de HUVECs y la adición de 3 ml de la solución de tripsina (1x en PBS). YOncubate durante 5 minutos (T = 37 ° C, 5% de CO 2, 100% de humedad).
- Resuspender las HUVECs a una concentración de 4 x 10 6 células / ml en medio de cultivo suplementado M199.
- Dentro de la campana de cultivo de células, semillas de HUVECs en el lumen de la construcción con una densidad de 1.000 células / cm 2 15. Cierre las extremidades superiores de la construcción para evitar cualquier fuga de la solución de HUVECs.
- Incubar las construcciones (T = 37 ° C, 5% de CO 2, 100% de humedad) alojada en el biorreactor de rotación de pared (Figura 8B) y la cultura durante 2 días a una rotación constante de 4,02 x 10 -5 g fuerza.
- Cosecha de la construcción después de 2 días de cultivo en condiciones estériles y prepararlo para su posterior caracterización biológica tal como se describe en la sección 2.4.
Resultados
Este trabajo describe la fabricación de construcciones a base de colágeno tubulares de ingeniería que contienen las células vasculares. Ya después de 1 hr de gelificación temprano, mezcla de células-y-colágeno se montó directamente en una geometría tubular 3D, con el diámetro externo igual al diámetro del molde correspondiente (alrededor de 14 mm). A lo largo de la maduración estática, mediciones revelaron la rápida reducción del diámetro exterior de las estructuras tubulares cellularized, como se muestra en la Tabla 1. El diámetro de los geles de colágeno cellularized encogido de alrededor de 60% de su valor inicial después de 1 día de cultivo estático, y de casi el 85% dentro de los 7 días (Suplementario de video 2). SMC dentro de las construcciones son responsables de la contracción observada y el refuerzo mecánico relacionado, ya que este fenómeno no se produce en los andamios de colágeno no cellularized. Tenga en cuenta que no se aplicó gradiente de cualquier tipo (térmica, bioquímica, mecánica, u otros). La células motricesn compactación resultó en un material con mayor densidad de colágeno que podrían ser manipulado y sometido a solicitaciones mecánicas (Videos Suplementarios 3 y 4).
Para relacionar la remodelación células impulsada a las propiedades mecánicas y viscoelásticas generales, se realizaron ensayos de fatiga en las construcciones (Videos Suplementarios 5 y 6). Estas pruebas consistieron en el ciclismo los constructos (30 veces) en diferentes cepas constantes (10%, 20%, y 30% de la longitud inicial de calibre) y para grabar el estrés como la respuesta de las construcciones a la solicitación mecánica en el tiempo. Los resultados representativos de una construcción se muestran en la Figura 9. El constructo soportó tensiones más altas en la dirección longitudinal (75 kPa) que en la dirección circunferencial (16 kPa) cuando se somete a la misma gama de tensión (30% de deformación). Mientras tanto, en cada ciclo, el valor de pico de estrés alcanzó la tadeformación máxima rgeted disminuyó con el tiempo. Este comportamiento es típico de las altas propiedades viscoelásticas exhibidos por estas construcciones a base de colágeno.
La actividad biológica de los constructos cellularized se evaluó durante la maduración estática. Por lo tanto, la actividad metabólica de las SMC se evaluó midiendo el consumo de glucosa y producción de lactato durante el cultivo estático. El medio de cultivo se tomaron muestras cada 2 días y la glucosa y las concentraciones de lactato se midieron usando un analizador de gases en sangre. El aumento constante en el consumo de glucosa y producción de lactato combinado a la contracción importante de las construcciones, atestiguan la actividad SMCs todo lo largo de cultivo estático (Figura 10).
El aumento de la estabilidad mecánica debido a la remodelación celular impulsada por permitió la manipulación de las construcciones y el proceso de endotelización posterior. Tinción de tricrómico de Masson realizó en las construcciones endotelizadomostró un endotelio altamente homogénea. SMC exhibió una morfología en forma de huso y parecía como dispersa homogéneamente a través de la pared, mientras HUVECs apareció bien difundida en el lado luminal (Figura 11).
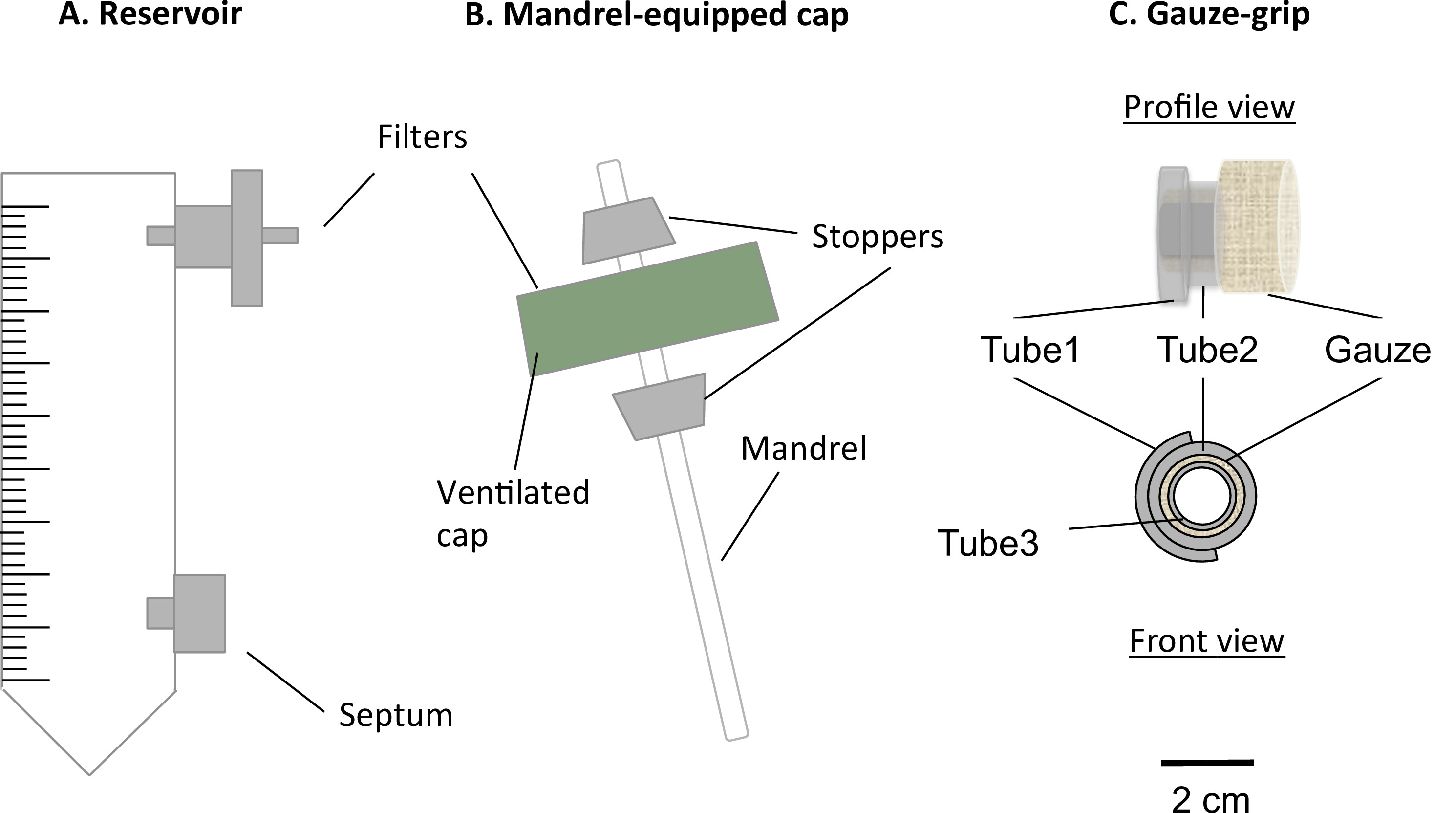
Figura 1:. Los componentes del biorreactor El biorreactor estática estática consistía en un tubo de centrífuga de 50 ml modificado (A) y una tapa de mandril-equipada (B). El tubo sirve como depósito de medio, y estaba equipado con un puerto para un filtro de 0,22 micras, para el intercambio de gas, y un tabique, para la toma de muestras y el cambio de medio. Un mandril presente en la tapa ventilada permite la fabricación de construcciones en forma tubular. La gasa-apretones (C) fueron diseñados y fabricados para apoyar la gelificación de las construcciones sobre el mandril. Por otra parte, estosapretones permitió a los constructos para ser manejados después de la maduración estática y que deben ser fijadas al aparato mecánico. El diámetro externo del mandril era 4,7 mm.
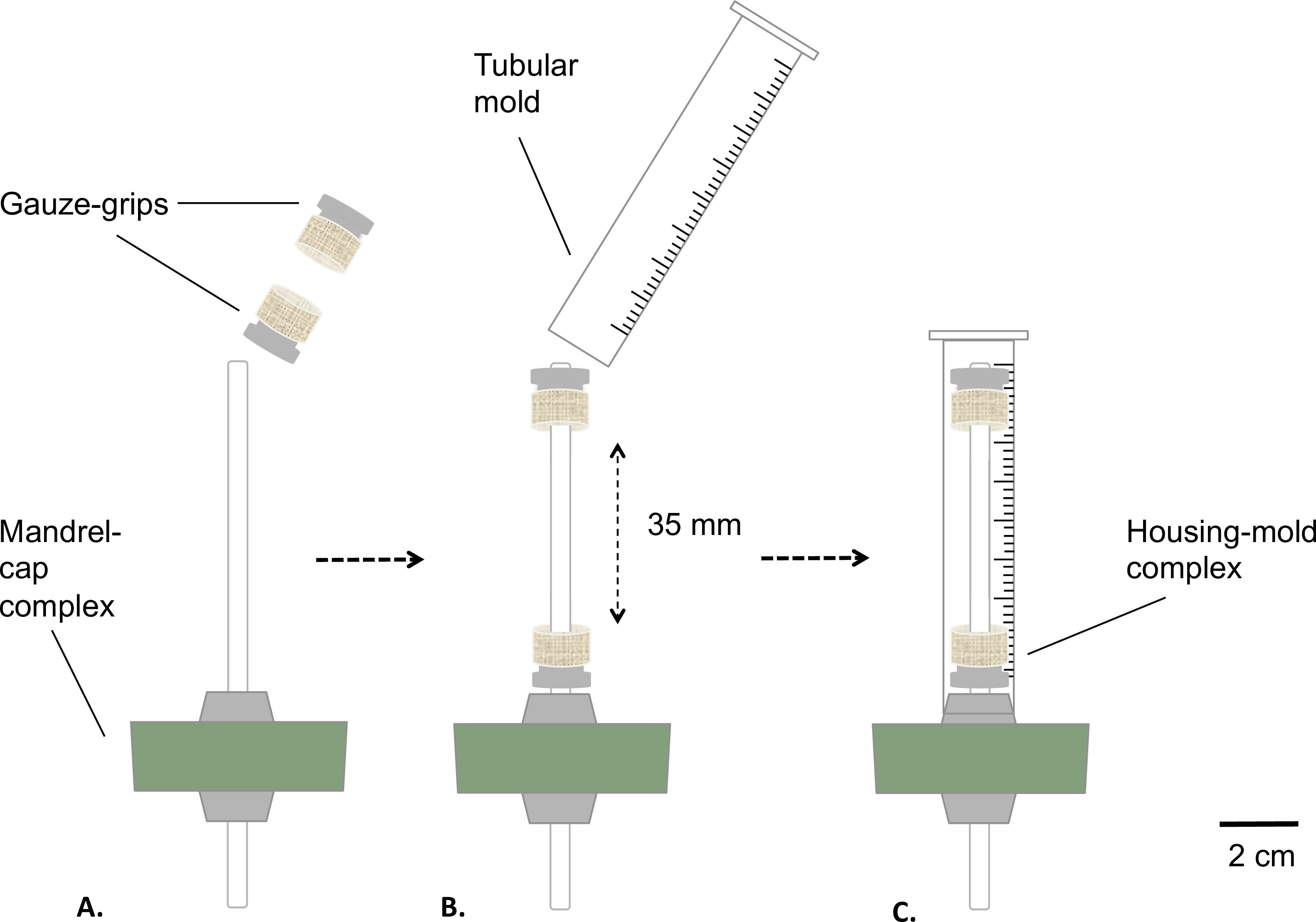
Figura 2: Montaje del biorreactor estática fases de montaje del biorreactor antes de la esterilización.. La gasa-apretones se montaron sobre el mandril (A) a una distancia fija. Se insertó un molde (B) y firmemente fijado al tapón de silicona (C). El diámetro externo del mandril era 4,7 mm.
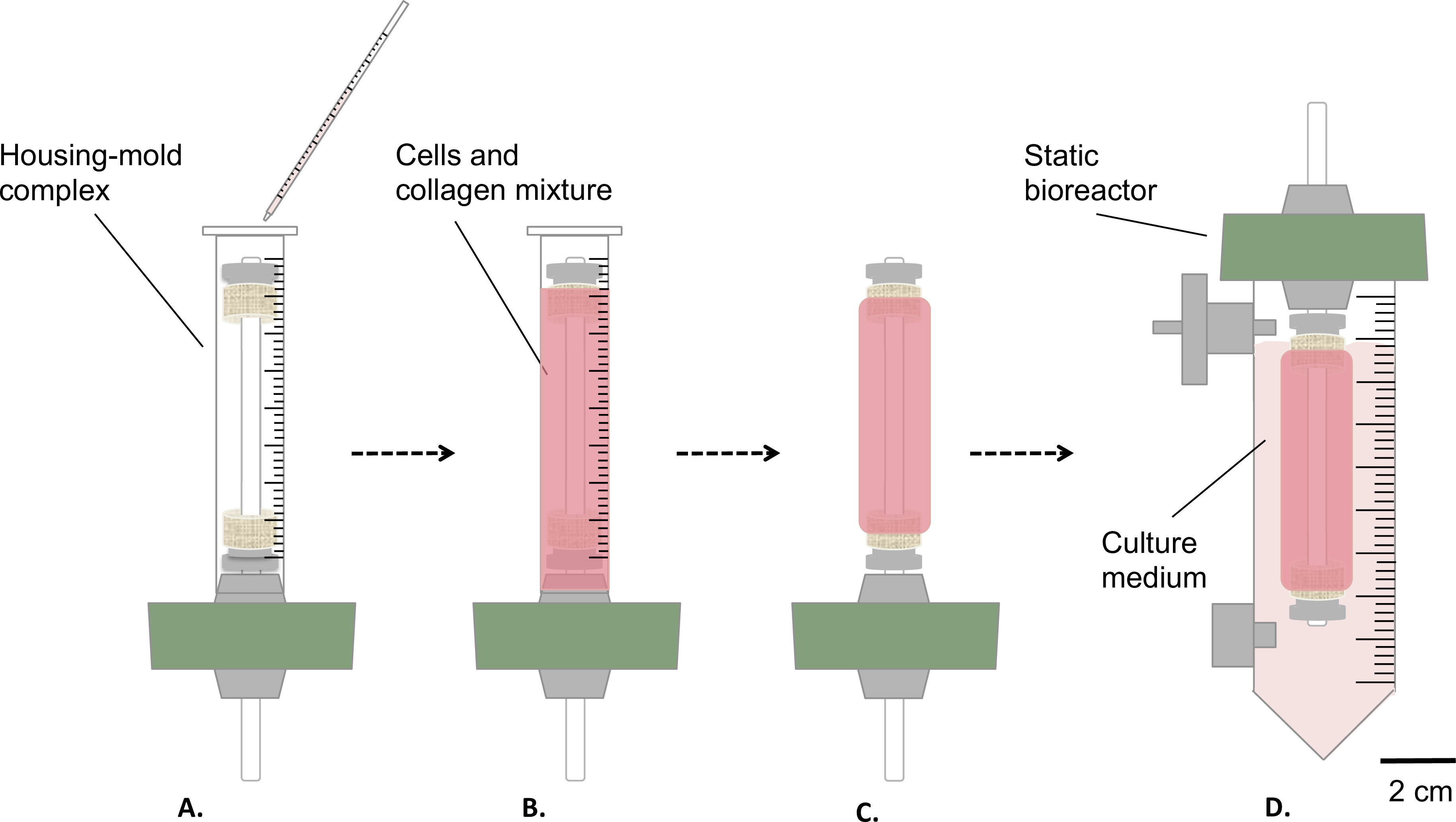
Figura 3:. La fabricación de las construcciones en condiciones estériles La mezcla de células y colágeno se vertió en el complejo de viviendas molde (A), y dejar gel durante 1 hora a temperatura ambiente (B). Posteriormente, se retiró el molde (C), el biorreactor fue montado estática (D) y se transfiere dentro de un depósito para la maduración estática de la construcción en la incubadora (T = 37 ° C, 5% de CO 2, 100% de humedad). El diámetro externo del mandril era 4,7 mm.

Figura 4:. Medición del espesor / diámetro exterior de las construcciones se utilizó un interferómetro de escaneado láser para realizar la medición de los diámetros externos de los constructos. La construcción se coloca en la vía del haz de láser y genera una sombra. La anchura de la sombra, que corresponde al diámetro externo de la construcción, se mide entonces y se visualiza en la pantalla.

Figura 5:. Apariencia morfológica de la construcción cosechado (A) Inmediatamente después de la gelificación y (B) después de la remodelación de las células impulsada durante la maduración estática durante 2 semanas.

Figura 6: Montaje experimental para la caracterización mecánica Consistía en el probador micromecánica equipado con una celda de 5 o 10 N de carga y un baño que contiene PBS a 37 ° C para mantener las muestras en condiciones de pseudo-fisiológica..
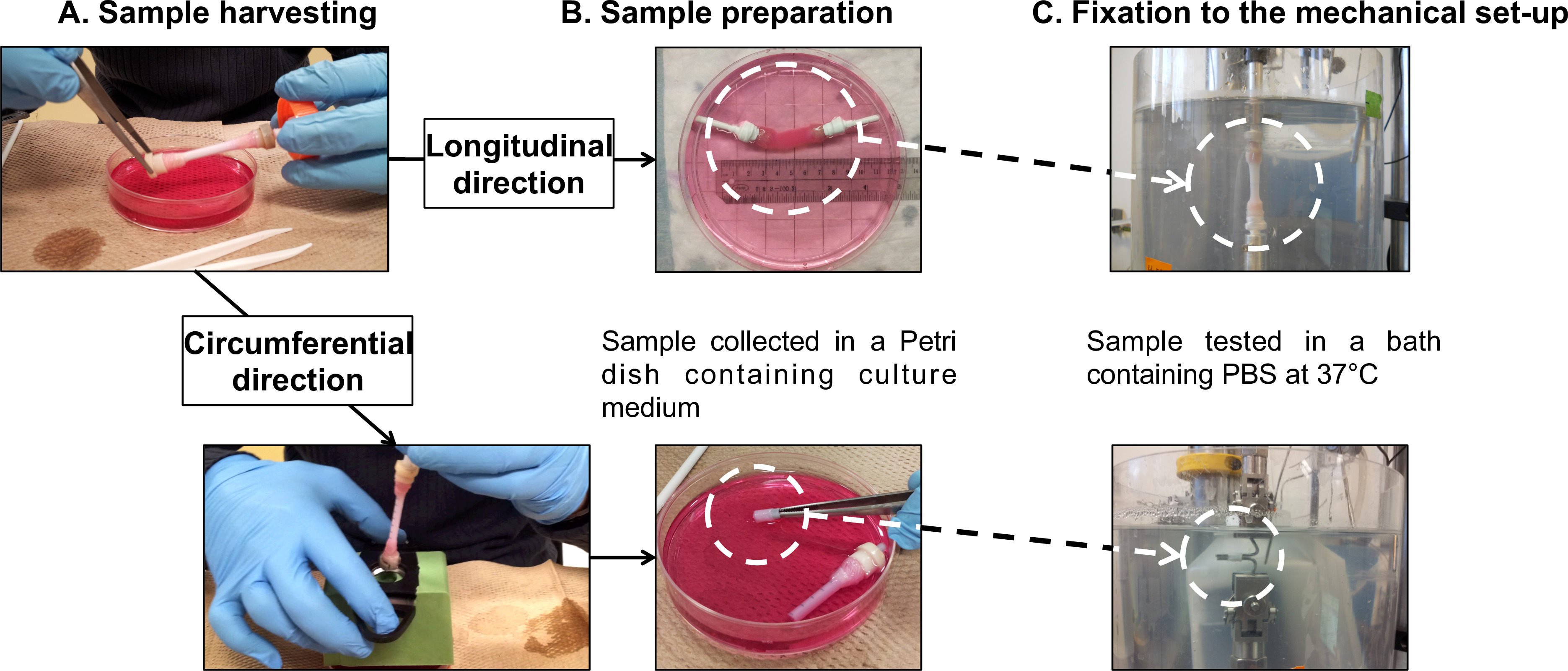
Figura 7: Preparación de muestras f o caracterizaciones mecánicas. recolección de la muestra (A) y la preparación (B) para pruebas de fatiga realizadas en el longitudinal y las direcciones circunferenciales (C). El diámetro externo del mandril era 4,7 mm.
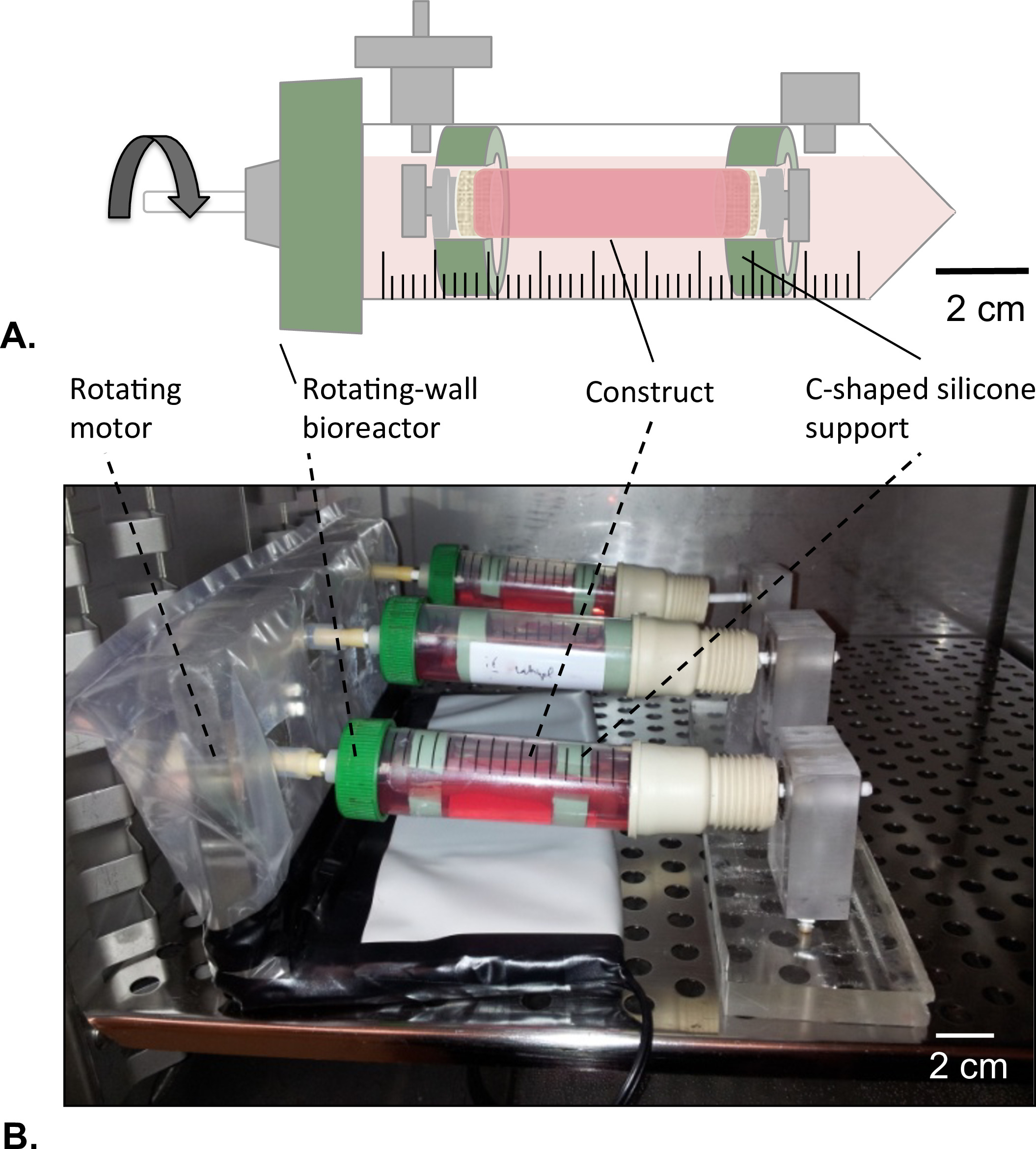
Figura 8: Rotación de pared biorreactor (A) Las construcciones tubulares se ensamblaron en el centro del depósito con la ayuda de apoyo de silicona en forma de c.. Tanto de las extremidades del constructo fueron cerradas para evitar cualquier fuga de la solución de HUVECs. (B) Los constructos se cultivaron en una incubadora (T = 37 ° C, 5% de CO 2, 100% de humedad) en rotación a 4,02 x 10 -5 g de fuerza durante 2 días.
2 / 52812fig9highres.jpg "width =" 700 "/>
Figura 9:.. Caracterizaciones mecánicas Los resultados de las pruebas de fatiga realizadas en construcciones en longitudinal (A) y (B) circunferencial después de la remodelación celular impulsada por favor haga clic aquí para ver una versión más grande de esta figura.
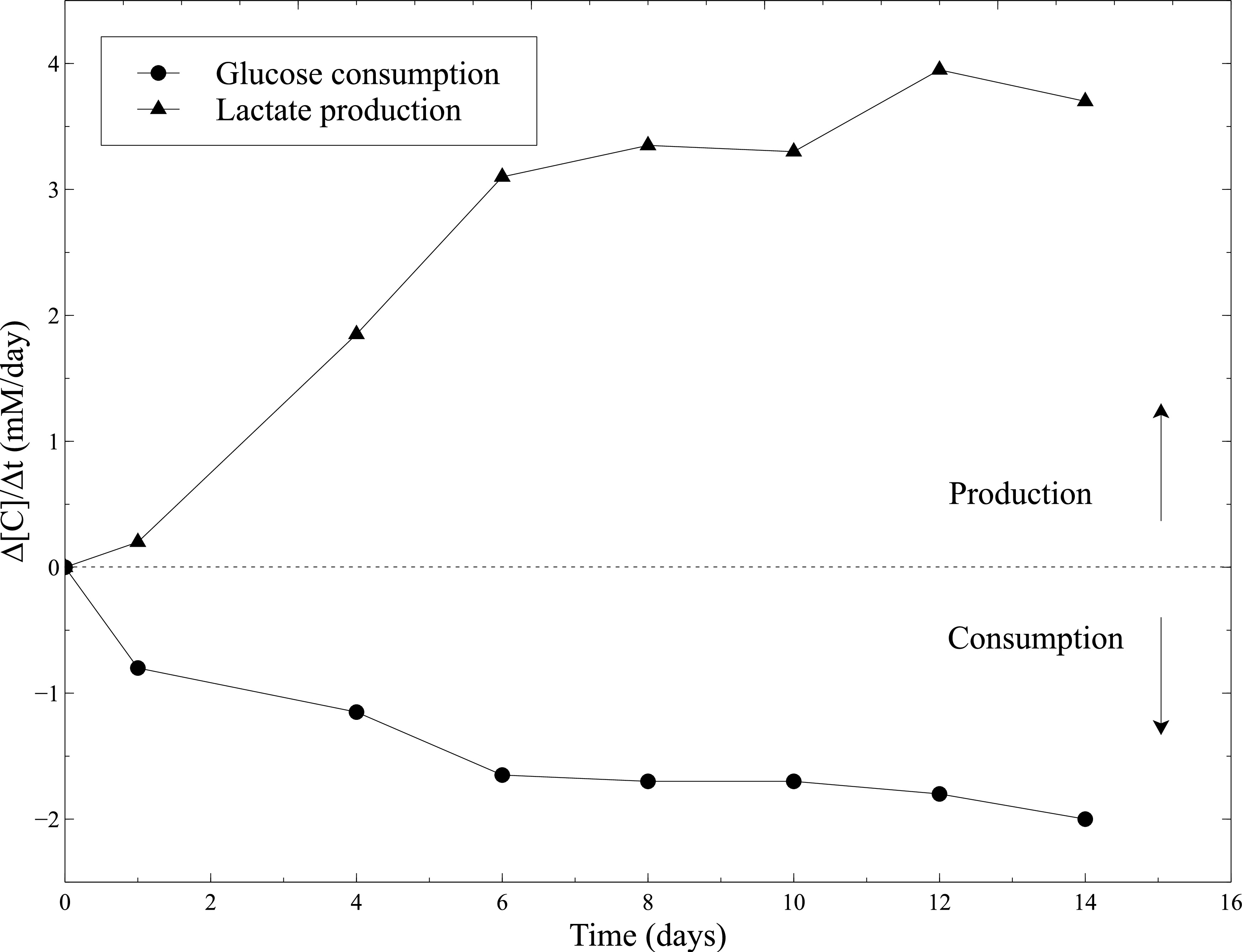
Figura 10:. La actividad metabólica de las SMC dentro de los geles de colágeno Las mediciones de la tasa de consumo de glucosa y la tasa de producción de lactato se realizaron con el analizador de gases en sangre cada 2 días, después de que el medio de cultivo cambiante. Se utilizó medio de cultivo fresco como un nivel de línea de base para las mediciones de las concentraciones de lactato y de glucosa.
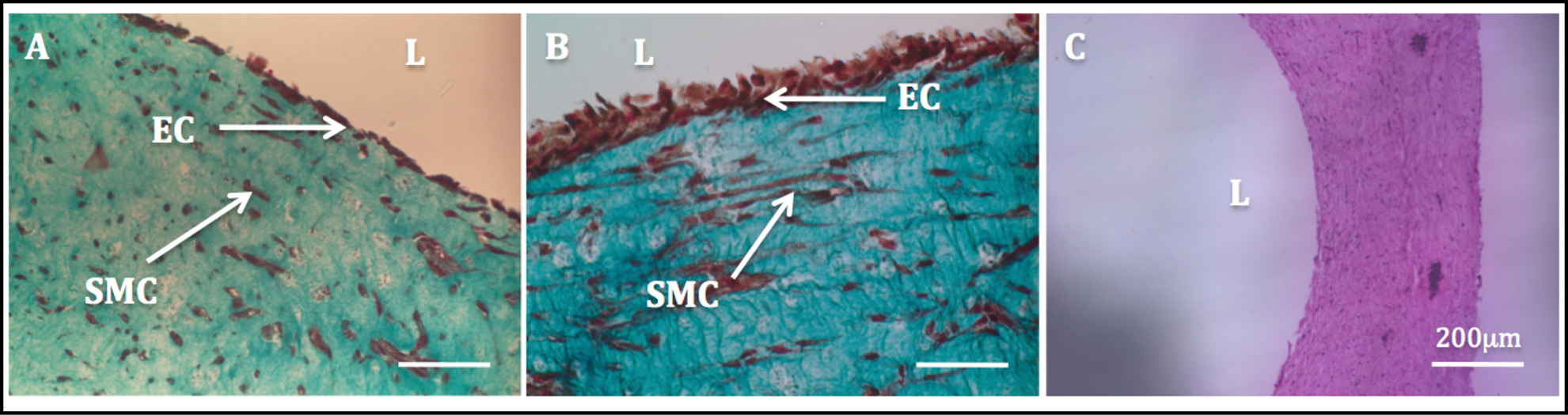
Figura 11: Lumen endotelialización imágenes histológicas de las secciones transversales radiales de construcciones tubulares.. Trichome tinción de Masson de las construcciones tubulares cultivó estáticamente por 1 semana (A) y 2 semanas (B). Tinción H & E de una construcción tubular (C).
| Tiempo | Espesor (mm) | Compactación (%) |
| 0 h | 4.83 ± 0.02 | 0 ± 0 |
| 2 horas | 4.26 ± 0.02 | 12 ± 0 |
| 4 horas | 4,21 ± 0,03 | 13 ± 1 |
| 6 hr | 4.06 ± 0.10 | 16 ± 2 |
| 12 hr | 3.16 ± 0.07 | 35 ± 1 |
| 1 día | 2.08 ± 0.11 | 57 ± 2 |
| 1 semana | 0.68 ± 0.07 | 86 ± 1 |
| 2 semanas | 0,36 ± 0,00 | 93 ± 0 |
Tabla 1: compactación rápida de diámetro constructo durante la maduración estática espesor de pared de las construcciones y la tasa de compactación como una función del tiempo de cultivo estático.. La compactación se midió determinando el diámetro externo de las construcciones tubulares con un interferómetro láser de barrido (Series 183B, LaserMike 136). Después de 24 horas, las construcciones compactadas al 57% ± 2% de sus dimensiones de trazado. Los datos se expresan como media ± desviación estándar (n = 3). La presencia y la actividad de las células del músculo liso de estar era el único responsable de tales cambios importantes.
Supplemental Video 1:. La recolección de los geles no remodelado colágeno tubular Por favor haga clic aquí para ver el vídeo.
Suplementario Video 2:. Las células impulsada compactación de geles de colágeno tubulares Por favor haga clic aquí para ver el vídeo.
Suplementario Video 3:. La manipulación de los geles no remodelado colágeno tubular Por favor haga clic aquí para ver el vídeo.
Suplementario Video 4:. La manipulación de los geles de colágeno tubular células-remodeladas Haga clic aquí para ver ªes video.
Suplementario Vídeo 5:. Ensayo de fatiga Longitudinal (al 30%) en las células-remodeladas geles de colágeno tubular Haga clic aquí para ver el vídeo.
Suplementario vídeo. 6: ensayo de fatiga circunferencial (al 30%) en las células-remodeladas geles de colágeno tubular Haga clic aquí para ver el vídeo.
Discusión
Entre la comunidad de ingenieros de tejido vascular, tremendos esfuerzos se han hecho para reproducir la capa túnica media responsable de la estabilidad mecánica de los vasos sanguíneos 16. Desde el trabajo pionero de Weinberg y Bell 17, colágeno ha sido ampliamente utilizado como un andamio para la ingeniería de tejido vascular debido a sus propiedades de biocompatibilidad, no inmunogénicos y disponibilidad. Sin embargo, el uso de colágeno representa un gran desafío para los investigadores, ya que este material no es fácil de manejar, debido a la falta intrínseca de rigidez mecánica. Manipulaciones durante la preparación de andamios pueden dañar los andamios, comprometiendo para su uso posterior.
La técnica descrita en este trabajo permite: i) para diseñar geles de colágeno cellularized en una geometría de forma tubular; ii) para diseñar tejidos biológicos suficientemente fuerte como para ser manejado después de un corto período de maduración estático (1 o 2 semanas); iii) comopropiedades mecánicas y viscoelásticas ses de tales tejidos biológicos de forma tubular en 2 direcciones. Las células en el gel juegan un papel clave en la remodelación de la matriz de colágeno. Durante el período de maduración, las CML contráctiles llevaron a la compactación de los geles que producen una construcción con una mayor estabilidad mecánica que podrían ser evaluadas en las direcciones longitudinal y circunferencial. Después, HUVECs sembradas en el lado luminal de las construcciones generado por un endotelio homogénea y viable, demostrando así la idoneidad de los geles de colágeno para aplicaciones de ingeniería de tejidos vasculares.
El biorreactor se presenta en este trabajo fue diseñado específicamente para proporcionar un entorno óptimo para el crecimiento celular durante la maduración estática. Además, los dispositivos desarrollados para la caracterización de las propiedades mecánicas y viscoelásticas de los constructos fueron diseñados con el objetivo de reducir cualquier daño potencial inherente a la manipulación detales materiales delicados. Por lo tanto, el biorreactor estática estaba equipado de un filtro de 0,22 micras y una membrana de filtro en la tapa (paso 1.1.2, Figura 1A y B) que permitió el intercambio de gases entre el medio de cultivo en el interior del depósito y la incubadora, mientras se mantiene un entorno de cultivo estéril. El tabique luer en la parte inferior fue utilizado como un puerto para muestreo de medio de cultivo y cambiar durante el cultivo estático. Algunos pasos críticos tienen que ser considerados durante la fabricación de constructo y caracterizaciones. Todas las manipulaciones (realizada en el paso 2.1.1 y en las etapas posteriores), que podrían alterar la esterilidad del sistema se llevaron a cabo en una campana biológica estéril. Las células y el gel de colágeno preparación de la mezcla se manejó en el hielo con el fin de retrasar el proceso de gelificación (pasos 2.1.4 al 2.1.7). En el paso 2.1.7, cualquier-burbujas de aire atrapadas en la mezcla antes de la gelificación son posibles áreas de concentración de esfuerzos que pueden comprometer los srentabilidad de los constructos. Por lo tanto, la eliminación de este tipo de burbujas de aire requiere sacudiendo ligeramente el montaje o el uso de vacío médica durante 3 minutos para desgasificación en condiciones estériles. Finalmente, los agarres fueron diseñados específicamente para mantener el eje del mandril central en el molde tubular durante la gelificación y para permitir la manipulación delicada de las construcciones durante la cosecha (extirpación del mandril, sección 2.4), para la endotelización, y para facilitar el montaje en el sistema mecánico (pruebas longitudinales).
El presente protocolo propone un enfoque alternativo originales fácil de proceso de refuerzo de geles de colágeno construcciones basadas en el potencial inherente contráctil natural de SMC. Las técnicas comunes de las matrices de colágeno de refuerzo implican el uso de agentes de reticulación físicos y químicos que pueden tener efectos deletéreos sobre las interacciones células de matriz de 18-20. La técnica de fabricación presentado eneste trabajo permite dirigir este proceso de remodelación células impulsada para producir una construcción ingeniería de tejidos con propiedades mecánicas específicas sin ningún tratamiento físico o químico.
Caracterización de propiedades mecánicas y viscoelásticas de los geles de colágeno hidratado es un gran desafío. En esta perspectiva, el presente protocolo describe un método simple y eficiente original para evaluar las propiedades mecánicas de los tejidos tubulares blandos. Esta caracterización puede realizarse no sólo en la dirección circunferencial, sino también en la dirección longitudinal, directamente en toda la estructura tubular. Durante la caracterización mecánica, temperatura, entorno acuoso, pH y fuerza iónica son algunos de los factores ambientales que se sabe que afectan drásticamente el comportamiento mecánico de los tejidos biológicos 21. Por lo tanto, el presente trabajo sugiere un original montaje y protocolo para la caracterización mecánica de los tejidos biológicos en un granpseudo-fisiológica reproducible medio ambiente (solución salina a 37 ° C y pH 7,4). A lo mejor de nuestro conocimiento, este tipo de caracterización no se ha informado en otras partes.
En conclusión, la técnica propuesta en este trabajo demuestra el alto potencial de la mezcla directa de las células con el colágeno para aplicaciones de ingeniería de tejidos vasculares. Este método, junto con el proceso de caracterización y la endotelización mecánica constituyen protocolos polivalentes altos. Por lo tanto, a través de ligeras modificaciones de los reglajes y protocolos mientras se mantiene la misma lógica, los principales requisitos para los equivalentes de tejido vascular de ingeniería se pueden abordar como el procesamiento rápido y sin complicaciones, incluyendo endotelialización, y la posibilidad de transponerse a una amplia gama de suave Los tejidos con diferentes longitudes y diámetros. Además, los diferentes tipos de células adherentes, las proteínas ECM y geometrías moldeados pueda ser investigada por un número de applicati dirigidosons, tales como tendones de ingeniería, injertos de piel, parches cardíacos, nervios, entre otros. Aunque las propiedades mecánicas de las construcciones son alentadores, siguen siendo inferiores a los de los tejidos nativos. En este contexto, estamos convencidos de que un período muy corto de maduración estática es un paso crucial hacia la estimulación dinámica en un biorreactor, lo que conduce a una mayor integridad estructural y estabilidad mecánica. Sin embargo, la posibilidad de producir rápidamente cellularized construcciones a base de colágeno ingeniería tisular adecuada para mecánica y análisis histológico hace que el biorreactor estático describe en este documento una herramienta útil y prometedora para dar una idea de la interacción entre las células y ECM durante el crecimiento y remodelación, o incluso para ser utilizado como un modelo para las terapias y los sistemas de administración de fármacos.
Divulgaciones
No se recibió financiación de organizaciones o agencias con un potencial conflicto de intereses.
Agradecimientos
Esta investigación fue financiada por el de Ciencias Naturales e Ingeniería de Investigación de Canadá, el Instituto Canadiense para la Investigación en Salud y el Centro de Investigación CHU de Québec.
Materiales
| Name | Company | Catalog Number | Comments |
| CellTreat 50 ml Bio-Reaction tubes | CELLTREAT Scientific Products | 229-475 | Centrifuge tube |
| Male luer with lock ring x 1/8" hose barb. PP. 25/pk | Cole Parmer | RK-45503-04 | Luer fittings for "gas-exchange port" |
| Female luer x 1/8" hose barb adapter. PP. 25/pk | Cole Parmer | RK-45500-04 | Luer fittings for the "medium sampling port" |
| Masterflex platinum-cured silicone tubing L/S 17. 25 ft. | Cole Parmer | RK-96410-17 | Tube 1 and 2 for the gauze grippers |
| Masterflex platinum-cured silicone tubing L/S 16. 25 ft. | Cole Parmer | RK-96410-16 | Tube 3 for the gauze grippers |
| Silastic Medical adhesive silicone, type A | Dow Corning | - | Silicon glue for the fabrication of the static bioreactor |
| Polyvent 4 Vessel venting filters | Whatman | 6713-0425 | Filter for "gas exchange port" |
| Rod. PP. stirring. 8’’ | Scienceware | 377660008 | Mandrel |
| Stopper silicone rubber 00 PK12 | VWR | 59590-084 | Stopper for the insertion of the mandrel to the vented cap of the centrifuge tube |
| Krytox PFPE/PTFE Greases | Dupont | GPL 202 | Medical grade grease for covering the mandrel |
| Trypsin-EDTA (0.5%) | Gibco | 15400-054 | Cell culture |
| Xiameter RTV-4130-J base and curing agent | Dow Corning | - | C-shaped silicone support for endothelialization |
| Dulbecco’s modified Eagle medium, DMEM, high glucose, pyruvate | Gibco (Life Technology) | 11995-065 | Cell culture |
| Pure acetone (99%) | Laboratoire Mat Inc. | AP0102 | Chemical for collagen extraction |
| Isopropyl alcohol (HPLC grade, 99.9%) | Fisher Scientific | AC610080040 | Chemical for collagen extraction |
| 0.02 N acetic acid (glacial acetic acid, HPLC grade, 99%) | Fisher Scientific | FL070494 | Chemical for collagen extraction |
| Chloroform solution (99%) | Laboratoire Mat Inc. | CR 0179 | Chemical for collagen extraction |
| Hepes | Sigma-Aldrich | 163716 | Chemical for construct preparation |
| NaOH | Laboratoire Mat Inc. | SR-0169 | Chemical for construct preparation |
| LaserMike 136 | LaserMike | Series 183B | Scanning laser interferometer |
| ElectroPulse MicroTester | Instron Corporation | - | Micromechanical Tester |
| HyClone Media M199/EBSS, 500 ml | GE Healthcare Life Sciences | SH30253.01 | Component of cell culture medium |
| Fetal bovine serum HI - 500 ml | Gibco | SH 30396.03 | Component of cell culture medium |
| Porcine serum (PS) | Sigma-Aldrich | P9783 | Component of cell culture medium |
| Penicillin-Streptomicin | Gibco | 15140-122 | Component of cell culture medium |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP661-50 | Saline solution |
| Tissue culture flask T17CN Vent Cap Red | Sarstedt Inc. | 83.1812.002 | Cell culture |
| ColorpHast- pH-indicator strips (pH = 6.5-10.0) | EMD | 9583 | pH measurements |
| Matrigel Basement Membrane Matrix Growth Factor Reduced, 5 ml vial | BD Biosciences - Discovery Labware | 356230 | Concentrate protein mixture for endothelialization process |
| LifeCam VX-3000 | Microsoft | - | Thickness measurement |
| Biochemical analyzer, DxC600 | Beckman Coulter Unicell Synchron | - | Glucose and lactate concentrations measurements |
| Collagen fibers | Rat tails | - | Collagen was extracted in the laboratory |
| Porcine smooth muscle cells (pSMCs) | Porcine aortas | - | pSMCs were isolated in the laboratory |
| Human umbilical vein endothelial cells (HUVECs) | Human umbilical veins | - | HUVECs were isolated in the laboratory |
Referencias
- Kim, B. S., Nikolovski, J., Bonadio, J., Smiley, E., Mooney, D. J. Engineered smooth muscle tissues: regulating cell phenotype with the scaffold. Experimental cell research. 251, 318-328 (1999).
- Heureux, N., McAllister, T. N., de la Fuente, H. L. Tissue-engineered blood vessel for adult arterial revascularization. The New England journal of medicine. 357 (14), 1451-1453 (2007).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Lee, C., Singla, A., Lee, Y. Biomedical applications of collagen. International journal of pharmaceutics. 221 (1-2), 1-22 (2001).
- Couet, F., Rajan, N., Mantovani, D. Macromolecular biomaterials for scaffold-based vascular tissue engineering. Macromolecular bioscience. 7 (5), 701-718 (2007).
- Christiansen, D. L., Huang, E. K., Silver, F. H. Assembly of type I collagen: fusion of fibril subunits and the influence of fibril diameter on mechanical properties. Matrix Biology. 19 (5), 409-420 (2000).
- Eppell, S. J., Smith, B. N., Kahn, H., Ballarini, R. Nano measurements with micro-devices: mechanical properties of hydrated collagen fibrils. Journal of the Royal Society, Interface / the Royal Society. 3 (6), 117-121 (2006).
- Lai, V. K., Lake, S. P., Frey, C. R., Tranquillo, R. T., Barocas, V. H. Mechanical behavior of collagen-fibrin co-gels reflects transition from series to parallel interactions with increasing collagen content. Journal of biomechanical engineering. 134 (1), 011004 (2012).
- Seliktar, D., Nerem, R. M., Galis, Z. S. The Role of Matrix Metalloproteinase-2 in the Remodeling of Cell-Seeded Vascular Constructs Subjected to Cyclic Strain. Annals of Biomedical Engineering. 29 (11), 923-934 (2001).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature protocols. 1 (6), 2753-2758 (2006).
- Kumar, V. A., Caves, J. M., et al. Collagen-Based Substrates with Tunable Strength for Soft Tissue Engineering. Biomaterials science. 1 (11), 1193-1202 (2013).
- Li, S., Van Den Diepstraten, C., D’Souza, S. J., Chan, B. M. C., Pickering, J. G. Vascular smooth muscle cells orchestrate the assembly of type I collagen via alpha2beta1 integrin, RhoA, and fibronectin polymerization. The American journal of pathology. 163 (3), 1045-1056 (2003).
- Badylak, S. F., Freytes, D. O., Gilbert, T. W. Extracellular matrix as a biological scaffold material: Structure and function. Acta biomaterialia. 5 (1), 1-13 (2009).
- Engbers-Buijtenhuijs, P., Buttafoco, L., et al. Biological characterisation of vascular grafts cultured in a bioreactor. Biomaterials. 27 (11), 2390-2397 (2006).
- Cheung, A. L. Isolation and culture of human umbilical vein endothelial cells (HUVEC). Current protocols in microbiology. 4, 4B (2007).
- Seifu, D. G., Purnama, A., Mequanint, K., Mantovani, D. Small-diameter vascular tissue engineering. Nature reviews. Cardiology. , (2013).
- Weinberg, C., Bell, E. A blood vessel model constructed from collagen and cultured vascular cells. Science. 231 (4736), 397-400 (1986).
- Meghezi, S., Chevallier, P., Mantovani, D. Why Mechanical Properties of Collagen Scaffolds Should Be Tested in a Pseudo-Physiological Environment. Advanced Materials Research. 409, 158-163 (2011).
- Tirella, A., Liberto, T., Ahluwalia, A. Riboflavin and collagen: New crosslinking methods to tailor the stiffness of hydrogels. Materials Letters. 74, 58-61 (2012).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. Journal of biomedical materials research. Part A. , 16-26 (2011).
- Meghezi, S., Couet, F., Chevallier, P., Mantovani, D. Effects of a pseudophysiological environment on the elastic and viscoelastic properties of collagen gels. International journal of biomaterials. 2012, 319290 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados