Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ortotópico Implantación y Seguimiento de la célula inmune periférica en el modelo II-45 Singénico Rata Mesotelioma
En este artículo
Resumen
Se presenta la generación de un modelo de rata ortotópico de mesotelioma maligno pleural mediante la implantación de II-45 células de mesotelioma en la cavidad pleural de ratas inmunocompetentes. Un método de citometría de flujo para analizar siete subconjuntos de células inmunes en estos animales de una muestra de sangre 25 l también se describe.
Resumen
El enorme aumento del interés en los tratamientos de base inmunológica para el cáncer, tales como vacunas e inhibidores de punto de control inmunológico, y un mayor entendimiento del papel del microentorno del tumor en la respuesta al tratamiento, en conjunto apuntan a la necesidad de modelos ortotópico inmuno-competentes para las pruebas preclínicas de estas nuevas terapias. En este trabajo se muestra cómo establecer un modelo de rata inmune competente ortotópico de mesotelioma maligno pleural. Progresión de la enfermedad de Monitoreo en modelos ortotópico es confundida por la ubicación interna de los tumores. Para supervisar longitudinalmente progresión de la enfermedad y su efecto sobre células inmunes circulantes en este y otros modelos de rata de cáncer, el flujo de un solo tubo ensayo de citometría de que requiere sólo 25 l de sangre completa se describe. Esto proporciona la cuantificación exacta de los siete parámetros inmunológicos: linfocitos totales, monocitos y neutrófilos, así como los subconjuntos de células T CD4 y CD8, células B y células asesinas naturales. Diferentes subsets de estos parámetros son útiles en diferentes circunstancias y modelos, con el neutrófilo a la proporción de linfocitos que tiene la mayor utilidad para el seguimiento de progresión de la enfermedad en el modelo de mesotelioma. Analizando los niveles circulantes de células inmunes que utilizan este método solo tubo también puede ayudar en el seguimiento de la respuesta a los tratamientos de base inmunológica y la comprensión de los mecanismos subyacentes que conducen al éxito o fracaso de un tratamiento.
Introducción
El mesotelioma maligno (MM) es una neoplasia agresiva que surge de las células transformadas en la membrana (mesotelio) que recubre el pulmón y la cavidad abdominal, el corazón y los órganos reproductivos internos, y es el tumor primario más frecuente de la cavidad pulmonar o la pleura 1,2 . La exposición a las fibras de amianto representa el 80% del total de MM, y si bien la prohibición de uso del amianto se introdujeron hace décadas en la mayoría de los países occidentales, su uso generalizado en la comunidad ha dejado un legado mortal. La Organización Mundial de la Salud ha estimado que 107.000 personas en el mundo mueren cada año por enfermedades relacionadas con el amianto, con tasas de mortalidad siguen aumentando. Una nueva ola de incidencia no ocupacional también está emergiendo y hay poca comprensión de cuándo, y en qué nivel esta llegará a su máximo 3.
La mayoría de las personas con MM son diagnosticados tarde cuando la quimioterapia sistémica representa una de las únicas opciones viables 4. Las mayoría de effective la quimioterapia y la corriente 'estándar de atención' (pemetrexed junto con cisplatino 5) fue identificado hace más de 10 años. Sin embargo el fracaso de este tratamiento es inevitable y no hay opciones de segunda línea probadas, dejando los pacientes con un pronóstico sombrío y la supervivencia media de sólo 12 meses 2. Por lo tanto, existe una necesidad no satisfecha urgente de tratamientos más eficaces. A pesar del examen de una serie de nuevos tratamientos en ensayos clínicos no se ha traducido en cambios en la práctica. Esto es debido en parte a la baja (5%) transferencia de resultados pre-clínicos, generalmente realizado en modelos de xenoinjerto de ratón, al ajuste de la clínica 6-8. Tales modelos no recapitulan fielmente los complejos aspectos de la microambiente tumoral se producen en lugares no fisiológicas, con frecuencia en la ausencia de un funcionamiento del sistema inmunológico 9.
Modelos ortotópico singeneicos crean un ambiente del tumor significativamente más realista que el commonly utilizado modelos de xenoinjerto subcutáneos como se producen los tumores en el lugar fisiológica correcta con un 10,11 intacta sistema inmunológico. El mayor tamaño de la rata aumenta su uso como modelo de la enfermedad de roedores, especialmente en los estudios de la droga donde la sangre dibuja serie se requieren para evaluar la respuesta al tratamiento y la toxicidad 12. Además, en modelos en los que el seguimiento de la progresión de la enfermedad es difícil debido a la ubicación de los tumores (como en la cavidad pleural), la capacidad de monitorear progresión de la enfermedad utilizando factores que se encuentran en la circulación es extremadamente atractivo. Se describe la generación de un modelo ortotópico singénico de mesotelioma pleural usando ratas inmuno-competentes. Además, también se describe un método fácil y relativamente no invasivo para el seguimiento de progresión de la enfermedad pleural mediante la medición de las células inmunes circulantes.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los procedimientos con animales se llevaron a cabo de acuerdo con las recomendaciones del Código Australiano de Prácticas para el Cuidado y Uso de animales con fines científicos. El protocolo de este estudio fue aprobado por el Comité de Cuidado de Animales y el Hospital Royal North Shore de Ética. Mujer ratas Fischer 344 (F344, 150-200 g) se mantuvieron en el Centro de Kearns, Kolling Instituto en condiciones estándar (12 horas de luz / oscuridad ciclos y el libre acceso a los alimentos y el agua).
Nota: Un diagrama de flujo para todos los procedimientos experimentales se presenta en la Figura 1.
1. Preparación de las células para la implantación
- Cultura del mesotelioma rata II-45 línea celular (también conocido como IL-45; obtenidas por introducción peritoneal del amianto crocidolita) en medio RPMI 1640 (RPMI) suplementado con suero bovino al 10% fetal (FBS) y crecer en condiciones estándar (37 ° C incubador humidificado con 5% de CO 2). Maintaen por pases y sub-cultivo aproximadamente a las 01:50 dos veces por semana en un matraz de 75 cm2.
- Preparar reactivos para cultivo celular y alícuotas caliente a 37 ° C. Reactivos requeridos incluyen medios RPMI sin suero (SFM), RPMI con 10% FBS, solución salina tamponada con fosfato (PBS) y 0,5% de tripsina-EDTA.
- Células de cultivo para la implantación de aproximadamente el 70-80% de confluencia. Esto asegura que están en la fase de crecimiento lineal.
- Células Cosecha descartando los medios de comunicación, de lavar una vez con 5 ml de PBS estéril y después añadiendo 3 ml de 0,5% de tripsina-EDTA.
- Matraces Volver a la incubadora durante aproximadamente 5 min hasta que todas las células se vuelven no adherente.
- Una vez que las células son no adherente, añadir 3 ml de RPMI con 10% de FBS para inactivar la tripsina. Recoger y centrifugar las células a 300 xg durante 3 min.
- Lavar el sedimento celular en 10 ml de SFM y se centrifuga de nuevo a 300 xg durante 3 min.
- Pellet de células de lavado de nuevo con 10 ml de SFM y centrifugar como anteriormente.
- Resuspender las células en 10 ml de SFM y realizar un recuento de células usando un hemocitómetro o instrumentación similar.
- Diluir las células de manera que 100 l contiene la cantidad de células para ser implantado.
Nota: El crecimiento del tumor se ha demostrado en una dosis tan baja como 100 células en 100 l pero una dosis estándar es de 500.000 células en 100 l. - Preparar suficientes células en medios para el número de ratas para ser implantado (es decir, 100 l / rata), además de al menos 0,5 ml extra para compensar las pérdidas de imprimación y el volumen muerto de la aguja.
- Preparar suficiente SFM (sin células) para ser implantado en ratas de control (es decir, 100 l / rata), además de al menos 0,5 ml adicional.
Nota: Las células y SFM están ya listos para su implantación. Deben mantenerse a 37 ° C y se implantaron dentro de 2 horas de la cosecha para mantener la viabilidad.
2. In vivo implantación de células
- Coloque la rata F344 (> 13 semanas de edad) en la cámara de inducción y anestesiar utilizando 1,4% inhalación isoflurano (o el método en uso en la instalación). Una vez que la rata parece ser movida dormidos desde la cámara a un cono de la nariz (con 1,4% de isoflurano fluye), colocarla en su espalda con el pecho hacia arriba (vista ventral). Esto permite que los órganos internos se asienten fuera de la cavidad torácica. Compruebe reflejos de acuerdo con los protocolos institucionales para asegurar la rata está totalmente anestesiado.
- Afeitarse el área derecha costalis regio (pecho) para quitar la piel.
- Limpie la zona afeitada con un 80% v / v de etanol.
- Identificar el lugar de la inyección: en el lado derecho, busque la segunda glándula partir craneal. El sitio de inyección es de 0,5 cm proximal a este, entre la tercera y la cuarta costilla desde el extremo caudal de la caja torácica. (Figura 2A).
- Mezclar suavemente las células II-45 para volver a suspender. Lentamente dibujar la suspensión celular (o SFM para el control de ratas) en un 1 ml y# 160; jeringa sin aguja. Si una aguja se adjunta para la elaboración de células existe el potencial para que las células crecen a lo largo de la línea de inyección de la aguja. Adjunte una 23G x 1¼ aguja. Primer de la aguja y eliminar cualquier burbuja de aire.
- Una vez que la jeringa y la aguja se cebaron, coloque a 20 mm de largo y 5 mm de diámetro espaciador sobre el eje de la aguja. Esto se utiliza para evitar que la aguja penetre demasiado profundamente en la cavidad pleural durante la inyección. Aproximadamente 5 mm-12 mm de aguja expuesta es suficiente para la penetración a través de las costillas sin dañar cualquier órgano.
- Lentamente inserte la aguja entre las costillas, retroceder en la jeringa para asegurar un vaso sanguíneo no ha sido perforado (sin sangre debe aparecer en la jeringa) y luego inyectar 100 células mu l o SFM. (Figura 2B).
- Retire la aguja y rodar suavemente la rata de lado a lado para difundir las células en la cavidad torácica.
- Coloque la rata en una jaula y compruebe si hay recuperación. The rata debe estar despierto dentro de 1 min y empezar a moverse.
- Repita el procedimiento para cada rata utilizando una aguja nueva. La reutilización de la misma aguja resultará en el crecimiento celular a lo largo de la línea de inyección de la aguja.
- Supervisar el bienestar de los animales diariamente.
- La eutanasia a los animales en los criterios de valoración ética definidos como gobernado por el comité de ética animal institucional. Los criterios de valoración éticos para las ratas en estos experimentos eran la pérdida de peso de más de 10% o dificultad para respirar.
3. cola vena extracción de sangre
- Si la sangre se debe desechar inmediatamente la implantación de células post, mantener la rata anestesiada. Si el muestreo de sangre en otro punto del tiempo, anestesiar la rata utilizando 1,4% de inhalación de isoflurano. Compruebe reflejos de acuerdo con los protocolos institucionales para asegurar la rata está totalmente anestesiado.
- Coloque la rata sobre su lado y localizar una vena lateral de la cola.
- Esterilizar la cola con etanol al 80% y la etiqueta de un 0,5 ml de EDTA ctubo ollection.
- Para recoger la sangre, siempre comienzan en el extremo caudal de la cola (aproximadamente un tercio del camino a lo largo). Esto permite que nuevos intentos más cerca del extremo craneal de la cola en caso de que el primer intento no tiene éxito. Nunca volver a muestrear caudal ya que esto puede causar un coágulo de sangre.
- Coloque una 23G x 1¼ aguja paralela a la vena lateral y deslícela en la vena con un ángulo pequeño por lo que penetra aproximadamente 10 mm (Figura 3A).
- Nota: Si la vena se ha perforado con éxito la sangre será visible en el extremo de fijación de la aguja (Figura 3B).
- Una gota de sangre se forma en la cola en el sitio de la punción de la aguja. Recoge esta sangre con una pipeta y transferencia a los marcados 0,5 ml (o menor) tubo de recogida de EDTA. Para el ensayo de células inmunes 25 l es suficiente. Aplicar una gasa con la presión para perforar sitio hasta que deje de sangrar.
- Flick el tubo de sangre para mezclar la sangre y EDTA a PRcoagulación evento. Mantener el tiempo entre la recogida de sangre y la mezcla con el EDTA lo más corto posible para evitar la coagulación.
- Cuando la recogida de sangre a partir de múltiples ratas almacenar muestras de sangre con EDTA en un bastidor a TA hasta el análisis. Sangre Proceso dentro de 2 horas de la recolección.
4. Preparación de muestras para Inmune Profiling celular utilizando el método basado en la gota
Nota: Este método se basa en la plataforma de un solo uso de tubos de conteo absolutos disponibles comercialmente que tienen un número conocido de los granos para cada muestra. Estos tubos contienen gránulos liofilizados que se disuelven durante la preparación de la muestra, la liberación de las cuentas. Las perlas se marcaron fluorescentemente y por gating en la población de perlas, los recuentos absolutos se pueden calcular.
- Asegúrese de que la muestra de sangre entera EDTA se mezcla bien colocándolo en un mezclador rotatorio lento durante varios minutos. Etiquetar un tubo de recuento absoluto para cada muestra. Un sedimento que contenía las perlas debe ser visible debajo tél portador del talón de metal en la parte inferior del tubo.
- Transferir 25 l de EDTA sangre entera en un tubo de recuento absoluto etiquetado. El sedimento de perlas se disolverá después de la adición de la sangre.
- A cada tubo se añaden 20 l de anti-rata cóctel / B / Killer celular (NK) natural T, 10 l de anti-rata CD8a PE, 10 l de anti-rata CD4 (dominio 1) FITC y 10 l de anti-rata CD45 PE / Cy7 (Figura 4A). Los fluoróforos se definen en la Tabla 1.
- Centrifugar brevemente el tubo (300 xg) para asegurar que los anticuerpos y las células están en la parte inferior del tubo y no pegados a la pared del tubo. Vortex para mezclar e incubar durante 15 min a TA.
- Para lisar las células rojas de la sangre añaden 400 l de Tris 10 mM, 0,15 M tampón de cloruro de amonio (pH 7,5) y agitar para mezclar. La lisis se completa cuando la muestra aparece translúcida y no turbia (figuras 4B y C). La falta de lisar la muestra completamente conducirá a aumentard fondo y falsamente elevados recuentos al analizar por citometría de flujo.
5. citometría de flujo de Procesamiento de Muestras
Nota: Realice un color 4 citómetro de flujo.
- Abra el software en modo de adquisición y una nueva plantilla con 8 parcelas como se muestra en la Figura 5.
- Ajustar la configuración de instrumentos de los que se enumeran en la Tabla 1 y configurar la puerta R1 (FITC [FL-1] frente APC [FL-4]), Figura 5ai) para contar las perlas fluorescentes. Las otras puertas no son tan importantes en esta etapa de adquisición, pero serán requeridos para el análisis. Los contar bolas absolutos utilizados en este protocolo contienen tintes fluorescentes y pueden detectarse en cualquier canal, aunque son más débiles en el canal azul.
- Utilizando una muestra de sangre de control preparado, vórtice y luego cargar en el citómetro y correr a una velocidad baja (12 l / min) en el modo de configuración de modo puertas de adquisición de datos se pueden ajustar.
- Establezca la adquisición derecolectar 10.000 eventos en la puerta del grano R1.
- Configurar una carpeta para grabar los datos y establecer el número de expediente y archivo de ejemplo de etiqueta en el menú de adquisición.
- Cargue la muestra a analizar en el citómetro y establecer el caudal medio (35 l / min). Ejecutar cada muestra a la misma velocidad de flujo. Puede necesitar la velocidad de flujo a ser variada para bajo (12 l / min) o alta (60 l / min), pero es generalmente medio apropiado. A este ritmo que se necesita aproximadamente el 90 a 120 seg para adquirir 10.000 eventos de cuentas para cada muestra.
- Una vez que la muestra se carga mirar los gráficos de dispersión para hacer eventos estén apareciendo en la puerta del grano R1. Inicialmente puede haber cierta inestabilidad en la presión de la muestra causando la deriva en los gráficos de dispersión. Espere a que esta se estabilice.
- Una vez estabilizado, haga clic en adquirir y permitir la muestra se ejecute. Una vez que el citómetro ha finalizado la adquisición de 10.000 eventos de cuentas en R1 el citómetro dejará de adquirir y guardar todos los datos.
- Retire la muestra y descartar fluir tuser. El citómetro está ahora listo para la siguiente muestra. Ejecutar todas las muestras y luego proceder a modo de análisis.
6. Análisis de la célula inmune
Nota: las estrategias de apertura de puerta y álgebra de Boole se utilizan para definir cada población celular. Álgebra de Boole es un método de análisis de la lógica basada que permite múltiples operaciones en una sola definición. El software de análisis de flujo el citómetro (por ejemplo, BD CELLQuest) permite el uso del álgebra booleana. Las ecuaciones se utilizan para tener en cuenta de forma activa para la reactividad negativa significativa que ayuda en la definición de la célula para identificar más específicamente cada población celular. "Regiones" se utilizan para definir una 'puerta'. Regiones definen un espacio de dimensión 2, mientras que las puertas pueden estar compuestas de numerosas regiones conectadas por los operadores algebraicas (+, *, -, definida en la Tabla 2).
- Cambiar el software a modo de análisis. Una plantilla de análisis debe ser generado para que coincida Figura 5 con las parcelas y las puertas que se muestran.
- Analizar cada archivo individual (es decir, cada muestra individual) por separado. Configure puertas R1 a través de R9 y luego configurar los algoritmos para cada tipo de células como se define en la Tabla 2 (también se muestra en la Figura 5).
- Utilice el contador de estadísticas de células para calcular las poblaciones de células individuales definidos por puertas y algoritmos (Tabla 2 y Figura 5). Los algoritmos se ajustará automáticamente el número de células en el contador de estadísticas de células.
- Calcular subconjuntos de células usando la siguiente ecuación:
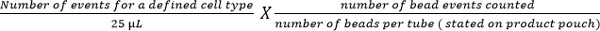
Nota: El número de eventos celulares contados (por ejemplo, eventos de células T CD4) se enumeran utilizando la ecuación anterior para dar el número de células por microlitro de sangre. Los ejemplos se muestran en la Figura 5.
Access restricted. Please log in or start a trial to view this content.
Resultados
El método utilizado en este documento para la generación de un modelo ortotópico del mesotelioma pleural utilizando células II-45 dio como resultado en los animales sucumben a mesotelioma en un plazo de tiempo reproducible y rápido, sin ratas morir debido al método de implantación. La titulación del número de células implantadas determinó que 1x 10 3 células fue el número mínimo requerido para un modelo completamente penetrante (100% engraftment). El distinto número de células implantadas en l...
Access restricted. Please log in or start a trial to view this content.
Discusión
Este documento detalla un método para la generación de un modelo ortotópico singénico de rata de mesotelioma pleural y un método simple para el seguimiento de la progresión de la enfermedad a través de muestreo de sangre longitudinal.
El modelo II-45 fue desarrollado mediante la exposición de ratas Fischer 344 a fibras de amianto 13. Aunque esta exposición representa la verdadera dinámica de las interacciones del sistema huésped-asbesto inmunológico para la patogénesi...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The syngeneic rat mesothelioma II-45 cell line was a kind gift from A/Prof. Emanuela Felley-Bosco, Zurich University.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| EDTA Collection tube (0.5 ml) | Greiner Bio One GmbH | 450480 | |
| Rat T/B/NK Cell cocktail | BD Pharmingen | 558509 | anti-Rat CD3 APC (IgM clone 1F4), anti-Rat CD45RA Fitc (IgG1 clone OX-33), anti-Rat CD161a PE (IgG1 Clone 10/78) |
| anti-RAT CD8a PE | Biolegend | 200608 | (IgG1vClone G28) |
| anti-Rat CD4 FITC (Domain 1) | Biolegend | 203406 | (IgG1 Clone OX-38) |
| anti-Rat CD45 PE/Cy7 | Biolegend | 202214 | (IgG1 Clone OX-1) |
| TruCount Tubes | Becton Dickinson | 340334 | Box of 50 absolute counting tubes |
| RPMI 1640 media | Life Technologies | 11875-119 | |
| foetal bovine serum (FBS) | Scientifix | FBS500-S (lot# 010101-1) | |
| trypsin-EDTA | Life Technologies | 15400-054 | |
| PBS tablets | Medicago AB | 09-9400-100 | |
| 23Gx1¼ Needle | Becton Dickinson | 302008 | |
| 1 ml Syringe | Becton Dickinson | 302 100 | |
| Fischer 344 Rat | Animal Resources Centre, Perth Australia | F344 | |
| I.S.O (Isoflurane USP) | Veterinary Companys Australia (VCA) | B7058 | |
| II-45 Rat Mesothelioma line | Zurich University | Note: The cell line was given as a gift and is not commercially available at the ATCC | |
| FACSCalibur 4 color | Becton Dickinson | 342975 | |
| TRIS-HCL | SIGMA | T3253 | |
| Ammonium Chloride | SIGMA | 9718 | |
| Anaesthetic Machine (The stinger) | Advanced Anaesthesia specialists | #00449 |
Referencias
- Kao, S. C., et al. Malignant mesothelioma. Intern Med J. 40 (11), 742-7450 (2010).
- Zucali, P. A., et al. Advances in the biology of malignant pleural mesothelioma. Cancer Treat Rev. 37 (7), 543-558 (2011).
- Olsen, N. J., et al. Increasing incidence of malignant mesothelioma after exposure to asbestos during home maintenance and renovation. Med J Aust. 195 (5), 271-274 (2011).
- Zucali, P. A., et al. Thymidylate synthase and excision repair cross-complementing group-1 as predictors of responsiveness in mesothelioma patients treated with pemetrexed/carboplatin. Clin Cancer Res. 17 (8), 2581-2590 (2011).
- Vogelzang, N. J., et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol. 21 (14), 2636-2644 (2003).
- Lowenstein, P. R., Castro, M. G. Uncertainty in the translation of preclinical experiments to clinical trials. Why do most phase III clinical trials fail? Curr Gene Ther. 9 (5), 368-374 (2009).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Yakisich, J. S. An Algorithm for the Preclinical Screening of Anticancer Drugs Effective against Brain Tumors. ISRN Pharmacol. 2012, 513580(2012).
- Basu, D., Herlyn, M. Defining microenvironments within mouse models that enhance tumor aggressiveness. Cancer Biol Ther. 8 (4), 380-381 (2009).
- Abolhassani, M., et al. Screening of well-established drugs targeting cancer metabolism: reproducibility of the efficacy of a highly effective drug combination in mice. Invest New Drugs. 4 (4), 1331-1342 (2011).
- Hudson, A. L., et al. Establishing a panel of chemo-resistant mesothelioma models for investigating chemo-resistance and identifying new treatments for mesothelioma. Sci Rep. 4, 6152(2014).
- Iannaccone, P. M., Jacob, H. J. Rats! Dis Model Mech. 2 (5-6), 206-210 (2009).
- Craighead, J. E., et al. Characteristics of tumors and tumor cells cultured from experimental asbestos-induced mesotheliomas in rats. Am J Pathol. 129 (3), 448-462 (1987).
- Hunter, S. D., et al. Lymphocyte subset analysis by Boolean algebra: a phenotypic approach using a cocktail of 5 antibodies and 3 color immunofluorescence. Cytometry. 15 (3), 258-266 (1994).
- Brando, B., et al. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42 (6), 327-346 (2000).
- Schnizlein-Bick, C. T., et al. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Clin Diagn Lab Immunol. 7 (3), 336-343 (2000).
- Gajkowska, A., et al. Flow cytometric enumeration of CD34+ hematopoietic stem and progenitor cells in leukapheresis product and bone marrow for clinical transplantation: a comparison of three methods. Folia Histochem Cytobiol. 44 (1), 53-60 (2006).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Kao, S. C., et al. High blood neutrophil-to-lymphocyte ratio is an indicator of poor prognosis in malignant mesothelioma patients undergoing systemic therapy. Clin Cancer Res. 16 (23), 5805-5813 (2010).
- Kao, S. C., et al. Validation of prognostic factors in malignant pleural mesothelioma: a retrospective analysis of data from patients seeking compensation from the New South Wales dust diseases board. Clin Lung Cancer. 14 (1), 70-77 (2013).
- Burt, B. M., et al. Circulating and tumor-infiltrating myeloid cells predict survival in human pleural mesothelioma. Cancer. 117 (22), 5234-5244 (2011).
- Weir, C., et al. Streptavidin: a novel immunostimulant for the selection and delivery of autologous and syngeneic tumor vaccines. Cancer Immunol Res. 2 (5), 469-479 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados