Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Photopatterning proteínas y células en el medio ambiente acuoso Usando TiO
En este artículo
Resumen
We describe a protocol for modifying cell affinity of a scaffold surface in aqueous environment. The method takes advantage of titanium dioxide photocatalysis to decompose organic film in the photo-irradiated region. We show that it can be used to create microdomains of scaffolding proteins, both ex situ and in situ.
Resumen
Los contaminantes orgánicos adsorbidos en la superficie de dióxido de titanio (TiO 2) se pueden descomponer mediante fotocatálisis bajo radiación ultravioleta (UV). Aquí se describe un nuevo protocolo que emplea la fotocatálisis TiO2 para alterar localmente afinidad de células de la superficie del sustrato. Para este experimento, una delgada película de TiO 2 fue revestido por bombardeo iónico sobre un cubreobjetos de vidrio, y la superficie de TiO 2 fue posteriormente modificado con una monocapa de organosilano derivado de octadecyltrichlorosilane (OTS), que inhibe la adhesión celular. La muestra se sumerge en un medio de cultivo celular, y se centró la luz UV se irradió a una región octogonal. Cuando un neuronales células PC12 línea celular se sembraron en la muestra, células adheridas sólo en la zona UV-irradiado. Además, muestran que esta modificación de la superficie también se puede realizar in situ, es decir, incluso cuando las células están creciendo en el sustrato. Modificación adecuada de la superficie requiere una matriz extracelular protein colágeno para estar presente en el medio en el momento de la irradiación UV. La técnica que aquí se presenta potencialmente se puede emplear en múltiples tipos de células de modelado para la construcción de sistemas de cocultivo o manipular arbitrariamente células en cultivo.
Introducción
Procesos de litografía de semiconductores y sus derivados - tales como 1,2 fotolitografía, la litografía por haz de electrones 3-6, y microcontacto impresión 7.10 - se han convertido en una herramienta establecida en la biología celular a crecer las células vivas en una posición y geometría definida. El método del patrón se basa en el uso de sustratos microfabricados, que consta de micro-isla de recubrimiento permisiva celular en un fondo no permisiva. Tal sustrato sirve como una plantilla para patrón de las células. Estas tecnologías nos han proporcionado los nuevos métodos para diseñar las células y su función en un nivel de una o varias celular, para extraer las propiedades intrínsecas de las células, y para aumentar el rendimiento de cribado de fármacos basado en células 11.
El grado de libertad en la morfogénesis celular aumentaría enormemente si la geometría patrón de plantilla podría ser alterado in situ, es decir, mientras que las células se cultivan sobre los sTu cara. Los métodos convencionales para la formación de patrones no pueden aplicarse directamente aquí, ya que procesan muestras en la atmósfera o en el vacío. Por lo tanto se han propuesto diversas técnicas nuevas modificación de la superficie, que se basan, por ejemplo, en compuestos fotorreactivos 12,13 5,14 o ablación con láser, sólo para nombrar unos pocos. Los métodos propuestos han sido muy bien revisado por Robertus et al. 15, y más recientemente por Choi et al. 16 y 17 por Nakanishi.
Aquí en este artículo, se describe un nuevo protocolo de modificación in situ de la superficie, que se aprovecha de la descomposición fotocatalítica de moléculas orgánicas en un dióxido de titanio (TiO2) Superficie 18,19. En este método, se inserta una película de TiO 2 entre el sustrato de vidrio y la película orgánica que interconecta las células, y la película orgánica se descompone in situ por localmente irradiar luz ultravioleta (UV)luz para una región de interés (λ <388 nm). Se demuestra que el nuevo protocolo se puede utilizar para crear micropatrones de proteínas de matriz extracelular y células vivas tanto ex situ como in situ. TiO2 es biocompatible, químicamente estable y ópticamente transparente, características de lo que lo hace amigable para introducir en los experimentos de cultivo celular. Este protocolo proporciona una alternativa de ciencia de los materiales de base para la modificación de los andamios de cultivo celular en medio de cultivo celular.
Protocolo
1. Preparación de TiO2 presenta el revestimiento de cristal Coverslip
- Número los cubreobjetos utilizando una punta de trazar diamante. Esto no sólo ayuda a mantener un registro de cada cubreobjetos, sino también para asegurar que el lado correcto de la muestra quede hacia arriba. Limpie los cubreobjetos, primero bajo el chorro de ddH2O, a continuación, sumergiéndolas en una solución de pirañas (H 2 SO 4: H 2 O 2 = 4: 1). Después de 10 minutos, enjuague los cubreobjetos a fondo, 8 veces en ddH2O Seque el cubreobjetos bajo flujo de N2.
- Conjunto TiO 2 de destino en el sistema de pulverización catódica de radiofrecuencia (RF). Coloque el cubreobjetos sobre un soporte de muestras del equipo de pulverización catódica con una cinta de poliamida. Colocar el soporte de muestra en la cámara de pulverización catódica. Evacuar la cámara hasta que la presión alcanza 2,0 × 10 -4 Pa.
- Introducir gas Ar en la cámara y ajustar la presión de deposición a 4,0 mTorr. Mientras se mantiene el obturador cerrado, aumentar gradualmentela potencia de RF a 70 W.
- Abra el obturador y pulverización catódica durante 15 min para obtener una película con un espesor de 120-150 nm de (Figura 1: Paso A). Tasa de crecimiento de la película tiene que ser derivado para cada máquina.
2. Recubrimiento de superficie con Film celular repelente
- Hidrofilizar la superficie de TiO 2 por tratamiento de la muestra con plasma de O2, siguiendo las instrucciones proporcionadas por el fabricante del reactor de plasma. Tratamos a la muestra durante 5 min a 200 W con O 2 flujo de 100 sccm. Sumergir la muestra en ddH2O y confirme que la superficie es superhidrófila. Seque la superficie a fondo en corriente de N2.
- Preparar octadecyltrichlorosilane 1 mM solución (OTS) mediante la adición de 39,6 OTS mu l a 100 ml de tolueno. Sumergir la muestra en la solución durante 1 hora a RT. Llevar a cabo este paso dentro de una bolsa de N 2 guante -filled (Figura 1: Paso B).
- Para eliminar las moléculas adsorbidas, sonicate la muestra en tolueno, acetona, etanol, y ddH 2 O durante 5 min cada uno, en ese orden. Enjuagar la muestra en cuatro ocasiones en fresco ddH2O y seque la superficie bajo flujo de N2. La superficie debe ser hidrófobo con un ángulo de contacto de 100-110ºC.
3. Ex-Situ Patrones de superficie
- Trabajando en una campana de flujo laminar, dibujar varias marcas de arañazos con una punta de trazar diamante en la superficie. Las marcas ayudan a mantener un registro de las regiones procesados y también con lo que los microscopios en el foco. Esterilizar el TiO recubierto-OTS 2 mediante la inmersión de la muestra en etanol 70% durante 5 min. Luego enjuague la muestra dos veces en esterilizada ddH2O
- Colocar la muestra en una placa de 35 mm, y añadir 2 ml de medio de crecimiento PC12 (ver Paso 4.2). Incubar durante más de 3 horas en una incubadora de CO 2 (37 ° C). Este procedimiento está destinado a dejar albúminas de suero absorben sobre la superficie. Albúminas adsorbidos inhiben la posterior adsorción de otra proteins y células (Figura 1: la etapa c).
- Mientras espera, configurar el microscopio de fluorescencia invertida.
- Encienda la lámpara de arco, inserte el cubo de filtro UV, y establecer la lente objetivo de 20X.
- Medir la intensidad de la luz I (W cm -2) utilizando un medidor de UV de intensidad, y calcular el tiempo de irradiación t (en segundos) para una dosis de d (en J cm -2) como: t = d / I.
Por ejemplo, para irradiar a una dosis de 200 J cm -2 usando una fuente de luz de 600 mW cm -2, se requiere 333 seg de la irradiación. - Use un micrómetro y cerrar el diafragma de campo para establecer el tamaño de la región a ser irradiada, por ejemplo, 200 micras.
- Después de la incubación de 3 horas, suplementar el medio con 200 l de 3,0 mg ml -1 de colágeno tipo IV (Col-IV; finales de concentración de 300 mg ml -1).
- Transferir el plato de 35 mm a la platina del microscopio. Encuentra el arañazo marca, foco del microscopio sobre la superficie de la muestra, y de irradiar luz UV a una dosis de 200 J cm -2 (Figura 1: Paso D). El área de la irradiación UV puede ser alterado ya sea ajustando la abertura del diafragma de campo o mediante la sustitución del diafragma de campo con una máscara de metal de la geometría arbitral.
- Sustituya el medio con un medio de crecimiento fresco (sin Col-IV) y luego colocar la muestra de nuevo en la incubadora.
4. Cultivo Celular
- Cultivo de rutina de las células PC12 se lleva a cabo en un plato de plástico recubierta con colágeno.
- Para cubrir una de 60 mm placa de cultivo de tejidos con Col-IV, mojar primero la superficie con ddH2O y aspirar todo ddH 2 O.
- Preparar 300 mg ml -1 Col-IV diluyendo la solución original (3 mg ml -1) 10x con ddH 2 O.
- Añadir 200 l de 300 mg ml -1 Col-IV por 60-mm plato. Deje que la solución se extendió a través de la superficie.
- T secoque plato en una campana de flujo laminar durante aproximadamente 1 hora.
- Enjuague la superficie dos veces con 4 ml de solución salina tamponada con fosfato de Dulbecco (D-PBS). Cuando no utilice el plato recubierto de inmediato, enjuague el plato una vez con 4 ml de ddH 2 O. Después de aspirar ddH2O, almacenar el plato en la incubadora. Trate de no mantenerla almacenada durante más de dos semanas.
- Las células PC12 se cultivan en un medio de crecimiento que consiste en: Medio (bajo nivel de glucosa) de Eagle modificado por Dulbecco suero solución de penicilina-estreptomicina + 10% de suero bovino fetal al 5% + caballo + 1%. Se incuban las células en una incubadora de CO 2 (37 ° C, 5% de CO 2), y reemplazar la mitad del medio cada dos días. Células Passage antes de llegar a la confluencia.
- Aspirar el medio de crecimiento, y añadir 2 ml de PBS + (D-PBS + 10 mg ml -1 albúmina de suero bovino (BSA) + EDTA 10 mM) precalentado a 37 ° C. Incubar durante 5 minutos a 37 ° C. Golpee suavemente el plato de separar todo ceLLS.
- Recoger las células en un tubo cónico de 15 ml. Enjuague el plato con 3 ml de fresco D-PBS, precalentada a 37 ° C.
- Centrifugar el tubo a 150 × g durante 4 min.
- Aspirar el sobrenadante, y se añade 1 ml de medio de crecimiento.
- Para el cultivo de rutina, dividir las células 1: 3 a 1: 5.
- Para placa células en la OTS / TiO2 muestra modificada UV, cuente densidad celular y añadir 3,0 × 10 5 células en una placa de 35 mm (Figura 1: Paso E). Incubar el plato en el incubador humidificado (37 ° C, 5% de CO 2) durante 1-2 días. Tanto el factor de crecimiento ingenua y el nervio (NGF), las células PC12 -differentiated se pueden utilizar para los experimentos de modelado. Para NGF diferenciación, 100 ng ml -1 de 7S-NGF se añade a la de crecimiento medio varios días antes en placas las células en la muestra. NGF-diferenciación parece aumentar la adhesividad de las células PC12 y hace que el manejo más fácil, especialmente en el in-situ e patronesxperimentos.
5. In-Situ Patrones de superficie
- Después de 1-2 días de cultivo en la superficie ex-situ modificado, confirman que las células se adhieran y crezcan sólo en la región UV-irradiado. Configure el microscopio, como se describe en el Paso 3.4.
- Transferir la muestra a un nuevo 35-mm placa de cultivo tisular que contiene el medio de crecimiento, 100 ng ml -1 NGF (en el caso de la utilización de células diferenciadas-NGF), y 100 mg ml -1 Col-IV.
- Coloque el plato en la platina del microscopio. Encontrar la posición adecuada, e irradiar la luz UV a una dosis de 200 J cm -2 (Figura 1: Paso F, G). La región permisiva recién creado se indica con un asterisco en la Figura 1: Paso G.
- Trata de completar el procesamiento de una sola muestra dentro de los 30 min. Después de la irradiación, la transferencia de la muestra de nuevo en el medio sin Col-IV.
- Tenga mucho cuidado al realizar el plato con cucélulas ltured y la transferencia de la muestra de plato a plato para evitar desprendimiento de las células estampadas.
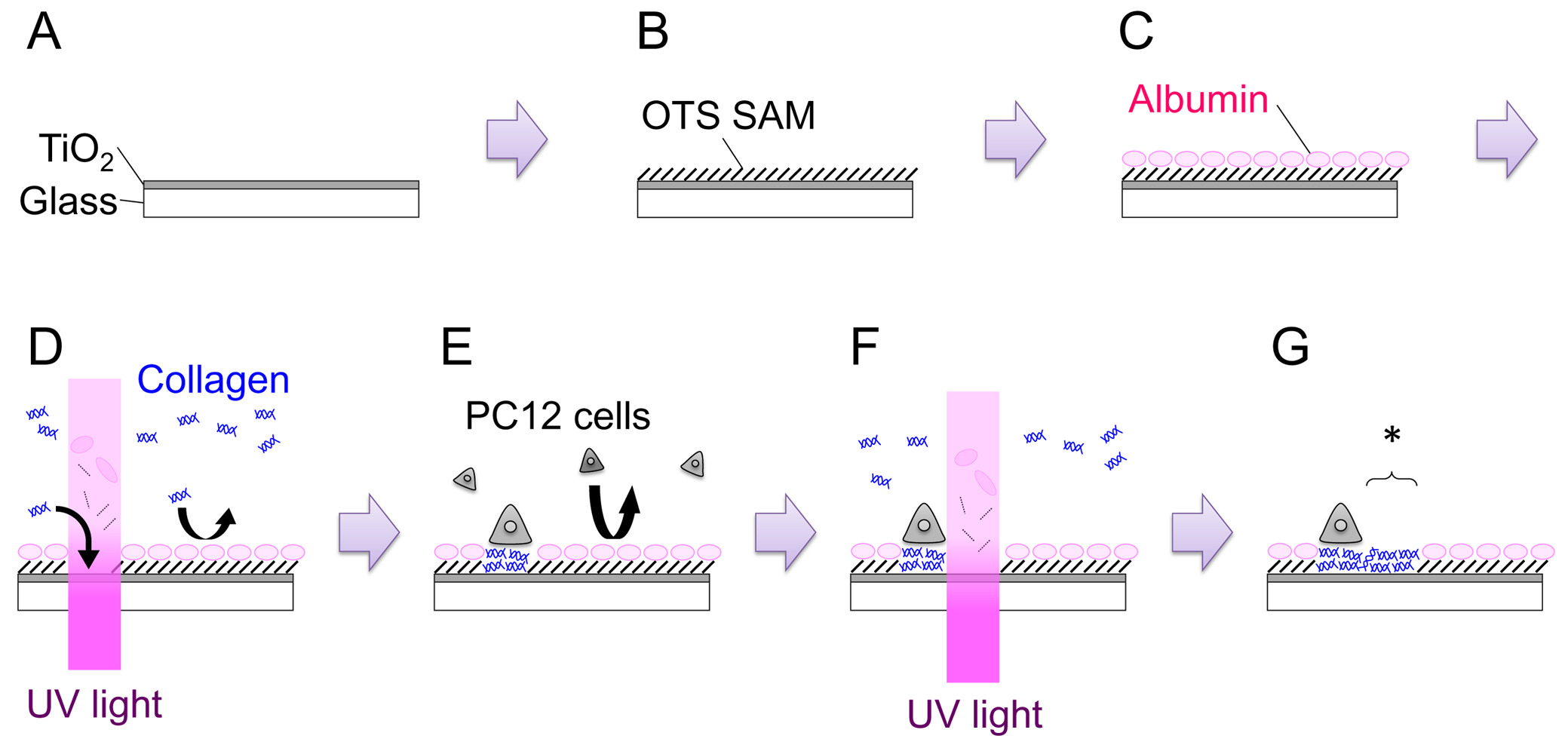
Figura 1. Esquema del proceso general. Véase el texto para más detalles. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
La Figura 2A muestra una imagen de microscopía electrónica de barrido de la sección transversal (SEM) de la película de TiO 2 bombardeo iónico depositado. De la observación, el espesor de la película se estimó en aproximadamente 150 nm. Notable aquí es la planitud del depositada TiO2 película. Un análisis posterior mediante microscopía de fuerza atómica (AFM) reveló que la rugosidad de la raíz cuadrada media (RMS) de la superficie era de 0,2 nm (Figura 2B).
Discusión
En nuestro protocolo actual, TiO2 película fue formada por pulverización catódica RF-magnetrón. Estamos a favor de este método de deposición, ya que nos permite preparar de manera reproducible una fotocatalítica de TiO2 película con una rugosidad sub-nm. Aunque los procesos de deposición por pulverización catódica son familiares para los científicos de materiales e ingenieros electrónicos, puede que no sea bastante accesible para los biólogos. En ese caso, TiO 2 película s...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Authors thank Mr. Kotaro Okubo for the kind assistance with SEM imaging. This work was supported by the Japan Society for the Promotion of Science Grant-in-Aid for Basic Research (B) (20310069), Grant-in-Aid for Research Activity Start-up (25880021), and by research grants from the Kurata Memorial Hitachi Science and Technology Foundation and the Nippon Sheet Glass Foundation for Materials Science and Engineering.
Materiales
| Name | Company | Catalog Number | Comments |
| Glass coverslip | Warner Instruments | CS-15R15 | 15 mm diameter, #1.5 thickness |
| Diamond scriber | Ogura Jewel Industry | D-Point Pen | |
| RF sputtering system | ANELVA | SPC350 | |
| TiO2 sputtering target | Kojundo Chemical Lab | Titanium (IV) oxide, target | Purity, 99.9% |
| Plasma reactor | Yamato | PR301 | |
| n-octadecyltrichlorosilane (OTS) | Aldrich | 104817 | |
| Toluene | Wako | 204-01866 | |
| Tissue-culture dish (35 mm) | Greiner | 627160 | |
| Tissue-culture dish (60 mm) | BD Falcon | 353002 | |
| Type-IV collagen | Nitta Gelatin | Cellmatrix Type IV | |
| D-PBS | Gibco | 14190-144 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco | 11885-084 | |
| Fetal bovine serum | Gibco | 12483-020 | Heat-inactivate and pass through a 0.22 μm filter before use |
| Horse serum | Gibco | 26050-088 | Pass through a 0.22 μm filter before use |
| Penicillin-streptomycin (100x) | Nacalai tesque | 26253-84 | |
| 7S nerve growth factor (NGF) | Alomone Labs | N-130 | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| EDTA | Dojindo | N001 | Stock solution in 0.5 M |
| TiO2 nanoparticle | Tayca | TKD-701 |
Referencias
- Hughes, M. A., Brennan, P. M., Bunting, A. S., Shipston, M. J., Murray, A. F. Cell Patterning on Photolithographically Defined Parylene-C: SiO2 Substrates. J. Vis. Exp. (85), e50929 (2014).
- Kleinfeld, D., Kahler, K. H., Hockberger, P. E. Controlled Outgrowth of Dissociated Neurons on Patterned Substrates. J. Neurosci. 8, 4098-4120 (1988).
- Pensen, D., Heinz, W. F., Werbin, J. L., Hoh, J. H., Haviland, D. B. Electron Beam Patterning of Fibronectin Nanodots that Support Focal Adhesion Formation. Soft Matter. 3, 1280-1284 (2007).
- Tanii, T., et al. Application of Organosilane Monolayer Template to Quantitative Evaluation of Cancer Cell Adhesive Ability. Jpn. J. Appl. Phys. 50, 06GL01 (2011).
- Yamamoto, H., et al. In-Situ Guidance of Individual Neuronal Processes by Wet Femtosecond Laser Processing of Self-Assembled Monolayers. Appl. Phys. Lett. 99, 163701-1610 (2011).
- Yamamoto, H., et al. Differential Neurite Outgrowth is Required for Axon Specification by Cultured Hippocampal Neurons. J. Neurochem. 123, 904-910 (2012).
- Shen, K., Qi, J., Kam, L. C. Microcontact Printing of Proteins for Cell Biology. J. Vis. Exp. (22), e1065 (2008).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Singhvi, R., et al. Engineering Cell Shape and Function. Science. 264, 696-698 (1126).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric Control of Cell Life and Death. Science. 276, 1425-1428 (1997).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects using Micropatterned Cells. J. Vis. Exp. (46), e2514 (2010).
- Nakanishi, J., et al. Photoactivation of a Substrate for Cell Adhesion under Standard Fluorescence Microscopes. J. Am. Chem. Soc. 126, 16314-16315 (2004).
- Kim, M., et al. Addressable Micropatterning of Multiple Proteins and Cells by Microscope Projection Photolithography Based on a Protein Friendly Photoresist. Langmuir. 26, 12112-12118 (2010).
- Deka, G., Okano, K., Kao, F. -. J. Dynamic Photopatterning of Cells In Situ by Q-Switched Neodymium-Doped Yttrium Ortho-Vanadate. Laser. J. Biomed. Opt. 19, 011012 (2014).
- Robertus, J., Browne, W. R., Feringa, B. L. Dynamic Control over Cell Adhesive Properties using Molecular-Based Surface Engineering Strategies. Chem. Soc. Rev. 39, 354-378 (2010).
- Choi, I., Yeo, W. -. S. Self-Assembled Monolayers with Dynamicity Stemming from (Bio)chemical Conversions: From Construction to Application. ChemPhysChem. 14, 55-69 (2013).
- Nakanishi, J. Switchable Substrates for Analyzing and Engineering Cellular Functions. Chem. Asian J. 9, 406-417 (2014).
- Yamamoto, H., et al. In Situ Modification of Cell-Culture Scaffolds by Photocatalytic Decomposition of Organosilane Monolayers. Biofabrication. 6, 035021 (2014).
- Sekine, K., Yamamoto, H., Kono, S., Ikeda, T., Kuroda, A., Tanii, T. Surface Modification of Cell Scaffold in Aqueous Solution using TiO2 Photocatalysis and Linker Protein L2 for Patterning Primary Neurons. e-J. Surf. Sci. Nanotech. 13, 213-218 (2015).
- Arima, Y., Iwata, H. Effects of Surface Functional Groups on Protein Adsorption and Subsequent Cell Adhesion using Self-Assembled Monolayers. J. Mater. Chem. 17, 4079-4087 (2007).
- Fujishima, A., Zhang, X., Tryk, D. A. TiO2 Photocatalysis and Related Surface Phenomena. Surf. Sci. Rep. 63, 515-582 (2008).
- Sigal, G. B., Mrksich, M., Whitesides, G. M. Effect of Surface Wettability on the Adsorption of Proteins and Detergents. J. Am. Chem. Soc. 120, 3464-3473 (1998).
- Zhang, X., et al. A Transparent and Photo-Patternable Superhydrophobic Film. Chem. Commun. 2007, 4949-4951 (1039).
- Kaech, S., Banker, G. Culturing Hippocampal Neurons. Nat. Protoc. 1, 2406-2415 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados