Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Viabilidad de Bioprinted celulares Construye El uso de un Tres Impresora cartesiana dispensador
En este artículo
Resumen
A Cartesian bioprinter was designed and fabricated to allow multi-material deposition in precise, reproducible geometries, while also allowing control of environmental factors. Utilizing the three-dimensional bioprinter, complex and viable constructs may be printed and easily reproduced.
Resumen
Tissue engineering has centralized its focus on the construction of replacements for non-functional or damaged tissue. The utilization of three-dimensional bioprinting in tissue engineering has generated new methods for the printing of cells and matrix to fabricate biomimetic tissue constructs. The solid freeform fabrication (SFF) method developed for three-dimensional bioprinting uses an additive manufacturing approach by depositing droplets of cells and hydrogels in a layer-by-layer fashion. Bioprinting fabrication is dependent on the specific placement of biological materials into three-dimensional architectures, and the printed constructs should closely mimic the complex organization of cells and extracellular matrices in native tissue. This paper highlights the use of the Palmetto Printer, a Cartesian bioprinter, as well as the process of producing spatially organized, viable constructs while simultaneously allowing control of environmental factors. This methodology utilizes computer-aided design and computer-aided manufacturing to produce these specific and complex geometries. Finally, this approach allows for the reproducible production of fabricated constructs optimized by controllable printing parameters.
Introducción
La ingeniería de tejidos utiliza los principios de la biología y la ingeniería en el desarrollo de sustitutos funcionales para mantener, restaurar o mejorar tejido nativo y. La capacidad de generar construcciones biomiméticos tridimensionales en la demanda que facilitaría los avances científicos y tecnológicos en la ingeniería de tejidos, así como en los sensores basados en células, drogas / detección de toxicidad, modelos tisulares o tumorales, y otra. La organización tridimensional de construcciones de ingeniería tisular es un componente fundamental del método de fabricación, ya que debe imitar de cerca la interacción altamente organizada de las células y la matriz extracelular en el tejido nativo.
Andamios tridimensionales biodegradables y forma de formación son factores críticos en la generación de nuevas construcciones de tejido ya que las células migran para formar una capa de dos dimensiones de las células, pero carecen de la capacidad de crecer en favorecida tridimensional. El andamio sirve como una base temporal para la célulael apego y la proliferación, por lo que debe ser construido a partir de materiales con porosidad y biodegradabilidad controlable, y suficiente integrit mecánica. Los materiales de andamiaje no deben ser citotóxico o crear una respuesta adversa del huésped. Los hidrogeles han sido utilizados comúnmente en las técnicas de ingeniería de tejidos, y debido a su hidrofilia, los hidrogeles permitir el intercambio de líquido y gas en todo el structur. Mediante la combinación de diferentes hidrogeles, las propiedades del hidrogel sintetizados se pueden modificar para cumplir el requisito de aplicación distinta.
El enfoque de la ingeniería de tejidos convencional consiste en la creación de andamios porosos de sacrificio acelular que se sembraron con células post-fabricatio. Muchas técnicas se han empleado, tales como unión de fibras, colada con disolvente, y se funden piezas de fundición, pero resultó ser mínimamente éxito para aplicaciones de ingeniería de tejidos. Métodos de unión de fibra permiten fibras para estar alineados en formas específicas, sino que sólo son capaces de producing andamio muy delgada. Métodos de fundición de disolvente produjeron construcciones altamente porosas, sin embargo la membrana producido más grande fue sólo de 3 mm thic. Por lo tanto, la creación de construcciones tridimensionales no es factible el uso de estas técnicas. Técnicas de moldeo en estado fundido tuvieron éxito en la producción de andamios tridimensionales, pero se requieren temperaturas tan altas que los materiales biológicos no pueden ser incorporados durante el proces de producción. Los andamios sembrados después de la fabricación están limitados en su capacidad para cumplir los requisitos de la ingeniería de tejidos para producir andamios tridimensionales con microestructuras pre-definidos o controlables y. Otro problema importante con las tecnologías de siembra andamio sólidos es la deficiencia de la vascularización y la mala mecánica.
Bioprinting desde entonces se ha extendido a tres dimensiones mediante el uso de, geles termo-reversible no tóxicos y biodegradables para superar las desventajas de la convencional. Algunos de los sólidos de forma libre fabricación techniques siendo empleadas actualmente son bioprinting y de inyección de tinta de impresión láser asistida. Técnicas bioprinting asistida por láser utilizan una fuente pulsada láser, una placa de destino, y un sustrato de recepción para generar tridimensional. Sin embargo, esta técnica está limitada debido a la baja el rendimiento, la viabilidad celular baja, y sólo puede producir arreglos limitadas de estructuras fabricadas porque sólo prepolímeros fotorreticulables pueden ser utilizados para formar un hidrogel reticulado. La impresión de inyección de tinta fue desarrollado como una metodología sin contacto que reproduce datos de imagen digital sobre un sustrato mediante el depósito de tinta picolitros. Sin embargo, la impresión de inyección de tinta no produce un constructo de alta resolución, construye experiencia rápida desnaturalización de las proteínas, y muchas de las células se lisan durante la deposición.
En la actualidad, se han desarrollado nuevos métodos de fabricación bioprinting aditivo. En estos sistemas de células, proteínas, factores de crecimiento, e hidrogeles biomiméticos son típicamente integrados en mater matrizmate- durante el proceso de fabricación y al mismo tiempo depositado utilizando actuadores controlados por el ordenador para generar constructos de células cargado a base de andamios tridimensionales que imitan estrechamente la microarquitectura del nativa. Los hidrogeles de células cargados constituyen la bioink, que puede ser heterogéneo, que consta de múltiples tipos de células, o homogénea. Aditivo sistemas de fabricación depósito bioink gota a gota o capa por capa a través de jeringas desechables y consejos a un escenario controlado por ordenador capaz de moverse en las direcciones x, y, z. A través de los programas informáticos, la arquitectura de andamios impresos puede ser fácilmente manipulado en función de los requisitos de la aplicación. A diferencia de las técnicas convencionales, tecnologías médicas tridimensionales (imágenes por resonancia magnética, tomografía computarizada) se pueden incorporar en los diseños, la generación de construcción específica del paciente. Estos métodos también permiten la posibilidad de producir reemplazos vascularizados porque construcciones se producen con una l mayordensidad celular vecinal, permitiendo interacciones célula-célula y la mejora de la probabilidad de Surviva post-implantación.
La impresora Palmetto es un sistema multi-dispensador tridimensional hecha a la medida que utiliza métodos programables fabricación robóticos para generar construcciones de tejido heterogéneo en tres dimensiones (Figura 1). Se permite el uso de una pluralidad de materiales en combinaciones únicas para producir estructuras heterogéneas. La inicialización del bioprinter es uno de los pasos más importantes en bioprinting porque le permite establecer una serie de parámetros para optimizar la capacidad de impresión de los constructos bioprinted.
El bioprinter comprende un proceso de tipo discontinuo con secuencias de arranque, funcionamiento y apagado controlado por un controlador lógico programable (PLC), que el usuario opera a través de un panel de control de pantalla táctil interactiva (Figura 1, A). Para evitar la contaminación de biomateriales lógicos del bioprinter está encerrado en un poli positivamente-presionados (metacrilato de metilo) (PMMA) con una cámara de arrestancia partículas de alta eficiencia (HEPA) -filtered sistema de circulación de aire (Figura 1, B, C). El interior de la impresora se puede esterilizar utilizando las fuentes de luz ultravioleta incorporados en la (Figura 1, D). El componente central de la bioprinter es un robot de posicionamiento totalmente programable que se puede colocar de manera reproducible una punta del dispensador con una precisión de 10 micrómetros (Figura 1, E). Hay tres dispensadores, que son capaces de depositar volúmenes tan pequeños como 230 nl utilizando un tornillo rotativo (Figura 1, F). Ellos son independientemente programable utilizando equipos independientes que gobiernan los parámetros de impresión para cada dispensador (Figura 1, G). Dispensación Rotary-tornillo utiliza la rotación de un tornillo accionado por motor para mover hacia abajo bioink una jeringa y fuera de la punta de la jeringa. Estos dispensadores están montados sobre una neumáticaNest Herramienta Ly controlado (Figura 2A, B), permitiendo que el robot para cambiar dispensador montado en el brazo robótico del eje Z bajo control programado (Figura 1, H).
El robot XYZ recibe instrucciones de impresión desde un equipo que ejecuta el software de diseño (Figura 1, I). Cada programa contiene ubicaciones de dispensación, las rutinas de calibración, y protocolos dispensador cambiante. El diseño de las construcciones generadas principalmente consiste en las coordenadas XYZ, donde cada dispensador depositará material. El bioprinter comprende dos sensores de luz ópticos (Figura 2C) que determinan las coordenadas XYZ del extremo de la punta de la jeringa. Estos sensores envían información de coordenadas para el robot, que las utiliza para calcular las posiciones de los extremos de punta del dispensador. Hay un láser de desplazamiento adicional (Figura 2D) que proyecta un diodo de 633 nm rayo láser rojo del tamaño del punto 30 x 100 micrómetros para medir la distancia con un Accuracy de 0,1 micrómetros. Cuando el haz está muy centrado el robot determina la distancia Z de la superficie de impresión. Esta medición, y la medición de los sensores de luz óptica de la extremo de la punta en Z, permite el cálculo de Z precisa coordenadas utilizadas para colocar la punta del dispensador en relación con la superficie de impresión. Las puntas de dosificación se mueven lateralmente y verticalmente a través del sensor de luz óptica orientada eje X para encontrar los centros Y y Z, y lateralmente a través de un sensor de eje Y para encontrar el centro del eje X. La superficie de impresión se asigna utilizando la fórmula para un plano en el espacio xyz: ax + by + cz = d para determinar donde la superficie es relativa a la posición del extremo de la punta de dispensación. La etapa de la impresora (Figura 1, J) tiene una muestra de placa de Petri de hasta 80 mm de diámetro y utiliza un baño de agua de recirculación para mantener la temperatura de ajuste (Figura 1, K). Etapa temperatura puede ajustarse dentro de un rango de -20 y permanece estable dentro. Hay una cámara USB montadoen el robot Z-brazo para proporcionar una vista ampliada de la punta dispensadora durante el proceso de impresión (Figura 1, L). Hay una segunda cámara montada hacia la parte superior del interior de la cámara que proporciona una visión completa de la bioprinter durante el proceso de impresión (Figura 1, L).
Un software de dibujo diseño asistido por ordenador determina el patrón de deposición y permite al usuario generar gotas espaciadas de forma incremental y estructuras complejas (Figura 3). Vías tridimensionales pueden ser codificados manualmente en el software de diseño compatible con la impresora o importados de un software independiente de dibujo asistido por ordenador de diseño (Figura 4, Tabla 1). El software compatible con la impresora permite variaciones de los parámetros de impresión tales como el método de deposición (single deposición de gotas o la deposición vía continua), la geometría tridimensional de las vías, velocidad de deposición, distancia entre el extremo de la punta de la jeringa y substsuperficie de impresión tasa, la cantidad de tiempo para depositar una gota individual, y la altura y la velocidad de la jeringa se levanta entre la deposición de las gotas. Cada programa contiene XYZ ubicaciones de dispensación, las rutinas de calibración punta y protocolos dispensador de cambio para proporcionar un ambiente estéril, sin intervención del operador, durante la impresión. El controlador lógico programable (PLC) del robot recibe instrucciones del equipo que ejecuta el software de diseño y controla el tiempo de los eventos de los controladores externos (por ejemplo, los dispensadores). Para ello, el PLC utiliza un mecanismo de bucle para controlar los dispensadores , dispositivo de posicionamiento robótico, y los factores ambientales.
Tridimensional bioprinting-escritura directa utilizando un sistema de dispensación de líquido rotativo de tornillo permite que el proceso de depositar las células a ser más eficiente, precisa y fácil que los métodos anteriores. Este estudio muestra la bioprinter hecha a la medida es capaz de generar ceconstrucciones de hidrogel-ll cargados con alta viabilidad celular.
Protocolo
1. Preparación de la gelatina sustrato que contiene para tridimensional Bioprinting de alginato hidrogeles
- Prepare el substrato de calcio / gelatina siguiendo el método de sustrato de calcio / gelatina descrito por Pataky et al 11 para evitar la viabilidad reducida asociada con alto contenido. El método de sustrato de calcio / gelatina se encuentra a continuación.
- Combinar dihidrato de cloruro de calcio (1,5% en peso), cloruro de sodio (0,9% en peso), y la gelatina porcina (2% en peso) en agua destilada y hervir durante 2 min para crear una solución de gelatina 100 mM.
- Vierta 5 ml de la solución de gelatina / calcio en 100 mm placas de Petri estándar, haga girar la solución a su alrededor para una capa uniforme sobre la superficie, y colóquelo sobre una superficie plana en la nevera para gel de O / N (permite gelificar al menos 8 h antes de su uso).
- Para aumentar la opacidad de la superficie del sustrato, añadir dióxido de titanio (0,3% en peso) a la solución gelatina / CaCl 2. Se agita durante 10 min. Autoclave la solución de gelatina / TiO 2 en el ciclo de líquidos durante 30 min para esterilizarlo.
- Añadir 3 ml de la solución de gelatina / TiO 2 a la superficie de las placas de gelatina previamente preparadas. Agitar la mezcla para asegurarse de que se distribuye de manera uniforme por toda la superficie. Dejar cuajar en el 4 ° C nevera O / N (permita a gel por lo menos 8 horas antes de su uso). Los soportes deben ser utilizados dentro de los 3 días.
2. El alginato Oxidación
- Oxidar el bioink alginato de sodio siguiendo el método de alginato parcialmente oxidado por Bouhadir et al 30 se describe a continuación.
- Para hacer una solución de alginato oxidado 5%, disolver 1 g de alginato de sodio en 100 ml de agua destilada. Añadir una solución acuosa de peryodato de sodio (0,25 M, 0,25 mmol), el agente oxidante, para producir una solución de oxidación 5%. Se agita durante 19 horas a temperatura ambiente. Añadir 40 ml de etilenglicol a la solución después de 24 horas para terminar el reacción.
- Disolver 2,5 g de cloruro de sodio en la solución. Añadir una cantidad en exceso de alcohol etílico (2: 1 ratio) para precipitar los alginatos oxidados. Centrifugar la solución a 1000 xg para recoger los precipitados y volver a disolver en agua destilada. Repita el lavado con etanol.
- Liofilizar los gránulos de alginato oxidados y almacenar a -20 ° C hasta que esté listo para su uso.
- Determinar el grado de oxidación mediante la medición del porcentaje de peryodato de sodio consumido antes de ser terminado por el glicol de etileno.
- Preparar una solución de yoduro de potasio (20% w / v, tampón de fosfato pH 7,0 de sodio) y una solución thyodene (10% w / v, tampón de fosfato pH 7,0 de sodio). Mezclar las dos soluciones con el alginato oxidado a TA.
- Poco a poco caer la solución de peryodato de alginato de sodio y reaccionado en la mezcla de soluciones de yoduro de potasio y theodyne. Medir la absorbancia de la mezcla espectrofotométricamente a 426 nm. Cuando se ha alcanzado unamáxima, registre el volumen utilizado de alginato de sodio y solución de peryodato como V 1.
- La reacción es
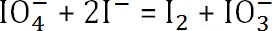 . La cantidad de peryodato de sodio sin reaccionar es
. La cantidad de peryodato de sodio sin reaccionar es 
- Restar la cantidad de peryodato de sodio sin reaccionar de la concentración original para determinar la cantidad de peryodato de sodio consumido. Utilizando la fórmula anterior, determinar el grado de oxidación final del alginato.
3. El alginato Péptido Conjugación
- Ligandos conjugadas con una secuencia arginina-glicina-aspartato expuesta (péptido) en el alginato oxidado previamente preparado siguiendo el método de conjugación RGD-Alginato por Rowley et al 31 se describe a continuación para promover la unión celular y la difusión.
- Utilice carbod acuosaquímica iimide con G 4 RGDSPto conjugada 31.
- Disolver 1 g de 5% de alginato oxidado en un ácido etanosulfónico 0,1 M 2- (N-morfolino) (MES), pH = 4. Añadir 1-etil- (dimetilaminopropil) carbodiimida (EDC, 0,54 mmol) y N-hidroxisuccinimida ( NHS, 0,27 mmol) en 2: 1 proporción para formar amida intermedia.
- Añadir 0,28 mmol péptido, de acoplamiento a la cadena principal del polímero de alginato a través de la amina terminal. Se agita a RT O / N.
- Detener la reacción de acoplamiento mediante la adición de 2,5 g de cloruro de sodio a la solución. Añadir una cantidad en exceso de alcohol etílico (2: 1 ratio) para precipitar los alginatos oxidados. Centrifugar la mezcla a 4000 xg durante 5 min para recoger los precipitados. Aspirar los medios de comunicación en la campana de cultivo de células y volver a disolver los precipitados en agua destilada. Repita el lavado con etanol.
- Liofilizar los precipitados hasta que queda completamente seco (aparecerá como una sustancia blanca en polvo) y almacenar en el -20 ° C nevera para más tardeusar.
4. adiposo humano Las células estromales Cell Tissue Culture (de hADSC)
- Cultura adiposo humano las células del estroma de tejido (de hADSC) en 75 cm (matraces T75) matraces de cultivo de células tratadas, cubierto con 15 ml DMEM bajo en glucosa con 10% de suero fetal bovino y 1% de penicilina-estreptomicina, glutamina al 1%, y 1% antimicina. Cambiar los medios de comunicación, en la campana de cultivo de células, cada dos días hasta que hayan alcanzado la confluencia (80-90%).
- Una vez confluentes, transferir los matraces T75 a la campana de cultivo celular y suspender la hADSC de usar el método de enzima tripsina digestión.
- En el capó, aspirar todos los medios de cultivo celular apagado de las células. Enjuague con 5 ml de fosfato de Dulbecco solución salina tamponada con calcio y magnesio (DPBS ++). Aspirar el DPBS ++ fuera de las células.
- Mientras que en la campana, hacer una solución de tripsina y DPBS ++ mediante la mezcla de 1 ml de tripsina y 4 ml de DPBS ++. Cada matraz requiere 5 ml de la solution, así que el volumen apropiado para el número de matraces confluentes. Añadir 5 ml de la tripsina / DPBS ++ a cada matraz y ponerlos en la incubadora durante 2 min.
- Después de 2 minutos, retire los frascos y golpee suavemente los lados de ellos para aflojar las células de los fondos. Mira cada frasco con un microscopio para asegurar que las células se suspenden. Colocar los frascos de nuevo en la campana de cultivo celular y añadir 3 ml de medio de cultivo celular apropiado a cada matraz. Esto termina la reacción tripsina.
- Transferir los medios de comunicación de las células cargadas de cada matraz y poner en un cónico de 50 ml. Centrifugar ellos en 1000 xg durante 5 min. Las células deben aparecer como una pequeña pastilla blanca en la parte inferior de la cónica. Traslado de regreso a la campana de cultivo celular y aspirar los medios de comunicación. Resuspender las células en 2 ml de medio de cultivo celular.
- Contar las células usando un hemocitómetro bajo el microscopio. Una vez que las células han sido contados, en la campana de la cultura, la alícuota de la cantidad de medios de comunicación que contiene ~ 1,3 millon células y la transferencia a un cónico de 15 ml. Centrifugar el cónica 15 ml que contiene las células de nuevo durante 5 min a 1000 x g.
- En la campana de cultivo, resembrar las células restantes en varios frascos T-75, la adición de una concentración de células de ~ 350.000 a cada matraz. Añadir 15 ml de medio DMEM y volver a la incubadora hasta la confluencia de nuevo.
- Una vez que el ciclo de centrifugación es completa, devuelva el cónica 15 ml al cultivo celular. Aspirar los medios de comunicación a partir del sedimento celular y resuspender las células en solución de alginato acuosa a una concentración de 1,3 millones de células por mililitro de bioink, terteriating la solución a menudo por lo que hay una distribución homogénea de células de todo el bioink. Cargue la solución de células cargadas en un 3 ml jeringa compatible con la impresora estéril y el tornillo en la 22 G punta de plástico estéril.
5. Bioprinter Configuración
- Encienda el bioprinter, cada uno de los ordenadores del dispensador y el recirculating baño de agua.
- Establezca manualmente la recirculación temperatura del baño de agua para el mecanismo de gelificación.
- Establezca manualmente los parámetros de impresión para cada distribuidor en el equipo dispensador de correlación. Ajuste el volumen de dispensación de 230 nl, número de backsteps a 0, y la tasa de dispensación de 10μl sec.
- Abra el software de diseño y el programa para la visualización de la pantalla de la cámara USB en el ordenador.
- Usando el software, introducir manualmente las coordenadas para una matriz de puntos 5 x 5 con 2,4 mm de separación entre las gotas.
- Establezca los parámetros de impresión de ser: distancia entre el extremo de la punta y la superficie del sustrato = 0,1 mm; altura jeringa se levanta entre los depósitos = 20 mm; la cantidad de tiempo por deposición = 1 seg.
- Guarde el programa y enviarlo al robot.
- Coloque la placa de Petri de gelatina / TiO2 -Con un contenido en el escenario de la impresora C 4 °. Cierre y bloquee la puerta de la cámara.
- Utilice el PLC para iniDar formato las fuentes de luz ultravioleta, y esterilizar la cámara durante 90 segundos.
- Una vez que la esterilización es completa, abrir la cámara y cargue la jeringa que contiene de hADSC suspendido en alginato en la pistola 1. Cierre y bloquee la puerta de la cámara.
- Utilice el PLC para activar el sistema de ventilación, espere 30 segundos para la presión interna de equilibrio.
- En el ordenador, ejecute el programa que contiene los parámetros de la vía y la impresión geométricas.
- Durante todo el proceso de impresión, ver la pantalla de la cámara USB en el equipo para confirmar la impresión precisa y uniforme.
- Una vez finalizada la impresión, permitir que las construcciones de gel durante 40 min.
6. Análisis de Viabilidad Celular
- Cubra las construcciones que no van a ser fotografiado inmediatamente después de la impresión en DMEM y almacenar en la incubadora hasta el momento de formación de imágenes.
- Para cuantificar la viabilidad de las construcciones, mancha usando un ensayo de viabilidad / citotoxicidad de base fluorescente, unnd imagen mediante microscopía confocal.
- Siguiendo las instrucciones del kit, preparar una solución de tinción que contienen calceína AM y homodímero de etidio-1. Para hacer 10 ml de solución de tinción, añadir 20 l de la etidio homodímero-1 y 5 l de la calceína am a 10 ml de agua estéril, fosfato solución salina tamponada con cultivo de tejidos grado de Dulbecco (+ magnesio, + de calcio; DPBS ++).
- Sumergir los constructos bioprinted en la solución de tinción durante 15 min en la oscuridad.
- Imagen de las construcciones teñidas utilizando un sistema de microscopio confocal en los días 0 y 8. Tomar varias imágenes de cada construcción bioprinted, utilizando parámetros Z-stack de 30 rebanadas ópticos en una profundidad de 300 m, y contar manualmente las células. Si las células aparecen de color amarillo o cuentan como viva verde, y si rojo, contarlos como muerto.
- Calcular el porcentaje de viabilidad celular como el número de células vivas dividido por el número total de células en la construcción; Viabilidad Celular = número decélulas vivas (verde + amarillo) / número de células totales (verde + amarillo + rojo) x 100%.
- Calcular la cantidad de proliferación celular para cada muestra como el número de células de 8 días dividido por el número de células en el día 0; Proliferación Celular = recuento de células en vivo los días 8 / células vivas cuenta en el día 0 x 100%.
7. Análisis Conjugación de péptidos RGD
- Para analizar el éxito de la conjugación péptido RGD en el alginato, alginato comparar RGD-conjugado y alginato no conjugado. Para ello, la imagen de las construcciones impresas usando (4 ', 6-diamidino-2-fenilindol, Dihydrochloride) (DAPI) y phalloidin manchas.
- Realice los phalloidins solución de trabajo diluyendo 5 l de la solución metanólica con 200 l de DPBS ++. Almacenar a -20 ° C hasta su uso.
- Hacer una solución 300 mM de stock de la mancha DAPI siguiente la ecuación: (0,10509 g / L) / (350,3 g / mol) = 3 × 10 -4 M = 0,0003 M = 0,300 mM = 300 mM. Hacer ªe DAPI solución de trabajo diluyendo la solución madre de 1: 100 en DPBS ++ para obtener 3 M solución. Almacenar a -20 ° C hasta su uso.
- Sumerja completamente la muestra en paraformaldehído al 4%. Incubar durante 1 hora a RT. Lavar tres veces con DPBS ++, permitiendo que la solución actúe durante 5 minutos cada lavado. Transferir la muestra de gel del pozo a un portaobjetos de vidrio, volteando el gel sobre en el proceso. Sumergir el gel en 0,1% de Triton X-100 (0,1 g / 100 ml) en DPBS ++ durante 10 min. Lavar tres veces con DPBS ++, permitiendo 5 minutos para cada lavado.
- Tinción de las construcciones impresas con faloidina por inmersión en la solución de trabajo. Cubra con papel aluminio y se incuba durante 4 horas. Quite la mancha faloidina y lavar tres veces con DPBS ++. El primer lavado debe ser rápido, los últimos lavados deben sentarse durante 5 minutos cada uno.
- Tinción de las construcciones impresas con DAPI sumergiéndolos en la solución de trabajo de DAPI. Cubrir con papel de aluminio y se incuba a TA durante 30 min. lavartres veces con DPBS ++, lo que permite cada lavado para sentarse durante 5 min. Observe y la imagen de las muestras en un sistema de microscopio confocal.
Resultados
Los resultados demuestran la bioprinter es capaz de depositar hidrogeles de células cargado en ubicaciones tridimensionales específicas precisa y consistente utilizando el software asistido por ordenador. Estos programas determinan la colocación de cada gotita y controlan muchos de los parámetros para la distribución (Figura 3,4). La repetibilidad del bioprinter para depositar apropiadamente biomateriales es fundamental para su éxito en aplicaciones de ingeniería tisular.
Discusión
El enfoque principal de la ingeniería de tejidos es cerrar la brecha entre la escasez de órganos y necesidades de trasplante mediante el desarrollo de sustitutos biológicos capaces de restaurar, mantener o mejorar functio tejido nativo. Esto ha llevado a la fabricación directa de andamios con un complejo, geometría externa anatómicamente correcta, y el control preciso sobre el Geometr interna. Bioprinting tridimensional es una metodología utilizada para generar construcciones tridimensionales de diversos tamaños...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Este trabajo fue apoyado por la ayuda del Gobierno bajo la Concesión No. EPS-0903795 otorgados por la National Science Foundation, NIH NIDCR R01-DE019355 (MJY PI), y Grant 8P20 GM103444 (YM PI).
Materiales
| Name | Company | Catalog Number | Comments |
| Positioning Robot (JR2000 XYZ) | Janome | ||
| Dispensers: SDAV Linear Drive SmartDispensers | Fishman Corporation | ||
| Optical Light Sensors: | Keyensce | ||
| Displacement Laser: OD Mini | SICK | ||
| Recirculating Water Bath: Polystat | Cole-Parmer | EW-12122-02 | |
| USB Cameras: Dino-Lite Premier 5MP | AnMo Electrionics/YSC Technologies | AD7013MT | |
| Printer-Compatible Computer Design Software: JR-C Points | Janome | Comes with purchase of Janome Robot | |
| Computer-Aided Design Drawing Software: Visual PathBuilder | RatioServ | Can be downloaded at: www.ratioserv.com/index.php/downloads | |
| Printer 3 cc Syringes: | Fishman Corporation | 122051 | |
| 22 G Dispenser Tips | Fishman Corporation | Z520122 | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 10035-04-8 | |
| Sodium Chloride | Sigma-Aldrich | 7647-14-5 | |
| Porcine Gelatin | Sigma-Aldrich | 9000-70-8 | |
| Titanium Dioxide | Sigma-Aldrich | 13462-67-7 | |
| Protanal LF 20/40 Alginate (Sodium Alginate) | FMC BioPolymer | 9005-38-3 | |
| Hydrochloric Acid | Sigma-Aldrich | 7647-01-0 | |
| Ethylene Glycol | Mallinckrodt Baker, Inc | 9300-01 | |
| Sodium Periodate | Sigma-Aldrich | 7790-28-5 | |
| hADSC | Lonza | PT-5006 | Store in vials in liquid nitrogen until use. |
| Dulbecco's Modified Eagle's Medium | Gibco Life Technologies | 11965-092 | Warm in 37 °C water before use. |
| Trypsin/EDTA | Lonza | CC-5012 | Warm in 37 °C water before use. |
| Calcein AM | Gibco Life Technologies | C3100MP | Store in the dark at -80 °C until use. |
| Live/Dead Mammalian Viability Assay Kit | Invitrogen Life Technologies | L-3224 | Store in the dark at -80 °C until use. |
| MES Hydrate | Sigma-Aldrich | M2933 | |
| N-Hydroxysuccinimide | Sigma-Aldrich | 130672 | |
| 1-ethyl-(dimethylaminopropyl) carbodiimide (EDC) | Sigma-Aldrich | E1769 | 10 G |
| Dulbecco's Phosphate-Buffered Saline, +Calcium, +Magnesium | Life Technologies | 14040133 | Warm in 37 °C water before use. |
| Dulbecco's Phosphate-Buffered Saline, -Calcium, -Magnesium | Life Technologies | 14190144 | Warm in 37 °C water before use. |
| RGD Peptides | International Peptides | ||
| Alexa Fluor 546 Phalloidin Stain | Invitrogen Life Technologies | A22283 | Store at -20 °C until use |
| (4’, 6-Diamidino-2-Phenylindole, Dihydrochloride) (DAPI) Stain | Life Technologies | R37606 | Store at -20 °C until use |
Referencias
- Langer, R., Vacanti, J. P. . Tissue Engineering. Science. 260 (5110), 920-926 (1993).
- Derby, B. Review: Printing and Prototyping of Tissues and Scaffolds. Science. 338 (6109), 921-926 (2012).
- Kachurin, A. M., et al. Direct-Write Construction of Tissue-Engineered Scaffolds. Mat. Res. Soc. Symp. Proc. 698, 10-1557 (2002).
- Sachlos, E., Czernuszka, J. T. Making Tissue Engineering Scaffolds Work. Review on the Application of Solid Freeform Fabrication Technology to the Production of Tissue Engineering Scaffolds. European Cells and Materials. 5, 29-40 (2003).
- Yeong, W. Y., Chua, C. K., Leong, K. F. Rapid Prototyping in Tissue Engineering. Challenges and Potential. Trends Biotechnol. 22 (12), 643-652 (2004).
- Landers, R., Pfister, A., Hubner, U., John, H., Schmelzeisen, R., Mulhaupt, R. Fabrication of Soft Tissue Engineering Scaffolds by means of Rapid Prototyping Techniques. Journal of Materials Science. 37 (15), 3107-3116 (2002).
- Murphy, S. V., Skardal, A., Atala, A. Evaluation of Hydrogels for Bio–Printing Applications. Journal of Biomedical Materials Research Part A. 101A (1), 272-284 (2013).
- Burg, K. J. L., Boland, T. Minimally Invasive Tissue Engineering Composites and Cell Printing. IEEE Eng Med Biol Mag. 22 (5), 84-91 (2003).
- Billiet, T., Vandenhaute, M., Schelfhout, J., Van Vlierberghe, S., Dubruel, P. A Review of Trends and Limitations in Hydrogel-Rapid Prototyping for Tissue Engineering. Biomaterials. 33 (26), 6020-6041 (2012).
- Khalil, S., Nam, J., Sun, W. Multi–Nozzle Deposition for Construction of 3D. Biopolymer Tissue Scaffolds. Rapid Prototyping Journal. 11 (1), 9-17 (2005).
- Pataky, K., Braschler, T., Negro, A., Renaud, P., Lutolf, M. P., Brugger, J. Microdrop Printing of Hydrogel Bioinks into Three–Dimensional Tissue–Like Geometries. Adv Mater. 24 (3), 391-396 (2011).
- Pati, F., Shim, J. H., Lee, J. S., Cho, D. W. Three-Dimensional Printing of Cell–Laden Constructs for Heterogeneous Tissue Regeneration. Manufacturing Letters. 1 (1), 49-53 (2013).
- Gruene, M., et al. Laser Printing of Three–Dimensional Multicellular Arrays for Studies of Cell–Cell and Cell–Environment Interactions. Tissue Eng. 17 (10), 973-982 (2011).
- Khalil, S., Sun, W. Bioprinting Endothelial Cells With Alginate for 3D Tissue Constructs. J Biomed Eng. 131 (11), 1-8 (2009).
- Xu, T., et al. Hybrid Printing of Mechanically and Biologically Improved Constructs for Cartilage Tissue Engineering Applications. Biofabrication. 5 (1), 1-10 (2012).
- Zhang, T., Yan, K. C., Ouyang, L., Sun, W. Mechanical Characterization of Bioprinted in vitro Soft Tissue Models. Biofabrication. 5 (4), 1-10 (2013).
- Chung, J. H. Y., et al. Bio–ink Properties and Printability for Extrusion Printing Living Cells. J. Biomater. Sci., Polym. Ed. 1 (7), 763-773 (2013).
- Yang, S., Leong, K. F., Du, Z., Chua, C. K. The Design of Scaffolds for Use in Tissue Engineering. Part II. Rapid Prototyping Techniques. Tissue Engineering. 8 (1), 1-11 (2002).
- Ferris, C. J., Gilmore, K. G., Wallace, G. G., Panhuis, M. Biofabrication: An Overview of the Approaches Used for Printing of Living Cells. Appl. Microbiol. Biotechnol. 97 (10), 4243-4258 (2013).
- Lu, L., Mikos, A. G. The Importance of New Processing Techniques in Tissue Engineering. MRS Bull. 21 (11), 28-32 (1996).
- Wake, M. C., Gupta, P. K., Mikos, A. G. Fabrication of pliable biodegradable polymer foams to engineer soft tissues. Cell Transplant. 5, 465-473 (1996).
- Mironov, V., Visconti, R. P., Kasyanov, V., Forgacs, G., Drake, C. J. Organ Printing: Tissue Spheroids as Building Blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Norotte, C., Marga, F. S., Niklason, L. E. Scaffold–free Vascular Tissue Engineering Using Bioprinting. Biomaterials. 30 (30), 5910-5917 (2009).
- Devillard, R., et al. Cell Patterning by Laser–Assisted Bioprinting. Methods Cell Biol. 119, 159-174 (2014).
- Binder, K. W., Allen, A. J., Yoo, J. J. Drop–on–Demand Inkjet Bioprinting: a Primer. Gene Ther Reg. 6 (1), 33 (2011).
- Xu, T., et al. Viability and Electrophysiology of Neural Cell Structures Generated by the Inkjet Printing Method. Biomaterials. 27 (19), 3580-3588 (2006).
- Calvert, P. Inkjet Printing for Materials and Devices. Chem Mater. 13 (10), 3299-3305 (2001).
- Chang, C. C., Boland, E. D., Williams, S. K. Direct–Write Bioprinting Three–Dimensional Biohybrid Systems for Future Regenerative Therapies. J Biomed Mater Res B Appl Biomater. 98 (1), 160-170 (2011).
- Li, M. G., Tian, X. Y. A Brief Review of Dispensing–Based Rapid Prototyping Techniques in Tissue Scaffold Fabrication: Role of Modeling on Scaffold Properties Prediction. Biofabrication. 1 (3), 1-10 (2009).
- Bouhadir, K. H., Lee, K. Y., Alsberg, E., Damm, K. L., Anderson, K. W., Mooney, D. J. Degradation of Partially Oxidized Alginate and its Potential Application for Tissue Engineering. Biotechnol Prog. 17 (5), 945-950 (2001).
- Rowley, J. A., Madlambaya, G. Alginate Hydrogels as Synthetic Extracellular Matrix Materials. Biomaterials. 20 (1), 45-53 (1999).
- Smith, C. M., Christian, J. J., Warren, W. L. Characterizing Environmental Factors that Impact Viability of Tissue–Engineered Constructs Fabricated by a Direct–Write Bioassembly Tool. Tissue Engineering. 13 (2), 373-383 (2007).
- Ozbolat, I., Yu, Y. Bioprinting Towards Organ Fabrication: Challenges and Future Trends. IEEE Trans Biomed Eng. 60 (3), 691-699 (2012).
- Peltola, S. M., Melchels, F. P., Grijpma, D. W., Kellomaki, M. A. A Review of Rapid Prototyping Techniques for Tissue Engineering Purposes. Annals of Medicine. 40 (4), 268-280 (2008).
- Malda, J., et al. 25th Anniversary Article: Engineering Hydrogels for Biofabrication. Adv Mat. 25 (36), 5011-5028 (2013).
- Murphy, S. V., Atala, A. 3D Bioprinting of Tissues and Organs. Nat Biotech. 32 (8), 773-785 (2014).
- Jia, J., et al. Engineering Alginate as Bioink for Bioprinting. Acta Biomaterialia. 10 (10), 4323-4331 (2014).
- Forty, R. A., Steinberg, M. S. The Differential Adhesion Hypothesis: a Direct Evaluation. Developmental Biology. 278 (1), 255-263 (2005).
- Wang, L., Shansky, J., Borselli, C., Mooney, D., Vandenburgh, H. Design and Fabrication of a Biodegradable, Covalently Crosslinked Shape–Memory Alginate Scaffold for Cell and Growth Factor Delivery. Tis Eng Part A. 18 (19-20), 2000-2007 (2012).
- El–Sherbiny, I. M., Yacoub, M. H. Hydrogel Scaffolds for Tissue Engineering: Progress and Challenges. Global Cardiology Science, & Practice. 3 (38), 316-342 (2013).
- Smith, C. M., et al. Three–Dimensional BioAssembly Tool for Generating Viable Tissue-Engineered Constructs. Tissue Engineering. 10 (9–10), 1566-1576 (2004).
- Ozbolat, I. T., Chen, H. Development of a ‘Multi-arm Bioprinter’ for Hybrid Fabrication of Tissue Engineering Constructs. Robotics and Computer–Integrated Manufacturing. 30 (3), 295-304 (2014).
- Kolesky, D. B., Truby, R. L., Gladman, A. S., Busbee, T. A., Homan, K. A. Three-Dimensional Bioprinting of Vascularized, Heterogeneous Cell–Laden Tissue Constructs. Adv Mater. X. Adv Mater. X, x-y (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados