Method Article
Aislamiento y composicional Análisis de Planta cutícula lípidos poliéster Monómeros
En este artículo
Resumen
Lipid polyesters constitute the structural components of two cell wall modifications, the plant cuticle and suberin-containing diffusion barriers. In this video, we describe a method to depolymerize cutin from whole delipidated leaves. The method can be applied to investigating mutants compromised in either cutin or suberin biosynthesis.
Resumen
Terrestrial plants produce extracellular aliphatic biopolyesters that modify cell walls of specific tissues. Epidermal cells synthesize cutin, a polyester of glycerol and modified fatty acids that constitutes the framework of the cuticle that covers aerial plant surfaces. Suberin is a related lipid polyester that is deposited on the cell walls of certain tissues, including the root endodermis and the periderm of tubers, tree bark and roots. These lipid polymers are highly variable in composition among plant species, and often differ among tissues within a single species. Here, we describe a detailed protocol to study the monomer composition of cutin in Arabidopsis thaliana leaves by sodium methoxide (NaOMe)-catalyzed depolymerisation, derivatization, and subsequent gas chromatography-mass spectrometry (GC/MS) analysis. This method can be used to investigate the monomers of insoluble polyesters isolated from whole delipidated plant tissues bearing either cutin or suberin. The method can by applied not only to characterize the composition of lipid polymers in species not previously analyzed, but also as an analytical tool in forward and reverse genetic approaches to assess candidate gene function.
Introducción
Las plantas vasculares se basan en capas extracelulares que funcionan como barreras impermeables entre tejidos de las plantas y el medio ambiente externo. Estas estructuras de la pared asociada de células lipófilo restringen la infección patógena y regulan el transporte pasivo de los gases, el agua y las sustancias disueltas dentro y fuera de los tejidos vegetales 1. Estas barreras son la cutícula de la planta, una estructura synapomorphic única de plantas 2, y diferentes barreras de difusión que contiene suberina. La cutícula es una capa oleófilo sintetizado por las células epidérmicas y unido a ellos a través de una capa pectináceo en el lado extracelular de la pared celular 3-5. Se recubre los órganos aéreos primarios de las plantas superiores, que funciona como una interfaz vital entre tejidos de las plantas y el medio ambiente.
Cutina, la matriz estructural de la cutícula, y suberina son dos poliésteres glicerolípido insolubles asociados con ceras disolvente extraíbles 2,4. Estos l poliméricoipids se componen de derivados de ácidos grasos saturados e insaturados y son tanto estructural como funcionalmente similar. Sin embargo, son distinguibles por diferencias características en los sitios de composición y deposición química.
Suberina es un poliéster alifático situado dentro de las paredes celulares de ciertos tejidos internos y externos que forman una pared secundaria. Tejidos suberizadas incluyen periderms de raíces, tubérculos y cortezas de árboles, endodermis de la raíz, capas de revestimiento de semillas, y las heridas cicatrizadas 2. A diferencia de la cutina, el poliéster suberina típicamente contiene alcoholes saturados y ácidos dicarboxílicos mono-insaturados, y una gran proporción de los monómeros de cadena muy larga (C≥20).
Cutina es el más abundante de poliéster de lípidos en plantas vasculares 6, y se compone de glicerol y C16-C18 derivados de ácidos grasos interesterificada, tales como ácidos grasos hidroxi e hidroxi-epoxi sustituido 4. Mientras que la composición de polímeros cutinavaría entre especies tracheophyte, los monómeros primarios más predominantes son 10, 16-dihidroxi 16: 0, 18-hidroxi-9,10-epoxi 18: 0 y 9,10,18-trihidroxi 18: 0 ácidos grasos. Curiosamente, Arabidopsis hoja y tallo cutina se componen principalmente de 18: 2 de ácido dicarboxílico 7,8.
Cutículas vegetales también presentan una variabilidad considerable en el espesor, que van desde unos pocos nanómetros a varios micrómetros 9. Desde el aislamiento de la cutícula es un paso laborioso y consume mucho tiempo, en particular para las cutículas de hojas muy delgadas, tales como los de Arabidopsis thaliana 8, los métodos que evitan el aislamiento de la cutícula se han desarrollado y validado 7,8. Aquí se describe un protocolo detallado para estudiar la composición de monómeros de cutina en hojas de Arabidopsis thaliana por metóxido sódico (NaOMe) despolimerización catalizada y / espectrometría de masas cromatografía de gases subsiguiente (GC / MS) análisis. Este protocolo ofrece un método robusto para ensayar la composition de poliésteres de lípidos en los tejidos de plantas deslipidada enteros, y ha sido adaptado de protocolos previamente reportados 7,10,11. Muestras de tejidos enteros son primero homogeneizada y exhaustivamente sin lípidos, la eliminación de los lípidos en disolventes extraíble incluyendo cuticular y ceras epicuticulares, lípidos de membrana, y triglicéridos. Residuos de la pared enriquecida de células son luego despolimerizan en sus monómeros de éster de metilo de sodio constituyentes por metanolisis catalizada por metóxido. Grasos ésteres metílicos de ácidos se extraen tras la acidificación, y derivatizarse para obtener sus derivados trimetilsililo o acetilo correspondientes. Residuos derivatizados son muy volátiles, y pueden eluirse de una columna de cromatografía de gases a una temperatura razonable sin alterar su conformación estructural durante el análisis GC / MS.
Protocolo
Nota: Este protocolo fue adaptado de Buenaventura et al. (2004), Molina et al. (2006), Li et al. (2013) 7,10,11. Los pasos 1-5 se resumen en la Figura 1.
Eliminación de lípidos 1. Tejido
Nota: Siempre enjuague toda la cristalería y las tapas con cloroformo, dejando seco bajo campana de extracción, antes de usar.
PRECAUCIÓN: Realice homogeneización del tejido y todas las etapas de transferencia de disolvente bajo campana de humos; siempre use bata de laboratorio, guantes y gafas de seguridad salpicaduras para evitar el contacto directo con productos químicos y proteger las muestras de la contaminación.
- Baño de agua Precaliente y el bloque de calor a 85 ° C.
- Pesar aproximadamente 0,5 g de cada muestra de hoja en mm x 125 tubos de ensayo de vidrio pesados previamente 20 mm con politetrafluoroetileno (PTFE) tapones de rosca -faced. Incluya cuatro réplicas por muestra.
- Coloque 2-propanol en un matraz Erlenmeyer (aproximadamente 125 ml; 25 ml por g de sample). Añadir 2,6-di-terc-butil-4-metilfenol (también conocido como hidroxitolueno butilado, BHT) a una concentración final de 0,01% (w / v).
Nota: Añadir BHT desde un 5% (w / v) solución madre en metanol (BHT ayuda a minimizar la oxidación de los ácidos grasos insaturados). - Precalentar solución de 2-propanol a 85 ° C en baño de agua.
- Añadir 12 ml de disolvente caliente 2-propanol a cada tubo de muestra y el calor durante 15 min a 85 ° C en el bloque de calor. Este paso inactiva lipasas que pueden ser liberados de células rotas.
- Deje que los tubos se enfríen a temperatura ambiente y moler el tejido a fondo con un homogeneizador hasta que se obtiene una suspensión homogénea.
- Colocar las muestras en un agitador orbital y agitar durante 1-2 horas a 100 rpm y la temperatura ambiente.
- Centrifugar durante 10 minutos a 800 xg y desechar el sobrenadante.
- Añadir un volumen igual de 2-propanol y agitar durante 12 horas a temperatura ambiente.
- Centrifugar durante 10 minutos a 800 xg y desechar el sobrenadante.
- Añadir 12 ml de CHCl 3: CH 3 OH (2: 1, v / v) al residuo (25 ml por g de muestra) y agitar durante la noche a 100 rpm y la temperatura ambiente.
- Centrifugar durante 10 minutos a 800 xg y desechar el sobrenadante.
- Añadir 12 ml de CHCl3: CH3OH (1: 2, v / v) al residuo y agitar durante la noche a 100 rpm y la temperatura ambiente.
- Centrifugar durante 10 min a 800 xg y eliminar el disolvente.
- Deje que las muestras se secan bajo campana de humos durante la noche a temperatura ambiente.
- Seque el residuo y luego se coloca en un desecador de vacío sobre CaCl 2 anhidro o CaSO 4 hasta peso constante se alcanza (3-5 días).
2. La despolimerización: metanolisis con metóxido de sodio (Figura 2)
PRECAUCIÓN: Siga los pasos 2.3 a 2.4, 2.7 a 2.8, 2.10 a 2.11, 02.13 a 02.15 y de 02.17 a 02.18 bajo campana de humos; siempre use bata de laboratorio, guantes y gafas de seguridad salpicaduras.
- Precaliente el bloque de calor a 60 ° C.
- Pesar tubos de ensayo que contienen el residuo seco (importante para los cálculos posteriores).
- Añadir estándares internos a cada tubo: 25 ωL heptadecanoato de metilo (1 mg / ml) y 25 l ω-pentadecalactona (1 mg / ml).
- Añadir 0,9 ml de acetato de metilo, 1,5 ml de metóxido de sodio, y 3,6 ml de metanol a cada tubo y la tapa ellos. Alternativamente, preparar una mezcla de reacción con estos tres reactivos y añadir partes alícuotas de 6 ml a cada muestra.
- Muestras de calor durante 2 horas a 60 ° C y agitar periódicamente en intervalos de 15 min.
- Deje que las muestras se enfríen a temperatura ambiente.
- Añadir 10 ml de dicloruro de metileno (CH 2 Cl 2) y 1,5 ml de ácido acético glacial para extraer los ésteres metílicos de ácidos grasos.
- Añadir solución salina (NaCl 0,5 M) para llenar cada tubo y la tapa.
- Muestras Vortex durante 1 min y se centrifuga durante 10 minutos a 800 x g.
- Pasar la fase orgánica (inferior) para limpiar los tubos de tamaño mediano (16 x 125 tubos de ensayo de vidrio mm con politetrafluoroetileno (PTFE) tapón de rosca -faced).
- Añadir solución salina (NaCl 0,5 M) para llenar cada tubo y la tapa.
- Muestras Vortex durante 1 min y se centrifuga durante 10 minutos a 800 x g.
- Retire fase acuosa (superior) y repita los pasos desde 2,11 hasta 2,12.
- Quite toda la fase acuosa (superior).
- Añadir sulfato sódico anhidro (Na 2 SO 4) para el disolvente, la tapa de los tubos, y de vórtice durante 1 min; muestras pueden ahora ser dejados hasta el día siguiente. En este punto las muestras se pueden dejar durante la noche bajo la campana de humos.
- Centrifugar durante 2 min a 800 xg para compactar el Na 2 SO 4 de sal en la parte inferior.
- Pasar la fase orgánica a un tubo desechable vaso pequeño (13 x 100 mm tubos de ensayo de vidrio con politetrafluoroetileno (PTFE) con tapón de rosca -faced).
- Se evapora el disolvente a sequedad bajo nitrógeno y pasar a la etapa de derivatización. Si no se procesa inmediatamente, almacenar evaporó muestras a -20 ° C (muestras pueden ser unalso almacenado antes de la etapa de evaporación).
3. Preparación de derivados para cromatografía de gases
PRECAUCIÓN: Realice los pasos 3.1.2 y 3.1.5 - 3.1.8 bajo una campana de humos; siempre use bata de laboratorio, guantes y gafas de seguridad salpicaduras.
- Derivados trimetilsililo
- Precaliente el bloque de calor a 100 ° C.
- Añadir 100 ml de piridina y 100 l de BSTFA (N, O-trimetilsilil-Bis trifluoroacetamida) a cada tubo y la tapa ellos.
- Muestras de calor a 100 ° C durante 10 minutos.
- Deje que las muestras se enfríen a temperatura ambiente.
- Evaporar las muestras en atmósfera de nitrógeno a temperatura ambiente. Evitar la aplicación de calor a las muestras, los monómeros son muy volátil en este momento.
- Añadir 500 l de 1: 1 (v / v) de heptano: tolueno.
- Muestras Vortex durante 1 min y centrifugar durante 2 minutos a 800 x g.
- Añadir muestras a viales de GC y proceder al análisis mediante GC / MS.
- Acetiloderivados
Nota: Para la acetilación, modificar pasos 3.1.1-3.1.3 por encima de la siguiente manera (no mostrado en video); 3.1.4-3.1.8 pasos son los mismos:- Precaliente el bloque de calor a 60 ° C.
- Añadir 100 l de piridina y 100 l de anhídrido acético (Ac 2 O) a los tubos.
- Muestras de calor 1 hora a 60 ° C.
4. GC / MS Análisis
- Utilice una columna HP-5 capilar (30 mx 0,25 mm x 0,25 m de espesor de película) o equivalente (es decir., 5% difenil, 95% dimetilpolisiloxano). Programa de la GC con flujo de gas portador de helio fijado en 1,5 ml / min y la temperatura del horno programada de 150 a 300 ° C a 3 ° C / min.
- Utilice la inyección split (relación 01:10 split) y establecer espectrómetro de masas al modo escanear a través de 40-600 amu (ionización por impacto de electrones).
- Crear una tabla de secuencia que incluye solvente (en blanco), WT y repeticiones mutantes, cada uno usando el método de análisis de la cutina se indica.
- Disolvente de cargay viales de muestra en el carrusel, añadir hexano a viales de jeringa-lavado en el inyector automático si es necesario, y empezar la secuencia. Después de que se completó la secuencia, el total de trazas cromatograma de iones están disponibles para todas las muestras.
Análisis 5. Datos
- Identificar monómeros de poliéster lípido comparando el espectro de masas de cada pico de publicada espectros de masas o buscando una biblioteca comercial si está disponible.
- Para cada pico identificado en el cromatograma corriente iónica total, el uso de sus respectivos tiempos de retención para encontrar las áreas en la tabla de resultados de integración del software de GC / MS (Figura Suplementario 1).
- Para cada monómero (columnas AB), agregue los valores de área se encuentran en la mesa de la integración (Figura Suplementario 1, columna D) a la columna correspondiente para cada replicar muestra en la tabla de Excel de monómeros (Archivo Suplementario 2, columnas CF), que es una hoja de cálculo para cuantificar Arabidopsisderivados cutina TMSi. Utilice Suplementario Archivo 3 si los derivados acetilados se preparan en su lugar.
- Añadir las áreas de cada patrón interno (IS) a las columnas de SI (HK). Para aquellos monómeros que no están derivatizados, ésteres metílicos saber de ácidos grasos (FAME), y ésteres de dimetilo ácido dicarboxílicos (DCA EMD), utilice 17: 0 FAME (IS1) como está para cuantificación (células-púrpura sombreada en la tabla de monómero; Suplementario Archivos 2/3). Para monómeros hidroxilados, incluyendo alcoholes primarios, ácido ferúlico y ácidos ω-hidroxi, utilizar 15: 0 FAME 15-hidroxi (IS2) de IS de elección para la cuantificación compuesto (células verdes shadded en la tabla de monómero; Archivos Suplementario 2/3) .
- Añadir peso de la hoja seca para cada replicar a las columnas AX-BA (Archivo Suplementario 2) o AQ-AT (Suplementario Archivo 3); alternativamente, escanear hojas para calcular áreas de superficie y añadir valores de área a la mesa de monómero de expresar cargas de monómero por unidad deárea de superficie.
Resultados
El protocolo se describe en este manuscrito está configurado para determinar monómeros de poliéster de lípidos, reduciendo al mínimo las contribuciones de lípidos no cutina 10 Figura 1 presenta una visión general del ensayo, que tiene en total entre 8 (es decir, cutina o suberina.) -. 10 día (desde la recolección inicial del tejido a la obtención de los datos de GC), dependiendo de cómo de largo muestras se dejan secar.
El método para despolimerizar poliésteres metanolisis catalizada por una base seleccionada (Figura 2) fue validado previamente para semillas de Arabidopsis, que contienen tanto la cutina y suberina. Los tejidos se homogeneizaron primera y exhaustivamente delipidated para eliminar los lípidos extraíbles con disolventes. El rendimiento residuo después de la extracción, como porcentaje del peso fresco inicial, es por lo general un 6% para A. thaliana Col-0 hojas. Residuos de la pared enriquecida de células se secan en un desecador de vacío y luego despolimerizan en sus monómeros de éster de metilo por constituyentescatalizada por base de transmetilación. Incubación de dos horas fue elegido como el momento crítico requerido para la despolimerización y recuperación de componentes de poliéster de lípidos adecuada. Tiempos de incubación más largos dieron lugar a aumento de los ácidos 2-hidroxi; éstos potencialmente derivan de esfingolípidos membrana 10.
Un cromatograma típico si Arabidopsis de tipo salvaje de la hoja cutina se muestra en la Figura 3, para los derivados O -TMSi éter (Figura 3A) y los derivados O acetil (Figura 3B). Cada pico fue identificado por comparación con los espectros de masas de la literatura 7,8 y una base de datos pública 12 protocolo de vídeo .Our muestra cómo preparar derivados TMSi, pero las muestras, alternativamente, puede ser acetilado para derivatizar grupos hidroxilo. Derivados sililados son buenas para fines de identificación porque dan espectros de masas de diagnóstico. Sin embargo, los derivados acetilados son más estables y una buena alternativa a sililaciónmonómeros una vez se han identificado 10. Para ayudar a implementar este protocolo en los laboratorios que sólo han GC acoplado al detector de ionización de llama (FID), GC / FID rastros correspondientes a derivados acetilados de WT monómeros hoja cutina y a una serie de homólogos de las normas de ésteres metílicos de ácidos grasos son también muestra (Figura Suplementario 4).
Este método es cualitativo y detecta diferencias cuantitativas entre las muestras, por lo tanto, su valor para el análisis de mutantes. Las cantidades de monómeros individuales se determinan utilizando el método estándar interno de cuantificación, lo que permite comparaciones de la abundancia de monómero entre las muestras. Debe aclararse, sin embargo, que el tamaño máximo (recuento total de iones) puede no reflejar las relaciones molares de los monómeros en el poliéster. Estamos incluyendo tablas editables de monómeros para calcular cantidades de monómero en la hoja de Arabidopsis cutina como ésteres metílicos de ácidos grasos y derivados TMSi (Archivo Suplementario 1), o as derivados tyl (Archivo Suplementario 2) de los alcoholes. Estas tablas pueden necesitar ser adaptados si las muestras se extraen de diferentes órganos o especies de plantas.
A modo de ejemplo, hemos analizado Arabidopsis thalia na Columbia (Col-0) hojas de tipo salvaje y dos alelos nulos mutante previamente caracterizados del gen CYP86A2 / ATT1, att1-1 (m-1) y att1-2 (m-2 ) 13,14. Monooxigenasas del citocromo P450 de la subfamilia CYP86A codifican putativos omega-oxidasas y participa en suberina y la biosíntesis de monómero cutina. Nuestros resultados (Figura 4) demuestran reducciones significativas en las cargas de los tres principales monómeros de lípidos en las hojas mutantes en comparación con las hojas WT. En consonancia con la función de la enzima predicho, 16: 0, 18: 2, y 18: 1 dicarboxilatos se vieron afectados específicamente en los mutantes Att1.
"Src =" / files / ftp_upload / 53386 / 53386fig1.jpg "/>
Figura 1. Visión general de análisis de poliéster de lípidos. Haga clic aquí para ver una versión más grande de esta figura.
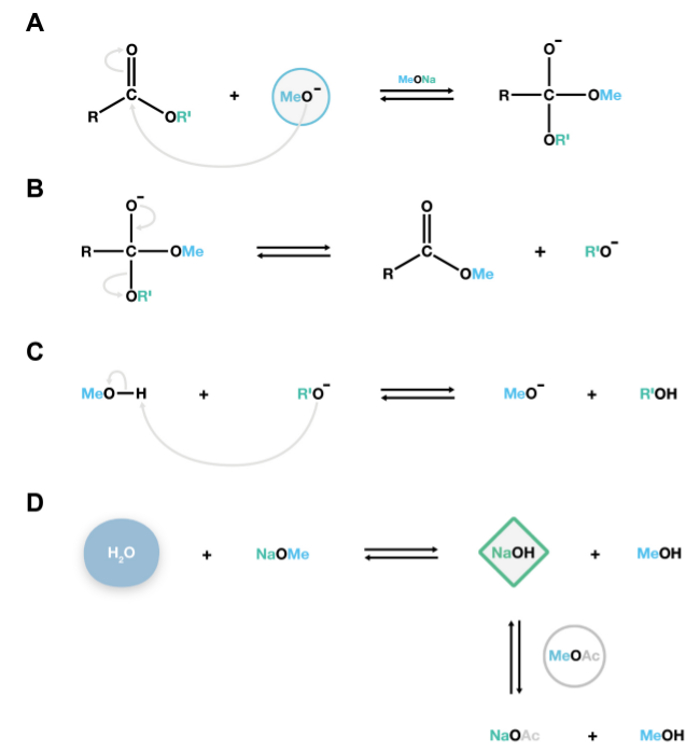
Figura 2. Mecanismo de la reacción de transmetilación catalizada por NaOMe. Los aniones nucleófilos metóxido atacar el carbono cabonyl de poliésteres de lípidos para formar una inestable intermedio tetraédrico (A), que se disocia fácilmente en ésteres metílicos de ácidos grasos y aniones alcóxido (B). Estos alcóxidos son bases conjugadas, y reaccionan con metanol, la regeneración de los aniones metóxido catalíticamente activos, sosteniendo así reacciones de despolimerización adicionales (C). Si el agua está presente en elsistema, reaccionará con metóxido de sodio para formar hidróxido de sodio, una base fuerte que hidroliza irreversiblemente ésteres para producir ácidos grasos libres indeseables. Acetato de metilo se añade como un co-disolvente 15 para eliminar pequeñas cantidades de hidróxido de sodio en el sistema (D). Haga clic aquí para ver una versión más grande de esta figura.
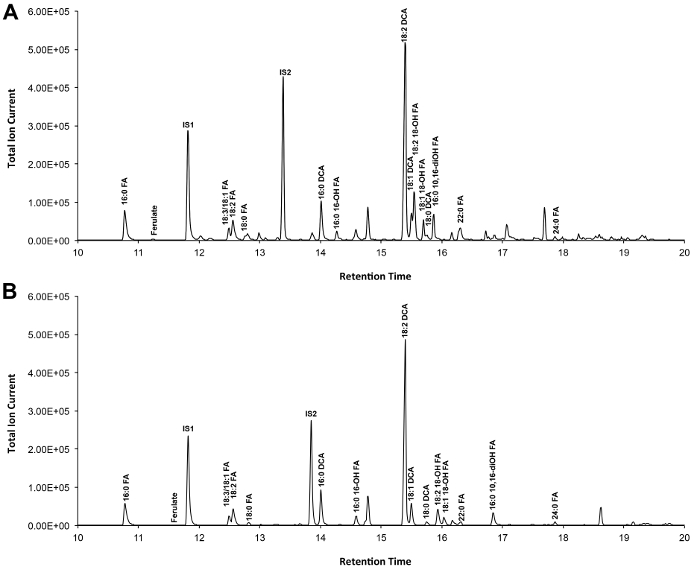
Figura 3. Representante cromatograma iónico total de tipo salvaje de la hoja de Arabidopsis thaliana monómeros cutina. (A) O trimetilsilil (TMSi) éter y derivados hidroxilo de etilo (B). Haga clic aquí para ver una versión más grande de esta figura.
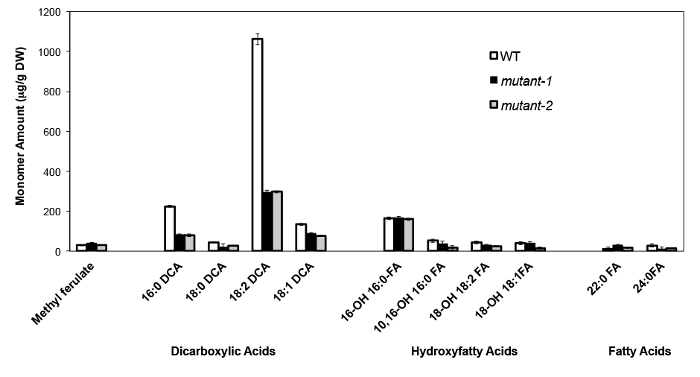
Figura 4. cutina composición de monómero de WT Arabidopsis thaliana y dos alelos mutantes nulos del gen CYP86A2. (Mutante-1 = att1-1; mutante-2 = att1-2) Las barras de error representan la desviación estándar de la media (n = 4) . Adaptado de 13, con el permiso de © Blackwell Publishing (2007). Haga clic aquí para ver una versión más grande de esta figura.
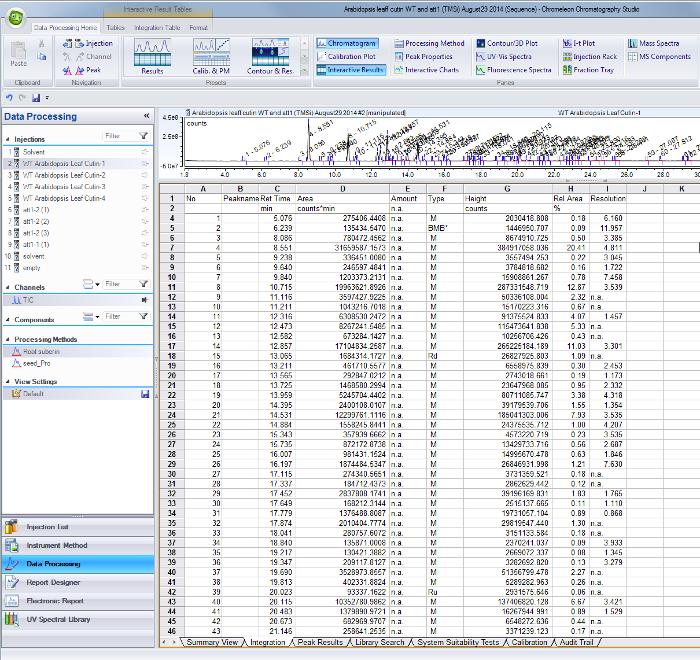
Adicional Figura 1. Pico resultados integración tabla de la GC de software / MS. Los picos correspondientes a los monómeros identificados y normas internas se identifican por su retenti a tiempo (columna C) y valores de área se tabulan en la columna D. Por favor haga clic aquí para descargar este archivo.
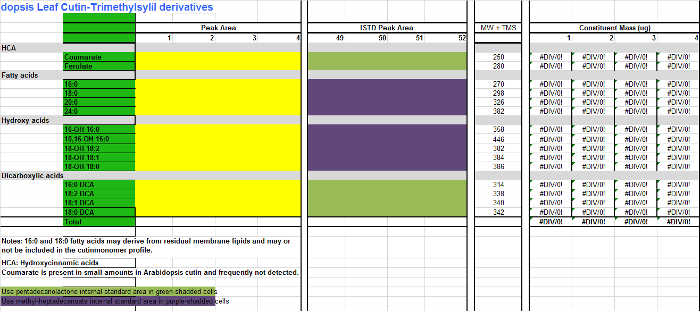
Suplementario Archivo 2. Tabla de Arabidopsis monómeros cutina (derivados de éter trimetilsilil de ésteres metílicos de ácidos grasos hidroxi). Por favor, haga clic aquí para descargar este archivo.
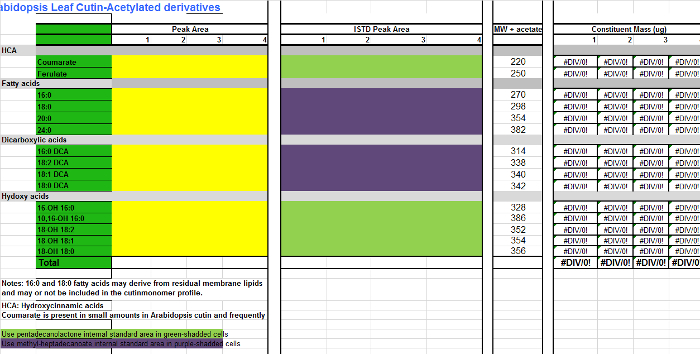
Suplementario Archivo 3. Tabla de Arabidopsis monómeros cutina (derivados O acetil de ésteres metílicos de ácidos grasos hidroxi).com / files / ftp_upload / 53386 / Supplemental_File_3_Cutin_template_Acetylated_derivatives.xlsx "target =" _ blank "> Haga clic aquí para descargar este archivo.
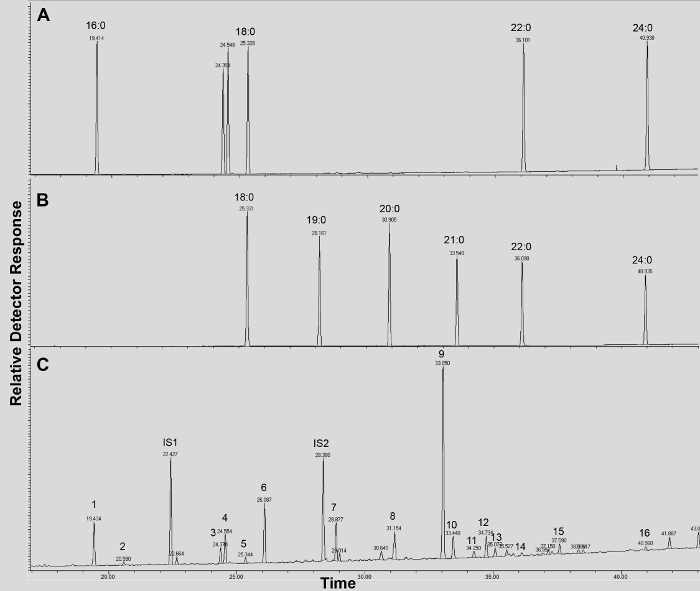
Adicional Figura 4. GC / FID rastros de (AB) de éster metílico de ácido graso (FAME) estándares índice de retención (picos están etiquetados con cada longitud de cadena saturada FAME); y (C) acetilado A. thaliana hoja WT monómeros cutina. Números en pico corresponden a: 16: 0 FAME (1), ferulato (2), 18: 3 FAME (3), 18: 1/18: 2 FAMEs (4), 18: 0 FAME (5), sinapate (6 ), 16: 0 DCA (7), 16-OH 16: 0 FAME (8), 18: 2 DCA (9), 18: 1 DCA (10) 18: 0 DCA (11), 18-OH 18: 2 FAME (12), 18-OH 18: 1 FAME (13), 20: 0 FAME (14), 10,16-diOH 16: 0 FAME (15), 24: 0 FAME (16). DCA: dimetil éster del ácido dicarboxílico; FAME: éster metílico de ácidos grasos; IS1: estándar interno 1, 17: 0 FAME; IS2: st internaAndard 2, 15-OH 15: 0 FAME. Haga clic aquí para descargar este archivo.
Discusión
A diferencia de otros biopolímeros tales como ADN y proteínas, lípidos poliésteres planta no están hechos de una plantilla. En cambio, sus composiciones dependen de la especificidad de las enzimas presentes en los tejidos que hacen que estos polímeros extracelulares. Como analiza tal, química del componente componentes son fundamentales para entender la composición de poliéster de lípidos.
Los métodos químicos para escindir enlaces éster incluyen saponificación, hidrogenolisis, transmetilación catalizada por ácido, y catalizada por base de transmetilación 2. Cada uno de ellos tiene sus ventajas y desventajas. La saponificación produce hidroxi ácidos grasos libres que pueden sufrir reacciones secundarias. La hidrogenólisis con hidruro de litio y aluminio (LiAlH 4) 16 se ha utilizado para el análisis de la cutina 7. Hidrogenólisis reduce carbonos funcionalizados a los alcoholes y las estructuras originales deben ser inferida por deuteriolysis con deuteruro de litio y aluminio (LiAlD 4). losdesventaja de este enfoque es el requisito de alta resolución GC / MS para comparar el grado de deuteriation de los polioles grasos obtenidos de hacer las asignaciones de sus estructuras. Transesterificación catalizada por ácido con trifluoruro de boro en metanol (BF 3) se ha utilizado con frecuencia en cutina y suberina depolymerizations 8,17,18, pero el reactivo tiene una vida útil limitada y puede introducir artefactos debido a reacciones secundarias 15. Ácido sulfúrico metanólico también produce ésteres metílicos de los monómeros, pero con una mayor proporción de ácidos grasos 2-hidroxi, que presumiblemente no son verdaderos componentes de poliéster de lípidos, en comparación con otros métodos 10.
El método de transesterificación catalizada por NaOMe descrito en este protocolo produce ésteres metílicos de ácidos grasos que se derivan mediante sililación de grupos hidroxilo, proporcionando espectros de masas característica para la identificación, o por acetilación para proporcionar derivados más estables de grupos hidroxilo for cuantificación. Un inconveniente de esta técnica es que la hidrólisis compite con transesterificación cuando el agua está presente en la reacción. El agua reacciona con NaOMe (el catalizador) y produce NaOH, que a su vez hidroliza ésteres metílicos de ácidos grasos para producir ácidos libres (Figura 2D). Esta es una reacción secundaria indeseable porque dos picos estarán presentes para cada ácido graso: un éster de metilo y un derivado de éster TMSi, lo que complica el análisis. El uso de reactivos anhidros y la adición de acetato de metilo como un co-disolvente para competir con la saponificación son por lo tanto cruciales pasos para evitar la hidrólisis (Figura 2D).
Cutina y suberina contienen entre 1 y 26% de glicerol 4. Sin embargo, este monómero no será detectada por las condiciones experimentales descritas en este protocolo. El glicerol es altamente hidrofílico y, a diferencia de los monómeros de éster metílico de ácidos grasos, será eliminado durante los pasos de lavado de disolventes acuosos. Esta limitación también unaS e aplica a otros métodos de despolimerización cutina, pero glicerol se pueden determinar en la capa acuosa obtenida después de la transesterificación utilizando un método enzimático. Alternativamente, se puede cuantificar utilizando condiciones más suaves (por ejemplo., 0,05 M NaOMe) sin más la extracción de agua para detectar todos los monómeros, incluyendo glicerol 19,20 .Aunque útiles para el propósito de la cuantificación de glicerol, condiciones suaves suelen dar despolimerización incompleta de la cutina y suberina.
Si un GC acoplado a un detector de ionización de llama (FID) está disponible, todas las repeticiones pueden ser analizados en este instrumento con fines cuantitativos, después de los picos de una muestra representativa han sido identificados por GC / MS. Alternativamente, los monómeros en los GC / FID huellas se pueden identificar si se conocen sus índices de retención. El detector de ionización de llama tiene especialmente una alta sensibilidad y una amplia gama de proporcionalidad, que es crítico para la cuantificación de mayores y menores componentes de la muestraen carreras individuales. Además, es robusto y fácil de mantener y operar 15.
El protocolo descrito permite la fiable y reproducible aislamiento, la identificación y la cuantificación de monómeros de poliéster de lípidos de la planta, lo que permite la caracterización química de los mutantes que difieren en la composición de uno o más monómeros de poliéster de lípidos. El procedimiento es escalable, puede ser fácilmente adaptado para procesar tanto pequeñas como cantidades a granel de diversos materiales de plantas, incluyendo semillas, raíces, hojas, tallos y flores. Datos espectrales de masa de monómeros de poliéster de lípidos de muchas especies se han publicado, por ejemplo., 21-26 y constituyen valiosos recursos para identificar monómeros desconocidos al adaptar este protocolo a otros tejidos y / o especies. Este método es aplicable a las investigaciones de la biosíntesis, regulación y distribución de poliésteres de lípidos en las plantas superiores.
Divulgaciones
No conflicts of interest declared.
Agradecimientos
This work was supported by a Natural Sciences and Engineering Research (NSERC)-USRA grant to S.J., and by an NSERC-Discovery Grant to I.M. We thank Richard Bourgault, Meghan Rains, and Amanda Fluke for technical assistance. Seeds of att1-1 and att1-2 mutants were kindly provided by Dr. Jian-Min Zhou, Institute of Genetics and Developmental Biology, Beijing, China.
Materiales
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-propanol | Fisher Scientific | BPA451-4 | Solvent for delipidation |
| Anhydrous sodium sulfate | Fisher Scientific | S421500 | |
| Acetic anhydride | Sigma Aldrich | 320102 | Derivatization agent |
| BSTFA (N,O-bis(trimethylsilyl)-trifluoroacetamide) | Sigma-Aldrich | 15222 | Derivatization agent |
| Butylated hydroxytoluene (BHT) | Sigma-Aldrich | 101162 | Antioxidant |
| Calcium chloride, anhydrous | Fisher Scientific | C614-3 | Desiccation agent |
| Calcium suflate, anhydrous (DRIERITE- 8 MESH with indicator) | Acros Organics | 219090020 | Desiccation agent |
| Chloroform (Trichloromethane) | Fisher Scientific | C6074 | Organic solvent |
| Glacial acetic acid | Fisher Scientific | BP2401212 | Acidification agent |
| Helium carrier gas, compressed | Air Liquide | ALPHAGAZ1-UN1046 | Carrier gas, GC/MS |
| Heptane | Fisher Scientific | H3501 | Organic solvent |
| Hexanes | Fisher Scientific | H3024 | Organic solvent |
| Methanol | Fisher Scientific | A4124 | Organic solvent, transmethylation reactive |
| Methyl acetate | Sigma-Aldrich | 296996 | Organic solvent |
| Methyl heptadecanoate | Sigma-Aldrich | H4515 | Internal standard (1mg/mL stock) |
| Methylene dichloride (Dichloromethane) | Fisher Scientific | D374 | Organic solvent |
| Nitrogen, compressed | Air Liquide | ALPHAGAZ1-UN1044 | Carrier gas, GC-FID |
| Pentadecanolactone | Fluka | 76530 | Internal standard (1 mg/ml stock) |
| Pyridine | Sigma-Aldrich | 270970 | Co-solvent for derivatization |
| Sodium chloride | Fisher Scientific | BP358212 | Saline solution |
| Sodium methoxide (25wt.%) | Sigma-Aldrich | 156256 | Nucleophile |
| Toluene | FIsher Scientific | T2904 | Organic solvent |
| Plant Growth Supplies | |||
| Pro-Mix PGX | Premier Tech Horticulture Ltd | Pro-Mix PGX is recommended to grow Arabidopsis plants (Eddy, R. and Hahn, D.T., 2012,http://docs.lib.purdue.edu/pmag/2) Purdue Methods for Arabidopsis Growth. | |
| PermaNest Humidity Dome | Grower's Solution, LLC, Cookeville, TN | GD2211-24 | |
| Perma-Nest Plant Trays (22x11in) | Grower's Solution, LLC, Cookeville, TN | N/A | |
| Square greenhouse pots, 3.5 inch | Grower's Solution, LLC, Cookeville, TN | P86 | |
| General Purpose Plant Fertilizer, Plant-Prod 20-20-20 | Premier Tech Home and Garden In., Brantford, ON | N/A | |
| Glassware | |||
| 13 x 100 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-13100 | |
| 16 x 125 mm glass test tube with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-16125 | |
| 20 x 125 mm glass test tubes with Teflon-faced screw cap | Kimble Chase Life Science and Research Products LLC | 45066A-20125 | |
| GC vial caps | National Scientific | C400051A | |
| GC vial microinserts | National Scientific | C4011631 | |
| GC vials | National Scientific | C40001 | |
| Disposable pasteur pipets | Fisher Scientific | 1367820B | |
| Flasks | Fisher Scientific | ||
| Equipment | |||
| Allegra X15R centrifuge | Beckman Coulter | ||
| Analytic balance | Fisher Scientific | ||
| Belly dancer | A shaker can be used for this purpose if Belly Dancer not available | ||
| DB-5 Capillary GC column | J&W Scientific, CA, USA; | 30 m x 0.25 mm x 0.25 μm film thickness | |
| Desiccator | |||
| Isotemp 202 water bath | Fisher Scientific | ||
| ISQ LT single quadupole mass spectrometer | Thermo Scientific | ||
| Heat block | Fisher Scientific | ||
| Nitrogen evaporator | |||
| Polytron homogenizer | Birkmann | ||
| Trace 1300 gas chromatograph | Thermo Scientific | ||
| Two-stage regulator | Air Liquide | Q1-318B-580 | |
| Vacuum desiccator | Fisher Scientific | ||
| Vortex mixer | Fisher Scientific |
Referencias
- Kolattukudy, P. Biopolyester membranes of plants: cutin and suberin. Science. 208 (4447), 990-1000 (1980).
- Kolattukudy, P. E. Polyesters in higher plants. Adv. Biochem. Eng. Biot. 71, 1-49 (2001).
- Yeats, T. H., Rose, J. K. C. The formation and function of plant cuticles. Plant Physiol. 163 (1), 5-20 (2013).
- Pollard, M., Beisson, F., Li, Y., Ohlrogge, J. B. Building lipid barriers: biosynthesis of cutin and suberin. Trends Plant Sci. 13 (5), 236-246 (2008).
- Beisson, F., Li-Beisson, Y., Pollard, M. Solving the puzzles of cutin and suberin polymer biosynthesis. Curr. Opin. Plant Biol. 15 (3), 329-337 (2012).
- Heredia, A. Biophysical and biochemical characteristics of cutin, a plant barrier biopolymer. Biochim. Biophys. Acta. 1620 (1-3), 1-7 (2003).
- Bonaventure, G., Beisson, F., Ohlrogge, J., Pollard, M. Analysis of the aliphatic monomer composition of polyesters associated with Arabidopsis epidermis: occurrence of octadeca-cis-6, cis-9-diene-1, 18-dioate as the major component. Plant J. 40 (6), 920-930 (2004).
- Franke, R., et al. Apoplastic polyesters in Arabidopsis surface tissues - A typical suberin and a particular cutin. Phytochemistry. 66 (22), 2643-2658 (2005).
- Vogg, G., et al. Tomato fruit cuticular waxes and their effects on transpiration barrier properties: functional characterization of a mutant deficient in a very-long-chain fatty acid -ketoacyl-CoA synthase. J. Exp. Bot. 55 (401), 1401-1410 (2004).
- Molina, I., Bonaventure, G., Ohlrogge, J., Pollard, M. The lipid polyester composition of Arabidopsis thaliana and Brassica napus seeds. Phytochemistry. 67 (23), 2597-2610 (2006).
- Li-Beisson, Y., et al. Acyl-lipid metabolism. The Arabidopsis Book. 11, e0161 (2013).
- Molina, I., Ohlrogge, J. B., Pollard, M. Deposition and localization of lipid polyester in developing seeds of Brassica napus and Arabidopsis thaliana. Plant J. 53 (3), 437-449 (2008).
- Xiao, F., et al. Arabidopsis CYP86A2 represses Pseudomonas syringae type III genes and is required for cuticle development. EMBO J. 23 (14), 2903-2913 (2004).
- Christie, W. W., Han, X. . Lipid Analysis - Isolation, Separation, Identification and Lipidomic Analysis. , 446 (2010).
- Walton, T. J., Kolattukudy, P. E. Determination of the structures of cutin monomers by a novel depolymerization procedure and combined gas chromatography and mass spectrometry. Biochemistry. 11 (10), 1885-1896 (1972).
- Matzke, K., Riederer, M. A comparative study into the chemical constitution of cutins and suberins from Picea abies (L.) Karst., Quercus robur L., and Fagus sylvatica L. Planta. 185 (2), 233-245 (1991).
- Riederer, M., Schönherr, J. Quantitative gas chromatographic analysis of methyl esters of hydroxy fatty acids derived from plant cutin. J. Chromatogr. 360, 151-161 (1986).
- Moire, L., Schmutz, A., Buchala, A., Yan, B., Stark, R., Ryser, U. Glycerol Is a Suberin Monomer. New Experimental Evidence for an Old Hypothesis. Plant Physiol. 119 (3), 1137-1146 (1999).
- Graça, J., Schreiber, L., Rodrigues, J., Pereira, H. Glycerol and glyceryl esters of omega-hydroxyacids in cutins. Phytochemistry. 61 (2), 205-215 (2002).
- Eglinton, G., Hunneman, D. H. Gas chromatographic-mass spectrometric studies of long chain hydroxy acids-I: The constituent cutin acids of apple cuticle. Phytochemistry. 7 (2), 313-322 (1968).
- Espelie, K. E., Köller, W., Kolattukudy, P. E. 9,16-dihydroxy-10-oxo-hexadecanoic acid, a novel component in citrus cutin. Chem. Phys. Lipids. 32 (1), 13-26 (1983).
- Holloway, P. J. Intracuticular lipids of spinach leaves. Phytochemistry. 13 (10), 2201-2207 (1974).
- Holloway, P. J., Deas, A. H. B. Epoxyoctadecanoic acids in plant cutins and suberins. Phytochemistry. 12 (7), 1721-1735 (1973).
- Holloway, P. J., Cutler, D. F., Alvin, K. L., Price, C. E. . The chemical constitution of plant cutins. , 45-85 (1982).
- Croteau, R., Fagerson, I. S. The constituent cutin acids of cranberry cuticle. Phytochemistry. 11 (1), 353-363 (1972).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados