Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imaging radiométrica de pH extracelular en los biofilms dentales
En este artículo
Resumen
Un colorante radiométrica sensible al pH se usa en combinación con microscopía confocal de barrido láser y análisis digital de imágenes para monitorizar el pH extracelular en biofilms dentales, en tiempo real.
Resumen
El pH en las biopelículas bacterianas en los dientes es de importancia central para la caries dental, una enfermedad con una alta prevalencia en todo el mundo. Los nutrientes y metabolitos no se distribuyen uniformemente en las biopelículas dentales. Una compleja interacción de sorción para y la reacción con la materia orgánica en la biopelícula reduce los caminos de difusión de solutos y crea gradientes empinados de moléculas reactivas, incluyendo ácidos orgánicos, a través de la biopelícula. métodos microscópicos fluorescentes cuantitativos, tales como formación de imágenes tiempo de vida de fluorescencia o ratiometry pH, se pueden emplear para visualizar pH en diferentes microambientes de biofilms dentales. ratiometry pH explota un cambio dependiente del pH en la emisión fluorescente de los colorantes sensibles al pH. Cálculo de la relación de emisión a dos longitudes de onda diferentes permite determinar pH local en imágenes microscópicas, independientemente de la concentración del colorante. Contrariamente a la técnica de microelectrodos permite la monitorización ambos gradientes de pH verticales y horizontales, en tiempo real conperturbar mecánicamente el biofilm. Sin embargo, se debe tener cuidado para diferenciar con precisión entre los compartimentos extra e intracelulares de la biopelícula. Aquí, el colorante radiométrica, seminaphthorhodafluor 4F-5- (y 6) el ácido carboxílico (C-SNARF-4) se emplea para controlar el pH extracelular en vivo en los biofilms dentales cultivadas de la composición de especies desconocidas. Tras la exposición a la glucosa es el colorante concentrado hasta el interior de todas las células bacterianas en las biopelículas; se utiliza de este modo tanto como una mancha bacteriana universal y como un marcador de pH extracelular. Después de la adquisición de imagen microscópica confocal, la biomasa bacteriana se elimina de todas las imágenes utilizando software de análisis de imagen digital, que permite calcular exclusivamente pH extracelular. ratiometry pH con el colorante radiométrico es muy adecuado para estudiar pH extracelular en biofilms delgadas de hasta 75 m de espesor, pero está limitado al intervalo de pH entre 4,5 y 7,0.
Introducción
El método aquí descrito permite el seguimiento de pH extracelular en biofilms dentales en el intervalo entre 4,5 y 7, usando el colorante radiométrica seminaphthorhodafluor-4F 5- (y-6) ácido carboxílico (C-SNARF-4) en combinación con microscopía confocal de barrido láser y análisis de imagen digital. El colorante fluorescente empleado es sensible al pH y muestra un cambio en su emisión fluorescente en función del estado de protonación. La emisión fluorescente de los picos de moléculas protonadas en 580 nm, y la emisión de la molécula desprotonado a 640 nm 1. La relación de las intensidades de emisión fluorescente en dos ventanas de detección que comprende los dos picos de emisión (576-608 nm y 629-661 nm) refleja así pH en la fase líquida, con independencia de la concentración de colorante. Con un pK a de ~ 6,4 el colorante es adecuado para visualizar pH en ambientes moderadamente ácidas.
PH en las biopelículas bacterianas es de vital importancia para todos los procesos metabólicos.En el caso de biofilms dentales, pH en la matriz extracelular es el factor de virulencia clave para el desarrollo de la caries dental. Los períodos prolongados con un pH bajo en la interfaz de plomo-biopelícula dental para frenar la desmineralización del esmalte subyacente 2. Debido a la compleja arquitectura tridimensional de biofilms, metabolitos, incluyendo ácidos orgánicos, no se distribuyen uniformemente a través de la biopelícula. Altamente y menos microambientes acidogénicas se pueden encontrar en estrecha proximidad espacial 3.
Durante décadas, los gradientes de pH verticales en biofilms se registraron con la ayuda de microelectrodos 4-6. Mientras que ofrecen una buena resolución espacial debido a su pequeño tamaño de la punta, no son muy adecuados para controlar los gradientes horizontales. Por otra parte, la inserción del electrodo perturba el biofilm mecánicamente. Cuantitativos técnicas microscópicas fluorescentes ofrecen la ventaja de visualizar los cambios de pH en las diferentes áreas de un biofilm sin interferir mecánicana vez. Diferentes campos microscópicos de vista se pueden seleccionar libremente y la imagen varias veces durante periodos prolongados 1,7-9. Sin embargo, al interpretar imágenes microscópicas de biofilm, es importante distinguir entre la fluorescencia que deriva de la biomasa microbiana y la fluorescencia derivada del espacio extracelular. En condiciones ácidas, el pH dentro de las células bacterianas es diferente de pH en la matriz extracelular, como las bacterias transportan activamente protones a través de su membrana celular a expensas de trifosfato de adenosina 10. En el contexto de la caries dental, pH intracelular bacteriana no tiene un impacto directo sobre el esmalte mientras que subyacen bajo pH extracelular conduce a la desmineralización. Un promedio de pH en imágenes microscópicas que contienen ambas áreas y bacterias libres de bacterias conduce a resultados erróneos. El uso de otros a lo largo de las manchas con el colorante sensible al pH con el fin de visualizar la biomasa bacteriana y diferenciar entre las áreas extra e intracelulares trae abel riesgo de contaminación fluorescente del espacio extracelular y mediciones falsas 11.
Por consiguiente, la presente manuscrito describe el uso del colorante radiométrico en una doble función; tanto como un marcador de pH y como una mancha bacteriana universal. A medida que el tinte es up-concentra en las células bacterianas, la combinación de imágenes microscópicas confocal y un procedimiento de análisis de imagen digital precisa permite la determinación de pH extracelular en el intervalo entre 4,5 y 7,0 en las biopelículas dentales delgados.
Protocolo
El protocolo experimental fue revisado y aprobado por el Comité de Ética del Condado de Aarhus (M-20100032).
1. confocal microscópica de calibración radiométrica del tinte
- Para la adquisición de imágenes, usar un microscopio invertido confocal equipado con una incubadora, un objetivo de inmersión en agua apertura 63X / 1.2-numérico, una línea láser de 543 nm y un detector de META.
- Preparar tampón HEPES soluciones madre (50 mM, ajustado a pH 4.5 a 8.5 en pasos de 0,1 unidades de pH). Pipetear 100 l de cada solución en los pocillos de una placa de 96 pocillos de fondo transparente para microscopía fluorescente.
- Use guantes de nitrilo al manipular el medio de contraste radiométrico C-SNARF-4. Preparar una solución madre 1 mM del colorante en sulfóxido de dimetilo. Añadir 5 l de la solución madre a cada pocillo con tampón HEPES. Coloque la placa de 96 pocillos en el microscopio.
- Encienda el microscopio. Abra el software de microscopio. Haga clic en los siguientes paneles: Adquirir → Laser; Adquirir → MICRO; Adquirir → Config; Adquirir → Scan; Adquirir → escenario. Calentar la incubadora a 37 ° C.
- Encienda la línea de láser 543 nm haciendo clic en el láser de 543 nm y el botón "Sí" en la ventana "Control de láser". Elija el objetivo de inmersión en agua apertura 63X / 1.2-numérico en la ventana "Control microscopio".
- Ajuste el detector de META para monitorear simultáneamente fluorescencia dentro de 576- a 608-nm (verde) y 629- a 661 nm (rojo) intervalos ( "Control de Configuración" → "ChS"). Ajustar la potencia del láser ( "Control de Configuración" → "excitación"). Ajuste el agujero de alfiler para dar un grosor de corte óptico de 1,6 micras ( "Scan Control" → "agujero de alfiler").
- Adquirir una imagen de cada solución tampón de HEPES, 5 m por encima del fondo de cristal de la placa de 96 pocillos. Nota: Tan pronto como el plano de enfoque se sitúa por debajo del fondo de cristal, no hay luz fluorescente puede ser vistoen la pantalla. Después de cada tercera imagen, ajustar la potencia del láser a cero y tomar una imagen de la sustracción del fondo.
- Realizar el experimento de calibración por triplicado (1,2-1,7).
- Determinar la intensidad de fluorescencia media y la desviación estándar en todas las imágenes rojas y verdes.
- Calcular la relación R y el error estándar de la media, S R, para cada imagen de acuerdo con las ecuaciones (1) y (2)
(1)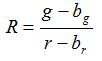
(2)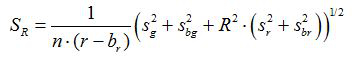
g, r, s g r y s son los promedios y las desviaciones estándar en las respectivas imágenes de verde y rojo. b g, b R, S y BG s br son los valores correspondientes para las imágenes de fondo. n 2 es el número de píxeles de imágenes. - Trazar las relaciones calculadas para cada valor de pH de los tres experimentos de calibración se replican en un diagrama y construir una curva ajustada de esta serie de puntos de datos (es decir, utilizando el software Sigma Plot 13). Hacer una función matemática de la curva ajustada que puede convertir fracciones en valores de pH 10.
- Calcular la relación R y el error estándar de la media, S R, para cada imagen de acuerdo con las ecuaciones (1) y (2)
2. Recogida de muestras in situ Grown Dental Biofilm
- Seleccionar voluntarios que cumplen los criterios de inclusión y exclusión relevantes para el estudio. Hacer impresiones de alginato de la arcada dentaria superior e inferior. Hacer modelos de yeso de estas impresiones y fabricar una férula de acrílico en el maxilar inferior. El diseño de la férula con bridas de acrílico bucales conectadas por un alambre de ortodoncia lingual, que permite al voluntario para morder en una oclusión normal 12.
- Recesiones agujeros en las bridas bucales de la férula acrílica (Figura 1 ) Con la ayuda de fresas de acrílico dental para permitir la inserción de los ladrillos de vidrio para la recogida de biofilm. La profundidad de las recesiones debe ser de al menos 1,5 mm, mientras que la anchura y la longitud de las recesiones pueden variar en función del número de los ladrillos de vidrio que debe insertarse.
- Para la recolección de biofilm, los usos finales hechos a la medida no fluorescentes de vidrio (4 x 4 x 1 mm 3) con una rugosidad superficial de grano 1200 con el fin de imitar el patrón de colonización en esmalte natural 11.
- Esterilizar las planchas de vidrio por tratamiento en autoclave antes del montaje. Montar las placas de vidrio con cera pegajosa en las depresiones en las bridas bucal de cada lado un poco empotradas a la superficie de la superficie acrílica con el fin de proteger el biofilm de las fuerzas de corte ejercidas por el movimiento de las mejillas 11.
Nota: El número de los ladrillos de vidrio colocados en una recesión puede variar entre 3 y 14, dependiendo del objetivo del estudio. - Insertar el aparato en la boca del voluntario. Instruir a la voluntaTeer para retener el aparato intra-oral durante todo el período experimental. Instruya al voluntario que guarde el aparato en un recipiente retenedor de ortodoncia con un trozo de tejido de papel húmeda (para mantenerlo húmedo) a temperatura ambiente durante el cepillado de los dientes y la ingesta de alimentos y bebidas que no sean agua. Dar instrucciones al voluntario para que no toque las bridas de acrílico bucales con los ladrillos de vidrio, mientras que la colocación o retirada del aparato.
Nota: El período experimental puede variar en función del objetivo del estudio (un día a varias semanas). - Retirar con cuidado las placas de vidrio del aparato al final del periodo experimental. Eliminar la cera adhesiva alrededor de las losas con un cuchillo y transferirlos con un par de pinzas para un recipiente cerrado, el biofilm hacia arriba, hasta que el análisis microscópico. Mantener el envase húmedo con un pañuelo de papel mojado. Realizar las imágenes de pH dentro de pocas horas después de la recogida de biopelículas.
3. El biofilm pH Imaging
- Prepararsolución salival mediante la adición de ditiotreitol a la saliva recogida de acuerdo con el método de de Jong et al. 13. Valorar la solución salival a pH 7,0 y añadir glucosa a una concentración de 0,4% (vol peso /). Pipeta de 100 l por biopelícula a analizar en una placa de 96 pocillos con fondo de vidrio para microscopía. Añadir 5 l de colorante radiométrica por pocillo.
- Coloque la placa de 96 pocillos sobre la platina del microscopio. Encienda el microscopio y la línea láser de 543 nm. Calentar la incubadora a 37 ° C. Usar los mismos ajustes del microscopio utilizado para la calibración del colorante (consulte los pasos 1.5-1.6). Espere durante 30 minutos, hasta que la placa de 96 pocillos se ha alcanzado la temperatura de trabajo.
- Recoger una o más planchas de vidrio con un conjunto de pinzas delgada y colocarlos en los pozos llenos de saliva, una losa por pozo, con las biopelículas hacia abajo.
- Adquirir imágenes individuales ( "Scan Control" → "único") o z-pilas ( "Scan Control" → "Inicio") spanning de la profundidad de los biofilms en diferentes áreas. Adquirir z-pilas elegir el número de cortes para formar una imagen ( "Scan Control" → "Ajustes Z" → "Num rebanadas") y marque la posición z para el primero y el último corte en el software del microscopio ( "Scan Control "→" Ajustes Z "→" Mark primero ";" Marcar el último ").
Nota: Z-pilas con una profundidad de hasta 75 micras pueden ser adquiridos con un buen contraste entre las zonas extracelulares e intracelulares. - Para seguir los cambios de pH en un campo microscópico de vista con el tiempo, marcar la posición xy en el software del microscopio ( "Stage y Control de enfoque" → "Mark Pos") y tomar imágenes repetidas en puntos de tiempo consecutivos ( "Scan Control" → " Soltero"). Regularmente tomar imágenes con la potencia del láser se establece en cero para la sustracción de fondo.
4. Análisis de Imágenes Digitales
- para export las imágenes microscópicas como archivos TIF, utilizar el archivo por lotes de exportación del software de microscopio ( "macro" → "archivos por lotes de exportación"). Marque los archivos que desea exportar y guardar imágenes de los canales rojo y verde en carpetas separadas como archivos TIF ( "Iniciar lotes de exportación"). Cambiar el nombre de los archivos en las carpetas que les dan los números secuenciales.
- Importe la imagen de la serie roja y verde en el software como Daime (análisis digital de imagen en la ecología microbiana) 14. Segmento de las imágenes del canal verde con umbrales elegidos individualmente brillo (segmento → → segmentación automática de umbral de encargo). Elija los umbrales de luminosidad con cuidado (típicamente entre 20 y 80), de manera que todas las bacterias (más brillante que la matriz extracelular), pero no la matriz serán reconocidos como objetos durante la segmentación. Verificar visualmente que las áreas reconocidas como objetos corresponden bien a la biomasa bacteriana.
- La transferencia de la capa de objetos de la g segmentadoreen imágenes de los canales correspondientes a las imágenes del canal rojo (Segmento → Transferencia de capa de objeto). Utilice la función de editor de objetos de rechazar y eliminar todos los objetos en las imágenes de los canales rojo y verde. Ahora solamente la matriz extracelular se deja en las imágenes de biofilm. Exportar la serie de imágenes procesadas como archivos TIF.
- Importar la serie de imágenes en ImageJ (http://rsb.info.nih.gov/ij; v.1.47). Determinar la intensidad media de fluorescencia en las imágenes de fondo tomadas con el láser apagado (Analizar → Histograma). Restar el fondo apropiada de las imágenes rojas y verdes (Proceso → Matemáticas → Restar).
- Todavía en ImageJ, dividir la serie de imágenes verde (G1) por sí mismo (Proceso → calculadora de imagen). Entonces multiplicar la serie de imagen resultante (G2) con la serie de imágenes verde (G1). Esto dará lugar a una serie de imágenes (G3), donde NaN se asigna a todos los píxeles que pertenecen a áreas que fueron reconocidos como objetos en el Daime. Proceder de tél mismo con la serie de imágenes de color rojo (R1 / R1 = R2; R2 x R1 = R3).
Nota: Como la biomasa bacteriana se eliminó de las imágenes en el paso 4.3, la intensidad fluorescente es 0 en estas áreas. Paso 4.5 es necesario convertir el valor 0 a NaN, que permite cálculo de la relación en el paso 4.6. - Aplicar el filtro 'Mean' (Proceso → → Filtros media; radio: 1 píxel) para compensar el ruido del detector. Dividir la serie de imágenes verde por la imagen de la serie roja (Proceso → calculadora de imagen). Esto resulta en una relación de verde / rojo para cada pixel que queda en el espacio extracelular de las imágenes. Utilizar mapeos de colores para la representación gráfica de las proporciones de las imágenes (cuadros de imagen → de búsqueda). Calcular la relación media para cada imagen (→ Analizar histograma).
- Convertir los coeficientes de verde / rojo a valores de pH de acuerdo con la función ajustada bajo 1.9.2). Nota: Un ejemplo de datos de calibración y curva ajustada se puede ver en Schlafer etal, 2015 11.
Resultados
El método presentado permite la monitorización extracelular pH cae en diferentes microambientes de biofilms dentales en el intervalo de pH de 4,5 a 7, en tiempo real. Si se eligen las condiciones experimentales como se ha descrito anteriormente, el pH comienza a caer en todas las áreas de las biopelículas poco después de la exposición a la glucosa.
Cuando el pH en un biofilm gotas, las células bacterianas se hacen visib...
Discusión
Monitoreo microscópico de pH biofilm proporciona varias ventajas, en comparación con los electrodos o microelectrodos mediciones 4-6. técnicas microscópicas permiten determinar el pH con una alta resolución espacial y permitir la captura de gradientes de pH, tanto horizontales como verticales en biofilms sin perturbar el biofilm mecánicamente. Los intentos previos de monitoreo del pH microscópico, sin embargo, no pudieron diferenciar entre pH extracelular e intracelular en las biopelículas 1,7,9....
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a Javier E. García y Lene Grønkjær para la asistencia técnica y Merete K. Raarup para un debate fructífero. Este trabajo fue financiado por la Fundación de Investigación de la Universidad de Aarhus y la Fundación Simon Spies.
Materiales
| Name | Company | Catalog Number | Comments |
| Zeiss LSM 510 META | Zeiss | N/A | |
| C-Apochromat 63X water immersion objective | Zeiss | N/A | |
| XL Incubator | PeCON | N/A | |
| SNARF-4F 5-(and-6)-Carboxylic Acid | Life Technologies | S23920 | |
| Dimethyl sulfoxide | Life Technologies | D12345 | |
| HEPES | Life Technologies | 11344-041 | |
| Costar 96-well black clear-bottom plate | Fisher Scientific | 07-200-567 | |
| Custom-made glass slabs (4 x 4 x 1 mm3; 1,200 grit) | Menzel | N/A | |
| Alginate impression material | GC Corporation | N/A | |
| Acrylic Adjusting Logic Sets/set of acrylic dental burs | Axis Dental | LS-906 | |
| Orthodontic retainer containers | Spark Medical Equipment Co., Ltd | SK-WDTC01 | |
| Sticky wax | Dentsply | N/A | |
| Chewing paraffin wax | Ivoclar Vivadent AG | N/A | |
| Dithiothreitol | Sigma Aldrich | D0632 | Used during preparation of salivary solution |
| 0.45 µm and 0.2 µm syringe filters | Sigma Aldrich | CLS431220; CLS431219 | |
| daime | University of Vienna, Austria | http://dome.csb.univie.ac.at/daime | |
| ImageJ | NIH, Bethesda, Maryland, USA | http://imagej.nih.gov/ij/ |
Referencias
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl. Environ. Microbiol. 71 (5), 2501-2510 (2005).
- Takahashi, N., Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42 (6), 409-418 (2008).
- Schlafer, S., et al. pH landscapes in a novel five-species model of early dental biofilm. PLoS. One. 6 (9), e25299 (2011).
- von Ohle, O. C., et al. Real-time microsensor measurement of local metabolic activities in ex vivo dental biofilms exposed to sucrose and treated with chlorhexidine. Appl. Environ. Microbiol. 76 (7), 2326-2334 (2010).
- Revsbech, N. P. Analysis of microbial communities with electrochemical microsensors and microscale biosensors. Methods Enzymol. 397, 147-166 (2005).
- Vanhoudt, P., Lewandowski, Z., Little, B. Iridium oxide pH microelectrode. Biotechnol. Bioeng. 40 (5), 601-608 (1992).
- Franks, A. E., et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energy & Environmental Science. 2 (1), 113-119 (2009).
- Hidalgo, G., et al. Functional tomographic fluorescence imaging of pH microenvironments in microbial biofilms by use of silica nanoparticle sensors. Appl. Environ. Microbiol. 75 (23), 7426-7435 (2009).
- Vroom, J. M., et al. Depth penetration and detection of pH gradients in biofilms by two-photon excitation microscopy. Appl. Environ. Microbiol. 65 (8), 3502-3511 (1999).
- Bender, G. R., Sutton, S. V., Marquis, R. E. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci. Infect. Immun. 53 (2), 331-338 (1986).
- Schlafer, S., et al. Ratiometric imaging of extracellular pH in bacterial biofilms using C-SNARF-4. Appl. Environ. Microbiol. 81 (4), 1267-1273 (2015).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J Oral Sci. 115 (6), 459-467 (2007).
- de Jong, M. H., van der Hoeven, J. S., van OS, J. H., Olijve, J. H. Growth of oral Streptococcus species and Actinomyces viscosus in human saliva. Appl. Environ. Microbiol. 47 (5), 901-904 (1984).
- Daims, H., Lucker, S., Wagner, M. daime, a novel image analysis program for microbial ecology and biofilm research. Environ. Microbiol. 8 (2), 200-213 (2006).
- Liu, Y. L., Nascimento, M., Burne, R. A. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int. J Oral Sci. 4 (3), 135-140 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados