Method Article
Multi-omisión de exón utilizando oligonucleótidos antisentido de cóctel en la distrofia muscular ligada al cromosoma X canina
* Estos autores han contribuido por igual
En este artículo
Resumen
La omisión de exón es actualmente una opción terapéutica más prometedora para la distrofia muscular de Duchenne (DMD). Para ampliar la aplicabilidad de los pacientes con DMD y para optimizar la estabilidad / función de las proteínas de distrofina truncados resultantes, un multi-exón enfoque saltar utilizando oligonucleótidos antisentido de cóctel fue desarrollado y hemos demostrado rescate distrofina sistémica en un modelo de perro.
Resumen
Distrofia muscular de Duchenne (DMD) es una de las enfermedades genéticas letales más comunes en todo el mundo, causadas por mutaciones en el gen de la distrofina (DMD). La omisión de exón emplea moléculas cortas de ADN / ARN, llamadas oligonucleótidos antisentido (AONs) que restauran el marco de lectura y producen proteínas más cortas, pero funcionales. Sin embargo, la terapia de omisión de exón se enfrenta a dos obstáculos principales: la aplicabilidad limitada (hasta sólo el 13% de los pacientes pueden ser tratados con un solo fármaco AON), y la función de las proteínas truncadas incierta. Estas cuestiones fueron tratadas con un método cocktail AON. Mientras que aproximadamente 70% de los pacientes con DMD puede ser tratada por solo la omisión de exón (todos los exones combinados), se podría potencialmente tratar a más de 90% de los pacientes con DMD si exón múltiple omitiendo el uso de drogas antisentido de cóctel puede ser realizado. Se utilizó el canino ligada al X distrofia muscular (CXMD) modelo de perro, cuyo fenotipo es más similar a los pacientes con DMD humanos, para probar la effic sistémicoACY y la seguridad de multi-omisión de exón de exones 6 y 8. El modelo de perro CXMD alberga una mutación del sitio de empalme en el intrón 6, que conduce a la falta del exón 7 en el ARNm de la distrofina. Para restaurar el marco de lectura en CXMD requiere multi-omisión de exón de exones 6 y 8; Por lo tanto, CXMD es un buen modelo animal de tamaño medio para probar la eficacia y seguridad de multi-omisión de exón. En el estudio actual, un cóctel de morfolinos antisentido dirigidos exón 6 y el exón 8 se diseñó y se restauró la expresión de distrofina en los músculos esqueléticos en todo el cuerpo. se presentan métodos para la transfección / inyección de oligos de cóctel y evaluación de la eficacia y seguridad de multi-omisión de exón en el modelo de perro CXMD.
Introducción
La distrofia muscular de Duchenne (DMD) es una enfermedad muscular recesiva ligada al cromosoma X se caracteriza por debilidad muscular progresiva, descrito por primera vez por el Dr. Guillaume-Benjamin-Amand Duchenne (de Boulogne) 1. La DMD es una enfermedad genética común que afecta a aproximadamente 1 de cada 3.500 niños en todo el mundo, con aproximadamente 20.000 niños afectados nacen cada año 2,3. El desarrollo motor se retrasa y alteraciones de la marcha se ve en la primera infancia 4, seguido de la dependencia sobre silla de ruedas en los primeros años de adolescencia. La muerte se produce normalmente entre las edades de 20 y 30 debido a la insuficiencia respiratoria o cardiaca 5-8. Actualmente no existe cura para la DMD. El tratamiento con glucocorticoides puede ralentizar la progresión de la degeneración muscular en cierto grado, pero se asocia con efectos secundarios significativos, incluyendo la obesidad y la diabetes mellitus 2,7,8. DMD resulta de mutaciones en el gen de la distrofina (DMD), lo que lleva a una pérdida de distrofina funcional protein. La DMD es un gen muy grande, con más de 2 millones de pares de bases y 79 exones 9,10. Deleción, sin sentido, y duplicación mutaciones que conducen a mutaciones fuera de la trama son la causa más común del fenotipo DMD. Las regiones de los exones 3 - 9 y los exones 45 - 55 se denominan "puntos calientes de mutación" como la mayoría de los pacientes tienen mutaciones de deleción dentro de estas porciones del gen, lo que lleva a la distrofina no funcional en pacientes con DMD 3,9,11-16. funciones de distrofina dentro del complejo distrofina-glicoproteína (DGC), que tiene un papel importante en la estabilización de la membrana muscular. La N- y C-terminales son los dominios más importantes para la función, mientras que el dominio de varilla central juega un papel menos importante 3,9,17. La observancia de un fenotipo leve asociado con distrofia muscular de Becker (BMD), lo que se traduce en su mayoría de las mutaciones en marco en el gen DMD, inspiró la aplicación de la omisión de exón para el tratamiento de la DMD. pacientes DMO han acortado una, pero functional, la proteína distrofina que mantiene ambos extremos 3,6,18. La omisión de exón, en teoría, puede restaurar el marco de lectura, lo que resulta en proteínas acortadas de distrofina funcional, pero-similares a los observados en la DMO 3,19.
Múltiples tipos de oligonucleótidos antisentido (AONs) han sido probados en ensayos clínicos, incluyendo fosforotioatos metilados-2O (2'OMePS) y oligómeros de morfolino fosforodiamidada (PMO). Saltarse los exones 51 y 53 que utilizan estos AONs ha sido examinado y si bien los resultados son prometedores, la omisión de exón de un solo tiene aplicabilidad limitada, ya que es-mutación específica 3, 19, 20,21, 22-26. Las preguntas también sobre la estabilidad de las proteínas distrofina acortada resultantes producidos a partir de un solo salto de exón 22,23. Además, algunos pacientes requieren más de un solo exón a ser omitido con el fin de restaurar el marco de lectura 3. Aunque técnicamente más difícil, multi-omisión de exón es un método quepodría hacer frente a estos problemas 3,19. Multi-omisión de exón previamente se ha demostrado en perro distrófica y líneas celulares humanas in vitro. Además, mdx52 ligadas al cromosoma X modelos de ratón para perros y caninos de la distrofia muscular (CXMD) se han utilizado para los estudios in vivo 22, 24-27. Distrofia muscular ligada al cromosoma X Canine Japón (CXMD J) se utilizaron beagles aquí, ya que el marco de lectura de CXMD J puede ser restaurada por la omisión de multi-exón de exones 6 y 8, o exones adicionales (por ejemplo, los exones 3-9) (Figura 1). CXMD a base de Beagle comparte el mismo patrón de mutación como el modelo Golden Retriever distrofia muscular (GRMD), pero beagles son más pequeños y más baratos de mantener debido a su tamaño corporal, proporcionando así un modelo útil para la DMD 28,29. CXMD perros se asemejan más a la fenotipo DMD humana que los modelos animales más pequeños, como roedores, y son más fiables para las evaluaciones toxicológicas 3,22,30,31 (Figura 2). CXMD perros muestran la decadencia progresiva muscular, alteraciones de la marcha, y los problemas cardíacos y respiratorios similares a los observados en la DMD. En comparación con la omisión de un solo exón, multi-omisión de exón es aplicable a una proporción mucho mayor de pacientes. Entre los tres tipos de mutaciones más comunes (deleciones, duplicaciones, y sin sentido), el 80 - 98% de los pacientes podría ser tratada a través de múltiples salto de exón 14,32,33, mientras que el 45% de todos los pacientes con DMD podría beneficiarse de los exones 45 saltarse específicamente - 55 3,19,22,34.
Con el desarrollo de morfolinos modificados, la eficiencia de cócteles AON a facilitar la omisión de exón ha mejorado. Ricos en arginina PMO conjugado de péptido-penetran en las células (PPMOs), y vivo-morfolinos (vPMOs) son las químicas AON que han mejorado significativamente la capacidad y la estabilidad 3,35-38 penetrante en las células. Persiste la preocupación acerca de la toxicidad de AON a largo plazo; Sin embargo, el progreso significativofue hecho. Las modificaciones químicas introducidas en morfolinos disminuyen en gran medida fuera de objetivo efectos y los estudios preclínicos no han reportado efectos tóxicos significativos 3,22,39,40. Un desafío pendiente para multi-omisión de exón es el requisito actual para cada sola AON a ensayar para la toxicidad por sí solo, como un solo fármaco, en vez de juntos como un cóctel 3,19,22,41,42. En los estudios que implican DMD, monofásicos y multi-omisión de exón dirigida al corazón, ha habido pocas mejoras en el tejido del corazón distrófica. La eficacia de morfolinos en el corazón se piensa que es bajo debido a la mala capacidad de penetración celular. PPMOs péptido conjugado han mejorado la capacidad de AONs para penetrar en las células cardíacas, el aumento de la cantidad de proteína distrofina funcional rescatado en el corazón 3,19,38.
Aquí, nuestro enfoque cóctel de AON se analiza en profundidad, incluyendo el diseño de secuencias utilizando el software de AON ESEfinder 43. protocTambién se describen oles para experimentos con perros multi-omisión de exón. CXMD J beagles se utilizaron para los exones 6 y 8 experimentos saltarse. Multi-omisión de exón en el modelo de perro CXMD muestra resultados prometedores, pero sigue habiendo dificultades que deben superarse antes de que sean clínicamente aplicable.
Protocolo
Todos los protocolos que figuran a continuación están en conformidad con las directrices de cuidado de animales establecidos por el Centro Nacional de Neurología y Psiquiatría (NCNP) en Japón. Todos los experimentos fueron aprobados por el Comité de Cuidado y Uso de Animales institucional de la NCNP.
1. Diseño de oligos antisentido
- Utilice ESE rescate y programas ESEfinder para detectar ESE sitios 44, 45-47.
- Diseño 25 pares de bases (pb) secuencias que son antisentido a los exones que se van a ser dirigidos. Exones 6 y 8 de destino en el modelo de perro (Figura 1).
- Utilice 25 - 30 pb secuencias de PMO (Tabla 1) o 25 pb para 2'OMePS. Diseñar 25 pb secuencias, seleccionar secuencias que están dentro de la región de destino. Considere la estructura secundaria, la evitación de heterodímeros, motivos potenciador exón de empalme, y el contenido de GC para crear secuencias estables 43. AONs deben dirigirse al menos uno de los sitios de ESE como identificado por el sof mencionadatware.
- Seleccione AONs con un contenido de GC que es inferior al 65%, con menos de 4 'secuencias consecutivas de G, y no contienen auto-complementaria. Utilice el software explosiva NCBI para predecir sitios de hibridación fuera de objetivo 22,48,49.
- Seleccione una química espina dorsal AON apropiado. Para los experimentos in vitro utilizar oligonucleótidos 2O-metilo (2'OMePS) o morfolinos. Para los experimentos in vivo, utilice 2'OMePS, morfolinos o vPMOs. 3,19,48,50
2. Experimentos in vitro (exones 6 y 8 Saltarse en el Modelo CXMD)
- 2'OMePS Transfección de mioblastos para perros
- Cultura mioblastos CXMD en 3 ml de medio de cultivo en placas de 6 pocillos. Seed 1-5 x 10 3 células / cm 2 con 0,5 ml / cm 2 de medio de mioblastos. Para el medio de crecimiento, utilizar un medio de Eagle modificado por Dulbecco (DMEM) con 10% de suero bovino fetal (FBS) y 1%penicilina / estreptomicina (P / S) 40.
- Incubar a 37 ° C hasta 60 a 80% de confluencia. Esto toma aproximadamente de 12 a 24 h.
- Diluir un agente de transfección de liposomas catiónicos a un total de 100 l en medio de suero reducido (2: agente de transfección relación de 1: AONs, por ejemplo, 10 l lipofectina vs. 5 g AONs). Deje que la mezcla repose a temperatura ambiente durante 30 - 45 min.
- Diluir AONs (2'OMePS o morfolinos) a un volumen final de 100 l en medio de suero reducido.
- Combinar el agente de transfección se diluyó con AONs diluidos y se incuba a RT durante 10 - 15 min.
- Mientras que la mezcla de agente de transfección / AON está sentado a la temperatura ambiente, eliminar los viejos medios de las células a través de la aspiración y lavar las células con los medios de comunicación.
- Añadir 0,8 ml de medio a la mezcla de agente de transfección / AON y luego agregar la solución completa a las células lavadas recién. Incubar durante 3 horas a 37 ° C.
- Después de la incubación, sustitución de los medios con differentiatmedios de iones (DM); la diferenciación puede tardar hasta 10 días. Comprobar para ver si se ha producido una diferenciación a partir de alrededor del día 3. El medio de diferenciación es DMEM con suero de caballo al 2%, 200 U / ml de penicilina, 200 mg / ml de estreptomicina y 10 mg / ml de insulina.
- Morfolino Transfección de mioblastos para perros
- Cultura CXMD mioblastos en medio de crecimiento tal como se describe en el paso 2.1.
- Cambiar a un medio de diferenciación (DM), y añadir 0,1 mM morfolino a cada pocillo para hacer que la concentración final de 1 mM. morfolinos de cóctel de calor a 65 ° C durante 10 min antes de la transfección o la inyección para evitar AON agregación. Añadir un reactivo de suministro de péptidos 39,51 y ajustarse a una concentración final de 3-6 M.
- Después del 16 - 48 h de incubación, recoger las células para la extracción de RNA. Añadir 1 ml de ácido guanidinio tiocianato-fenol-cloroformo a las células para separar las células de la placa. Realizar ARN extracción después de este paso.
- Alternativamente, añadir tripsina para que cubra todas las células y se incuba durante 2 min a 37 ° C.
Nota: Si la intención de realizar la inmunoquímica, el uso de gafas de diapositivas con cámaras de cultivo. Después de la diferenciación, las células se pueden fijar usando paraformaldehído (PFA) (4% durante 10 min).
- Alternativamente, añadir tripsina para que cubra todas las células y se incuba durante 2 min a 37 ° C.
- La extracción de RNA y transcripción reversa reacción de polimerasa en cadena (RT-PCR)
- Una vez que las células se diferencian en miotubos, retire medio y agregar 1 ml de ácido guanidinio tiocianato-fenol-cloroformo; incubar durante 10 min a TA.
- Transferir a tubos de 1,5 ml. Combinar con 200 l de cloroformo y se incuba a TA durante 2 min hasta tres capas separadas se pueden ver. Las tres capas de arriba a abajo son: una capa de RNA, una capa de ADN, y una capa de proteína.
- Centrifugar a 12.000 × g durante 15 min a 4 ° C. Eliminar el sobrenadante capa superior y colocar en un tubo con 500 & #181; l de isopropanol (si parar aquí, almacenar el sobrenadante a -80 ° C). Centrifugar el sobrenadante a 12.000 xg durante 10 min a 4 ° C; después de centrifugar, mantener el ARN precipitado resultante y eliminar el sobrenadante.
- Lavar el precipitado con etanol y se centrifuga a 8000 xg durante 5 min a 4 ° C. Se evapora el etanol residual invirtiendo el tubo durante 15 minutos y luego añadir 15 - 30 l de agua libre de RNasa. Cuantificar la concentración de ARN total usando espectroscopia de EE.UU. / VIS a 260 nm.
- Se combinan los reactivos necesarios para una reacción de RT-PCR: cebador directo 1.5 l de 10 mM, 1,5 l de 10 mM cebador inverso, dNTP 1 l, 5 l de un solo paso tampón PCR kit, 0,7 l inhibidor de RNasa, 1 l de mezcla de enzimas de uno paso kit PCR, y 200 ng de RNA. Una vez que éstos se han mezclado, añadir agua hasta un volumen final de 25 microlitros.
- Coloque la mezcla en un termociclador. Ejecutar un ciclo de 30 minutos a 50 ° C, 15 min0; ciclo a 95 ° C, luego 35 ciclos de 94 ° C durante 1 min, 60 ° C durante 1 min, y 72 ° C durante 1 min. Por último, ejecute un ciclo de 10 min a 72 ° C. Tienda de productos de PCR en un refrigerador a 4 ° C o -20 ° C
- ADN complementario (ADNc) Secuenciación
- Identificar el exón 6 - 9-bandas omitirse utilizando electroforesis en gel de agarosa. Carga de 5 l de cada muestra en los pocillos de un gel de agarosa al 1,5%, funcionamiento 135 V a través del gel durante 5 minutos, y luego 120 V durante 20 min. A continuación, se incuba el gel en mancha de gel de ADN a temperatura ambiente durante 30 min. Visualizar las bandas utilizando software de imagen.
- Escindir la banda de interés utilizando un kit de extracción de gel.
- Cortar el fragmento de ADN y solubilizar el corte de gel utilizando 200 NTI l / 100 mg de gel. Deje que repose durante este de 5 a 10 min en un baño de agua a 50 ° C. A continuación, traslado a la sílice tubo de membrana.
- Centrifugar a 11.000 xg durante 30 seg. Lavar dos veces con 700 l de tampón NT3 antes de centrifuging de nuevo a 11.000 xg durante 30 seg.
- Secar la membrana de sílice por centrifugación a 11.000 xg durante 1 min.
- Añadir 15 - 30 l de tampón NE y deje reposar a temperatura ambiente durante 1 min. A continuación, se centrifuga a 11.000 xg durante 1 min. Quitar el gel de sílice y mantener el contenido en el tubo.
- Utilice un kit de secuenciación para determinar la secuencia de acuerdo con el protocolo del fabricante.
3. Las inyecciones intramusculares o una biopsia muscular abierto
- Para el mantenimiento de las condiciones estériles durante la cirugía de supervivencia, eliminar el vello utilizando máquinas de cortar en la zona que rodea el sitio de la cirugía (la extremidad posterior). Utilice yodóforos o clorhexidina como desinfectante. Utilice paños estériles para la zona quirúrgica mediante la colocación y sujeción ellos sobre todo el animal y la mesa de operaciones.
- Use batas, mascarillas de limpieza, cubierta para la cabeza, guantes estériles, y los zapatos especiales para la sala de operaciones 52,53.
- Inyectar perros CXMD con 20 mg / kg de tiopental sódico para anestesiar a ellos. Utilice ungüento veterinario en los ojos para evitar que los ojos se sequen.
- Utilice 2 - 3% por inhalación de isoflurano para mantener la anestesia general (Figura 3). Revisar los reflejos musculares y supervisar frecuencia cardiaca y respiratoria para evaluar la profundidad de la anestesia. El ritmo normal de respiración (RR), frecuencia cardíaca (FC), y la SpO 2 bajo anestesia general son los siguientes: RR: 10 - 20 respiraciones / min; SpO 2 95 - 100%, HR: 80 - 120 latidos por minuto (lpm).
- El uso de un bisturí, cortar la piel sobre el tibial craneal (TC), también conocido como el tibial anterior (TA), y hacer un solo corte de aproximadamente 5 cm en sentido longitudinal (para perros adultos jóvenes). Para marcar los sitios de inyección, coser la fascia profunda utilizando una aguja quirúrgica y el hilo quirúrgico y hacer dos marcadores de puntadas a intervalos de 2 cm.
- Inyectar la concentración deseada de AONs en el músculo con una aguja 27 G. El tración deseadatración varía entre las condiciones de tratamiento. Para la TC, darle dos inyecciones de 1 ml de capacidad cada uno, para un total de 1,2 mg de PMO cóctel (0,4 mg cada PMO) o 0,4 mg de vPMOs cóctel (0,13 mg cada vPMO). Para la extremidad anterior del músculo extensor cubital del carpo (ECU), inyecte dos volúmenes de 0,5 ml cada una para un total de 1,2 mg de PMO cóctel (0,4 mg cada PMO) o 0,4 mg de vPMOs cóctel (0,13 mg cada vPMO). Deje la aguja en durante 1 min. Utilice una cantidad igual de cada AON para el cóctel.
- Realizar una biopsia muscular abierta mediante la eliminación de un pedazo de tejido muscular de aproximadamente 2 cm de longitud del músculo CT utilizando un bisturí quirúrgico.
- Vaya al paso 6.5 para la preparación de muestras de músculo.
- Usando una aguja, administrar una inyección intramuscular de 0,02 mg de clorhidrato de buprenorfina / kg antes de despertar de la anestesia general. Coloque la fascia muscular y la piel de la espalda sobre el músculo y unir éstos utilizando un hilo absorbible 3-0 y 3-0 hilo de nylon para la fascia muscular y cierre de la piel, respectivEly.
- Mientras mantiene la boca abierta, determinar si el reflejo nauseoso; cuando se ha vuelto el reflejo nauseoso, retirar la intubación del perro.
- Administrar 15 a 30 mg / kg de cefazolina o cefalexina (antibióticos) para un máximo de 3 días desde la inyección intravenosa o intramuscular para prevenir la infección.
- Retirar las suturas dentro de los siete días. No dejar el perro solo hasta que se haya recuperado el conocimiento suficiente para mantener decúbito esternal y no permitir que el perro para interactuar con otros animales hasta que se realice una recuperación completa. Mantener los tubos endotraqueales en su lugar el mayor tiempo posible y eliminarlos cuando el animal comienza a masticar o tragar. El monitor de la frecuencia cardiaca de los animales, la respiración y la hidratación para asegurarse de que son estables y dentro de los límites normales.
- Para el cuidado post-cirugía, proporcionar analgesia durante 3 días (por ejemplo, buprenorfina 0,01 mg / kg) y el apoyo de enfermería, incluyendo un lugar oscuro y tranquilo reposo, apropiado de la herida y el mantenimiento vendaje, una suavesuperficie de apoyo, la rehidratación con fluidos orales o parenterales, y el retorno a la alimentación normal a través del uso de alimentos o golosinas muy agradables al paladar. Si los animales requieren la medicación adicional, una inyección intramuscular de 0,3 mg / kg de tartrato de butorfanol en función de los síntomas de dolor.
Nota: Los perros en el dolor pueden morder, arañar, o guardia de las regiones dolorosas, y si se maneja, pueden ser inusualmente nerviosa o agresiva. Además, el dolor en una extremidad por lo general resulta en cojera o mantener en marcha de la extremidad afectada con intentos de utilizarlo. En tales situaciones, una inyección intramuscular de 0,02 mg / kg de hidrocloruro de buprenorfina cada 6 a 8 h.
4. Las inyecciones sistémicas
Nota: Este procedimiento se puede repetir semanal o quincenal para el número deseado de semana.
- Restringir perros manualmente y con cuidado por conseguir que el perro para acostarse y luego cubrir los brazos sobre los hombros y las caderas para mantener al perro en su lugar a lo largo de tprocedimiento que él.
- Inyectar AONs; 120 - PMOs 240 mg / kg de cóctel (40 - 80 mg cada AON) utilizando una aguja permanente venosa en una vena del miembro (conocido como un cefálica o una vena safena). La cantidad de AON inyectado depende de la condición experimental. Utilice una cantidad igual de cada AON para el cóctel.
- Utilice una bomba de infusión o un controlador de jeringa para inyectar 50 ml en total a una velocidad de 2,5 ml / min durante 20 min, siguiendo las instrucciones del fabricante. Repetir las inyecciones semanales o cada dos semanas (cada dos semanas) por lo menos 5 veces, la expresión de distrofina se acumulan con inyecciones repetidas.
- Realizar análisis de sangre semanales para examinar la toxicidad.
- Usando una aguja, recoger 3 ml de sangre - 0,5 ml para el recuento sanguíneo completo (CBC) y 2,5 ml para otros - de una de las venas subcutáneas de primer plano o de los miembros posteriores. Incluir CBC, gamma-glutamil transferasa (GGT), aspartato aminotransferasa (AST), nitrógeno de urea en sangre (BUN), alanina aminotransferase (ALT), la creatina quinasa (CK), y las evaluaciones de creatinina al probar la sangre recogida, siguiendo las instrucciones del fabricante de los kits de prueba de sangre. 40,54
5. La clasificación clínica de los perros
- Configurar una cámara de vídeo y el comportamiento del perro registro y la marcha. Grabar todo el encuentro con el perro, ya que actuará como una referencia al calificar el perro; esto significa que cada video será una longitud diferente en función de las capacidades y la disposición del perro. Usar parámetros de grabación por defecto. El rodaje crea un registro de la clasificación para que pueda ser revisado en una fecha posterior.
- Grado de la marcha y el movimiento perturbaciones.
- Para trastornos de la marcha y el movimiento, utilice los siguientes grados:
grado 1 = ninguna, 2 = grado que se sienta con la extremidad posterior extendida, grado 3 = conejito lúpulo con las patas traseras, grado 4 = caminar arrastrando los pies, y el grado 5 = incapaz de caminar. - Correspondiente a la alteración de movilidad, utilice los siguientes grados: grado 1 = ninguno, grade 2 = acostarse más de lo normal, grado 3 = no se puede saltar sobre las patas traseras, grado 4 = aumento de dificultad para moverse, y el grado 5 = incapaz de levantarse y moverse.
- Para trastornos de la marcha y el movimiento, utilice los siguientes grados:
- Medir el tiempo que tarda el perro a correr 15 m. Mide 15 m, colocar al perro en la línea de salida y animar a que se ejecute hasta que la marca de 15 m.
- Determinar la atrofia muscular de la extremidad utilizando la siguiente escala de calificaciones:
grado 1 = ninguno, grado 2 = dureza sospechoso, grado 3 = se puede sentir la dureza o aparece delgadas, de grado 4 = entre los grados 3 y 5, y el grado 5 = extremadamente delgada o dura. - Grado babeo utilizando la siguiente escala: 1 = ninguno de grado, grado 2 = de vez en cuando dribla saliva al sentarse, grado 3 = algo de baba al comer y beber, grado 4 = hilos de baba cuando come o bebe, y el grado 5 = baba continua.
- hipertrofia de grado de la lengua (macroglosia) utilizando la siguiente escala: 1 = ninguno de grado, grado 2 = ligeramente ampliada, de grado 3 = outsi extendidade la dentición, grado 4 = ampliada y espese un poco, y el grado 5 = agrandado y espesado.
- Grado capacidad del perro de tragar utilizando la siguiente escala: grado 1 = ninguna dificultad, grado 2 = requiere tiempo y esfuerzo en la toma de alimentos, grado 3 = dificultad en la toma de comida de un plato, grado 4 = dificultad para masticar, tragar o beber y grado 5 = incapaz de comer.
- Calcular la puntuación total sumando las puntuaciones de cada categoría (a excepción de la prueba de funcionamiento 15 m) 55.
Nota: Los estudios deben estar cegados a fin de no introducir un sesgo.
6. Imagen por Resonancia Magnética (IRM)
- Use un 3 Tesla (3T) RM y / bobina extremidad humana 18 cm de longitud de 18 cm de diámetro para obtener imágenes ponderadas en T2 de las extremidades traseras.
- Anestesiar los animales mediante la inyección de perros CXMD con 20 mg / kg de tiopental. Utilice ungüento veterinario en los ojos para evitar que los ojos se sequen. Use la inhalación de isoflurano 2-3% para mantener la anestesia general.
- Revisar los reflejos musculares y supervisar frecuencia cardiaca y respiratoria para evaluar la profundidad de la anestesia. El ritmo normal de respiración (RR), la frecuencia cardíaca (FC) y la SpO 2 bajo anestesia general son los siguientes: RR: 10 - 20 respiraciones / min, SpO 2 95 - 100%, HR: 80 - 120 latidos por minuto (lpm ).
- Utilice los siguientes parámetros para obtener ponderadas en T2 imágenes: TR / TE = 4.000 / 85 mseg, grosor de corte = 6 mm, la rebanada de espacio = 0 mm, campo de visión = 18 cm x 18 cm, tamaño de la matriz = 256 x 256, y número de adquisiciones = 3 durante eco de espín rápido (Figura 4).
7. Músculo muestreo y la preparación (necropsia)
Nota: Los músculos se deben muestrear una o dos semanas después de la última inyección de AON.
- Inyectar perros con 20 mg / kg de tiopental sódico para anestesiar a ellos. Utilice ungüento veterinario en los ojos durante la anestesia para prevenir la sequedad de los ojos.
- Utilice 2 - 3% por inhalación de isoflurano para mantener Anessia. Revisar los reflejos musculares y supervisar frecuencia cardiaca y respiratoria para evaluar la profundidad de la anestesia. El ritmo normal de respiración (RR), la frecuencia cardíaca (FC) y la SpO 2 bajo anestesia general son los siguientes: RR: 10 - 20 respiraciones / min; SpO 2 95 - 100% de HR: 80 - 120 lpm.
- La eutanasia a perros por desangramiento bajo anestesia general (para la necropsia solamente). Utilice desangrado bajo anestesia general profunda para evitar los efectos causados por factores derivados de la sangre en el análisis molecular (por ejemplo, músculos cardíacos).
- Diseccionar los siguientes músculos (Figura 5): CT, extensor largo de los dedos (EDL), femoral gastrocnemio, sóleo, bíceps femoral, recto, bíceps braquial, tríceps braquial, deltoides, ECU, extensor radial del carpo (ECR), flexor cubital del carpo (FCU ), flexor radial del carpo (FCR), gracilis, intercostales, los músculos abdominales, diafragma, músculo dorsal lateral, esófago, esternocleidomastoideo, y el corazón. Para examinar la toxicidad, recoger los riñones y limuestras Ver. Uso Evans y Alexander de Lahunta (2009) como referencia para la técnica de disección 56.
- Cortar el TC, EDL, gastrocnemio, sóleo, bíceps femoral, recto femoral, bíceps braquial, tríceps braquial, deltoides, ECU, ECR, FCU, FCR, gracilis, intercostales, los músculos abdominales, dorsal lateral, esófago, esternocleidomastoideo, corazón, riñón, y el hígado en pequeñas secciones de aproximadamente 1 a 1,5 cm de longitud. Rodar el diafragma hacia arriba y luego se corta en 1 - 1,5 cm secciones 56.
- Coloque goma de tragacanto de modo que es de aproximadamente 0,5 - 1 cm de espesor de los discos de corcho. discos de la etiqueta con la identificación y el músculo el nombre del animal en el lado opuesto de la goma de tragacanto.
- Colocar los músculos con su eje longitudinal perpendicular a la del corcho en la goma de tragacanto.
- Coloque los tapones en un recipiente de isopentano que está sentado en nitrógeno líquido. Moverlo constantemente con pinzas durante 1 minuto o hasta que esté completamente congelado. los músculos de las tiendas en los corchosen viales a -80 ° C. Durante el transporte, puesto viales en hielo seco.
- Preparar portaobjetos de vidrio con la etiqueta de identificación de animales Nombre / muscular y la fecha.
- En un criostato enfría a -25 ° C, montar el tapón en el soporte. Seleccionar el espesor de hasta el nivel deseado. Utilice 8 m para inmunohistoquímica y 12 micras para hematoxilina y eosina (HE) de tinción. Utilice 15 micras para las muestras de Western blot. Recorte alrededor de un cuarto del músculo para obtener un músculo plano para el muestreo muscular adecuado.
- Cortar una sección del músculo a la vez, coloque cada sección 6ª en el mismo portaobjetos de vidrio Si planea utilizar muestras para inmunohistoquímica o tinción HE. Si el uso de muestras para transferencias de Western, poner 30 - 40 secciones en un tubo y se almacena a -80 ° C.
- Después de la preparación de diapositivas, permiten secar los portaobjetos durante 1,5 horas a temperatura ambiente. Tienda desliza a -80 ° C.
8. La inmunohistoquímica
- Retire muestras preparadas a partir de almacenamiento y colocarlos enuna cámara de humedad para mantener las diapositivas separadas y mantener la humedad. Llenar la cámara de humedad para que el fondo quede cubierto con agua (aproximadamente 1 mm de agua).
- Deje secar al aire durante 0,5 horas. Dibujar un cuadrado que encierra la muestra de músculo en el portaobjetos con un bolígrafo barrera hidrofóbica.
- Añadir 15% de suero de cabra en solución salina tamponada con fosfato (PBS) y se incuba durante 2 horas a RT en reactivo de bloqueo.
- Añadir dominio anti-distrofina varilla (DYS-1) de ratón anticuerpo primario monoclonal, o un anticuerpo monoclonal C-terminal (DYS-2) para la tinción de distrofina perro (dilución 1: 150). Diluir el uso de un agente de bloqueo en 1,25 ml de PBS. Incubar O / N en un refrigerador a 4 ° C.
- Lavar con PBS durante 5 min, que se repite tres veces. Añadir anticuerpo secundario Alexa 594 anticuerpo de cabra contra IgG1 de ratón (por DYS-2) o IgG2 (por DYS-1) (1: 2500). Se diluye con un reactivo de bloqueo en PBS que contenía 0,1% de octil fenol etoxilato. Incubar durante 0,5 horas a temperatura ambiente.
- Lavar con PBS durante 5 min, tres tIME. Dejar que los portaobjetos se seque. Añadir 1 - 2 gotas (3 ng / ml) de 4 ', 6-diamidino-2-fenilindol (DAPI) solución de montaje. Con unas pinzas, coloque una hoja de vidrio sobre la parte superior de las secciones, evitando las burbujas.
- Ver dystrophin- (DYS-1 / DYS-2) fibras positivas bajo un microscopio de fluorescencia a 594 nm a 20 aumentos.
9. Transferencia Western
- Añadir secciones musculares recogidos de la crio-seccionar a 150 l de tampón de muestras en hielo.
- El uso de un homogeneizador de mano, homogeneizar brevemente las muestras de proteína. muestras de calor en un tubo de 1,5 ml en un incubador de bloque de calentamiento a 95 ° C durante 3-5 min. Centrifugar a 16.500 × g durante 15 min y recoger el sobrenadante.
- alícuotas de las tiendas del sobrenadante a -70 ° C. Use agua destilada para diluir hasta 100x.
- Determinar la concentración de proteína utilizando un kit comercial de acuerdo con el protocolo del fabricante. Añadir tampón de Laemmli SDS-carga 2x a las muestras y el calor durante 3 minutos y# 160; a 95 ° C.
- Cargar las muestras en 3-8% de gel de Tris-acetato antes de ejecutarlo durante 3 horas a 150 V. incluir varias muestras diluidas de tipo salvaje (WT) (por ejemplo, 1%, 10% y 50%) para la cuantificación. Menos de 1% los niveles de WT de distrofina deben detectarse con este método.
- Colocar el gel en tampón de cátodo para 20 min. Durante este tiempo, tomar nueve piezas de papel de filtro y ponerlos en las memorias intermedias de transferencia (3 papeles en el tampón de cátodo [+], el tampón de ánodo ([-], y el tampón del ánodo concentrado [-], respectivamente) Este. describe un método de transferencia semi-seco que aumenta la sensibilidad (Figura 6).
- Remojar una membrana de PVDF en metanol durante 20 segundos y luego se coloca en el buffer de ánodo.
Configurar el gel con la membrana de transferencia semi-seca y permitir que se ejecute 1,5 horas a 400 mA en TR o en una habitación fría. - Lavar la membrana con PBS. Incubar la membrana en una mezcla de PBS con Tween 20 (PBST) y 5% de leche en polvo durante 2 h.
- Diluir DYS-1 (anticuerpo primario) en PBST y 5% mezcla de leche en polvo a una dilución de 1: 100. Añadirlo a la membrana y se deja incubar durante al menos 1 hora. Lavar tres veces con PBST 100 ml durante 15 minutos cada uno.
- Añadir 65 l / carril de HRP anticuerpo secundario conjugado (anti-ratón IgG2a para DYS1) a 1: 5000 dilución de 1 hora a RT en una zona oscura. A continuación, se lava con tres veces con 200 ml de PBST durante 20 min. Mezclar las soluciones de un kit de detección como se indica. Incubar durante 1 min.
- Desarrollar película para detectar bandas y analizar con el software ImageJ 48,57,58.
Resultados
Los experimentos in vitro
Los mioblastos se transfectaron con diferentes condiciones de tratamiento 2'OMePS el fin de comparar la eficacia de cada AON. tratamientos individuales AON con 600 nM de cada uno de Ex6A, Ex6B, Ex8A, o Ex8B se realizaron, así como un tratamiento de cóctel con 600 nM de cada uno de los 4 secuencias de AON. Las muestras de ARN se recogieron cuatro días después de la transfección. Después de RT-PCR, las muestras para cada tratamiento se ejecutan en un gel junto con las muestras no tratadas (NT). Bandas más altas en el gel representan fuera del marco de productos DMD; estas bandas se observaron en NT, Ex8A, y Ex8B mioblastos tratados. Ex6A, Ex6B, Ex8A, y los mioblastos cóctel tratados mostraron productos montados en el bastidor. El cóctel y Ex6A / B mostraron 100% de productos en marco, mientras que Ex8A mostró sólo un 30% de productos en marco (Figura 7). Para confirmar la omisión de exón y la restauración deel marco de lectura, se realizó la secuenciación de ADNc; los resultados indicaron que los exones 6-9 de hecho se han saltado (Figura 7). La inmunohistoquímica mostró que los perros tratados con AON habían aumentado fibras positivas de distrofina en comparación con muestras de NT (Figura 8).
Experimentos in vivo
Para comparar la eficacia de diferentes condiciones de tratamiento AON, perros CXMD (0,5 - 5 años de edad) se inyectaron una vez con 1,2 mg Ex6A o un cóctel de Ex6A, Ex6B, y Ex8A en varias dosificaciones. Dos semanas después de la inyección, se recogieron muestras de músculo y se tiñeron con DYS-1 para comparar el número de fibras positivas de distrofina. Todas las muestras de cóctel tratados mostraron un aumento de la expresión de distrofina en comparación con muestras de NT. Fibras positivas de distrofina aumentaron con la dosis de AON (Figura 9). siguiente sistemaLa inyección IC, de tipo salvaje (WT), NT, y muestras de músculo CXMD cóctel tratados se tiñeron con DYS-1 (Figura 10). perros CXMD cóctel tratados mostraron un incremento en la expresión de distrofina en comparación con los perros NT CXMD, tanto en la TC y muestras del músculo del corazón. Sin embargo, el músculo esquelético AON-tratado (CT) mostró mucho más alta expresión de distrofina en comparación con el músculo cardiaco tratado. Una comparación de inmunoblot WT, NT, y varios músculos tratados con cócteles morfolino llevó a la misma conclusión. También había una amplia gama de la expresión de distrofina en las muestras de músculo esquelético tratados (Figura 10). Hematoxilina y eosina (HE) tinción reveló que trató CXMD perros mostraron una mejor histopatología, con una disminución significativa en las fibras centralmente nucleadas (CNF) en comparación con los perros NT CXMD (Figura 11). Esto indica que hay más degeneración / regeneración que ocurre en el perro NT, un signo de patología muscular distrófica. Además, los perros tratados tenían más rápidotiempos y puntuaciones mejoradas que se ejecuta en la escala de calificación clínica. CXMD perros tratados mostraron mejores puntajes que los perros NT CXMD en todas las categorías (Figura 12).
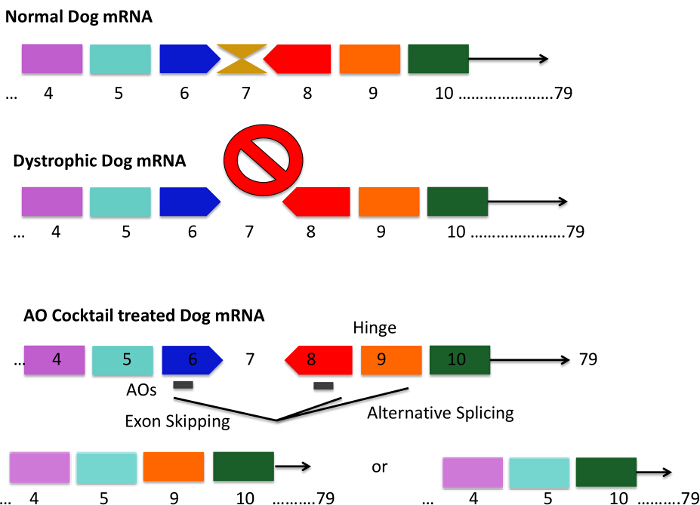
Figura 1. patrón de mutación del Perro CXMD y exones 6 -. 8 Skipping Estrategias El uso de un cóctel antisentido perros CXMD tienen una mutación puntual en el exón 6 conduce a una pérdida del exón 7 en el ARNm perro distrófico. Esto se traduce en el ARNm ser fuera de marco y la producción de proteína distrofina se pierde. secuencias AON cortas están diseñadas para unirse al exón 6 y 8, lo que resulta en mRNA splicing saltar efectivamente exones 6 - 8. La barra gris en los perros tratados con cóctel AON representa secuencias cortas AON. Exón 9 codifica un dominio bisagra y es a veces espontáneamente empalmado con AONs contra el exón 6 y 8. Los códigos resultantes de ARNm de la distrofina proteínas que son más cortas pero funcionanal. Por favor, haga clic aquí para ver una versión más grande de esta figura.
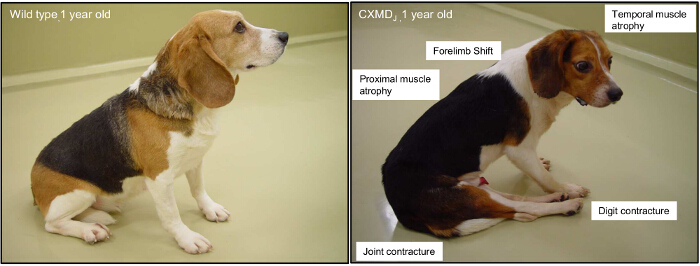
Se muestra en la Figura 2. Principales síntomas clínicos de un animal de 1 año de edad, ligada al cromosoma X canina de la Distrofia Muscular (CXMD). A 1 años de edad, beagle de tipo salvaje y un perro CXMD. La participación de los proximal, la integridad física, y los músculos temporales se observan típicamente de 2 meses de edad. Contractura de la articulación y un desplazamiento de la pelvis son abiertas a partir de 4 meses de edad. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Figura 3. La anestesia general para un perro. A) Intramusculinyecciones de Ar y biopsias musculares se llevan a cabo bajo anestesia general con isoflurano. B) La celebración del animal para inyecciones sistémicas. Haga clic aquí para ver una versión más grande de esta figura.
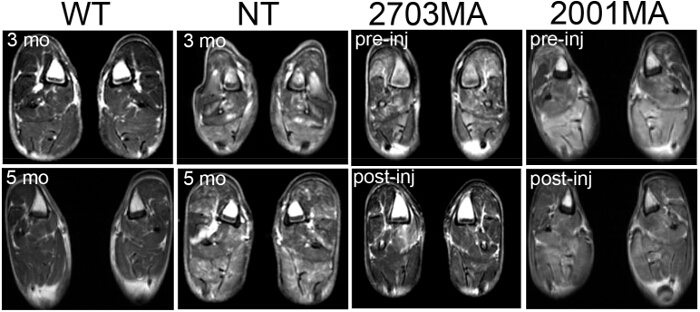
Figura 4. Imagen de Resonancia Magnética (MRI) de tipo salvaje, para no tratada CXMD, y se trata CXMD. Una resonancia magnética del miembro posterior a los 3 meses y 5 meses en WT y NT CXMD perros. Se muestran dos imágenes de la muestra de imágenes de resonancia magnética de las extremidades traseras CXMD tratados pre- (1 semana antes de la primera inyección) y post-inyección de AON. 2703MA se trató semanal 7x con 200 kg de cóctel morfolinos mg /. 2001MA se trató con inyección IV semanal 5x de 120 mg / kg de cóctel morfolinos. Control y perros tratados fueron emparejados por edad. Los perros tratados muestran una disminución de señales T2. Las imágenes son ADAP Ted con el permiso de Yokota et al. (Copyright 2009, John Wiley & Sons) 40 Haga clic aquí para ver una versión más grande de esta figura.
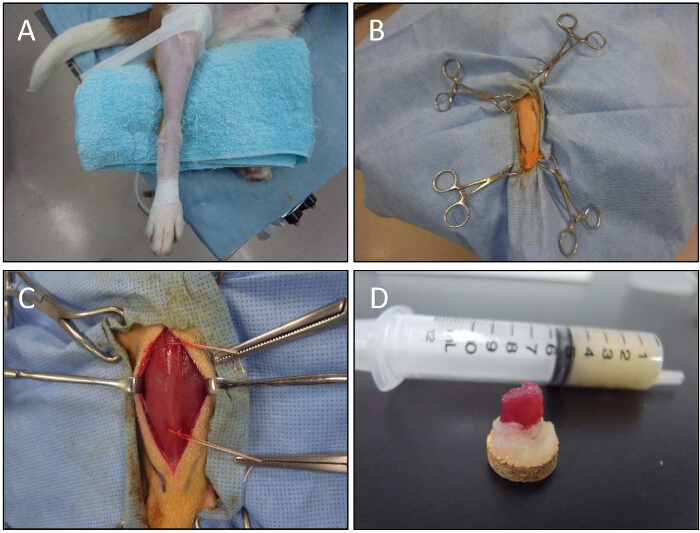
Figura 5. muscular procedimiento de biopsia para un perro. A) Un miembro inferior se fija para la biopsia muscular. B) Con la ayuda de unas pinzas, se lleva a cabo la extremidad inferior. C) El músculo CT está expuesto. técnica de biopsia abierta se utiliza para obtener muestras de músculo de sitios inyectados. Los hilos se utilizan para mantener las muestras de biopsia. Muestras D) del músculo en la goma de tragacanto después de la disección. Haga clic aquí para ver una versión más grande de esta figura.
/53776/53776fig6.jpg "/>
Se presenta la figura 6. Método semiseco de transferencia. Una representación del método de transferencia semi-seco por transferencia Western. Tres documentos empapados en tampón de ánodo concentrado se establecen en el terminal negativo; 3 papeles empapados en tampón de ánodo se apilan en la parte superior de esta. El documento Mb PVDF se empapa en tampón de ánodo metanol y, a continuación, antes de ser establecido en la parte superior de los 6 papeles. El gel, que se ha empapado en tampón de cátodo, se coloca suavemente sobre el papel PVDF. Finalmente, 3 papeles empapados en tampón de cátodo se colocan en la parte superior del gel. El terminal positivo se fija en la parte superior. Durante 1 hora, 400 mA se ejecuta a través del sistema. Por favor, haga clic aquí para ver una versión más grande de esta figura.
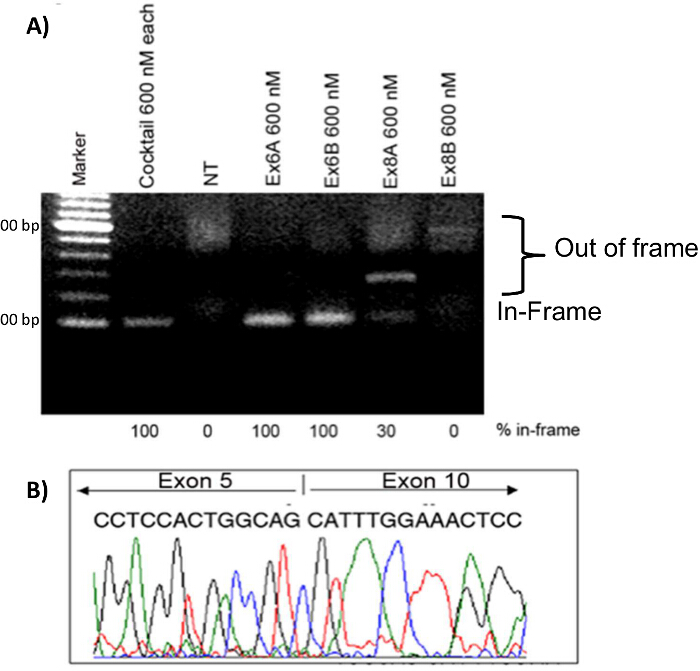
Figura 7. La omisión de exón en CXMD mioblastos. mioblastos CXMD fueron transfectadas con Ex6A, Ex6B, Ex8A, o Ex8B solo, o un cóctel de los cuatro. Se utilizó un total de 600 nM para las secuencias individuales y para el cóctel se utilizó 600 nM de cada secuencia. A) 2'OMePS tratamiento en mioblastos perro CXMD. Ex6A, Ex6B, y las muestras de cóctel tratados muestran fuertes bandas a la posición esperada de las transcripciones exón-omitido en el marco. Ex8A muestra una banda intermedia, Ex8B muestra una banda débil, y NT no muestra una banda en la posición en el marco. B) la secuencia de ADNc de Ex6A solo, 4 días después de la transfección. Las imágenes se adaptan con permiso de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8. El aumento de Dystrophin Expresión en metilados-2O (fosforotioato 2'OMePS) transfectadas CXMD mioblastos. mioblastos CXMD fueron transfectadas con Ex6A solo o con 2'OMePS cóctel. DYS-2 (rojo) y DAPI (azul) se muestran. Los mioblastos tratados se comparan con los de tipo salvaje (WT) y mioblastos no tratadas (NT). Las imágenes se adaptan con permiso de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Bar = 50 micras. Haga clic aquí para ver una versión más grande de esta figura.
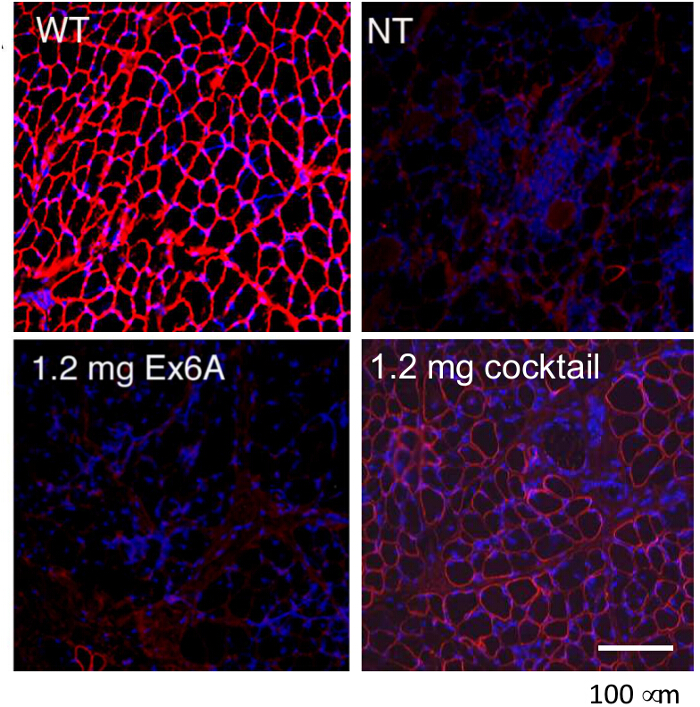
Figura 9. Rescate de la expresión de distrofina con inyecciones intramusculares de Morpholinos en CXMD perros. De cualquier Ex6A solo o un cóctel de Ex6A, Ex6B, y Ex8A se inyecta en los músculos de TC de perros CXMD. La distrofina (DSY-1) tinción de tipo silvestre(WT), no tratados (NT), y se muestran los perros tratados CXMD. Los perros fueron tratados con 1,2 mg Ex6A solo o 1,2 mg de cóctel. Las imágenes se adaptan con permiso de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Barra = 100 micras. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10. El aumento de la expresión de distrofina Después de Cocktail Tratamiento sistémico morfolino en CXMD perros. La distrofina (DYS-1) tinción se utilizó para comparar la expresión de distrofina en el tipo salvaje (WT) (control positivo), no tratados (NT) (control negativo), y perros CXMD tratados con 120 mg / kg morfolino cóctel (40 mg / kg de cada AON). El cóctel de morfolino contenía Ex6A, Ex6B, y Ex8A. Los perros fueron inyectados por vía intravenosa 5 vecesekly con este cóctel. A) Una comparación de la expresión de distrofina en los músculos tibial craneal (TC) de WT, NT, y los perros tratados. B) Una comparación de la expresión de distrofina en el tejido del corazón entre NT y los perros tratados con cóctel de morfolino. C) por inmunotransferencia de la distrofina con desmina como control de carga se muestra para WT, NT, y los perros tratados con cóctel de morfolino. Los siguientes músculos se muestran para los perros tratados: tríceps braquial (TB), bíceps braquial (BB), el diafragma (DIA), el esófago (ESO), CT, aductor (ADD), el extensor largo de los dedos (EDL), masetero (MAS), y el corazón. Las imágenes se adaptan con permiso de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Barra = 200 micras. Haga clic aquí para ver una versión más grande de esta figura.
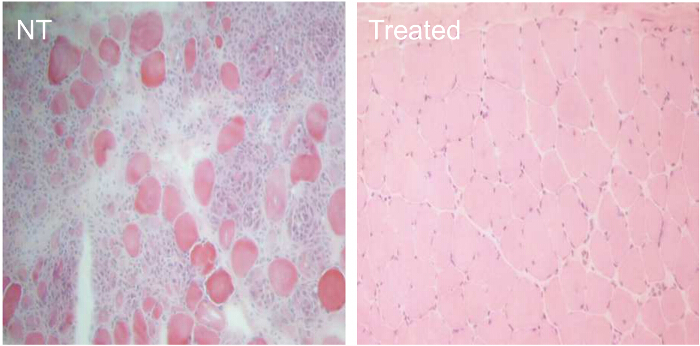
Figura11. Mejora de la histopatología en CXMD perros tratados durante 7 semanas con 240 mg / kg de cóctel morfolino. CXMD perros que van de medio año a cinco años de edad fueron inyectados por vía intravenosa con 240 mg / kg morfolino cóctel (Ex6A, Ex6B, y Ex8A) una vez al semana durante 7 semanas. Catorce días después de la última inyección, se tomaron los músculos del esófago y se hizo hematoxilina y eosina (HE) tinción. Tinción HE de los músculos del esófago de la no tratada (NT) y morfolino cóctel tratados (tratados) CXMD perros (40X lente objetivo). Haga clic aquí para ver una versión más grande de esta figura.
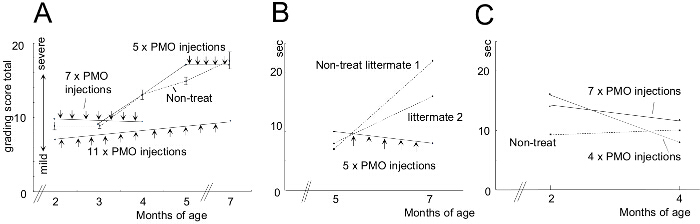
Figura 12. puntuaciones mejoraron en clasificación clínica y 15 m Duración Después de los perros tratados con morfolino morfolino tratamiento. Se compararon con los no tratados de la misma camada (NT)s. Las barras de error en el gráfico indican SEM. A) La puntuación total en el examen de graduación clínica se calculó antes y después del tratamiento y los animales tratados se compararon con los compañeros de camada NT. B) Una comparación de 15 m tiempos de funcionamiento de los perros tratados y NT. C) Similar al modelo B; sin embargo, se utilizaron perros más jóvenes. Las imágenes se adaptan con permiso de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Haga clic aquí para ver una versión más grande de esta figura.
| El oligonucleótido antisentido | secuencia de nucleótidos |
| Ex6A | GTTGATTGTCGGACCCAGCTCAGG |
| Ex6B | ACCTATGACTGTGGATGAGAGCGTT |
| Ex8A | CTTCCTGGATGGCTTCAATGCTCAC |
Tabla 1. Diseño oligonucleótido antisentido.
Discusión
La omisión de exón es una técnica terapéutica prometedora para el tratamiento de la DMD. Tanto in vitro e in vivo han demostrado que la omisión de multi-exón es factible. A continuación, se discute el uso del modelo de perro CXMD. En primer lugar, AONs fueron diseñados utilizando los programas de rescate-ESE y ESEfinder para apuntar exones de la distrofina 6 - 8. Se utilizó la química 2'OMePS AON para CXMD transfección de mioblastos y la química de la columna vertebral AON morfolino fue elegido para los experimentos in vivo. vPMOs son más eficientes que PMOs no modificados, pero debido a su toxicidad más alta que no son adecuadas para inyecciones sistémicas. La extracción de RNA, la RT-PCR, y la secuencia de ADNc se realizaron en los mioblastos CXMD. Los perros inyectados con el cóctel PMO fueron clínicamente graduada para evaluar cualquier mejora en los síntomas clínicos. Después de que los perros se sacrificaron humanamente, se tomaron muestras de músculo y se prepararon para la crio-seccionamiento. La vida media de la proteína distrofina inducida por unaONs se cree que es aproximadamente 1 - 2 meses. perros adultos jóvenes se utilizaron en este estudio, aunque estos experimentos se pueden realizar con los perros neonatales y perros de edad avanzada (> 5 años de edad). Secciones de músculo preparados se utilizaron para evaluar la histopatología y evaluar rescate proteína distrofina a través de transferencia de Western e inmunohistoquímica 48.
Es importante asegurarse de que el volumen de la solución de PMO es correcta antes de las inyecciones; Al no hacerlo tendrá efectos significativos en los resultados. Durante las inyecciones intramusculares, se requiere una presión suficiente para entrar en las fibras musculares. El seguimiento de la salud del perro y la inspección del sitio de la cirugía son importantes para la solución de problemas. Para monitorear la salud de los animales, los análisis de sangre semanales y pesada se realizará. Después de la eutanasia del animal y preparación de muestras de músculo, un paso fundamental para garantizar una sensibilidad para detectar la proteína distrofina es utilizar tanto el gel de Tris-acetato y método de transferencia semisecadurante el procedimiento de transferencia Western.
Como se muestra en los resultados representativos, mioblastos tratados con Ex6A, Ex6B, Ex8A, y el cóctel (que contiene Ex6A, Ex6B, Ex8A, y Ex8B) producido en marco productos DMD. Desde Ex8B no produjo productos exón omitido, no se utilizó en posteriores experimentos in vivo. secuenciación de cDNA mostró que los exones 6 - 9 se produjo el salto e inmunocitoquímica con DYS-2 tinción mostró restauró la expresión de distrofina en las muestras tratadas. perros tratados con AON mostraron un aumento significativo de fibras positivas de distrofina. Esto indica que los exones 6 - 8 fueron saltadas y se produjo una proteína acortada. La cantidad de fibras positivas de distrofina aumentó cuando se utilizó un cóctel de AONs y fue proporcional a la dosis AON. Las inmunotransferencias mostraron un aumento de la expresión de distrofina en los perros tratados con morfolino sistémicos. El músculo esquelético tenían niveles variables de fibras distrofina; sin embargo, el tejido del corazón morfolino-tratado mostró pocomejora en la expresión de distrofina. Desde la distrofina tiene un alto peso molecular (427 kDa), la detección de bajas cantidades de distrofina puede ser difícil. Para los mejores resultados, se utilizaron gel de Tris-acetato y el método de transferencia semi-seco. Tinción HE mostraron histopatología mejorado en los perros tratados con morfolino. fibras nucleadas centralmente (CNFs) son una muestra de músculo poco saludable y representan ciclos de degeneración y regeneración muscular. perros CXMD tratados con morfolino mostraron una disminución en el porcentaje de CNFs en comparación con los perros CXMD no tratados. graduación clínica reveló una mejoría de los síntomas, tales como el aumento de la capacidad para caminar y correr, en los animales tratados con morfolino. La dureza de los músculos se cree que reflejan la atrofia muscular, por lo tanto, se incluye en el sistema de clasificación 59. Se evaluó la dureza de los músculos del muslo (de las extremidades posteriores); Sin embargo, se excluyeron músculo sartorio craneales, ya que tienden a exhibir una hipertrofia en lugar de la atrofia en CXMD. perros tratados muestraned puntajes más bajos de calificación y tenía veces más rápido en el test de carrera 15 m. Tiempos mejorados con respecto a la prueba de 15 m son indicativos de mejora de la función muscular 40. puntajes de calificación globales más altos indican una mala salud y una mayor atrofia muscular.
Aunque estos resultados son prometedores, multi-omisión de exón todavía presenta muchos desafíos que hay que superar antes de que la técnica tiene aplicabilidad clínica. tejido cardíaco todavía muestra reducida absorción de AONs, probablemente debido a la diferencia en el tráfico celular entre el tejido cardíaco y esquelético. No se observaron efectos tóxicos se han observado en animales bajo los regímenes de dosificación actuales; Sin embargo, aún queda trabajo por hacer para evaluar la toxicidad a largo plazo antes de que el uso de cócteles AON puede pasar a los ensayos clínicos. Es difícil lograr la aprobación de drogas cóctel AON porque las agencias reguladoras definen cada secuencia AON como fármaco único. Esto significa que tendría que ser probado de forma individual para cada uno de segur secuencia en un cóctelY, lo que requiere más tiempo y más dinero. Otra barrera para el uso de multi-omisión de exón en un entorno clínico es una gran cantidad de productos de proteína de intermedios producidos con funciones desconocidas. Estas proteínas pueden potencialmente conducir a efectos secundarios impredecibles, dependiendo de la mutación individuo 22. Además, los patrones de mutación disponibles dentro de los modelos actuales de perros distróficos son limitadas. Hay pocas mutaciones naturales, y no todas las mutaciones son útiles para el estudio de multi-omisión de exón. El modelo de cerdo distrófica promete ser una buena alternativa para el futuro DMD omisión de exón 33, 34 estudios.
Los modelos de perros con DMD tienen algunas ventajas sobre otros modelos de DMD. Al ser un modelo animal más grande, la clasificación clínica y la resonancia magnética son posibles, lo que permite un análisis más detallado. Dado que los perros son los animales grandes también son más adecuados para los estudios de toxicología y representan más de cerca la enfermedad humana en comparación con el modelo de ratón. perro modelos también tienen secuencias de genes de DMD que son más similares a los humanos 23, 34, 45.
Aunque técnicamente difícil, el enfoque multi-omisión de exón podría beneficiarse en última instancia,> 90% de los pacientes con DMD 24. Esto hace que sea una alternativa mucho mejor que la omisión de un solo exón, como la omisión de exón de un solo es aplicable únicamente a un pequeño subgrupo de pacientes. Además, multi-omisión de exón nos permitirá seleccionar los patrones de deleción que optimizan la funcionalidad de las proteínas distrofina acortada. Por ejemplo, la supresión de la DMD exones 45 - 55 se asocia con síntomas leves o excepcionalmente individuos asintomáticos 14,19,60-63. La omisión multi-exón de exones 45 - 55 ya se ha demostrado en un modelo murino de DMD con una deleción del exón 52 (mdx52) usando inyecciones sistémicas de vPMOs 22,26. El uso de vPMOs cóctel se ha demostrado también en otras formas de distrofia muscular, talesFukuyama como la distrofia muscular congénita (FCMD). FCMD es causada por atrapamiento de exones, en el que el empalme de mRNA aberrante es causada por la inserción retrotransposón. vPMOs se han demostrado para rescatar el patrón de empalme tanto en un modelo de ratón FCMD y en líneas celulares humanas 64. La próxima generación de AON químicas que presentan una mayor eficacia y baja toxicidad, podría facilitar la traducción eficaz del enfoque multi-omisión de exón en la aplicación clínica. Además, la omisión de multi-exón potencialmente se podría aplicar a otros trastornos genéticos, tales como la dysferlinopathies 24, 65.
Divulgaciones
Open access fees for this article were provided by, Gene Tools, LLC.
Agradecimientos
This work was supported by The University of Alberta Faculty of Medicine and Dentistry, The Friends of Garrett Cumming Research Chair Fund, HM Toupin Neurological Science Research Chair Fund, Muscular Dystrophy Canada, Canada Foundation for Innovation (CFI), Alberta Advanced Education and Technology (AET), Canadian Institutes of Health Research (CIHR), Jesse's Journey - The Foundation for Gene and Cell Therapy, and the Women and Children's Health Research Institute (WCHRI).
Materiales
| Name | Company | Catalog Number | Comments |
| 2'OMePS Transfection of Dog Myoblasts | |||
| 3 ml 6-well plates | IWAKI | 5816-006 | |
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 11965-092 | |
| Fetal bovine serum (FBS) | HyClone | SH30071.01 | |
| Penicillin | Sigma-Aldrich | P4333 | 200 U/ml |
| Lipofectin | Invitrogen | 18292-011 | Total volume of 100 ml in opti-MEM media at a ratio of 2:1 for lipofectin. 10 ml lipofectin for 5 mg RNA. |
| 2’OMePS | Eurogentec | Ex6A (GUU GAUUGUCGGACCCAGCUCAGG), Ex6B (ACCUAUGA CUGUGGAUGAGAGCGUU), and Ex8A (CUUCCUGG AUGGCUUCAAUGCUCAC). | |
| Horse Serum | Gibco | 16050-114 | 2% |
| streptomycin | Sigma-Aldrich | P4333 | 200 μg/ml |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9418 | |
| Insulin | |||
| Morpholino transfection of dog myoblasts All material from MePS Transfection of Dog Myoblasts for culturing | |||
| Antisense morpholinos | Gene-tools | Ex6A(GTTGATTGTCGGACCCAGC TCAGG), Ex6B(ACCTATGACTGTGGATGAG AGCGTT), Ex8A(CTTCCTGGATGGCTTCAAT GCTCAC) Dilute to a final volume of 100 L in opti-MEM media. 120–200 mg/kg of morpholinos at 32 mg/ml in saline | |
| Endo-Porter | Gene-tools | ||
| guanidinium thiocyanate-phenol-chloroform | Invitrogen | 15596-018 | 1 ml/plate |
| RNA Extraction and Reverse Transcription Polymerase Chain Reaction (RT-PCR) | |||
| guanidinium thiocyanate-phenol-chloroform | Invitrogen | 15596-018 | 1 ml/plate |
| Chloroform | Sigma-Aldrich | P3803 | 200 μl |
| 1.5 ml Tubes | Eppendorf | 22363204 | |
| Centrifuge | Beckman-Coulter | ||
| 75% Ethanol | Sigma-Aldrich | 34852 | |
| UV Spectrometer | |||
| Forward primer in exon 5 | Invitrogen | CTGACTCTTGGTTTGATTTGGA 1.5 μl 10 μM | |
| Reverse primer in exon 10 | Invitrogen | TGCTTCGGTCTCTGTCAATG 1.5 μl 10 μM | |
| dNTPs | Clontech | 3040 | |
| One-Step RT-PCR kit | Qiagen | 210210 | |
| Thermo-cycler | Scinco | ||
| Complementary DNA (cDNA) Sequencing | |||
| Gel extraction kit | Qiagen | 28704 | |
| Centrifuge | |||
| Terminator v3.1 Cycle Sequencing Kit | Applied Biosystems | 4337454 | |
| Intramuscular injections or open muscle biopsy | |||
| Surgical Tools | Scissors, scalpel, needle, surgical thread | ||
| Vet Ointment | |||
| Iodophors | webtextiles | 12190-71-5 | |
| chlorohexidine | Peridex | 12134 | |
| Surgical Drapes | |||
| Scrubs | |||
| Facial Mask | |||
| Surgical Gloves | |||
| Head Covering | |||
| Thiopental sodium | Mitsubishi Tanabe Pharma | 20 mg/kg | |
| Isoflurane | Abbott laboratories | 05260-05 | 2-3% |
| Antisense morpholinos | Gene-tools | Ex6A(GTTGATTGTCGGACCCAGC TCAGG), Ex6B(ACCTATGACTGTGGATGAG AGCGTT), Ex8A(CTTCCTGGATGGCTTCAAT GCTCAC) Dilute to a final volume of 100 L in opti-MEM media. 120–200 mg/kg of morpholinos at 32 mg/ml in saline | |
| 27 G Needles | TERUMO | SG3-2325 | |
| 50 ml syringe | TERUMO | SG2-03L2225 | |
| buprenorphine hydrochloride | |||
| Tongue Depressor | |||
| cephalexin | 15 to 30 mg/kg | ||
| cefazolin | 15 to 30 mg/kg | ||
| buprenorphine | 0.01 mg/kg | ||
| buprenorphine hydrochloride | 0.02 mg/kg | ||
| Systemic Injections | |||
| Syringe infusion pump | Muromachi | ||
| 22 G Indwelling needles | TERUMO | SG3-2225 | |
| 27 G Needles | TERUMO | SG3-2325 | |
| 50 ml syringe | TERUMO | SG2-03L2225 | |
| Saline | Ohtsuka-Pharmaceutical | 28372 | |
| Clinical Grading of Dogs | |||
| Video Camera | |||
| Stop watch | |||
| Magnetic resonance imaging (MRI) | |||
| 3 Tesla MRI l | |||
| 18 cm diameter/18 cm length human extremity coil | |||
| Muscle sampling and preparation (necropsy) | |||
| Thiopental sodium | Mitsubishi Tanabe Pharma | 20 mg/kg | |
| Isoflurane | Abbott laboratories | 05260-05 | 2-3% |
| Tragacanth gum | 10-20 ml | ||
| Liquid Nitrogen | |||
| Cork Discs | Iwai-kagaku | 101412-806 | |
| Dry Ice | |||
| Tweezers | |||
| Poly-L-lysine–coated slides | Fisher | 22-037-216 | |
| Cryostat Microsystem | Leica | cm1900 | |
| Immunohistochemistry | |||
| DYS1 | Novocastra | NCL-DYS1 | 1:150 dilutions |
| DYS2 | Novocastra | NCL-DYS2 | 1:150 dilutions |
| Alexa 594 goat antimouse IgG1 | Invitrogen | A-21125 | 1:2,500 dilutions |
| Alexa 594 goat antimouse IgG2 | Invitrogen | A-11005 | 1:2,500 dilutions |
| DAPI | Invitrogen | D1306 | Contains mounting agent |
| Goat Serum | Invitrogen | 10000C | 15% |
| PBS | |||
| Moisture chamber | Scientific Devise Laboratory | 197-BL | |
| Chamber slide | Lab-tek | 154453 | |
| Cover Glasses | Fisher | 12-540A | |
| Hydrophobic barrier pen | |||
| Fluorescent microscope | 594 nm at 20X magnification. | ||
| Western Blotting | |||
| Distillied Water | |||
| Hand Homogenizer | |||
| 2× Laemmli SDS-loading buffer | 0.1 M Tris–HCl (pH 6.6), 2% (w/v) SDS, 2% (0.28 M) beta-mercaptoethanol, 20% glycerol, 0.01% bromophenol blue | ||
| SDS gels | Bio-Rad | 161-1210 | 5% resolving |
| SDS gels | Invitrogen | Invitrogen, WG1601BOX | 3-8% |
| PVDF membrane | GE | 10600021 | |
| Methanol | |||
| Running buffer (10×) | 250 mM of Tris-Base, 1,920 mM of Glycine | ||
| Running buffer (1×) | 10% 10× buffer, 20% methanol | ||
| 0.05% PBS/Tween 20 (PBST) | 2,000 ml 3× 200 ml for washing | ||
| PBST/5% milk powder | 100 ml | ||
| Protein Assay Kit | BCA | T9650 | |
| Tween 20 | Sigma | P5927 | |
| Urea | Sigma | U5378 | |
| Beta Mercaptoethanol | Millipore | ES-007-E | |
| SDS | Sigma | L3771 | |
| Tris-Acetate | Sigma | ||
| Tris HCl | Sigma | T3253 | |
| Glycerol | Sigma | G8773 | |
| Loading/sample buffer for Western blotting | NuPage Invitrogen | NP007 | |
| NaCl | Sigma | S3014 | |
| PMSF | Sigma | P7626 | |
| Protease cocktail inhibitor | Roche | 11836153001 | |
| Cathode Buffer | 0.025 M Tris base + 40 mM 6-aminocaproic acid + 20% Methanol | ||
| Anode Buffer | 0.03 M Tris Base + 20% Methanol | ||
| Concentred Anode Buffer | 0.3 M Tris base + 20% Methanol | ||
| desmin antibody | Abcam | ab8592 | |
| DYS1 | Novocastra | NCL-DYS1 | 1:150 dilutions |
| ImageJ Software | |||
Referencias
- Duchenne, A. The Pathology of Paralysis with Muscular Degeneration (Paralysie Myosclerotique), or Paralysis with Apparent Hypertrophy. Br Med J. 14 (2), 541-542 (1867).
- Zellweger, H., Antonik, A. Newborn screening for Duchenne muscular dystrophy. Pediatrics. 55 (1), 30-34 (1975).
- Echigoya, Y., Yokota, T. Skipping multiple exons of dystrophin transcripts using cocktail antisense oligonucleotides. Nucleic Acid Ther. 24, 57-68 (2014).
- Bushby, R. F., Birnkrant, D. J., et al. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and pharmacological and psychosocial management. The Lancet Neurology. 9 (1), 77-93 (2010).
- Eagle, M., Baudouin, S. V., Chandler, C., Giddings, D. R., Bullock, R., Bushby, K. Survival in Duchenne muscular dystrophy: improvements in life expectancy since 1967 and the impact of home nocturnal ventilation. Neuromuscul. Disord. 12 (10), 926-929 (2002).
- Heald, A., Anderson, L. V., Bushby, K. M., Shaw, P. J. Becker muscular dystrophy with onset after 60 years. Neurology. 44 (12), 2388-2390 (1994).
- Stöllberger, C., Finsterer, J. Worsening of heart failure in Becker muscular dystrophy after non-steroidal anti-inflammatory drugs. Med. J. 98 (4), 478-480 (2005).
- Passamano, L., et al. Improvement of survival in Duchenne Muscular Dystrophy: retrospective analysis of 835 patients. Acta Myol. 31 (2), 121-125 (2012).
- Hoffman, E. P., Brown, R. H., Kunkel, L. M. Dystrophin: the protein product of the Duchenne muscular dystrophy locus. Cell. 51 (6), 919-928 (1987).
- Koenig, M., et al. Complete cloning of the Duchenne muscular dystrophy (DMD) cDNA and preliminary genomic organization of the DMD gene in normal and affected individuals. Cell. 50 (3), 509-517 (1987).
- Takeshima, Y., et al. Mutation spectrum of the dystrophin gene in 442 Duchenne/Becker muscular dystrophy cases from one Japanese referral. JHG. 55 (6), 379-388 (2010).
- White, S. J., et al. Duplications in the DMD gene. Hum. Mutat. 27, 938-945 (2006).
- Yokota, T., Duddy, W., Echigoya, Y., Kolski, H. Exon skipping for nonsense mutations in Duchenne muscular dystrophy: too many mutations, too few patients. Expert Opin. Biol. Ther. 12 (9), 1141-1152 (2012).
- Yokota, T., Duddy, W., Partridge, T. Optimizing exon skipping therapies for DMD. Acta Myol. 26 (3), 179-184 (2007).
- Magri, F., et al. Genotype and phenotype characterization in a large dystrophinopathic cohort with extended follow-up. J Neurol. 258 (9), 1610-1623 (2011).
- Yoshida, H. H., Ishikawa-Sakurai, M. Biochemical evidence for association of dystrobrevin with the sarcoglycan- sarcospan complex as a basis for understanding sarcogly- canopathy. Hum. Mol. Genet. 9 (7), 1033-1040 (2000).
- Bies, R. D., Caskey, C. T., Fenwick, R. An intact cysteine-rich domain is required for dystrophin function. J. Clin. Invest. 90 (2), 666-672 (1992).
- Monaco, A. P., Bertelson, C. J., Liechti-Gallati, S., Moser, H., Kunkel, L. M. An explanation for the phenotypic differences between patients bearing partial deletions of the DMD locus. Genomics. 2 (1), 90-95 (1988).
- Aoki, Y., Yokota, T., Wood, M. J. Development of multiexon skipping antisense oligonucleotide therapy for Duchenne muscular dystrophy. Biomed Res Int. 2013 (402369), (2013).
- Cirak, V. A. -. G., Guglieri, M., et al. Exon skipping and dystrophin restoration in patients with Duchenne muscular dystrophy after systemic phosphorodiamidate morpholino oligomer treatment: an open-label, phase 2, dose-escalation study. The Lancet. 378 (9791), 595-605 (2011).
- Goemans, N. M., et al. Systemic administration of PRO051 in Duchenne's muscular dystrophy. N Engl J Med. 364 (16), 1513-1522 (2011).
- Echigoya, Y., et al. Long-term efficacy of systemic multiexon skipping targeting dystrophin exons 45-55 with a cocktail of vivo-morpholinos in mdx52 mice. Mol Ther Nucleic Acids. 4, (2015).
- Hoffman, E. P., et al. Restoring dystrophin expression in Duchenne muscular dystrophy muscle progress in exon skipping and stop codon read through. Am J Pathol. 179 (1), 12-22 (2011).
- Aartsma-Rus, A., et al. Antisense-induced multiexon skipping for Duchenne muscular dystrophy makes more sense. Am J Hum Genet. 74 (1), 83-92 (2004).
- Aartsma-Rus, A., Kaman, W. E., Weij, R., Tden Dunnen, J., van Ommen, G. J., van Deutekom, J. C. Exploring the frontiers of therapeutic exon skipping for Duchenne muscular dystrophy by double targeting within one or multiple exons. Mol. Ther. 14 (3), 401-407 (2006).
- Aoki, Y., et al. Bodywide skipping of exons 45-55 in dystrophic mdx52 mice by systemic antisense delivery. Proc Natl Acad Sci U S A. 109 (34), 13763-13768 (2012).
- McClorey, G., Iversen, P. L., Moulton , H. M., Fletcher, S., Wilton, S. D. Antisense oligonucleotide-induced exon skipping restores dystrophin expression in vitro in a canine model of DMD. Gene Ther. 13 (19), 1373-1381 (2006).
- Sharp, N. J., et al. An error in dystrophin mRNA processing in golden retriever muscular dystrophy, an animal homologue of Duchenne muscular dystrophy. Genomics. 13 (1), 115-121 (1992).
- Shimatsu, Y., et al. Canine X-linked muscular dystrophy in Japan (CXMDJ). Exp Anim. 52 (2), 93-97 (2003).
- Nguyen, F., Cherel, Y., Guigand, L., Goubault Leroux, I., Wyers, M. Muscle lesions associated with dystrophin deficiency in neonatal golden retriever puppies. J Comp Pathol. 126 (2-3), 100-108 (2002).
- Nakamura, A., Takeda, S. Mammalian models of Duchenne Muscular Dystrophy: pathological characteristics and therapeutic applications. J Biomed Biotechnol. 2011 (184393), (2011).
- Yokota, T., et al. A renaissance for anti-sense oligonucleotide drugs in neurology: Exon-skipping breaks new ground. Arch. Neurol. 66, 32-38 (2009).
- Aartsma-Rus, A., et al. Theoretic applicability of antisense-mediated exon skipping for Duchenne muscular dystrophy mutations. Hum. Mutat. 30 (3), 293-299 (2009).
- Yu, X., Bao, B., Echigoya, Y., Yokota, T. Dystrophin-deficient large animal models: translational research and exon skipping. Am. J. Transl. Res. 7 (8), 1214-1231 (2015).
- Yin, H., Moulton, H., Betts, C., Wood, M. CPP-directed oligonucleotide exon skipping in animal models of Duchenne muscular dystrophy. Methods Mol Biol. 683, 321-338 (2011).
- Moulton, H. M., Moulton, J. D. Morpholinos and their peptide conjugates: therapeutic promise and challenge for Duchenne muscular dystrophy. Biochim. Biophys. Acta. 1798 (12), 2296-2303 (2010).
- Morcos, P. A., Li, Y., Jiang, S. Vivo-Morpholinos: a non-peptide transporter delivers Morpholinos into a wide array of mouse tissues. BioTechniques. 45 (6), 613-614 (2008).
- Betts, C., et al. A New Generation of Peptide-oligonucleotide Conjugates With Improved Cardiac Exon Skipping Activity for DMD Treatment. Mol Ther Nucleic Acids. 14 (1), e38 (2012).
- Saito, T., et al. Antisense PMO found in dystrophic dog model was effective in cells from exon 7-deleted DMD patient. PLoS One. 5 (8), e12239 (2010).
- Yokota, T., et al. Efficacy of systemic morpholino exon-skipping in Duchenne dystrophy dogs. Ann Neurol. 65 (6), 667-676 (2009).
- Melacini, P., et al. Cardiac and respiratory involvement in advanced stage Duchenne muscular dystrophy. Neuromuscul. Disord. 6 (5), 367-376 (1996).
- Guncay, A., Yokota, T. Antisense oligonucleotide drugs for Duchenne muscular dystrophy: how far have we come and what does the future hold. Future Med. Chem. 7 (13), 1631-1635 (2015).
- Fairbrother, W. G., Yeh, R. F., Sharp, P. A., Burge, C. B. Predictive identification of exonic splicing enhancers in human genes. Science. 297, 1007-1013 (2002).
- Cartegni, L., Wang, J., Zhu, Z., Zhang, M. Q., Krainer, A. R. ESEfinder: A web resource to identify exonic splicing enhancers. Nucleic Acids Res. 31, 3568-3571 (2003).
- Yokota, T., Hoffman, E., Takeda, S. Antisense oligo-mediated multiple exon skipping in a dog model of duchenne muscular dystrophy. Methods Mol Biol. 709, 299-312 (2011).
- Jenuth, J. P. The NCBI. Publicly available tools and resources on the Web. Methods Mol Biol. 132, 301-312 (2000).
- Yokota, T., et al. Extensive and Prolonged Restoration of Dystrophin Expression with Vivo-Morpholino-Mediated Multiple Exon Skipping in Dystrophic Dogs. Nucleic Acid Ther. , (2012).
- Summerton, J. E. Endo-Porter: a novel reagent for safe, effective delivery of substances into cells. Ann. N. Y. Acad. Sci. 1058, 62-75 (2005).
- Mangram, A. J., et al. Guideline for Prevention of Surgical Site Infection. Am J Infect Control. 27, 97-134 (1999).
- Reichman, D. E., Greenberg, J. A. Reducing Surgical Site Infections. A Review . Rev Obstet Gynecol. 2, 212-221 (2009).
- Mizuno, H., Nakamura, A., Aoki, Y., Ito, N., Kishi, S., Yamamoto, K., Sekiguchi, M., Takeda, S., Hashido, K. Identification of muscle-specific microRNAs in serum of muscular dystrophy animal models: promising novel blood-based markers for muscular dystrophy. PloS one. 6, (2011).
- Shimatsu, Y., et al. Major clinical and histopathological characteristics of canine X-linked muscular dystrophy inJapan, CXMDJ. Acta Myol. , 145-154 (2005).
- Evans, H., de Lahunta, A. Guide to the Dissection of the Dog. SAUNDERS. , (2009).
- Girish, V., Vijayalakshmi, A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer. 41 (47), (2004).
- Bearer, E. L., et al. Overview of image analysis, image importing, and image processing using freeware. Current protocols in molecular biology. 14, (2003).
- Shimatsu, Y., et al. Major clinical and histopathological characteristics of canine X-linked muscular dystrophy inJapan, CXMDJ. Acta Myol. 24, 145-1454 (2005).
- Beroud, C., et al. Multiexon skipping leading to an artificial DMD protein lacking amino acids from exons 45 through 55 could rescue up to 63% of patients with Duchenne muscular dystrophy. Hum Mutat. 28, 196-202 (2007).
- Ferreiro, V., et al. Asymptomatic Becker muscular dystrophy in a family with a multiexon deletion. Muscle Nerve. 39, 239-243 (2009).
- Nakamura, A., et al. Follow-up of three patients with a large in-frame deletion of exons 45-55 in the Duchenne muscular dystrophy (DMD) gene. J Clin Neurosci. 15, 757-763 (2008).
- Yokota, T., Pistilli, E., Duddy, W., Nagaraju, K. Potential of oligonucleotide-mediated exon-skipping therapy for Duchenne muscular dystrophy. Expert Opin Biol Ther. 7, 831-842 (2007).
- Taniguchi-Ikeda, M., et al. Pathogenic exon-trapping by SVA retrotransposon and rescue in Fukuyama muscular dystrophy. Nature. 478, 127-131 (2011).
- Lee, J. J., Yokota, T. Antisense therapy in neurology. J Pers Med. 3, 144-176 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados