Method Article
Aplicaciones de la sonda: Single-Imaging espectrometría de masas y análisis de celda única bajo condiciones ambientales
En este artículo
Resumen
Here, we present protocols to perform both ambient mass spectrometry imaging (MSI) of tissues and in-situ live single cell MS (SCMS) analysis using the single-probe, which is a miniaturized multifunctional device for MS analysis.
Resumen
Mass spectrometry imaging (MSI) and in-situ single cell mass spectrometry (SCMS) analysis under ambient conditions are two emerging fields with great potential for the detailed mass spectrometry (MS) analysis of biomolecules from biological samples. The single-probe, a miniaturized device with integrated sampling and ionization capabilities, is capable of performing both ambient MSI and in-situ SCMS analysis. For ambient MSI, the single-probe uses surface micro-extraction to continually conduct MS analysis of the sample, and this technique allows the creation of MS images with high spatial resolution (8.5 µm) from biological samples such as mouse brain and kidney sections. Ambient MSI has the advantage that little to no sample preparation is needed before the analysis, which reduces the amount of potential artifacts present in data acquisition and allows a more representative analysis of the sample to be acquired. For in-situ SCMS, the single-probe tip can be directly inserted into live eukaryotic cells such as HeLa cells, due to the small sampling tip size (< 10 µm), and this technique is capable of detecting a wide range of metabolites inside individual cells at near real-time. SCMS enables a greater sensitivity and accuracy of chemical information to be acquired at the single cell level, which could improve our understanding of biological processes at a more fundamental level than previously possible. The single-probe device can be potentially coupled with a variety of mass spectrometers for broad ranges of MSI and SCMS studies.
Introducción
Mass spectrometry imaging (MSI) is a relatively new molecular imaging technique to provide the spatial distribution of the compounds of interest on surfaces. During the MSI analysis, mass spectrometry (MS) measurements are recorded across the surface on an individual pixel basis to create a 2D image of the species of interest 1. MSI techniques have the ability to provide a spatially resolved feature distribution for a large range of metabolites, allowing a much greater amount of information to be obtained from a sample than from using traditional molecular imaging techniques, and they have the potential to greatly improve the analysis of biological samples for biological and pharmacology studies 2. MSI can be broadly separated into non-ambient and ambient approaches. The non-ambient MSI analysis techniques, such as matrix assisted laser desorption ionization (MALDI) MS 3 and time of flight secondary ion MS (ToF SIMS) 4, are capable of high spatial resolution (around 5 µm and 100 nm, respectively) and high sensitivity. However, these methods require extensive sample preparation, such as the application of matrix molecules to the sample surface, and a vacuum sampling environment, which could introduce artifacts to the data obtained. Ambient techniques such as desorption electrospray ionization (DESI) MS 5, laser ablation electrospray ionization (LAESI) MS 6, and nano-DESI MS 7 are capable of MSI of samples with little to no prior preparation under the ambient environment, which is able to produce MS images that potentially reflect the sample in its most native state. However, most of these techniques generally lack the high spatial resolution and detection sensitivity compared with the non-ambient techniques, with experiments typically conducted at around 150 µm per pixel 8.
Single cell analysis (SCA) is a growing field that has the ability to characterize the chemical composition of biological samples at the cellular level. SCA enables the analysis of biological systems at a more fundamental level than traditional cell analysis techniques, which produce an averaged result of a population of cells, potentially providing insights that are previously intractable 9. MS techniques have recently been applied to SCA (termed single cell mass spectrometry or SCMS) using non-ambient techniques such as MALDI MS 10 and ToF SIMS 11 in which cells are pretreated before analysis, and with ambient techniques such as LAESI MS 12 and direct extraction methods, such as live single-cell video-MS 13, 14, to analyze a wide variety of cell types such as egg, plant, and cancer. Ambient techniques have the advantage of being applied to live cells, which again minimizes the artifacts, leading to a better representation of the metabolites in the live cells. The direct extraction based methods described above, however, perform the sample extraction and analysis process at two different steps, which result in a time gap during the analysis that could potentially alter the metabolites present within the sample.
The single-probe, a miniaturized multifunctional device that is capable of conducting high spatial resolution ambient MSI on biological tissue sections 15 and near real-time in-situ SCMS on live single cells 16. The single-probe has an integrated construction that is made up of a pulled dual-bore quartz capillary coupled with a solvent providing inlet and a nano-ESI emitter made from fused silica capillaries, enabling solvent delivery and analyte extraction to be performed from a single device. In the ambient MSI mode, the single-probe is placed over the sample tissue and surface micro-extraction occurs, allowing a rastered MS image to be made at high spatial resolution. Particularly, the tapered tip of the single-probe is small enough to be inserted into live eukaryotic cells for in-situ SCMS analysis, where the metabolite detection takes less than two seconds between probe insertion and MS detection, allowing chemical information to be taken in near real-time. Here are the protocols to fabricate the single-probe device and to conduct both the ambient MSI and SCMS modes using the single-probe MS techniques.
Protocolo
el uso y el bienestar de los animales deben cumplir con la Guía del NIH para el Cuidado y Uso de Animales de Laboratorio siguiendo los protocolos revisados y aprobados por el Comité de Cuidado y Uso de Animales Institucional (IACUC). muestras de tejido de ratón fueron proporcionados por el colaborador Dr. Chuanbin Mao.
1. Ratón de tejidos sección de la preparación
- Colocar un órgano del ratón entero de interés (cerebro, riñón, hígado, etc.) en el centro de un pequeño plástico bien (por ejemplo, de 12 pocillos placa de cultivo celular), y sumergir en el tejido incrustación de compuesto de hasta aproximadamente 10 mm de altura. Asegúrese de que no hay ninguna burbuja formada en el compuesto incrustación de tejidos y que el órgano se coloca en la orientación deseada (es decir, sagital, coronal, etc.).
- Inmediatamente colocar los tejidos en nitrógeno líquido para congelar flash. Para el almacenamiento a largo plazo, almacenar las muestras congeladas en un congelador a -80ºC.
- Tome el órgano del ratón congelado y descongelar a -15 ° C en una temperature criomicrotomo controlada.
- tejido Secure sobre una base de acero con aproximadamente 500 l de compuesto de la incrustación de tejido y el lugar en un criomicrotomo seccionar el montaje de manera que la orientación de seccionamiento deseada se presenta a la cuchilla.
- Sección del tejido a un espesor 12 micras. Coloca las rebanadas de tejidos seccionados en portaobjetos de microscopio de policarbonato y dejar secar durante 30 minutos a temperatura ambiente. Para el almacenamiento a largo plazo, almacenar la diapositiva congelada en un congelador a -80ºC.
2. Cultura de la célula
Nota: El cultivo celular se realizó en cabina de seguridad biológica (Bioseguridad Nivel II) en condiciones estériles. línea de células HeLa se usó como un modelo de sistema, y las células se cultivaron en medio de cultivo completo con los siguientes protocolos convencionales:
- Reactivos calientes (es decir, la tripsina, la solución salina tamponada con fosfato (PBS), y medio de cultivo celular) a 37 ° C.
Nota: El medio de cultivo celular contiene sa inorgánicolts, aminoácidos, vitaminas, y otros. Para obtener una lista completa de los componentes, se refieren a la formulación por parte del fabricante. - Obtener muestra de células (por ejemplo, 1 ml de suspensión de células HeLa) y añadirlo en 9 ml de medio de cultivo celular completo en una placa de cultivo celular estándar de 10 cm. El número inicial de células es de alrededor de 0,5 x 10 6 células / ml. Mantener las células en cultivo a 37 ° C con 5% de CO 2 durante 2-3 días hasta que la superficie de crecimiento está cubierto a 70-80% en la placa de cultivo celular. número de pases celulares registro para cada ronda sucesiva.
- Realizar pases de células (es decir, la división celular) en la placa de cultivo celular.
- Aspirar el medio de crecimiento, y el uso de 5 ml de PBS 1x para aclarar las células. Retirar PBS utilizando una punta de aspiración estéril, y se incuban las células con 2,5 ml de tripsina (0,25%) durante ~ 5 min a 37 ° C para separar las células de la placa de cultivo.
Nota: El tiempo de tratamiento necesario tripsina real para ser optimizado de acuerdo con la produ tripsina específicact compró al fabricante. tiempo de tratamiento inadecuada deja las células unidas a la placa, mientras que el tratamiento excesivo conduce a la muerte celular. - Deja de actividad de la tripsina mediante la adición de 7,5 ml de medio de cultivo de células completa, y luego volver a suspender uniformemente las células (volumen total 10 ml). Utilice la suspensión de células para cultivo (paso 2.2) o la preparación de muestras SCMS (paso 2.4).
- Aspirar el medio de crecimiento, y el uso de 5 ml de PBS 1x para aclarar las células. Retirar PBS utilizando una punta de aspiración estéril, y se incuban las células con 2,5 ml de tripsina (0,25%) durante ~ 5 min a 37 ° C para separar las células de la placa de cultivo.
- Preparar las muestras de células para los experimentos SCMS.
- Colocar los portaobjetos de micro portadas individuales en una placa de 12 pocillos, y añadir medio de cultivo de células 1,8 ml y 0,2 ml de suspensión celular en el pozo.
- Mezclar suavemente las células con agitación suave de la placa, y se incuba en un entorno de 5% de CO2 a 37 ° C durante ~ 24 h. Para llevar a cabo el tratamiento de drogas a las células cultivadas, añadir una solución del compuesto de fármaco (por ejemplo, en DMSO (sulfóxido de dimetilo)) en placa de cultivo celular de 12 pocillos.
Nota: La concentración de fármaco final (por ejemplo, 10 nM, 100 nM, 1 mM, y 10 mM) y tratamiento tiempo (por ejemplo, 4 horas) se varió de acuerdo con el propósito específico de los estudios. Las células están asociadas a las diapositivas micro cubierta y listo para los experimentos CSMS (paso 6).
Fabricación 3.-sonda individual
- Coloque el tubo de cuarzo de doble orificio (diámetro interior (ID) 127 m, diámetro exterior (OD) a 500 micras) en un extractor de micropipeta láser y tirar de una aguja de cuarzo de doble orificio. Utilice los siguientes parámetros como puntos de partida: Calor = 400, Fil = 3, Vel = 80, Del = 150, y = 250 Pul (todas las unidades son unidades del fabricante). Asegúrese de que la aguja de doble orificio de cuarzo tirado tiene una punta cónica para las propiedades óptimas de la sonda. Cortar la punta retirado de modo que no es de ~ 5 mm de largo de unpulled capilar de cuarzo de doble orificio a la izquierda en el otro extremo.
Nota: Los parámetros reales del extractor láser debe ser optimizado de acuerdo con las condiciones específicas del instrumento. - Cortar una sección de ~ 80 mm de capilar de sílice fundida (ID 40 micras, OD. 105 micras) como disolvente proporcionando capilar, y la inserta en un orificio en el extremo plano de la aguja de cuarzo de doble orificio.
- Cortar una sección de ~ 40 mm de capilar de sílice fundida (ID 40 micras, OD 105 micras) y el uso de una navaja de afeitar ~ 5 mm de la capa de poliimida del punto medio. Utilizar una llama de propano para calentar y tire del capilar cerrado en un emisor de ionización por electrospray nano-(ESI) con una fina cónica rápidamente. Cortar un emisor de nano-ESI (~ 7-10 mm de largo), y la inserta en el otro orificio en el extremo plano de la aguja de cuarzo de doble orificio. Como alternativa, utilice el extractor de láser para producir una fina cónica.
- Aplicar una cantidad mínima de resina de curado UV (~ 1-2 l) en el extremo plano de la aguja de cuarzo de doble ánima, y solidificar la resina usando una lámpara UV LED para ~ 20 seg para asegurar el disolvente proporcionando capilar y la nano- ESI emisor. Los procedimientos para ensamblar las partes individuales en una sola sonda se muestran en la Figura 1a.
- Corte un microscopio estándar gldiapositiva culo (1 "x 3") en la mitad a lo largo. Coloque la única sonda en un extremo de la lámina de vidrio de modo que el emisor de nano-ESI apunta hacia el exterior. Aplicar el epoxi regular para el cuerpo de la sonda de un solo modo que se convierta asegura sobre el portaobjetos de vidrio (Figura 1b). Dejar toda la noche para el endurecimiento. Pareja la sola sonda fabricada con la configuración de una sola sonda integrada (Figura 1c), que está unido a un espectrómetro de masas como se ilustra en la Figura 1d.
4. Construir el único integrado con sonda de instalación de MS
- Modificar la brida de interfaz de fuente de iones del espectrómetro de masas y fabricar el soporte (con posición ajustable y altura) de la estereoscopio digital (figuras 1e y 1f).
- Perforar un reborde interfaz de fuente de iones con dos agujeros que permiten la fijación de una junta óptica de aluminio. Hacer un dispositivo de carril de deslizamiento y una varilla de ajuste de altura (que se adjunta a launa etapa XY para la posición de ajuste fino), de manera que el sistema estereoscopio digital puede estar unido a la placa óptica de aluminio (Figura 1e).
- Una el microscopio modificado estéreo digital, un microscopio digital USB, una etapa de traducción XYZ manual de miniatura con un soporte de abrazadera flexible, el sistema de plataforma de traslación motorizado XYZ a la placa óptica de aluminio, que se monta en la brida de interfaz de fuente de iones a medida del espectrómetro de masas (Figuras 1c y 1f). Utilice el soporte de abrazadera flexible para fijar el portaobjetos de vidrio unida con una sola sonda.
- Fije la configuración de una sola sonda hasta el espectrómetro de masas (Figura 1F). Ajuste el soporte de la mordaza flexible y la etapa de XYZ miniatura para colocar el emisor del single-sonda en frente de la entrada del espectrómetro de masas. Utilizar el microscopio digital USB (con ángulo de visión ajustable) en el lado de una sola sonda para proporcionar una imagen con zoom-in del single-ppunta de la túnica o el emisor de nano-ESI, y el estereoscopio digital (regulable en altura) por encima de la única sonda para ver las células y la punta de la sonda.
Nota: El uso de la brida correspondiente fuente de iones, este sistema de una sola sonda integrada puede ser acoplado a cualquier otro tipo de espectrómetros de masas equipados con fuentes de ionización ambiente.
5. ambiente MSI
- Descongelar la sección de la muestra a temperatura ambiente y colocarlo en el sistema de plataforma de traslación motorizada XYZ debajo de la sola sonda. Ajustar la posición de la muestra por el cambio de las coordenadas en el software de control.
- El uso de la jeringa para bombear el disolvente de muestreo a una tasa apropiada (por ejemplo, 0,2 l / min), y se aplica el voltaje de ionización (por ejemplo, 5 kV). La selección del disolvente de muestreo es flexible, y los más comunes incluyen MeOH: agua (9: 1) y acetonitrilo. El volumen muerto del emisor nano-ESI se estimó en ~ 3 nl, y el tiempo entre la sonda-surface el contacto y la observación de la señal de iones es por lo general menos de 1 seg 15.
Nota: La brida de interfaz de fuente de iones a medida permite la tensión de ionización que se entregarán a partir del espectrómetro de masas para una unión conductora a través de una pinza de cocodrilo. El voltaje de ionización se transmite entonces a través de una unión conductora para el disolvente en el interior del capilar y los canales de una sola sonda, y se aplicó sobre el emisor nano-ESI para ionizar los analitos en la muestra. Asegúrese de que el voltaje de ionización se apaga cuando se conecta la pinza de cocodrilo con la unión conductora. - Ajustar la altura de la única sonda de modo que está descansando justo por encima de la superficie de la muestra y capaz de realizar la superficie de extracción de los metabolitos. Levante con cuidado el Z-etapa, y luego usar el microscopio digital USB (en el lado del single-sonda) para monitorear el cambio distancia entre la punta de una sola sonda y la superficie del tejido. Monitorear los cambios en el espectro de masas durante este ajuste en altura, y dejar de ascensoring la Z-etapa en la que se observa un cambio de la señal de ion de fondo disolvente a metabolitos de tejido.
- Repita el paso 5.3 tres veces para ajustar tres puntos diferentes dentro del programa de control de la etapa de ajuste de aplanar la superficie automatizado. Coloque la punta de la sonda sola en tres puntos sobre la superficie de la muestra a una distancia de unos 10 mm de distancia entre sí. Realizar el ajuste de altura pulsando el arriba y abajo de los iconos, y bloquear los tres puntos en su posición en el marco del "Plan de método".
- Establecer otros parámetros de rastering a través de la sección de interés dentro de la muestra utilizando este programa. Para las secciones de riñón de ratón que aquí se presentan, utilizar una / s de velocidad de Barrido de 10,0 micras y 20 micras distancia entre líneas. El sistema de plataforma motorizada tiene un movimiento mínimo de la subasta 0,1 micras mínimo. La distancia entre la punta y el tejido de una sola sonda se obtiene de la etapa 5.3.
- Configuración de un método automatizado para la adquisición de espectros de MS desde el espectrómetro de masas. for resolución de masas de alta MSI en muestra de riñón de ratón, utilice los siguientes parámetros: la resolución de masa de 60.000 (m / Delta M), ~ modo positivo 5 kV, 1 Microscan, tiempo de inyección de 150 ms como máximo, y en AGC. Todos los espectros de MS adquiridos representan líneas individuales de la imagen MS tenían el mismo número de exploraciones con una separación de tiempo uniforme entre cada exploración, lo que indica que los tamaños de pixel de las imágenes producidas se distribuyeron de manera uniforme.
- Iniciar la adquisición de datos de MSI. Iniciar la secuencia de adquisición de MS para el espectrómetro de masas, y luego iniciar la secuencia de Barrido de para el programa de control de XYZ.
- Por ejemplo, en el programa de adquisición de datos MS utilizado aquí, ir a "Configuración de Secuencia", seleccione "Nueva secuencia", generar un conjunto de archivos para una nueva secuencia numerada de 01 a X, donde X es el número de líneas utilizadas para la MS imagen deseada que deben tomarse, a continuación, pulse "secuencia de ejecución".
- Utilice un dispositivo electrónico hecho en casa para permitir que el software para producir una contaseñal de cierre de la TC para el espectrómetro de masas para recoger los datos. El diagrama de circuito se muestra en la figura complementaria (Figura S1) como referencia.
- MS construir imágenes de archivos de MS primas que utilizan software de visualización MSI apropiado. Por ejemplo, cuando se utiliza el paquete de software desarrollado por el grupo de Laskin en PNNL 17, realice los siguientes pasos.
- Haga clic en "Archivo cejas." Seleccione el primer archivo obtenido a partir del experimento de MSI. Especifique la ubicación del archivo comienza y termina en "Número de líneas". Seleccionar un rango de valores de m / z para el rango de la imagen MS en "Enter MZ Rango".
- Presione el botón "Inicio" para iniciar el proceso de creación de la imagen. Una vez tomada la imagen MS, haga clic en "Guardar imagen" en "Barra de herramientas" para almacenar las imágenes en el ordenador.
6. En situ vivo SCMS
- Configuración del sistema de una sola sonda según instruyaiones de MSI. Ajuste el disolvente (por ejemplo, MeOH / H 2 O o acetonitrilo) velocidad de flujo (por ejemplo, ~ 25 nl / min).
- Se lavan las células cultivadas, que se adjuntan en los portaobjetos de vidrio cubierta de micro, con PBS para eliminar el medio cultural y componentes extracelulares de la droga. Colocar célula que contiene portaobjetos de vidrio en el sistema motorizado etapa de traslación XYZ para el experimento.
Nota: Como alternativa, utilice el medio de cultivo celular fresco (sin contenía suero bovino fetal) para enjuagar las células cultivadas. se observó una supresión de iones menos. Además, la célula puede sobrevivir durante más tiempo durante el experimento donde la temperatura ambiente (~ 20 ° C) es significativamente menor que la temperatura de cultivo (37 ° C). El tipo de fármaco, la concentración de la solución, y el tiempo de tratamiento varían en los diferentes estudios. - Enfocar el microscopio estéreo digital (por encima de la muestra) sobre la punta de la sonda de un solo para controlar la penetración celular durante el análisis. Utilizar el microscopio digital USB (en el side del single-sonda) para supervisar las condiciones de trabajo del emisor nano-ESI en el single-sonda.
- Utilice el programa de control de fase XYZ motorizado y el microscopio estéreo digital (por encima de las células) para localizar una célula de interés, y colocar con precisión la punta de una sola sonda por encima de la muestra. Iniciar la adquisición de datos de MS antes de la punta de una sola sonda se inserta en la célula.
- Utilice los siguientes parámetros como referencia para el análisis de MS utilizando un espectrómetro de masas de alta resolución: la resolución de masa 100.000 (m / Delta M), ~ 3 kV modo positivo y negativo, 1 Microscan, 150 ms de tiempo de inyección máxima, en modo AGC. adquisición automatizada de espectros de MS se realiza haciendo clic en "Inicio" en el programa de adquisición de datos de MS.
- Levante la Z-platina motorizada haciendo clic en el icono para penetrar la membrana celular y mantener el registro de la señal MS generado a partir de la célula. Un retardo de tiempo de 1-2 seg por lo general se observa entre la inserción de la sonda y la detección de la señal MS. Como la otra confirmación dela penetración celular, un cambio dramático de las señales de MS se puede observar en la penetración de la membrana celular. Las señales MS de compuestos intracelulares por lo general puede durar ~ 15-20 segundos antes de una disminución significativa.
- Más abajo en la celda que contiene la placa para tirar de la punta de una sola sonda hacia fuera de la célula. Por lo general toma <15 seg para las señales de iones de los compuestos celulares para acercarse al nivel de ruido. Dejar que el flujo de disolvente para ~ 3 min para vaciar por completo el single-sonda. Mientras tanto, la posición del sistema XYZ etapa motorizada para localizar la siguiente celda a analizar. Cada experimento célula requiere ~ 3 minutos para llevarse a cabo.
Resultados
La única sonda se utilizó con éxito para el análisis ambiental de MSI de tejido del riñón del ratón en sección 15. El dispositivo utiliza el mecanismo de líquido de la superficie micro-extracción (Figura 1a), que proporciona la extracción de analito altamente eficiente de un área pequeña, dando lugar a abundantes señales de iones intensidades en los resultados de MSI. Por ejemplo, las intensidades de señal de más de 10 7 Se han logrado algunos metabolitos abundantes (Figura 2a). Se detectaron un gran número de metabolitos de esta manera, incluyendo un número de esfingomielina (SM) y fosfatidilcolina (PC) especies tales como [SM (34: 1) + Na] + (725,5575 m / z), [PC (32: 0) + H] + (734,5700 m / z), [PC (34: 1) + Na] + (782,5696 m / z), y [PC (38: 5 + Na)] + (814,5726 m / z). Estos compuestos fueron identificados con masas de alta resolución y exactitud de la masa cuando se combina tespectrómetro de masas de alta resolución OA. Por ejemplo, la identificación se logró con menos de 4 ppm m / z exactitud de masa (es decir, la diferencia entre los valores observados y teóricos) para cada metabolito (figura 2b) en los resultados que aquí se presenta. Además, los análisis de MS en tándem (es decir, MS / MS) se llevaron a cabo también para la identificación de más confianza de especies de interés. 15
Debido a la capacidad de realizar micro-extracción líquido eficaz en un área pequeña, el dispositivo de una sola sonda se puede utilizar para llevar a cabo experimentos de alta resolución MSI espaciales en condiciones ambientales 15. Por ejemplo, imágenes detalladas MS de secciones de riñón de ratón han sido obtenidos que ilustra la distribución espacial de los metabolitos seleccionados (Figura 2C). La resolución espacial de la imagen de MS se determinó que era 8,5 micras, siguiendo la métrica ampliamente utilizado de tener la Transiti. en punto de una función determinada dentro de un brusco cambio de intensidad del 20-80% de la señal MS 18 En el caso de fosfolípidos [PC (38: 5 + Na)] + en la sección de riñón de ratón, la transición entre la función de médula interna y la médula externa se lleva a cabo a través de un ciclo de exploración en el cronograma, que muestra un cambio de intensidad alcance de más de 20-80%. Sobre la base de la velocidad de la muestra en movimiento (10,0 m / s) y MS tasa de adquisición de datos (0,85 seg / espectro), la muestra se mueve a distancia en una MS escanear ciclo (8,5 micras), es decir, la resolución espacial MSI, se puede calcular (Figura 2d). Esta resolución espacial es uno de los más alto alcanzado aún para las técnicas de MSI ambientales realizadas en muestras biológicas.
Para SCMS la única sonda fue capaz de lograr el análisis de las células HeLa vivas individuales 16. El tamaño de la punta de la sonda sola es típicamente inferior a 10 micras (Figure 3a), que es lo suficientemente pequeño para insertarse directamente en muchos tipos de células eucariotas, de las cuales el diámetro es de ~ 10 m, para la extracción y el análisis de MS. El proceso de inserción de la punta de una sola sonda en una célula se puede monitorizar visualmente utilizando un microscopio estéreo digital (Figura 3b), y la penetración de la membrana celular puede ser confirmado a través del cambio rápido y significativo de espectros de masa de PBS (o cultivo celular fresco medio) a compuestos intracelulares (Figuras 3C y 3D). Los experimentos pueden llevarse a cabo en ambos modos de iones positivos y negativos para detectar los tipos más amplios de la especie molecular. Por ejemplo, 18 especies de lípidos diferentes se identificaron en el modo positivo, incluyendo esfingomielinas (SM) y fosfatidilcolinas (PC), mientras que los fosfatos de adenosina (AMP, ADP, y ATP) se detectaron en el modo de ion negativo (Figuras 3c y d). El retardo de tiempo entre el i-inserción única sondanto una célula y la detección de la señal era típicamente menos de dos segundos, lo que permite una detección en tiempo casi real de metabolitos celulares. SCMS se aplicó también a experimentos en los que las células se trataron con fármacos contra el cáncer (por ejemplo, OSW-1, paclitaxel y doxorrubicina) 19]. Los medicamentos correspondientes pueden ser detectadas dentro de las células HeLa después de un tratamiento de 4 horas en una serie de concentraciones (es decir, 10 nM, 100 nM, 1 mM, y 10 mM) en DMSO (dimetil sulfóxido), utilizando las células no tratadas (añadir DMSO solamente ) como los controles. Las señales MS de medicamentos no estaban presentes en el PBS extracelular o el control (Figura 3E), pero no se detectaron en las células individuales utilizando la técnica de MS-sola sonda (solamente los resultados del tratamiento 100 nM se muestran en la figura 3f). Dado que las células se aclararon con PBS (o medio de cultivo celular fresco) para eliminar los compuestos extracelulares y contaminaciones, la detección de metabolitos endógenos (por ejemplo, lípidos celulares unad fosfatos de adenosina) y los compuestos exógenos (por ejemplo, medicamentos contra el cáncer) indica que la sonda individual MS técnica se puede utilizar para analizar compuestos intracelulares.
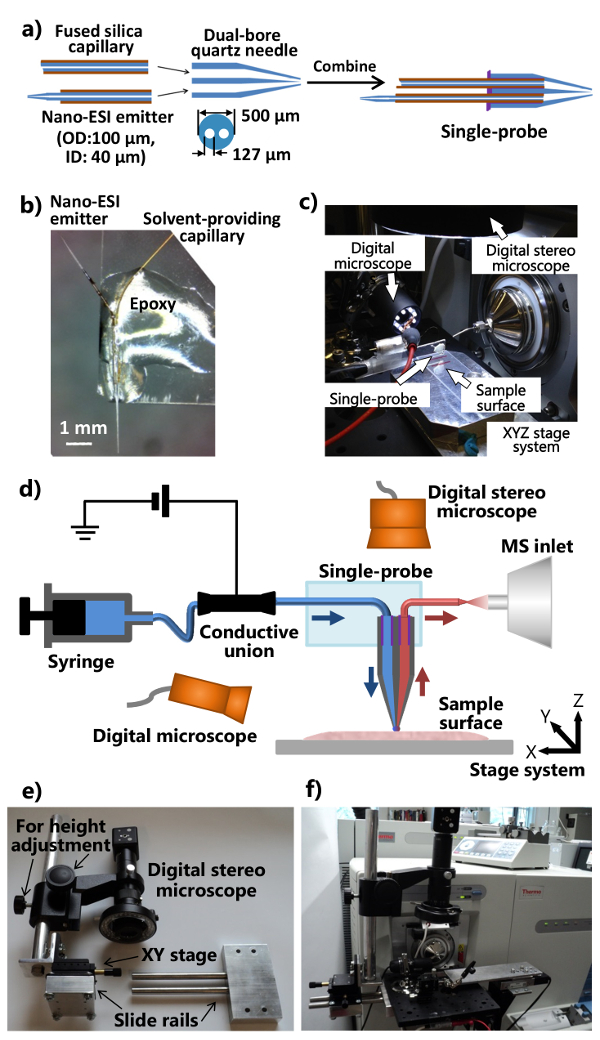
Figura 1. La fabricación e instalación del single-sonda para el análisis ambiental MSI y SCMS. A) procedimientos de fabricación de la sola sonda. B) fotografía de una sola sonda fabricada unido a un portaobjetos de vidrio. C) Fotografía de la sola configuración sonda conectada a un espectrómetro de masas. d) Diagrama de la configuración de una sola sonda unida a un espectrómetro de masas. Durante un experimento, el disolvente de muestreo se proporciona continuamente desde la jeringa, el voltaje de ionización se aplica a la unión conductora de la espectrómetro de masas, dos microscopios digitales se utilizan para controlar la colocación de la muestra, la etapa de XYZ motorizadosistema se utiliza para controlar el movimiento de la muestra, y un espectrómetro de masas se utiliza para el análisis. e) Fotografía del sistema estereoscopio digitales personalizado. f) Fotografía que muestra el estereoscopio digital conectada a la brida de interfaz de fuente de iones a través de una junta óptica. Por favor, haga clic aquí para ver una versión más grande de esta figura.
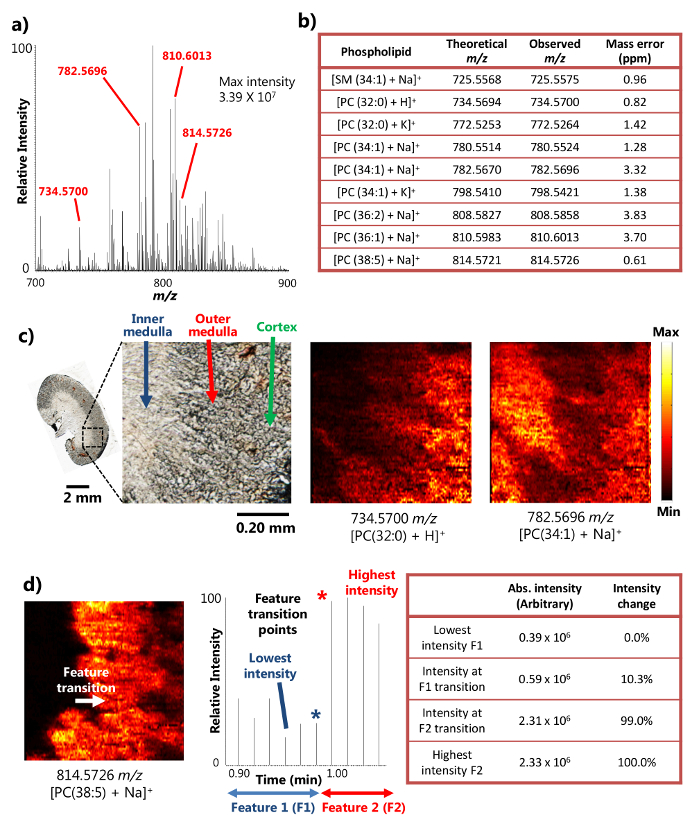
Figura 2. Resultados de un estudio de MSI ambiente de una sección de riñón de ratón con una alta resolución espacial y de masas. A) un espectro de masas representativo de la única sonda MSI. La intensidad máxima de los metabolitos detectados puede alcanzar 3,39 x 10 7 (unidades arbitrarias). B) Una selección de los metabolitos detectados presenta con su precisión en masa. C)MS imágenes de [PC (32: 0) + H] + y [PC (34: 1) + Na] + tomadas de una sección de riñón de ratón a 8,5 micras resolución espacial. PC: fosfatidilcolina. Barra de escala: 2 mm; 0.20 mm (recuadro) d) Determinación de la resolución espacial de la imagen de MS. [PC (38: 5) + Na] + (adaptado con permiso de referencia 15). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Los resultados de un análisis SCMS ambiente de tratados con el fármaco células HeLa con resolución de alta masa. A) zoom en la fotografía de la punta de una sola sonda que muestra un tamaño típico de <10 micras de diámetro. B) Fotografía tomada en el punto de la inserción de una sola sonda en una célula HeLa. Barra de escala: 50 micras.c) Un espectro de masas modo de ion positivo típico con las identificaciones de un número de PC (fosfatidilcolina) especies. d) Una lista representativa de los metabolitos detectados a partir de análisis SCMS de las células HeLa, tanto en los modos de iones positivos y negativos. EF) Los espectros de masas de el control y tratada (100 nM OSW-1) células (adaptado con permiso de referencia 16). Haga clic aquí para ver una versión más grande de esta figura.
Figura S1. Diagrama de circuito del dispositivo electrónico utilizado para producir la señal de cierre de contacto para el espectrómetro de masas para recoger datos. Por favor, haga clic aquí para ver o descargar esta figura.
Discusión
La sola sonda es un dispositivo multifuncional que se puede utilizar para ambos experimentos MSI y SCMS. La configuración de una sola sonda (incluyendo sistemas etapa de traducción, microscopios, bridas interfaz de fuente de iones, etc.) está diseñado como un componente de complemento que se puede adaptar flexiblemente al espectrómetro de masas existentes. Un intercambio rápido entre la configuración de una sola sonda y la fuente de iones ESI convencional puede llevarse a cabo dentro de un minuto. En principio, el uso de la brida de interfaz de fuente de iones apropiado, la configuración de una sola sonda se puede adaptar a los otros espectrómetros de masas. Además, el disolvente de muestreo que contiene una variedad de reactivos se puede utilizar con la configuración de una sola sonda para reactivos experimentos MSI y SCMS, que mejora en gran medida la detección de intervalos más amplios de las biomoléculas. Además de los tejidos animales y líneas celulares, la única sonda también es capaz de analizar otros sistemas biológicos, tales como plantas. Por lo tanto, con la misma configuración experimental yformación de usuario similar, una variedad de estudios se puede realizar utilizando un único instrumento y por los mismos usuarios, que se logra con el tiempo de entrenamiento mínimo y el costo de instrumentación que permite experimentos eficiente y versátil.
El componente clave de la técnica de una sola sonda de MS es la propia sonda. La calidad del single-sonda tiene una influencia significativa en su rendimiento, lo que determina en gran medida la calidad de ambos experimentos MSI y SCMS. Cuando se fabrica solo-sondas, asegúrese de que los capilares en el interior del tubo de doble tubo están pegadas de forma segura para eliminar la posibilidad de fuga de disolvente durante los experimentos. Es fundamental para utilizar una cantidad mínima de UV epoxi curable, de manera que los orificios y los tubos capilares no están obstruidas durante la fabricación de la sonda.
La única sonda se ha utilizado para llevar a cabo alta resolución ambiente espacial y la masa MSI en muestras biológicas 15. La principal ventaja de MSI ambiente durantemétodos no ambiente es que la preparación de la muestra se mantiene a un mínimo, sin necesidad de un entorno de toma de muestras de vacío, que permite que la muestra que va a analizarse en un estado nativo cerca de 8. Uno de los principales obstáculos para la mayoría de los demás ambiente técnica MSI ha habido una falta de resolución espacial 1. En comparación con la desorción basado MSI técnicas (tales como DESI y LAESI), el tamaño de la punta pequeña de la sola sonda permite una micro-extracción líquido superficie más robusto y eficiente para llevar a cabo sobre un área pequeña, lo que lleva a una alta resolución espacial de 8,5 micras, que se encuentra entre los más altos obtenidos mediante técnicas de MSI ambiente 15. Además, el ajuste de los componentes del disolvente de muestreo proporciona flexibilidad adicional para llevar a cabo los experimentos. Por ejemplo, el muestreo de disolventes que contienen reactivos (por ejemplo, compuestos dicatiónicos) se han utilizado para realizar experimentos de MSI reactivos, lo que permite un aumento significativo en el número de metabolitos identificados PEexperimento r 20. La otra ventaja de la sola sonda es el diseño integrado, que proporciona la facilidad de operación durante todo el proceso de adquisición de datos. Debido a que la distancia entre la punta y la superficie del tejido es muy sensible para la intensidad de la señal de iones y la estabilidad, la obtención de una sección de tejido plano y la superficie de la realización de aplanamiento de ajuste para minimizar la varianza distancia es una clave para los experimentos de MSI de alta calidad. De ello se desprende que las técnicas de MSI de una sola sonda no son adecuados para obtener imágenes de alto MS espaciales de superficies irregulares.
Además de la fabricación de una sonda de alta calidad, sintonizar cuidadosamente el instrumento es esencial para un experimento de MSI éxito. Entre todas las etapas de ajuste, el ajuste de la altura de la punta de una sola sonda por encima de la superficie de sección de tejido es la más crítica. Al ajustar la altura de la sonda, bombear el disolvente muestreo y encender la tensión de ionización, por lo que sólo las señales de iones fondo disolvente puede ser observed. Entonces supervisar el cambio del espectro de masas al tiempo que reduce cuidadosamente la distancia de la sonda de la superficie por el levantamiento de la Z-platina motorizada hasta que las señales de iones fuertes y estables de la sección de tejido se pueden observar; esta altura de la sonda se utiliza para la recogida de datos MSI durante el experimento. Además, una tasa de flujo de disolvente optimizado es esencial para los experimentos de MSI. Ajustar la velocidad de flujo con la altura de la sonda optimizado. Asegúrese de que este no se presenta disolvente sobre la superficie del tejido (es decir, el caudal es demasiado alto) o la formación de burbujas en el interior del emisor nano-ESI (es decir, el caudal es demasiado bajo).
El single-sonda es un dispositivo multifuncional para bioanálisis. Además de los experimentos de MSI, es capaz de llevar a cabo casi en tiempo real in situ SCMS para elucidar la información química detallada a partir de células eucariotas vivas 16, que es una gran ventaja en comparación con otros de vacío técnicas SCMS base (tales como MALDI 10 y SIMS 21 ). El pequeño tamaño de la punta de la sonda proporciona la capacidad de ser insertado en una célula eucariota en vivo y para extraer y ionizar los compuestos intracelulares para el análisis de MS inmediata. Del mismo modo, los disolventes de muestreo contienen los reactivos (por ejemplo, compuestos dicatiónicos) se pueden utilizar en los experimentos SCMS, y una gama más amplia de los componentes celulares se pueden detectar en una única célula viva que nunca (investigación en curso, los datos no se muestran). Aunque el análisis en tiempo real proporcionará los perfiles químicos de las células individuales en vivo, debido a la penetración de células de la membrana y la extracción de contenido celular, la célula bajo investigación se mató después del experimento, lo que implica que la de una sola sonda SCMS técnica es todavía un método destructivo. Además, la punta de la sonda y el emisor nano-ESI en el single-sonda puede ser obstruidas fácilmente para usuarios inexpertos. Para reducir la posibilidad de obstrucción dispositivo, asegurarse de no tocar el núcleo cuando se inserta la punta de una sola sonda en un cell. Si se produce la obstrucción, el dispositivo se puede regenerar mediante el calentamiento de la punta de la sonda obstruido o el nano-ESI emisor utilizando una bobina de calentamiento de construcción casera 16. Otra limitación de la técnica de una sola sonda SCMS es que sólo las células adhesivas (es decir, las células se unen a las superficies) se pueden analizar usando la configuración actual. Sin embargo, mediante la incorporación del sistema de manipulación de células en el aparato de MS-sola sonda, los tipos más amplios de la célula pueden ser estudiadas en el futuro.
Al igual que en el experimento de MSI, la obtención de una sonda de alta calidad y una tasa de flujo de disolvente optimizado es crítica para estudios de SCMS. Cuando se ajusta un caudal de disolvente, la punta de una sola sonda se coloca por encima de la muestra (es decir, sin contacto con el medio de células o cultivo), y asegúrese de que no hay goteo de disolvente de la punta de la sonda o la formación de burbujas dentro de la nano-ESI emisor.
Divulgaciones
We have no conflict of interest to declare with the work presented here.
Agradecimientos
The authors would like to thank Dr. Laskin (the Pacific Northwest National Laboratory) for sharing the motorized stage control software and MSI visualization program. We also thank Dr. Mao (the University of Oklahoma) for providing mouse organ samples and Mr. Chad E. Cunningham (the University of Oklahoma) for the assistance in machining and electronics work. This research was supported by grants from the Research Council of the University of Oklahoma Norman Campus, the American Society for Mass Spectrometry Research Award (sponsored by Waters Corporation), Oklahoma Center for the Advancement of Science and Technology (Grant HR 14-152), and National Institutes of Health (R01GM116116).
Materiales
| Name | Company | Catalog Number | Comments |
| Single-probe fabrication | |||
| Dual bore quartz tubing, 1.120’’ × 0.005” × 12” | Friedrich & Dimmock, Inc, Millville, NJ | MBT-005-020-2Q | |
| Micropipette laser puller | Sutter Instrument Co., Novato, CA | Model P-2000 | |
| Fused silica capillary, ID: 40 µm, OD: 110 µm | Molex, Lisle, IL | TSP040105 | |
| UV curing resin | Prime Dental, Prime-Dent, Chicago, IL, USA | Item No. 006.030 | |
| LED UV lamp | Foshan Liang Ya Dental Equipment, Guangdong, China | LY-C240 | |
| Epoxy resin | Devcon, Danvers, MA | Part No. 20945 | |
| Inline MicroFilter | IDEX Health & Science LLC, Lake Forest, IL | M-520 | |
| Microunion | IDEX Health & Science LLC, Lake Forest, IL | M-539 | |
| Microscope slide (glass) | C & A Scientific - Premiere, Manassas, VA | 9105 | |
| Syringe | Hamilton, Reno, NV | 1725LTN 250UL | |
| Mass spectrometer | |||
| LTQ Orbitrap Mass sprectrometer | Thermo Fisher Scientific, Inc., Waltham, MA | LTQ Orbitrap XL | |
| Xcalibur 2.1 Software | Thermo Fisher Scientific, Inc., Waltham, MA | XCALIBUR21 | |
| Fance Stage Control | Pacific Northwest National Laboratory, Richland, WA | ||
| MSI QuickView | Pacific Northwest National Laboratory, Richland, WA | ||
| Contact closure device | |||
| USB-6009 Multifunction DAQ | National Instruments, Austin, TX | 779026-01 | |
| DR-5V SDS Relay | Panasonic, Kadoma, Japan | DR-SDS-5 | |
| Logic Gates 50 Ohm Line Driver | Texas Instruments, Dallas, TX | SN74128N | |
| Single-probe setup | |||
| Motorized linear stage and controller (3 sets) | Newport, Irvine, CA | Conex-MFACC | |
| Miniature XYZ stage | Newport, Irvine, CA | MT-XYZ | |
| Translation XY stage | ThorLab, Newton, NJ | PT1 and PT102 | |
| Thermo LTQ XL ion source interface flange | New Objective, Woburn, MA | PV5500 | |
| Digital stereo microscope, 250X - 2,000X | Shenzhen D&F Co., Shenzhen, China | Supereyes T004 | |
| USB Digital Photography Microscope | DX.com, HongKong, China | S02 25~500X | |
| Syringe pump | Chemyx Inc., Stafford, TX | Nexus 3000 | |
| Solid Aluminum Optical Breadboard, 8" x 8" x 1/2" | Thorlabs, Newton, NJ | MB810 | |
| Flexible clamp holder | Siskiyou, Grants Pass, OR | MXB-3h | |
| Solvents | |||
| Methol | Sigma-Aldrich, St. Louis, MO | 34860 Chromasolv | |
| Water | Sigma-Aldrich, St. Louis, MO | W4502 | |
| Acetonitrile | Sigma-Aldrich, St. Louis, MO | 34967 Chromasolv | |
| Cell culture | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Cellgro, Manasas, VA | 10-013-CV | |
| 10% heat-inactivated fetal bovine serum (FBS) | Gibco/Life Technologies, Long Island, NY | 10100-139 | |
| Penicillin/Streptomycin | Cellgro, Manasas, VA | 30-002-CI | |
| 10 mM HEPES (pH 7.4) | Cellgro, Manasas, VA | 25-060-CI | |
| Phosphate Buffered Saline (PBS) | Cellgro, Manasas, VA | 46-013-CM | |
| TrypLE Express | Thermo Fisher Scientific, Waltham, MA | 12604-013 | |
| 12-well plates | Corning Inc., Corning, NY | Falcon 351143 | |
| T25 flask | Corning Inc., Corning, NY | Falcon 3055 | |
| Micro Cover Glasses, Round, No. 1 | VWR International, Radnor, PA | 48380-046 | |
| DMSO (Dimethyl Sulfoxide) | VWR International, Radnor, PA | BDH1115-1LP | |
| Tissue imaging | |||
| Cyro-Cut Microtome | American Optical Coporation | ||
| Tissue-Tek, Optimum cutting temperature (OCT) | Sakura Finetek Inc., Torrance, CA | 4583 | |
| Microscope slide (polycarbonate) | Science Supply Solutions, Elk Grove Village, IL | P11011P | |
Referencias
- Vickerman, J. C. Molecular imaging and depth profiling by mass spectrometry-SIMS, MALDI or DESI?. Analyst. 136 (11), 2199-2217 (2011).
- Schwamborn, K. Imaging mass spectrometry in biomarker discovery and validation. J. Proteomics. 75 (16), 4990-4998 (2012).
- Schwamborn, K., Caprioli, R. M. MALDI Imaging Mass Spectrometry - Painting Molecular Pictures. Mol Oncol. 4 (6), 529-538 (2010).
- Kraft, M. L., Klitzing, H. A. Imaging lipids with secondary ion mass spectrometry. Biochim. Biophys. Acta. 1841 (8), 1108-1119 (2014).
- Wiseman, J. M., et al. Desorption electrospray ionization mass spectrometry: Imaging drugs and metabolites in tissues. Proc Natl Acad Sci U S A. 105 (47), 18120-18125 (2008).
- Nemes, P., Woods, A. S., Vertes, A. Simultaneous imaging of small metabolites and lipids in rat brain tissues at atmospheric pressure by laser ablation electrospray ionization mass spectrometry. Anal. Chem. 82 (3), 982-988 (2010).
- Laskin, J., Heath, B. S., Roach, P. J., Cazares, L., Semmes, O. J. Tissue Imaging Using Nanospray Desorption Electrospray Ionization Mass Spectrometry. Anal. Chem. 84 (1), 141-148 (2012).
- Wu, C., Dill, A. L., Eberlin, L. S., Cooks, R. G., Ifa, D. R. Mass spectrometry imaging under ambient conditions. Mass. Spectrom. Rev. 32 (3), 218-243 (2013).
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: do differences make a difference?. Cell. 141 (4), 559-563 (2010).
- Amantonico, A., Urban, P. L., Fagerer, S. R., Balabin, R. M., Zenobi, R. Single-Cell MALDI-MS as an Analytical Tool for Studying Intrapopulation Metabolic Heterogeneity of Unicellular Organisms. Anal. Chem. 82 (17), 7394-7400 (2010).
- Passarelli, M. K., Ewing, A. G., Winograd, N. Single-cell lipidomics: characterizing and imaging lipids on the surface of individual Aplysia californica neurons with cluster secondary ion mass spectrometry. Anal. Chem. 85 (4), 2231-2238 (2013).
- Shrestha, B., et al. Subcellular metabolite and lipid analysis of Xenopus laevis eggs by LAESI mass spectrometry. PLoS One. 9 (12), e115173 (2014).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass. Spectrom. 43 (12), 1692-1700 (2008).
- Zhang, L., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Rao, W., Pan, N., Yang, Z. High Resolution Tissue Imaging Using the Single-probe Mass Spectrometry under Ambient Conditions. J. Am. Soc. Mass. Spectrom. 26 (6), 986-993 (2015).
- Pan, N., et al. The single-probe: a miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Thomas, M., et al. Visualization of High Resolution Spatial Mass Spectrometric Data during Acquisition. 2012 Annual International Conference of the Ieee Engineering in Medicine and Biology Society (Embc). , 5545-5548 (2012).
- Luxembourg, S. L., Mize, T. H., McDonnell, L. A., Heeren, R. M. High-spatial resolution mass spectrometric imaging of peptide and protein distributions on a surface. Anal. Chem. 76 (18), 5339-5344 (2004).
- Zhou, Y., et al. OSW-1: a natural compound with potent anticancer activity and a novel mechanism of action. J Natl Cancer Inst. 97 (23), 1781-1785 (2005).
- Rao, W., Pan, N., Tian, X., Yang, Z. High-Resolution Ambient MS Imaging of Negative Ions in Positive Ion Mode: Using Dicationic Reagents with the Single-Probe. J. Am. Soc. Mass. Spectrom. 27 (1), 124-134 (2016).
- Ostrowski, S. G., Kurczy, M. E., Roddy, T. P., Winograd, N., Ewing, A. G. Secondary ion MS imaging to relatively quantify cholesterol in the membranes of individual cells from differentially treated populations. Anal. Chem. 79 (10), 3554-3560 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados