Method Article
La neurogénesis en la evaluación primaria
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo presenta un método conveniente y rápido para la visualización de diferentes poblaciones de células neuronales en el sistema nervioso central de embriones de Xenopus utilizando la tinción de inmunofluorescencia en secciones.
Resumen
Primary neurogenesis is a dynamic and complex process during embryonic development that sets up the initial layout of the central nervous system. During this process, a portion of neural stem cells undergo differentiation and give rise to the first populations of differentiated primary neurons within the nascent central nervous system. Several vertebrate model organisms have been used to explore the mechanisms of neural cell fate specification, patterning, and differentiation. Among these is the African clawed frog, Xenopus, which provides a powerful system for investigating the molecular and cellular mechanisms responsible for primary neurogenesis due to its rapid and accessible development and ease of embryological and molecular manipulations. Here, we present a convenient and rapid method to observe the different populations of neuronal cells within Xenopus central nervous system. Using antibody staining and immunofluorescence on sections of Xenopus embryos, we are able to observe the locations of neural stem cells and differentiated primary neurons during primary neurogenesis.
Introducción
En los vertebrados, el desarrollo del sistema nervioso central comprende varias etapas distintivas todavía consecutivos. El primer paso es la inducción neural, cuando se especifican células ectodérmicas ingenuos hacia un destino neuronal en lugar de un destino epidérmica. Varios mecanismos de regulación interconectados están involucrados en esta etapa en Xenopus y otros sistemas modelo 1,2. Este proceso está coordinado principalmente por factores secretados producidos por el mesodermo subyacente, como chordin, noggin, y folistatina 3-7. Después de la inducción neural, un subconjunto de progenitores neurales salir del ciclo celular y comienzan a diferenciarse en un proceso denominado neurogénesis como primaria. No todos los precursores neuronales se diferencian en este momento. Las células precursoras neurales restantes continúan proliferando, manteniendo de ese modo la piscina de células madre necesario para el crecimiento continuo de sistema nervioso central en todo el desarrollo y la edad adulta.
estos proliferating células precursoras neuronales se caracterizan por su expresión de la SRY (región determinante del sexo Y) -box 3 (sox3) gen 8-11. La otra población de células, que salen del ciclo celular y se comprometen a un destino diferenciado, se identifican por la expresión de los marcadores de genes de diferenciación, tubulina, beta 2B clase IIb (tubb2b, N-bañera) y la mielina factor de transcripción 1 (Myt1) 12-14. Tales células neuronales diferenciadas finalmente dan lugar a diferentes categorías de neuronas, incluyendo, pero no limitado a, motor, internacional, y las neuronas sensoriales situados en áreas distintas dentro del tubo neural 15-17.
Si bien los esfuerzos significativos se han dedicado a descubrir los mecanismos de regulación que rigen el patrón y el destino determinación de eventos en el neuroectodermo anterior, menos atención se ha hecho en la investigación de los eventos neurogénicos que se producen a raíz de laetapa inicial del patrón. De hecho, la transducción de señales, las regulaciones de la transcripción, así como las modificaciones post-traduccionales están involucrados en esta etapa posterior, controlar tanto la especificación sincronización y linaje durante la neurogénesis 18-20. Otras investigaciones sobre estos mecanismos requieren un método fiable para visualizar y distinguir las diferentes poblaciones de células neuronales fácilmente. La N-bañera mencionada marcadores neuronales, incluyendo, Sox3, Myt1, y, puede proporcionar un medio para la identificación de estas diferentes poblaciones celulares, proporcionando así las bases necesarias para revelar los mecanismos subyacentes de la diferenciación neuronal 21-23.
Aunque el etiquetado diferencial de poblaciones de células neuronales se ha demostrado en otros organismos modelo, relativamente pocos estudios han explotado el sistema de Xenopus al máximo en este sentido. Esto se debe principalmente a la escasez de anticuerpos compatibles que identificar de forma fiable los distintos neurpoblaciones de células onal en tubo neural. A continuación, describimos un método para la visualización de la diferenciación neuronal en los primeros embriones de Xenopus mediante inmunotinción, que proporciona un enfoque robusto y conveniente para la investigación de la neurogénesis primaria en Xenopus. Este protocolo deberá proporcionar una orientación suficiente para los investigadores interesados en el desarrollo temprano del sistema nervioso central Xenopus entre la etapa 26 y la etapa 45.
Protocolo
Todos los experimentos con animales fueron aprobados por la Universidad de Manchester Centro de Bienestar Animal y estaban cubiertos por una licencia del Reino Unido Proyecto de Ministerio del Interior.
1. Recogida y Fijación de Xenopus embriones
- Preparar reactivos y materiales para experimentos.
- Preparar 10x Ringers Modificado de Marc (MMR) por disolución de 56,5 g de NaCl en agua ultrapura aproximadamente 800 ml y la adición de soluciones madre de 1 M KCl, 1 M MgSO 4, 1 M CaCl 2, y 1 M HEPES pH 7,4 para alcanzar una concentración final de KCl 20 mM, 10 mM MgSO4, se mM CaCl 2 20 mM, HEPES 50. Ajustar el pH a 7,4 con NaOH 10 M y luego ajustar el volumen final a 1 L.
- Esterilizar la solución 10x MMR en autoclave a 121 ° C durante 20 min en un ciclo líquido. Al usar, diluir con ddH2O a 0,1 x concentración final y añadir 20 mg / L de gentamicina para inhibir el crecimiento microbiano.
- Hacer 10x solución de TBS mezclando 24 g de Tris-HCl, 5,6 g de Tris-base, 88 g de NaCl y disolver en aproximadamente 900 ml de agua ultrapura. La solución final tendrá un valor de pH alrededor de 7.6. Ajuste ya sea con NaOH M 10 o HCl concentrado para conseguir un pH final de 7,6 y el volumen final a 1 L.
- Al usar, hacer TBS 1x diluyendo 1 parte de 10x solución de TBS con 9 partes de agua ultrapura.
- Hacer 10x MEM sal por disolución de 209,2 g MOPS en aproximadamente 800 ml de agua ultrapura y la adición de soluciones madre de 0,5 M EGTA y 1 M MgSO 4 para lograr una concentración final de EGTA 20 mM, 10 mM MgSO 4. Ajustar el pH a 7,4 con NaOH 10 M y luego ajustar el volumen final a 1 L.
- Esterilizar la solución de sal MEM en autoclave a 121 ° C durante 20 min en un ciclo de líquido (la solución puede ponerse amarillas por unos pocos meses de almacenamiento a temperatura ambiente o después de que ha sido tratado en autoclave, pero este cambio en el color no afecta a su uso ). Sin embargo, no utilice la solución después de un almacenamiento prolongado (más de 6 meses).
- Hacer 1x MEMsolución FA por dilución de 1 parte de MEM sales, 1 parte de 37% de formaldehído con 8 partes de agua ultrapura (v / v, estable a 4 ° C durante al menos 1-2 semanas).
- Preparar paraformaldehído al 4% en TBS (para la tinción posterior que implica faloidina) disolviendo 4 g de polvo de paraformaldehido en 100 ml de solución de TBS 1x calentar la solución a 60 ° C y añadir unas gotas de NaOH 10 M para ayudar a la disolución. La alícuota en 5-10 ml de volumen y la congelación de -20 ° C. No vuelva a congelar una vez descongelado.
PRECAUCIÓN: El paraformaldehído en polvo es un irritante y es tóxico si se inhala, por tanto, el paso de pesaje se debe realizar en una campana de humos. - Etiquetar tantos viales de vidrio de 4 ml con tapones de rosca antes de la recogida de muestras.
- Preparar 15% de gelatina / 15% de sacarosa mediante el vertido de 20 ml de 40% de gelatina de pescado (pre-calor en un baño de agua a 50 °) en un tubo de centrífuga de 50 ml. Añadir 8 g de sacarosa y llenar el tubo a la línea de 50 ml con TBS 1x.
- Se coloca el tubo de gelatina en un mezclador rotatorio o lecho de laminaciónpara mezclar durante una noche a temperatura ambiente. Esta solución de gelatina es estable a 4 ° C durante 1 semana. No use la solución expirado y no congelar y descongelar.
- Preparar y corregir X. laevis o X. tropicalis embriones cultivados a las etapas deseadas.
- Cultura en la X. fertilizado laevis o X. tropicalis embriones en MMR 0,1x con gentamicina hasta las etapas deseadas.
NOTA: Por lo general, recoger embriones entre las etapas 23 y 40. Más tarde recolección de los embriones después de la etapa 40 es posible, especialmente cuando se observa el crecimiento axonal de la médula espinal, pero tenga en cuenta que el tiempo adicional de penetración de gelatina puede ser requerida. Los embriones pueden ser de tipo salvaje, transgénicos, mutante, tratados con inhibidor de, morfolino (MO): se inyecta, o electroporación 23,24. - Recoger 20-50 embriones en cada vial de vidrio de 4 ml, eliminar la mayor cantidad posible medio y reemplazar con MEMFA.
NOTA: Si la tinción posterior implica faloidina, usar paraformaldehído al 4%en lugar de MEMFA ya que las soluciones de formaldehído suministrado comerciales generalmente contienen hasta 10% de metanol como un estabilizador que pueda interferir con la tinción de faloidina. - Solución durante la noche a 4 ° C o, si en una urgencia, a temperatura ambiente durante 2 h en un mezclador rotatorio. Los embriones serán estables en solución de fijación durante al menos 1 semana a 4 ° C.
- Después de la fijación, lavar los embriones 3 veces por 20 min usando 1x TBS con 0,05% de Triton X-100. Después del lavado final, eliminar la mayor cantidad TBS-Triton como sea posible y añadir 3 ml de 15% de gelatina / 15% de sacarosa en cada vial.
- Colocar los viales en un rodillo de cama durante la noche a temperatura ambiente. Para los embriones mayores de 40 etapas, utilizar al menos 24 horas de tiempo de penetración. Después de la penetración, proceder inmediatamente a la sección 2.2 en el día siguiente.
- Cultura en la X. fertilizado laevis o X. tropicalis embriones en MMR 0,1x con gentamicina hasta las etapas deseadas.
2. Montaje y cryosectioning de Xenopus embriones
- Preparar reactivos y materiales para experimentos.
- Tome una caja de charg positivamenteed desliza, a ser posible sin abrir.
NOTA: Si se abre, guarda los portaobjetos en una condición seca (tal como una caja seca) y utilizar el plazo de 1 mes para asegurar que se mantiene la carga estática en las diapositivas. No utilice diapositivas caducados ya que las muestras se caerán durante la inmunotinción. - Pre-enfriar la cámara del criostato a -30 ° C. Establecer los parámetros del instrumento como -35 ° C durante microtomo y 12 micras de espesor sección. Instalar la placa de cubierta de vidrio de espesor en el escenario y dejar que el criostato equilibre durante al menos 30 minutos antes de la sección comienza.
- Preparar pinceles de pintura para mover bandas de perfiles, mantener el interior de la cámara del criostato.
- Preparar lápices para escribir en las diapositivas, ponerlos a temperatura ambiente.
- Use guantes durante la sección criogénica. No use las manos desnudas.
- Tome una caja de charg positivamenteed desliza, a ser posible sin abrir.
- Los embriones de Xenopus montaje
- Con cuidado aspirar 5-10 embriones fuera del vial de vidrio usando una pipeta de plástico o de vidrio sin introducir burbujas de aire. La transferencia de los embriones ena la cámara de montaje y observar bajo un estereoscopio. Llenar la cámara de montaje con una solución de gelatina para asegurar la rigidez del bloque de sección.
- Organizar los embriones como en la figura 1 utilizando un par de pinzas de punta fina. Marcar la orientación de la cabeza dibujando una flecha en el borde de la cámara usando un marcador compatible con criogénico. Para múltiples grupos de embriones, anote la descripción de cada grupo en el borde de la cámara correspondiente también.
- Con cuidado, coloque la cámara horizontalmente en una caja de espuma de media llena de hielo seco y cierre la tapa. Observar la congelación cámara de montaje en 5-10 min. Procesar cada cámara en serie (es decir, colocar la cámara anterior en hielo seco antes de proceder a la siguiente) ya que le dejarán tiempo suficiente para que cada cámara para congelar y evitar que la caja de hielo seco para convertirse en hacinamiento.
NOTA: cámaras de montaje congeladas no necesitan estar en horizontal y se pueden apilar en el interior de la caja. - Proceder con cryosectioning o, si es necesario, mantener las muestras congeladas a -80 ° C durante al menos 1-2 semanas sin perder la inmunogenicidad.
- Cryosection de embriones de Xenopus Montado
- Retirar un bloque de muestra congelada de la cámara pulsando el fondo de la cámara usando un palo romo (tal como un lápiz).
- Añadir varias gotas de medio de congelación de tejido, (un polietilenglicol y polivinil-alcohol que contiene medio) en el disco de sujeción de muestra y montar el bloque de muestras con el extremo anterior de los embriones apunta hacia arriba (Figura 2). Deje que el bloque de mounted- de pie dentro de la cámara del criostato durante aproximadamente 1 minuto o hasta que el medio de congelación de tejido se vuelve opaca.
- instalar inmediatamente el disco de retención de la muestra en el micrótomo con la parte inferior del bloque de muestras hacia arriba. Se quita una porción del bloque de muestra usando una cuchilla cuando el bloque de muestra es todavía relativamente "suave" para reducir la longitud de cada sección(Si es deseado). Deje el disco de retención de la muestra en el microtomo durante al menos 5 minutos para permitir que su temperatura alcance el equilibrio.
- Poco a poco recortar el bloque de muestras hacia abajo hasta que las cabezas de los renacuajos son visibles a través de la gelatina translúcida. Para aumentar la velocidad de corte, aplique un ajuste más alto (más gruesa) de la sección de espesor (por ejemplo 20-25 M) en esta etapa (por ejemplo, activando la opción de "recortar"), pero no demasiado gruesa porque bloque de muestras puede caerse desde el disco de retención de la muestra . Observar el rendimiento de criostato, tales como la nitidez y el ángulo de la cuchilla en esta etapa para asegurar la generación de una tira larga de las secciones posteriores.
- Una vez que las cabezas de renacuajo se hacen visibles, ajustar la configuración del criostato volver a la normalidad (por ejemplo 10-12 M) y limpia tanto el microtomo y etapas utilizando un pincel. hacer suavemente 2-3 secciones como un ensayo utilizando la configuración de la rueda de mano (no utilice el ajuste motorizado) para asegurarse de que las rebanadas acabados pueden formar strips, no se superponen o se pegue a la hoja.
- Continuar el recorte hasta que las cabezas de los renacuajos son casi expuestos (esto puede necesitar algo de experiencia, pero alcanzable). Cepillar las secciones cualquier remanente en el escenario y la colección de secciones de la muestra va a comenzar.
- Hacer aproximadamente 10-15 secciones y dejar que ellos forman una tira larga.
- Dé la vuelta a la placa de cubierta de vidrio de espesor a un lado y retire con cuidado la tira de la hoja utilizando un pincel de punta fina y disponerlo en el escenario con el eje longitudinal paralela a la hoja.
- Escoja una diapositiva con carga positiva a temperatura ambiente, etiquetarlo con un lápiz (que no será arrastrada durante los tratamientos de coloración posterior), presione rápidamente pero con firmeza sobre la tira con el lado de la etiqueta hacia abajo y retire la tapa de la cámara del criostato. Si se hace correctamente, la tira debe pegarse inmediatamente a la diapositiva cargado positivamente (Figura 3A).
- Repita este paso para tener 20-30 rebanadas en cada deslizadoe y dispuestos en paralelo (Figura 3B). Esto es suficiente para cubrir toda la región del cerebro de X. embriones tropicalis y la mayoría del cerebro anterior y del mesencéfalo regiones de X. laevis embriones.
- Secar los portaobjetos durante 10 minutos, proceda de inmediato o, almacenar los portaobjetos en una caja de portaobjetos a -80 ° C durante al menos 3-6 meses sin perder la inmunogenicidad.
3. La inmunotinción de embriones de Xenopus seccionada
- Preparar reactivos y materiales para experimentos.
- Preparar 0,05% TBS-Triton X-100 mediante la adición de Triton X-100 en TBS 1x para lograr una concentración final de 0,05%. Esta solución es estable a temperatura ambiente durante 3-4 días. No use la solución caducada.
- Preparar 5% de suero de cabra inactivado por calor o 5% de BSA en TBST como tampón de bloqueo. En primer lugar, el calor-inactivar el suero de cabra / cordero mediante la colocación de aproximadamente 20 a 30 ml de suero en un baño de agua a 65 ° durante 30-60 min. Alícuota de 1,5 ml de centrífugatubos y congelación de -20 ° C. No se requiere re-inactivación en el uso.
- Diluir el suero inactivado por calor o BSA en TBST para alcanzar una concentración final de 5% antes de su uso.
- Preparar anticuerpos primarios apropiados de acuerdo con diluciones en tampón de bloqueo (por ejemplo, 1: 250 anti-tubulina Myt1 26 / anti-acetilada: 500 anti-Sox3 10,25 / 1). Utilice aproximadamente 100 l de solución de anticuerpos en cada diapositiva.
- Preparar anticuerpos fluorescentes apropiados (por ejemplo, anticuerpos anti-ratón de conejo / rojo fluorescente del tinte conjugado) en tampón de bloqueo (por lo general 1: 500).
- (Opcional) Añadir colorante fluorescente de color rojo-conjugado faloidina (1: 500) en la mezcla de anticuerpo secundario para revelar red de actina.
- (Opcional) Añadir DAPI (0,5 mg / ml de concentración final) en combinación anticuerpo secundario de visualizar la localización nuclear.
- Tome el medio de montaje anti-fade fuera del congelador y descongelar en un baño de agua a temperatura ambiente.
- La inmunotinción
- Retire las diapositivas congelados entre -80 ° C y colocarlos en un pedazo de toalla de papel dentro de una campana de ventilación durante al menos 1 hora para eliminar cualquier gota de agua condensada, luego hornear los portaobjetos secos sobre un bloque de calor C 85-90 ° con el rebanadas hacia arriba durante 15 minutos para activar el mecanismo de adhesión. Finalmente, deje que los portaobjetos se enfríen a temperatura ambiente (al menos 10 min).
- Llenar la cubeta de tinción con acetona pura y se incuban los portaobjetos en acetona durante 10 minutos para eliminar la gelatina de pescado. Si varias diapositivas deben ser tratados, disponerlas sobre una rejilla de tinción. El aire seco de los toboganes tratados durante 15 min en una campana de ventilación. No vuelva a usar la acetona.
- elaborar cuidadosamente un anillo alrededor de las muestras en el portaobjetos con un bolígrafo PAP sin tocar las muestras. Asegúrese de que el anillo está encerrado en sí mismo, de lo contrario la solución de anticuerpo fluirá a cabo durante la tinción. secar completamente el anillo de la pluma PAP.
- Llene otra cubeta de tinción con TBS 1x sin Triton X-100. Insert los deslizamientos secos en la cubeta de tinción y permitir la rehidratación durante al menos 1 hora. Mientras tanto, preparar el tampón de bloqueo mediante la dilución o bien suero de cabra inactivado por calor o BSA al 5% de concentración final usando 1x TBS con 0,05% de Triton X-100.
- Hacer una caja húmeda mediante la colocación de 1-2 placas de 6 pocillos dentro de una caja de comida de bloqueo por encaje y llenar los pozos hasta la mitad con agua ultrapura. Retirar los portaobjetos rehidratadas de la cubeta de tinción y colocarlos horizontalmente en las placas de 6 pocillos (sin la tapa de la placa).
- Añadir con cuidado 300-600 l de tampón de bloqueo en el interior del anillo de PAP. Sellar la caja húmeda mediante el bloqueo de la tapa en su posición y se incuba a temperatura ambiente durante al menos 1 hr.
- Diluir los anticuerpos primarios apropiados en tampón de bloqueo. Generalmente, se utiliza 100-150 solución de anticuerpos l diluida por diapositiva. Si se procesan varias diapositivas, ampliar el volumen de forma proporcional.
- Después de bloquear, retirar con cuidado el tampón de bloqueo de diapositivas por aspiración y añadir rápidamente primary solución de anticuerpos para prevenir seco, luego sellar la cámara húmeda y se incuba a 4 ° C durante la noche.
- Al día siguiente, retire la solución de anticuerpo primario de los portaobjetos mediante aspiración. Se lavan los portas mediante la inserción en recipientes de tinción llenos de 1x TBS con 0,05% de Triton X-100, 3 veces, 15 min cada uno. Mientras tanto, diluir los anticuerpos secundarios fluorescentes apropiados con tampón de bloqueo (con o sin DAPI o faloidina).
- Añadir con cuidado 100-150 l de solución de anticuerpo secundario sobre los portaobjetos. Colocar los portaobjetos dentro de la caja húmeda y selle la tapa. Incubar los portaobjetos durante 1-2 horas a temperatura ambiente.
- Lavar los portaobjetos en recipientes de tinción llenos de 1x TBS con 0,05% de Triton X-100, 3 veces, 15 min cada uno. Al final de lavado, descongelar el medio de montaje anti-fade en un baño de agua a 50 ° durante 10 minutos, si se almacena a -20 ° C. Enfriar el medio de montaje a la temperatura ambiente antes de su uso.
- Añadir aproximadamente 20 l (una gota) de medio de montaje enla diapositiva y se aplica una gran hoja de la cubierta (al menos 22 mm x 64 mm) sobre las muestras. Observe el uso de fluorescentes o microscopio confocal dentro de las 6 horas después de montaje.
- Si la imagen no se puede hacer en el mismo día, sellar diapositivas usando esmalte de uñas y colocarlos dentro de la caja húmeda a 4 ° C durante la noche.
NOTA: El medio de montaje anti-fade, poco a poco oxidado después de unos días (y gire marrón) por lo que se recomienda tomar las imágenes tan pronto como sea posible.
- Si la imagen no se puede hacer en el mismo día, sellar diapositivas usando esmalte de uñas y colocarlos dentro de la caja húmeda a 4 ° C durante la noche.
Resultados
Los resultados representativos muestran secciones transversales de la etapa 30 embriones de Xenopus a diferentes niveles, a saber, el prosencéfalo, el mesencéfalo, rombencéfalo y la médula espinal, teñidas con diferentes anticuerpos (Figura 4). Como se ha mencionado, Sox3 marcado población de células progenitoras neuronales se localiza en la proximidad de la luz del tubo neural, mientras que Myt1 etiquetados-neuronas primarias diferenciadas migran hacia el exterior y localizar cerca de la capa marginal (lámina basal) del tubo neural. Anti-acetil-tubulina etiquetas de los axones en las neuronas diferenciadas, que se pueden observar dentro de todo el tubo neural.
-Side específico gen desmontables o sobreexpresión es un método usado ampliamente en la neurobiología de evaluar si la modulación de la expresión de gen específico (s) interrumpe el crecimiento y la diferenciación de las células neuronales. En tales casos, o bien Morpholinos (OMs) o constructo (s) de ADN que lleva pro gen (s) promotor impulsado se inyectan en uno de los dos blastómeros en la etapa de dos células 23. Alternativamente, pueden ser inyectados en el ventrículo cerebral seguido de electroporación, que dará lugar a la precipitación o la sobre-expresión del gen deseado (s) 27. En ambos casos, los efectos se limitan a un lado del embrión, por lo que el lado opuesto del embrión como control interno no tratado.
Después de la fijación, el corte, y la inmunotinción, los impactos del gen desmontables / sobre-expresión se cuantificó contando y comparando el número de células de diferentes poblaciones a ambos lados del embrión. Mediante la acumulación de estos datos de varios embriones, el análisis estadístico se puede realizar. En nuestros resultados representativos, no perturbación se hizo en los embriones. Ejemplos de perturbación gen y sus efectos sobre diferentes poblaciones de células neuronales se pueden encontrar en las referencias 20,23.
t "fo: keep-together.within-page =" 1 ">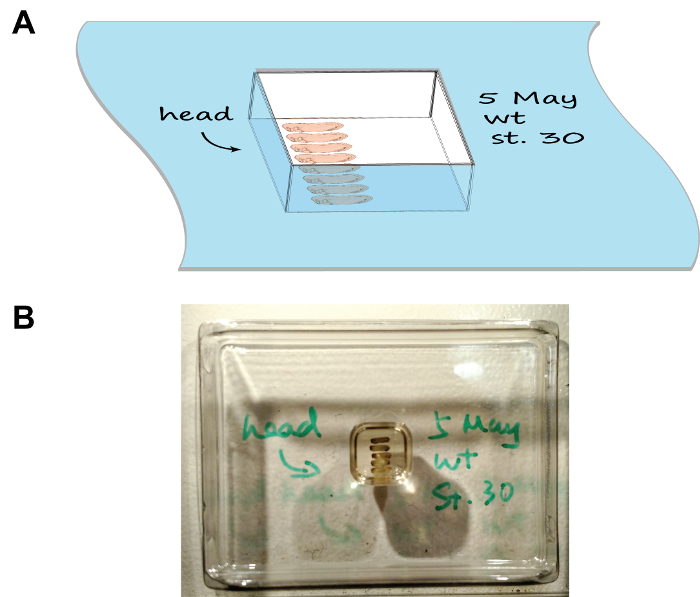
Figura 1:. Embrión disposición y orientación en la sección de molde (A) Una representación de dibujos animados que muestra el conjunto de montaje, tenga en cuenta la bandeja ha sido etiquetado con la fecha, el estadio y la orientación de embriones. (B) Una imagen que muestra el aspecto natural del conjunto de montaje. Haga clic aquí para ver una versión más grande de esta figura.
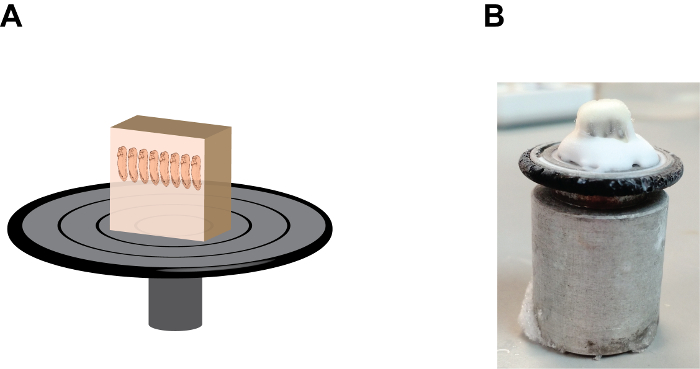
Figura 2:. La orientación y la posición del bloque de gelatina en el disco de retención de la muestra (A) Una representación de dibujos animados que muestra el conjunto del bloque de la sección, tenga en cuenta que los embriones se encuentran en una posición de "mano a mano" y el bloque de gelatina se fija firmemente ore a la muestra del disco de retención por el medio de congelación de tejido en la base (ver Figura 2B). (B) Una imagen que muestra el aspecto natural del conjunto del bloque de la sección, tenga en cuenta la acumulación del medio de congelación de tejido entre el bloque de gelatina y el disco de retención de la muestra. Por favor, haga clic aquí para ver una versión más grande de esta figura.
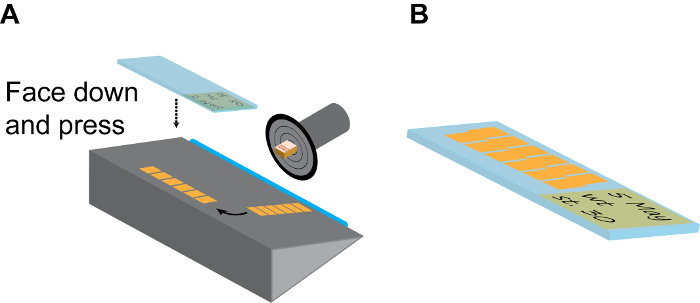
Figura 3:. Seccionamiento Continuo (A) Modelo de una cámara de sección. El disco de retención de la muestra debe ser girado y se fija a la posición de que el lado del embrión hacia arriba. Después de unos pocos (6-10) secciones, la tira larga de las baldosas de sección continua se separan suavemente de la hoja (azul) usando un pincel fino, y luego se volvió de 90 ° en la placa de sujeción. A continuación, una habitación-temp cargado positivamente diapositiva espresiona firmemente contra la tira de la sección hacia abajo e inmediatamente levantado a las tiras terminados recogidos. (B) Normalmente, cada diapositiva tiene capacidad para 2 líneas paralelas de tiras, como se muestra. Recuerde hacer registro detallado en la etiqueta de diapositivas usando lápiz. Haga clic aquí para ver una versión más grande de esta figura.
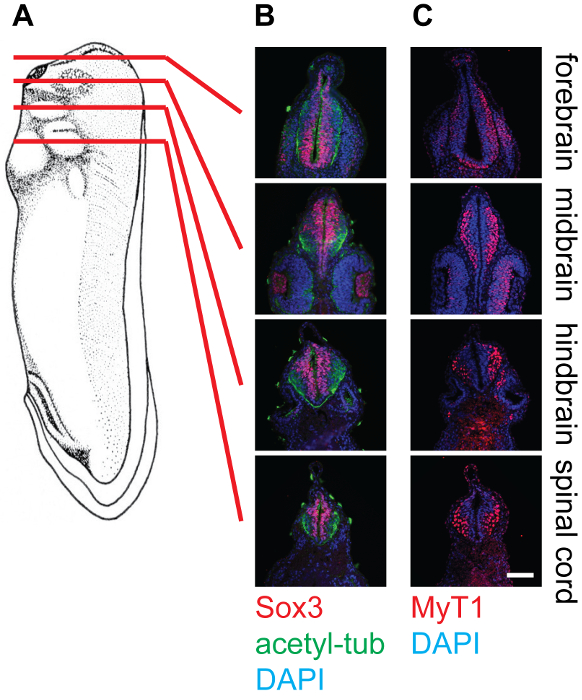
Figura 4: Sección transversal de la etapa 30 X. laevis renacuajos y tinción en el tejido neural, 20X. (A) Esquema que indican las posiciones relativas (prosencéfalo, el mesencéfalo, rombencéfalo y la médula espinal) de planos de sección en los renacuajos Xenopus. (B) correspondientes secciones transversales teñidas con anti-Sox3 (rojo), anti-tubulina acetilada (Green), y DAPI (azul), que muestra las ubicaciones relativas de las piscinas de células madre neurales, así como neurofilamentos dentro del tubo neural. (C) correspondientes secciones transversales teñidas con anti-Myt1 (rojo) y DAPI (azul), que muestra las ubicaciones relativas de las neuronas primarias diferenciadas dentro del tubo neural. Barra de escala = 20 micras. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí se demuestra un método conveniente y eficiente para la visualización de la neurogénesis primaria en embriones de Xenopus. Este método permite la evaluación de diferentes tipos de células neuronales, incluyendo las células madre neuronales y neuronas primarias diferenciadas utilizando marcadores específicos de tipo de células.
El protocolo es generalmente robusto con muy alto nivel de reproducibilidad. Para los embriones que se encuentran en etapas pre-eclosión (es decir, hasta el estadio 28), se recomienda eliminar manualmente la membrana vitelina antes de la fijación ya que esto permite que los embriones a estiren completamente antes de la fijación. Esto es especialmente importante en la recogida de embriones en las fases relativamente tempranas (antes de la eclosión), ya que los embriones dobladas son extremadamente difíciles de organizar en la orientación deseada dentro de la cámara de montaje. No hemos experimentado una pérdida de inmunogenicidad después MEMFA o PFA fijación de ahí paso adicional de recuperar el antígeno no es necesario para este protocolo. Además, esteprocedimiento de inmunotinción puede llevarse a cabo en muestras de cromógeno / hibridación fluorescente in situ. En tal escenario, se recomienda para omitir la etapa de tratamiento K proteasa durante el protocolo de hibridación in situ. Después de la reacción de sustrato cromogénico / fluorescente, las muestras se pueden lavar con TBS y se embebieron en solución de gelatina de pescado en una forma similar a las muestras fijadas MEMFA / PFA. Frascos de la muestra pueden ser protegidos de la luz envolviendo los viales en papel de aluminio si hibridación fluorescente in situ serán fotografiadas junto con la tinción de inmunofluorescencia después.
En algunos casos, los embriones pueden reducir excesivamente después de la penetración de gelatina. Esto es muy probablemente causado por cualquiera de una fijación insuficiente o insuficiente de extracción TBS-Triton. Asegúrese de que los embriones se han corregido en PFA / MEMFA durante al menos 2-3 horas o preferiblemente durante la noche a 4 ° C. Si el problema persiste, aumente el tiempo de lavado de TBS-Triton al 3 durante 1 hora.
Durante la crio-seccióNing, la rigidez de la muestra puede variar en diferentes lotes de gelatina de pescado tienen propiedades diferentes. Este problema puede ser parcialmente compensada mediante el ajuste de la temperatura del micrótomo. Una temperatura más baja dará lugar a un bloque "más duro" de la muestra sin embargo, bajo baja temperatura excesiva del bloque de muestras se vuelve quebradizo y difícil de sección. Algunos ajustes o práctica (utilizando bloques de muestras simuladas sin embriones) antes de cada seccionamiento pueden ser beneficiosos antes de su uso en muestras particularmente valiosos.
Un problema comúnmente encontrado durante el corte es las secciones delgadas a veces tienden a pegarse sobre la placa de vidrio grueso en lugar de permanecer plana en el escenario de acero. Esto puede ser particularmente interrumpir ya que constantemente interrumpe el proceso de corte continuo. Tales casos son causados generalmente por una de dos razones: la cámara de sección y (especialmente) la placa de vidrio grueso no ser carga estática lo suficientemente frío, o excesiva en la máquina y la juntaperator, sobre todo en tiempo seco. El primero puede ser resuelto por bajar la temperatura de la cámara de sección y dejando la placa de vidrio dentro de un tiempo extra (posiblemente durante la noche); y los segundos al conectar a tierra adecuadamente el criostato. Conexión de la superficie metálica del criostato a un grifo de metal o sistema de tubos de agua similar hecha de metal puede ser una forma alternativa para liberar los cargas estáticas. Después de cada uso, la placa de vidrio de espesor se debe lavar bien con detergente no corrosivo (por ejemplo, líquido para lavar platos), se enjuagó con agua ultrapura, rociado con etanol puro, y se envolvió en una toalla de papel para proteger la superficie y los bordes de perjudicial.
Los anticuerpos que figuran en el protocolo son generalmente específicos y que rara vez se encuentran con la adsorción inespecífica o alta señal de fondo. Cabe señalar que, si se utiliza suero de cabra / cordero inactivado por calor como agente de bloqueo, el exceso de calor de la inactivación (como se visualizó mediante la formación de precipitado esponjoso en el suero) debedebe evitarse ya que esto precipitante es muy atractivo para los anticuerpos secundarios y puede contribuir a una fuente de alto fondo.
Es posible, y a veces se desea, para realizar de doble tinción para visualizar diferentes poblaciones de células neuronales simultáneamente. Tal doble tinción es posible y por lo general da resultados satisfactorios con las siguientes combinaciones: Sox3 / N-bañera o Myt1 / N-bañera. Sin embargo, de doble tinción de Sox3 y Myt1 se complica por el hecho de que los dos anticuerpos son ambos de origen de conejo. Hemos probado varios kits de marcaje directo de anticuerpos, sin embargo, no se observaron resultados satisfactorios (bajo nivel de señal a ruido), posiblemente debido a la falta de amplificación de la señal de anticuerpos secundarios. Un posible enfoque para evitar este problema sería aumentar líneas transgénicas en Xenopus, como se discute a continuación.
Una de las principales limitaciones de este protocolo es que, mientras que este protocolo podría suficientemente distinguish dos piscinas principales de células neuronales, es decir, el grupo de células madre neurales que expresan Sox3 y los Myt1 que expresan las neuronas diferenciadas, que carece de la capacidad para revelar diferentes subpoblaciones de neuronas diferenciadas. Tales sub-poblaciones, que incluyen, pero no se limitan a, neuronas motoras primarias, interneuronas, y las neuronas sensoriales, por lo general se caracterizan por sus genes marcadores diferencialmente expresado 28-30. Como se mencionó anteriormente, los recientes avances en el desarrollo de multicolor de hibridación in situ combinado con el método de detección de inmunofluorescencia basado en anticuerpos en embriones de Xenopus pueden llenar el vacío para revelar estas subpoblaciones de neuronas diferenciadas para una posible investigación 31. Por otra parte, como se ha demostrado en el modelo de ratones, sería también ser deseable para criar a un conjunto más amplio de anticuerpos específicos del tipo de células para distinguir estos diferentes poblaciones de células en Xenopus.
EsTambién vale la pena mencionar que, como una adición a este método, los recientes avances en la imagen óptica y análisis de imagen, como la microscopía multifotónica, reconstrucción 3D, y la segmentación, también pueden aplicarse después de las evaluaciones iniciales para lograr observaciones más completas de los ovocitos de Xenopus, así como los embriones tempranos, en particular en virtud de un ajuste de 32,33 vivo. Por lo tanto, para realizar un seguimiento de la proliferación, diferenciación, y el movimiento de las células neuronales en los animales vivos, se desearía establecer una o más líneas transgénicas que albergan proteínas fluorescentes impulsados por promotor específico del tipo de células para permitir la observación en vivo de tales poblaciones de células a principios de Xenopus embriones. El establecimiento de una X. laevis línea con el promotor de β-tubulina-neuro específica conducción tauGFP y sus aplicaciones han proporcionado un buen ejemplo 23,34. Con las secuencias promotoras completos de ambos sox3 y Myt1 caracterizado vertebrados 35-37, es should ser relativamente fácil de establecer líneas transgénicas adicionales en Xenopus que deben contribuir ampliamente para tanto la comunidad de Xenopus y un campo más general de la investigación neurogénesis primaria.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos al Prof. Michael Klymkowsky en la Universidad de Colorado en Boulder y Prof. Nancy Papalopulu en la Universidad de Manchester para proporcionar la amabilidad de anticuerpos anti-Sox3 y anti-Myt1, respectivamente. Agradecemos a los miembros del laboratorio Papalopulu por sus sugerencias interesantes en el desarrollo de este protocolo. Este trabajo fue apoyado por dos Healing Foundation becas a SZ y JL, dos subvenciones para proyectos de la Fundación Healing a SZ / EA y JL / EA, respectivamente, subvención programa de una de la Wellcome Trust para EA (WT082450MA), y una subvención Institucional de Apoyo Estratégico de la Wellcome Trust [097820 / Z / 11 / Z].
Materiales
| Name | Company | Catalog Number | Comments |
| gentamicin | Sigma-Aldrich | G1397 | |
| Tris-HCl | Sigma-Aldrich | T3253 | |
| Tris-base | Sigma-Aldrich | T1503 | |
| NaCl | Sigma-Aldrich | S7653 | |
| KCl | Sigma-Aldrich | 746436 | |
| MgSO4 | Sigma-Aldrich | 746452 | |
| CaCl2 | Sigma-Aldrich | 793639 | |
| HEPES | Sigma-Aldrich | H3375 | |
| MOPS | Sigma-Aldrich | RDD003 | |
| EGTA | Sigma-Aldrich | E3889 | |
| 37% formaldehyde | Sigma-Aldrich | F8775 | |
| Gelatin from cold water fish skin | Sigma-Aldrich | G7765 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| Base Mould Disposable 15 Mm x 15 Mm x 5 Mm Simport | VWR | EMB-200-015A | |
| Base Mould Disposable 7 Mm x 7 Mm x 5 Mm Simport | VWR | EMB-200-010K | |
| Superfrost Plus slides | ThermoFisher | 12-550-15 | |
| Tissue Freezing Medium (OCT) | Leica | 14020108926 | |
| Cryostat | Leica | CM3050 | |
| Gloves | |||
| Dry Ice | |||
| Triton X-100 | Sigma-Aldrich | X100 | |
| 85-90 °C Heat block | |||
| PAP pen | Sigma-Aldrich | Z377821 | |
| Acetone, analytical grade | |||
| Staining jar with slide racks | |||
| Click-lock food box of appropriate size (has the capacity to hold 1-2 6-well plate inside) | |||
| anti-acetylated tubulin | Sigma-Aldrich | T7451 | |
| Anti-mouse IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 488 Conjugate) | Cell Signaling | 4408 | |
| Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 555 Conjugate) | Cell Signaling | 4413 | |
| Alexa Fluor® 647 Phalloidin | Cell Signaling | 8940 | |
| DAPI | Cell Signaling | 4083 | |
| ProLong Gold Antifade Mountant | Life Technologies | P36930 |
Referencias
- De Robertis, E. M., Kuroda, H. Dorsal-ventral patterning and neural induction in Xenopus embryos. Annual Rev Cell Dev Biol. 20, 285-308 (2004).
- Wilson, S. W., Houart, C. Early steps in the development of the forebrain. Dev Cell. 6, 167-181 (2004).
- Hemmati-Brivanlou, A., Melton, D. Vertebrate embryonic cells will become nerve cells unless told otherwise. Cell. 88, 13-17 (1997).
- Hemmati-Brivanlou, A., Melton, D. A. Inhibition of activin receptor signaling promotes neuralization in Xenopus. Cell. 77, 273-281 (1994).
- Fainsod, A., et al. The dorsalizing and neural inducing gene follistatin is an antagonist of BMP-4. Mech Dev. 63, 39-50 (1997).
- Piccolo, S., Sasai, Y., Lu, B., De Robertis, E. M. Dorsoventral patterning in Xenopus: inhibition of ventral signals by direct binding of chordin to BMP-4. Cell. 86, 589-598 (1996).
- Zimmerman, L. B., De Jesus-Escobar, J. M., Harland, R. M. The Spemann organizer signal noggin binds and inactivates bone morphogenetic protein 4. Cell. 86, 599-606 (1996).
- Koyano, S., Ito, M., Takamatsu, N., Takiguchi, S., Shiba, T. The Xenopus Sox3 gene expressed in oocytes of early stages. Gene. 188, 101-107 (1997).
- Rogers, C. D., Harafuji, N., Archer, T., Cunningham, D. D., Casey, E. S. Xenopus Sox3 activates sox2 and geminin and indirectly represses Xvent2 expression to induce neural progenitor formation at the expense of non-neural ectodermal derivatives. Mech Dev. 126, 42-55 (2009).
- Zhang, C., Basta, T., Jensen, E. D., Klymkowsky, M. W. The beta-catenin/VegT-regulated early zygotic gene Xnr5 is a direct target of SOX3 regulation. Development. 130, 5609-5624 (2003).
- Penzel, R., Oschwald, R., Chen, Y., Tacke, L., Grunz, H. Characterization and early embryonic expression of a neural specific transcription factor xSOX3 in Xenopus laevis. Int J Dev Biol. 41, 667-677 (1997).
- Bellefroid, E. J., et al. X-MyT1, a Xenopus C2HC-type zinc finger protein with a regulatory function in neuronal differentiation. Cell. 87, 1191-1202 (1996).
- Moody, S. A., Miller, V., Spanos, A., Frankfurter, A. Developmental expression of a neuron-specific beta-tubulin in frog (Xenopus laevis): a marker for growing axons during the embryonic period. J Comp Neurol. 364, 219-230 (1996).
- Oschwald, R., Richter, K., Grunz, H. Localization of a nervous system-specific class II beta-tubulin gene in Xenopus laevis embryos by whole-mount in situ hybridization. Int J Dev Biol. 35, 399-405 (1991).
- Chitnis, A., Henrique, D., Lewis, J., Ish-Horowicz, D., Kintner, C. Primary neurogenesis in Xenopus embryos regulated by a homologue of the Drosophila neurogenic gene Delta. Nature. 375, 761-766 (1995).
- Roberts, A. Early functional organization of spinal neurons in developing lower vertebrates. Brain Res Bull. 53, 585-593 (2000).
- Hartenstein, V. Early neurogenesis in Xenopus: the spatio-temporal pattern of proliferation and cell lineages in the embryonic spinal cord. Neuron. 3, 399-411 (1989).
- Hirabayashi, Y., et al. The Wnt/beta-catenin pathway directs neuronal differentiation of cortical neural precursor cells. Development. 131, 2791-2801 (2004).
- Munji, R. N., Choe, Y., Li, G., Siegenthaler, J. A., Pleasure, S. J. Wnt signaling regulates neuronal differentiation of cortical intermediate progenitors. J Neurosci. 31, 1676-1687 (2011).
- Bonev, B., Stanley, P., Papalopulu, N. MicroRNA-9 Modulates Hes1 ultradian oscillations by forming a double-negative feedback loop. Cell Rep. 2, 10-18 (2012).
- Bonev, B., Pisco, A., Papalopulu, N. MicroRNA-9 reveals regional diversity of neural progenitors along the anterior-posterior axis. Dev Cell. 20, 19-32 (2011).
- Munoz, R., et al. Regeneration of Xenopus laevis spinal cord requires Sox2/3 expressing cells. Dev Biol. , (2015).
- Zhang, S., Li, J., Lea, R., Vleminckx, K., Amaya, E. Fezf2 promotes neuronal differentiation through localised activation of Wnt/beta-catenin signalling during forebrain development. Development. 141, 4794-4805 (2014).
- Zhang, S., Li, J., Lea, R., Amaya, E., Dorey, K. A Functional Genome-Wide In Vivo Screen Identifies New Regulators of Signalling Pathways during Early Xenopus Embryogenesis. PloS one. 8, e79469(2013).
- Wang, T. W., et al. Sox3 expression identifies neural progenitors in persistent neonatal and adult mouse forebrain germinative zones. J Comp Neurol. 497, 88-100 (2006).
- Sabherwal, N., et al. The apicobasal polarity kinase aPKC functions as a nuclear determinant and regulates cell proliferation and fate during Xenopus primary neurogenesis. Development. 136, 2767-2777 (2009).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev Biol. 7, 107(2007).
- Moreno, N., Retaux, S., Gonzalez, A. Spatio-temporal expression of Pax6 in Xenopus forebrain. Brain Res. 1239, 92-99 (2008).
- Kay, B. K., Shah, A. J., Halstead, W. E. Expression of the Ca2+-binding protein, parvalbumin, during embryonic development of the frog, Xenopus laevis. J Cell Biol. 104, 841-847 (1987).
- Park, B. Y., Hong, C. S., Weaver, J. R., Rosocha, E. M., Saint-Jeannet, J. P. Xaml1/Runx1 is required for the specification of Rohon-Beard sensory neurons in Xenopus. Dev Biol. 362, 65-75 (2012).
- Lea, R., Bonev, B., Dubaissi, E., Vize, P. D., Papalopulu, N. Multicolor fluorescent in situ mRNA hybridization (FISH) on whole mounts and sections. Methods Mol Biol. 917, 431-444 (2012).
- Canaria, C. A., Lansford, R. Advanced optical imaging in living embryos. Cell Mol Life Sci. 67, 3489-3497 (2010).
- Prouty, A. M., Wu, J., Lin, D. T., Camacho, P., Lechleiter, J. D. Multiphoton laser scanning microscopy as a tool for Xenopus oocyte research. Methods Mol Biol. 322, 87-101 (2006).
- Love, N. R., et al. pTransgenesis: a cross-species, modular transgenesis resource. Development. 138, 5451-5458 (2011).
- Kovacevic Grujicic, N., Mojsin, M., Krstic, A., Stevanovic, M. Functional characterization of the human SOX3 promoter: identification of transcription factors implicated in basal promoter activity. Gene. 344, 287-297 (2005).
- Wang, S., et al. Myt1 and Ngn3 form a feed-forward expression loop to promote endocrine islet cell differentiation. Dev Biol. 317, 531-540 (2008).
- Rogers, C. D., Archer, T. C., Cunningham, D. D., Grammer, T. C., Casey, E. M. Sox3 expression is maintained by FGF signaling and restricted to the neural plate by Vent proteins in the Xenopus embryo. Dev Biol. , 307-319 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados