Method Article
Análisis alta Content Screening para evaluar los efectos toxicológicos de nocivo Componentes y potencialmente perjudicial (HPHC)
En este artículo
Resumen
The objective of the study was to assess the biological impact of 15 cigarette smoke constituents using a combination of an impedance-based real time cell analyzer and a high-content screening (HCS)-based platform for toxicological assessment in vitro. This study provides information on effective doses, toxicity and modes of action of the tested compounds.
Resumen
El humo del cigarrillo (CS) es un importante factor de riesgo para las enfermedades cardiovasculares y pulmonares. Debido a que CS es un aerosol complejo que contiene más de 7.000 sustancias químicas 1 es un reto para evaluar las contribuciones de los componentes individuales a su toxicidad general. Perfiles toxicológicos de los componentes individuales así como las mezclas se pueden sin embargo establecieron in vitro, mediante la aplicación de alto rendimiento de procesamiento herramientas de evaluación, que permiten determinar las características de nocivo Componentes y potencialmente perjudicial (HPHC) del humo del tabaco, tal como se define por la Food and Drug Administration (FDA). 2
Para una evaluación inicial, se utilizó un instrumento basado en la impedancia para un tiempo real, la evaluación etiqueta libre de la toxicidad del compuesto. La lectura de instrumento se basa en la adhesión celular, la viabilidad y la morfología que todos juntos proporcionan una visión general del estado de las células. Un parámetro adimensional, llamada índice de células, se utiliza para la cuantificación. Un conjunto de DIFrentes protocolos de tinción fue desarrollado para una investigación basada en imágenes de fluorescencia y se utilizó una plataforma HCS para obtener información más detallada sobre el tipo de citotoxicidad provocada por cada HPHC.
De los 15 componentes al control, sólo cinco fueron seleccionados para el análisis basado en HCS, ya que registraron un LD computable 50 (<20 mm). Estos incluyen 1-aminonaphtalene, arsénico (V), cromo (VI), crotonaldehído y fenol. Sobre la base de su efecto en el HCS, 1-aminonaphtalene y fenol pueden ser identificados para inducir la disfunción mitocondrial, y, junto con el cromo (VI) como genotóxico basada en el aumento de la fosforilación de la histona H2AX. El crotonaldehído se identificó como un inductor de estrés oxidativo y arsénico como un activador de la vía estrés quinasa.
Este estudio demuestra que una combinación de tecnologías basadas en la impedancia y HCS proporciona una herramienta robusta para la evaluación in vitro de los componentes de CS.
Introducción
Evaluación del riesgo toxicológico históricamente se ha basado en el uso de modelos animales que, aunque fundamental en las ciencias de la vida, también están vinculados con deficiencias tales como la traducibilidad inconsistente para los seres humanos y de alto costo. Por otra parte, ha habido un creciente esfuerzo para encontrar alternativas a la experimentación con animales en el espíritu de "Las 3R" 2 (reemplazo, reducción y refinamiento). Este esfuerzo se ha acelerado en los últimos años, no sólo debido a los recientes avances tales como técnicas de alto rendimiento y los enfoques de biología de sistemas, sino también debido a la legislación que restringe el uso de la experimentación con animales, especialmente en la Unión Europea.
La complejidad de las vías de señalización celular que regulan la respuesta a los insultos tóxicos hace que sea evidente que el uso de criterios de valoración toxicológicos individuales no será suficiente para describir la base toxicológica de ciertos compuestos. Para esto, la interacción de cientos de interactuar pTambién tendrá que ser tenido en cuenta roteins que contribuyen a una red biológica. Para estudiar el efecto de las sustancias tóxicas en dichas redes, un enfoque toxicología sistema combinado con mediano fenotípicas y ensayos de selección de alto rendimiento es útil para inferir potencias y, al mismo tiempo, proporcionar más información sobre el mecanismo de acción de sustancias tóxicas individuales.
En este estudio, hemos empleado HCS como una poderosa herramienta de detección, que se compone de un microscopio automatizado y una aplicación de software biológica, que se puede adquirir, procesar y analizar datos de imagen obtenidos a partir de ensayos celulares específicos basados en fluorescencia. Esto permite cambios visuales dentro de una célula a ser cuantificado, en una única célula o nivel subcelular, y muchos parámetros a analizar de forma simultánea. 3 Por ejemplo, el ADN doble filamento se rompe se evaluaron utilizando una identificación basada en anticuerpos de la fosforilación de la histona H2AX y especies reactivas del oxígeno (ROS) se cuantificaron utilizando una célula-permsuperóxido eable colorante sensible.
Dado que las células epiteliales del pulmón representan la primera barrera biológica contra la inhalación de sustancias tóxicas, como el humo del cigarrillo, que utilizó las células epiteliales bronquiales primarias como un modelo in vitro para perfilar el efecto de HPHC publicados por la Food and Drug Administration. 4 Este manuscrito es un seguimiento -up en un estudio anterior 5 en el que se evaluó el impacto biológico de un subconjunto diferente de HPHC.
Como parte de nuestro flujo de trabajo para evaluar la citotoxicidad in vitro, que inicialmente se evaluaron las potencias de una selección de 15 HPHC de, mediante un análisis celular en tiempo real basado en la impedancia del sistema (RTCA), que permitió establecer dosis-rangos, adecuados para su posterior HCS análisis (Figura 1). Una evaluación toxicológica HCS continuación, se llevó a cabo utilizando nueve puntos terminales multi-paramétricas de toxicidad celular, cada uno controla a dos puntos de tiempo (4 y 24 h). Los marcadores utilizados fueron indicativos de toxicidad mitocondrial, el daño del ADN, el estrés quinasa, especies reactivas de oxígeno (ROS), contenido de glutatión (GSH), caspasa 3 - actividad 7, la liberación de citocromo C y permeabilidad de la membrana celular, como se describe en la Tabla 1.
Nuestro enfoque permitido la identificación y caracterización de los efectos de los componentes del humo del cigarrillo a través del muestreo de la dosis y dependiente del tiempo. En última instancia, esto produjo un perfil toxicológico in vitro para cada HPHC. enfoques Multi-ómicas también se pueden utilizar para complementar aún más el análisis de HCS. Esto finalmente también proporcionar una comprensión más profunda de los efectos en la señalización celular y / o de transcripción.
Protocolo
1. La recolección normal Humanos células epiteliales bronquiales (NHBEs)
- Pre-calentar el medio de cultivo celular (crecimiento celular epitelial bronquial suplementado medio a medio), el, tripsina, y solución de tripsina neutralizante HEPES (TNS) en el baño de agua a 37 ° C.
- Recoger las células cuando se alcanza el 80% de confluencia.
NOTA: La siguiente cultivo de células NHBE siembra condiciones puede ser utilizada para obtener confluencia óptima en matraces T75 no recubiertas con 20 ml de medio:- Sembrar 1 x 10 6 células para el cultivo de 3 días, 0,5 x 10 6 células para el cultivo de 4 días y 0,25 x 10 6 células de cultivo de 5 días. Cambiar el medio cada 2 días cuando las células están en la cultura para refrescar nutrientes. Células de cultivo a 37 ° C y 5% de CO2.
- Eliminar el sobrenadante del matraz (s) y añadir HEPES para lavar las células (por ejemplo., 3 ml de un matraz de 75 cm2). Girar cada matraz para cubrir la monocapa de células con el sol de HEPESlución.
- Eliminar la solución de HEPES y añadir una solución de tripsina (por ejemplo., 3 ml de un matraz de 75 cm2). Girar el matraz para cubrir la monocapa de células con solución de tripsina.
- Incubar el matraz durante 5 min a 37 ± 2 ° C. Monitorear el desprendimiento de células bajo el microscopio y si es necesario, ya incubar y toque en el frasco para liberar las células unidas restantes suavemente.
- Añadir TNS para detener la reacción (por ejemplo., 3 ml de un matraz de 75 cm2) y la transferencia de la suspensión celular a un tubo de 15 ml.
- Centrifugar la suspensión celular a 300 g durante 5 min.
- Eliminar el sobrenadante y volver a suspender el sedimento celular en 10 ml de medio fresco, mezclando suavemente para producir una suspensión celular homogénea.
- Se filtra la suspensión celular a través de un filtro de células de 100 mM para eliminar los agregados y contar las células. Nota: En nuestro laboratorio se utilizó un sistema de conteo de células de varios canales de campo eléctrico para evaluar de forma precisa y consistente la viablnúmero de células correos.
2. Analizador en Tiempo Real de la célula (RTCA) a base de Dosis Rango de Investigación (DRF)
NOTA: Un sistema de medición basado en la impedancia se utiliza para: 1) evaluar la toxicidad compuesto, 2) compuestos seleccionados para investigarse más a fondo por el HCS y 3) seleccionar las dosis apropiadas para HCS. Las células NHBE en las placas RCTA se dosifican mediante la adición de 25 l de diluciones del compuesto de ensayo a 100 l presente medio de cada pocillo. Por lo tanto, todas las soluciones de ensayo se preparan a 5 veces (5x) la concentración final deseada.
- Las células NHBE de siembra
- Programar el instrumento para definir el número y la duración de las mediciones de impedancia. En este estudio, los datos se registraron cada 15 min durante 48 horas (de 24 hr ± 2 horas antes y 24 horas después de la dosificación de las células con agentes de ensayo).
- Medir la placa de fondo pipeteando 50 l de medio de pre-calentado en cada pocillo de una placa de 96 pocillos RTCA. Nota: Este paso representa un requisito técnicopara el instrumento para calcular la resistencia eléctrica medio que luego se utiliza como una referencia de línea de base para el cálculo basado en células.
- Preparar una suspensión celular a una concentración de 144.000 células / ml (± 5%) y añadir la suspensión de células 50 l (7.200 células / pocillo) a cada pocillo de la placa de RTCA en el que 50 l / pocillo de medio ya fue añadido para el fondo instrumento medición.
- Deje que las células se adhieren durante 30 min a temperatura ambiente antes de colocarlos en la cuna RTCA (para mejorar la distribución homogénea de las células). Se incuban las placas RTCA en la cuna RTCA en la incubadora (37 ° C y 5% de CO 2) y empezar a grabar los datos para el próximo 24 ± 2 horas antes de la dosificación.
- Las diluciones de controles positivos y HPHC
- Control positivo de dilución
- Diluir la solución Staurosporine madre (10 mM) 1:10 en DMSO (ver Tabla 3) y añadir 5 l de la dilution a 195 l de medio para obtener una solución de trabajo de 5x.
- La dilución HPHC
- Disolver / diluir cada HPHC en el vehículo (Tabla 2) para generar una solución madre 1 M. Diluir cada HPHC solución madre 1:10 en un medio para generar una solución 100 mM.
- Generar la "placa maestra compuesto" mediante la realización de una dilución en serie 1:10 de cinco pasos utilizando medio vehículo + 10% para obtener las soluciones de trabajo 5x (Figura 2). Nota: En última instancia, las dosis finales serán: 0,2 M, 2 M, 20 mM, 0,2 mM, 2 mM, 20 mM. También hay que preparar la dosis 0, que corresponde al único vehículo, en este paso.
- dosificación
- Pausa el instrumento RTCA y abrir la cuna para eliminar la placa.
- Retire la placa y colocarla en la herramienta de temperatura de la placa RTCA (diseñado para estabilizar la temperatura de la placa RTCA durante los procedimientos experimentales fuera de la RTCAEstación) para evitar el enfriamiento de las células, lo que podría afectar a la medición de la impedancia.
- Añadir 25 l de 5x solución de la "placa de compuesto maestra" a las células, por triplicado, que mantienen el mismo orden de dosificación como en la placa de compuesto principal (dosis más alta en la fila superior y el vehículo de control en el número de fila 7) (Figura 2). No retire el (100 l) medio de cultivo celular existente.
- Añadir 25 l 5x solución de control positivo a las células en la fila inferior (media-derecha) sin necesidad de retirar el medio de cultivo existente. Añadir 25 l de medio a las células en la fila inferior (media-izquierda) sin la eliminación de medio de cultivo celular existente.
- Sellar la placa con el sellador de placas. Coloque la placa posterior en la cuna RTCA y bloquearlo. Grabación para el tiempo de exposición deseado de reinicio de datos (por ejemplo., 24 h). Nota: El uso de esta película sellante se recomienda evitar la posible contaminación, incluyendo la contaminación cruzada acomodado bien.
- Análisis de Datos RTCA y LD 50 Cálculo
- Exportar datos en bruto como un texto (.txt) o un archivo de Excel (.xls). Nota: El archivo contendrá toda la información sobre la disposición de la placa (Compuestos, dosis y posición bien). Índice de células en bruto se organizan en un (distribución bien la placa de espejo) formato de 96 pocillos y se proporcionan cada momentos de la hora en que se produjo la grabación. El valor en la posición i en la placa de 96 pocillos en el tiempo t se denota por CI t (i).
- Identificar como una normalización la referencia el último punto de tiempo antes de la dosificación para cada posición i en la placa de 96 pocillos (por ejemplo, del Índice de Células en 23 hr 50 min 00 seg en la posición i, CI t (i) = 23: 50: 00 = CI Ref (i)). Nota: Esta información debe ser anotado cuando se realiza la dosificación.
- Divide, sobre una base bien, cada valores de los puntos de tiempo por parte de la normalización de referencia para normalizar todos los valores en el momento de la dosificación. El valor normalizado en positioni en la placa de 96 pocillos en el tiempo t se denota por NCI t (i) y por lo tanto se define por NCI t (i) = CI t (i) / CI Ref (i) para todo t.
- Calcular el área bajo la curva (AUC) a las 24 horas después de la dosificación para cada muestra I (posición i en la placa de 96 pocillos), incluyendo posiciones para el control positivo y el vehículo.
- Obtener el AUC en la posición i se obtiene mediante la suma de las áreas de cada rectángulo, siendo entre dos puntos de tiempo cada rectángulo denotado por t k y t l (t k l); calcular cada área rectángulo con x * y con x = t l - siendo t k la distancia entre dos puntos de tiempo y siendo Y la media de la actividad de los dos puntos de tiempo (y = (tk NCI (i) + tl NCI (i)) / 2).
Nota: El AUC a las 24 horas después de la dosificación para la posición i se denota por AUC (i). Como todas las condiciones se colocaron en placas en pocillos por triplicado se usa la mediana de los tres valores.
- Obtener el AUC en la posición i se obtiene mediante la suma de las áreas de cada rectángulo, siendo entre dos puntos de tiempo cada rectángulo denotado por t k y t l (t k l); calcular cada área rectángulo con x * y con x = t l - siendo t k la distancia entre dos puntos de tiempo y siendo Y la media de la actividad de los dos puntos de tiempo (y = (tk NCI (i) + tl NCI (i)) / 2).
- Normalizar los valores utilizando la siguiente ecuación:
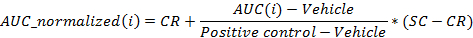
donde i es la posición en la placa de 96 pocillos para el que se calcula el AUC a las 24 horas después de la dosificación,
Vehículo es la mediana de los valores de AUC para los pozos de vehículos en una placa en 24 horas después de la dosificación,
Control positivo es la mediana de los valores de AUC para los pocillos de control positivo en una placa en 24 horas después de la dosificación,
CR es el valor normalizado mediana deseada para el vehículo (0%), y
SC es el valor normalizado mediana deseado para los controles positivos (-100%)
NOTA: Al final de este paso, un conjunto de datos se obtiene que contiene, para cada posición i en la placa de 96 pocillos, un ci concentración (en unidades logarítmicas) que se aplica a la muestra contenida en posición / pocillo i y su correspondiente AUC normalizada a las 24 horas después de la dosificación AUC_normalized (i). - Trama y adaptarse a la (c i, AUC_normalized (i))-valores utilizando un 4-parámetros ecuación de Hill. Cuando sea posible, también calcular la DL50.
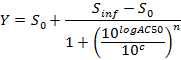
donde Y = AUC_normalized,
El nivel 0 = Actividad Actividad Zero S a concentración cero del compuesto de ensayo,
Nivel infinita inf = Actividad Actividad S a una concentración infinita,
AC50 = concentración en la que la actividad alcanza el 50% del nivel máximo,
Coeficiente de Hill n = Medida de la pendiente en AC50, y
c = concentración en unidades logarítmicas correspondientes a los valores en el eje x de la trama curva de dosis-respuesta.
NOTA: AC50 corresponde a LD 50 (ensayos de citotoxicidad). Es una medida de la potencia, donde los valores bajos indican alta potencia.
- Control positivo de dilución
3. Medición de la toxicología Efectos de HCS
NOTA: Un total de nueve marcadores multi-paramétricas de la toxicidad, agrupados en seis ensayos diferentes, se valoran utilizando la plataforma HCS (Tabla 1). Con base en el análisis de la viabilidad celular RTCA (Sección 2) el rango de dosis de cada componente se define y se incluye también una dosis de referencia 3R4F. La dosis de referencia es equivalente a la cantidad de HPHC presente en el humo de un palo de la 3R4F cigarrillo de referencia.
- Las células NHBE de siembra
- Preparar una suspensión celular a 120.000 células / ml (± 5%) y añadir la suspensión de células 100 l a cada pocillo de una placa de HCS 96 pocillos (12.000 células / pocillo). Preparar platos suficientes para la evaluación de todos los ensayos (citotoxicidad, daño en el DNA, estrés quinasa, ROS, el contenido de GSH y la apoptosis) y los puntos de tiempo (4 y 24 horas).
- Deje las placas de HCS a temperatura ambiente durante 30 minutos para permitir que las células se unan a los pozos y luego se incuban a las 37 ° C y 5% de CO2 durante 24 ± 2 horas antes de la dosificación.
- La dilución de HCHPs y controles positivos
NOTA: Las células NHBE en las placas de HCS se dosifica mediante la adición de 25 l de soluciones de muestra de ensayo a 100 l de medio ya presente en cada pocillo. Por lo tanto, todas las dosis se preparan a 5x la concentración final deseada.- Los controles positivos de dilución (control positivo Plate)
- Prescindir de 40 l de solución madre de cada control positivo (véase la Tabla 3) en la columna # 2 (Figura 4a, pozos sombreados en rojo). Prescindir de 20 l de vehículo en las columnas # 3 y # 5 (Figura 4a, pozos sombreados en azul claro) y 40 l de vehículo en la columna # 4 (Figura 4a, pozos sombreados en azul claro).
- Retirar 12 l de los pocillos en la columna # 2, dispensarla a los pocillos en la columna # 3 y mezclar (Figura 4b), Continúe hasta una dilución en serie final con 3 dosis (d1, d2, d3 y) y el vehículo (V) para cada compuesto de control positivo se obtiene (Figura 4c). Para generar la placa de control positivo, se prepara una dilución 1:40 de compuestos en los medios de comunicación (Figura 4d).
- HPHC dilución (Compuesto placa maestra)
NOTA: Los intervalos de dosis seleccionados de HPHC para HCS se enumeran en la Tabla 2.- Diluir cada HPHC solución madre (1 M) 1:10 en medio de una concentración de 100 mM. Realizar diluciones usando medio con vehículo 10% para obtener las dosis 5x seleccionados para cada HPHC.
- Los controles positivos de dilución (control positivo Plate)
- dosificación
- Añadir 25 l de soluciones de 5x de la placa maestra compuesto a las células por triplicado mantener el mismo orden de dosificación como en la placa de compuesto principal (dosis más alta en la fila superior y el vehículo de control en el número de fila 7) (Figura 5). No retire el correoxistentes (100 l) medio de cultivo celular.
- Añadir 25 l de 5x solución de la placa de control positivo a las células en la fila inferior se mantiene el mismo orden de dosificación como en la placa de control positivo (Figura 5). No retire el (100 l) medio de cultivo celular existente. Nota: Cada ensayo tiene un control positivo específico; véase la Tabla 3. Incubar la placa a 37 ° C y 5% de CO2 durante el tiempo de exposición deseado (4 o 24 horas).
- tinción
- Preparación para todos los ensayos
- Pre-calentar el tampón de lavado (PBS) soluciones a 37 ° C.
- Preparar la solución de fijación (solución de formaldehído al 4%) la adición de 10,81 ml de formaldehído al 37% a 89,19 ml de tampón de lavado y pre-calentamiento a 37 ° C.
- Preparar el tampón de permeabilización mediante la adición de 10 ml de 10x tampón de permeabilización a 90 ml de tampón de lavado y se pre-caliente a 37 ° C.
- Preparar el Blotampón cking mediante la adición de 10 ml de 10x tampón de bloqueo a 90 ml de tampón de lavado y se pre-caliente a 37 ° C.
- Pre-calentar el medio de cultivo celular a 37 ° C.
- Retire las placas de HCS de la incubadora una vez que se alcanzan los 4 y 24 horas los tiempos de exposición y realice los siguientes protocolos específicos para cada ensayo.
- Ensayo de citotoxicidad
- Preparar un volumen suficiente (V) de la solución de tinción de células vivas de acuerdo con la siguiente fórmula: volumen de medio (l) V = 50 x W x 1,2 (W Número de pozos)
- Diluir el colorante mitocondrias en la solución de tinción de células vivas de acuerdo con las instrucciones del proveedor. Diluir el colorante Permeabilidad de la Membrana en la solución de tinción de células vivas de acuerdo con las instrucciones del proveedor.
- Añadir la solución de tinción de células vivas 50 l a cada pocillo de la placa (s) designado "Ensayo de citotoxicidad". NO retire el medio de cultivo celular y se incuba durante 30 minutos a 37 ° C, 5% de CO 2.
- aspirar suavemente la solución del medio y la tinción y añadir 100 l / pocillo de solución de fijación a cada pocillo, a continuación, se incuba la placa (s) durante 20 min a temperatura ambiente en la oscuridad.
- aspirar suavemente solución de fijación y se lava una vez con 100 l / pocillo de tampón de lavado.
- Eliminar el tampón de lavado y añadir tampón de permeabilización de 100 l / pocillo de 1X a cada pocillo y se incuba durante 10 min a temperatura ambiente en la oscuridad.
- Aspirar tampón de permeabilización y la placa de lavado dos veces con 100 l / pocillo de tampón de lavado.
- Aspirar el tampón de lavado y añadir 100 l de tampón de bloqueo 1x a cada pocillo y se incuba durante 15 minutos a temperatura ambiente en la oscuridad.
- Preparar un volumen suficiente (V) de solución de anticuerpo primario de acuerdo con la siguiente fórmula: Volumen de tampón de bloqueo (l) V = 50 x W x 1,2 (W Número de pozos). Diluir el anticuerpo anti-C citocromo (ratón) 1: 250 en solución de anticuerpo primario.
- Aspirar un tampón de bloqueod añaden 50 l así la solución de anticuerpo / Primaria a cada pocillo y se incuba durante 60 minutos a temperatura ambiente en la oscuridad.
- Preparar un volumen suficiente (V) de anticuerpo secundario y la solución Nuclear de acuerdo con la siguiente fórmula: Volumen de tampón de bloqueo (l) V = 50 x W x 1,2 (W Número de pozos). Diluir el anticuerpo anti-ratón de 1: 500 en solución de anticuerpo secundario y Nuclear. Diluir el colorante nuclear 1: 1.000 en secundaria de anticuerpos y la solución nuclear.
- Aspirar solución de anticuerpo primario y la placa de lavado tres veces con 100 l / pocillo de tampón de lavado usando el lavador de placas.
- Aspirar el tampón de lavado y añadir 50 l / pocillo de anticuerpo secundario y la solución Nuclear a cada pocillo de la placa (s) e incubar durante 60 min a temperatura ambiente en la oscuridad.
- Aspirar secundaria de anticuerpos y la solución nuclear y la placa de lavado tres veces con 100 l / pocillo de tampón de lavado usando el lavador de placas. Añadir 100 l / pocillo de tampón de lavado. Placa (s) está (n) ahoralisto para ser evaluado en el lector de HCS.
- Ensayo de daño del ADN
- Se aspira suavemente el medio de las placas designadas "daño en el ADN".
- Realizar los mismos pasos como se describe en secuencia: 3.4.2.4 - 3.4.2.8. Tenga en cuenta que en este ejemplo, sólo se retira el medio durante la etapa 3.4.2.4.
- Preparar un volumen suficiente (V) de solución de anticuerpo primario de acuerdo con la siguiente fórmula: Volumen de tampón de bloqueo (l) V = 50 x W x 1,2 (W Número de pozos)
- Diluir el anticuerpo H2AX anti-fosfato (ratón) 1: 2000 en solución de anticuerpo primario.
- Realice los mismos pasos como se describe en 3.4.2.10.
- Preparar un volumen suficiente (V) de anticuerpo secundario y Nuclear solución de acuerdo con la siguiente fórmula: Volumen de tampón de bloqueo (l) V = 50 x W x 1,2 (W Número de pozos)
- Diluir el anticuerpo anti-ratón de 1: 500 en solución de anticuerpo secundario y Nuclear.
- Se diluye la Nuclear tinte 1: 1.000 en secundaria de anticuerpos y la solución nuclear.
- Realizar los mismos pasos que se describen en secuencia: 3.4.2.12-3.4.2.14.
- El estrés Ensayo de quinasa
- aspirar suavemente el medio de cada una de las placas designadas "Stress quinasa".
- Realizar los mismos pasos como se describe en secuencia: 3.4.2.4 - 3.4.2.8. Tenga en cuenta que en este ejemplo, sólo se retira el medio durante la etapa 3.4.2.4.
- Preparar un volumen suficiente (V) de solución de anticuerpo primario de acuerdo con la siguiente fórmula: Volumen de tampón de bloqueo (l) V = 50 x W x 1,2 (W Número de pozos)
- Diluir el anticuerpo anti-fosfo cJun (conejo) 1: 200 en solución de anticuerpo primario.
- Realice los mismos pasos como se describe en 3.4.2.10.
- Preparar un volumen suficiente (V) de anticuerpo secundario y Nuclear solución de acuerdo con la siguiente fórmula: Volumen de tampón de bloqueo (l) V = 50 x W x 1,2 (W Número de pozos)
- Diluir el anticuerpo anti-conejo 1: 500 en solución de anticuerpo secundario y Nuclear.
- Diluir el colorante nuclear 1: 1.000 en secundaria de anticuerpos y la solución nuclear.
- Realizar los mismos pasos que se describen en secuencia: 3.4.2.12-3.4.2.14.
- ROS Ensayo
- Preparar un volumen suficiente (V) de la solución de tinción de células vivas de acuerdo con la siguiente fórmula: volumen de medio (l) V = 50 x W x 1,2 (W Número de pozos).
- Diluir el colorante de ROS en células vivas tinción Solución acuerdo con las instrucciones del proveedor
- Diluir el colorante nuclear 1: 1.000 en células vivas tinción Solution.3.4.5.4) Añadir 50 l solución de tinción de células vivas para cada placas de pocillos designados "ROS"; NO retire los medios de cultivo de células y se incuba durante 30 minutos a temperatura ambiente en la oscuridad.
- aspirar suavemente la solución del medio y de tinción y lavar la placa tres veces con 100 l / pocillo medio.
- Aspirar el medio, añadir 100 _6; l / pocillo solución de fijación a cada pocillo y se incuba la placa durante 20 min a temperatura ambiente en la oscuridad.
- aspirar suavemente solución de fijación y se lava la placa tres veces con 100 l / pocillo de tampón de lavado.
- Añadir 100 l / pocillo de tampón de lavar. Placa (s) es (son) listo.
- Evaluar la placa en el lector de HCS dentro de 1 hora.
- GSH Determinación Contenido
- Preparar un volumen suficiente (V) de la célula en vivo Nuclear solución de tinción de acuerdo con la siguiente fórmula: volumen de medio (l) V = 50 x W x 1,2 (W Número de pozos).
- Diluir el colorante nuclear (rojo lejano) 1: 1.000 en células vivas tinción nuclear Solution.3.4.6.3). Añadir 50 l de células vivas Nuclear solución de tinción a cada pocillo de las placas designadas "contenido de GSH". NO retire los medios de cultivo de células y se incuba durante 30 minutos a 37 ° C, 5% de CO 2.
- Preparar un volumen suficiente (V) de la célula en vivo GSH solución de tinción de acuerdo con lasiguiente fórmula: Volumen de HBSS (l) V = 50 x W x 1,2 (W Número de pozos)
- Diluir el colorante GSH en células vivas GSH solución de tinción de acuerdo con las instrucciones del proveedor.
- Se aspira suavemente el medio y la solución de tinción nuclear y lavar la placa tres veces con 100 l / pocillo medio.
- medio Aspirar y añadir 100 l / pocillo de células vivas GSH solución de tinción a cada pocillo de la placa (s).
- Incubar durante 10 min a temperatura ambiente en la oscuridad. Placa (s) es (son) listo.
- Evaluar placa (s) en el lector de HCS dentro de 1 hora.
- apoptosis Ensayo
- Preparar un volumen suficiente (V) de la solución de tinción de células vivas de acuerdo con la siguiente fórmula: volumen de medio (l) V = 50 x W x 1,2 (W Número de pozos).
- Diluir el colorante caspasa 1: 300 en solución de tinción de células vivas.
- Retire el medio de cultivo de células, añadir 50 l solución de tinción de células vivas en cada pocillo de tque la placa (s) designado "Apoptosis" y se incuba durante 30 min a 37 ° C, 5% de CO 2.
- Preparar un volumen suficiente (V) de células vivas Nuclear solución de tinción de acuerdo con la siguiente fórmula: Volumen de la solución Fix (l) V = 50 x W x 1,2 (W Número de pozos).
- Diluir el colorante nuclear 1: 1.000 en células vivas Nuclear solución de tinción.
- Eliminar la solución de tinción de células vivas, se añaden 100 l / pocillo de células vivas solución de tinción nuclear a cada pocillo de la placa (s) y se incuba durante 30 minutos a temperatura ambiente en la oscuridad.
- Aspirar la solución de colorante fijador / nuclear y lavar la placa (s) tres veces con 100 l de tampón / pocillo lavar.
- Añadir 100 l / pocillo de tampón de lavar. Placa (s) es (son) listo.
- Evaluar placa (s) en el lector de HCS.
- Preparación para todos los ensayos
- Análisis de datos HCS
- Exportar datos en bruto como archivo de Excel (.xls). Nota: Los valores del Índice de Células Raw se organizan en una forma de 96 pocillosal (reflejo de la distribución así placa) y se proporcionan para cada puntos finales a un determinado punto de tiempo después de la dosificación.
- Normalizar los valores usando la siguiente ecuación:
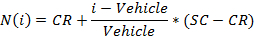
donde i es el valor de la señal medida en bruto de un pozo,
Vehículo es la mediana de los valores de señal medidos para los pozos de vehículos en un plato,
CR es el valor normalizado mediana deseada para el vehículo (0%), y
SC es el valor normalizado mediana deseado para los controles positivos (100),
NOTA: Al final de esta etapa, un conjunto de datos se obtiene que contiene, para cada posición i en la placa de 96 pocillos, una concentración c i (en unidades logarítmicas) que se aplicó a la muestra contenida en posición / i bien y su correspondiente señal normalizada N (i). - Trama y adaptarse a la (c i, N (i)) - 4 valores mediante una ecuación de Hill-parámetros.
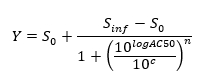
donde la actividad Zero S = 0 nivel de actividad a concentración cero del compuesto de ensayo,
Nivel infinita inf = Actividad Actividad S a una concentración infinita,
AC50 = concentración en la que la actividad alcanza el 50% del nivel máximo,
Coeficiente de Hill n = Medida de la pendiente en AC50, y
c = concentración en unidades logarítmicas correspondientes a los valores en el eje x de la trama curva de dosis-respuesta.
NOTA: AC50 es una medida de la potencia, donde los valores bajos indican alta potencia.
Resultados
RTCA
Debido a que los puntos finales de HCS no ser informativo cuando se detecta ningún efecto tóxico, aquellos compuestos que no muestran disminución de la viabilidad celular hasta la concentración más alta en el RCTA no son probados por HCS (Figura 3b, c, d, g, k, l, m , p). Los compuestos que muestran disminución de la viabilidad celular en la más alta concentración (Figura 3e, o) están también anula la selección de HCS. Por último, sólo los constituyentes con una LD computable 50 (<20 mM) se seleccionan para su posterior análisis HCS (Figura 3a, f, h, j, n). HPHC cumplen los criterios anteriores son: 1-aminonaphtalene, arsénico (V), cromo (VI), crotonaldehído y fenol.
HCS
Como comprobación de la calidad (QC), controles positivos son fiprimero analizada para asegurar que el procedimiento de tinción se lleva a cabo correctamente. Imágenes representativas de las células de control tratadas con positivos se muestran en la Figura 6. Los valores de datos se normalizan para vehículo como se describe anteriormente. No hay curvas de dosis-respuesta se representan como sólo tres dosis son probados y no todas las tres dosis se consideran en cada punto de tiempo. dosis del control positivo se seleccionan (en base a los experimentos anteriores, datos no mostrados) de manera que las respuestas apropiadas se observan para cada punto final, tanto en 4 hr y 24 hr. En dosis particulares 1 y 2 se utilizan para evaluar el efecto en 4 hr mientras que las dosis de 2 y 3 se utilizan para evaluar el efecto a las 24 horas. Las placas se descartan si no se observa respuesta para las dosis de control positivo. Tenga en cuenta que para todos los puntos finales, a excepción de potencial de membrana mitocondrial y el contenido de GSH, se espera un incremento de la intensidad de la señal.
Todos los compuestos, con excepción de fenol, inducen un fenotipo necrótico tipo, basado en aumento de la permeabilidad de la membrana celular (Figura 7a, f, h, l). 1-aminonaphtalene, el cromo (VI), crotonaldehído y fenol se identificaron como genotóxicos basado en aumento de la fosforilación de la histona H2AX (Figura 7e, j, n, p). Se encontraron fenol y 1-aminonaphtalene para inducir disfunción mitocondrial grave (Figura 7b, o) el cual, con 1-aminonaphtalene, dio lugar a un aumento de la liberación de citocromo C (Figura 7c). La detección del aumento de la actividad caspasa 3/7 proporcionó evidencia de eventos apoptóticos tras la exposición de cromo. Inducción de estrés oxidativo (ROS o GSH) también se detectó después del tratamiento con 1-aminonaphtalene, crotonaldehído y fenol (Figura 7d, m, q). Finalmente, arsénico induce estrés celular como se demuestra por el aumento de la fosforilación del factor de transcripción cJun (Figura 7 g).
carga / 53987 / 53987fig1.jpg "/>
Figura 1. Compuesto Tox-Profiler de flujo de trabajo. A) Representación esquemática del flujo de trabajo seguido en este estudio. En primer lugar, la constatación intervalo de dosis se realizó utilizando la plataforma RTCA para seleccionar las dosis apropiadas para su posterior HCS para caracterizar los perfiles específicos de toxicidad. B) Diseño experimental del estudio. 24 horas después de la siembra, se dosificaron células y los valores de impedancia monitoreados continuamente durante 24 horas la siguiente, mientras que los puntos finales de HCS se investigaron 4 y 24 horas después de la dosificación. Por favor, haga clic aquí para ver una versión más grande de esta figura.
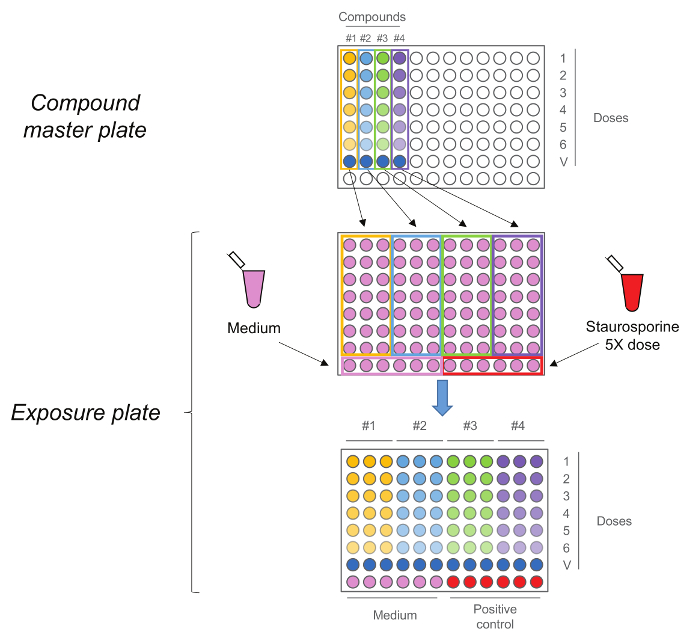
Figura 2. RTCA exposición de la plancha. Compuesto placa principal se generó por primera vez mediante la realización de una serie de dilución 1:10 de cinco pasos. Cada compuesto,incluyendo el control del vehículo (dosis 0) se añade a continuación por triplicado a la placa de la exposición, junto con medio y estaurosporina como controles. Tenga en cuenta que las dosis secuencia se mantiene después de la transferencia, las dosis más altas están en la fila número 1, mientras que los controles del vehículo están en la fila número 7. Haga clic aquí para ver una versión más grande de esta figura.
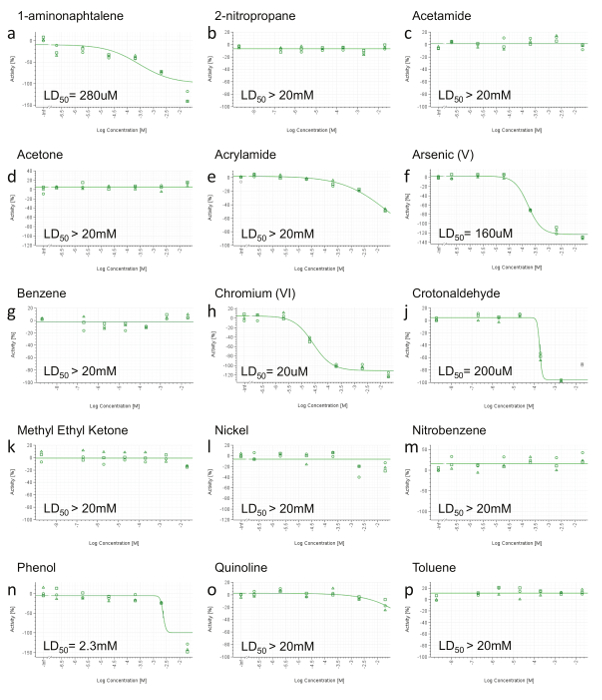
Figura 3. Representante RTCA de viabilidad de la célula Resultados. A) 1-aminonaphtalene, b) 2-nitropropano, c) acetamida, d) Acetona, e) acrilamida, f) Arsénico (V), g) benceno, h) de cromo (VI) , j) crotonaldehído, k) de metil etil cetona, l) Nickel (II), m) nitrobenceno, n) fenol, o) quinolina, p) tolueno. A las 24 h después de la dosificación, el área bajo la curva (AUC) se calculó para cada dosis (incluido el control positivo y el vehículo) y normalizado en un intervalo de 0 a la actividad -100% (eje y), donde 0 refleja la actividad de el vehículo y -100 del control positivo. Los valores se representan a continuación y ajustaron mediante una ecuación de Hill de cuatro parámetros y, cuando sea posible, se calculó la DL50. Las concentraciones se expresan en una escala logarítmica (eje x). Por favor, haga clic aquí para ver una versión más grande de esta figura.
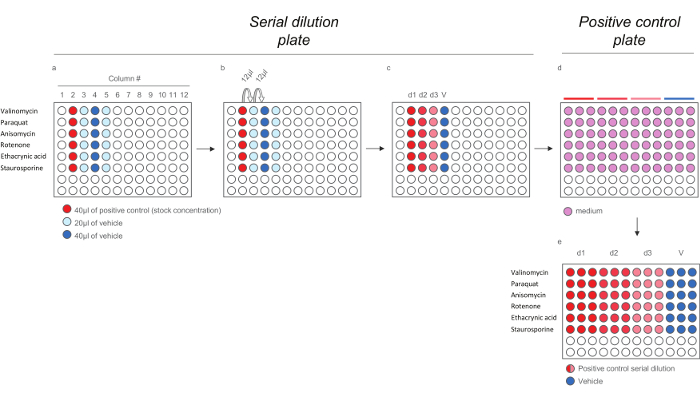
Figura 4. Esquema de dilución para los Compuestos control positivo para ensayos de HCS. A) La adición de controles positivos y cincohículo a la dilución en serie de placas. b) dilución de serie de los controles positivos. c) 200X controles positivos dosis. de) Dilución de los 200x controles positivos en dosis media (01:40) para generar la placa de control positivo que contiene las dosis de 5x. Tenga en cuenta que cada dosis se diluye por triplicado para reflejar la disposición final en la placa de la exposición). Por favor, haga clic aquí para ver una versión más grande de esta figura.
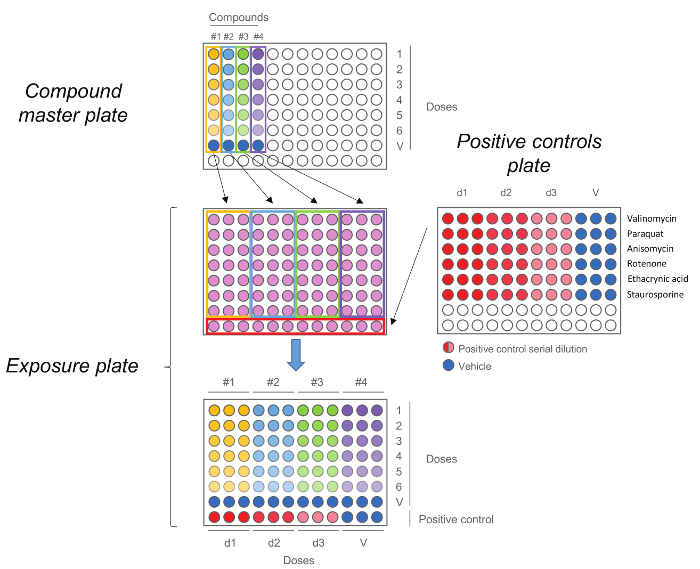
Figura 5. HCS exposición de la plancha. Compuesto placa principal se generó por primera vez mediante la realización de una dilución de cinco pasos. Se añadió cada compuesto, incluyendo el control del vehículo (dosis 0) y luego por triplicado a la placa de la exposición, junto con los controles positivos. Tenga en cuenta que el orden de las dosis se mantiene después de la transferencia,Las dosis más altas están en la fila número 1, mientras que los controles del vehículo están en la fila número 7. Haga clic aquí para ver una versión más grande de esta figura.
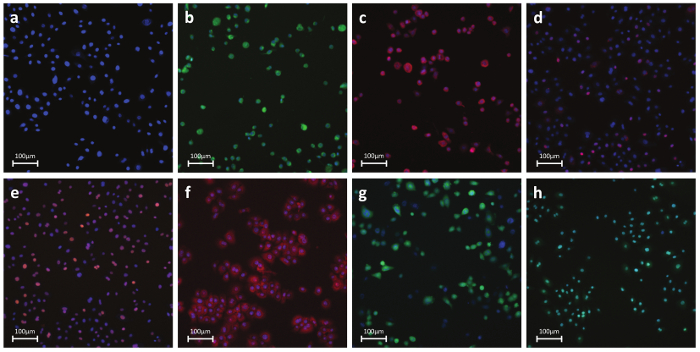
Figura 6. Representante fluorescentes Fotos de anticuerpo o tinte-células teñidas a) Parámetros nucleares - tinte nuclear: un colorante. Permeables que se une al ADN de las células vivas o fijas. Esta mancha se utiliza para identificar las células individuales de etiquetado de la región nuclear b) Necrosis - colorante permeabilidad de la membrana celular:. Detección basada en tinte de integridad de la membrana celular. Reactivo es intrínsecamente impermeable a la membrana celular. Durante necrosis, la membrana se hace permeable y el colorante penetra en la célula y se une al ADN produciendo un fuerte s fluorescente. ignal c) Apoptosis - citocromo C: la detección basada en anticuerpos de la liberación del citocromo C, una característica bien conocida de la apoptosis temprana. Tras la inducción de la apoptosis, el citocromo c se libera desde la mitocondria y se difunde en el núcleo d) Daño del ADN - pH2AX:.. Detección basada en anticuerpos de la fosforilación de la histona H2AX, una característica bien conocida de roturas de doble cadena de ADN e) quinasa de estrés - cJun:. detección basada en anticuerpos de la fosforilación en Ser-73 de cJun, un sello bien conocido de estrés celular f) estrés oxidativo - DHE: la detección basada en tinte de radicales superóxido. Sí dihydroethidium presenta fluorescencia azul en el citoplasma mientras que la forma oxidada de etidio fluorescencia roja al ADN intercalación g) GSH - CMBC:. Detección basada en tinte de moléculas libres de GSH. CMBC reacciona con GSH agenerar un producto altamente fluorescente h) La apoptosis - Caspasa 3/7 de activación:. detección basada en tinte de la caspasa 3/7 actividad. Reactivo es no fluorescente con un péptido de cuatro aminoácidos que inhibe la unión al ADN. Tras la activación de la caspasa-3/7, el péptido se escinde permitiendo que el tinte de unirse al ADN y producir una respuesta brillante, fluorogénico. BH paneles muestran las células de control tratadas positivos. Haga clic aquí para ver una versión más grande de esta figura.
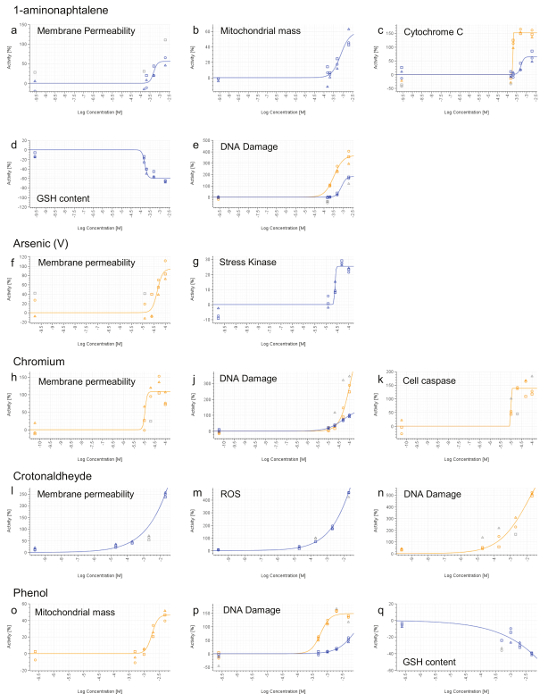
Figura 7. Representante HCS Resultados. 1-aminonaphtalene (ae), arsénico (V) (F y G), cromo (VI) (HK), crotonaldehído (ln) y fenol (OQ). 4 horas (línea azul) y24 hr (línea naranja) las señales se calcularon para cada dosis y se normalizó a la actividad del vehículo (0%). Los valores que no están incluidos en los cálculos de la curva de ajuste se muestran en gris. Las concentraciones se expresan en una escala logarítmica (eje x). Por favor, haga clic aquí para ver una versión más grande de esta figura.
| Ensayo | punto final # | punto final biológico | compartimento celular | La función de salida |
| citotoxicidad | 1 | La masa mitocondrial 6 | Citoplasma | el área promedio de entrega inmediata |
| 2 | Potencial de membrana mitocondrial 6 | Citoplasma | la intensidad promedio de entrega inmediata | |
| 3 | la liberación del citocromo C 7 | Núcleo | intensidad media | |
| 4 | Permeabilidad de la membrana celular 8 | Núcleo | intensidad media | |
| Daño en el ADN | 5 | fosfo-H2AX 9 | Núcleo | intensidad media |
| El estrés quinasa | 6 | fosfo-10 cJun | Núcleo | intensidad media |
| ROS | 7 | ROS 11 | Núcleo | intensidad media |
| el contenido de GSH | 8 | GSH 12 | Citoplasma | la intensidad promedio de entrega inmediata |
| La apoptosis | 9 | La caspasa 3 13 | Citoplasma | la intensidad promedio de entrega inmediata |
Tabla 1. Lista de HCS unassays y puntos finales.
| Vehículo | RTCA dosis (M) | LD 50 | dosis HCS | |||||||||||
| Cell viabilidad-seleccionado (M) | 3R4F (nM) | |||||||||||||
| 1-Aminonaphtalene | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | 280 M | 2.000 | 500 | 200 | 150 | 0.27 | |
| 2-nitropropano | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| acetamida | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Acetona | Agua | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| acrilamida | Agua | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Arsénico (V) | Agua | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | 160 M | 200 | 100 | 50 | 25 | 0,17 | |
| Benceno | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| El cromo (VI) | Agua | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | 20 M | 100 | 50 | 20 | 10 | 0.06 | |
| crotonaldehıdo | Agua | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | 200 micras | 20.000 | 2.000 | 200 | 20 | 2.000 | |
| Metil etil cetona | Agua | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | >20 mM | ||||||
| Níquel | Agua | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Nitrobenceno | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Fenol | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | 2.300 M | 5,000 | 2.000 | 1000 | 500 | 240 | |
| quinolina | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| tolueno | Agua | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
Tabla 2. Lista de compuestos HPHC Probado con relativa LD 50 a las 24 horas de tratamiento. Los compuestos seleccionados para el análisis HCS se resaltan en color naranja y también se dan las dosis probadas. La dosis 3R4F es equivalente a la cantidad de constituyente presente en el humo de un palo de la 3R4F cigarrillo de referencia.
| Ensayo | Compuesto | Solución de reserva | Solvente | Dosis (s) (M) | ||
| Viabilidad celular | estaurosporina | 10 mM | DMSO | 50 | ||
| citotoxicidad | valinomycin | 10 mM | DMSO | 50 | 20 | 5 |
| Daño en el ADN | El paraquat | 100 mM | DMSO | 500 | 200 | 50 |
| El estrés quinasa | anisomicina | 2 mM | DMSO | 10 | 4 | 1 |
| ROS | rotenona | 200 mM | DMSO | 1000 | 400 | 100 |
| el contenido de GSH | ácido etacrínico | 200 mM | DMSO | 1000 | 400 | 100 |
| La apoptosis | estaurosporina | 40 mM | DMSO | 200 | 50 | 20 |
Tabla 3. Lista de controles positivos y concentraciones utilizadas para cada ensayo.
Discusión
La necesidad de alternativas a la experimentación animal y para los nuevos enfoques de pruebas de alto rendimiento han sido ampliamente discutido en los últimos años. Esto ha llevado a los científicos y las autoridades reguladoras para investigar métodos alternativos para los ensayos de toxicidad estándar, utilizando ensayos celulares que imitan estrechamente la fisiología de los tejidos diana. En este estudio, hemos demostrado la aplicabilidad de la combinación de un analizador de células en tiempo real (RTCA) con una plataforma de alto contenido de cribado (HCS) para evaluar el impacto de la exposición a los componentes individuales de CS en las células epiteliales de pulmón humano. Esta configuración se puede aplicar de forma análoga para evaluar la citotoxicidad inducida por diversos otros contaminantes transportados por el aire, partículas en el aire, y nanopartículas. Por otra parte, los resultados obtenidos se pueden combinar con los de la transcriptómica de todo el genoma y los métodos de cálculo basado en redes biológicas causales. Como se informó anteriormente, este enfoque nos permitió corroborar datos sobre el mecanismo molecularperturbación tras la exposición CS 5 con puntos finales de HCS, frente a estas perturbaciones vía también fenotípicamente.
Como un ensayo de diagrama de flujo, análisis de células en tiempo real proporciona información relacionada con la viabilidad celular en una resolución de la dosis y dependiente del tiempo, lo que permite una mejor toma de decisiones que la exposición punto de tiempo de la dosis y pueden ser favorables para el análisis de aguas abajo 14. El principio del analizador se basa en cambios en la impedancia eléctrica generada por las células, ya que se unen y se extendió sobre una superficie de pocillo de cultivo cubierto con un microelectrodo de oro. La impedancia se convierte en un parámetro adimensional denominada célula-índice, que puede ser utilizado para controlar la adhesión celular, la difusión, la morfología y en última instancia, la viabilidad celular. Aunque esta técnica no proporciona información sobre los mecanismos citotóxicos, su sensibilidad permite la detección de cambios celulares morfológicos incluso a dosis muy bajas en la que el HCS no es informativo (datos no mostrados). Basado en Previsos experimentos, hemos observado que la metodología RTCA es capaz de detectar cambios morfológicos en dosis más bajas en comparación con los criterios de valoración de HCS.
Tras el cribado inicial con el analizador de células en tiempo real, se utilizó una plataforma HCS para obtener información más detallada sobre el tipo de citotoxicidad provocada por cada HPHC. El panel de ensayo de HCS permitido al perfil HPHC hacia su potencial impacto en compartimentos celulares / orgánulos, así como para identificar las encontradas para la genotoxicidad o el estrés oxidativo. El análisis reveló distintos perfiles mediante el cual los HPHC seleccionados inducen citotoxicidad en células NHBE. En general, todos los compuestos, excepto de fenol, se encontraron para inducir la necrosis en las dosis más altas ensayadas. De acuerdo con un posible papel en el desarrollo del cáncer de la fosforilación inducida por 1-aminonaphtalene de H2AX como un marcador para la genotoxicidad, sin embargo, el panel de HCS también actividad no cubierta de este HPHC en la lectura de la toxicidad mitocondrial (aumento de la masa y el citocromo C releaSE) y el estrés oxidativo (agotamiento GSH). Del mismo modo, como se describió anteriormente, el fenol se identificó para inducir la disfunción mitocondrial, y causar daño en el ADN, así como el agotamiento de GSH. El cromo (VI), uno de los compuestos clasificados como carcinógenos del grupo I, y crotonaldehído fueron también los dos, identificados como genotóxico, en particular, el cromo (VI) la apoptosis inducida también (activación cascada de caspasas) y crotonaldehído causó una mayor generación de ROS. Finalmente arsénico (V), se encontró para inducir la fosforilación de cJun, que es un marcador de la activación de la vía estrés quinasa.
En este estudio, hemos utilizado células NHBE como un modelo para las células epiteliales del pulmón in vitro. El uso de estas células en un entorno HCS no tiene precedentes y permitió a la investigación de una gama más amplia de puntos finales, incluyendo los marcadores de genotoxicidad y el estrés oxidativo. Tanto células en vivo y enfoques de tinción de células fijadas se describen dentro de nuestros protocolos, lo que demuestra la flexibilidad de la técnica en general. en facto, los mismos protocolos se puede aplicar a una gama más amplia de objetivos, que puede ser abordado por el uso de cualquier colorante fluorescente o anticuerpo. Para la ejecución con éxito de los protocolos de tinción en vivo, es importante respetar el tiempo de incubación, ya que algunos de los colorantes tienen una vida media limitada y la señal de fluorescencia puede disminuir antes de que se completó la adquisición de la imagen. También es importante tener en cuenta que si se utiliza un tipo de célula diferente, todas las condiciones de tinción deben ser re-evaluado, ya que la concentración óptima de colorante y el tiempo de incubación pueden ser diferentes.
En el presente trabajo hemos descrito un escenario en el que sólo cinco compuestos en los que seleccionaron con la metodología de HCS. Teniendo en cuenta la disposición de la placa descrita previamente, que fueron dosificados más de 2 diferentes conjuntos de placas para un total de 24 placas (6 ensayos y 2 puntos de tiempo) .El número de placas también se podría aumentar, permitiendo así la detección simultánea de más compuestos o los Invesgación de más puntos finales. Antes de hacerlo, sin embargo, se debe tener en cuenta que ciertos criterios de valoración (GSH y ROS) requieren la adquisición inmediata, y como consecuencia, la dosificación de las placas debe ser realizado de forma escalonada para permitir la adquisición de la placa anterior. Por otro lado, el uso de un protocolo de tinción celular fijo representa una ventaja ya que las placas pueden ser apiladas, interrumpiendo el protocolo en cualquier paso después de la fijación, para la realización del procedimiento de tinción en una etapa posterior. Este enfoque, por ejemplo, podría proporcionar al operador el tiempo para completar todas las placas de tinción de células vivas sin comprometer la calidad de los datos.
Para optimizar aún más el flujo de trabajo al disminuir el número de placas, que también sería posible multiplexar más puntos finales juntos. Por ejemplo en este contexto daño del ADN y el estrés quinasa podría ser investigado juntos el simple uso de dos anticuerpos secundaria con fluorocromos que emiten en diferentes channels. El desarrollo continuo de la plataforma de HCS, incluyendo la siembra totalmente automatizado de células, la dilución del compuesto, la dosificación y la tinción, así como la adición de nuevos criterios de valoración serán ampliar aún más la capacidad de la plataforma de HCS como una herramienta de perfilado de gran alcance para HPHC en epiteliales y otros tipos de células .
Divulgaciones
Todos los autores son empleados de Philip Morris International. Philip Morris International es la única fuente de financiación y patrocinador de este proyecto.
Agradecimientos
Los autores desean agradecer a Karsta Luettich y Grégory Vuillaume para su revisión del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Cellomics ArrayScan VTI HCS Reader | Thermo | N01-0002B | |
| xCelligence RTCA MP | ACEA | 05331625001 | |
| Screener (HCS) | Genedata | NA | |
| CASY counter TTC | Roche | 05 651 719 001 | |
| e-Plates VIEW 96 | ACEA | 06 472 451 001 | |
| RTCA Frame 96 | ACEA | 05232392001 | |
| RTCA Cardio Temperature Tool | ACEA | 2801171 | |
| Plate sealer breathseal | Greiner bio-one | 676051 | |
| Normal Human Bronchial Epithelial cells (NHBE) | Lonza | CC-2540 | non-smoking 60-year-old Caucasian male donor |
| BEGM BulletKit | Lonza | CC-3170 | Warm at 37 °C before use |
| ReagentPack Subculture Reagents kit | Lonza | CC-5034 | Warm at 37 °C before use |
| Penicillin/Streptomycin (100x) | Corning | 30-002-CI | |
| Easy Flask filter cap 75 cm2 | Thermo Scientific | 12-565-349 | |
| 96 well assay plate black | Corning | 3603 | |
| Hoechst 33342 | Fisher Scientific | PI-62249 | |
| Draq5 (For Far Red Nuclear Staining) | Biostatus | DR50200 | |
| Mitochondrial Dye: MitoTracker Red CMXRos | Life technologies | M-7512 | |
| Mitochondrial Dye: MitoTracker Red CM-H2XRos | Life technologies | M-7513 | |
| ROS Dye: Dihydroethidium | Sigma | D7008 | |
| ROS Dye: CellROX | Life technologies | C10422 | |
| ROS Dye: MitoSOX | Life technologies | M36008 | |
| GSH Dye: Monochlorobimane | Sigma | 69899 | Toxic |
| GSH Dye: Monobromobimane | Life technologies | M-1378 | Toxic |
| Membrane permeability Dye: YO-PRO-1 | Life technologies | Y3603 | Irritating |
| Membrane permeability Dye: TO-PRO-1 | Life technologies | T3602 | Irritating |
| Membrane permeability Dye: TOTO-1 | Life technologies | T3600 | Irritating |
| Caspase Dye: Cellevent Caspase 3/7 green | Life technologies | C10423 | Irritating |
| Anti-Cytochrome C antibody (Mouse) | Thermo | MA5-11823 | |
| Anti-phospho-c-Jun antibody (Mouse) | Thermo | MA5-15889 | |
| Anti-phospho-H2AX antibody (Mouse) | Thermo | MA1-2022 | |
| Goat anti-Mouse IgG DyLight 650 | Abcam | ab96878 | |
| 10x permeabilization buffer | Fisher | 8408400 | |
| 4% Formaldehyde solution | Sigma | F1635 | Toxic |
| 10x blocking buffer | Fisher | 8408500 | |
| Dulbecco’s Phosphate Buffered Saline | Sigma | D8537 | |
| Hanks' Balanced Salt solution | Sigma | H8264 | |
| Staurosporine | Sigma | S4400 | Toxic |
| Valinomycin | Sigma | V0627 | Toxic |
| Paraquat | Sigma | 36541 | Toxic |
| Anisomycin | Sigma | A9789 | Toxic |
| Ethacrynic acid | Sigma | E4754 | Toxic |
| 1-Aminonaphthalene | Sigma | 34390 | Toxic |
| 2-Nitropropane | Sigma | 130265 | Toxic |
| Acetamide | Sigma | 695122 | Toxic |
| Acetone | Sigma | 650501 | Toxic |
| Acrylamide | Sigma | A9099 | Toxic |
| Arsenic (V) | Sigma | A6756 | Toxic |
| Benzene | Sigma | 12540 | Toxic |
| Chromium (VI) | Sigma | 216623 | Toxic |
| Crotonaldehyde | Sigma | 262668 | Toxic |
| Methyl ethyl ketone | Sigma | 34861 | Toxic |
| Nickel | Sigma | 203866 | Toxic |
| Nitrobenzene | Sigma | 48547 | Toxic |
| Phenol | Sigma | P5566 | Toxic |
| Quinoline | Sigma | 241571 | Toxic |
| Toluene | Sigma | 34866 | Toxic |
Referencias
- Rodgman, A., Perfetti, T. A. The chemical components of tobacco and tobacco smoke. , CRC Press. Boca Raton, FL. (2013).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. , Methuen, London. (1959).
- Zock, J. M. Applications of high content screening in life science research combinatorial chemistry & high throughput screening. Comb. Chem. High. Throughput. Screen. 132 (9), 870-876 (2009).
- US Food and Drug Administration. Harmful and potentially harmful constituents in tobacco products and tobacco smoke; established list, federal register. , 20034-20037 (2012).
- Gonzalez-Suarez, I. Systems Biology Approach for Evaluating the Biological Impact of Environmental Toxicants in Vitro. Chem. Res. Toxicol. 27 (3), 367-376 (2014).
- Camilleri-Broet, S., Vanderwerff, H., Caldwell, E., Hockenbery, D. Distinct alterations in mitochondrial mass and function characterize different models of apoptosis. Exp. Cell. Res. 239 (2), 277-292 (1998).
- Li, P., et al. Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates and apoptotic protease cascade. Cell. 91 (4), 479-489 (1997).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. Double strand breaks induce histone H2AX phosphorylation on serine 139. J. Biol. Chem. 273 (10), 5858-5868 (1998).
- Westwick, J. K., Weitzel, C., Minden, A., Karin, M., Brenner, D. A. Tumor necrosis factor α stimulates AP-1 activity through prolonged activation of the c-jun kinase. J. Biol. Chem. 269 (42), 26396-26401 (1994).
- Bindokas, V. P., Jordán, J., Lee, C. C., Miller, R. J. Superoxide production in rat hippocampal neurons: selective imaging with hydroethidine. J. Neurosci. 16 (4), 1324-1336 (1996).
- Barhoumi, R., Bailey, R. H., Burghardt, R. C. Kinetic analysis of glutathione in anchored cells with monochlorobimane. J. Cytometry. 19 (3), 226-234 (1994).
- Huang, T. C., Lee, J. F., Chen, J. Y. Pardaxin an antimicrobial peptide, triggers caspase-dependent and ROS-mediated apoptosis in HT-1080 Cells. Mar. Drugs. 9 (10), 1995-2009 (2011).
- Bao, S., Knoell, D. L. Zinc modulates cytokine-induced lung epithelial cell barrier permeability. Am. J. Physiol. Lung Cell Mol. Physiol. 291 (6), L1132-L1141 (2006).
- Xia, M., et al. Compound Cytotoxicity Profiling Using Quantitative High-Throughput Screening. Environ Health Perspect. 116 (3), 284-291 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados