Method Article
Método electrofisiológico para registrar las respuestas de voltaje intracelular
En este artículo
Resumen
Sharp microelectrodes enable accurate electrophysiological characterization of photoreceptor and visual interneuron output in living Drosophila. Here we show how to use this method to record high-quality voltage responses of individual cells to controlled light stimulation. This method is ideal for studying neural information processing in insect compound eyes.
Resumen
Voltage responses of insect photoreceptors and visual interneurons can be accurately recorded with conventional sharp microelectrodes. The method described here enables the investigator to measure long-lasting (from minutes to hours) high-quality intracellular responses from single Drosophila R1-R6 photoreceptors and Large Monopolar Cells (LMCs) to light stimuli. Because the recording system has low noise, it can be used to study variability among individual cells in the fly eye, and how their outputs reflect the physical properties of the visual environment. We outline all key steps in performing this technique. The basic steps in constructing an appropriate electrophysiology set-up for recording, such as design and selection of the experimental equipment are described. We also explain how to prepare for recording by making appropriate (sharp) recording and (blunt) reference electrodes. Details are given on how to fix an intact fly in a bespoke fly-holder, prepare a small window in its eye and insert a recording electrode through this hole with minimal damage. We explain how to localize the center of a cell's receptive field, dark- or light-adapt the studied cell, and to record its voltage responses to dynamic light stimuli. Finally, we describe the criteria for stable normal recordings, show characteristic high-quality voltage responses of individual cells to different light stimuli, and briefly define how to quantify their signaling performance. Many aspects of the method are technically challenging and require practice and patience to master. But once learned and optimized for the investigator's experimental objectives, it grants outstanding in vivo neurophysiological data.
Introducción
La mosca de la fruta del ojo (Drosophila melanogaster) compuesto es un buen sistema modelo para investigar la organización funcional de los fotorreceptores y las interneuronas matrices para el muestreo y procesamiento de imagen neuronal, y para la visión de los animales. El sistema cuenta con el diagrama de cableado más completa 1,2 y es amigable para las manipulaciones genéticas y supervisión de la actividad neuronal precisa (de alta relación señal-ruido y el tiempo de resolución) 3-10.
El ojo de Drosophila es modular, que contiene ~ 750 estructuras de lentes con tapón aparentemente regulares llamados ommatidia, que en conjunto proporcionan un campo de visión de la panorámica que cubre casi todas las direcciones alrededor de su cabeza volar. Información primaria del ojo unidades de muestreo son sus fotorreceptores rhabdomeric 7,8,11. Cada ommatidium contiene ocho células fotorreceptoras (R1-R8), que comparten la misma lente faceta pero están alineados con siete direcciones diferentes. Mientras que los fotorreceptores exteriores R1-R6 are más sensible a la luz azul-verde, sensibilidades espectrales de las células internas R7 y R8, que están por encima de la otra y apuntan a la misma dirección, exhiben tres subtipos distintivos: pálido, amarillo y área del borde dorsal (DRA) 12- 15.
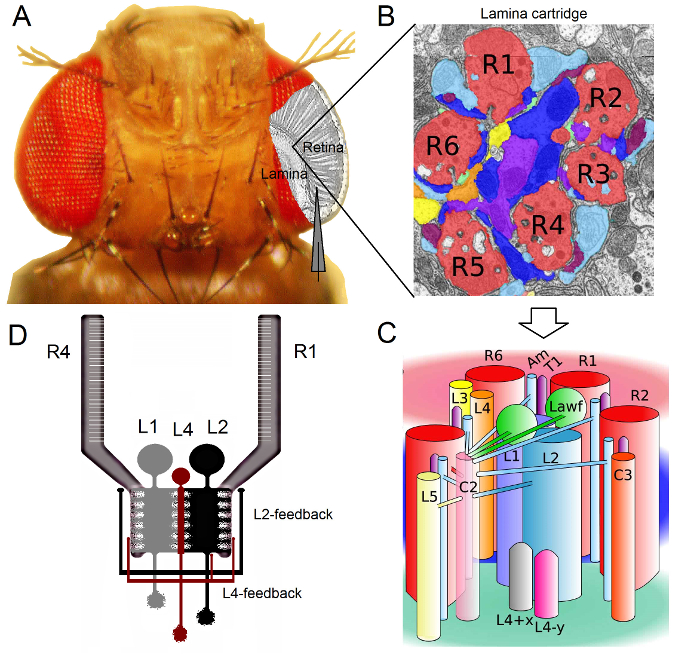
Figura 1. Organización funcional del ojo de Drosophila. (A) Los dos primeros ganglios de la óptica, la retina y la lámina, se resaltan en gris en el interior del ojo de la mosca. Fotorreceptores de la retina R1-R6 y lámina grandes células monopolares (LMC: L1-L3) son de fácil acceso en vivo a las grabaciones de microelectrodos convencionales fuerte. El electrodo esquemática destaca la ruta normal a grabar de R1-R6 en la retina. Uno de los caminos para grabar desde LMC en la lámina es cambiar de forma paralela al electrodo de la izquierda. (B) Lamina es una matriz de órgano retinotopicallyzados cartuchos, cada uno de los cuales está lleno de neuronas que procesa la información a partir de una pequeña área específica en el espacio visual. Debido a la superposición neural, seis fotorreceptores de diferentes ommatidia vecinos envían sus axones (R1-R6) a la misma cartucho de lámina, formando sinapsis de salida histaminérgicos a L1-L3 y una célula amacrine (Am). (C) La difusión de la información neural entre terminales de los axones R1-R6 y las interneuronas visuales (incluyendo L4, L5, Lawf, C2, C3 y T1), en el interior de un cartucho de lámina es complejo. (D) R1-R6 fotorreceptor axones reciben evaluaciones sinápticas de las células monopolar L2 y L4. (B) y (C) modificado de Rivera-alba et al 2. Haga clic aquí para ver una versión más grande de esta figura.
El ojo de Drosophila es del tipo neuronal superposición 16. Esto significa tsombrero de las señales neurales de ocho fotorreceptores pertenecientes a siete ommatidia vecina, que se ven en el mismo punto en el espacio, se agrupan juntos en un cartucho neural en los próximos dos neuropils: la lámina y la médula. Mientras que los seis fotorreceptores exteriores del proyecto R1-R6 sus terminales de los axones neuronales en columnas a la lámina (Figura 1), las células R7 y R8 pasar por alto esta capa y hacen contactos sinápticos con su columna de médula 17-19 correspondiente. Estos cableados exactas producen el sustrato neural para el mapeo retinotopic de la mosca de la visión temprano, después de lo cual cada lámina (Figuras 1A-C) y la columna médula (cartucho) representa un único punto en el espacio.
Las entradas directas de fotorreceptores R1-R6 son recibidas por las células monopolares grandes (LMC: L1, L2 y L3) y la célula amacrinas (AM) en la lámina 1,2,20. De estos, L1 y L2 son las células más grandes, que median en las principales vías de información (Figura 1D), WHIch responden a dentro y fuera de los bordes en movimiento, y por lo tanto constituyen la base de cálculo del detector de movimiento 21,22. Experimentos sobre el comportamiento sugiere que, en contraste intermedia, las dos vías facilitan la percepción del movimiento de direcciones opuestas: back-to-front en L1 y de adelante hacia atrás en células L2 23,24. Conectividad implica, además, que las neuronas L4 pueden jugar un papel crítico en la comunicación lateral entre los cartuchos vecinos 25,26. sinapsis recíprocas se encontraron entre las células L2 y L4, situados en la misma y dos cartuchos adyacentes. Aguas abajo, cada célula L2 y sus tres células L4 asociados proyectan sus axones a un objetivo común, la neurona Tm2 en la médula, donde se cree que las aportaciones de los cartuchos de vecinos para ser integrado para el procesamiento de movimiento de delante a atrás 27. Aunque las neuronas L1 reciben el aporte de personas del mismo cartucho de L2 a través de las dos uniones comunicantes y las sinapsis, que no están conectados directamente a los cartuchos de lámina L4s y por lo tanto adyacentes.
evaluaciones Synaptic para fotorreceptor axones R1-R6 son proporcionados únicamente por las neuronas pertenecientes a los circuitos / L4 L2 pero no la vía de 1,2 L1 (Figura 1D). Mientras que las conexiones del mismo cartucho son selectivamente de L2 a R1 y R2 y de L4 a R5, todos los fotorreceptores R1-R6 reciben retroalimentación sináptica de L4 de uno o ambos cartuchos de vecinos. Además, existen fuertes conexiones sinápticas de AM a R1, R2, R4 y R5, y células gliales también están conectados sinápticamente a la red y por lo tanto pueden participar en el procesamiento de imágenes neural 6. Por último, axonal gap-uniones, que une la vecina R1-R6 y R6 y R7 entre / R8 fotorreceptores en la lámina, contribuyen a la representación de la información asimétrica y el procesamiento de cada cartucho 14,20,28.Grabaciones de tensión intracelulares de fotorreceptores individuales y las interneuronas visuales en casi intacto Drosophila proporcionan una alta r-señal-ruidoación de datos con una resolución sub-milisegundo 3,5,7-10,29, que es necesaria para dar sentido a los cálculos neuronales rápidas entre las neuronas conectadas. Este nivel de precisión no es posible mediante técnicas de imagen ópticos actuales, que son significativamente más ruidoso y por lo general operan a las 10 - una resolución de 100 ms. Por otra parte, debido a que los electrodos tienen puntas muy pequeñas y afiladas, el método no está restringido a los cuerpos de las células, pero puede proporcionar grabaciones directas de las estructuras nerviosas activas pequeñas; tales como árboles dendríticas los LMC 'o axones fotorreceptoras, las cuales no se puede acceder por consejos mucho más grandes de los electrodos de patch-clamp. Es importante destacar que el método también es estructuralmente menos invasivo y perjudicial que la mayoría de las aplicaciones de patch-clamp, y así afecta a menos de muestreo medio y la información intracelular de las células estudiadas. Por lo tanto, las técnicas de microelectrodos afilados convencionales han contribuido, y siguen contribuyendo, descubrimientos fundamentales y la visión original en Infor neuronalprocesamiento de la escala en el momento adecuado; mejorar nuestra comprensión mecanicista de la visión 3-10.
En este artículo se explica cómo en registros intracelulares in vivo de Drosophila fotorreceptores y LMC R1-R6 se llevan a cabo en el laboratorio Juusola. Este protocolo describe cómo construir una plataforma de electrofisiología adecuado, preparar la marcha, y realizar las grabaciones. Se presenta algunos datos representativos, y algunos problemas comunes y las posibles soluciones se discuten que se pueden encontrar cuando se utiliza este método.
Protocolo
El siguiente protocolo cumple con todas las pautas de cuidado de animales de la Universidad de Sheffield y la Universidad Normal de Beijing.
1. Reactivos y la Preparación de
- Grabación y configuración de la luz Equipo de Estimulación
- Elija por lo menos un área de grabación de 2,5 x 2,5 m para la realización de experimentos electrofisiológicos en una habitación que tiene aire acondicionado con humedad regulado y medios para proporcionar condiciones de grabación oscuros. Asegúrese de que esta zona es lo suficientemente grande como para caber cómodamente a: (i) 1 x 1 m mesa de vibración-aislamiento que alberga el equipo de perforación [vuela estimulación y aparatos de grabación], microscopio estereoscópico y una fuente de luz fría con dos cuellos de ganso, todos encerrados dentro de una grandes> 180 cm de altura jaula de Faraday; (Ii) un bastidor de equipo de 38U para alojar un ordenador personal con un monitor de pantalla plana LCD, amplificador de microelectrodos, los conductores del LED, filtros, unidades de control de temperatura, osciloscopios y otros instrumentos eléctricos necesarios; y (iii) unapequeño escritorio y una silla para el investigador.
- Coloque la plataforma lejos de fuentes de ruido eléctrico y mecánico, tales como refrigeradores, centrífugas y elevadores. Use protectores de sobretensión separadas para proteger los dispositivos eléctricos del equipo de perforación de los picos de tensión que se producen en la red eléctrica. Lo ideal es conectar la plataforma a su propia fuente de alimentación ininterrumpida (UPS batería) para minimizar el ruido.
- Construir una mosca titular cónica de latón y plástico negro (Figura 2). Perforar un agujero pequeño estrechamiento a través de la unidad de latón con su estrechamiento del borde externo a ~ 0,8 mm de diámetro (que se corresponda ancho tórax de una mosca típica).
Nota: Este agujero debe disminuir gradualmente hacia la punta de la mosca-soporte de manera que una más grande que la media de Drosophila, que se proyecta desde abajo por el flujo de aire, que se atascan a profundidad del hombro en el borde superior. - Diseño y construcción de un aparato de registro de estimulación y mecánicamente robusta, pero preciso, volar (Figura 3). Construir a cabo of aluminio o latón (metales de alta conductividad) una plataforma poste preparación mosca y alrededor de él un sistema Cardan-brazo, con rodamientos de bolas incrustadas, para proporcionar x suaves y precisos, y-posicionamiento y el bloqueo del estímulo luminoso.
Nota: Este diseño compuesto integrado minimiza las vibraciones mecánicas, que de otro modo podrían desprender la punta del electrodo de registro hacia fuera de la célula estudiada. Se puede incorporar además un sistema de control de temperatura de bucle cerrado basado en elemento Peltier, que permite a los investigadores a utilizar construcciones genéticas sensibles a la temperatura, tales como shibire TS, para la evaluación de los cálculos de circuitos sinápticos 9,30. Anodizar el aparato o pintarlo de negro para minimizar la dispersión de estímulo luminoso.- Fijar la estimulación de la mosca y aparatos de grabación en placa de la mesa antivibraciones; por ejemplo, por M6-pernos, el uso de sus orificios de los tornillos métricos. Use un tablero negro o cubrirlo con tela de color negro para minimizar la dispersión de la luz durante los experimentos.
- Position y bloqueo (utilizando un tornillo de bloqueo) una plataforma poste preparación mosca ajustable verticalmente en el centro de un sistema Cardan-brazo. Coloque la mosca-preparación (dentro de la mosca titular, consulte el paso 2) en la plataforma poste de modo que la fuente de luz unido a la Cardan-brazo apunta radialmente hacia la cabeza de la marcha. Asegúrese de que el centro de los ojos de la mosca está exactamente en el punto de intersección (0, 0) de x- la de Cardan-brazo y ejes Y, ya que esto permite x precisos, y-posicionamiento del estímulo luminoso a cualquier punto dentro de la mosca de campo visual.
Nota: Esta funcionalidad es necesaria para el mapeo de las propiedades de respuesta de las células individuales a posiciones específicas de los ojos; por ejemplo, en la búsqueda de pruebas electrofisiológicas para las adaptaciones estructurales, tales como zonas brillantes o agudas, que mostrarían una mayor sensibilidad o resolución, respectivamente 31.
- Montar el microscopio estereoscópico mosca detrás de la estimulación y aparatos de grabación en la mesa anti-vibración paraque proporciona una visualización de alta magnificación cómoda del ojo de la mosca.
- Montar la fuente de luz fría en la parte superior del microscopio con doble cabezal semi-rígidos guías de luz de cuello de cisne de la fuente de luz apuntando hacia abajo hacia el soporte preparación mosca. Puede mover libremente dos iluminación del haz hace que sea más fácil visualizar la punta del electrodo de registro cuando se conduce a través de una pequeña abertura en el ojo de la mosca.
- Adjuntar un x, y, conjunto z-micromanipulador apropiado (grueso y fino) para el electrodo de registro y la cabeza-etapa en la mesa de anti-vibración, en el lado derecho del aparato de estimulación de la mosca y la grabación, usando M6-pernos o magnético se levanta.
Nota: En el laboratorio Juusola, diferentes plataformas están equipadas con diferentes manipuladores; para más detalles ver la Tabla de Materiales y Reactivos. Todo esto proporciona registros intracelulares de alta calidad. - Montar un pequeño manual micromanipulador de 3 ejes para el soporte del electrodo de referencia en la f regulable en alturaplataforma poste preparación ly. Oriente el electrodo de referencia de manera que apunte hacia la preparación mosca.
- Construir una jaula de Faraday independiente luz blindado de acero-paneles alrededor de la mesa antivibraciones, que rodea al aparato de estimulación mosca y grabación, para evitar las perturbaciones electromagnéticas externas. Deje la parte delantera de la jaula abierta, proporcionando acceso para el transporte de la preparación de la mosca para los experimentos. Coloque cortinas negras de tela (que tienen cobre o de aluminio de malla implantados dentro de ellos para la puesta a tierra) en la parte frontal para proteger el ruido y la luz. Pintar el interior de la jaula de negro para minimizar la dispersión de la luz y el perno los pies de la jaula en el suelo para evitar vibraciones.
- Conectar el voltaje y corrientes de salida del amplificador de alta impedancia microelectrodo intracelular a las entradas de dos filtros de paso bajo de Bessel separados (o similar) utilizando cables BNC. Del mismo modo, conecte las salidas de los filtros en los canales apropiados de los blo-conector DCCKS / tablas del sistema de adquisición de datos (tarjetas DA / AD). Conectar la tarjeta DA / AD (s) en un ordenador personal a través de cables especializados, de acuerdo con los manuales de los proveedores.
- Instalar el software de adquisición adecuado para el sistema de adquisición de datos de elección en el ordenador personal. Asegúrese de que los conductores de adquisición de datos son compatibles con el sistema operativo en el ordenador personal.
- Planta eléctricamente la estimulación de la mosca y aparatos de grabación, jaula de Faraday, malla de cobre (dentro de las cortinas), microscopio, micromanipulador, fuente de luz fría, estante 38U equipo con todos sus instrumentos (el amplificador intracelular, filtros, unidad de control de la temperatura, la PC y el monitor LCD etc.) en un único punto central de tierra mediante el uso de alambre de tierra del equipo y M6 engarzado extremos del anillo de puesta a tierra. Utilice un multímetro eléctrico para probar que todas las partes están en la misma planta.
Nota: Para lograr las mejores condiciones de grabación de bajo ruido posible, las configuraciones de puesta a tierra suelen variar lado a otrom una puesta a punto a otro.- Si es necesario, conecte el punto común de tierra aún más a la tierra del edificio, y / o central de tierra del amplificador de microelectrodos. Después de probar el sistema en pleno funcionamiento durante los experimentos electrofisiológicos reales, estar preparado para cambiar la configuración de conexión a tierra, según sea necesario para minimizar el ruido en las grabaciones.
- Configurar el software de la amplificación (1 - 10 veces), el filtrado de la señal (generalmente filtros de paso bajo regulado a 500 Hz, lo que es adecuado tanto para los datos de R1-R6 y LMC), y la frecuencia de muestreo (por lo menos 1 KHz). Asegúrese de que los ajustes obedecen Nyquist-Shannon teorema de muestreo de 32; por ejemplo, cuando la adquisición de datos que es baja se pasa filtrada a 500 Hz, utilizar una frecuencia de muestreo de 1 kHz o superior para minimizar los efectos de aliasing.
- A medida que las respuestas de tensión característicos de fotorreceptores R1-R6 son 40 - 65 mV, y las de los países de ideas afines 20 - 45 mV, establece la amplificación y la visualización de las escalas en consecuencia para permitir a alta resolución sampling y visualización de datos.

Figura 2. cónico Fly-titular de la mosca titular está hecho de dos piezas:. La unidad de latón cónica central y su capa de plástico negro. El agujero central dentro de la unidad de latón se estrecha hasta un diámetro pequeño que apenas permite la marcha a través. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Descripción general del Rig electrofisiológico. La puesta a punto contiene una jaula independiente luz blindado de Faraday, la mesa antivibraciones, el aparato de estimulación y registro de la mosca, y cortinas de tela negro con cobre o aluminio-malla en el interior de toma de tierra. los complementostrumento bastidor está conectado eléctricamente a la misma planta central con todo el equipo dentro de la jaula de Faraday. Por favor, haga clic aquí para ver una versión más grande de esta figura.
- La fabricación de microelectrodos
- Tire del microelectrodo de referencia a partir de borosilicato filamented (diámetro exterior: 1,0 mm; diámetro interior 0,6 mm) o de cristal de cuarzo (diámetro exterior: 1,0 mm; diámetro interior de 0,5, 0,6 o 0,7 mm) tubería usando un instrumento extractor de pipeta. Tratar de lograr una reducción gradual corto.
Nota: Los ajustes exactos del programa de pipeta extractor varían de un instrumento a otro; más detalles en la Tabla de Materiales y regentes. El tamaño de poro en la punta no es crucial, ya que la punta del electrodo de referencia se romperá antes de ser insertado en la preparación de la mosca. - Tire del microelectrodo grabación de borosilicato filamented (diámetro externo: 1,0 mm; diámetro interior 0,6 mm) o de vidrio de cuarzo (diámetro exterior: 1,0 mm; diámetro interior 0,5, 0,6 o 0,7 mm) tubería usando un instrumento de pipeta extractor. Trate de conseguir una larga (10 - 15 mm) cónica fina gradual.
- Inspeccionar con un microscopio de luz que los electrodos de registro muestran estrechamiento correcta. Montar el electrodo sobre un portaobjetos de vidrio con adhesivo moldeable y utilizar objetivo 40X de aire para inspeccionar su punta.
Nota: Una buena electrodo se estrecha suavemente hasta su forma invisible punta pequeña, alrededor de los cuales más oscuro paralelo continuo y patrones de interferencia más ligeros pueden ser vistos. Algunas configuraciones del extractor generan electrodos de alta resistencia, que no pueden producir penetraciones celulares exitosos debido a que sus extremidades se asemejan a "trompetas". Por lo tanto, la inspección visual de los electrodos es importante. - Coloque los electrodos en posición horizontal sobre una gran placa de Petri con plastilina (o adhesivo moldeable similar) para su custodia y el transporte a la plataforma de electrofisiología. Asegúrese de que la puntas de los electrodos de unavolver siempre en el aire y no tocar accidentalmente nada.
- Copias de llenar los electrodos de registro y de referencia justo antes del experimento con la solución de sal apropiada. Use una pequeña jeringa de 5 ml conectada a un filtro de partículas pequeño con una punta de plástico fina (como un microloader).
- Para fotorreceptores experimentos, llenar el electrodo de registro hasta completa (se forma una gotita en su extremo grande) con 3 M KCl ya que esta solución reduce al mínimo el efecto del potencial de unión líquida a la tensión de grabado.
- Para la investigación de los países de ideas afines histaminérgicos, que responden a la entrada sináptica de fotorreceptores R1-R6 por los cambios de cloruro-conductancia, llenar los electrodos de registro con 3 M acetato de potasio y KCl 0,5 mM, ya que esta solución tiene menos efecto sobre la batería de cloruro de la célula. Llenar el electrodo de referencia con mosca Ringer, que contiene en mM: NaCl 120, KCl 5, 10 TES (C 6 H 15 NO 6 S), 1,5 CaCl2, MgCl2 4, y 30 de la sacarosa
5.
Prueba de la resistencia de un electrodo de registro recién tirado en el sistema de grabación.- Asegúrese de que los cables de plata dentro del electrodo titulares están uniformemente recubiertas con cloruro de plata (que aparece de color púrpura-gris - no plateada brillante) para minimizar los artefactos de grabación (como la deriva en el potencial de unión). Si no es así, reemplazarlos con cables debidamente clorurada.
- Si es necesario, chloridize nuevos hilos de plata. Limpiar cuidadosamente los cables (haciendo pasar rápidamente a través de una llama) para que éstos aparecen plata brillante en color. Evitar tocar con los dedos, con el fin de depositar en una capa uniforme de AgCl. Remojar los cables en lejía total de hogares fuerza durante 15 - 30 minutos hasta que aparecen de color púrpura-gris. Alternativamente, electroplate cada cable (por lo que es positivo con respecto a una solución que contiene 3 M KCl y pasar una corriente a través de él a una velocidad de 1 mA / cm 2 de área de superficie) para 10 a 15 seg hasta recubierto adecuadamente.
- Conectar la grabación de nuevo lleno de electrodos de referencia y de sus electrodos titulares. Coloque baño de solución de Ringer un pequeño sobre la plataforma poste preparación mosca regulable en altura. Conducir las puntas de los electrodos en la solución de Ringer y medir la resistencia de la punta del electrodo de registro.
Nota: Este paso sólo es necesario cuando se prueban las propiedades de resistencia de los electrodos, que se extraen de un nuevo lote de tubos de vidrio, o cuando la optimización de los programas de instrumentos de microelectrodos extractor a través de iteración. - Antes de realizar las mediciones de resistencia, lea las instrucciones en el manual del usuario del fabricante del amplificador para la configuración de medición adecuados. Para un buen electrodo de registro, tener una resistencia punta de ~ 100 - 220 mO.
- Tire del microelectrodo de referencia a partir de borosilicato filamented (diámetro exterior: 1,0 mm; diámetro interior 0,6 mm) o de cristal de cuarzo (diámetro exterior: 1,0 mm; diámetro interior de 0,5, 0,6 o 0,7 mm) tubería usando un instrumento extractor de pipeta. Tratar de lograr una reducción gradual corto.
2. Preparación de Drosophila
Recoger 5 - 10 días de edad moscas (después de la eclosión) y colocarlos en un tubo limpio mosca que contiene standard alimentos. Es posible conseguir buenas grabaciones de más joven vuela demasiado, incluso de los "recién nacidos"; pero debido a sus ojos más suaves, el corte de una abertura de la córnea para el electrodo de registro es más difícil.Construir un tubo de captura de mosca y una preparación mosca de pie (Figura 4). Ver Figura 4 para la idea general de cómo estas herramientas hechos a sí mismos fueron puestos juntos.- Para hacer un tubo de captura de mosca, cortar la punta de fondo cónico de 50 ml tubo de centrífuga de plástico. A continuación, insertar y pegar el extremo grande de la punta de la pipeta 1 ml de esta nueva apertura.
- Por último, cortar el extremo pequeño de la pipeta a un tamaño que permite fácilmente una mosca para caminar a través. Consulte a un taller mecánico para montar una pequeña etapa de preparación de la mosca que permite la rotación de 2 ejes y el bloqueo de la marcha-titular a diferentes posiciones.

figure 4. Herramientas e idea necesaria para hacer la preparación de la mosca. Fly tubo de captura se hace pegando una punta de pipeta de plástico de 1 ml a un tubo de plástico de centrífuga de 50 ml. A medida soporte preparación mosca permite de libre rotación y bloqueo de la mosca titular en una posición preferida para preparar la marcha. La mosca es fijado por la cera de abejas, cera de eléctrica mediante el calentador. La vaselina es aplicada por un pequeño aplicador realizado mediante la conexión de un cabello tipo de espesor sobre un mango. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Se recoge una mosca para el experimento en una punta de pipeta de 1 ml, que apenas permite un elevado al pasar a través. Una el tubo de cazar moscas, con la punta de la pipeta en él, al tubo de mosca. En la captura de una mosca, aprovechar su tendencia inherente a subir hacia arriba (antigravitaxis) en la punta de la pipeta. Preferiblemente, seleccione el máximo femenina, ya que el tamaño importas en electrofisiología.
Nota: Cuanto más grande sea la marcha, cuanto más grande es sus células y mejores serán las posibilidades de registros intracelulares de alta calidad. moscas pequeñas (tanto hembras como machos) también pueden proporcionar excelentes grabaciones, pero la preparación es más difícil de hacer. Una vez que la mosca está atrapada en una punta de pipeta grande, no olvide cerrar el tubo de mosca para detener otras moscas escapen.Conectar una jeringa de 100 ml con un tubo de plástico flexible para la abertura más grande de la punta de la pipeta - con la mosca todavía en ella.Coloque el extremo más estrecho en la punta de la pipeta grande, que se amplía sólo para que un Drosophila través, a la abertura en la parte inferior de la marcha-soporte y apretar un pequeño volumen de aire de la jeringa para expulsar la mosca en la marcha titular .- Mira a través de la lupa binocular y administrar con cuidado más aire que la cabeza de la marcha sobresale desde el extremo cónico de la mosca titular. Asegúrese de que la mosca está firmemente atrapado desde el tórax hasta la pequeña opeNing en la parte superior de la mosca titular.
Utilizar un calentador de cera para fijar la marcha con la cera de abejas de sus "hombros" a la marcha-soporte. Ajustar la temperatura del calentador de cera para ser tan bajo como sea posible todavía limpiamente la fusión de la cera.
Nota: Cuando la temperatura es correcta, la cera aparece transparente. Demasiado alto de una temperatura que hace que la cera "quemar"; demasiado baja mantiene la rigidez de cera. Al fijar la marcha, ser precisa y breve ya que la exposición prolongada al calor puede dañarlo. El uso de pegamento dental de fotocurado no se recomienda aquí que su aplicación es demasiado lento.

Figura 5. Preparación de la mosca para experimentos in vivo. Izquierdo, la cabeza A 's Drosophila se encuentre en posición vertical en la mosca de titular y se fija a partir de su trompa, ojo derecho y los hombros a la mosca-soporte con calentarseeswax. Derecha, una pequeña abertura se corta en la parte más gruesa del ojo, justo por encima del ecuador y sólo unos pocos ommatidia lejos de la cutícula hacia atrás, usando un filo de la navaja afilada. Un trozo de córnea se retira con suavidad y el agujero se sella con vaselina para evitar que el ojo se seque. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Inmovilizar la cabeza de la marcha. Aplicar la cera de abejas a la trompa (Figura 5) y la esquina del ojo derecho, evitando la córnea, y fijar la cabeza de estos puntos a la marcha-soporte.Producir un micro-cuchillo. Sujetar una hoja de afeitar no de acero inoxidable con dos soportes de lamas / interruptores (ambos con agarre plana) y el crack una pequeña franja de su borde afilado. Para la salud y la seguridad, el uso de gafas de protección para los ojos (a pesar de que es muy poco probable que las piezas podrían rebotar cuando se quebró la maquinilla de afeitar). Idealmente,producir un borde de gran nitidez que se asemeja a una aguja. Asegúrese de que este "aguja" está firmemente unido al soporte de lama, pero tenga cuidado de evitar cualquier autolesión!Utilizando el micro-cuchillo, preparar un pequeño tamaño de la abertura de unos pocos ommatidia en el ojo izquierdo de la marcha - en alrededor de 4 - 5 ommatidia de la cutícula dorsal justo por encima del ecuador del ojo para dar el paso para el microelectrodo de grabación. Llevar a cabo bajo un microscopio estereoscópico, visualización de la preparación con una gran ampliación.
Nota: Debido a que el ojo de la mosca siente elástico y resistente a la palpación, el agujero es mejor corte con un -knife "aguja". La técnica de corte es bastante difícil, así que presta mucha atención a la demostración de vídeo. Mantener la marcha titular en ciertas orientaciones (en el stand preparación mosca) puede hacer más fácil la disección. Inicialmente, la microcirugía puede sentir difícil de aprender, pero una vez cometido, la adaptación neuronal mejora gradualmente 3D-percepción y la destreza del investigador.Retire con cuidado el pequeño trozo de córnea de la abertura que se acaba de cortar, dejando al descubierto la retina debajo. Rápidamente cubrir el agujero en el ojo con una pequeña gota de vaselina usando el pelo fino del aplicador vaselina.
Nota: La jalea de petróleo sirve para múltiples funciones aquí. Previene la deshidratación del tejido y la coagulación de la hemolinfa que rompería el electrodo de registro insertado. Recubre también por cierto, la microelectrodos, reduciendo su capacitancia intramural. Esto puede mejorar la respuesta de frecuencia del sistema de grabación, y por lo que la resolución temporal de las señales neuronales registradas. Evitar que se corra la vaselina por encima del resto del ojo, ya que difumina la óptica.
3. Grabación de R1-R6 fotorreceptores o LMC
Siempre estar conectado a tierra cuando se opera el amplificador de microelectrodos (por ejemplo, al tocar la superficie metálica de la jaula de Faraday o mesa antivibraciones), ya que esto impide que uno entregue de forma accidentaling una carga estática a la cabeza etapas, lo que podría dañar los circuitos.Iluminar la plataforma poste preparación mosca desde arriba por dos guías de luz de cuello de ganso (Figura 6 A) (con la fuente de luz fría dentro de la jaula de Faraday), de modo que la mosca-soporte puede ser colocado en el poste en la posición preferida bajo control visual de cerca .
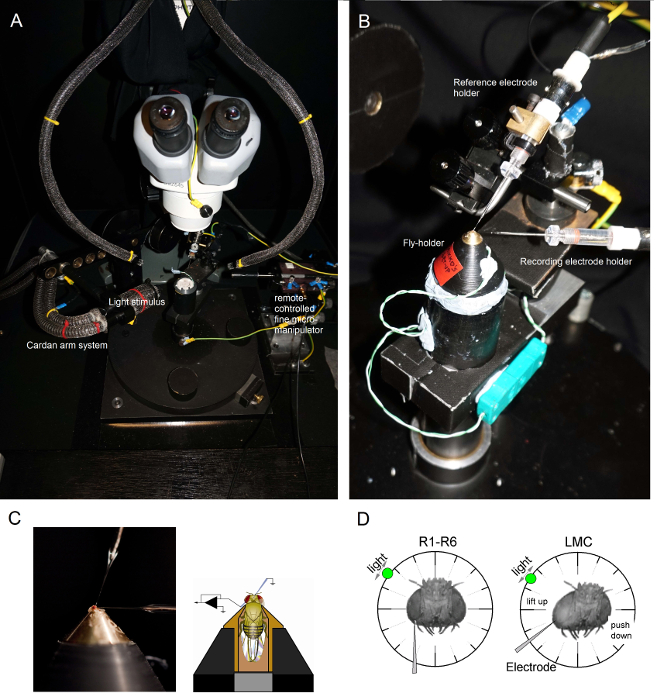
Figura 6. Colocación de la mosca de su titular y los Electrodos para los experimentos (AB) La mosca titular se coloca en la plataforma de grabación que también proporciona control de la temperatura a través de un elemento Peltier (A: plataforma redonda blanca en el centro).. El Cardan-brazo permite un posicionamiento exacto del estímulo de luz a la misma distancia (a través de x, y-rotación) alrededor de la marcha, con la fuente de luz (un extremo haz de fibra óptica líquido o cuarzo) apuntando directamente a su ojo. En muchos de our plataformas, estimulación de la luz es generada por los LED (con los actuales conductores lineales) o por un monocromador. Por lo tanto, sus estímulos llevan un determinado contenido espectral (banda de paso obligatorio), seleccionado entre 300 - 740 nm y cubren 4 - 6 log rango unidad de intensidad (como atenuada por los filtros de densidad neutra separadas). (C) Dos microelectrodos, controlada por micromanipulador separados, están situados en la cabeza de la mosca: el electrodo de referencia (arriba) a través de la ocelos; el electrodo de registro (a la izquierda) a través de la pequeña abertura en el ojo izquierdo. (D) Para la obtención de un número máximo de grabaciones fotorreceptoras, el microelectrodo de grabación es impulsado en el agujero, paralelo al eje proboscis-ocelo. Cuando penetra la punta del electrodo y los sellos a un fotorreceptor, la fuente de luz puede girar libremente está fijado a la posición en la que la célula produce la respuesta máxima tensión a un estímulo de luz dada. Este punto en el espacio se encuentra en el centro de campo receptivo de la célula. Si el agujero is cerca de la cutícula, las penetraciones de LMC pueden además ser alcanzados con este mismo ángulo electrodo (izquierda). Si el agujero está más lejos de la cutícula, otro ángulo de aproximación de electrodo útil para obtener grabaciones de LMC también se muestra (a la derecha). Por favor, haga clic aquí para ver una versión más grande de esta figura.
Montar la mosca titular (con la mosca en ella!) En la plataforma poste preparación mosca. Gire el fly-soporte de manera que el ojo izquierdo de la marcha está directamente frente al investigador (Figura 6B).Insertar el electrodo de referencia contundente suavemente a través Occelli de la mosca en la cápsula de la cabeza utilizando una pequeña micromanipulador gruesa mientras se observa la preparación a través del microscopio estereoscópico (Figura 6C). No empuje el electrodo demasiado profundo, ya que esto puede dañar el cerebro de la mosca.- Alternativamente, insertar el electrodo de referencia en la parte posterior del tórax. Siempre, asegúrese de que la mosca aparece cubierto de brezos (mueve sus antenas) y sus ojos están intactos; no dañado accidentalmente. Si la preparación se ve menos de inmaculada, preparar una nueva mosca para los experimentos.
Conducir el microelectrodo grabación afilado en el ojo izquierdo a través de la vaselina cubiertos pequeña abertura preparado con anterioridad. Utilice una gran ampliación en el microscopio estereoscópico y mueva las guías de luz y el plano focal de modo que la localización de la punta del electrodo se hace evidente en 3D por sus patrones de reflectancia.
Nota: La Figura 6D muestra cómo la cabeza de la marcha se debe colocar de forma ligeramente diferente (con respecto al ángulo de la microelectrodo grabación entra en el ojo) de los fotorreceptores y grabaciones de LMC. Conducir el electrodo en el ojo sin romper que es la fase más difícil del experimento. Si la punta del electrodo no alcanza la pequeña abertura en el ojo, golpeando la córnea, por lo general se rompe.Encienda el amplificador de microelectrodosUna vez que ambos electrodos están firmemente dentro de la preparación, en contacto eléctrico con los fluidos corporales de la mosca.Apague la fuente de luz fría (dentro de la jaula de Faraday) y desconecte de la red eléctrica. Conectar el enchufe a tierra central para minimizar planta de ciclo inducido ruido eléctrico, y mover las guías de luz de cuello de ganso de distancia para que el sistema Cardan-brazo se puede mover libremente alrededor de la marcha. Apagar las luces de la habitación para asegurarse de que la preparación de la mosca se encuentra ahora en una oscuridad relativa.Mida la resistencia del electrodo de registro en el ojo (como se indica en el manual de usuario del amplificador). Utilizar electrodos única grabación en la que la resistencia son 100 - 250 mO.
Nota: Es prácticamente imposible de conseguir registros intracelulares de alta calidad por <70 mO electrodo. Si la resistencia es <80 mO, es probable que la punta del electrodo se rompe. En este caso, apague el amplificador y cambiar el electrodo de registro.- Una vez que el electrodoy se sustituye en el ojo, encender el amplificador para medir su resistencia. A veces, la punta del electrodo puede ser bloqueada por algunos detritus medida que entra en el tejido. Esto puede remediarse mediante el uso de funciones de moda capacitiva y pulso de corriente del amplificador que normalmente clara por resonancia rápida o repulsión.
Ajuste el amplificador de corriente de pinza (CC) o el modo de grabación de puente. Descartar cualquier tipo de diferencia de tensión arbitraria entre los electrodos de registro y de referencia, ya que ambos ahora descansan en el espacio extracelular interconectados eléctricamente, estableciendo el desplazamiento de señal (tensión de grabación) a cero. Siga las señales compensar los cambios usando lectura de la pantalla del amplificador o una pantalla de osciloscopio.Espere 2-3 minutos para el ojo de la mosca a oscuro-adaptación.Conducir la punta del electrodo de registro gradualmente más profundo en el ojo con pequeños pasos micrones 0,1 a 1. Hacer esto con un eje x piezo-paso a paso de un micromanipulador o B a control remotoy girar suavemente el botón de resolución fina de un manipulador manual.Estimular el ojo de la mosca con la breve (1 - 10 ms) destellos de luz como el electrodo de registro se está promoviendo en el tejido.
Nota: Si el electrodo de registro se coloca en la retina y el ojo funciona normalmente, cada destello de luz hará que una breve y pequeña caída en el voltaje (0,2 a 5 mV hiperpolarización), llamado el electrorretinograma (ERG). Este cambio en el potencial del campo del espacio extracelular es causada por la respuesta colectiva de las células de la retina 'a la luz. Sin embargo, una vez que la punta del electrodo entra en la lámina, cerrando en los países de ideas afines, el ERG se invierte, que muestra las respuestas de despolarización.Mover la fuente de luz alrededor del ojo de la mosca utilizando el sistema Cardan-brazo y encontrar la posición en la que la luz evoca la mayor respuesta del ERG.
Nota: Esta posición marca el área pequeña en el espacio visual donde los fotorreceptores (o LMC), que se encuentran al lado de la punta del electrodo de registro, Probar su entrada de luz.Penetrar en una célula con el electrodo de registro.
Nota: La penetración puede ocurrir espontáneamente, o cuando el electrodo es micro dio un paso hacia adelante. Puede facilitarse aún más golpeando suavemente el sistema micromanipulador o utilizando el zumbido funciones del amplificador; estas acciones resuenan la punta del electrodo en el tejido. Cuando el electrodo empala la membrana de los fotorreceptores, entra en su espacio intracelular, la diferencia de tensión entre la grabación y electrodo de referencia cae de repente de 0 mV a -65 mV ~ (entre -55 y -75 mV); mientras que durante las penetraciones de LMC, esta caída es típicamente menor (entre -30 y -50 mV). Estas diferencias de voltaje representan los potenciales de reposo negativos de las células dadas. Dependiendo de la calidad del electrodo de registro (su nitidez) y el proceso celular penetró, la lectura de voltaje del electrodo de registro puede estabilizar rápidamente o gradualmente a la potencial de reposo, como la membrana celularsellos a la capa exterior del electrodo. Pero si la penetración es sólo parcial o pobre, el electrodo normalmente se desliza fuera de la célula con la escalada potencial grabado de nuevo hacia cero.Localizar el centro del campo receptivo de la célula penetrado cuando el electrodo aparece debidamente sellado, mostrando el potencial de membrana estable (potencial de reposo oscuro). Mueva el estímulo de luz intermitente alrededor del ojo de la mosca, utilizando el sistema Cardan-brazo, para encontrar el punto en el espacio visual, en el que el flash de la luz evoca respuesta de tensión máxima de la célula. Bloquear el Cardan-brazo cuando el estímulo luminoso se enfrenta directamente (en puntos) del centro del campo receptivo.
Nota: En la oscuridad, los fotorreceptores de Drosophila responden a pulsos de luz intensa con 40 - 65 mV respuestas de voltaje de despolarización de 4,5, mientras que las grabaciones de LMC estables muestran 20 a 45 mV respuestas de hiperpolarización 9,10,14. glia penetraciones pueden ser muy frecuente, indicado por <-80 mV potenciales de reposo y mucho más lentoy más pequeño (~ 5 mV) saturado despolarizaciones inducidas por la luz. Fotorreceptores de Drosophila con diferentes pigmentaciones oculares, como el blanco de ojos 7 y cinabrio, muestran tamaños de respuesta comparables con el de tipo salvaje.Uso del modo del amplificador de corriente-clamp (CC), compensar la capacitancia del electrodo de registro por inyección de pequeñas 0,1 nA y breve (100-200 ms) impulsos de corriente en la célula estudiada para minimizar los artefactos de grabación durante su carga de la membrana.
Nota: Este procedimiento importante es explicado en detalle en el manual del usuario del amplificador, y debe ser practicado con un modelo de célula eléctrica antes de los experimentos reales.respuestas de tensión registro a pulsos de luz y otros estímulos de interés, que tiene diferentes calidades estadísticos o físicos (tales como las series temporales intensidad de la luz naturalista o patrones aleatorios de contraste). Prueba, por ejemplo, cómo las respuestas registradas cambian con el color oscuro o adaptación.
Nota: Una precisión posible liGHT-adaptar la célula estudiada por la luz continua de la intensidad preseleccionada mediante la adición de filtros de densidad neutra en la trayectoria de la luz 4,5. Alternativamente, para prolongado-adaptación a la oscuridad apagar el estímulo de luz durante un tiempo preestablecido. Debido a la estabilidad mecánica del sistema de registro, la alta calidad de los electrodos de registro y la integridad de la preparación, las condiciones de grabación estables pueden a veces durar muchas horas. Por lo tanto, en un buen día, es posible recoger una gran cantidad de datos en diferentes condiciones de adaptación por parte de una sola célula. Cuando el electrodo se desliza fuera de la célula, las respuestas registradas disminuyen y la tensión media comienza a acercarse a cero.Avanzar cuidadosamente el electrodo de registro con el control fino del eje x de la micromanipulador hasta que el electrodo hace contacto y penetra en la siguiente celda (este suele ser el vecino neural más cercano). No mueva el electrodo a lo largo de Y o Z-eje que estas maniobras podrían hacer que el electrodo de "plough el tejido "de lado, dañando las estructuras del ojo!
Nota: Con un buen electrodo y una preparación saludable, se puede registrar las respuestas de alta calidad de muchos fotorreceptores (pero rara vez de muchos países de ideas afines) en la misma mosca durante un período de varias horas; de vez en cuando, durante toda la jornada laboral (> 8 h) sin deterioro de la señal clara.Guarde los archivos de datos periódicamente con información de identificación, como la fecha, el genotipo y el tipo de célula registrada. Debido a la gran cantidad de datos que pueden ser recogidos en una sesión de grabación con éxito, mantener buenos registros escritos en un laboratorio-libro para el análisis de los datos futuros.
Resultados
El método de grabación de microelectrodos agudo, tal como fue adaptada aquí por el ojo de Drosophila, se puede utilizar para cuantificar de manera fiable el muestreo y el procesamiento neuronal de información en las células de la retina y la lámina, y la comunicación entre ellos 4,5,7,8,10,33. Al usarlo para estudiar la codificación en diferentes poblaciones de tipo salvaje, mutantes o cepas de moscas de la ingeniería genética, el método ha demostrado su valor; no sólo en la cuantificación de los efectos de una mutación, la temperatura, la dieta o de expresión seleccionado 3,4,6,9,10,14,30,34, sino también en la revelación de razones mecanicistas para alterados comportamientos visuales 14,34. El método también es fácilmente aplicable a otras preparaciones de insectos 35,36, potenciando los estudios de visión neuroethological. A continuación, mostramos algunos ejemplos de sus aplicaciones exitosas.
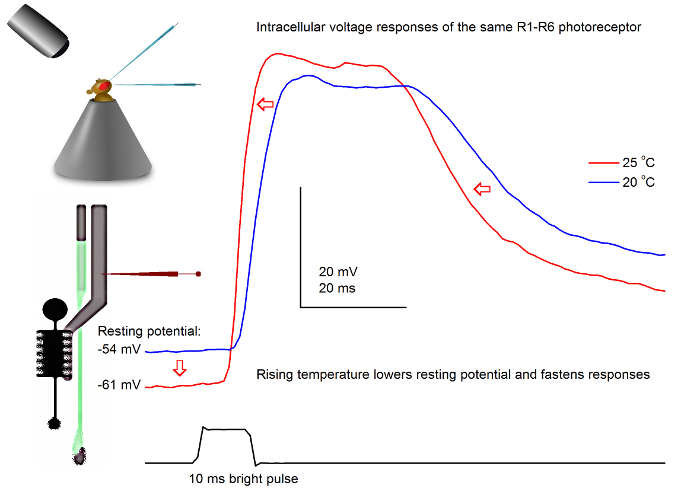
Figura 7. VoltajeRespuestas de una mosca de la fruta R1-R6 fotorreceptor a un pulso de luz a los 20 y 25 ° C. Debido a las penetraciones de microelectrodos afilados son a menudo muy estable, es posible registrar las respuestas de tensión de la misma fotorreceptor R1-R6 a un estímulo de luz dada en diferentes temperaturas ambiente por el calentamiento o enfriamiento de la mosca. En nuestros montajes, la mosca titular se coloca en un sistema de control de temperatura de cerca de bucle basado elemento Peltier. Esto nos permite cambiar la temperatura de la cabeza de la marcha en cuestión de segundos. Una temperatura más alta acelera las respuestas de tensión y de forma característica reduce el potencial de reposo de los fotorreceptores R1-R6 (como se indica por las flechas rojas). Haga clic aquí para ver una versión más grande de esta figura.
Estudiar el efecto de la temperatura sobre la salida de fotorreceptores
Con un buen diseño y un sistema de grabación de vibración aislada, el método puede ser usado para medir el efecto de la temperatura en la salida de los nervios de una célula individual por el calentamiento o enfriamiento de la mosca. El ejemplo que muestra las respuestas de voltaje a un brillante pulso de 10 ms de largo, registrados en el mismo fotorreceptor R1-R6 a los 20 y 25 ° C (Figura 7). Cuantificada antes de 4,9, el calentamiento reduce el potencial de reposo de un fotorreceptor en la oscuridad, y acelera sus respuestas tensión.
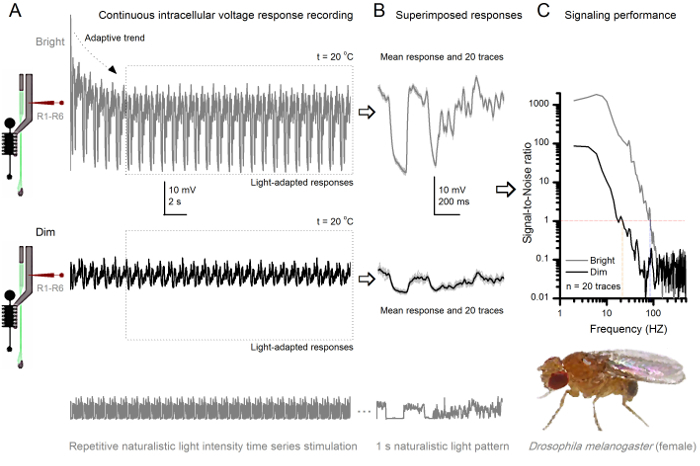
Figura 8. Rendimiento de Señalización de una mosca de la fruta R1-R6 fotorreceptor mejora con la intensidad de la luz (A) de salida de fotorreceptores se atenúen (abajo) y brillante. (Encima; 10.000 veces una luz más brillante) repiten series temporales intensidad de la luz naturalista registrado por la misma microelectrodoen la misma célula a 20 o C. Las respuestas al estímulo luminoso son más grandes, ya que integran más muestras, respuestas elementales (protuberancias) a fotones individuales 4,5,7,8. (B) 20 respuestas de voltaje consecutivos de un segundo de larga se superponen. Se tomaron las respuestas individuales (gris claro) después de que las tendencias adaptativas (flecha en A) había retrocedido (recuadro de puntos en A). Los medios de respuesta correspondientes (las señales) son las huellas más oscuros. La diferencia entre la señal y las respuestas individuales es el ruido. (C) Las células de rendimiento de señalización se cuantificó por las grabaciones de 'relaciones de señal a ruido (SNR) mediante los métodos estándar 4,5,7,8. Salida de los fotorreceptores tiene alrededor de 64 Hz más amplia gama de señalización fiable en la estimulación luminosa ( '≥1 brillante, hasta 84 Hz que en el dim (SNR SNR)' Dim ≥1, hasta 20 Hz), con signal-a-ruido mejora en gran medida; de SNR Dim MAX = 87 a SNR brillante MAX = 1,868. Haga clic aquí para ver una versión más grande de esta figura.
El estudio de adaptación y codificación neuronal repetitiva por estimulación
La invasividad del método, haciendo relativamente poco daño en las estructuras de la retina y la lámina, lo hace ideal para el estudio del rendimiento de señalización de las células individuales a diferentes estímulos de luz en su estado fisiológico natural cerca in vivo. La figura 8 muestra las respuestas de tensión de un R1- R6 fotorreceptor a un estímulo serie oscuro y brillante repetida naturalista tiempo intensidad de la luz, a 20 ° C, mientras que la figura 9 muestra las respuestas de otro fotorreceptor R1-R6 y un LMC a un estímulo naturalista diferente a 25 ° C. Las grabaciones pre y postsinápticos se realizaron por separado a partir de dos diferentes moscas porque registros intracelulares simultáneos de dos microelectrodos afilados de la misma mosca, una en la retina y el otro en la lámina, son demasiado difíciles de ser viable 30.
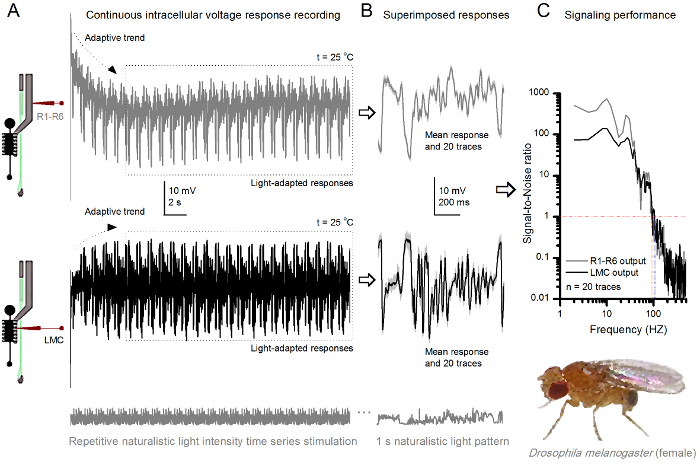
Figura 9. Respuestas de tensión de una mosca de la fruta R1-R6 fotorreceptores y LMC a las repetidas naturalista estimulación a 25 ° C (A) R1-R6 (gris) y LMC (negro) salidas registradas por diferentes microelectrodos de diferentes moscas. (B) 20 pre-luz totalmente adaptada consecutiva (arriba) y las respuestas postsinápticas (a continuación) para el mismo patrón de estímulo naturalista con las respuestas individuales, se muestra en gris claro unad los correspondientes medios de respuesta (las señales) como las huellas oscuras. La diferencia entre la señal y las respuestas individuales es el ruido. (C) Las células de rendimiento de señalización se cuantificó por las grabaciones de 'relaciones de señal a ruido (SNR). LMC tiene salida de aproximadamente 10 Hz más amplia gama de señalización fiable (SNR 'LMC ≥1, hasta 104 Hz) de salida R1-R6 (SNR' R ≥1, hasta 94 Hz). Ambas relaciones señal-ruido son altos (SNR LMC MAX = 142, SNR R MAX = 752), y como el ruido de la grabación fue baja, sus diferencias reflejan diferencias de codificación reales entre las células. Haga clic aquí para ver una versión más grande de esta figura.
Después del inicio del estímulo, las grabaciones típicaLy muestre la adaptación rápida tendencias que se desaparecen en gran parte dentro de 5-6 seg. A partir de entonces, las células producen respuestas muy consistentes a cada 1 seg presentación larga de estímulo (cada recuadro de puntos encierra 20 de estos). La repetibilidad de las respuestas se hace evidente cuando estos se superponen (Figura 8B y en la Figura 9B). Las respuestas individuales son las huellas grises delgadas, y su significan el grueso trazo más oscuro. La respuesta media se toma como la señal neural, mientras que el ruido neural es la diferencia entre la media y cada 4,5,9,37,38 respuesta individual. Las respectivas relaciones de señal a ruido en el dominio de frecuencia (Figura 8C y la Figura 9C) se obtuvieron por Fourier-transformación de los fragmentos de datos de señal y ruido en espectros de potencia, y dividiendo el espectro de potencia media de la señal con el correspondiente espectro de potencia de ruido media 4, 5,9,37,38. Característicamente, las máximas relaciones señal a ruido of las salidas neuronales registrados a la estimulación naturalista son altas (100 - 1000), y en las preparaciones más estables con ruido de grabación muy baja puede alcanzar valores >> 1000 (por ejemplo, la Figura 8C.). Nótese también que el calentamiento se expande el ancho de banda de las células de señalización fiable 4 (SNR 'brillante ≥ 1); por ejemplo, la diferencia relativa entre los dos R1-R6S en las figuras 8 y 9, respectivamente, es de 10 Hz (84 a 20 ° C y 94 Hz a 25 o C).
Uno puede estimar más velocidad de transferencia de información a partir de su relación señal-ruido de cada célula mediante el uso de la ecuación de Shannon 32, o mediante el cálculo de la diferencia entre la entropía y la entropía de ruido tasas de las respuestas 'a través del método de extrapolación de triple 39. Más detalles acerca de los análisis teóricos de la información, así como su uso y limitacioness específicamente con este método se dan en las publicaciones anteriores 7,8,39.
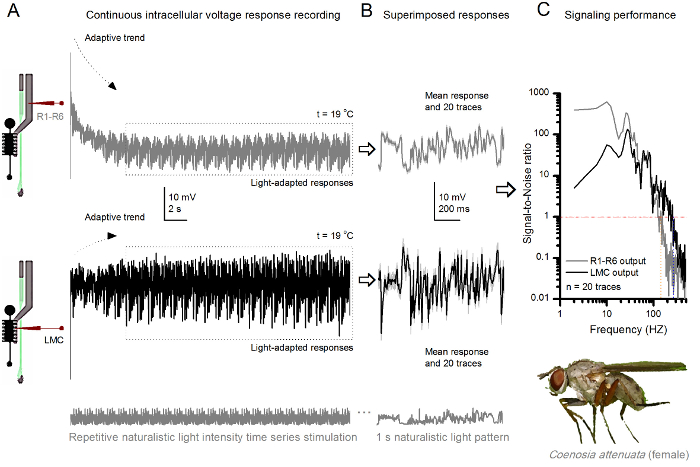
Figura 10. Respuestas de tensión de una mosca del asesino R1-R6 fotorreceptores y LMC a las repetidas naturalista estimulación a 19 ° C (A) R1-R6 (gris) y LMC (negro) resultados registrados por el mismo microelectrodo de la misma mosca; postsináptico primera y más tarde presináptica, como el electrodo se avanzó en el ojo. (B) 20 pre consecutiva (arriba) y postsinápticos (abajo) respuesta (trazas de color gris claro) para el mismo patrón de estímulo naturalista fueron capturados después de la adaptación inicial (recuadro de puntos en A). Sus medios son las señales (los trazos más oscuros en la parte superior), mientras que sus respectivas diferencias con respecto a las respuestas individuales dan el ruido. (C) El correspondiente SignaRatios-l-ruido (SNR) se calcularon como en las figuras 8C y 9C. LMC tiene salida sobre un rango más amplio de 100 Hz de señalización fiable (SNR 'LMC MAX ≥1, hasta 234 Hz) de salida R1-R6 (SNR' R MAX ≥1, hasta 134 Hz). Ambas relaciones señal-ruido son altos (SNR LMC MAX = 137, SNR R MAX = 627), y como la misma microelectrodo se utilizó en las grabaciones, sus diferencias reflejan diferencias reales en las salidas neurales pre- y postsinápticos. Estos resultados implican que el sistema de grabación tenía bajo nivel de ruido, y su influencia en los análisis fue marginal. Haga clic aquí para ver una versión más grande de esta figura.
Estudios Vision Neuroethological
El método también se puede utilizar para registrar las respuestas pre y postsinápticos de tensión de los ojos compuestos de diferentes especies de insectos 7,8,35,36 (Figura 10), lo que permite estudios comparativos neuroethological de procesamiento de la información visual. Para el sistema de grabación presentada, la única adaptación requerida es de preparación de los nuevos titulares, cada uno con una abertura de dimensiones adecuadas para las especies estudiadas. Estas grabaciones son ejemplares de un asesino de mosca hembra (Coenosia attenuata). Ellos muestran respuestas de tensión intracelulares de un fotorreceptor R1-R6 y LMC a la estimulación repetitiva luz idéntica, tal como se utiliza para los homólogos de Drosophila en la Figura 9, pero a 19 o C. En este caso, tanto los datos pre y postsinápticos se registraron de la misma mosca; uno después del otro, con el mismo electrodo de registro (lleno de 3 M KCl) primero avanzando a través de la lámina lateral antes de entraring la retina frontal. En comparación con los datos de Drosophila a 25 ° C, los datos Coenosia - incluso a la temperatura más fría - muestra las respuestas con dinámicas más rápidas; ampliar la gama de señalización fiable (relación señal a ruido >> 1) sobre un rango de frecuencias más amplio. Tales adaptaciones funcionales en la codificación neuronal de estímulos naturalistas están en consonancia con el estilo de vida depredador Coenosia 's 36, que requieren alta precisión la información espacio-temporal para lograr comportamientos de caza aéreas rápidas.
Discusión
We have presented the basic key steps of how to use sharp conventional microelectrodes to record intracellular responses of R1-R6 photoreceptors and LMCs in intact fly eyes. This method has been optimized, together with bespoke hardware and software tools, over the last 18 years to provide high-quality long-lasting recordings to answer a wide range of experimental questions. By investing time and resources to construct robust and precise experimental set-ups, and to produce microelectrodes with favorable electrical properties, high-quality recordings can become the norm in any laboratory working on Drosophila visual neurophysiology. Whilst well-designed recording and light stimulation systems are important for swift execution of different experimental paradigms, there are three procedural steps that are even more critical to achieving successful recordings: (i) to make the fly preparation with minimal eye damage, (ii) to pull microelectrodes with the right electrical properties, and (iii) to drive the recording electrode into the eye without breaking its tip. Ultimately, to record meaningful data, the investigator has to understand the physical basis of electrophysiology and how to fabricate suitable microelectrodes for the targeted cell-types.
Therefore, the limitations of this technique are primarily set by the patience, experience and technical ability of the investigator. Because this technique can take a long time to master for small Drosophila cells, it is advisable for trainee electrophysiologists to first practice with larger insect eyes, such as the blowfly36 or locust35, using the same rig. Once performing high-quality intracellular recordings from the larger photoreceptors and interneurons becomes routine, it is time to move on to the Drosophila eye. Another limitation of the technique concerns cellular identification. Penetrated Drosophila cells can be loaded electrophoretically with dyes, including Lucifer yellow or neurobiotin. However, because of the small tip size of the microelectrodes, electrophoresis works less efficiently than with lower resistance electrodes, such as patch-electrodes. Furthermore, the dye-filled microelectrodes characteristically have less favorable electrical properties, making it much harder to record high-quality responses with them from Drosophila photoreceptors and LMCs.
A technical problem that occurs sometimes is unstable input signal, or a complete lack of it. This is often associated with the voltage signal being either constantly drifting or higher/lower than the amplifier's recording range. On most occasions, this behavior is caused by the recording electrode being blocked (or its tip being too fine - having too high a resistance or intramural capacitance - to properly conduct fast signal changes). Although one can try to unblock the tip by buzzing the electrode capacitance, which sometimes works, often the situation is best resolved by simply changing the recording electrode. This may further require parameter adjustments in the microelectrode puller instrument to lower the tip resistance of the new electrodes. The electrode tip can also become blocked in preparations, for which it took too much time to cover the corneal hole by petroleum jelly. Prolonged air-contact can dry up the freshly exposed retinal tissue, turning its surface layer into a glue-like substance. If this is the case, the investigator typically sees a red blob of tissue stuck on the recording electrode when pulling it out of the eye. The only solution here is to make a new preparation. Petroleum jelly may provide many benefits for electrophysiological recordings: (i) it prevents the coagulation of the hemolymph that could break the electrode tip; (ii) it coats the electrode tip reducing its intramural capacitance, which lowers the electrode's time constant, and thus has the potential to improve the temporal resolution of the recorded neural signals40,41; (iii) it keeps the electrode tip clean, facilitating penetrations; and after penetration, (iv) it may even help to seal the electrode tip to the cell membrane42.
The signal can further be unstable or lost when the silver-chloride wire of the electrode-holder is broken or dechloridized; in which case just replace or rechloridize the old wire. The missing signal can also result from one (or both) of the electrode-holders not being securely connected to their jacks. However, it is extremely unusual that a piece of equipment would be malfunctioning. If signal is undetectable and all other possibilities have been exhausted, test that each part of the recording apparatus, including the headstage, amplifier, low-pass filters and AD/DA-converters, are connected properly and functioning normally. One way to achieve this is to replace each instrument with another from a rig that is known to operate normally. Alternatively, use a signal generator to check the performance of the electronic components one by one.
But perhaps the most common technical problem facing the electrophysiologist is that of recording noise. Broadly, recording noise is the observed electrical activity other than the direct neuronal response to a given stimulus. Because the fly preparation, when properly done, is very stable, the observed noise (beyond the natural variably of the responses) most often results from ground-loops in the recording equipment, or is picked up from nearby electrical devices. Such noise is typically 50/60 Hz mains hum and its harmonics; but sometimes composed of more complex waveforms. To work out the origin of the noise, remove the fly preparation holder from the set-up, connect the recording and reference electrodes through a drop of fly Ringer (or place them in a small Ringer's solution bath; see step 1.2.6) and record the signal in CC- or bridge-mode. If noise is observable on the recorded signal, this likely means that the noise is external to the fly preparation.
Another good test for identifying the origin of noise is to replace the electrode-holders with an electric cell model connected to the amplifier. In an ideally configured and grounded set-up, the recorded signal should now be practically noise-free, showing only stochastic bit-noise from the AD-converter (in the best case not even that!). If noise is still present, then recheck that all rig equipment is properly grounded. A convenient approach to detect ground-loops is to: (i) disconnect all the grounding wires from all the parts within the rig; (ii) ensure that, after doing this, every single part is actually isolated from ground, by means of an ohm-meter; (iii) connect the parts, one by one, to the central ground directly, not through any other part of the rig. Try also changing the equipment configurations. For example, sometimes moving the computer and monitor further away from the rig can reduce noise; yet at other times, moving the computer inside the equipment rack reduces noise. It is also worth unplugging nearby equipment to see if noise is reduced, or shield additional components. Furthermore, try unplugging or replacing different components of the recording equipment, especially BNC cables (which can have faulty ground connections). If only bit-noise is observed when using the cell model, the initial noise source is either the electrodes or the fly preparation itself. For example, it could be that the reference electrode is inadvertently touching a motor nerve or active muscle fibers inside the head capsule (or disturbing flight muscles in the thorax - if placed there). It is usually simplest to prepare a new fly for recording, taking care to minimize damage to the fly. But if the noise persists and is broadband, it is likely that the electrodes are suboptimal for the experiments; too sharp/fine (hence too noisy) or just wrong for the purpose; we have even seen quartz-electrodes acting as antennas - picking up faint broadcasting signals! Although iteration of the puller-instrument parameter settings to generate the just right microelectrodes for consistent high-quality recordings from specific cell-types can take a lot of effort, it is worth it. Once the recording electrodes are well-tailored for the experiments, they can provide long-lasting recordings of outstanding quality.
Sharp microelectrode recording techniques can be similarly applied to study neural information processing in multitude of preparations, including different processing layers in the insect eyes and brain43,44. Because the microelectrode tips can be made very fine, these typically damage the studied cells less than most patch-clamp applications. Importantly, the modern sample-and-hold microelectrode amplifiers enable good control of the tips' electrical properties40,45-47. Thus, when correctly applied, this technique can provide reliable data from both in vivo3,5,7-10,44 or in vitro48 preparations with high signal-to-noise ratio at sub-millisecond resolution. Such precision would be impossible with today's optical imaging techniques, which are noisier and slower. Moreover, the method can be used to characterize small cells' electrical membrane properties both in current- and voltage-clamp configurations5,29,33,36,40-42,49, providing valuable data for biophysical and empirical modeling approaches7,8,11,33,49-54 that link experiments to theory.
Divulgaciones
The authors have nothing to disclose
Agradecimientos
The authors thank Mick Swann, Chris Askham and Martin Gautrey for their important contributions in designing and building many electrical and mechanical components of the rigs. MJ's current research is supported by the Biotechnology and Biological Sciences Research Council (BBSRC Grant: BB/M009564/1), the State Key Laboratory of Cognitive Neuroscience and Learning open research fund (China), High-End Foreign Expert Grant (China), Jane and Aatos Erkko Foundation Fellowship (Finland), and the Leverhulme Trust grant (RPG-2012-567).
Materiales
| Name | Company | Catalog Number | Comments |
| Stereo Zoom Microscope for making the fly preparation | Olympus | SZX12 DFPLFL1.6x PF eyepieces: WHN30x-H/22 | Capable of ~150X magnification with long working distance; bespoke heavy steel table mount stand |
| Stereomicroscope in the intracellular set-up | · Olympus | Olympus SZX7; eyepieces: WHN30x-H/22 | 30X eyepieces are needed for seeing the electrode tip reflections well when driving it through the small corneal hole into the eye |
| Nikon microscope | Nikon SMZ645; eyepieces: C-W30x/7 | ||
| Anti-vibration Table | Melles Griot | With metric M6 holes on the breadboard | Our bespoke rigs have a large hole drilled through the thick breadboard that lets in the fly preparation platform pole (houses a copper heatsink with electronics) from below |
| Newport | |||
| Micromanipulators | Narishige | Narishige NMN-21 | In our intracellular set-ups, different micromanipulator systems are used for driving the shap recording electrodes into the fly eye. All the listed manipulators are succesfully providing long-lasting stable recordings from Drosophila photoreceptors and LMCs. |
| Huxley Bertram | Huxley xyz-axis with fine manual control | ||
| Sensapex | Sensapex triple axis | ||
| Märzhäuser | Märzhäuser DC-3K with additional x-axis piezo stepper and MS 314 controller | ||
| Magnetic Stands | Any magnetic base with on/off switch will do | For example, to manage cables inside the Faraday cage | |
| Electrode Holders | Harvard Apparatus | ESP/W-F10N | |
| Silver Wire | World Precision Instruments | AGW1510 | 0.3 - 0.5 mm diameter; needs to be chloridized for the electrode holders |
| Fiber Optic Light Source | Many different, including Olympus | ||
| Fiber Optic Bundles | UltraFine Technology | To deliver the LED light stimulus to the Cardan arm system. We use both liquid and quartz light guides (range from UV to IR) | |
| Thorn Labs | |||
| Fly Cathing Tube | P80-50P 50ml Cent. Tube PP., Pack of 100 Pcs | Cut the conical bottom off from 50 ml Plastic Centrifuge Tube and glue a 1 ml pipette tip on it. | |
| Digital Acquisition System | National Instruments | ||
| Single-electrode current/voltage-clamp microelectrode amplifier | npi SEC-10LX | http://www.npielectronic.de/products/amplifiers/sec-single-electrode-clamp/sec-10lx.html | Outstanding performer! |
| Head-stage | Standard (+/- 150 nA) | For npi SEC-10LX | |
| LED light sources and drivers | 2-channel OptoLED (Cairn Research Ltd., UK) | Many of our stimulus systems are in-house built | |
| Self-designed and constructed | |||
| Acquisition and Analyses Software | Many companies to choose from | Biosyst; custom written Matlab-based system for experimental and theoretical work in the Juusola laboratory | |
| Personal Computer or Mac | Ensure that PC or Mac is compatible with data acquisition system and software | ||
| Cardan arm system | Self-designed and constructed | Providing accurate x,y,z-positioning of the light stimuli | |
| Peltier temperature control system | Self-designed and constructed | ||
| Faraday Cage | Self-constructed | Electromagnetic noise shielding | |
| Filamented Borosilicate Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Filamented Quartz Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Pipette Puller | Sutter Instrument Company | Model P-2000 laser Flaming/Brown Micropipette Puller | For borosilicate reference electrodes, use the preset program #11 (patch electrodes): Heat = 350; Filament = 4; Velocity 36; Delay = 200).1.2.1). For borosilicate recording electrodes, use the preset program #12 (this typically pulls good conventional sharps for photoreceptor recordings): Heat = 355; Filament = 4; Velocity 50; Delay = 225; Pull = 150. For LMC recordings, which require electrodes with finer tips, these values need to be adjusted. For pulling quartz capillaries, P-2000 manual suggests programs for fine tipped microelectrodes. These programs’ preset parameters serve as useful starting points for systematic modifications to generate electrodes with good penetration success and low recording noise. |
| Extracellular Ringer Solution for the reference electrode | Chemicals from Fisher Scientific | 10326390, NaCl 10010310, KCl 10147753, TES 10161800, CaCl2 10159872, MgCl2 10000430, sucrose | See the recipe in the protocol section |
| 3 M KCl solution for filling the filamented recording microelectrode | Salts from Fisher Scientific | 10010310, KCl | |
| Petroleum jelly | Vaselin | ||
| Non-stainless steel razor blades | |||
| Blade holder/breaker | Fine Science Tools By Dumont | 10053-09 | 9 cm |
| Blu-tack | Bostik | Alternatively, use molding clay | |
| Forceps | Fine Science Tools By Dumont | 11252-00 | #5SF (super-fine tips) |
Referencias
- Meinertzhagen, I. A., O'Neil, S. D. Synaptic Organization of Columnar Elements in the Lamina of the Wild-Type in Drosophila-Melanogaster. J Comp Neurol. 305, 232-263 (1991).
- Rivera-Alba, M., et al. Wiring Economy and Volume Exclusion Determine Neuronal Placement in the Drosophila Brain. Curr Biol. 21, 2000-2005 (2011).
- Abou Tayoun, A. N., et al. The Drosophila SK Channel (dSK) Contributes to Photoreceptor Performance by Mediating Sensitivity Control at the First Visual Network. J Neurosci. 31, 13897-13910 (2011).
- Juusola, M., Hardie, R. C. Light adaptation in Drosphila photoreceptors: II. Rising temperature increases the bandwidth of reliable signaling. J Gen Physiol. 117, 27-41 (2001).
- Juusola, M., Hardie, R. C. Light adaptation in Drosophila photoreceptors: I. Response dynamics and signaling efficiency at 25 degrees. C. J Gen Physiol. 117, 3-25 (2001).
- Pantazis, A., et al. Distinct roles for two histamine receptors (hclA and hclB) at the Drosophila photoreceptor synapse. J Neurosci. 28, 7250-7259 (2008).
- Song, Z., Juusola, M. Refractory sampling links efficiency and costs of sensory encoding to stimulus statistics. J Neurosci. 34, 7216-7237 (2014).
- Song, Z., et al. Stochastic, Adaptive Sampling of Information by Microvilli in Fly Photoreceptors. Curr Biol. 22, 1371-1380 (2012).
- Zheng, L., et al. Feedback network controls photoreceptor output at the layer of first visual synapses in Drosophila. J Gen Physiol. 127, 495-510 (2006).
- Zheng, L., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye I Dynamics. Plos One. 4, (2009).
- Hardie, R. C., Juusola, M. Phototransduction in Drosophila. Curr opin neurobiol. 34, 37-45 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35, 827-841 (2002).
- Wernet, M. F., et al. Homothorax switches function of Drosophila photoreceptors from color to polarized light sensors. Cell. 115, 267-279 (2003).
- Wardill, T. J., et al. Multiple Spectral Inputs Improve Motion Discrimination in the Drosophila Visual System. Science. 336, 925-931 (2012).
- Hardie, R. C., Ottoson, D. . Progress in Sensory Physiology. 5, 1-79 (1985).
- Borst, A. Drosophila's View on Insect Vision. Curr Biol. 19, 36-47 (2009).
- Kirschfeld, K. Die Projektion Der Optischen Umwelt Auf Das Raster Der Rhabdomere Im Komplexauge Von Musca. Exp Brain Res. 3, 248-270 (1967).
- Morante, J., Desplan, C. Photoreceptor axons play hide and seek. Nat Neurosci. 8, 401-402 (2005).
- Fischbach, K. F., Hiesinger, P. R. Optic lobe development. Adv Exp Med Biol. 628, 115-136 (2008).
- Shaw, S. R. Early Visual Processing in Insects. J Exp Biol. 112, 225-251 (1984).
- Joesch, M., Schnell, B., Raghu, S. V., Reiff, D. F., Borst, A. ON and OFF pathways in Drosophila motion vision. Nature. 468, 300-304 (2010).
- Clark, D. A., Bursztyn, L., Horowitz, M. A., Schnitzer, M. J., Clandinin, T. R. Defining the Computational Structure of the Motion Detector in Drosophila. Neuron. 70, 1165-1177 (2011).
- Rister, J., et al. Dissection of the peripheral motion channel in the visual system of Drosophila melanogaster. Neuron. 56, 155-170 (2007).
- Vogt, N., Desplan, C. The first steps in Drosophila motion detection. Neuron. 56, 5-7 (2007).
- Strausfeld, N. J., Braitenberg, V. Compound Eye of Fly (Musca-Domestica) - Connections between Cartridges of Lamina Ganglionaris. Z Vergl Physiol. 70, 95-104 (1970).
- Strausfeld, N. J., Campos-Ortega, J. L4-Monopolar Neuron - Substrate for Lateral Interaction in Visual System of Fly Musca-Domestica (L). Brain Res. 59, 97-117 (1973).
- Takemura, S. Y., et al. Cholinergic Circuits Integrate Neighboring Visual Signals in a Drosophila Motion Detection Pathway. Curr Biol. 21, 2077-2084 (2011).
- Shaw, S. R., Frohlich, A., Meinertzhagen, I. A. Direct Connections between the R7/8 and R1-6 Photoreceptor Subsystems in the Dipteran Visual-System. Cell Tissue Res. 257, 295-302 (1989).
- Wolfram, V., Juusola, M. Impact of rearing conditions and short-term light exposure on signaling performance in Drosophila photoreceptors. J Neurophysiol. 92, 1918-1927 (2004).
- Nikolaev, A., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye II Mechanisms. Plos One. 4, (2009).
- Land, M. F. . Compound eye structure: Matching eye to environment. Adaptive Mechanisms in the Ecology of Vision. , (1999).
- Shannon, C. E. A Mathematical Theory of Communication. At&T Tech J. 27, 379-423 (1948).
- Niven, J. E., et al. The contribution of Shaker K+ channels to the information capacity of Drosophila photoreceptors. Nature. 421, 630-634 (2003).
- Randall, A. S., et al. Speed and sensitivity of phototransduction in Drosophila depend on degree of saturation of membrane phospholipids. J Neurosci. 35, 2731-2746 (2015).
- Faivre, O., Juusola, M. Visual Coding in Locust Photoreceptors. Plos One. 3, e2173 (2008).
- Gonzalez-Bellido, P. T., Wardill, T. J., Juusola, M. Compound eyes and retinal information processing in miniature dipteran species match their specific ecological demands. P Natl Acad Sci USA. 108, 4224-4229 (2011).
- Juusola, M., Kouvalainen, E., Järvilehto, M., Weckström, M. Contrast Gain, Signal-to-Noise Ratio, and Linearity in Light-Adapted Blowfly Photoreceptors. J Gen Physiol. 104, 593-621 (1994).
- Juusola, M., Uusitalo, R. O., Weckstrom, M. Transfer of Graded Potentials at the Photoreceptor Interneuron Synapse. J Gen Physiol. 105, 117-148 (1995).
- Juusola, M., de Polavieja, G. G. The rate of information transfer of naturalistic stimulation by graded potentials. J Gen Physiol. 122, 191-206 (2003).
- Weckstrom, M., Kouvalainen, E., Juusola, M. Measurement of Cell Impedance in Frequency-Domain Using Discontinuous Current Clamp and White-Noise-Modulated Current Injection. Pflug Arch Eur J Phy. 421, 469-472 (1992).
- Juusola, M. Measuring Complex Admittance and Receptor Current by Single Electrode Voltage-Clamp. J Neurosci Meth. 53, 1-6 (1994).
- Juusola, M., Seyfarth, E. A., French, A. S. Rapid coating of glass-capillary microelectrodes for single-electrode voltage-clamp. J Neurosci Meth. 71, 199-204 (1997).
- Haag, J., Borst, A. Neural mechanism underlying complex receptive field properties of motion-sensitive interneurons. Nat Neurosci. 7, 628-634 (2004).
- Rien, D., Kern, R., Kurtz, R. Synaptic transmission of graded membrane potential changes and spikes between identified visual interneurons. Eur J Neurosci. 34, 705-716 (2011).
- Muller, A., et al. Switched single-electrode voltage-clamp amplifiers allow precise measurement of gap junction conductance. Am J Physiol-Cell Ph. 276, C980-C987 (1999).
- Polder, H. R., Swandulla, D., Konnerth, A., Lux, H. D. An Improved, High-Current Single Electrode Current Voltage Clamp System. Pflug Arch Eur J Phy. 402, R35-R35 (1984).
- Richter, D. W., Pierrefiche, O., Lalley, P. M., Polder, H. R. Voltage-clamp analysis of neurons within deep layers of the brain. J Neurosci Meth. 67, 121-131 (1996).
- Juusola, M., French, A. S. The efficiency of sensory information coding by mechanoreceptor neurons. Neuron. 18, 959-968 (1997).
- Vähäsöyrinki, M., Niven, J. E., Hardie, R. C., Weckström, M., Juusola, M. Robustness of neural coding in Drosophila photoreceptors in the absence of slow delayed rectifier K+ channels. J Neurosci. 26, 2652-2660 (2006).
- Friederich, U., Coca, D., Billings, S., Juusola, M. Data Modelling for Analysis of Adaptive Changes in Fly Photoreceptors. Lect Notes Comput Sc. 5863, 34-48 (2009).
- Asyali, M. H., Juusola, M. Use of Meixner functions in estimation of Volterra kernels of nonlinear systems with delay. Ieee T Bio-Med Eng. 52, 229-237 (2005).
- French, A. S., et al. The Dynamic Nonlinear Behavior of Fly Photoreceptors Evoked by a Wide-Range of Light Intensities. Biophys J. 65, 832-839 (1993).
- Juusola, M., French, A. S. Visual acuity for moving objects in first- and second-order neurons of the fly compound eye. J Neurophysiol. 77, 1487-1495 (1997).
- Juusola, M., Weckstrom, M., Uusitalo, R. O., Korenberg, M. J., French, A. S. Nonlinear models of the first synapse in the light-adapted fly retina. J Neurophysiol. 74, 2538-2547 (1995).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados