Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Implementación de un sistema coherente anti-Stokes Raman Scattering (CARS) en un Ti: Zafiro y OPO láser basado en Laser Standard Microscopio de Barrido
En este artículo
Resumen
Coherente dispersión anti-Stokes Raman (CARS) microscopía basada en la vibración inherente de la molécula se adhiere permite imágenes de células vivas químicamente selectivo libre de etiquetas. Este trabajo presenta la aplicación de una técnica de microscopía complementaria en un microscopio de barrido láser estándar multifotónica basado en un femtosegundo Ti: zafiro láser y un láser de OPO.
Resumen
microscopios de barrido láser de femtosegundo que combinan una Ti: zafiro láser y un oscilador paramétrico óptico (OPO) para duplicar la línea de láser se han hecho disponibles para los biólogos. Estos sistemas están diseñados principalmente para múltiples canales de dos fotones microscopía de fluorescencia. Sin embargo, sin ninguna modificación, microscopía óptica no lineal complementaria tales como la generación de segundo armónico (SHG) o tercera generación armónica (THG) también se puede realizar con esta puesta a punto, permitiendo de imágenes libre de etiquetas de moléculas estructuradas o medio acuoso interfaces de lípidos. Estas técnicas son muy adecuadas para la observación in vivo, pero son limitados en la especificidad química. Químicamente imagen selectiva se puede obtener de las señales de vibración inherentes en base a la dispersión Raman. Confocal Raman microscopía proporciona una resolución espacial en 3D, pero requiere alta potencia media y de largo tiempo de adquisición. Para superar estas dificultades, los recientes avances en la tecnología láser han permitido el desarrollo de la microscopía óptica no lineal vibratorio, en particular, coherente anti-Stokes dispersión Raman (CARS). Por lo tanto, la microscopía CARS ha surgido como una poderosa herramienta para imágenes de células biológicas y en directo, por los lípidos químicamente mapeo (a través de la vibración de estiramiento CH), agua (a través de las vibraciones de estiramiento OH), proteínas o ADN. En este trabajo se describe la aplicación de la técnica de los coches en un microscopio de barrido láser estándar multifotónica OPO acoplado. Se basa en la sincronización en tiempo de las dos líneas de láser mediante el ajuste de la longitud de uno de la trayectoria del haz láser. Presentamos una implementación paso a paso de esta técnica en un sistema múltiple de fotones existentes. Una base de fondo en la óptica experimental es servicial y el sistema que se presenta no requiere costosos equipos suplementarios. También ilustramos CARS por imágenes obtenidas en las vainas de mielina del nervio ciático de roedores, y se muestra que esta imagen se puede realizar simultáneamente con otra óptica no lineal de imágenes, tal como t normawo-fotón técnica de fluorescencia y la generación de segundo armónico.
Introducción
La microscopía óptica se ha convertido en una técnica importante para la visualización no destructiva de los procesos dinámicos en los sistemas biológicos vivos con una resolución subcelular. Microscopía de fluorescencia es actualmente el contraste de imagen más popular usado en células vivas debido a su alta especificidad y sensibilidad 1. Una gran gama de sondas fluorescentes ha surgido (colorantes exógenos, las proteínas codificadas genéticamente, nanopartículas de semiconductores). Varios muestra de iluminación técnicas basadas en fluorescentes han florecido (como la microscopía confocal o de dos fotones) para realizar las imágenes en 3D y para reducir un inconveniente principal de esta técnica que se photobleaching 2. Otras limitaciones incluyen el requisito de etiquetado fluoróforo porque la mayoría de las especies moleculares no son intrínsecamente fluorescente y por lo tanto estos fluoróforos que ser introducido artificialmente en la muestra de imágenes. Esta manipulación artificial puede ser perjudicial, especialmente para las pequeñas moléculas o induzca a la ollaential fototoxicidad. Estas razones hacen que no microscopía de fluorescencia muy adecuado para las observaciones in vivo. Por lo tanto, el uso de técnicas de formación de imágenes ópticas con alta sensibilidad y contrastes moleculares específicos sin el uso de moléculas fluorescentes es muy deseable en la ciencia biomédica.
Varias técnicas de imagen óptica no lineal sin etiquetado o tinción han surgido, incluyendo la generación del segundo armónico (SHG) 3,4 y la generación de tercera armónica (THG) 5. SHG microscopía se ha utilizado para disposiciones estructurales de la imagen en el nivel supramolecular tales como microtúbulos o colágeno 6. THG se genera a partir heterogeneidades ópticas tal como la interfaz entre un medio acuoso y lípidos 7. THG También se demostró que la imagen de la mielina 8,9. Ambas técnicas se pueden implementar en un microscopio de fluorescencia de dos fotones y requieren solamente un haz de láser. Sin embargo requieren la intensidad del láser de alta potencia (típicamente 50mW a 860 nm para SHG 10, 25 - 50 mW en 1180 nm para THG 9), que es perjudicial en muestras de vida, y no proporcionan la especificidad química que se requiere para inequívocamente imagen estructuras biológicas específicas.
Químicamente imagen selectiva se puede obtener de las señales de vibración molecular inherentes en base a la dispersión Raman. Cuando un haz de luz incide en la materia, los fotones pueden ser absorbidos y dispersados por átomos o moléculas. La mayoría de los fotones dispersados tendrá la misma energía, es decir, la frecuencia, como los fotones incidentes. Este proceso se denomina dispersión de Rayleigh. Sin embargo, un pequeño número de fotones se dispersa en una frecuencia óptica diferente de la frecuencia de los fotones incidentes, es decir, con un proceso de dispersión inelástica llamada dispersión Raman. La diferencia de energía se origina a partir de la excitación de modos de vibración en función de la estructura molecular y el medio ambiente. Por lo tanto, Raman espontánea prov dispersiónidus de imagen químicamente selectivos diferentes moléculas tienen frecuencias vibratorias específicas. Sin embargo, es limitada debido a su señal extremadamente débil. Confocal Raman microscopía se ha desarrollado y proporciona una resolución espacial en 3D, pero requiere alta potencia media y la adquisición de mucho tiempo 11. Para superar estas dificultades, los recientes avances en la tecnología láser han permitido el aumento de la microscopía óptica no lineal vibratorio, en particular, dispersión coherente anti-Stokes Raman (CARS) 11,12,13.
CARS es un proceso óptico no lineal de tercer orden. Tres rayos láser, compuesto de un haz de bombeo en ω frecuencia P, un haz de Stokes a la frecuencia ω S y un haz de sonda (siendo lo más a menudo la bomba) se centran en una muestra y generan un haz de anti-Stokes a la frecuencia ω AS = ( 2ω P - ω S) 14. La señal anti-Stokes se puede mejorar de manera significativa cuando la diferencia de frecuenciaentre la bomba y el Stokes vigas está sintonizado a una R Ω vibración molecular Raman = (ω P - ω S). señal CARS se basa en la interacción múltiple de fotones. Por lo tanto, genera una señal coherentes órdenes de magnitud más fuerte que la dispersión Raman espontánea.
CARS microscopía se demostró experimentalmente por primera vez por Duncan et al. 15. Zumbusch et al. Mejoró entonces la técnica, mediante el uso de dos haces de láser de femtosegundo se centraron en el infrarrojo cercano con una lente de objetivo de gran apertura numérica, que permite la condición de coincidencia de fases de coches y evitando el de dos fotones de fondo no resonante 16. Por lo tanto CARS microscopía ha surgido como una poderosa herramienta para la formación de imágenes de células y tejidos en vivo, mediante la detección de moléculas químicamente tales como lípidos (a través de la vibración de estiramiento CH) 17,18, agua (a través de las vibraciones de estiramiento OH), proteínas, ADN en células vivas 19,20 pero también deuterado compuesto químicos para la industria farmacéutica 21 y 22 aplicaciones cosméticas.
La principal limitación de la microscopía no lineal origina a partir de la complejidad y el costo de las fuentes ópticas. Un sistema CARS requiere dos láseres sintonizables de longitud de onda con duraciones de pulso corto y con trenes de impulsos sincronizados temporal y espacialmente. Los primeros microscopios CARS se basaron en dos picosegundos sincronizada Ti: zafiro láseres 20. CARS imágenes también se obtuvo a partir de una sola femtosegundo Ti: zafiro láser que genera una fuente de luz supercontinuo 23. Recientemente, fuentes de láser compuestos por un solo Ti femtosegundo: láser de zafiro de bombeo de un osciladores paramétricos ópticos sintonizables (OPO) se han utilizado para la microscopía CARS. Esta configuración permite intrínsecamente temporal sincronizada vigas con una diferencia de frecuencia entre la bomba y el haz de Stokes que cubre el espectro de vibración molecular completa 24. Además, microscopios de barrido láser basado en un volumen de negociosláser de fs clave y un OPO, que se utiliza principalmente para la fluorescencia de dos fotones (TPF) están ahora disponibles para los no-físicos. El potencial de este tipo de puestas a punto se puede mejorar en gran medida sin necesidad de inversión suplementaria por la incorporación de otras imágenes ópticas no lineales, ya que cada modalidad de imagen no lineal (NLO) es sensible a las estructuras o moléculas específicas. Por lo tanto, la imagen multimodal NLO capitaliza el potencial de la microscopía NLO para muestras biológicas complejas 25. El acoplamiento de estas técnicas ha permitido la investigación de muchos cuestiones biológicas, en particular, sobre el metabolismo de los lípidos, de la piel o cáncer de desarrollo 26, el desarrollo del músculo esquelético 27, 28 lesiones ateroscleróticas. Por otra parte, la aplicación de rayo láser de barrido con los coches da la capacidad de formación de imágenes de alta velocidad, es decir, una herramienta atractiva para estudiar los procesos dinámicos en vivo.
El objetivo de este trabajo es mostrar cada paso para poner en práctica tél CARS técnica en un microscopio de barrido láser estándar multifotónica. El microscopio se basa en un Ti FSEC: láser de zafiro y un OPO (bombeada por el Ti: Zafiro láser), operado por un software para los biólogos. La integración se llevó a cabo mediante el ajuste de la longitud de uno de la trayectoria del rayo láser con el fin de sincronizar en el tiempo los dos haces. Se describe la ejecución paso a paso de esta técnica que requiere sólo base de fondo en la óptica experimentales. También ilustramos CARS formación de imágenes obtenidas en las vainas de mielina del nervio ciático de roedores, y mostramos esta imagen se puede realizar simultáneamente con otra óptica no lineal de imágenes, tales como técnica de fluorescencia de dos fotones estándar y segundo armónico generación.
Access restricted. Please log in or start a trial to view this content.
Protocolo
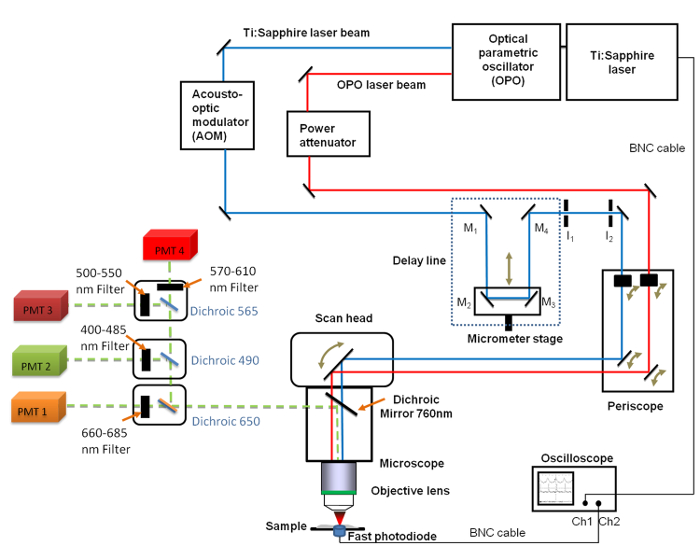
Figura 1. Vista esquemática de la configuración general hasta Incluye el Ti:. Zafiro (680 - 1.080 nm) y el OPO (1.050 - 1.300 nm) láser, la línea de retardo con los 4 espejos (M1 a M4), el osciloscopio rápido, el fotodiodo y dos diafragmas iris fijo I 1 y 2. Espejos M 2 y M 3 se fijan en una etapa de traslación lineal que permite cambiar la longitud de la línea de retardo con una resolución micrométrica. A 660 -. Filtro de paso de banda de 685 nm se coloca delante del tubo fotomultiplicador (PMT) que se utiliza para obtener imágenes CARS Haga clic aquí para ver una versión más grande de esta figura.
1. Puesta en marcha del sistema láser
- Compruebe que el Ti: zafiro longitud de onda está ajustado a 800 nm o definiresta longitud de onda en el Ti: zafiro controlador de fuente de alimentación. Gire la llave del modo de espera en On para encender el Ti: Zafiro láser.
- Encienda el láser OPO en la parte posterior del controlador y abra el OPO Ti: zafiro del obturador en el Ti: zafiro controlador de fuente de alimentación.
- Encender el ordenador tableta para subir el OPO. Haga clic en los iconos OPO Conectado y conectados a distancia en la tableta. Espere a 30 - 40 minutos para calentar.
- Encender el ordenador microscopio y encender los interruptores "Microscopio Componentes". Inicie el software haciendo doble clic en el icono en el escritorio.
- En la pestaña de adquisición de software, abra la herramienta láser en el Administrador de instalación para operar ambos láseres desde el software. Seleccionar Ti: zafiro láser El láser OPO y On. Comprobar el valor de la potencia del láser óptico (valores típicos de 3.700 mW a 800 nm y 700 mW a 1.000 nm).
- Para configurar la trayectoria del haz y el láser,abrir la herramienta de rayo luminoso en el grupo de herramientas para administración de instalación y comprobar la caja del primer tubo fotomultiplicador (PMT).
- Para comprobar el Ti: zafiro punto láser en la salida del objetivo, abrir la herramienta de Canales en el grupo de herramientas de adquisición de parámetros. Seleccione el Ti: el poder de zafiro a valor bajo (alrededor del 1%), reducir la ganancia a 0 (no se necesita ninguna imagen en esta etapa) y haga clic en el botón Continua para iniciar el procedimiento de exploración para lanzar el rayo láser a través del objetivo del microscopio. Compruebe la presencia de una mancha roja por observación directa mediante la colocación de la tarjeta de visualización láser IR a la salida del aire del objetivo del microscopio (10X).
- Para comprobar el punto de láser OPO, detener la exploración del laser de titanio zafiro haciendo clic en el botón Detener. Seleccione el poder OPO a valor bajo en la ventana de Canales y haga clic en la Continuous botón.
2. Configuración del microscopio
- colocar manualmente el espejo dicroico con una longitud de onda de corte a 760 nm en el puerto lateral deslizante en el espacio infinito por encima de la pieza de nariz objetivo de poner en marcha la luz hasta 760 nm de la muestra en los PMT de detección no descanned modo (DDN).
- Ajuste el filtro de paso de banda estrecha a 660 - 685 nm en el cubo reflector DDN frente a PMT1 para registrar sólo las CARS señal a 670 nm para reproducir los resultados presentados en este trabajo.
- Colocar un filtro de banda estrecha de 500 a 550 nm en el cubo reflector NDD delante de pMT3 para la observación de la fluorescencia de la mielina. Coloque un filtro de banda estrecha que van desde 565 a la 610 nm en el cubo reflector delante de pMT4 para la observación de los grupos de autoayuda.
- Para seleccionar en el software de la grabación de la señal en el detector con el filtro de paso de banda especial, abra la herramienta de rayo luminoso en el menú Administrador de instalación en la pestaña de Adquisición. Activar el PMT deseada (casilla de verificación) y seleccione un color para este canal. En este trabajo, el verde fue elegido para coches, para la fluorescencia de color rojo y magenta para los grupos de autoayuda.
3. La sincronización temporal
Nota: Los dos rayos láser se originan de la misma Ti: zafiro láser pero el haz OPO se retrasa cuando se genera de manera que los dos haces no están sincronizados en el tiempo cuando llegan al microscopio. El objetivo aquí es retrasar una de las dos vigas que volver a sincronizar en el tiempo antes de que lleguen al microscopio.
- Conectar con cables BNC del canal de entrada CH1 del osciloscopio a la salida eléctrica láser BNC (Sync. Out). Conectar el canal de entrada CH2 del osciloscopio para el fotodiodo y seleccione el canal CH1 como el canal de disparo pulsando MENU de disparo, entonces el menú principal el botón Fuente y luego el botón de menú lateral que corresponde al canal seleccionado CH1.
- Posición y fijar con postes de montaje ópticos el fotodiodo en el plano focal de un objetivo de microscopio de aire (10 veces), o en la trayectoria del haz del microscopio después de retirar el objetivo. Nota: Si es necesario, retire el condensador y su portador.
- En la herramienta de Canales (grupo herramienta de adquisición de parámetros), definir el Ti: longitud de onda de láser de zafiro a 830 nm a baja potencia (es decir, menos de 1% de la potencia total). En la herramienta de modo de adquisición, reducir el área de escaneado a un punto con el fin de iluminar el fotodiodo con el haz más pequeño. Encienda el escaneo láser haciendo clic en el botón Continua.
- Presione AUTOCONFIGURAR en el panel frontal del osciloscopio y manualmente mover la posición del fotodiodo para obtener los trenes de impulsos en la pantalla. Pulse el botón RUN / STOP para congelar la imagen.
- Para guardar una copia de la pantalla del osciloscopio, inserte un 3,5pulgadas disquete en la unidad de disco o conectar el puerto GPIB en el panel posterior a un ordenador. A continuación, pulse SHIFT MENÚ DE COPIADO, pulse FORMATO (principal) para seleccionar el formato de imagen TIFF y especificar en el menú Puerto del canal de salida. Pulse el botón COPIA IMPRESA para grabar la pantalla del osciloscopio de los trenes de impulsos de Ti: zafiro láser.
- Apagar el Ti: zafiro escaneo láser haciendo clic en el botón Detener. Al hacer clic en la herramienta Canales definir la señal de OPO a 1.107 nm y potencia baja. Encienda el escaneo láser OPO y registrar los trenes de pulsos del láser OPO en el osciloscopio. Apagar el escaneo láser OPO.
- Comparar el desplazamiento temporal entre el Ti: zafiro y las señales OPO.
NOTA: El cambio t desplazamiento temporal da la longitud de la línea de retardo L DelayLine que tiene que ser implementado siguiendo la ecuación: L = c delayLine5; t turno donde c es la velocidad de la luz. - Elija una de las líneas de láser.
NOTA: En este trabajo, el Ti: zafiro línea láser fue elegido porque el espacio libre disponible cerca de esta línea de láser. Además, esta opción permite lograr la realineación de la línea de láser con una luz láser visible. - Abra la línea de láser mediante la eliminación de los tubos de protección en la posición donde se llevará a cabo la línea de retardo.
Precaución! Usar gafas de protección adecuadas y eliminar las pulseras de cadena o ver desde las muñecas. - Seleccione una longitud de onda en el intervalo visible con el fin de poder observar fácilmente el haz de láser (700 nm, por ejemplo, a baja potencia en la herramienta de canales del software). Encienda el escaneo láser.
- Colocar y fijar con los postes de montaje ópticos dos diafragmas iris a lo largo de la línea láser abierta. La posición uno del iris a la salida de la línea de retardo y coloque el otro iris en la entrada del periscopio.
NOTA: El PEcontroles riscope por dos espejos motorizados pilotados por el software el ángulo de entrada del haz de láser en la cabeza de exploración del microscopio de exploración láser. - Disminuir la apertura del diafragma iris y ajustar las posiciones de diafragma para adaptarse a la trayectoria del rayo láser. Fijarlos sobre la mesa óptica. Ajustar la posición vertical de tercera diafragma iris móvil, para comprobar la altura del haz de láser, mientras que, sucesivamente, el posicionamiento de los cuatro espejos de la línea de retardo.
NOTA: Estos diafragmas iris servirán como control para el procedimiento de realineación, mostrando el camino a seguir. - Coloque el espejo M1 montado en un espejo cinemática compacto de montaje en la entrada de la línea de retardo (como se muestra en la Figura 1) y ajustar su posición y su orientación para mantener la altura del haz con el uso de la iris diafragma móvil. Colocar espejos M2 y M3 (también montados sobre soportes de los espejos cinemáticas compactos) a 90 ° en la etapa de traducción, que se coloca en Midcourse. La posición de ellos para adaptarse a la longitud de la línea de retardo calculado previamente.
- Ajuste la orientación de M2 y M3 con el uso de la iris diafragma móvil. Establecer M4 (también fija en un montaje compacto) a la salida de la línea de retardo (justo antes de iris I 1 como se muestra en la Figura 1) y cuidadosamente ajustar su posición y el ángulo para adaptarse a la trayectoria del haz láser a través de los dos diafragmas iris fijos.
- Coloque la tarjeta de visualización láser a la salida del objetivo del microscopio y comprobar el perfil de rayo láser haciendo clic en continuo para activar el escaneo láser. Observar un disco brillante uniforme. Si es necesario, ajuste ligeramente la orientación del M4.
- Posición de nuevo el fotodiodo rápido bajo el haz de láser en el plano de enfoque de la muestra del microscopio. Observar el desplazamiento temporal entre el Ti: zafiro rayo láser y el haz OPO en el osciloscopio.
Nota: Si es necesario, cambiar la longitud de la línea de retardo moviendo todo el sistema M2, M3 montado en eletapa de traducción (sin cambiar la afinación etapa de traducción) para sincronizar los dos pulsos. Los cambios de unos pocos centímetros pueden ser requeridos.
4. La superposición espacial de los haces
Nota: Para producir una señal CARS, se requiere el solapamiento espacial de los dos rayos láser. La iluminación alternativa de ambos haces en las mismas perlas teñidas en todo con dos colorantes fluorescentes diferentes se puede utilizar para indicar el desplazamiento espacial. Los ajustes de precisión de las posiciones de los espejos se pueden reducir al mínimo el desplazamiento.
- El uso de pre-montado microesferas fluorescentes. O montar microesferas en suspensión en portaobjetos de microscopio limpios, como se describe a continuación:
- Antes del muestreo, mezcla (en un mezclador de la corteza o por sonicación) la solución de perlas para asegurarse de que las perlas se suspenden uniformemente.
- Aplicar 5 l de la suspensión de perlas a la superficie de un portaobjetos y se extiende con la punta de pipeta. Espere a que la gotita para secar y luego aplicar 5 l de montajeing medio, tal como glicerol, agua o aceite de inmersión sobre la muestra en seco de los granos. Cubrir la muestra con un cubreobjetos y sellar el cubreobjetos con pegamento de secado rápido o parafina derretida.
- Colocar las perlas de poliestireno fluorescentes fijadas en un portaobjetos bajo el agua objetivo 20X. Añadir unas gotas de agua para sumergir el objetivo.
- Para lograr el enfoque sobre las perlas, abra la pestaña Localizar en el software para cambiar del modo de escaneo láser para la observación directa de la muestra con el ojo, pulsando el botón Online. Abra la herramienta ocular para seleccionar el filtro especial y encender la lámpara halógena haciendo clic en los iconos.
- quitar manualmente el espejo dicroico en el control deslizante puerto lateral en el espacio infinito y utilizar el mando de enfoque del microscopio para enfocar el plano de la muestra mediante la observación de las perlas con los oculares. Vuelva a colocar el espejo dicroico.
- En elPestaña localizar, cambiar al modo de escaneo láser pulsando el botón de conexión. Ir a la ficha Adquisición de definir los parámetros para escanear: seleccione el tamaño de la trama de 512 píxeles, una velocidad de barrido de 9, promediar los 1, una profundidad de bits de 8 bits y aumentar el área de escaneado al máximo.
- En la herramienta de Canales de la ficha Adquisición, añadir una pista (pista 1) si no se ha creado. Seleccionar la longitud de onda a 830 nm y baja potencia para el Ti:. Rayo láser de zafiro Marque el color a verde en el cuadro de la pista 1 de la ventana de Canales y en el pMT3 o en el cuadro pMT4 desde la ventana Light Path.
- En la herramienta de Canales de la ficha Adquisición, agregar una segunda pista (pista 2). Seleccione la longitud de onda a 1.107 nm y potencia baja para el rayo láser OPO. Marque el color a rojo en el cuadro de la pista 2 de la ventana de Canales y en el cuadro de la pMT3 ventana Ruta de la Luz.
- Ajustar la ganancia de ambas pistas a 600. A continuación, aplicar secuencialmente la exploración de los dos haces sobre la muestra haciendo clic en continuo.
- Observar la imagen en el área de la pantalla en la vista 2D. En la vista de pantalla de bloque de control de opción, ajustar la intensidad de la pantalla.
Nota: Si es necesario, mueva ligeramente el mando de enfoque para encontrar el plano de enfoque de las perlas. Ajuste del cultivo y ampliar la imagen en una sola cuenta o en un grupo de bloques adyacentes. - Utilice el controlador de periscopio para solapar las vigas en el plano xy. En el software, abra la ficha de mantener. Haga clic en las opciones del sistema y mostrar la ventana de la herramienta motorizada de periscopio. Utilice ajustes gruesos y finos de los espejos periscopio del Ti: zafiro rayo láser con el fin de sincronizar en el espacio las dos imágenes.
- Para la manipulación de periscopio, utilice las primeras barras de ajuste vertical y para el Second uno de los movimientos horizontales del haz de láser. Mover la viga con el espejo de entrada hasta que la imagen es ligeramente visible, y luego compensar la intensidad del láser con el espejo de salida del periscopio haciendo clic en "entrada" y "salida".
- Con el fin de se superponen verticalmente las vigas, en la pestaña de Mantener, abrir la herramienta de colimador y ajustar el valor de la distancia focal de la Ti: haz láser de zafiro.
- Mueva suavemente la posición vertical objetivo de comprobar la diferencia de enfoque en ambas imágenes. O bien, tomar un z-pila de la muestra mediante la apertura de la ficha Adquisición de la herramienta Z-Stack y elegir los diferentes parámetros (rango, número de rebanadas). Presione Ortho en el área de la pantalla en la imagen para ver las vigas en sección transversal axial. Maximizar el z-solapamiento haciendo el mismo procedimiento varias veces.
5. Los ajustes finales y coherente de lucha contra la dispersión Raman Stokes (CARS) de la señal de observación del Aceite de Oliva Dr.oplets
- Ponga una gota de aceite de oliva en una placa de vidrio y se cubre con una cubierta de vidrio deslizante. Añadir unas gotas de agua para sumergir a un objetivo de inmersión en agua 20X. Centrarse en el borde de la hoja de la cubierta mediante el uso de los oculares (como se ha explicado anteriormente en el punto 4.2).
- En la herramienta de Canales de la ficha Adquisición, seleccione en la pista 1 la longitud de onda a 830 nm para el Ti: zafiro y rayo láser a 1.107 nm para el OPO. Marque los dos láseres en la pista 1 para obtener un análisis simultáneo de ambos láseres. Set poderes a valor bajo para un comienzo.
- En la ventana Light Path, seleccione PMT1. Encienda los escáneres láser haciendo clic en el botón Continua. Mueva ligeramente el foco para entregar la luz láser en la capa delgada de aceite.
- Si es necesario, aumentar la potencia óptica de ambos láseres. Ajustar la intensidad de la pantalla en la visualización de pantalla de bloque de control de opción. Mueva lentamente la etapa de traducción de la línea de retardo hasta que la señal se convierte en sigsignificativamente mejorada.
- Después de que las alineaciones son finas completa, comprobar si es realmente una señal CARS: Mover ligeramente la etapa de traducción; la intensidad de la señal debe ser más débil. Y / o apagar uno del rayo láser, ya sea Ti: zafiro o láser OPO. Una vez más debe haber un fuerte deterioro en intensidad en comparación con la señal CARS.
- Para lograr la máxima señal CARS, seleccione la opción en el software para proporcionar un valor de la intensidad media de toda la imagen (en la vista de la ficha Histo área de la pantalla). Ajustar la longitud de onda (nm pocos), entonces las x, y, z posiciones del haz de enfoque para maximizar el valor de intensidad media.
6. Recinto de la trayectoria de luz de la línea de retardo
- Dado que el sistema final está dedicado a los no-físicos, encerrar la trayectoria de la luz de la línea de retardo con tubos o una caja acústica, para evitar el acceso directo a alto pico de potencia rayo láser no visible perjudicial. Tenga cuidado para proporcionar un acceso a la etapa de traducciónnudo.
7. Longitud de onda de sintonización para CARS
- Use la ecuación
 para sintonizar las longitudes de onda de láser a la vibración Raman deseada. Para reproducir los resultados presentados en este trabajo para CARS imagen Señal de enlaces CH tienen la vibración de estiramiento de 3015 cm-1, seleccione λ Ti: zafiro = 830 nm y λ = 1,095 nm OPO.
para sintonizar las longitudes de onda de láser a la vibración Raman deseada. Para reproducir los resultados presentados en este trabajo para CARS imagen Señal de enlaces CH tienen la vibración de estiramiento de 3015 cm-1, seleccione λ Ti: zafiro = 830 nm y λ = 1,095 nm OPO.
NOTA: frecuencias vibratorias característicos Raman observadas en muestras biológicas, tales como agua, CH enlace se puede encontrar en Evans et al 13 o en Ellis et al 29... - Use la ecuación
 para determinar la longitud de onda de emisión de la señal CARS. Para CH imágenes de bonos por los coches, elige un filtro de banda estrecha a 670 nm ya que los coches lambda = 670 nm con longitudes de onda láser presenta en 7.1.
para determinar la longitud de onda de emisión de la señal CARS. Para CH imágenes de bonos por los coches, elige un filtro de banda estrecha a 670 nm ya que los coches lambda = 670 nm con longitudes de onda láser presenta en 7.1.
NOTA: Una aplicación de telefonía móvil es available para el cálculo lambda de CARS λ λ P y S valores (véase la referencia 30).
8. Observación de CARS de la Señal y manchado mielina del nervio ciático Cortes
Nota: Todos los experimentos con animales se realizaron de conformidad con las normas institucionales.
- Preparar los cortes del nervio ciático axiales y longitudinales sobre un portaobjetos de microscopio como se presenta en Ozcelik et al. 31.
- Preparar la solución de tinción con rojo fluoromyelin por dilución de la solución madre de 300 veces en PBS. Inundar los cortes nerviosos con la solución de tinción durante 20 minutos a temperatura ambiente. Retire la solución y lavar 3 veces durante 10 minutos con PBS.
- Coloque los recortes en el marco del objetivo de inmersión en agua 20X. Colocar un cubreobjetos. Añadir unas gotas de PBS para sumergir el objetivo y ajustar el enfoque del objetivo para obtener una imagen clara de los cortes a través de los oculares (como se detalla anteriormente en 4.2).
- En la pista 1, seleccionar el Ti: zafiro y el OPO láseres y definir sus longitudes de onda de 830 nm y 1.095 nm, respectivamente. En la ventana Light Path, seleccione PMT1 y color verde.
- En la pista 2, seleccione el láser OPO solamente (longitud de onda a 1.095 nm). En la ventana Light Path, seleccione pMT4 y color rojo.
- Para ambos láseres, seleccione baja potencia y ajustar la ganancia de 600 para empezar. Encender los escáneres láser y ajustar los parámetros siguientes para mejorar los coches y la señal de fluorescencia contrasta: valores de potencia, mando etapa de traducción (muy poco), longitudes de onda (nm), pocos intensidad de la pantalla.
- Para grabar imágenes finales en alta resolución, seleccione la herramienta en modo de adquisición de los siguientes parámetros: tamaño de bastidor de 1.024 píxeles, velocidad de escaneo de 7, con un promedio de 4. Haga clic en el botón Snap para grabar una sola imagen. Guarda la imagen en forma exclusivaal grabar la imagen y los parámetros de adquisición completos.
9. Observación de coches y señales de los grupos de autoayuda de los recortes del nervio ciático
- Preparar el nervio ciático como se presenta en Özcelik et al. 31.
- Siga el procedimiento que se explica en parte 8 para obtener una imagen a través de los oculares y para seleccionar CARS parámetro de señal (pista 1).
- En la pista 2, seleccione el láser OPO solamente (longitud de onda de 1095 nm). En la ventana Light Path, seleccione pMT3 y el color magenta.
- Siga el procedimiento que se explica en parte 8 para activar los escáneres láser y guardar las imágenes de alta resolución.
Access restricted. Please log in or start a trial to view this content.
Resultados
La frecuencia de los trenes de impulsos de Ti estándar: láser de zafiro es típicamente alrededor de 80 MHz. La OPO tiene la misma frecuencia, ya que se bombea por el Ti: Zafiro láser. por lo tanto, se requiere un osciloscopio rápido de al menos 200 MHz. Un fotodiodo rápido en el rango también se requiere de 600 a 1.100 nm. El desplazamiento temporal máxima se produce cuando el Ti: las señales OPO zafiro y se desplazan de 1 / (2 × 80 × 10 6) = 6,2 nanosegundos....
Access restricted. Please log in or start a trial to view this content.
Discusión
La parte más difícil del trabajo es la sincronización temporal de los rayos láser. Se requiere un fotodiodo rápido combinado con un osciloscopio rápido, pero sólo una superposición aproximada en el tiempo se puede realizar a primera. A continuación, se requiere un ajuste adicional de unos pocos centímetros. Por último, micrómetro se mueve por una etapa de traslación lineal permite realizar el ajuste fino final de la longitud de la línea de retardo con el fin de desencadenar la señal CARS. Esta señal se m...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
The authors want to thank Dr. Philippe Combette (IES, UM, Montpellier, France) for the loan of the fast oscilloscope and acknowledge financial supports from Montpellier RIO Imaging (MRI). HR acknowledges ANR grants France Bio Imaging (ANR-10-INSB-04-01) and France Life Imaging (ANR-11-INSB-0006) infrastructure networks for coherent Raman imaging developments. This work was mainly supported by an European Research Council grant (FP7-IDEAS-ERC 311610) and an INSERM - AVENIR grant to NT.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Oscilloscope | Tektronix | TDS 520D | 500 MHz |
| Photodetector | Thorlabs | DET08C/M, T4290 | 5 GHz InGaAs, 800 - 1,700 nm |
| Ti:Sapphire laser Chameleon Ultra Family II | Coherent | ||
| Optical parametric oscillator OPO Compact Family | APE Berlin | ||
| Axio Examiner microscope LSM 7 MP | Carl Zeiss | ||
| Motorized periscope | Newport | ||
| Objective W Plan-Apochromat 20X/1.0 | Carl Zeiss | ||
| Beam combiner | Carl Zeiss | ||
| Acousto-optic modulator | Carl Zeiss | ||
| OPO power attenuator | Carl Zeiss | ||
| Photomultiplier tube | Carl Zeiss | ||
| ZEN software | Carl Zeiss | ||
| Bandpass filters | Carl Zeiss | LSM BiG 1935-176 | 400 - 480 nm; 500 - 550 nm; 465 - 610 nm |
| Dichroic mirror | Carl Zeiss | Cutoff wavelength 760 nm | |
| Silver mirrors | Newport | 10D20ER.2 | λ/10, 480 - 20,000 nm, Quantity 4 |
| Single-axis translation stage with standard micrometer | Thorlabs | PT1/M | Quantity 1 |
| Aluminium breadboard | Thorlabs | MB1015/M | Quantity 1 |
| Mirror mount | Thorlabs | KMSS/M | Quantity 4 |
| Mirror holder for Ø1" Optics | Thorlabs | MH25 | Quantity 4 |
| Iris diaphragms | Thorlabs | ID8/M | Quantity 3 |
| Protective box | Thorlabs | TB4, XE25L900/M, T205-1.0, RM1S | Quantity 1 |
| Optical posts | Thorlabs | TR40/M, PH50/M, PH75/M, BA2/M | Quantity 8 (lengths depending on the set-up) |
| 661 - 690 nm bandpass filter | Semrock | 676/29 nm BrightLine® single-band bandpass filter | Quantity 1 |
| Fluorescent beads | ThermoFisher | TetraSpeck™ Fluorescent Microspheres Size Kit | |
| Laser viewing card | Thorlabs | IR laser viewing card | |
| Laser safety glass | Newport | LV-F22.P5L07 | |
| FluoroMyelin™ Red Fluorescent Myelin Stain | ThermoFisher | F34652 |
Referencias
- Valeur, B., Berberan-Santos, M. N. Molecular Fluorescence: Principles and Applications. , 2nd Edition, Wiley-VCH Verlag GmbH. (2012).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Moreaux, L., Sandre, O., Mertz, J. Membrane imaging by second-harmonic generation microscopy. JOSA B. 17 (10), 1685-1694 (2000).
- Zoumi, A., Yeh, A., Tromberg, B. J. Imaging cells and extracellular matrix in vivo by using second-harmonic generation and two-photon excited fluorescence. Proc. Natl. Acad. Sci. USA. 99 (17), 11014-11019 (2002).
- Yelin, D., Silberberg, Y. Laser scanning third-harmonic-generation microscopy in biology. Opt. Express. 5 (8), 169-175 (1999).
- Campagnola, P. J., Millard, A. C., Terasaki, M., Hoppe, P. E., Malone, C. J., Mohler, W. A. Three-dimensional high-resolution Second-Harmonic Generation imaging of endogenous structural proteins in biological tissues. Biophys. J. 81 (1), 493-508 (2002).
- Olivier, N., et al. Cell lineage reconstruction of early zebrafish embryos using label-free nonlinear microscopy. Science. 329 (5994), 967-971 (2010).
- Farrar, M. J., Wise, F. W., Fetcho, J. R., Schaffer, C. B. In vivo imaging of myelin in the vertebrate central nervous system using third harmonic generation microscopy. Biophys. J. 100 (5), 1362-1371 (2011).
- Lim, H., Sharoukhov, D., Kassim, L., Zhang, Y., Salzer, J. L., Melendez-Vasquez, C. V. Label-free imaging of Schwann cell myelination by third harmonic generation microscopy. Proc. Natl. Acad. Sci. U.S.A. 111 (50), 18025-18030 (2014).
- Strupler, M., Pena, A. M., Hernest, M., Tharaux, P. L., Martin, J. L., Beaurepaire, E., Schanne-Klein, M. C. Second harmonic imaging and scoring of collagen in fibrotic tissues. Opt. Express. 15 (7), 4054-4065 (2007).
- Cheng, J. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: Instrumentation, theory, and applications. J. Phys. Chem. B. 108 (3), 827-840 (2004).
- Volkmer, A. Vibrational imaging and microspectroscopies based on coherent anti-Stokes scattering microscopy. J. Phys. D: Appl. Phys. 38, R59-R81 (2005).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annu. Rev. Anal. Chem. 1, 883-909 (2008).
- Mukamel, S. Principles of nonlinear optical spectroscopy. , Oxford University Press. New York. (1995).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Opt. Lett. 7 (8), 350-352 (1982).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Phys. Rev. Lett. 82 (20), 4142-4145 (1999).
- Folick, A., Min, W., Wang, M. C. Label-free imaging of lipid dynamics using Coherent Anti-Stokes Raman Scattering (CARS) and Stimulated Raman Scattering (SRS) microscopy. Curr. Opin. Genet. Dev. 21 (5), 585-590 (2011).
- Wang, P., Liu, B., Zhang, D., Belew, M. Y., Tissenbaum, H. A., Cheng, J. X. Imaging lipid metabolism in live Caenorhabditis elegans using fingerprint vibrations. Angew. Chem. Int. Ed. Engl. 53 (44), 11787-11792 (2014).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Cheng, J. X., Jia, Y. K., Zheng, G., Xie, X. S. Laser-scanning coherent anti-Stokes Raman scattering microscopy and applications to cell biology. Biophys J. 83 (1), 502-509 (2002).
- Chiu, W. S., Belsey, N. A. N., Garrett, L., Moger, J., Delgado-Charro, M. B., Guy, R. H. Molecular diffusion in the human nail measured by stimulated Raman scattering microscopy. Proc Natl. Acad. Sci. U.S.A. 112, 7725-7730 (2015).
- Chen, X., Grégoire, S., Formanek, F., Galey, J. -B., Rigneault, H. Quantitative 3D molecular cutaneous absorption in human skin using label free nonlinear microscopy. J. of Control. Release. 200, 78-86 (2015).
- Kano, H., Hamaguchi, H. In vivo multi-nonlinear optical imaging of a living cell using a supercontinuum light source generated from a photonic crystal fiber. Opt. Express. 14 (7), 2798-2804 (2006).
- Brustlein, S., Ferrand, P., Walther, N., Brasselet, S., Billaudeau, C., Marguet, D., Rigneault, H. Optical parametric oscillator-based light source for coherent Raman scattering microscopy: practical overview. J. Biomed. Opt. 16 (2), 021106(2011).
- Chen, H., et al. A multimodal platform for nonlinear optical microscopy and microspectroscopy. Opt. Express. 17 (3), 1282-1290 (2009).
- Yue, S., Slipchenko, M. N., Cheng, J. X. Multimodal nonlinear optical microscopy. Laser Photonics Rev. 5 (4), 496-512 (2011).
- Sun, Q., Li, Y., He, S., Situ, C., Wu, Z., Qu, J. Y. Label-free multimodal nonlinear optical microscopy reveals fundamental insights of skeletal muscle development. Biomed Opt Express. 5 (1), 158-166 (2013).
- Le, T. T., Langohr, I. M., Locker, M. J., Sturek, M., Cheng, J. X. Label-free molecular imaging of atherosclerotic lesions using multimodal nonlinear optical microscopy. J. Biomed. Opt. 12 (5), 054007(2007).
- Ellis, D. I., Cowcher, D. P., Ashton, L., O'Hagana, S., Goodacre, R. Illuminating disease and enlightening biomedicine: Raman spectroscopy as a diagnostic tool. Analyst. 138, 3871-3884 (2013).
- A•P•E Angewandte Physik & Elektronik GmbH. , Germany. Available from: http://www.ape-berlin.de/en/page/calculator (2015).
- Ozçelik, M., et al. Pals1 is a major regulator of the epithelial-like polarization and the extension of the myelin sheath in peripheral nerves. J Neurosci. 30 (11), 4120-4131 (2010).
- Heinrich, C., Hofer, A., Ritsch, A., Ciardi, C., Bernet, S., Ritsch-Marte, M. Selective imaging of saturated and unsaturated lipids by wide-field CARS-microscopy. Opt. Express. 16 (4), 2699-2708 (2008).
- Kyriakidis, N. B., Skarkalis, P. Fluorescence spectra measurement of olive oil and other vegetable oils. J. AOAC Int. 83 (6), 1435-1439 (2000).
- King, R. Microscopic anatomy: normal structure. Handb. Clin. Neurol. 115, 7-27 (2013).
- Monsma, P. C., Brown, A. FluoroMyelin Red is a bright, photostable and non-toxic fluorescent stain for live imaging of myelin. J. Neurosci. Methods. 209 (2), 344-350 (2012).
- Wang, H., Fu, Y., Zickmund, P., Shi, R., Cheng, J. X. Coherent anti-stokes Raman scattering imaging of axonal myelin in live spinal tissues. Biophys. J. 89 (1), 581-591 (2005).
- Wang, H. W., Fu, Y., Huff, T. B., Le, T. T., Wang, H., Cheng, J. X. Chasing lipids in health and diseases by coherent anti-Stokes Raman scattering microscopy. Vib. Spectrosc. 50 (1), 160-167 (2009).
- Jung, Y., Tam, J., Jalian, H. R., Anderson, R. R., Evans, C. L. Longitudinal, 3D in vivo imaging of sebaceous glands by coherent anti-stokes Raman scattering microscopy: normal function and response to cryotherapy. J. Invest. Dermatol. 135 (1), 39-44 (2015).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados