Method Article
Un protocolo detallado para la caracterización de la línea celular murina C1498 y su modelo asociado de leucemia de ratón
En este artículo
Resumen
Este manuscrito proporciona un procedimiento técnico que puede ser utilizado para caracterizar los cultivos de células C1498 in vitro y la leucemia aguda inducida en ratones después de su inyección. Los análisis fenotípicos y funcionales se realizan mediante citometría de flujo, microscopía de inmunofluorescencia, y la tinción citoquímica de May-Grünwald Giemsa.
Resumen
La inyección intravenosa de C1498 células en ratones singénicos o congenic se ha realizado desde 1941. Estas inyecciones resultar en el desarrollo de la leucemia aguda. Sin embargo, la naturaleza de esta enfermedad no ha sido bien documentado en la literatura. Aquí, proporcionamos un protocolo técnico para la caracterización de las células C1498 in vitro y para determinar la naturaleza de la leucemia inducida in vivo. La primera parte de este procedimiento se centra en la determinación del linaje hematopoyético y la etapa de diferenciación de las células C1498 cultivadas. Para lograr esto, multi-paramétrico tinción de citometría de flujo se utiliza para detectar los marcadores de células hematopoyéticas. La inmunofluorescencia, citoquímica y una tinción de May-Grünwald Giemsa se realizan a continuación, para evaluar la expresión de la mieloperoxidasa, la actividad de esterasas y morfología celular, respectivamente. La segunda parte de este protocolo está dedicado a la descripción de la enfermedad de la leucemia que se induce envivo. Este último se puede lograr mediante la determinación de las frecuencias de células leucémicas e inherentes en la sangre, los órganos hematopoyéticos (por ejemplo, médula ósea y bazo) y tejidos no linfoides (por ejemplo, el hígado y los pulmones) mediante tinción específica y citometría de flujo análisis. La naturaleza de la leucemia luego se confirmó mediante la tinción de May-Grünwald Giemsa y tinción para esterasas específicas en la médula ósea. A continuación, presentamos los resultados que se obtuvieron usando este protocolo en ratones inyectados con PBS C1498- y de la misma edad.
Introducción
leucemia mieloide aguda (AML) se caracteriza por la proliferación incontrolada de células mieloides hematopoyéticas que están bloqueados en las diferentes etapas de maduración. Esta desregulación puede afectar a la granulocítica, monocítica, eritrocítica o vías de diferenciación megaryocytic 1. células de AML se acumulan en la médula ósea, que conduce a la hematopoyesis alterada, lo que resulta en trombopenia, linfopenia y anemia. Las células leucémicas también invaden la sangre y los órganos no linfoides.
El modelo C1498 ratón ha sido utilizado durante décadas como un modelo para la leucemia aguda puesto que las células cancerosas se aislaron a partir de un 10 meses de edad, hembra de ratón leucémica C57BL / 6 (H-2 b) en 1941. La literatura describe la invasión en la sangre , órganos hematopoyéticos (por ejemplo, el bazo y los ganglios linfáticos) y los órganos no hematopoyéticas (por ejemplo, el hígado, los pulmones, los ovarios y riñones) por las células C1498 altamente proliferativas después de que fueron inyectados a través de una deintravenosa, subcutánea o vía intra-peritoneal en ratones susceptibles 2-4. Sin embargo, se informó este modelo de ratón para inducir o bien granulocítica 2,5 o 6 mielomonocítica leucemia. Más recientemente, un estudio publicado en 2002 describe este tipo de cáncer como la leucemia de células NKT murino 7. De este modo, la literatura difiere respecto a la naturaleza de esta línea celular C1498 y la leucemia asociada induce en ratones. Estas discrepancias se deben principalmente a la falta de información detallada y actualizada publicada sobre las células leucémicas y la enfermedad, en general, debido a que muchos estudios se realizaron en los años 1950 - 70.
Aquí se proporciona un protocolo detallado para describir cómo caracterizar células C1498 y analizar la naturaleza de la enfermedad leucémica que es inducido por su inyección intravenosa en ratones. La primera sección de este protocolo se dedica a una descripción de las células C1498 que han sido cultivadas in vitro. contra fluorescentecuerpos dirigidos contra la superficie y marcadores hematopoyéticos intracelulares se utilizaron para determinar su fenotipo mediante citometría de flujo. La presencia de mieloperoxidasa se evaluó mediante microscopía de inmunofluorescencia, su etapa de linaje y diferenciación hematopoyética se evaluaron usando citoquímica para evaluar la actividad de las esterasas, y se realizó la tinción de May-Grünwald Giemsa. Las células C1498 se inyectan en ratones, y la enfermedad de leucemia aguda que fue inducida se describe en la segunda sección de este manuscrito. Se utilizaron las mismas técnicas para determinar las frecuencias y los fenotipos de las células leucémicas y inherentes en la médula ósea, la sangre periférica, el bazo y los órganos no hematopoyéticas (el hígado y los pulmones).
Este protocolo es altamente reproducible, y los datos presentados aquí ayudará a los investigadores a evaluar los efectos de nuevas estrategias terapéuticas. Este modelo de leucemia de ratón ya se ha utilizado para probar la inmunoterapia se acerca a unand diferentes fármacos quimioterapéuticos del cáncer 8,9. Su eficacia se evaluó mediante la determinación de la evolución de la carga tumoral y las tasas de supervivencia. Este protocolo se puede utilizar para proporcionar información adicional acerca de la distribución y la subsistencia de las poblaciones de células hematopoyéticas leucémicas y otros durante el tratamiento.
Protocolo
Alojamiento de animales y todos los procedimientos experimentales fueron aprobados por el Comité de Ética Animal Care locales, CEEA.NPDC (no.512012 acuerdo), y todos los experimentos se realizaron de acuerdo con las directrices francesas y europeas para el Cuidado y Uso de Animales de Laboratorio.
1. caracterización in vitro de la línea celular C1498
- El cultivo in vitro de las células C1498
- Preparar completo RPMI (Roswell Park Memorial Institute) 1640 mediante la adición de 50 ml de suero bovino fetal (FBS), 5 ml de penicilina (100 U / ml) -streptomycin (100 g / ml), 500 l de 50 mM β-mercaptoetanol , 5 ml de N-2-hidroxietilpiperazina-N-2-etano sulfónico (HEPES), 5 ml de aminoácidos no esenciales y 5 ml de piruvato de sodio a 500 ml de medio RPMI.
- Crecer la línea celular C1498 en RPMI completo. Recoger las células en suspensión mediante pipeteo, y transferir las células a un tubo de 50 ml. Centrifugar a 350 xg durante 10 minutos, y retirar el supernatante.
- Añadir 20 ml de solución salina tamponada con fosfato (PBS) (1x) solución, centrifugar a 350 g durante 10 min, y se elimina el sobrenadante.
- Resuspender las células en 10 ml de tampón clasificador de células activado por fluorescencia (FACS) (2,5 g de albúmina de suero bovino en polvo (BSA) y 2 ml de solución 0,5 M de ácido etilendiaminotetraacético (EDTA) en 500 ml de solución de PBS). Contar las células por medio de una célula de Thoma cámara de recuento después de teñir las células con azul de tripano.
- Caracterización fenotípica de la línea celular C1498 usando inmunotinción y citometría de flujo análisis
- tinción de la superficie celular
- Preparar tampón FACS.
- Ajustar las células recogidas en tampón FACS a 10 7 células / ml y dispensar 10 6 células (en 100 l) para cada experimento de tinción de citometría de flujo en los tubos.
- Marcar las células con 100 l de los siguientes anticuerpos o sus controles de isotipo asociados diluidos en tampón FACS:
- para markers de precursores y células diferenciadas, marcar las células con anticuerpos anti-CD11b / CD18 anti-(1), anti-Ly-6G (1), anti-CD19, anti-B220 (2), anti-NK1.1, anti- CD49b, anti-CD4 (1), anti-CD8 (2), anti-CD3 (3), anti-CD21 / 35, anticuerpos anti-CD115 y anti-TCRVβ.
- Para los marcadores de células madre / progenitoras hematopoyéticas, utilizar una combinación de anti-CD34 / anti-CD117 / anti-Sca-1, anti-CD150 / anti-CD117 / anti-Sca-1, anti-CD117 / anti-CD127 o anti- CD16 anticuerpos / 32-biotina sola.
- Para los marcadores de las funciones celulares (por ejemplo, la adhesión, la presentación de antígenos, moléculas coestimuladoras y receptores), teñir las células con anti-CD18 (2) / anti-CD11a, anti-MHC de clase I, anti-MHC clase II, anti- CD31, anti-CD44, anti-CD80-biotina, anti-CD86, y anti-CD274 anticuerpos.
- Incubar toda la citometría de flujo tubos a 4 ° C durante 30 min.
- Lavar las células dos veces mediante la adición de 2 ml de tampón de FACS para cada tubo de centrífuga, a 350 xg durante 5 min, y eliminar el sobrenadante.
- Añadir 100 l de tampón FACS a cada tubo y proceder a la tinción secundaria mediante la adición de 100 l de estreptavidina fluorescente (1/100 en tampón FACS para una dilución final de 1/200) a los anticuerpos con biotina conjugados. Incubar los tubos a 4 ° C durante 30 min.
- Lavar las células dos veces de la siguiente manera: añadir 2 ml de tampón FACS a cada tubo, centrifugar los tubos a 350 xg durante 5 min, y eliminar el sobrenadante mediante pipeteo.
- Resuspender las células en 500 l de PBS frío y colocar las células en hielo, manteniéndolos en la oscuridad mediante el uso de papel de aluminio para cubrir los tubos. Analizar los resultados utilizando un citómetro de 10.
- tinción intracelular
- Preparar tampón de fijación mediante la adición de 125 ml de una solución de 4% de paraformaldehído (PFA) a 375 ml de solución de PBS.
NOTA: Para preparar 500 ml de 4% PFA, calor 400 ml de solución de PBS a aproximadamente 60 ° C en una placa de agitación en una campana ventilada. Añadir 20 g de polvo de PFA, y elevar el pHhasta que se disuelva la PFA. Deje que la solución se enfríe, ajustar el pH a 6,9, y completar el volumen hasta 500 ml con PBS. - Preparar el tampón de permeabilización mediante la adición de 0,5 g de saponina y 0,5 g de BSA a 500 ml de solución de PBS.
- Ajustar las células recogidas en tampón FACS a 10 7 células / ml y distribuir 10 6 de las células (100 l) para cada experimento de tinción de citometría de flujo en los tubos. Centrifugar las células a 350 xg durante 5 min, y se elimina el sobrenadante.
- Fijar las células en 200 l de solución de PFA al 1% y se incuba durante 10 minutos a 4 ° C.
- Añadir 2 ml de tampón de permeabilización a cada tubo, los tubos de centrifugación a 350 xg durante 5 minutos, y retirar el sobrenadante con la pipeta. Añadir 100 l de tampón de permeabilización a cada tubo.
- Marcar las células con 100 l de los siguientes anticuerpos o sus controles de isotipo correspondientes después de diluirlos en tampón de permeabilización: anti-CD3 (2) / anti-CD8 (1), anti-CD3 (3) / anti-CD4 (2), anti-CD107b y anti-CD3 (3) / anti-TCRVβ.
- Se incuban las células a 4 ° C durante 30 min.
- Lavar las células dos veces mediante la adición de 2 ml de tampón de permeabilización a cada tubo. Centrifugar los tubos a 350 xg durante 5 min, y se elimina el sobrenadante.
- Añadir 100 l de tampón de permeabilización a las células. Proceder a la tinción secundaria mediante la adición de 100 l de estreptavidina fluorescente diluido en tampón de permeabilización de anticuerpos con biotina conjugados. Incubar los tubos a 4 ° C durante 30 min.
- Añadir 2 ml de tampón de permeabilización a cada tubo, centrifugar los tubos a 350 xg durante 5 min, y se elimina el sobrenadante. Repita este paso una vez más.
- Resuspender las células en 500 l de PBS frío, y luego colocar las células en hielo en la oscuridad. Analizar los resultados utilizando un citómetro de flujo 10.
- Preparar tampón de fijación mediante la adición de 125 ml de una solución de 4% de paraformaldehído (PFA) a 375 ml de solución de PBS.
- tinción de la superficie celular
- Preparación de una suspensión de células en portaobjetos para microscopía
- Lavar 10 6 del jacélulas rvested C1498 (obtenidos en la etapa 1.1.4) con 5 ml de tampón FACS frío dos veces, y se diluyen las células en 1 ml de tampón FACS frío. Colocar los tubos en hielo.
- Colocar los portaobjetos en cámaras desechables con filtros de tarjetas pre-adjunto y colocarlos en una cytocentrifuge.
- Añadir 100 l de tampón FACS para cada tarjeta de cámara y el filtro, y hacerlos girar durante 2 min a 4,52 x g.
- Añadir 100 l de células a cada tarjeta de cámara y el filtro, y hacer girar las células a 4,52 × g durante 2 min.
- Retirar con cuidado las diapositivas de las cámaras de aire y Secar los portaobjetos antes de la tinción con mieloperoxidasa (paso 1.4), esterasas (paso 1.5) o de May-Grünwald Giemsa (paso 1.6).
- tinción mieloperoxidasa para inmunofluorescencia
- Fijar las células en los portaobjetos mediante la inmersión de los portaobjetos en una mezcla de metanol frío: acetona (1: 1) solución durante 2 minutos, y luego secar al aire el portaobjetos.
- Para confinar el líquido a la superficie de la diapositiva que contiene las células, dibujar una circle alrededor de las células por medio de una pluma que repele el agua.
- Enjuagar las células en 200 l de solución de PBS frío durante 10 min.
- Bloquear las células en 200 l de tampón de BSA 3% / PBS que contiene 10 l de suero normal de burro y 10 g / ml de anti-CD16 purificadas anticuerpos / 32.
- Aplicar 200 l de la mieloperoxidasa anti-ratón (diluido a 20 mg / ml en BSA tampón 3% / PBS). Se incuban las células O / N a 4 ° C en una cámara de humedad.
- Se lavan las células con 200 l de frío 0,1% de BSA / PBS.
- Aplicar 200 l de anticuerpos IgG anti-cabra diluido a 1/250 en BSA al 3% / tampón PBS. Se incuban las células durante 2 horas a RT en una cámara de humedad.
- Lavar las células 3 veces con 200 l de BSA / tampón PBS 0,1% y dos veces en PBS frío.
- Tinción de los núcleos de las células con 200 l de Hoechst diluido a 1 / 1.000 en PBS (a una concentración final en 1 mg / ml) durante 2 min a TA.
- Se lavan los portas con agua y permitir que se seque al aire antes mountingramo. Aplicar una gota de medio de montaje 1 a las células, colocar un borde de una cubierta de vidrio sobre el portaobjetos, y bajarlo con cuidado en las células utilizando fórceps. Presione suavemente sobre la cubierta de vidrio para eliminar cualquier burbuja de aire.
- citoquímica esterasa
Nota: Precalentar los reactivos a temperatura ambiente.- preparación fijador
- Para preparar la solución de citrato-acetona-formaldehído (CAF), añadir 2,5 ml de solución de citrato, 6,5 ml de acetona y 0,8 ml de formaldehído al 37% a una botella de vidrio. Mezclar suavemente y almacenar a 4 ° C.
- Naftol AS-D cloroacetato esterasa (CAE) ensayo de actividad
- agua desionizada caliente a 37 ° C.
- En un tubo de 50 ml, añadir 1 ml de solución de nitrito de sodio a 1 ml de solución de colorante. Mezclar suavemente y dejar reposar durante 2 minutos. Añadir 40 ml de agua desionizada precalentada, 5 ml de concentrado pH 6,3 tampón y 1 ml de solución de naftol AS-D cloroacetato. Mezclar y transferir en una jarra Coplin.
- Fijar las células sobre ladiapositivas (ver sección 1.3) durante 30 segundos con una solución de la CAF (véase el paso 1.5.1.1), y lavar los portaobjetos durante 45 segundos con agua desionizada.
- Transferir los portaobjetos en la solución que se preparó en la etapa 1.5.2.2, e incubar los portaobjetos a 37 ° C durante 30 min en una cámara de humedad protegido de la luz.
- Se secan las diapositivas y luego enjuague ellos a través de la inmersión en agua desionizada durante 2 min.
- Contratinción de las células mediante la adición de unas gotas de solución de hematoxilina y incubarlos durante 1 min.
- Se lavan los portas con agua neutra (pH 7) y permitir que se seque al aire. Aplicar una gota de medio de montaje 2 a las células, colocar un borde de una cubierta de vidrio sobre el portaobjetos y bajarlo con cuidado en las células utilizando fórceps. Presione suavemente sobre la cubierta de vidrio para eliminar cualquier burbuja de aire.
- Alpha-naftil butirato esterasa (NBE) ensayo de actividad
- solución caliente butirato de α-naftil a 37 ° C antes de su uso.
- Diluir un comprimido de nit de sodiorito en 6,25 ml de agua desionizada.
- En un tubo de 50 ml, añadir 1,5 ml de una solución de nitrito de sodio tableta y 1,5 ml de una solución de pararosanilina. Mezclar suavemente y dejar reposar la solución durante 5 minutos. Complementar la solución con 40 ml de solución tamponada con fosfato. Se lleva a pH 6 por adición cuidadosa de NaOH 10 N gota a gota. Añadir 5 ml de la solución de butirato de α-naftilo, mezclar la solución entera, y la transfiere en una jarra Coplin.
- Fijar las células sobre los portaobjetos durante 10 segundos utilizando la solución de CAF a TA y enjuague durante 45 segundos con agua desionizada.
- La transferencia se desliza dentro de la jarra Coplin que contiene la solución que se preparó en el paso 1.5.3.2 e incubar juntos durante 1 hora a 37 ° C en una cámara de humedad mientras que está protegido de la luz.
- Lavar los portaobjetos durante 2 min en agua neutra (pH 7) y aire seco.
- CONTRATINCIÓN las células con una solución de azul de metileno mediante la adición de unas gotas en la diapositiva y se incuba durante 4 min.
- Sumergir los portaobjetos en DEIOnocido agua durante 2 min y permitir que se seque al aire. Para montar las diapositivas, aplicar una gota de medio de montaje 2 a las células, colocar un borde de la cubierta de vidrio sobre el portaobjetos, y bajarlo con cuidado en las células utilizando fórceps. Presione suavemente sobre la cubierta de vidrio para eliminar cualquier burbuja de aire.
- preparación fijador
- May-Grünwald Giemsa (MGG) tinción
- Tinción de las células (preparados en la sección 1.3) mediante la inmersión de los portaobjetos en un tarro Coplin que contenía solución de May-Grünwald para 3 min.
- Transferir los portaobjetos en una jarra Coplin que contiene la solución tampón de pH 6,8 durante 1 min.
- Tinción de las diapositivas, colocándolos en una jarra Coplin que contiene la solución Giemsa R (diluido a 1/20 en solución pH 6,8 tampón) durante 10 min. Lavar los portaobjetos con agua neutra (pH 7) durante 10 s.
- Escurrir y secar con aire los portaobjetos. Montar las diapositivas mediante la aplicación de una gota de medio de montaje 2 en las células. Colocar un extremo de la cubierta de vidrio sobre el portaobjetos y baje con cuidado ena las células utilizando fórceps. Presione suavemente sobre la cubierta de vidrio para eliminar cualquier burbuja de aire.
2. En Vivo Desarrollo y caracterización de leucemia aguda
NOTA: Cuatro semanas de edad congenic ratones hembra C57BL / 6J-Ly5.1 se mantuvieron en condiciones libres de patógenos específicos (es decir, en un ambiente estéril). Los ratones fueron inyectados cuando tenían entre 5 y 6 semanas de edad.
- La inyección intravenosa con células C1498
- Recoger las células C1498 cultivadas en suspensiones con la pipeta. Transferir las células a un tubo de centrífuga de 50 ml y a 350 xg durante 10 min. Se lavan las células en 10 ml de PBS frío dos veces, y preparar una suspensión celular de 10 7 células / ml en PBS. Coloque la suspensión celular en hielo antes de realizar la inyección.
- Coloque el ratón en un retenedor y realizar la inyección en condiciones estériles en una campana de flujo laminar.
- Use una aguja 29G con una jeringa para inyectar las células en elvena de la cola. Agarre la cola en el extremo distal, y desinfectar con una esponja gasa empapada en etanol al 70%. Compruebe para asegurarse de que no hay burbujas de aire en la jeringa, y luego inyectar lentamente 100 l de la suspensión de células C1498 (10 6 células) en la vena de la cola.
- Después de la inyección, retire la aguja de la cola, y controlar la hemorragia aplicando presión con una gasa estéril en el lugar de la inyección. Devolver el animal a su jaula, y cuidadosamente comprobar su salud durante las próximas horas y días.
- la extracción de sangre retroorbital
- Monitorizar el comportamiento de los ratones inyectados con PBS-C1498 y de signos de enfermedad leucémica (por ejemplo, piloerección, el aislamiento del grupo, y la reducción o no hay movimientos en la jaula).
NOTA: Esto ocurre generalmente entre 17 y 19 días después se inyectan las células. - Realizar la recogida de sangre orbital retro justo antes de la eutanasia (ver paso 2.2.7) en condiciones estériles en un flujo laminarcampana y bajo una lámpara de calentamiento para prevenir la hipotermia.
- Para la anestesia, el uso de ketamina en 150 mg / kg y xilazina 10 mg / kg. Preparar la solución de anestésico mediante la dilución de 1,5 ml de cetamina y 0,5 ml de xilazina en 18 ml de solución de PBS.
- Anestesiar al control y ratones leucémicos. Proceder con una inyección intraperitoneal de 200 l de la solución anestésica por 10 g de ratón utilizando una aguja 26G y una jeringa de 1 ml. Comprobar la pérdida del reflejo de pedal para confirmar la anestesia.
- Insertar un tubo capilar en el canto interno del ojo. La sangre se elevará desde el seno orbital en el tubo capilar. Controlar el sangrado mediante la aplicación de una presión suave sobre el ojo con una gasa estéril.
NOTA: Un volumen de 100 a 200 l de sangre puede ser recogida utilizando esta técnica. - Recoger la sangre en un tubo EDTA, y almacenar la muestra en hielo antes de aislar las células mononucleares.
- La eutanasia el ratón por dislocación cervical yprocederá a aislar los órganos (sección 2.3).
- Monitorizar el comportamiento de los ratones inyectados con PBS-C1498 y de signos de enfermedad leucémica (por ejemplo, piloerección, el aislamiento del grupo, y la reducción o no hay movimientos en la jaula).
- Órganos y células de aislamiento
- aislamiento órganos
- Coloca el ratón sobre su espalda sacrificados en un tablero de plástico y utilizar agujas para fijar las patas del animal para facilitar el aislamiento de órganos. Desinfectar el ratón usando etanol al 70% antes de realizar una incisión.
- Con unas tijeras estériles, realizar una incisión ventral de la piel abdominal en el cuello. Corte a través de la pared abdominal para acceder al hígado. Corte a través de la caja torácica y el diafragma para acceder a los pulmones. Mover el intestino hacia un lado y extirpar el bazo usando tijeras y pinzas estériles.
- Para aislar la médula ósea, cortar las piernas en la parte superior de los fémures encima de la articulación con unas tijeras estériles. Desconectar la tibia del fémur tirando suavemente y quitar la piel y los músculos de los huesos utilizando pinzas y tijeras.
- Coloque cada órgano y hueso en un tubo de 50 ml que contenía PBS frío, y colocarlos en hielo.
- El aislamiento de las células de los órganos
- Pesar el bazo antes de romper las células. Mecánicamente interrumpir el bazo, los pulmones y el hígado presionando a través de un filtro de 70 micras utilizando un émbolo de la jeringa en un tubo de 50 ml, y recoger las células en 30 ml de PBS frío.
- Para recoger células de médula ósea, poner los fémures y tibias en una placa de Petri en el hielo, cortar las extremidades usando tijeras estériles, y enjuagar la médula ósea mediante la inserción de una aguja 26G unida a una jeringa 10 ml que contiene 5 ml de PBS frío.
- Romper las células de la médula ósea por pasar la suspensión celular a través de la aguja / jeringa, y filtrar la suspensión de células a través de un filtro de 70 micras en un tubo de 50 ml.
- Centrifugar todos los tubos que contienen cada uno de los órganos y las células de médula ósea a 350 xg durante 10 min. Eliminar el sobrenadante y resuspender las células recogidas de los pulmones y médula ósea en 2 ml de tampón de lisis (1x) y la células aislado del hígado y el bazo en 5 ml de tampón de lisis (1x) pipeteando suavemente la mezcla arriba y abajo. Llenar los tubos de 50 ml con PBS frío.
- Centrifugar las células a 350 xg durante 10 min. Resuspender las células en tampón FACS para el análisis de citometría de flujo o para preparar las células para la microscopía. Contar las células utilizando una cámara de recuento Thoma celular después de la tinción con azul de tripano.
- aislamiento órganos
- tinción de la superficie celular de las células aisladas a partir de órganos para citometría de flujo análisis
- En un tubo de citometría de flujo, la etiqueta 10 6 células que fueron aisladas de órganos con 10 g / ml de purificados anti-CD16 / 32 anticuerpos en 100 l de tampón de FACS.
- A 10 6 células de médula ósea, añadir 100 l de los siguientes anticuerpos o combinaciones de anticuerpos y sus controles de isotipo correspondientes diluidos en tampón FACS: anti-CD11b / anti-CD3 (1) / anti-Ly6C / anti-Ly6G (2), anti-B220 (1) /anti-CD45.2/anti-CD19, anti-CD115 / anti-CD3 (1) / unati-Ly6C / anti-Ly6G (2), anti-CD45.2, anti-Ly6G (2), anti-CD11b, anti-CD115 o anti-CD19 solo para ajustes de compensación.
- Para esplenocitos, añadir 100 l de los siguientes anticuerpos y sus controles de isotipo correspondientes diluidos en tampón FACS: una combinación de anti-CD11b / anti-CD3 (1) / anti-Ly6C / anti-Ly6G (2), anti-B220 (1 ) /anti-CD45.2/anti-CD19, anti-CD45.2, anti-Ly6G (2), anti-CD11b o anti-CD19 para ajustes de compensación.
- Para las células del pulmón y del hígado, añadir 100 l de anticuerpos anti-CD45.2 y su correspondiente control de isotipo diluido a 1/100 en tampón FACS.
- Incubar todas las soluciones de células de 30 min a 4 ° C.
- Lavar las células mediante la adición de 2 ml de tampón FACS a cada tubo. Centrifugar los tubos durante 5 min a 350 xg y desechar el sobrenadante mediante pipeteo. Repita este paso una vez más.
- Resuspender las células marcadas en 500 l de PBS frío. Mantener las células en hielo y protegido de la luz antes de realizar citometría de flujo para acquisition y análisis 10.
- Aislamiento de células mononucleares de la sangre y la tinción de inmunofluorescencia para citometría de flujo análisis
- Antes de iniciar el protocolo, pre-calentar la solución que separa a RT.
- Transferir la muestra de sangre (de 100 a 200 l; obtenido de la etapa 2.2) en un tubo de microcentrífuga, y añadir una solución de PBS / EDTA 1 mM hasta que el volumen de la solución es de 500 l. capa cuidadosamente 500 l de solución de separación en virtud de la solución que contiene la sangre utilizando una aguja 30G y una jeringa de 1 ml. No mezcle la sangre y la solución de separación.
- Centrifugar los tubos a 800 xg (sin freno) durante 20 min a RT. Después de la centrifugación, recoger el anillo celular (la capa blanca opaca) utilizando una pipeta. Transferir las células a un tubo de microcentrífuga.
NOTA: La capa blanca opaca contiene linfocitos, así como monocitos y aparece entre la capa inferior - la solución de separación - y la capa superior. - Añadir 1 mlde la solución de PBS, y se centrifuga el tubo a 350 xg durante 10 min. Resuspender las células en 600 l de tampón de FACS.
- Añadir 10 g / ml de anticuerpos purificados anti-CD16 / 32 y distribuir 100 l de la suspensión de células en seis tubos separados (100 l cada uno).
- Marcar las células con 100 l de los siguientes anticuerpos o sus controles de isotipo asociados diluidos en tampón FACS: una combinación de anti-CD3 (1) / anti-B220 (1) /anti-CD45.2 y anti-Ly6C / anti-CD115 /anti-CD45.2 o anti-CD45.2 y anti-CD115 solo para ajustes de compensación.
- Incubar todos los tubos a 4 ° C durante 30 min.
- Lavar las células mediante la adición de 2 ml de tampón FACS a cada tubo, y centrifugar los tubos durante 10 min a 350 xg, y descartar el sobrenadante usando una pipeta.
- Resuspender las células marcadas en 500 l de PBS frío. Mantener las células en hielo y protegido de la luz antes de realizar citometría de flujo adquisición y análisis 10.
- Preparación de suspensiones de células de médula ósea en portaobjetos para microscopía
- Siga los pasos descritos en la sección 1.3, pero en el paso 1.3.1, utilizar 10 5 células de médula ósea, y en el paso 1.3.4, girar las células en cada cámara en 72.26 g durante 10 min.
- Los ensayos de actividad esterasa utilizando células de médula ósea
- Para llevar a cabo los ensayos de esterasa de citoquímica de médula ósea, proceder a partir de los pasos 1.5 a 1.5.3.7.
- May-Grünwald Giemsa tinción de células de médula ósea
- Para la tinción de células de médula ósea, seguir el protocolo descrito en la sección 1.6, pero en el paso 1.6.1, se incuban los portaobjetos en solución de May-Grünwald durante 5 min.
Resultados
Para caracterizar el modelo C1498 ratón, se procedió con dos pasos principales. En primer lugar, se caracterizaron las células C1498 para determinar su etapa de linaje hematopoyético y la maduración in vitro (Figura 1). Estas células se inyectan en ratones congenic, y la naturaleza de la enfermedad leucémica inducida se evaluó para determinar diferentes características: la infiltración de células leucémicas, su fenotipo, una cuantificación de las células hematopoyéticas (maduros y progenitores / precursores) en la médula ósea, las frecuencias C1498 de células y células hematopoyéticas maduras en la sangre y una evaluación de la hinchazón de órganos (en el bazo, el hígado y los pulmones) y la composición celular.
Para caracterizar los fenotipos de células C1498 en vitro, las células se marcaron con anticuerpos dirigidos contra moléculas que se expresan por los precursores hematopoyéticos y células maduras (Tabla 1), y los resultados se analizaron mediante cytomet flujory. Las células C1498 fueron positivos para la expresión de la superficie celular de Mac-1 (CD11b / CD18) (~ 7%), B220 (> 25%), y que muestran la expresión intracelular de CD3ε, receptor de T-Cell cadenas (TCR) Vβ y Mac -3 (Figuras 2A y B). Las células fueron negativos para los marcadores de superficie celular Ly6G, Ly6c, CD115, CD21 / CD35, CD19, CD3, CD4, CD8, NK1.1, y pan-NK moléculas y para la expresión intracelular de CD4 y CD8 (datos no mostrados) . Ellos fueron examinados a continuación, para los marcadores de células madre hematopoyéticas y progenitores (Tabla 1). También fueron negativos para la expresión de la superficie celular de CD117, CD34, Sca-1, CD150 y CD16 / 32 (datos no presentados). a continuación, se ensayaron Estas células leucémicas para determinar la expresión de la adhesión, la presentación de antígenos y moléculas co-estimuladoras. Las células expresan los marcadores de superficie LFA-1 (CD11a / CD18), CD44, CD31 (PECAM-1), y H-2D b y fueron negativas para MHC de clase II, CD80, CD86 y CD274 (datos no mostrados). C1498 células Therefore expresado tanto mieloide (Mac-1, Mac-3) y marcadores linfoides (B220, CD3, TCR).
Para caracterizar mejor su linaje hematopoyético, la expresión de mieloperoxidasa se evaluó mediante microscopía de inmunofluorescencia. Todas las células fueron positivas para la mieloperoxidasa, que verifica su origen mieloide (Figura 3A). La mayoría de las células también tiñe positivo para esterasas α-naftil butirato (Figura 3B, panel izquierdo), y algunos de ellos se tiñe para los naftol AS-D cloroacetato de esterasas (flechas negras) (Figura 3B, panel derecho). Los resultados indican que las células contenían las mezclas de células monocíticas y granulocítica. Después se realizó la tinción de May-Grünwald Giemsa, se observaron las células C1498 para mostrar una morfología explosión-como con una elevada relación núcleo-citoplasma, de 3 a 5 nucléolos en el núcleo, un halo perinuclear, numerosas vacuolas y citoplasma basófilo (Figura 3C ). Thnosotros, la línea de células C1498 se compone de Monoblastos y mieloblastos.
Las células C1498 (CD45.2 +), entonces se inyectaron por vía intravenosa en CD45.1 + ratones. Los ratones sucumbieron 17 a 19 días después se inyectaron las células. Estos ratones fueron sacrificados a fin de que su tipo de leucemia puede ser analizado antes de morir de la enfermedad. Los ratones de control, que fueron inyectados con PBS, se analizaron en los mismos puntos de tiempo para la comparación. Los ratones inyectados con células C1498 muestra la infiltración masiva de células C1498 en su médula ósea, como se demuestra por la aparición de altos como de las células después de May-Grünwald Giemsa tinción se realizó (Figura 4A). También conservan su monocítica y granulocítica fenotipos (Figura 4B y C), lo que demuestra una acumulación de células monoblásticos y mieloblástica que es característico de leucemia mielomonocítica aguda.
para determine si los números de células hematopoyéticas medulares fueron menores después de la invasión células leucémicas, células CD45.2 + C1498, B linfocítica, monocítica y granulocítica poblaciones (incluidos los progenitores, los precursores y las células maduras), se cuantificaron utilizando la tinción de inmunofluorescencia y el flujo multiparamétrica análisis de citometría. Las células leucémicas representados 16 a 36% de las células hematopoyéticas (datos no mostrados). Los otros tipos de células se encuentran presentes en un número significativamente más bajos en los ratones inyectados con C1498 que en los ratones inyectados con PBS (por 5 veces en promedio para los subconjuntos de células B, 4 veces en promedio para las células granulocíticas y 3 veces en promedio para subconjuntos monocíticas) (Figura 5A a C).
Una investigación de las frecuencias de células mononucleares en muestras de sangre leucémicas y de ratón de control mostró que contenían un porcentaje comparable de linfocitos (Figura 6A) pero una mayor frecuencia de monocíticay células leucémicas. Estas características son representativas de la leucemia mielomonocítica aguda 11 (Figura 6B).
Entre las otras características de la leucemia mielomonocítica aguda 12, los ratones inyectados-C1498 presentados con hígados hinchados (hepatomegalia), los pulmones y el bazo (esplenomegalia) (Figura 7A). Se detectaron varias frecuencias de células CD45.2 + C1498 en estos órganos usando la tinción de inmunofluorescencia y citometría de flujo análisis (Figura 7B). Como esplenomegalia puede ser resultado de un alto número de monocitos infiltrados, también estima que las proporciones de las poblaciones de bazo. Los números de células en el linfocítica B, monocítica y fracciones de células granulocíticas fueron significativamente más grandes, en un promedio de 2 veces, 2,5 veces y 3 veces, respectivamente, en el bazo leucémicas que en los bazos de control (Figura 7C).
delgada-page = "1"> 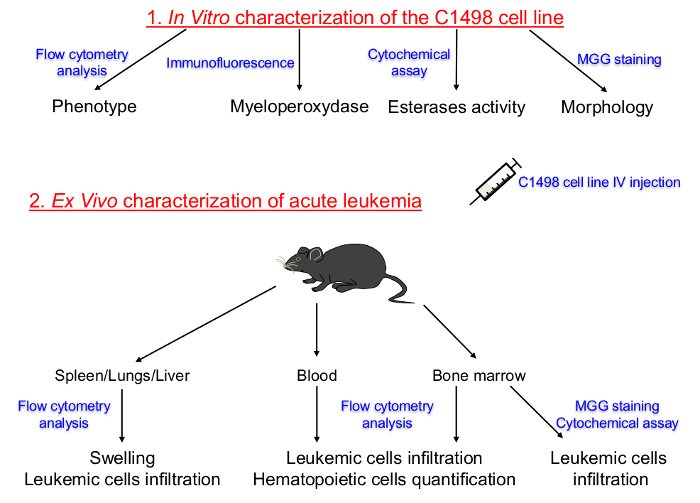
Se determina en primer lugar la Figura 1. Representación esquemática del Protocolo de Configuración para la caracterización in vitro de líneas celulares cultivadas C1498 y en descripciones vivo de leucemia aguda. El linaje hematopoyético y la etapa de diferenciación de las células C1498 cultivadas de tejido. células C1498 se inyectaron en ratones congenic para inducir el desarrollo de la leucemia aguda. Se realizó el aislamiento de la médula ósea, la sangre periférica, el bazo, el hígado y tejidos del pulmón para determinar las frecuencias, fenotipos y cambios morfológicos después de la infiltración de células C1498. IV: MGG intravenosa:. May-Grünwald Giemsa Haga clic aquí para ver una versión más grande de esta figura.
ad / 54270 / 54270fig2.jpg "/>
Figura 2. Análisis fenotípico de C1498 células después de cultivo in vitro. Representante flujo citometría de gráficos de puntos y los histogramas de superficie de la célula (A) e intracelular (B) C1498-expresa moléculas que se asociaron con la diferenciación de células hematopoyéticas maduras se muestran. C1498 células fueron cosechadas a partir de cultivos, lavados y etiquetados con anticuerpos fluorescentes que eran específicas para la superficie de células CD11b, CD18 y marcadores B220 o sus controles de isotipo. Para la tinción intracelular, las células se fijaron, permeabilizaron y etiquetados con anticuerpos dirigidos contra Mac-3, CD3ε, y un epítopo común de TCR (T-Cell Receptor) cadena Vβ o sus controles de isotipo. Los análisis se realizaron con gating con células vivas. Por favor, haga clic aquí para ver una versión más grande de esta figura.
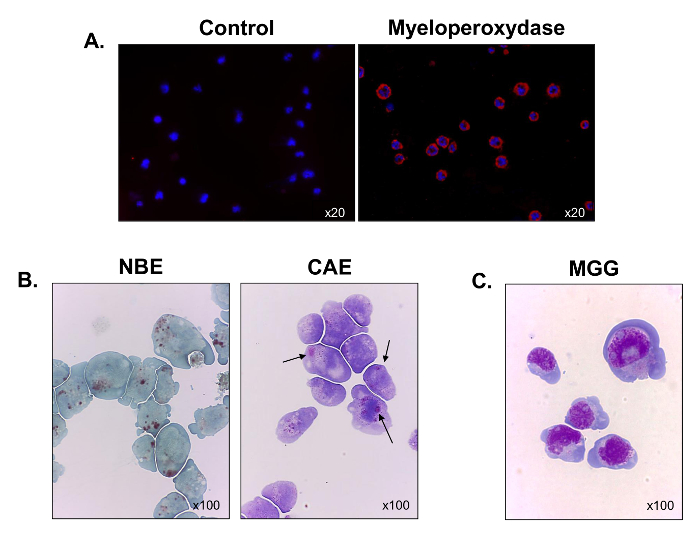
Figura 3. Caracterización morfológica y funcional de las células cultivadas C1498. Se recogieron las células C1498 a partir de cultivos y se centrifugaron sobre portaobjetos de microscopía. (A) La tinción para la expresión de mieloperoxidasa se realizó mediante inmunofluorescencia. (B) reacciones citoquímicas se utilizaron para analizar la esterasa α-naftil butirato (NBE) y naftol AS-D cloroacetato esterasa (CAE) las actividades en las células C1498. Las células se consideran positivos para cada etiqueta cuando, respectivamente, se observaron grandes gránulos citoplasmáticos, marrón y rojo-púrpura. (C) May-Grünwald Giemsa (MGG) tinción de las células C1498. Para cada experimento de tinción, el aumento del objetivo de microscopía se indica. Cada imagen es representativa de tres experimentos separados.large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
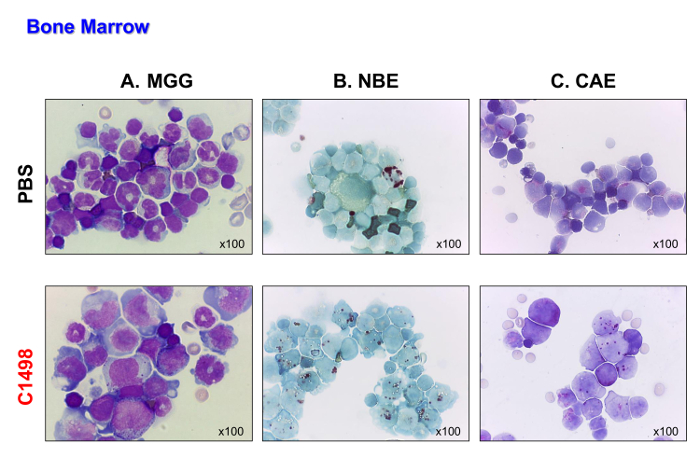
Figura 4. Los ratones de médula ósea Morfologías en PBS y C1498-inyecta. Se aislaron células de médula ósea de PBS y ratones inyectados con células C1498 y se centrifugaron sobre portaobjetos de microscopía. (A) May-Grünwald Giemsa (MGG) tinción. (B ) esterasa α-naftil butirato (NBE) y naftol (C) AS-D se evaluaron funciones cloroacetato esterasa (CAE) usando citoquímica. En el panel A, la banda (inmaduros) o neutrófilos segmentados (maduras) son menos visibles en la médula ósea de los ratones inyectados-C1498 que los ratones inyectados con PBS. Panel B y C indican que no hubo una acumulación de células monocíticas y granulocítica en la médula ósea leucémica en comparación con los números observados en la médula ósea de control. TodasLos análisis microscópicos se realizaron utilizando un objetivo de aumento de 100X. Por favor, haga clic aquí para ver una versión más grande de esta figura.
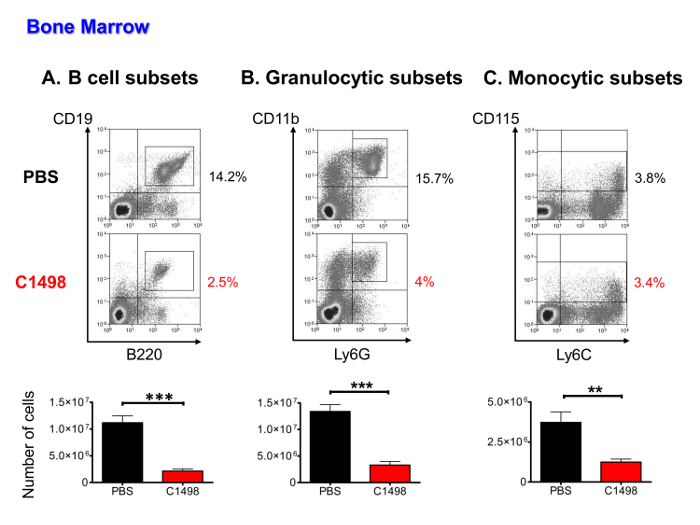
Figura 5. Análisis cuantitativo de ratones medulares Las poblaciones en PBS y C1498-inyectada. Se aislaron células de médula ósea de ratones inyectados con PBS y las células-C1498 y estimaron después se realizó el recuento de células. Las frecuencias de las diferentes poblaciones de células se determinaron después de inmunotinción y el flujo de células cerrada en vivo análisis de citometría. (A) los subconjuntos de células B incluyen las células CD19 + B220 + en etapas a partir de células pro-B para madurar los linfocitos B (B) células granulocíticas en el CD3 - CD11b + y + Ly6G linajes, que incluía una precursoresnd. granulocitos inmaduros y maduros (C) Los subconjuntos monocitos se definieron como CD3 - CD115 + y células incluidas en el progenitor de madurar etapas de monocitos. n = 7 ratones / grupo, y los datos se presentan como histogramas que muestran las medias ± SEM. ***, P <0,0001 y **, p <0,01, prueba de la t de Student para datos independientes comparando con PBS y ratones inyectados-C1498. Haga clic aquí para ver una versión más grande de esta figura.
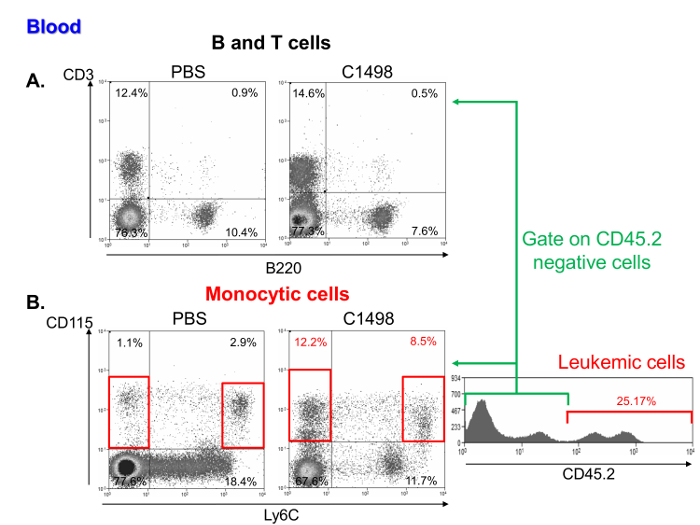
Figura 6. Análisis de Sangre de subconjuntos de células mononucleares en PBS y ratones C1498-inyectado. Un resultado representativo citometría de gráficos de puntos de porcentajes de linfocitos (A) T y B, que se definieron, respectivamente, como CD3 + y células B220 + en PBS y C1498 células con inyección de. ratones (B) frecuencias celular de monocitos en leucémica y el control C1498 ratones (PBS) se determinó mediante el análisis de CD115 + Ly6C - y CD115 + Ly6C pilas de gran. El análisis se realizó por gating células vivas. Para comparar los ratones leucémicos y control, CD45.2 + Se excluyeron las células C1498. Por favor, haga clic aquí para ver una versión más grande de esta figura.
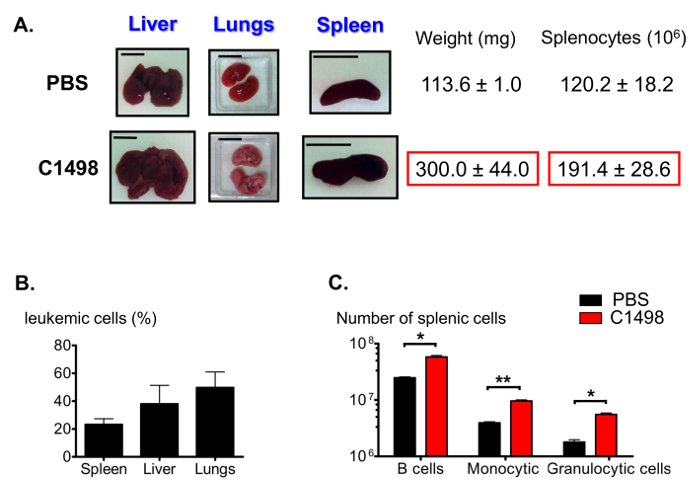
Figura 7. Estimación de esplénicos Poblaciones en leucémicas y los ratones de control. (A) fotografías representativas de hígado, pulmón y bazo de hinchamiento en ratones leucémica comparación con ratones control. Se extrajeron los bazos y se pesaron y se contaron esplenocitos tras la interrupción del tejido. (B) Histograma que representa las frecuencias de células leucémicas en diffErent órganos después de la inmunotinción se realizó para las células CD45.2 + y los resultados se analizaron mediante citometría de flujo. (C) Las estimaciones de B esplénica, el número de células granulocíticas y monocitos después de inmunotinción y análisis de citometría de flujo compuerta se realizaron para identificar vivo CD19 + B220 + , CD3 - CD11b + Ly6G +, CD3 - CD11b + Ly6C - y CD3 - CD11b + pilas de gran Ly6c. Las barras de escala que se muestran para los pulmones, el bazo y el hígado indican a 1 cm. .. n = 5 - 8 ratones / grupo, y los datos están representados en los histogramas como los medios ± SEM *, p <0,05; **, p = 0,0033 ratones, prueba de la t de Student para datos independientes comparando con PBS y C1498 con inyección de favor clic aquí para ver una versión más grande de esta figura.
| Tipo de célula | Membrana o intracelulares moléculas |
| Precursores y células maduras | |
| células NK | NK1.1 +, pan-NK + |
| las células NKT | NK1.1 +, pan-NK +, TCR Vbeta + (8,2), CD3 + |
| linfocitos T | TCR Vbeta +, CD3 +, CD4 +, CD8 + |
| células B y los linfocitos B precursores | B220 +, CD19 +, CD21 / 35 + |
| precursores de granulocitos y granulocitos | Ly6G +, Mac-1 +, CD11b + |
| precursores monocitos y monocitos / macrófagos | CD11b +, Mac-1 +, Mac-3 +, CD21 / 35 +, CD115 +, Ly6Chi |
| progenitores | |
| progenitoras multipotentes | CD117 + Sca-1+ CD34 + (Lin-CD150-) |
| progenitores multipotentes linfoides cebado | CD117hi Sca-1ALT CD127 + (Lin) |
| progenitores linfoides comunes | CD117lo Sca-1Lo CD127 + (Lin) |
| progenitores mieloides comunes | CD16 / CD117 + 32lo CD34int (Lin-Sca-1) |
| progenitores de granulocitos-macrófagos | CD16 / CD117 + 32hi CD34hi (Lin-Sca-1) |
| progenitores de megacariocitos-eritroide | CD16 / CD117 + 32lo CD34lo (Lin-Sca-1) |
| Las células madre hematopoyéticas | CD117 + Sca-1 + CD150 + (Lin-CD34) |
Tabla 1. Los marcadores de linajes de células hematopoyéticas y la diferenciación.
CD: grupo de diferenciación; Lin: marcadores de células maduras; Mín:baja expresión; hola: alta expresión; Int: expresión intermedia; NK: las células asesinas naturales; TCR: receptor de células T.
Discusión
En estudios anteriores, la línea de células C1498 fue descrito como un inductor de la granulocítica aguda 5, 6 o mielomonocítica NKT 7 leucemia de células. Sin embargo, los datos demostrativos en la literatura eran ausentes o incompletos. El protocolo presentado aquí utiliza diferentes técnicas, tales como citometría de flujo, inmunofluorescencia, la tinción de MGG y ensayos citoquímicas, para caracterizar las células C1498 cultivadas y para determinar la naturaleza de la leucemia que se induce en ratones después de que se inyectan.
Cuando phenotyped en las células C1498 vitro cultivadas después de inmunotinción y citometría de flujo se realizaron análisis, se observó algunas limitaciones debido a que estas células expresan pocos marcadores hematopoyéticos de la superficie celular que se han descrito previamente en la literatura 6,7. De acuerdo con nuestros resultados, Labelle et al. No observó la expresión de la superficie celular de las células maduras TCR en C1498 usando cytomet flujotinción ry. Sin embargo, ellos consideran como una línea de células NKT después de que se detectaron CD3ε y TCRVβ8.2 ARNm 7. También se observó la expresión intracelular de cadenas TCRVβ y moléculas CD3ε en la mayoría de las células (> 70%), pero sus linajes hematopoyéticos no se pudo determinar debido a que también era la expresión intracelular concomitante de la molécula de Mac-3.
Mieloperoxidasa, las manchas y las evaluaciones para analizar esterasas funcionales utilizando citoquímica MGG demostrado que la línea celular C1498 tuvo un origen mieloide y se compone de Monoblastos y mieloblastos. Estos resultados fueron concordantes con el porcentaje de células Mac-3 + que se obtuvieron en citometría de flujo análisis de tinción. Aunque no es cuantitativa, estos pasos representan experimentos clave a realizar. De hecho, siguen siendo, hasta ahora, los mejores métodos existentes para la caracterización de la etapa de linaje y diferenciación de las células hematopoyéticas que expresan no o few marcadores fenotípicos específicos.
La citometría de flujo de tinción era útil para demostrar el desarrollo de la leucemia aguda en ratones congenic después C1498 células se inyectaron por vía intravenosa. Los + C1498 células CD45.2 que se infiltraron en la sangre periférica y varios órganos se aislaron, y se determinaron sus frecuencias. También se realizó la cuantificación de analizar medular inherente y células esplénicas después de inmunofenotipo. Limitaciones se encontraron cuando el fenotipo de las células C1498 se examinó en los órganos, ya que expresan pocos marcadores hematopoyéticos (sólo unos pocos de ellos eran B220 +). Para definir la naturaleza de la leucemia aguda observada, la tinción de May-Grünwald Giemsa y un análisis de las actividades de esterasas monocítica y granulocítica se realizaron utilizando la médula ósea. Los resultados mostraron que las células C1498 conservan su morfología y función mieloblástica y monoblástica, revelando la aparición de la leucemia mielomonocítica.
En consideración de los pasos críticos descritos en este protocolo, se debe prestar especial atención a pH al realizar reacciones histoquímicas y tinción MGG debido a errores en el pH pueden dar lugar a interpretaciones erróneas de los resultados. Por ejemplo, la actividad esterasa butirato de α-naftil es específico para células monocíticas solamente a un pH de 6,0 ya que los granulocitos y linfocitos también pueden manchar positivo para esta prueba a valores de pH más altos. La fijación de las células no se recomienda antes de realizar la tinción de MGG, y nos mostró que sólo la fijación CAF proporciona resultados satisfactorios cuando se realizan las esterasas reacciones citoquímicas usando células C1498. Para preservar la expresión de la molécula CD115 y su detección mediante citometría de flujo, todas las muestras (por ejemplo, células, sangre, médula ósea y bazo) se debe mantener en hielo durante el procedimiento. Si no se observa tinción en citometría de flujo y / o experimentos de inmunofluorescencia, la referencia de los anticuerpos, su almacenamiento reelogios y sus diluciones deben ser controlados. Las referencias especificadas en la tabla de materiales / equipos se han seleccionado para aplicaciones de citometría de flujo o inmunofluorescencia. Los anticuerpos primarios / secundarios o sus fluoróforos conjugados podrían haber perdido su actividad debido a un almacenamiento inadecuado (por ejemplo, la exposición a la luz o el calor), la dilución inadecuada, extensa de congelación / descongelación o el uso de tampones contaminados. Ejecutar controles positivos para asegurarse de que están funcionando correctamente. Utilice el ratón de médula ósea o células de bazo derivadas de que se sabe que expresan las proteínas de interés. Para evitar el alto fondo y la tinción no específica, asegúrese de que las células se lavan adecuadamente y se mantienen a una alta humedad (por inmunofluorescencia) y que los anticuerpos se diluyen con las instrucciones. Usar la misma concentración y dilución para el anticuerpo de control de isotipo y el anticuerpo primario para determinar con precisión el nivel de fondo en la muestra. Para los experimentos de esterasa de citoquímica, laLos reactivos pueden ser probados mediante el uso de portaobjetos de control positivo y negativo contienen ratón purificada granulocítica esplénica (Ly6G +) y células de monocitos (CD115 +).
El procedimiento descrito en este estudio mostró que muchas de las características leucémicas observados en ratones después de la inyección de las células C1498 compartían características comunes con leucemia mielomonocítica aguda humana 11,12. Las células leucémicas invadido resultaron en una reducción de maduros e inmaduros (progenitores y precursores de células hematopoyéticas) medulares. células C1498 están presentes en alta frecuencia (> 20%) en la sangre periférica, como lo son las células monocíticas. Hepatomegalia y esplenomegalia se observó que el resultado de la infiltración de células leucémicas, y también se observaron incrementos significativos en los linfocitos B y las células mieloides para acompañar esplenomegalia. Trombopenia también se observó cuando los números de plaquetas de la sangre se estimaron usando un analizador de hematología.
Fue espectáculon, usando experimentos in vitro, que C1498 células inhiben la hematopoyesis murina normal, mediante la secreción de factores solubles 13. En varios modelos de ratón tumor, las células mieloides inmaduras (incluyendo monocitos y células granulocíticas) también se ha demostrado que migrar de la médula ósea para el bazo, donde inhiben la activación de células T específicas anti-tumor y la proliferación 14. Por lo tanto, la reducción de las células hematopoyéticas que se observó en la médula ósea puede ser el resultado de una deficiencia en la hematopoyesis y / o de su emigración. Este último mecanismo podría explicar la presencia de monocitosis en la sangre periférica o la observación de las fracciones mieloides agrandados en el bazo. También es concebible que estas células podrían haber sido derivados de la mejora de la hematopoyesis esplénica. De hecho, bajo condiciones de estado estable, se identificaron algunos subconjuntos de células B esplénicas como precursores de linfocitos B maduros 15. Por otra parte, en condiciones inflamatorias, medcélulas madre y progenitores ullary se ha demostrado que trasladarse a la bazo para inducir la producción de monocitos maduros 16. Este protocolo no permite sacar conclusiones con respecto a los mecanismos que están implicados en el desarrollo de la leucemia, y ensayos funcionales, así como moleculares adicionales deben ser empleados para hacerlo. Sin embargo, estos datos incluyen información detallada sobre las características clínicas de la leucemia mielomonocítica aguda y ayudarán a los investigadores a evaluar y comprender los efectos de nuevos agentes terapéuticos.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
The authors would like to acknowledge the "Ligue Nationale contre le Cancer" (Comité du Septentrion), the SIRIC ONCOLille (Grant INCa-DGOS-INSERM 6041) and the Institut pour la Recherche sur le Cancer de Lille (IRCL) for supporting this work. They would like to thank Delphine Taillieu and the animal facility staff for housing the mice and maintaining their welfare. We also thank Raphaëlle Caillerez and Nathalie Jouy for their respective help in microscopy and flow cytometry.
Materiales
| Name | Company | Catalog Number | Comments |
| C1498 cell line | ATCC | TIB 49 | |
| C57BL/6J-Ly5.1 | Charles River | B6.SJL-Ptprc a Pep3 b/BoyCrl | |
| Cells culture reagents | |||
| 2-Mercaptoethanol, Gibco | ThermoFisher Scientific | 21985 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | 10270 | |
| HEPES, Gibco (1 M) | ThermoFisher Scientific | 15630 | |
| Non-Essential Amino Acids Solution, Gibco | ThermoFisher Scientific | 11140 | |
| Penicillin-Streptomycin, Gibco | ThermoFisher Scientific | 15140 | |
| RPMI 1640 Medium (Gibco, GlutaMAX Supplement) | ThermoFisher Scientific | 61870 | |
| Sodium Pyruvate, Gibco (100 mM) | ThermoFisher Scientific | 11360 | |
| Flow cytometry staining reagents | |||
| anti-mouse B220 APC (1) | ebiosciences | 17-0452 | clone RA3-6B2, final dilution 1/100 |
| anti-mouse B220 biotin (2) | ebiosciences | 13-0452 | clone RA3-6B2, 1/400 |
| anti-mouse CD3 eFluor450 (1) | ebiosciences | 48-0032 | clone 17A2, 1/100 |
| anti-mouse CD3 PE (2) | BD biosciences | 555275 | clone 17A2, 1/100 |
| anti-mouse CD3 PE-Cy5 (3) | ebiosciences | 15-0031 | clone 145-2C11, 1/100 |
| anti-mouse CD4 APC (1) | ebiosciences | 17-0041 | clone GK1.5, 1/500 |
| anti-mouse CD4 PE (2) | ebiosciences | 12-0041 | clone GK1.5, 1/200 |
| anti-mouse CD8 biotin (1) | ebiosciences | 13-0081 | clone 53-6.7, 1/100 |
| anti-mouse CD8 eFluor450 (2) | ebiosciences | 48-0081 | clone 53-6.7, 1/500 |
| anti-mouse CD11a biotin | ebiosciences | 13-0111 | clone M17/4, 1/100 |
| anti-mouse CD11b PE | ebiosciences | 12-0112 | clone M1/70, 1/200 |
| anti-mouse CD16/32 biotin | ebiosciences | 13-0161 | clone 93, 1/400 |
| purified anti-mouse CD16/32 (FcR blocking) | BD biosciences | 553141 | clone 2.4G2 |
| anti-mouse CD18 biotin (1) | ebiosciences | 13-0181 | clone M18/2, 1/100 |
| anti-mouse CD18 FITC (2) | ebiosciences | 11-0181 | clone M18/2, 1/50 |
| anti-mouse CD19 PE | ebiosciences | 12-0193 | clone 1D3, 1/200 |
| anti-mouse CD21/35 PE | ebiosciences | 12-0211 | clone 8D9, 1/50 |
| anti-mouse CD31 PE | ebiosciences | 12-0311 | clone 390, 1/100 |
| anti-mouse CD34 eFluor660 | ebiosciences | 50-0341 | clone RAM34, 1/20 |
| anti-mouse CD44 PE | BD biosciences | 553134 | clone IM7, 1/50 |
| anti-mouse CD45.2 FITC | ebiosciences | 11-0454 | clone 104, 1/100 |
| anti-mouse CD49b/Pan NK PE | BD biosciences | 553858 | clone DX5, 1/50 |
| anti-mouse CD80 biotin | ebiosciences | 13-0801 | clone 16-10A1, 1/200 |
| anti-mouse CD86 biotin | ebiosciences | 13-0862 | clone GL1, 1/200 |
| anti-mouse CD107b (Mac-3) PE | ebiosciences | 12-5989 | clone M3/84, 1/40 |
| anti-mouse CD115 PE | ebiosciences | 12-1152 | clone AFS98, 1/100 |
| anti-mouse CD117 eFluor450 | ebiosciences | 48-1171 | clone 2B8, 1/100 |
| anti-mouse CD127 PE | ebiosciences | 12-1271 | clone A7R34, 1/100 |
| anti-mouse CD150 APC | ebiosciences | 17-1501 | clone 9D1, 1/20 |
| anti-mouse CD274 (PD-L1) biotin | ebiosciences | 13-5982 | clone MIH5, 1/200 |
| anti-mouse Ly-6A/E (Sca-1) PE | ebiosciences | 12-5981 | clone D7, 1/100 |
| anti-mouse Ly-6C APC | ebiosciences | 17-5932 | clone HK1.4, 1/200 |
| anti-mouse Ly-6G (Gr-1) biotin (1) | ebiosciences | 13-5931 | clone RB6-8C5, 1/400 |
| anti-mouse Ly-6G FITC (2) | ebiosciences | 11-9668 | clone 1A8, 1/50 |
| anti-mouse MHC class I (H-2Db) biotin | ebiosciences | 13-5999 | clone 28-14-8, 1/50 |
| anti-mouse MHC class II (I-A/I-E) PE-Cy5 | ebiosciences | 15-5321 | clone M5/114.15.2, 1/1000 |
| anti-mouse NK1.1 PE | BD biosciences | 557391 | clone PK136, 1/50 |
| anti-mouse TCRVb FITC | BD biosciences | 553170 | clone H57-597, 1/50 |
| streptavidin PE-Cy5 | ebiosciences | 15-4317 | 1/200 |
| Immunofluorescence staining reagents | |||
| Anti-mouse myeloperoxidase (heavy chain antibody) | Santa Cruz Biotechnology | sc-16129 | 1/10 (20 µg/ml) |
| anti-goat IgG (Texas Red coupled antibody) | Jackson Immunoresearch | 705-076-147 | 1/250 |
| Normal donkey serum | Jackson Immunoresearch | 017-000-001 | |
| Hoechst solution | BD Biosciences | 561908 | 1/1000 |
| Mounting medium 1 (Fluoromount) | Sigma-Aldrich | F4680 | |
| Acetone | VWR | 20066 | |
| Methanol | Merck Millipore | 106009 | |
| Esterase cytochemical staining reagents | |||
| Naphtol AS-D chloroacetate solution | Sigma-Aldrich | 911 | |
| Dye solution (Fast Red Violet LB Base solution) | Sigma-Aldrich | 912 | |
| pH6.3 buffer concentrate (TRIZMAL) | Sigma-Aldrich | 913 | |
| Sodium nitrite solution | Sigma-Aldrich | 914 | |
| Citrate solution | Sigma-Aldrich | 915 | |
| Hematoxylin solution | Sigma-Aldrich | GHS3 | |
| Acetone | VWR | 20066 | |
| Formaldehyde solution, 37% | Sigma-Aldrich | F1635 | |
| α-naphthyl butyrate solution | Sigma-Aldrich | 1801 | |
| Phosphate buffer solution | Sigma-Aldrich | 1805 | |
| Sodium nitrite Tablet | Sigma-Aldrich | 1809 | |
| Pararosaniline solution | Sigma-Aldrich | 1804 | |
| Methylene blue solution | Sigma-Aldrich | 1808 | 1/10 |
| mounting medium 2 (Clearmount) | Invitrogen | 00-8010 | |
| May-Grünwald Giemsa staining reagents | |||
| May-Grünwald solution | RAL Diagnostics | 320070 | |
| Giemsa R solution | RAL Diagnostics | 320310 | 1/20 |
| pH 6.8 buffer solution | RAL Diagnostics | 330368 | |
| Others materials, reagents and equipment | |||
| Ketamine 1000 (100 mg/ml) | VIRBAC | 3597132111010 | |
| Xylazine SEDAXYLAN (20 mg/ml) | CEVA | ||
| Bovin albumin serum (BSA) powder | ThermoFisher Scientific | BP671 | |
| PBS solution (1x concentrate) | ThermoFisher Scientific | 14190 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Saponin | Sigma-Aldrich | 47036 | |
| Ultra Pure 0.5 M EDTA solution, pH 8.0 | ThermoFisher Scientific | 15575 | |
| Separating solution (Pancoll Mouse) | PANBIOTECH | P04-64100 | |
| Lysis buffer (Red Blood Cells Lysing Buffer) (10x) | BD Biosciences | 555899 | 1/10 |
| NaOH 10 N | ThermoFisher Scientific | SS267 | |
| Trypan blue solution (0.4 %) | ThermoFisher Scientific | 15250-061 | 1/2 |
| 50 ml tube (Falcon) | Fisher Scientific | 14-432-22 | |
| 70 µm Cell Strainer (Falcon) | Corning Life Sciences | 352350 | |
| Chamber & filter card (EZ Cytofunnel Shandon) | Thermo Scientific | A78710003 | |
| Microscope Cover Glasses, 24 x 24mm | Knittel Glass | VD1 2424 Y100 | |
| Slides (Starfrost - ground edges 90) | Knittel Glass | VS1137# 077FKB | |
| EDTA Tube | Greiner Bio-One | 454034 | |
| Pasteur Pipette 150 mm (capillary tube) | Fisherbrand | 1154-6963 | |
| 26 G needle | Terumo | NN-2613R | |
| insulin syringe and needle 29 G | Terumo | BS05M2913 | |
| 30 G needle | Becton & Dickinson | 304000 | |
| Flow cytometry tubes (blue) | Beckman Coulter | 2523749 | |
| Water-repellent pen (Dakopen) | Dako | S200230 | |
| Sharp sterile scissors | Nessi-care | SCI-01 | |
| Sterile forceps | Dominique Dutscher | 956506 | |
| Thoma cell counting chamber | VWR | 631-0397 | |
| Petri Dishes (Fisherbrand Plastic) | ThermoFisher Scientific | S33580A | |
| Microcentrifuge tube (1.5 ml) | ThermoFisher Scientific | 05-408-129 | |
| Cylindrical Restrainer 15 - 30 gm | Stoelting | 51338 | |
| Shandon Cytospin 3 Cytocentrifuge | ThermoFisher Scientific | ||
| 10 ml syringe | Terumo | SS-10L | |
| 1 ml syringe | Terumo | SS-01T | |
| Ethanol | Merck | 1.08543 | |
| Sterile gauze sponges | URGO | 501580 |
Referencias
- Forthun, R. B., Hinrichs, C., Dowling, T. H., Bruserud, Ø, Selheim, F. The past, present and future subclassification of patients with acute myeloid leukemia. Curr. Pharm. Biotechnol. 17 (1), 6-19 (2016).
- Goldie, H., Butler, C. H., Anderson, M. M., Maxwell, M. C., Hahn, P. F. Growth characteristics of free C1498 (granulocytic leukemia) tumor cells in the peritoneal fluid and the blood of C57 mice. Cancer Res. 13 (2), 125-129 (1953).
- Tanaka, K. K., Roberts, E. Biological studies of E.L.4 lymphoma and C Leukemia in susceptible (C57BL) and resistant (B10.D2) mice. Cancer Res. 24 (1498), 1785-1797 (1964).
- Law, L. W. Characterization of an influence affecting growth of transplantable leukemias in mice. Cancer Res. 4, 257-260 (1944).
- Graham, J. D., McMahon Welch, C., Patchen, M. L. Studies of an implanted murine myelogenous leukemia C1498. Ohio J. Sci. 75 (4), 202-208 (1975).
- Boyer, M. W., Orchard, P. J., Gorden, K. B., Anderson, P. M., Mclvor, R. S., Blazar, B. R. Dependency on intercellular adhesion molecule recognition and local interleukin-2 provision in generation of an in vivo CD8+ T-cell immune response to murine myeloid leukemia. Blood. 85 (9), 2498-2506 (1995).
- Labelle, J. L., Truitt, R. L. Characterization of a murine NKT cell tumor previously described as an acute myelogenous leukemia. Leuk. Lymphoma. 43 (8), 1637-1644 (2002).
- Bradner, W. T., Pindell, M. H. Myeloid leukemia as a screen for cancer chemotherapeutic agents. Cancer Res. 26 (4), Pt 2 375-390 (1966).
- Lin, J. M., Li, B., Rimmer, E., VanRoey, M., Jooss, K. Enhancement of the anti-tumor efficacy of a GM-CSF-secreting tumor cell immunotherapy in preclinical models by cytosine arabinoside. Exp. Hematol. 36 (3), 319-329 (2008).
- Robinson, J. P. Handbook of Flow Cytometry Methods. , Wiley-Liss, Inc. New York, NY. (1993).
- Xu, Y., McKenna, R. W., Wilson, K. S., Karandikar, N. J., Schultz, R. A., Kroft, S. H. Immunophenotypic identification of acute myeloid leukemia with monocytic differentiation. Leukemia. 20 (7), 1321-1324 (2006).
- Hassan, K., Qureshi, M., Shafi, S., Ikram, N., Akhtar, M. J. Acute myeloid leukemia-FAB classification and its correlation with clinico-haematological features. J. Pak. Med. Assoc. 43 (10), 200-203 (1993).
- Quesenberry, P. J., Rappeport, J. M., Fountebouni, A., Sullivan, R., Zuckerman, K., Ryan, M. Inhibition of normal murine hematopoiesis by leukemic cells. N.Engl.J. Med. 299 (2), 71-75 (1978).
- Youn, J. I., Nagaraj, S., Collazo, M., Gabrilovich, D. I. Subsets of myeloid-derived suppressor cells in tumor-bearing mice. J. Immunol. 181 (8), 5791-5802 (2008).
- Loder, F., et al. B cell development in the spleen takes place in discrete steps and is determined by the quality of B cell receptor-derived signals. J. Exp. Med. 190 (1), 75-89 (1999).
- Robbins, C. S., et al. Extramedullary hematopoiesis generates Ly-6C(high) monocytes that infiltrate atherosclerotic lesions. Circulation. 125 (2), 364-374 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados