Method Article
Agregada la optimización del tamaño de micropocillos para basada en suspensión cardiaca diferenciación de células madre pluripotentes
En este artículo
Resumen
Los métodos convencionales para iniciar la diferenciación cardiaca basada agregada suspensión de pluripotente humana se deriva células (hPSCs) están plagados de heterogeneidad de cultivo con respecto al tamaño y la forma agregada. A continuación, describimos un método robusto para la diferenciación cardiaca empleando pocillos para generar HPSC tamaño controlado agregados cultivan en condiciones cardíacas promotoras.
Resumen
Cardiac differentiation of human pluripotent stems cells (hPSCs) is typically carried out in suspension cell aggregates. Conventional aggregate formation of hPSCs involves dissociating cell colonies into smaller clumps, with size control of the clumps crudely controlled by pipetting the cell suspension until the desired clump size is achieved. One of the main challenges of conventional aggregate-based cardiac differentiation of hPSCs is that culture heterogeneity and spatial disorganization lead to variable and inefficient cardiomyocyte yield. We and others have previously reported that human embryonic stem cell (hESC) aggregate size can be modulated to optimize cardiac induction efficiency. We have addressed this challenge by employing a scalable, microwell-based approach to control physical parameters of aggregate formation, specifically aggregate size and shape. The method we describe here consists of forced aggregation of defined hPSC numbers in microwells, and the subsequent culture of these aggregates in conditions that direct cardiac induction. This protocol can be readily scaled depending on the size and number of wells used. Using this method, we can consistently achieve culture outputs with cardiomyocyte frequencies greater than 70%.
Introducción
En el cultivo de células in vitro se puede realizar bajo una serie de modalidades, pero típicamente se lleva a cabo ya sea en dos dimensiones condiciones adherentes o en condiciones de suspensión tridimensionales que recapitular más completamente en sistemas in vivo. En consecuencia, existe una tendencia creciente en muchos campos de investigación para desarrollar métodos robustos para generar construcciones de tejido tridimensionales. En escenarios en los tipos y los procesos celulares requieren un apoyo señales de adhesión de la superficie y la matriz extracelular (ECM), de tres dimensiones de cultivo se puede activar a través de construcciones escalonadas, donde las células se cultivan sobre o en una matriz de soporte exógeno 1. Las células y los procesos que no requieren adhesión a una matriz de soporte se pueden llevar a cabo en suspensión como sistemas unscaffolded compuestos principalmente o exclusivamente de las células (que puede entonces proceder a generar sus propias matrices endógenos) 2,3. A continuación, presentamos un protocolo para la diferenciación cardiaca oLas células madre pluripotentes humanas f - en, uniforme, agregados unscaffolded tamaño controlado (hPSCs células capaces de convertirse en cualquier tipo de célula en el cuerpo, ya sea de fuentes embrionarias u otras STEM).
La diferenciación de hPSCs como agregados de suspensión está plagada de grandes variaciones en el tamaño de los agregados, tanto dentro de una misma serie y entre carreras. Esta variabilidad es una consecuencia del método típicamente empleado para generar estos agregados, que implica disociación mecánica de las colonias de células. Para reducir esta variabilidad, una serie de enfoques se han utilizado para controlar el número de células por agregado, así como el diámetro agregado y uniformidad. Los ejemplos incluyen la formación de agregados en tubos de microcentrífuga de 4 o como colgante gotas 5, micropatterning definen bidimensionales colonias HPSC 6 que a continuación pueden ser transferidos a la suspensión, o centrifugación de las células en U o placas de múltiples pocillos de fondo en V 7,8, 9. Sin embargo, todos estos aproaches están limitadas por su bajo rendimiento de la generación total. sistemas basados bien emplean un enfoque similar para sistemas de placa de fondo en V, sin embargo, el menor tamaño de los micropocillos (en este protocolo, teniendo cada uno una anchura de 400 micras) permite la generación de un mayor número de agregados de uniforme de una sola cultura-placa de pocillos (diámetro estándar de 15,5 mm que contienen ~ ~ 1.200) micropocillos que se generaría a partir de una placa entera de fondo en V 10. La formación de agregados basados bien se ha utilizado en una serie de escenarios, incluyendo la diferenciación de hPSCs a ectodérmica 11, 12 endodérmico, mesodérmico 13 y 14 extraembryonic suertes; condrogénesis de células madre mesenquimales 15; generación de sustratos uniformes para el cribado toxicológico 16; y las investigaciones de mecanobiología 17.
Un desafío importante en el desarrollo de protocolos de fabricación robustos para la producción de derivados de cardiom HPSCyocytes ha sido la falta de reproducibilidad en la eficiencia de la diferenciación cardiaca entre las corridas. Hemos demostrado anteriormente que esta variabilidad puede atribuirse a la heterogeneidad en la población HPSC de partida, que comprende tanto las células auto-renovación y la diferenciación hPSCs que expresan genes asociados con endodermo y neural diferenciación 6,18. Las señales secretadas por estas células que se diferencian impacto inducción cardiaca. Específicamente, endodermo extraembrionario promueve la inducción cardíaca, mientras que los progenitores neurales inhiben la inducción cardiaca. Al HPSC agregación, las células dentro del agregado de diferenciar y organizar de manera que hPSCs indiferenciadas están rodeados por una capa de células del endodermo extraembrionario que se desarrollan en la superficie total de 13. Mediante el control de tamaño de los agregados, que pueden modular la proporción de células del endodermo cardíacos que inducen a hPSCs indiferenciados (relación de superficie a volumen) y optimizar esta relación para la inducción cardiaca máxima 13.
Protocolo
1. Preparación de los componentes del medio
- Preparar medio de lavado. Por 100 ml de DMEM / F12, añadir 1 ml de 100x penicilina / estreptomicina (Pen / Strep), 1 ml de 100x L-glutamina, y 5 ml de la sustitución de suero.
- Preparar el químicamente definido basal cardiaca de inducción medio de acuerdo con las instrucciones del fabricante.
- Preparar los reactivos siguientes acciones para los medios que serán utilizados en este protocolo.
- Ácido L-ascórbico: Preparar una solución madre de 5 mg por ml en 4 ° C, el agua destilada ultrapura estéril en un tubo cónico.
- Deja esta solución en hielo y agitar el tubo periódicamente hasta que el soluto se disuelve completamente. Filtros de esterilizar la solución de ácido ascórbico usando un filtro de jeringa de 0,22 micras.
- Preparar alícuotas de 1 ml de la solución de ácido ascórbico y almacenar estas alícuotas a -20 ° C. Utilice una alícuota recién descongelado se prepara cada medio tiempo.
- En el día de la preparación de medio, Diluir 13 l de monotioglicerol (MTG) en 1 ml de Basal Medium cardíaca inducción. Descartar sin usar, MTG diluida.
- Preparar alícuotas de 1 ml de transferrina (30 mg / ml) para almacenar a -20 ° C. Tienda descongeló alícuotas a 4 ° C durante un máximo de 3 meses.
- Preparar ácido 4 mM clorhídrico (HCl) que contiene 0,1% de albúmina sérica bovina (BSA). En una campana de humos, añadir 30 l de solución de HCl 6,0 N a 50 ml de agua destilada ultrapura. Filtros de esterilizar la solución utilizando un filtro de jeringa de 0,22 micras. Añadir 2 ml de solución de BSA al 25% a la solución de HCl 50 ml.
- Preparar Phosphate Buffered Saline (PBS) que contiene 0,1% de BSA. Añadir 20 l de solución de BSA 25% por ml de PBS.
- Preparar humana Proteína morfogenética ósea 4 (BMP-4) solución madre (10 ng / l). Disolver 10 mg liofilizados BMP-4 en 1 ml de solución tampón 4 mM HCl que contiene 0,1% de BSA. Preparar 50 l alícuotas para almacenar a -20 ° C.
- Preparar humano factor de crecimiento fibroblástico 2 solución madre (bFGF)(10 ng / l). Disolver 10 mg liofilizado bFGF en 1 ml de salina tamponada con fosfato (PBS) conteniendo 0,1% de BSA. Preparar 50 l alícuotas para almacenar a -20 ° C.
- Preparar Vascular Endotelial Growth Factor humano (VEGF) stock solución (5 ng / l). Disolver 5 g VEGF liofilizado en 1 ml de PBS que contenía 0,1% de BSA. Preparar 50 l alícuotas para almacenar a -20 ° C.
- Preparar una solución madre activina (10 ng / l). Disolver 10 mg liofilizados activina A en 1 ml de PBS que contenía 0,1% albúmina de suero bovino (BSA). Preparar 50 l alícuotas para almacenar a -20 ° C.
- Preparar inhibidor de Wnt Producción-2 (2-IWP) solución madre (10 mM). Disolver 2 mg IWP-2 en 429 l sulfóxido de dimetilo (DMSO). Preparar 10 l alícuotas para almacenar a -80 ° C.
- Ácido L-ascórbico: Preparar una solución madre de 5 mg por ml en 4 ° C, el agua destilada ultrapura estéril en un tubo cónico.
- Preparar completa cardiaca inducción Medio. A 100 ml de Inducción cardíaca basal mediano, añadir 1 ml de 100x penicilina / estreptomicina, 1 ml de 100x L-glutamina, 500 l de transferrina, 1ml de ácido ascórbico recién descongelado, y 300 l de MTG. Desechar medio sin usar.
2. Preparación de la microplaca
NOTA: Todos los pasos deben realizarse en una cabina de seguridad biológica.
- Añadir 0,5 ml de solución de lavado (componente del kit) a cada pocillo que se utilizará en el plato. Para asegurarse de que los contactos de la solución toda la superficie interior de cada pocillo, se centrifuga la placa a 840 xg durante 2 min.
- Incubar la placa durante 30 a 60 min a TA.
- Aspirar el líquido de lavado de los pocillos. Lavar cada pocillo dos veces de la siguiente manera: Añadir 1 ml de PBS a cada pocillo, se centrifuga la placa a 840 xg durante 2 minutos, y luego aspirar el PBS.
3. Formación de HPSC agregados en la microplaca
NOTA: Todos los pasos deben realizarse en una cabina de seguridad biológica.
- Coloque medio de lavado en un baño de agua a 37 °.
NOTA: El volumen requerido = 1 ml x número de pozos de HPSC que se disocia. - Disociar hPSCs a células individuales
NOTA: Estos pasos describen la disociación de las células cultivadas en placas de 6 pocillos - los volúmenes de reactivos se pueden escalar proporcionalmente para diferentes formatos de cultivo.- Aspirar el medio de cultivo de cada cultivo HPSC bien para la disociación. Enjuague cada pocillo con 1 ml de enzima de disociación y, a continuación aspirar de inmediato la enzima de disociación de cada pocillo.
NOTA: enzima de disociación residual debe ser suficiente para disociar las células. - Incubar la placa a 37 ° C durante 3 min.
- Añadir 1 ml de medio de lavado a cada pocillo y mecánicamente disociar las células de la superficie de cultivo de tejidos pipeteando el medio de lavado con una micropipeta P1000 sobre la superficie de cultivo de tejidos. Si la disociación parece ser permanecen grupos incompletos y celulares, pasar la suspensión a través de un colador en este punto.
- Transferir la suspensión celular a un tubo cónico de 15 ml y almacenarel tubo en la incubadora, mientras que el recuento de células se lleva a cabo en la siguiente etapa.
- Realizar un recuento de células:
- Tomar una muestra de 10 l de la suspensión celular recogida en el paso anterior. Añadir 30 l de azul de tripano y mezclar bien la suspensión con la pipeta.
- Transferencia de 10 l de células teñidas con azul de tripano para cada cámara de un hemocitómetro y visualizar bajo el microscopio invertido con el objetivo de 10X. Contar las células.
- A partir de los resultados del conteo de células, calcular cuántos pozos se pueden sembrar a 1,2 x 10 6 células por pocillo de la microplaca. Calcula Agregación Medio necesaria para sembrar las células en 1 ml por pocillo.
- Para preparar el medio de agregación. Por 10 ml de completa cardíaca inducción mediana, añadir 0,5 l de solución madre de BMP4 (concentración final = 0,5 ng / ml) y Y-27632 ROCA inhibidor (concentración final = 10 mM).
- Retire el tubo cónico que contiene los hPSCs de la incubadora y centrifuge el tubo a 200 xg durante 5 min. Aspirar el medio de lavado y resuspender las células en medio de agregación a una densidad de 1,2 x 10 6 células por ml.
- Aspirar la solución de lavado PBS de cada pocillo de la microplaca. Usando una micropipeta P1000, distribuir uniformemente y de semillas de 1 ml de la suspensión celular a cada pocillo en la placa de micropocillos. Para sembrar un gran número de pozos, vórtice periódicamente la suspensión de células para evitar la sedimentación.
- Centrifugar la placa a 200 xg durante 5 min. Examinar la placa bajo el microscopio para confirmar las células han hecho girar a la parte inferior de cada pocillo.
- Se incuba la placa durante 24 horas a 37 ° C en un 5% de CO2, 5% de O2 (hipoxia) incubadora.
- Aspirar el medio de cultivo de cada cultivo HPSC bien para la disociación. Enjuague cada pocillo con 1 ml de enzima de disociación y, a continuación aspirar de inmediato la enzima de disociación de cada pocillo.
4. Inducción cardíaca Etapa 1
- Un día después de la agregación (día 1), preparar el volumen requerido de la Etapa 1 medio de inducción (para una placa de 24 pocillos, de volumen = 1 ml x número de pozos). Para 1 ml de completamedio de inducción cardiaca, añadir 1 l de BMP4 solución madre (concentración final = 10 ng / ml), 0,5 l de bFGF solución madre (concentración final = 5 ng / ml), y 0,6 l de activina A (concentración final = 6 ng / ml). Coloque el medio en un baño de agua C 37 ° durante al menos 15 min.
- Retire la placa de micro de la incubadora. De los agregados bajo el microscopio. En comparación con la agregación inmediatamente después de la centrifugadora, que deben aparecer intacta, con bordes lisos (más redonda y cuadrada de menos que el día anterior).
- Eliminar el sobrenadante sin perturbar los agregados dentro de los pocillos:
- Mantenga la microplaca en posición horizontal (es decir., No lo incline). Para cada pozo de la placa de micro, coloque la punta de una micropipeta P1000 en la superficie del medio de cultivo y contra el borde del pozo.
- Retire lentamente el medio, teniendo cuidado de no molestar a los agregados en el fondo de los pocillos. Después de la reducción de tque el nivel medio de alrededor de 1 a 2 mm de la superficie de micropocillos texturizado, lentamente incline la placa para recoger medio en un lado del pozo (una vez que el volumen es suficientemente baja, el movimiento del fluido se reduce en gran medida y es más fácil para evitar agregados conseguir levantado fuera de sus pocillos individuales). Lentamente pipetear a cabo el medio restante en el pozo.
- Para agregar fresco Etapa 1 Inducción Medium garantizando al mismo tiempo los agregados permanecen en sus pocillos individuales: Dibuje 1 ml de medio de inducción de la etapa 1 con una micropipeta P1000. Mantenga la punta de la pipeta contra el borde interior del pozo y muy lentamente dispensar el medio contra la pared interior del pozo. Repita para los pocillos restantes.
- Devolver la placa a la incubadora en condiciones de hipoxia durante 3 días.
5. cardíaca inducción Etapa 2
- En el día 4, el lugar medio de lavado (volumen = número de pocillos x 2 ml) en un baño de agua a 37 ° C durante un mínimo de 15 min.
- Preparar el volumen necesario de la Etapa 2 de inducción Medium (volumen = número de pocillos x 1 ml): por ml de completa cardíaca inducción mediana, añadir 2 l de solución de VEGF de la (concentración final = 10 ng / ml) y 0,5 l IWP-2 solución madre (concentración final = 5 M). Coloque el preparado de la etapa 2 medio de inducción en un baño de agua a 37 ° durante un mínimo de 15 min.
- Utilizando una pipeta serológica de 5 ml, cosechar los agregados de cada pocillo de la microplaca y recoger la suspensión total en unos 15 ml tubo cónico (obtener hasta 10 pozos por tubo de 15 ml).
- Permitir que los agregados se asienten durante 15 minutos en una incubadora hipóxica.
NOTA: Este paso es importante para separar las células individuales y los restos celulares de los agregados intactos. - Aspirar el sobrenadante y resuspender cuidadosamente los agregados en 10 ml de la pre-calentado medio de lavado para eliminar las citoquinas inductivas residuales (por ejemplo, activina A es una molécula de señalización potente incluso a muy bajo concentrations).
- Centrifugar los agregados a 50 xg durante 2 min. Aspirar el sobrenadante. Volver a suspender los agregados granulados en la pre-calentado por inducción 2 Medio.
- Transferir la suspensión agregada a una placa de 24 pocillos de ultra bajo de fijación (ULA) a 1 ml por pocillo. Observar los agregados bajo el microscopio como uniforme, grupos de células cerradas. Incubar en condiciones de hipoxia hasta el día 6.
6. cardíaca inducción Etapa 3
- En el día 6, preparar el volumen necesario de la Etapa 3 Inducción Medium (volumen = número de pocillos x 1 ml). Para 1 ml de completa cardíaca inducción mediana, añadir 2 l solución de VEGF de la (concentración final = 10 ng / ml), y 0,5 l de solución madre de bFGF (concentración final = 5 ng / ml). Coloque medio de inducción de la etapa 3 preparado en un baño de agua a 37 ° durante un mínimo de 15 min.
- Usar una pipeta de 5 ml serológica para transferir los agregados a tubos de 15 ml cónicos, la puesta en común de hasta 10 ml de agregados por tubo.
- Permita 10 minutos para los agregados se asienten. Aspirar el sobrenadante y resuspender los agregados en el pre-calentado Etapa 3 Inducción Medium. Utilizando una pipeta serológica de 5 ml, redistribuir los agregados en una placa de 24 pocillos ULA a 1 ml por pocillo.
- En el día 10, preparar el volumen necesario de la Etapa 3 Inducción Medium (volumen = número de pocillos x 1 ml) según el paso 6.1.
- Utilice a 5 ml pipeta serológica para transferir los agregados a tubos de 15 ml cónicos, la puesta en común de hasta 10 ml de agregados por tubo.
- Permita 10 minutos para los agregados se asienten. Aspirar el sobrenadante y resuspender los agregados en la Etapa 3 Inducción Medium. Utilizando una pipeta serológica de 5 ml, redistribuir los agregados en una placa de 24 pocillos ULA a 1 ml por pocillo.
- Incubar en condiciones hipóxicas durante dos días. En el día 12, comenzará la incubación de las células a los niveles de oxígeno de normoxia durante el resto del periodo de cultivo (37 ° C, 20% de O 2, 5% de CO 2).
NOTA:Después de este punto de tiempo, las células ya no son cultivadas bajo condiciones de hipoxia. - Repita este cambio de medio completo (pasos 6.2 y 6.3) cada 4 días, comenzando día 14 hasta la cosecha de células (típicamente, las concentraciones máximas de cardiomiocitos se observan después de día 14 de diferenciación).
7. Análisis de Flujo Citometría de troponina T (TnT) Expresión de frecuencia de salida de micropocillos de Cultura
- Disociar los agregados de la siguiente manera:
- Use un 5 ml pipeta serológica para transferir 1 bien de los agregados a un tubo cónico de 15 ml. Centrifugar los agregados a 50 xg durante 2 min y aspirar cuidadosamente el sobrenadante.
- Añadir 1 ml de solución de 1 mg / ml de colagenasa tipo II recién disuelto a los agregados. Transferir la suspensión agregada a un tubo de microcentrífuga de 1,5 ml. Incubar los agregados en colagenasa de tipo II durante la noche a temperatura ambiente.
- El día siguiente, utilizar una micropipeta P1000 para disociar los agregados suavementeen una suspensión de células individuales homogénea. Si los agregados no se disocian fácilmente, resolver los agregados, aspirar el sobrenadante, y se incuban los agregados en 700 l de enzima de disociación para 1-2 min a TA. pipetear suavemente los agregados de 1 a 2 veces con una micropipeta P1000 disociar.
- Diluir la enzima de disociación: Añadir 700 l de medio de lavado que contienen 14 l de 1 mg solución madre de ADNasa ml /. Tomar una muestra de 10 l para realizar un recuento de células y centrifugar la suspensión restante utilizando una microcentrífuga de sobremesa a 300 xg durante 2 min.
- Realizar un recuento de células: Mancha de la muestra de recuento 10 l con un volumen igual de Trypan Blue y contar con un hemocitómetro.
- Retire el tubo de microcentrífuga de 1,5 ml que contiene las células restantes de la microcentrífuga. Aspirar el sobrenadante y resuspender las células, a una concentración de 200.000 a 500.000 células por 100 l, en solución salina equilibrada de Hanks que contiene2% de suero bovino fetal (HF).
- Para cada condición, la transferencia de 100 l de suspensión de células por pocillo a 2 pocillos de una placa de 96 pocillos (un pocillo se tiñeron con el anticuerpo cTnT y el otro será el control anticuerpo secundario).
- Centrifugar la placa a 300 xg durante 2 min. Eliminar el sobrenadante con una micropipeta multicanal.
- Fijar las células: Añadir 200 l de solución de fijación (componente del kit) por pocillo y se incuba la placa durante 15 min a TA.
- Centrifugar la placa a 300 xg durante 2 min. Utilice una micropipeta multicanal de retirar cuidadosamente el sobrenadante de los pocillos. Desechar el sobrenadante en un contenedor de residuos paraformaldehído.
- Se lavan las células fijadas dos veces: Añadir 200 l de HF a cada pocillo. Centrifugar la placa a 300 xg durante 2 min. Aspirar el sobrenadante y repetir el paso de lavado una vez más. Las células fijadas se pueden almacenar durante un máximo de una semana de HF a 4 ° C.
- Permeabilizar las células:
- Centrifugar la placa a 300xg durante 2 min.
- Añadir 100 l de permeabilización de la solución (componente del kit) a cada pocillo y se incuba la placa a temperatura ambiente durante 5 min.
- Centrifugar la placa a 300 xg durante 2 min y aspirar el sobrenadante.
- Preparar una mezcla maestra de anti-cTnT en HF en la concentración óptima para el número de lote dado (La dilución óptima debe determinarse por titulación y típicamente varía de 1: 500 a 1: 2000).
- Para cada condición (2 pozos por condición), añadir 100 l de mezcla maestra a un pocillo (muestra teñida) y 100 l de HF sin formato a otro bien (control anticuerpo secundario). Se incuban las células a 4 ° C durante 30 min.
- Centrifugar las células a 300 xg durante 2 min. Aspirar el sobrenadante y añadir 200 l de HF por pocillo. Repita este paso de lavado una vez más.
- Preparar una mezcla maestra de la secundaria de anticuerpos. Transferir un volumen de HF que corresponde a 100 l por cada pocillo (control de anticuerpo secundario ycTnT-manchado) se está tratando. Añadir 1 l de cabra anti-ratón-APC anticuerpo secundario por cada 200 l de HF (dilución 1: 200).
- Manchar las muestras. Añadir 100 l de solución de tinción a cada pocillo (tanto el control de anticuerpo secundario y pozos teñidas con anti-cTnT). Se incuban las células en la oscuridad a 4 ° C durante 30 minutos (mantenga la placa de cubierta o en la oscuridad después de la adición de anticuerpo secundario fluorescente para evitar photobleaching).
- Centrifugar las células a 300 xg durante 2 min. Aspirar el sobrenadante y añadir 200 l de HF por pocillo. Repita este paso de lavado una vez más.
- Transferir las muestras a 5 ml de fondo redondo de flujo citómetro de tubos de análisis y realizar citometría de flujo para la señal en el canal de APC utilizando los protocolos estándar para el instrumento 19.
Resultados
agregados de tamaño controlado de hPSCs efectivamente se pueden formar usando el sistema de micropocillos, sólo depende de la concentración de células y el área superficial de micropocillos. Después de una breve centrifugación, los números apropiados de células (1.000 en este protocolo) se reúnen en cada micropocillo (Figura 1A). Es importante destacar que estas células restablecer las conexiones intracelulares dentro de las 24 horas, y ya no deben llenar el pozo, pero aparecen como agregados compactos con bordes lisos (Figura 1B). Estos agregados proporcionan los materiales de partida para una mayor diferenciación hacia un destino cardiaca. Si las células no pueden formar racimos apretados, esto sugiere una posible muerte celular después de la disociación y el reagrupamiento y la idoneidad de las concentraciones individuales pases celular e inhibidor de ROCK una línea celular particular, debe ser examinado. Los siguientes tres días en pocillos muestran poco cambio en morfo agregadalogía, aunque algunos de crecimiento es evidente. Cuando se extraen de los pocillos, los agregados deben mantener su morfología redonda, apretada y ser de un tamaño similar entre sí (Figura 1C). Cultura en la ULA placas de 24 pocillos permitirá una mayor expansión y el crecimiento celular.
En el día 8, después de la exposición a la activina primera señalización, y la inhibición de Wnt, los agregados comenzarán a aparecer en forma de agregados más grandes y más brillantes (Figura 1D). Durante este período, considerable restos celulares será evidente en la parte inferior de cada pocillo y debe ser eliminado, permitiendo agregados se asienten antes de retirar los medios de comunicación. De vez en cuando, muchos agregados se fusionan juntos. Esto no va a inhibir la diferenciación de otros agregados en el pozo, aunque estos "super agregados" tienden a no mostrar los cambios morfológicos observados con agregados más pequeños y son menos propensos a sufrir diferenciación completa.
"Jove_content" fo: keep-together.within-page = "1"> Continuación resultados de diferenciación en los cambios morfológicos notables a los agregados con un aumento del tamaño y la apariencia de las regiones fibrosas organizados. Para el día 12, se pueden observar los agregados de contratación. Estos siempre se componen de células grandes, transparentes y con frecuencia incluyen extensa matriz extracelular fuera del agregado (Figura 2). Mientras que las contracciones a nivel de agregados indican una diferenciación exitosa, la expresión del marcador cardiaco también se puede observar en los agregados que no aparecen a contraerse. Tras la disociación de los agregados y immunolabeling, una mayoría de las células será positiva para el marcador de cTnT cardiomiocitos por citometría de flujo (Figura 3). La expresión de este marcador es estable en las células y se puede observar en los agregados tan tarde como 19 días de diferenciación.
1.jpg "/>
Figura 1: Cronología de HPSC diferenciarse hacia un destino cardiaca Inmediatamente después de la agregación, las células se llenan casi cada pocillo (A).. Un día después, los agregados aparecen condensados y suave (B). Esta morfología persiste incluso cuando los agregados se retiran de los pocillos y se sembraron en placas de pocillos (C). En el día 8, los agregados comienzan a expandirse y aparecen de color más claro (D). Barra de escala:. 250 micras Haga clic aquí para ver una versión más grande de esta figura.
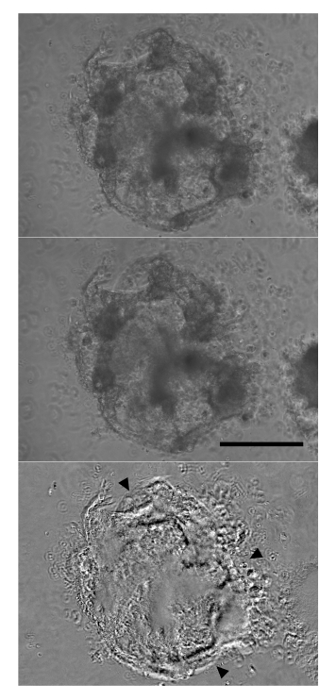
Figura 2: Agregados a contraerse por el día 12 de Diferenciación Después de seis días de la función cardiaca inducción Etapa 3 Media, se observaron contracciones a nivel de agregado contundentes (panel superior:. Relajarseación, el panel medio: contracción). El panel inferior se deriva de restar los paneles superior y medio, con la mayoría de las diferencias significativas que aparecen como negro o blanco (puntas de flecha). Barra de escala:. 250 micras Haga clic aquí para ver una versión más grande de esta figura.
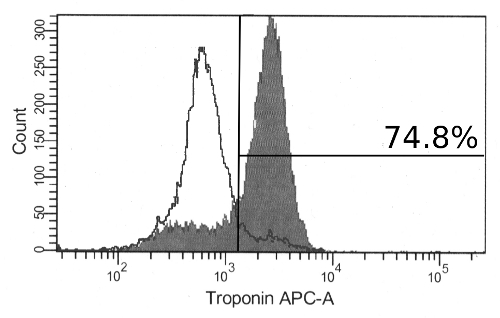
Figura 3:. Immunolabeling para troponina T en Diferenciada hPSCs Al día 17, la mayoría de las células son positivas para la troponina cardíaca T por citometría de flujo (histograma relleno). También se muestran las células teñidas con el anticuerpo secundario solo (histograma sin relleno). Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
Se ha observado que la diferenciación cardiaca eficaz de células madre pluripotentes es un proceso altamente variable. Si bien no es sorprendente que diferentes líneas celulares muestran diferentes tendencias para la capacidad de diferenciación de tipos celulares específicos, se ha observado que la eficiencia cardiaca diferenciación fluctúa drásticamente entre replicar ejecuta utilizando la misma línea celular 6. El protocolo descrito aquí se dirige a una fuente principal de esta variabilidad controlando directamente el número de células de entrada por agregado. Para reducir aún más la variabilidad entre las corridas, se recomienda que se utilizan líneas de HPSC adaptadas para pases de células individuales, ya que esta forma de HPSC de expansión y el mantenimiento resulta en poblaciones pluripotentes más consistentes con respecto a las frecuencias de expresión de los marcadores de pluripotencia (por ejemplo, Oct4, Nanog, Tra-1-60, etc.).
El protocolo tal como está escrita aquí especifica un tamaño agregado de 1.000 células de Oinducción cardiaca ptimal desde la línea de células madre embrionarias HES-2. Para aplicar este protocolo para las diferentes líneas celulares, es muy importante que una pantalla inicial tamaño de los agregados puede realizar para determinar el tamaño del agregado celular óptima alineación específica. Si bien no afecta directamente a los procedimientos que se han seguido hasta aquí, recordamos al lector que los cambios de tamaño de los agregados y la densidad celular en general se espera que afecten el suministro de oxígeno. Esto puede convertirse en una consideración relevante en aplicaciones posteriores. Además, la muerte celular por apoptosis es una preocupación durante la disociación de hPSCs a células individuales. Por lo tanto, es fundamental para asegurar que inhibidor de la roca esté presente durante la agregación celular forzado en los pocillos. Por último, es crítico que el día 4 de la diferenciación de los agregados son bien lavadas para eliminar trazas Activina A, presente en la inducción 1 mediana, antes de la resuspensión en la inducción de 2 Medium. Después de día 4 de diferenciación, activina A promueve la diferenciación endodermo a expensas de mesoinducción Derm 20.
La principal aplicación de esta técnica es seleccionar tamaños de los agregados que promueven la diferenciación cardiaca eficiente. Sin embargo, una de las limitaciones de la técnica actual es que es difícil de escalar la producción cardíaca a niveles clínicamente relevantes utilizando placas de microtitulación. Escala de la diferenciación cardiaca se lleva a cabo normalmente en condiciones de cultivo a granel en biorreactores suspensión agitada 21. Por lo tanto, una vez que el sistema de micropocillos se ha utilizado para determinar los rangos aceptables de tamaño de los agregados para la inducción cardiaca eficiente, el siguiente paso de ampliar es determinar las velocidades del impulsor biorreactor que pueden generar el tamaño del agregado celular deseada.
Una de las diferencias importantes de esta técnica con respecto a otros métodos para la diferenciación cardíaca basados en agregados es que permite dirigir las investigaciones en la modulación de los efectos de la señalización endógena en los agregados, así comoel co-cultivo de tipos de tejidos inductivos / inhibitorios con los hPSCs en el agregado 13. Este tipo de investigaciones pueden informar el desarrollo de procesos de producción a gran escala cardiaca.
Divulgaciones
M.U. has a financial interest in the underlying microwell technology.
Agradecimientos
We thank Dr. Peter Zandstra, in whose laboratory this protocol was developed, and Drs. Mark Gagliardi and Gordon Keller who provided assistance in establishing the initial methods on which this process was based. Protocol development was supported by an Ontario Graduate Scholarship in Science and Technology to C.B. and a grant from the Heart and Stroke Foundation of Ontario to Peter Zandstra.
Materiales
| Name | Company | Catalog Number | Comments |
| Biological safety cabinet | |||
| Pipette aid | |||
| Serological pipettes (5 to 25 ml) | |||
| Aspirator | |||
| Aspirator or Pasteur pipettes | |||
| 15 and 50 ml conical tubes | |||
| Fume hood | |||
| 0.22 µm syringe filter | |||
| 5% CO2, 5% O2, and humidity controlled cell culture incubator | Hypoxic (low oxygen) incubator | ||
| 5% CO2, 20% O2, and humidity controlled cell culture incubator | |||
| Low speed centrifuge with a swinging bucket rotor fitted with a plate holder | |||
| P2, P20, P200, and P1000 micropipettors and associated tips | |||
| Inverted microscope with 4X, 10X and 20X phase objectives | |||
| Ultra-Low Attachment (ULA) 24 well plates | Corning/Costar | 3473 | |
| 1.5 ml microcentrifuge tubes | |||
| Bench-top microcentrifuge | |||
| L-Ascorbic Acid | Sigma-Aldrich | A4403 | |
| Sterile Ultrapure distilled water | Sigma-Aldrich | W3500 | |
| Vortex | |||
| Ice | |||
| -20 °C freezer | |||
| Monothioglycerol | Sigma-Aldrich | M6145 | Toxic; Aliquoting of MTG is strongly recommended to minimize oxidation due to repeated opening. Aliquots can be stored at 4 °C for up to 3 months, -20 °C is recommended for long-term storage. |
| StemPro-34 Medium | Thermo Fisher Scientific | 10639-011 | Basal Cardiac Induction Medium; The supplement is stored at -20 °C and the basal medium at 4 °C. |
| Transferrin | Roche | 10652202001 | |
| BMP-4 | R&D Technologies | 314-BP | |
| bFGF | R&D Technologies | 233-FB | |
| VEGF | R&D Technologies | 293-VE | |
| Activin A | R&D Technologies | 338-AC | |
| IWP-2 | Reagents Direct | 57-G89 | |
| Phosphate buffered saline (PBS) | Thermo Fisher Scientific | 14190 | |
| Bovine Serum Albumin (BSA) | Thermo Fisher Scientific | 15561 | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | Corrosive |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| DMEM/F-12 | Thermo Fisher Scientific | 12660 | |
| 100x Penicillin/Streptomycin | Thermo Fisher Scientific | 15140 | |
| 100x L-glutamine | Thermo Fisher Scientific | 25030 | |
| Knockout Serum Replacement | Thermo Fisher Scientific | 10828010 | |
| TrypLE Select | Thermo Fisher Scientific | 12563 | Dissociation enzyme |
| Hemocytometer | |||
| Trypan Blue | |||
| Aggrewell 400 plates | StemCell Technologies | 27845 | Microwell Plates |
| Aggrewell Rinsing Solution | StemCell Technologies | 7010 | Microwell Rinsing Solution |
| Y-27632 ROCK Inhibitor | Tocris | 1254 | |
| Collagenase Type II | Sigma-Aldrich | C6885 | |
| Hank's Balanced Salt Solution | Thermo Fisher Scientific | 14025092 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 12483 | |
| 96 well plate (for FACS staining) | |||
| Intraprep Permeabilization Reagent | Beckman Coulter | IM2389 | Kit with 2 parts: Fixation Solution and Permeabilization Solution; Toxic |
| cTnT antibody | Neomarkers | MS-295 | |
| goat anti-mouse-IgG APC antibodyThermoFisher | Molecular Probes | A865 | |
| 5 ml round bottom flow cytometry tubes | FACS machine dependent |
Referencias
- Wintermantel, E., et al. Tissue engineering scaffolds using superstructures. Biomaterials. 17, 83-91 (1996).
- Lazar, A., et al. Formation of porcine hepatocyte spheroids for use in a bioartificial liver. Cell Transplant. 4, 259-268 (1995).
- Sachlos, E., Auguste, D. T. Embryoid body morphology influences diffusive transport of inductive biochemicals: a strategy for stem cell differentiation. Biomaterials. 29, 4471-4480 (2008).
- Johnstone, B., Hering, T. M., Caplan, A. I., Goldberg, V. M., Yoo, J. U. In vitro chondrogenesis of bone marrow-derived mesenchymal progenitor cells. Exp. Cell Res. 238, 265-272 (1998).
- Steinberg, M. S. Does differential adhesion govern self-assembly processes in histogenesis? Equilibrium configurations and the emergence of a hierarchy among populations of embryonic cells. J. Exp. Zool. 173, 395-433 (1970).
- Bauwens, C. L., et al. Control of human embryonic stem cell colony and aggregate size heterogeneity influences differentiation trajectories. Stem Cells Dayt. Ohio. 26, 2300-2310 (2008).
- Koike, M., Kurosawa, H., Amano, Y. A Round-bottom 96-well Polystyrene Plate Coated with 2-methacryloyloxyethyl Phosphorylcholine as an Effective Tool for Embryoid Body Formation. Cytotechnology. 47, 3-10 (2005).
- Ng, E. S., Davis, R. P., Azzola, L., Stanley, E. G., Elefanty, A. G. Forced aggregation of defined numbers of human embryonic stem cells into embryoid bodies fosters robust, reproducible hematopoietic differentiation. Blood. 106, 1601-1603 (2005).
- Burridge, P. W., et al. Improved human embryonic stem cell embryoid body homogeneity and cardiomyocyte differentiation from a novel V-96 plate aggregation system highlights interline variability. Stem Cells Dayt. Ohio. 25, 929-938 (2007).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PloS One. 3, e1565 (2008).
- Kozhich, O. A., Hamilton, R. S., Mallon, B. S. Standardized generation and differentiation of neural precursor cells from human pluripotent stem cells. Stem Cell Rev. 9, 531-536 (2013).
- Ungrin, M. D., et al. Rational bioprocess design for human pluripotent stem cell expansion and endoderm differentiation based on cellular dynamics. Biotechnol. Bioeng. 109, 853-866 (2012).
- Bauwens, C. L., et al. Geometric control of cardiomyogenic induction in human pluripotent stem cells. Tissue Eng. Part A. 17, 1901-1909 (2011).
- Golos, T. G., Giakoumopoulos, M., Garthwaite, M. A. Embryonic stem cells as models of trophoblast differentiation: progress, opportunities, and limitations. Reprod. Camb. Engl. 140, 3-9 (2010).
- Markway, B. D., et al. Enhanced chondrogenic differentiation of human bone marrow-derived mesenchymal stem cells in low oxygen environment micropellet cultures. Cell Transplant. 19, 29-42 (2010).
- Fey, S. J., Wrzesinski, K. Determination of drug toxicity using 3D spheroids constructed from an immortal human hepatocyte cell. Toxicol. Sci. Off. J. Soc. Toxicol. 127, 403-411 (2012).
- Wallace, L., Reichelt, J. Using 3D culture to investigate the role of mechanical signaling in keratinocyte stem cells. Methods Mol. Biol. Clifton NJ. 989, 153-164 (2013).
- Ungrin, M., O'Connor, M., Eaves, C., Zandstra, P. W. Phenotypic analysis of human embryonic stem cells. Curr. Protoc. Stem Cell Biol. , (2007).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. J. Vis. Exp. JoVE. , e52010 (2014).
- Nostro, M. C., et al. Stage-specific signaling through TGFβ family members and WNT regulates patterning and pancreatic specification of human pluripotent stem cells. Dev. Camb. Engl. 138, 861-871 (2011).
- Niebruegge, S., et al. Generation of human embryonic stem cell-derived mesoderm and cardiac cells using size-specified aggregates in an oxygen-controlled bioreactor. Biotechnol. Bioeng. 102, 493-507 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados