Method Article
Crecimiento diferida Ensayo de inhibición para cuantificar el efecto de antimicrobianos de bacterias derivadas de la Competencia
En este artículo
Resumen
The deferred growth inhibition assay can be used to assess the competition effect by one bacterial isolate on another. Inhibition is quantified by measuring the zone of clearing around the inhibitor-producing isolate, or qualitatively assessed by determining the visible extent of inhibition.
Resumen
Competitive exclusion can occur in microbial communities when, for example, an inhibitor-producing strain outcompetes its competitor for an essential nutrient or produces antimicrobial compounds that its competitor is not resistant to. Here we describe a deferred growth inhibition assay, a method for assessing the ability of one bacterium to inhibit the growth of another through the production of antimicrobial compounds or through competition for nutrients. This technique has been used to investigate the correlation of nasal isolates with the exclusion of particular species from a community. This technique can also be used to screen for lantibiotic producers or potentially novel antimicrobials. The assay is performed by first culturing the test inhibitor-producing strain overnight on an agar plate, then spraying over the test competitor strain and incubating again. After incubation, the extent of inhibition can be measured quantitatively, through the size of the zone of clearing around the inhibitor-producing strain, and qualitatively, by assessing the clarity of the inhibition zone. Here we present the protocol for the deferred inhibition assay, describe ways to minimize variation between experiments, and define a clarity scale that can be used to qualitatively assess the degree of inhibition.
Introducción
Bacteria living in communities compete at the interspecific and intraspecific level for space and nutrients 6. Competition between microbes can often lead to exclusion of particular species or strains within a community. Exclusion can be due to competition for a particular receptor or nutrient, or the production of an antimicrobial compound by a member of the community 6.
Studies investigating competitive exclusion frequently examine the presence and absence of species using 16S rRNA sequencing 3,4,13. However, intraspecific trait variation, for example the presence or absence of antimicrobial peptide production, can hugely impact the ability of one species to inhibit another 1. Since 16S rRNA sequencing cannot distinguish between strains of the same species, intraspecific trait variation cannot be assessed. The technique described here can be used to assess the potential of individual strains to exclude other bacteria. This method has previously been used to show a positive correlation between the presence of Staphylococcus aureus inhibitory bacteria and the absence of S. aureus in a nasal community 7.
The deferred growth inhibition (competition) assay can identify production of antimicrobial compounds or nutrient competition by the inhibitor strain. It can also detect positive interactions, whereby the presence of the inhibitor strain actually improves the growth of the competitor strain. This assay can be used to create quantitative data (zone of clearing size) and qualitative data (degree of inhibition), both of which can be overlaid onto data of the presence or absence of a species within a community to find correlations between phenotype (trait) and competitive exclusion 7.
Protocolo
El siguiente método se adapta para poner a prueba 7,8 cepas de la competencia con cepas productoras de inhibidor.
NOTA: Este protocolo implica la generación de aerosoles con cultivos bacterianos. Esto sólo puede llevarse a cabo en un espacio contenido en la aplicación de las consideraciones de seguridad aprobados localmente. La pulverización de la cultura sobre las placas de agar en una cabina de seguridad de nivel 2 minimizará la contaminación de las placas de agar y el medio ambiente circundante. Esto también protegerá el investigador de la inhalación de aerosol de las bacterias pulverizadas, esta es una de las principales preocupaciones si el investigador está utilizando un nivel de contención 2 organismos. equipo de protección personal adecuado debe ser usado. La zona que rodea la placa de Petri está mejor cubierto con papel absorbente desechable. Se recomienda la descontaminación posterior a la pulverización usando luz UV.
1. Preparación de las placas de agar
- Preparar agar infusión de cerebro y corazón (BHI) de acuerdo a la manulas instrucciones del fa-.
- Autoclave el agar BHI a 121 ° C, 15 psi durante 20 min, o de acuerdo con las recomendaciones del fabricante autoclave, para esterilizar.
- Verter 15 ml alícuotas de agar BHI esterilizada en placas de Petri estériles y permitir que fije.
NOTA: asegurar que cada placa de agar que se utilizará dentro de el ensayo se origina en el mismo stock de agar y que hay la misma cantidad de agar en cada placa. Esto limita la variabilidad de los nutrientes disponibles y difusión inhibidor entre las placas que permiten la comparabilidad.
2. Preparación estéril Caldo
- Preparar el caldo de BHI de acuerdo con las instrucciones del fabricante.
- Añadir alícuotas de 10 ml de BHI 28 botellas de vidrio universales ml.
- Autoclave el caldo BHI a 121 ° C, 15 psi durante 20 min, o de acuerdo con las recomendaciones del fabricante autoclave, para esterilizar.
NOTA: Asegúrese de que todo el caldo utilizado en el ensayo se origina en el mismo lote de caldo de autoclaved al mismo tiempo para limitar la variación en nutrientes que podrían causar variación en los resultados.
3. Preparación frasco estéril vaporizador (s)
- Desmontar la botella vaporizador.
- Rocíe detergente tensioactivo 5% a través del vaporizador para eliminar los contaminantes internos, remoje la botella vaporizador, la tapa y el vaporizador en el agente tensioactivo de limpieza 5% durante la noche.
NOTA: Los guantes y equipo de protección personal adecuado deben utilizarse durante la manipulación de limpieza de superficie activa. - Se seca el vaporizador, la tapa y botellas bajo campana de flujo de aire estéril.
- Llenar la botella con un 70% de etanol, vuelva a colocar vaporizador y rociar un poco de etanol a través del vaporizador.
- Ponga la tapa en el vaporizador y almacenar con el etanol en el interior hasta su uso.
- Inmediatamente antes de su uso, asépticamente enjuagar la botella con el caldo de BHI estéril y pulverizar el caldo a través de la vaporizador.
NOTA: Esto evita que el etanol affeja el inóculo agregado a la botella en la sección 6.3.
4. Preparación del cultivo de una noche bacteriana (s)
- Streak el competidor y el inhibidor de las cepas sobre una placa de agar BHI estéril y se incuba a 37 ° C aeróbicamente durante aproximadamente 18 h (durante la noche).
NOTA: Esta placa produce una acción de las bacterias que se pueden utilizar para múltiples repeticiones dentro de la misma semana cuando se almacenan a 4 ° C. - Inocular 10 ml de caldo de BHI estéril con una sola colonia de la cepa bacteriana que competidor dentro de una botella universal de 28 ml.
- Incubar la botella universal, a 37 ° C aeróbicamente durante la noche por agitación a 250 rpm en un agitador orbital.
5. Punto Cultura del aislado Inhibidor productoras
- Preparar la cultura (s) durante la noche como se describe en la sección 4.
- Asegúrese de placas de agar son completamente seco, sin condensación en la tapa, antes de la inoculación (por ejemplo, mediante la incubación de plate durante 60 min a 37 ° C); esto impide que el inóculo se propague a través de la placa desde el sitio de la inoculación.
- Pipetear 25 l de cultivo de una noche en el centro de las placas de agar. Evitar presionar completamente el émbolo de la pipeta para evitar burbujas de aire que rocían la cultura a través del agar.
- Deje que la cultura se seque a temperatura ambiente para limitar la propagación de la cultura. Se incuban las placas de agar a 37 ° C aeróbicamente durante la noche.
6. Preparación del inóculo de aerosol de la cepa de prueba de un competidor (s)
- Preparar el cultivo de una noche como se describe en la sección 4. Diluir la noche a la mañana de cultivo de 10 veces en caldo BHI para producir aproximadamente 4 x 10 6 UFC ml -1, y una suspensión de 600 OD de 0,3 ± 0,05.
NOTA: A 10 veces la dilución no dará 4 x 10 6 UFC ml-1 para todas las especies bacterianas, calcular el factor de dilución necesaria por la propagación placas diluciones seriadas entre 1 x 10 -1 -1 x 10 -6. - Verter el cultivo diluido en una botella de perfume vaporizador de plástico estéril.
NOTA: El volumen total debe ser más de lo necesario para que se rocía el número de placas de agar. Aproximadamente 250 l por placa es adecuado para un diámetro de plato de Petri de 9 cm.
7. Diferido Crecimiento Ensayo de inhibición
- Pulverizar la cultura a través de cada una de las botellas de vaporizador para asegurar que el cultivo se carga en el mecanismo de pulverización antes de la pulverización sobre el agar.
- Desde una distancia de aproximadamente 15 cm por encima del agar, rociar aproximadamente 250 l de cultivo diluido (3 pulverizaciones de un típico 50 ml vaporizador) sobre toda la superficie del agar. Se incuban las placas de agar a 37 ° C aeróbicamente durante la noche. Repita para otras placas con el mismo número de aplicaciones.
8. Interpretación diferidos de inhibición del crecimiento de ensayo Resultados
- Medir la zona de inhibición del crecimiento de la competi rociadotor cepa (Figura 1 A - C, "X" a "X") en milímetros, restando el diámetro del punto central del inhibidor-productor (Figura 1 A - C, "Y" a "Y").
NOTA: La figura 1E muestra cómo se podría presentar estos datos - Registrar la puntuación de la claridad de las zonas de inhibición.
NOTA: Esto indica el grado de inhibición observado. Los ejemplos se muestran en la Figura 1A - D, las cepas que pueden ser utilizados para la normalización se sugieren en la sección de resultados representativo. La siguiente escala se puede utilizar para la puntuación claridad: una puntuación de 0 claridad para describir una zona de inhibición completa del crecimiento de la cepa competidor. Una puntuación de 1 para describir una zona de inhibición casi completa del crecimiento, con las colonias solamente individuales presentes en la zona de la compensación. Una puntuación de 2 para describir una zona visible de la reducción del crecimiento, el crecimiento dentro de esta zona es confluidez o cerca de la confluencia, pero redujo la densidad de> 50%. Una puntuación de 3 para describir sólo la reducción de crecimiento mínimo, el crecimiento es confluente y reducido en menos de 50%, una zona es todavía visible y medible. Una puntuación de 4 para describir ninguna inhibición visible del crecimiento. Una puntuación de 5 para describir que el crecimiento de la cepa competidor se incrementó en la proximidad de la cepa productora de inhibidor de prueba. Ver Figura 1 para los ejemplos. Estas puntuaciones son subjetivas para el experimentador.
9. Las repeticiones
- Repetir los ensayos al menos por triplicado biológica para determinar la reproducibilidad de los resultados obtenidos.
NOTA: Si repeticiones se llevan a cabo en diferentes días, tomar medidas y anotar las placas inmediatamente después de la eliminación de la incubación, a continuación, las placas de cualquiera de las tiendas a 4 ° C o tomar fotografías de alta calidad de las placas antes de desecharlos. Almacenamiento o fotografías de las placas permite una fácil comparación de los resultados entre diferentes días, tla suya es particularmente importante para la confirmación de puntuación reproducible a través de días / experimentos. Tenga en cuenta que el almacenamiento de las placas tiene el potencial de alterar los resultados.
NOTA: Para obtener fotografías claras lugar placas en posición vertical sin su tapa sobre un fondo negro mate en un área de la luz difusa, utilizar una cámara de alta resolución (≥8 MP) capaz de enfocar objetos cerca de la lente (modo macro). Como alternativa, algunos reproductores de imágenes de gel con trans-iluminador fijados a la luz blanca puede producir alta calidad, imágenes altamente reproducibles.
Resultados
Los resultados del ensayo deben ser observable como una diferencia en la cepa superpuesto competidor cerca del manchado centralmente inhibidor cepa productora (Figura 1). Estas diferencias se pueden interpretar como la inhibición completa (Figura 1 A), la inhibición parcial (Figura 1B y 1C), ninguna inhibición (Figura 1D) o asociación positiva. El laboratorio ampliamente disponibles cepas de S. epidermidis y S. Tü3298 epidermidis RP62A, y S. epidermidis y S. RP62A aureus Newman se utilizaron en las figuras 1B y 1D, respectivamente. Sugerimos que estas cepas podrían ser utilizados para poner a prueba este protocolo.
Dependiendo de las especies estudiadas, completa la inhibición y la inhibición parcial es más probable el resultado de péptidos antimicrobianos, antibióticos u otros inhibito crecimiento difusibleR producidos por la cepa productora de inhibidor. La inhibición parcial también se ha ligado a la reducción de la disponibilidad de nutrientes para la cepa competidor debido a la absorción o secuestrante de nutrientes por la cepa inhibidor 6.
Comparación del tamaño de la zona de inhibición entre diferentes aislados a los inhibidores de la producción de probados contra la misma cepa competidor indica diferencias en cualquiera de los siguientes: la cantidad de antimicrobiano producido por la cepa productora de inhibidor; la capacidad del inhibidor para difundirse a través de los medios de comunicación; el tipo de inhibidor producida y el nivel de resistencia de la cepa competidor a los inhibidores que se produce. Comparación del tamaño de la zona de inhibición entre las diferentes cepas de la competencia probados contra la misma cepa inhibidor productoras es indicativo de los niveles de resistencia de las cepas de competidor para el inhibidor de la que se produce.
Los resultados pueden variar dependiendo de la cepa utilizada inhibitoria y la cepa utilizada competidor. Repite utilizando la misma cepa inhibitorio y competidor deben tener idealmente la misma puntuación claridad (que se describe en la sección 8.2), esto indica una buena técnica se ha utilizado a lo largo.
Si se ha producido la aplicación inconsistente de bacterias las placas no deben ser utilizados. Por ejemplo, si el cultivo competidor prueba es demasiado diluida la zona de inhibición aparecerá más grande y con un borde menos claramente definido que se observa típicamente (Figura 2A); esto afectaría a la fiabilidad de las mediciones comparativas de la zona. Si el punto de la cepa productora de inhibidor no se secó completamente antes de la incubación durante la noche, la cepa inhibidor es probable que se extienda y no formar un punto claramente definido (Figura 2B), que afecta típicamente a las mediciones de la zona sino que también puede afectar a la puntuación de la claridad. Si la cepa es competidorNo rocía uniformemente esto puede conducir a una distribución desigual de las bacterias (Figura 2C). Si la cepa competidor está demasiado concentrada, es posible que la cepa competidor puede crecer en la parte superior de la cepa inhibidor (Figura 2C), en casos extremos, esto puede dar lugar a algunos inversión de los papeles de deformación competidor / inhibidor.
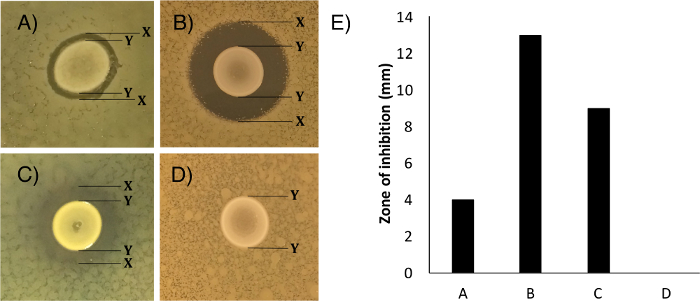
Figura 1:. La gama de resultados cualitativos y cuantitativos que se puede obtener a partir del ensayo de inhibición del crecimiento diferido Resultados para la inhibición del crecimiento pueden variar desde (A) la inhibición completa (puntuación de 0), (B) la inhibición parcial (puntuación de 1) , (C) la inhibición parcial (puntuación de 2) a (D) ninguna inhibición (puntuación de 4). Las etiquetas indican los bordes de crecimiento de las cepas de inhibidor (Y) y el borde más exterior de la inhibiciónzonas (X). El tamaño de la zona de inhibición rango de 0 mm a más de 10 mm, como se muestra en (E), que muestra las mediciones para las placas fotografiadas en A, B, C y D. Los resultados se muestran para los aislamientos de estafilococos recientes (A , C) o por estafilococos aislados de laboratorio común S. epidermidis Tü3298 (inhibidor) y S. epidermidis RP62A (competidor) (B), y S. epidermidis RP62A (inhibidor) y S. aureus Newman (competidor) (D). Haga clic aquí para ver una versión más grande de esta figura.
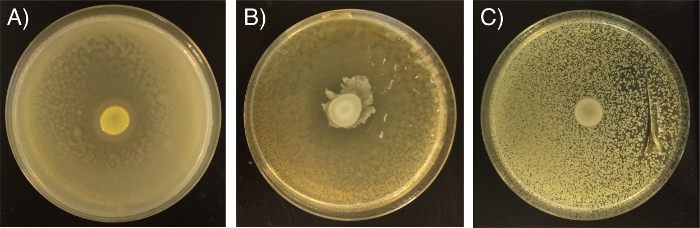
Figura 2: Ejemplos de resultados inconsistentes debido a una mala técnica Los resultados pueden parecer diferentes de lo esperado si (a. ) cepa competidor estaba demasiado diluida, (B) cepa inhibidor no estaba totalmente seco antes de incubación / placas no estaban secas o (C) si la cepa competidor no se pulverizó uniformemente y estaba demasiado concentrada. Haga clic aquí para ver una versión más grande de esta cifra.
Discusión
Un paso crítico de este protocolo la competencia de especies bacterianas que lo diferencia de los demás, es la incubación durante la noche del inhibidor de aislar antes de la adición del aislado competidor. La cepa inhibidor requiere este período de crecimiento para producir compuestos inhibidores. Como la cepa competidor se superpone en la parte superior del mismo medio, este método permite al investigador observar el potencial de la cepa inhibidor para interferir con el crecimiento de la cepa competidor. Como resultado, este ensayo refleja lo que sucede con la naturaleza; un aislado está plenamente establecido en un nicho, y el otro debe ser capaz de contrarrestar cualquier variable de inhibidores para ser capaces de invadir con éxito el nicho.
Hay dos partes en el presente Protocolo que son más susceptibles de causar resultados erróneos si se realiza de forma incorrecta. En primer lugar, la esterilización incompleta de las botellas vaporizador puede introducir bacterias contaminantes en el ensayo. Incubación del caldo utilizado para enjuagar la botella vaporizador en el paso 3.6 en un recipiente estéril se puede utilizar para confirmar botellas fueron completamente esterilizado. lavados adicionales en soluciones desinfectantes, tales como Virkon, se pueden utilizar antes de la colada en agente de limpieza de superficie activa, que se describe en el paso 3.2, si se requiere esterilización adicional.
Un segundo paso que puede causar resultados erróneos es la dilución de la cepa competidora (paso 6.1). Si la dilución no es óptima, las mediciones claras de inhibición no se pueden determinar fácilmente. Este ensayo se optimizó el uso de diversos aislados nasales como inhibidor de cepas productoras través de una amplia gama de especies Gram-positivas y Gram-negativas frente a S. SH1000 aureus como el 7,8 cepa competidor. Posteriormente, se ha probado el uso de varios estafilococos coagulasa-negativos y coagulasa positivos como competidor y cepas productoras de inhibidor. Al probar géneros distintos de los descritos anteriormente como el competidorcepa, cierta optimización de la dilución para el inóculo puede ser necesario.
Si las puntuaciones de claridad varían significativamente entre las repeticiones, podría ser necesario estandarizar el inóculo cepa competidor estableciéndola en una densidad óptica específica. Sin embargo, esto aumentará el tiempo de ensayo necesario para configurar, y es probable que reduzca el número de cepas es posible procesar en cada experimento. ajustar visualmente la cultura a un OD apropiada utilizando un estándar de McFarland puede proporcionar una alternativa rápida.
Una limitación de esta técnica es que sólo se puede aplicar a bacterias cultivables. Por ello, muchos estudios utilizan la secuenciación del 16S rRNA para predecir las interacciones de exclusión competitiva 3,4,13. Sin embargo, las técnicas genéticas y metagenomic sólo pueden distinguir a los miembros de la comunidad a nivel de especie, y / o no tienen en cuenta en particular rasgo variación intraespecífica. Es posible detectar la asociación de un particulgen ar que codifica un rasgo con la presencia o ausencia de una especie bacteriana 5, sin embargo, esto requiere conocimiento previo de un gen probable que esté asociado con la exclusión de una especie.
Una consideración de seguridad de esta técnica es que, debido a la generación de aerosoles de bacterias, sólo puede ser utilizado en los laboratorios con una cabina de seguridad de nivel 2, o con las precauciones de seguridad similares. Existen técnicas alternativas para la prueba de la competencia entre los aislados que dan cuenta de la variación intraespecífica rasgo y no generan aerosoles de bacterias. Uno de tales métodos es el ensayo de antagonismo simultánea 2. En este método, un inóculo de un aislado se extiende sobre una placa de agar, y un segundo inóculo aislado presenta puntos o acuchillado en la parte superior una vez que el primero se haya secado. Esto produciría un ambiente donde las cepas están en competencia directa (antagonismo simultánea), ambos compitiendo para producir compuestos inhibidores y compactar los nutrientes en primer lugar. el advantage del ensayo de inhibición del crecimiento diferido durante el ensayo de antagonismo simultánea es que el aislado inhibidor siempre debe tener la ventaja competitiva de ser plenamente establecida antes de la invasión del aislado competidor. Esto es más un reflejo de lo que sucedería en el medio ambiente, como en la mayoría de los nichos, se establecerá un aislado antes de añadir otra cepa, en lugar de dos aislamientos que se agregan al mismo tiempo 8.
Otra alternativa para evitar la generación de aerosoles de bacterias sería añadir el competidor aislar en agar superior, lo que podría ser vertido en lugar de pulverizar sobre el aislado de inhibidor. Sin embargo, el volumen de agar superior añadido tendría que ser de aproximadamente 3 ml para asegurar una cobertura uniforme de la placa. Dentro de este volumen, el aislado competidor no sería cada vez mayor en los mismos medios de comunicación como el aislado de inhibidor, por lo que no sufriría de nutrientes reducidos. El competidor tampoco estaría en contacto directo con los compuestos inhibidores de la UNTil se difunde en el agar superior. Tal ensayo no puede ser descrito como la inhibición o el antagonismo diferido simultánea.
Un método similar se ha utilizado anteriormente para evaluar los niveles de resistencia a la bacitracina entre S. clínica aureus 10. La principal diferencia entre el protocolo descrito aquí y que se describe en un 10, es las últimas cepas competidor solamente clasificados como sensibles (completar la claridad inhibition- marcó el 0) o resistentes (parciales o ninguna claridad inhibition- anotar 1-5). El ensayo de inhibición de crecimiento diferido, por tanto, podría también ser utilizado para la detección de niveles de resistencia a los productores de determinados antimicrobianos, o incluso para buscar nuevos antibióticos activos contra los patógenos resistentes a múltiples fármacos.
Se ha sugerido que la microflora huésped podrían ser manipuladas para eliminar los miembros no deseados de la comunidad bacteriana 9. Aplicación de corinebacterias o estafilococoylococcus epidermidis ya se ha demostrado para eliminar S. colonización aureus en las fosas nasales en una proporción significativa de la población 11,12. Los estudios sobre cepas específicas que pueden excluir competitivamente miembros indeseables de la flora de acogida, a través de técnicas como la descrita aquí, por lo tanto, pueden dar lugar a futuras terapias.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
JCM es financiado por un premio BBSRC-IPA con Unilever Plc (BB / L023040 / 1). AST es financiado por un árabe Ministerio de Educación Superior de doctorado beca de educación de Arabia.
Materiales
| Name | Company | Catalog Number | Comments |
| Brain heart infusion broth | Lab M | lab049 | rich general purpose media |
| agar-agar | Merck Milipore | 101614 | |
| Petri dishes | Sarstedt | 82.1473.001 | |
| Plastic perfume vaporizer | not known | - | 10 cm high with 3.5 cm diameter clear plastic spray bottle with lid, purchased from the travel section of a supermarket |
| Universal bottles | no longer in production, alternative SLS BOT5006 | 28 ml glass cylindrical bottle (~280 mm diameter, 850 mm height), flat bottomed with plastic screw cap | |
| Decon 90 | Decon | surface active cleaning agent |
Referencias
- Bolnick, D. I., et al. Why intraspecific trait variation matters in community ecology. Trends Ecol Evol. 26 (4), 183-192 (2011).
- Christensen, G. J. M., et al. Antagonism between Staphylococcus epidermidis and Propionibacterium acnes and its genomic basis. BMC Genomics. 17 (152), (2016).
- Faust, K., et al. Microbial co-occurrence relationships in the human microbiome. PloS Comput Biol. 8 (7), (2012).
- Frank, D. N., Feazel, L. M., Bessesen, M. T., Price, C. S., Janoff, E. N., Pace, N. R. The Human nasal microbiota and Staphylococcus aureus carriage. PLoS One. 5 (5), e10598(2010).
- Fredheim, E. G., Flaegstad, T., Askarian, F., Klingenberg, C. Colonisation and interaction between S. epidermidis and S. aureus in the nose and throat of healthy adolescents. Eur J Clin Microbiol Infect Dis. 34, 123-129 (2015).
- Hibbing, M. E., Fuqua, C., Parsek, M. R., Peterson, S. B. Bacterial competition: surviving and thriving in the microbial jungle. Nat Rev Microbiol. 8, 15-25 (2010).
- Libberton, B., Coates, R. E., Brockhurst, M. A., Horsburgh, M. J. Evidence that intraspecific trait variation among nasal bacteria shapes the distribution of Staphylococcus aureus. Infect Immun. 82 (9), 3811-3815 (2014).
- Libberton, B., Horsburgh, M. J., Brockhurst, M. A. The effects of spatial structure, frequency dependence and resistance evolution on the dynamics of toxin-mediated microbial invasions. Evol appl. 8, 738-750 (2015).
- Liu, C. M., et al. Staphylococcus aureus and the ecology of the nasal microbiome. Sci Adv. 1, e1400216(2015).
- Nascimento, J. S., Ceotto, H., Nascimento, S. B., Giambiagi-deMarval, M., Santos, K. R., Bastos, M. C. Bacteriocins are alternative agents for control of multiresistant staphylococcal strains. Lett Appl Microbiol. 42, 215-221 (2006).
- Park, B., Iwase, T., Liu, G. Y. Intranasal application of S. epidermidis prevents colonization by methicillin-resistant Staphylococcus aureus in mice. PLoS One. 6 (10), e25880(2011).
- Uehara, Y., et al. Bacterial interference among nasal inhabitants: eradication of Staphylococcus aureus from nasal cavities by artificial implantation of Corynebacterium sp. J Hosp Infect. 44, 127-133 (2000).
- Wos-Oxley, M. L., et al. A poke into the diversity and associations within human anterior nare microbial communities. ISME J. 4, 839-851 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados