Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Procedimiento para Adaptive Laboratory Evolución de microorganismos utilizando un quimiostato
* Estos autores han contribuido por igual
En este artículo
Resumen
A continuación, se presenta un protocolo para obtener la evolución adaptativa de laboratorio de microorganismos bajo condiciones de cultivo utilizando quimiostato. Además, se discute el análisis genómico de la cepa evolucionado.
Resumen
Natural evolution involves genetic diversity such as environmental change and a selection between small populations. Adaptive laboratory evolution (ALE) refers to the experimental situation in which evolution is observed using living organisms under controlled conditions and stressors; organisms are thereby artificially forced to make evolutionary changes. Microorganisms are subject to a variety of stressors in the environment and are capable of regulating certain stress-inducible proteins to increase their chances of survival. Naturally occurring spontaneous mutations bring about changes in a microorganism's genome that affect its chances of survival. Long-term exposure to chemostat culture provokes an accumulation of spontaneous mutations and renders the most adaptable strain dominant. Compared to the colony transfer and serial transfer methods, chemostat culture entails the highest number of cell divisions and, therefore, the highest number of diverse populations. Although chemostat culture for ALE requires more complicated culture devices, it is less labor intensive once the operation begins. Comparative genomic and transcriptome analyses of the adapted strain provide evolutionary clues as to how the stressors contribute to mutations that overcome the stress. The goal of the current paper is to bring about accelerated evolution of microorganisms under controlled laboratory conditions.
Introducción
Los microorganismos pueden sobrevivir y adaptarse a diversos ambientes. En situaciones de estrés severo, la adaptación puede ocurrir a través de la adquisición de fenotipos beneficiosos por mutaciones genómicas al azar y la selección positiva posterior 1-3. Por lo tanto, las células microbianas se pueden adaptar cambiando metabólica o las redes de regulación para un crecimiento óptimo, que se denomina "evolución adaptativa". microbianas tendencias recientes importantes, tales como brotes de superbacterias y la aparición de cepas microbianas resistentes, están muy estrechamente relacionados con la evolución adaptativa en condiciones de estrés. En condiciones de laboratorio definidos, somos capaces de estudiar los mecanismos de la evolución molecular e incluso controlar la dirección de la evolución microbiana para diversas aplicaciones. A diferencia de los organismos multicelulares, los organismos unicelulares son muy adecuadas para la evolución adaptativa de laboratorio (ALE) por las siguientes razones: se regeneran rápidamente, mantienen grandes poblaciones, y es fácil de crear y mantener homogeneous entornos. En combinación con los recientes avances en las técnicas de secuenciación de ADN y las tecnologías de alto rendimiento, ALE permite la observación directa de los cambios genómicos que conducen a cambios en la regulación sistémicos. dinámica mutacional y una diversidad de la población también son observables. Estrategias de ingeniería genética se pueden determinar a partir del análisis de las cepas ALE 4,5.
Cultura quimiostato es un método utilizado para obtener células en estado de equilibrio y aumentar la productividad en los procesos de fermentación de 6. se añade medio fresco y el caldo de cultivo se recoge durante el proceso (el último incluye medio y biomasa). Cultura quimiostato a largo plazo, sin embargo, cambia la productividad de estado estacionario de la cultura y provoca la acumulación de mutaciones espontáneas y la selección durante el cultivo (Figura 1a). Bajo diferentes presiones de selección (estrés), la acumulación de mutaciones es mayor. Un aumento gradual de la tensión en un largo plazo chemostat prevé una selección continua de las mutaciones que trabajan contra los factores de estrés dadas, tales como temperatura, pH, presión osmótica, el hambre de nutrientes, la oxidación, los productos finales tóxicos, etc. transferencia de colonias a partir de un medio sólido y la transferencia en serie de un medio líquido (repetido cultivo por lotes) también permiten a los investigadores obtener microorganismos evolucionados (Figura 1B y 1C). Aunque la cultura chemostat requiere métodos complicados, la piscina de la diversidad (número de repeticiones y tamaño de la población) es mayor que la obtenida por transferencia de colonias y las técnicas de transferencia en serie. La exposición al estrés estable a las células individuales y la disminución de la variación en el estado celular durante el cultivo en quimiostato (estado estacionario) son otros beneficios de ALE comparación con las técnicas basadas en el cultivo por lotes. ALE inducida por estrés de Escherichia coli sometidos a altas condiciones de succinato se introduce en este artículo.
iles / ftp_upload / 54446 / 54446fig1.jpg "/>
Figura 1: Métodos de laboratorio de la evolución adaptativa (A) Chemostat;. (B) la transferencia en serie; (C) la transferencia de la colonia. Las máximas figuras ilustran el concepto de los métodos para ALE, y las cifras de abajo ilustran el número de células que crecieron durante la ALE. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Preparación del equipo
- Obtener un frasco quimiostato (150-250 ml) o un matraz Erlenmeyer (250 ml) que contiene un orificio de entrada y un puerto de salida. Conectar los puertos con tubo de silicona que permite velocidades de flujo de 10 a 100 ml / hr. Opcionalmente, utilizar una salida de aire, un puerto de salida de aire, y puertos de entrada y salida de agua de temperatura controlada.
- Obtener un dispositivo adecuado para el frasco chemostat que proporciona para el control de la agitación y la temperatura (o utilizar una incubadora de agitación rotatoria).
- Obtener dos bombas peristálticas con el fin de entregar medio fresco y recoger el cultivo.
- Obtener un frasco de depósito (10 a 20 L) que contiene un puerto de salida de medios y un puerto de entrada de aire.
- Obtener tubo de silicona adecuado para la tasa de dilución (es decir, ID 0,8 mm, rango de flujo desde 0,06 hasta 36 ml / min; L / S 13 tubos).
2. Medio preparación y esterilización
- medio inicial
- Disolver 0,3 g de glucosa, 0,08 g NH 4Cl, 0,05 g de NaCl, 0,75 g de Na 2 HPO 4 · 2H 2 O y 0,3 g de KH 2 PO 4 en 90 ml de agua destilada (DW) en un frasco quimiostato.
- Sellar el frasco quimiostato junto con el tubo con abrazaderas. No selle la salida de aire.
- Esterilizar el frasco quimiostato en un autoclave a 121 ° C durante 15 min. Después de la esterilización, almacenar el frasco quimiostato a temperatura ambiente.
- Disolver 0,02 g MgSO4 · 7H 2 O, 0,01 g de CaCl 2, y 0,1 mg de tiamina en 10 ml DW (solución A).
- Filtrar la solución A mediante una jeringa y un filtro de jeringa pre-esterilizado (un filtro de 0,45 micras de poro).
- Añadir la solución A los filtrados a la jarra quimiostato.
- Medio estrés
- Disolver 30 g de glucosa, 8 g de NH4Cl, 5 g de NaCl, 75 g de Na 2 HPO 4 · 2H 2 O, 30 g de KH 2 PO 4, y 300 g de hexahidrato de succinato disódico (Na 2 · · 6H succinato 2 O; el factor estresante usado en este experimento) en 9,9 L DW en un frasco de depósito.
- Sellar el vaso del depósito junto con el tubo con abrazaderas. No selle la salida de aire.
- Esterilizar el vaso del depósito en un autoclave a 121 ° C durante 15 min. Después de la esterilización, almacenar el frasco a temperatura ambiente.
- Disolver 2 g MgSO 4 · 7H 2 O, 1 g de CaCl 2, y 10 mg de tiamina en 100 ml DW (solución A).
- Filtrar la solución A con una jeringa y un filtro de jeringa pre-esterilizado (un filtro de 0,45 micras de poro).
- Añadir la solución A los filtrados al vaso del depósito.
- Asépticamente conectar el tubo de silicona esterilizado al vaso del depósito y adjuntar las bombas peristálticas.
- Medio-alto estrés
- Preparar el medio como en la sección 2.2, pero con una mayor concentración de factor de estrés (es decir, 3-5 g / L mayor en la adaptación succinato).
Nota: Este protocolo es para la adaptación a un esfuerzo de THen el se pueden entregar a través del medio. En el caso de los factores estresantes físicos tales como la temperatura, agitación, o iluminación, el cultivo debe ser diseñada en consecuencia.
- Preparar el medio como en la sección 2.2, pero con una mayor concentración de factor de estrés (es decir, 3-5 g / L mayor en la adaptación succinato).
3. El cultivo inicial
- Se inocula una sola colonia de tipo salvaje E. coli en un tubo de ensayo 15 ml que contiene 4 ml de medio inicial.
- Incubar el tubo de ensayo en una incubadora de agitación durante 12 horas a 37 ° C y 220 rpm.
- transferencia asépticamente 1 ml de cultivo previo a la jarra quimiostato.
- Incubar el frasco quimiostato, proporcionando para la aireación (aire 50 ml / min) y agitación (200 rpm), a 37 ° C durante 6 horas.
4. Adaptación del estrés
- Asépticamente conectar el extremo del tubo de silicio de las bombas a la jarra quimiostato.
- Arrancar la bomba de salida (10 ml / hr o superior) y recoger la cultura.
Nota: El cultivo debe estar en la fase exponencial, típicamente 4-8 horas después del cultivo inicial. - check la densidad óptica (600 nm) del cultivo de la tubería de salida.
- Arrancar la bomba de entrada (10 ml / h, correspondiente a una tasa de dilución de 0,1 -1 hr).
- Comprobar la densidad óptica del cultivo a 600 nm desde el tubo de salida cada 24 horas.
- Operar el quimiostato durante 96 horas (volumen de negocios 9.6 veces) o más. Si la densidad óptica es estable, intercambiar el depósito que contiene el medio de alta tensión. Si la densidad óptica es inferior a 0,2, detener la bomba de entrada de alimentación durante 6 horas. Reiniciar la bomba de entrada y comprobar que la densidad óptica es superior a 0.2.
- Aumentar gradualmente la concentración del factor de estrés al cambiar a un depósito que contiene una concentración de factor de estrés superior.
- Tomar muestras de la cultura adaptada cada vez que llegue un hito (por ejemplo, una cepa adaptada a 100 g / L estrés succinato), y almacenar para su posterior análisis genómico.
- Para el almacenamiento de la muestra, mezclar la muestra de cultivo (0,5 ml) con una soluti glicerol esterilizado 80%en (0,5 ml) y almacenarlo a -80 ° C.
Nota: Si el microorganismo adquiere una capacidad de degradar el factor de estrés durante el proceso de ALE, la concentración de estrés en la jarra de fermentación no es el mismo que en el depósito fresco.
5. Single-colonia aislamiento de la cepa Stress-adaptado
- Preparar medio de placa de agar (1,6% de agar) que contiene el mismo factor de estrés y a la misma concentración de medio.
- Placa de la cultura de salida (0,1 ml) de la quimiostato, y se incuba a 37 ° C durante 16 hr.
- Recoger colonias individuales de la placa usando un palillo de dientes estéril e inocular en 15 ml tubos de ensayo que contienen el mismo factor de estrés y a la misma concentración medio como en el quimiostato, y se incuba durante 6 hr.
- Transferir 1 ml de caldo de cultivo en un matraz Erlenmeyer de 250 ml que contiene 50 ml de medio. Cosecha 0,5 ml de caldo de cultivo cada 1 hr, y medir la DO a 600 nm. Comparación de la tasa de crecimiento de la strai adaptadon a la de la cepa de tipo salvaje dado el factor de estrés.
Resultados
Para la adaptación de alta tensión succinato, la de tipo salvaje E. coli cepa W3110 se cultivó en un quimiostato a D = 0,1 h-1 por 270 días (Figura 2).
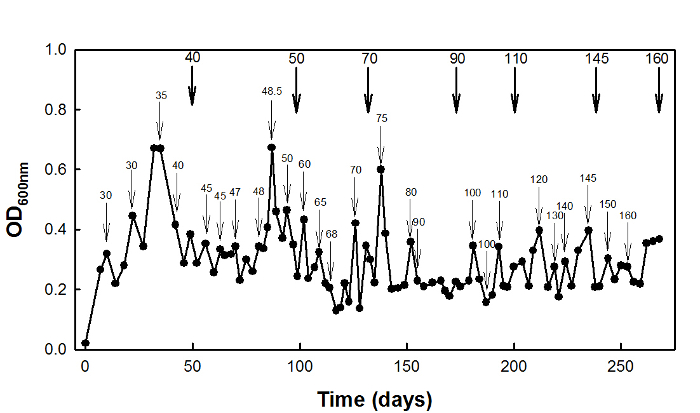
Figura 2: High-succinato de adaptación al estrés de E. coli W3110 uso de la cultura quimiostato. flechas delgadas indican los momentos en que se aumentó la concentració...
Discusión
Los microorganismos son capaces de adaptarse a casi todos los entornos debido a su rápida tasa de crecimiento y la diversidad genética. la evolución adaptativa de laboratorio permite a los microorganismos a evolucionar en condiciones diseñadas, lo que proporciona una manera de seleccionar los organismos individuales que albergan mutaciones espontáneas que son beneficiosos en las condiciones dadas.
La técnica quimiostato es más robusta para lograr la evolución impulsada artificialment...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This study was financially supported by the Korean Ministry of Science, ICT and Future Planning (Intelligent Synthetic Biology Center program 2012M3A6A8054887). P. Kim was supported by a fellowship from the Catholic University of Korea (2015).
Materiales
| Name | Company | Catalog Number | Comments |
| Mini-chemostat fermentor | Biotron Inc. | - | manufactured by special order |
| silicon tubing | Cole-Parmer | Masterflex L/S 13 | tubing size can be varied depending on the dilution rate and the size of fermentor jar. |
| reservoir jar | Bellco | Media storage bottle | 20 L |
| chemicals | Sigma-Aldrich | - | reagent grade |
| glucose | Sigma-Aldrich | G5767 | ACS reagent |
| NH4Cl | Sigma-Aldrich | A9434 | for molecular biology, suitable for cell culture, ≥99.5% |
| NaCl | Sigma-Aldrich | 746398 | ACS reagent, ≥99% |
| Na2HPO4·2H2O | Sigma-Aldrich | 4272 | 98.5-101% |
| KH2PO4 | Sigma-Aldrich | 795488 | ACS reagent, ≥99% |
| MgSO4·7H2O | Sigma-Aldrich | 230391 | ACS reagent, ≥98% |
| CaCl2 | Sigma-Aldrich | 793639 | ACS reagent, ≥96% |
| thiamine·HCl | Sigma-Aldrich | T4625 | reagent grade, ≥99% |
| Na2·succinate·6H2O | Sigma-Aldrich | S2378 | ReagentPlus, ≥99% |
Referencias
- Rando, O. J., Verstrepen, K. J. Timescales of genetic and epigenetic inheritance. Cell. 128, 655-668 (2007).
- Kim, H. J., et al. Short-term differential adaptation to anaerobic stress via genomic mutations by Escherichia coli strains K-12 and B lacking alcohol dehydrogenase. Front Microbiol. 5, 476 (2014).
- Mendizabal, I., Keller, T. E., Zeng, J., Yi, S. V. Epigenetics and evolution. Integr Comp Biol. 54, 31-42 (2014).
- Lee, J. Y., Seo, J., Kim, E. S., Lee, H. S., Kim, P. Adaptive evolution of Corynebacterium glutamicum resistant to oxidative stress and its global gene expression profiling. Biotechnol Lett. 35, 709-717 (2013).
- Lee, J. Y., et al. Artificial oxidative stress-tolerant Corynebacterium glutamicum. AMB Express. 4, 15 (2014).
- Narang, A. The steady states of microbial growth on mixtures of substitutable substrates in a chemostat. J Theor Biol. 190, 241-261 (1998).
- Kwon, Y. D., Kim, S., Lee, S. Y., Kim, P. Long-term continuous adaptation of Escherichia coli to high succinate stress and transcriptome analysis of the tolerant strain. J Biosci Bioeng. 111, 26-30 (2011).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nat Rev Genet. 14, 827-839 (2013).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25, 2078-2079 (2009).
- McKenna, A., et al. The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res. 20, 1297-1303 (2010).
- Deatherage, D. E., Barrick, J. E. Identification of mutations in laboratory-evolved microbes from next-generation sequencing data using breseq. Methods Mol Biol. 1151, 165-188 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados