Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Síntesis de polímeros cíclicos y caracterización de su movimiento difusivo en el estado fundido en la molécula de un solo nivel
En este artículo
Resumen
Se presenta un protocolo para la síntesis y caracterización de movimiento difusivo de los polímeros cíclicos en el nivel de una sola molécula.
Resumen
We demonstrate a method for the synthesis of cyclic polymers and a protocol for characterizing their diffusive motion in a melt state at the single molecule level. An electrostatic self-assembly and covalent fixation (ESA-CF) process is used for the synthesis of the cyclic poly(tetrahydrofuran) (poly(THF)). The diffusive motion of individual cyclic polymer chains in a melt state is visualized using single molecule fluorescence imaging by incorporating a fluorophore unit in the cyclic chains. The diffusive motion of the chains is quantitatively characterized by means of a combination of mean-squared displacement (MSD) analysis and a cumulative distribution function (CDF) analysis. The cyclic polymer exhibits multiple-mode diffusion which is distinct from its linear counterpart. The results demonstrate that the diffusional heterogeneity of polymers that is often hidden behind ensemble averaging can be revealed by the efficient synthesis of the cyclic polymers using the ESA-CF process and the quantitative analysis of the diffusive motion at the single molecule level using the MSD and CDF analyses.
Introducción
Cyclic polymers are unique in that they do not have chain ends. They often exhibit unusual behaviors which is distinct from their linear counterpart, including increased thermal stability of polymer micelles by a linear-to-cyclic conversion,1,2 and spatial organization of DNA in bacterial cells by a loop formation.3 Topological interactions between the cyclic chains are believed to be the critical factor for such unusual behaviors.4,5 Therefore, characterizing the motion and relaxation of cyclic polymers under entangled conditions has been an important research topic in polymer science for decades.6
Cyclic polymer dynamics has been investigated using both synthetic and naturally occurring molecules by means of ensemble averaged experimental methods such as nuclear magnetic resonance (NMR), light scattering, and viscosity measurements.7-9 However, these studies often suffer from impurity molecules in the samples.10 Furthermore, spatiotemporal heterogeneities of the motion of individual molecules caused by inherent structural heterogeneity of entangled polymers are often hidden behind the ensemble averaging in these studies. In order to characterize molecular level dynamics of cyclic polymers, a synthesis method that provides high purity cyclic polymers and an experimental and analysis methods that allow for quantitative characterization of molecular motion at the single molecule level have to be developed. Here, we will show a method to synthesize high-purity cyclic and dicyclic poly(THF)s that incorporate a fluorophore unit using an electrostatic self-assembly and covalent fixation (ESA-CF) process11-13 and a method to analyze the motion of the individual fluorophore-incorporated polymer chains using a combination of mean-squared displacement (MSD) and cumulative distribution function (CDF) analyses.
A proper data processing has been shown to be essential for the accurate characterization of the diffusive motion. With an adequate MSD and CDF analyses, a multiple-mode diffusion of the cyclic and dicyclic polymers in the melt and semi-dilute solution of the linear polymer chains has been revealed,14-16 suggesting the significant effects of the topological states of the polymers on the diffusive motion of the chains under entangled conditions.17 While the experimental and analytical approaches to characterize the motion of the cyclic polymers are described in this protocol, the same method can be used to quantitatively characterize the diffusive motion in many other heterogeneous systems. The approach would be especially suitable when multiple diffusion components existing in the samples are to be analyzed.
Protocolo
1. Síntesis de monofuncionales y bifuncionales poli (THF)
- Poli monofuncional (THF)
- Llama secar un matraz de fondo redondo de 2 bocas de 100 ml. Vacío y llenar el matraz con nitrógeno (3 ciclos).
- Añadir tetrahidrofurano destilado (THF) (50 ml) al matraz. Poner el matraz en un baño de agua a 20 ° C y se equilibre la temperatura.
- Añadir triflato de metilo (0,5 mmol) al matraz mediante una jeringa. Se agita la mezcla durante 5-10 minutos a 20 ° C.
- Añadir N -fenil pirrolidina (4-6 equiv.) Al matraz mediante una jeringa. Se agita la mezcla durante 30 a 60 min.
- Eliminar completamente el disolvente a presión reducida (ca. 100 Torr). Disolver el residuo en 3-5 ml de acetona. Añadir la solución de acetona en 300-500 ml de n-hexano. Se filtra el precipitado y se seca bajo presión reducida.
- Poli bifuncional (THF)
- Llama secar un matraz de fondo redondo de 2 bocas de 100 ml. Virginiacuum y llenar el matraz con nitrógeno (3 ciclos).
- Añadir THF destilado (50 ml) al matraz. Poner el matraz en un baño de agua a 20 ° C y se equilibre la temperatura.
- Añadir anhídrido tríflico (0,3 mmol) al matraz mediante una jeringa. Se agita la mezcla durante 5-10 minutos a 20 ° C.
- Añadir N -fenil pirrolidina (4-6 equiv.) Al matraz mediante una jeringa. Se agita la mezcla durante 30 a 60 min.
- Eliminar completamente el disolvente a presión reducida (ca. 100 Torr). Disolver el residuo en 3-5 ml de acetona. Añadir la solución de acetona a 300-500 ml de n-hexano. Se filtra el precipitado y se seca bajo presión reducida.
en forma de 8 2. Síntesis de perileno Diimide incorporado-estrellas 4-armado y dicıclicos poli (THF)
- Armado poli estrella (THF)
- Intercambio iónico
- Disolver la sal perileno diimida tetracarboxilato de sodio en agua (10 mg / ml, 150 ml). Disolverpoli monofuncional (THF) en acetona (160 mg / ml, 4 ml). Añadir gota a gota la solución de acetona en la solución acuosa se agitó vigorosamente. Recoger el precipitado formado por filtración.
- Repita el procedimiento anterior con el precipitado recuperado (2.1.1.1) cuatro veces.
- la fijación covalente
- Se disuelve el precipitado obtenido en tolueno (5 mg / ml). Se calienta a reflujo la solución durante 4 hr.
- Eliminar completamente el disolvente a presión reducida (ca. 100 Torr). Se filtra el residuo a través de un tapón de gel de sílice con n-hexano / acetona (2/1 vol / vol). Añadir la solución en agua enfriada con hielo (300 a 500 ml) para precipitar el producto. Se recoge el precipitado por filtración.
- Intercambio iónico
- Poli en forma de 8 dicíclico (THF)
- Intercambio iónico
- Disolver la sal perileno diimida tetracarboxilato de sodio en agua (6 mg / ml, 50 ml). Disolver poli bifuncional (THF) (0,5 g) En 30-50 ml de acetona. Añadir gota a gota la solución de acetona en la solución acuosa agitada vigorosamente a 0 ° C. Recoger el precipitado formado por filtración.
- Repita el procedimiento anterior con el precipitado recuperado (2.2.1.1).
- la fijación covalente
- Se disuelve el precipitado obtenido en tolueno (0,05 g / L). Se calienta a reflujo la solución durante 4 hr.
- Eliminar completamente el disolvente a presión reducida (ca. 100 Torr). Añadir tolueno para disolver parcialmente el residuo. Vuelva a precipitar en 300-500 ml de n-hexano.
- Se filtra el precipitado formado a través de un tapón de gel de sílice con n-hexano / acetona (2/1 vol / vol). Vuelva a precipitar en 300-500 ml de agua.
- Se purifica el precipitado formado mediante cromatografía en columna 18 utilizando un gel de poliestireno. Purificar adicionalmente el producto en bruto por cromatografía de permeación en gel preparativa (GPC) 19 con un eluyente de CHCl 3 a remove subproductos de seguimiento de índice de refracción (RI) y detectores UV.
- Intercambio iónico
3.-molécula único experimento de la imagen de fluorescencia
- preparación de la muestra
- Limpieza de cubreobjetos de microscopio
- Lugar: No. 1.5 24 x 24 mm cubierta de microscopio se desliza en una cubeta de tinción.
- Añadir solución de hidruro de potasio 1 M (100 ml) en el frasco y sonicar durante 15 min. Retirar la solución de hidróxido de potasio por decantación y enjuague la cubierta se desliza con agua ultra pura para varias veces. Añadir etanol de grado espectroscópico (100 ml) en el frasco y sonicar durante 15 min.
- Verter el etanol por decantación y enjuague la cubierta se desliza con agua ultra pura para varias veces. Después de verter el agua ultrapura por decantación, repita el paso 3.1.1.2.
- Añadir agua ultrapura a la jarra y someter a ultrasonidos durante 15 min. Enjuague las hojas de la cubierta con agua ultra pura para varias veces. Sacar las hojas de la cubierta de la jarra por un pinzas de plástico de secarlos, ya sea aire seco o nitrógeno seco.
- Preparación de las muestras de masa fundida de polímero 14,15
- Añadir 100 l de poli lineal no marcado (THF) en una botella de vidrio y se calienta a una temperatura superior al punto de fusión (aproximadamente 25 ° C) utilizando un secador de pelo.
- Se disuelve el polímero de fluoróforo-incorporada (lineal, estrella de 4 brazos, cíclico o dicıclico en forma de 8 sintetizado en 2.1 y 2.2) en cloroformo (1 ml, 10 -6 M). Añadir 1 l de la solución a los 100 l de la masa fundida de la poli lineal no marcado (THF).
- Después de mezclar a fondo la muestra con una punta de pipeta, se evapora el cloroformo por calentamiento de la muestra utilizando un secador.
NOTA: Esto proporciona una masa fundida del poli lineal no marcado (THF) que contiene 10 -8 M de los polímeros fluoróforo incorporado. - Tomar 10 l de la muestra utilizando un micro-pipeta y dROP en una hoja de la cubierta limpiado. Dicho de otra hoja de la cubierta limpia de la muestra y el sándwich de la muestra entre las dos hojas de la cubierta.
- Presione la muestra suavemente con unas pinzas de plástico.
- Limpieza de cubreobjetos de microscopio
- Configuración de imágenes de fluorescencia de campo amplio 15
- La introducción de un láser de excitación (488 nm) en el puerto de atrás del microscopio invertido
- Insertar un filtro de excitación de paso de banda y el polarizador en la trayectoria del haz.
- Expandir el haz de aproximadamente 1 cm de diámetro por un expansor de haz.
- Insertar una placa de cuarto de onda en la trayectoria del haz. Ajuste el eje óptico de la placa de onda en 45 grados con respecto a la del polarizador. Alternativamente, inserte un compensador Berek y establecer el retardo óptico para lambda / 4.
- Insertar un diafragma en la trayectoria del haz de excitación para ajustar el tamaño del haz.
- Antes de introducir el rayo láser en el puerto posterior de la óptica invertida microscope, insertar una lente de enfoque (lente plano-convexa, la longitud focal ≈ 300 mm) a una posición en la que se colima el haz de láser de la lente del objetivo.
- Después de reflejar el haz de láser utilizando un espejo dicroico montado en un cubo de filtro, introducir el haz de láser a la muestra a través de una lente de objetivo de alta apertura numérica (NA) (por ejemplo, NA 1,3, 100X aumentos, de inmersión en aceite).
- Adjuntar un calentador objetivo de la lente del objetivo y ajustar la temperatura a 30 ° C.
- Montaje de la muestra sobre la platina del microscopio invertido
- Deje caer una gota de aceite de inmersión sobre la lente del objetivo y montar la muestra sobre el estado del microscopio.
- Asegúrese de que el espesor de la muestra de aproximadamente 10 micras se obtiene por control de la posición axial de la superficie inferior y superior de la muestra.
- Ajuste el enfoque del microscopio a unos pocos micrómetros por encima de la superficie inferior de la muestra.
- Obtener luz de excitación polarizada circularmente con la lente objetivo
- Inserte un polarizador en el rayo láser colimado de la lente del objetivo.
- Registrar la intensidad del láser transmitida a través del polarizador mediante la inserción de un medidor de potencia después de que el polarizador. Registrar la potencia del láser transmitida a diferentes ángulos de polarización girando el polarizador.
- Si la potencia del láser transmitida no es constante en todos los ángulos de polarización, rotar ligeramente la placa de cuarto de onda o compensador Berek insertada en la trayectoria del haz de excitación.
- Repita el paso 3.2.5.2 y 3.2.5.3 hasta que la potencia del láser transmitida constante se obtiene en todos los ángulos de polarización. Asegúrese de que la luz polarizada circularmente se obtiene en la muestra.
- Configuración de la EM (multiplicador de electrones) -charge dispositivo acoplado (CCD)
- Fije la cámara EM-CCD para el puerto lateral del microscopio y conectarlo a tque el software de adquisición de imágenes.
- Si es necesario, sincronizar la exposición de la cámara a un obturador mecánico o un filtro sintonizable acústico-óptico insertado en la trayectoria del haz de excitación mediante el envío de la lógica transistor-transistor (TTL) señales generadas por la cámara EM-CCD a los dispositivos. Alternativamente, sincronizar la exposición de la cámara a la salida del láser mediante el envío de las señales TTL generados por la cámara EM-CCD al láser.
NOTA: La última opción es aplicable sólo cuando un láser de estado sólido cuya potencia de salida puede ser modulada por la entrada lógica transistor-transistor (TTL) de señales se utiliza para el experimento. - Aplicar una ganancia EM (típicamente de aproximadamente 300) a la cámara CCD utilizando software que controla la cámara a fin de obtener una imagen de fluorescencia de alta calidad de la solo fluoróforo.
- Establecer una región de interés (ROI) (típicamente de 128 x 128 píxeles en el centro del campo de vista) utilizando software que controla la cámara.
NOTA: Esto permite la Imagiexperimentos ng a los tipos de trama de 100 a 200 Hz en el modo de transferencia de marco, que se requiere para visualizar el movimiento de las cadenas de polímero fluoróforo incorporado en la muestra en estado fundido.
- La introducción de un láser de excitación (488 nm) en el puerto de atrás del microscopio invertido
- Ejecución del experimento
- La optimización de las condiciones experimentales
- Ajuste el área de iluminación de la muestra a aproximadamente 20 micras de diámetro usando el diafragma insertado en la trayectoria del haz de excitación.
- Ajuste la potencia del láser de excitación a la muestra a 4 - 8 MW seleccionando manualmente un filtro apropiado de densidad neutra (ND) que se inserta en la trayectoria del haz de excitación.
NOTA: Esto proporciona la potencia del láser media de 1 - 2 kW cm -2 en la muestra. - Grabar imágenes de fluorescencia de la muestra en las frecuencias de cuadro de los 100 - 200 Hz. Si la intensidad de fluorescencia obtenida a partir de los polímeros individuales fluoróforo incorporado es demasiado baja, aumentar gradualmente la potencia de excitación mediante THe ND filtro hasta llegar a aproximadamente 100 mW a la muestra.
- Si la calidad de la imagen de fluorescencia de una sola molécula de la todavía no es satisfactoria, comprobar las impurezas de fluorescencia en la muestra mediante la grabación de imágenes de fluorescencia de una masa fundida pura de la poli no marcado (THF). En caso de que se observa un fondo de alta fluorescencia, utilizar diferentes poli no marcado (THF).
- Si la densidad de la mancha de fluorescencia obtenido a partir de los polímeros de fluoróforo-incorporado en la masa fundida es demasiado alta para aislar espacialmente ellos (esto provoca errores en el análisis del movimiento difusivo), disminuir la concentración de los polímeros de fluoróforo-incorporado en la muestra hasta espacialmente se observan manchas aisladas.
- Si la densidad de la mancha de fluorescencia obtenido a partir de los polímeros de fluoróforo-incorporado en la masa fundida es demasiado baja (esto provoca un bajo rendimiento del experimento de formación de imágenes), aumentar la concentración de los polímeros de fluoróforo-incorporado en la muestra hasta una correspondse alcanza la densidad IATE de la mancha de fluorescencia.
- Si las imágenes de fluorescencia obtenidos a partir de los polímeros fluoróforo incorporada en la masa fundida se difuminan, aumentar las velocidades de fotogramas de la adquisición de imágenes.
NOTA: A menudo, esto requiere un retorno de la inversión más pequeña, típicamente de 64 x 64 píxeles.
- La optimización de las condiciones experimentales
- Adquisición de imágen
- Una vez que se optimizan las condiciones experimentales, dejar la muestra montada en la platina del microscopio durante una hora para que la muestra llegue a condiciones de equilibrio.
- Grabar 500 - 1.000 secuencias de imágenes de fluorescencia de los polímeros con fluoróforo constituida en el estado fundido a una 100 - 200 Hz frecuencia de imagen. Si el formato de archivo por defecto no es TIFF, convertir todas las secuencias de imágenes en el formato TIFF.
4. Análisis de la difusivo Motion
- El desplazamiento cuadrático medio de análisis (MSD)
- Recortar las secuencias de imágenes de fluorescencia de manera talque cada secuencia de imágenes contiene un único y bien enfocado polímero usando software de procesamiento de difusión de fluoróforo-incorporada de imagen, como ImageJ.
- Cuando las secuencias de imágenes recortadas contienen más de 10 marcos, dividir las secuencias de imágenes en múltiples secuencias de tal manera que cada secuencia consta de 10 tramas.
- Determinar las posiciones de las moléculas en cada una secuencias de imágenes con precisión mediante el ajuste de Gauss bidimensional de las imágenes.
- Determinar el coeficiente de difusión (D) de las moléculas individuales mediante análisis cuadrático medio de desplazamiento (MSD) de las trayectorias de difusión (es decir, las posiciones dependientes del tiempo de la molécula) utilizando una ecuación 20
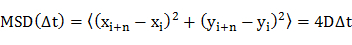
donde x e y i i son las posiciones de la molécula en el marco de la imagen i, y n denota el número de bastidor con el lapso de tiempo? t de la trama i. - Representar gráficamente los coeficientes de difusión enun histograma de frecuencias.
NOTA: Por lo general, el histograma se construye a partir de más de 100 moléculas.
- Función de distribución acumulativa de análisis (CDF)
NOTA: Una CDF, P (r 2, i Δ t) corresponde a la probabilidad acumulada de la búsqueda de las moléculas que se difunden dentro de un radio r desde el origen después de un cierto intervalo de tiempo i delta t.- Calcular el cuadrado de desplazamiento se produce durante lapsos de tiempo de 1Δt, 2Δt, ···, iΔt para todas las trayectorias de difusión obtenidos en 4.1.3.
NOTA: Estos cálculos dan m total de I cuadrado para desplazamientos retrasa el momento de iΔt. - Calcular los números de los desplazamientos-cuadrado (l i) dentro de conjunto de datos m i totales que son menores que r 2 a diferentes valores de r 2 (0 i r vs 2 parcelas corresponden a la CDF, P (r 2, iΔt).
- Calcular el cuadrado de desplazamiento se produce durante lapsos de tiempo de 1Δt, 2Δt, ···, iΔt para todas las trayectorias de difusión obtenidos en 4.1.3.
- Análisis de los FDC con distintos modelos de difusión
Nota: Las CDF obtenidos se ajustaron mediante modelos de difusión distintos; homogénea modelo de difusión, múltiples modos de difusión en la que la distribución D se describe por una gaussiana (modelo Gaussiano individual), y múltiples modos de difusión en la que la distribución D se describe por múltiples Gaussian (modelo Gaussiano múltiple).- En el modelo de difusión homogénea, determinar una media D mediante el ajuste de la CDF mediante una ecuación 21
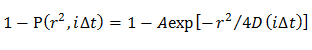
NOTA: Cualquier desviación de la ecuación sugiere la difusión heterogénea de la molécula. - En el modelo de Gauss sola, determinar la distribución de probabilidad de D descrito por una gaussiana (f (D)) mediante el ajuste de la CDF mediante 15
on3 "src =" / files / ftp_upload / 54503 / 54503equation3.jpg "/>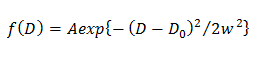
en la que A, W, D y 0 son la amplitud, la anchura, y el centro de la gaussiana. - En el modelo de doble Gaussian, determinar la distribución de probabilidad de j-ésima componente de D descrito por una gaussiana (f (D)) mediante el ajuste de la CDF mediante 14
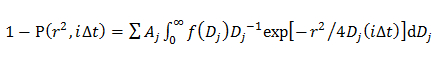

donde A j es la fracción de cada componente de difusión, y α j, w j, y 0 D j son la amplitud, la anchura, y el centro de la j-ésima componente de la gaussiana.
- En el modelo de difusión homogénea, determinar una media D mediante el ajuste de la CDF mediante una ecuación 21
- Cálculo de la probabilidad teórica distribución del coeficiente de difusión
NOTA: Las distribuciones de probabilidad de D que se producen debido a los errores estadísticos (p (D) D D) son calculadas de los distintos modelos de difusión; homogénea modelo de difusión, múltiples modos de difusión en la que la distribución D se describe por una gaussiana (modelo Gaussiano individual), y múltiples modos de difusión en la que la distribución D se describe por múltiples Gaussian (modelo Gaussiano múltiple).- En el modelo de difusión homogénea, calcular la distribución de probabilidad estadística de D utilizando una ecuación 22
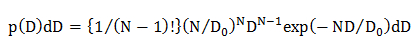
donde N es el número de los puntos de datos en una trayectoria de difusión (N = 10, véase 4.1.2), D 0 es el coeficiente medio de difusión (determinado por el análisis de CDF, véase 4.2.3.1), y D es el obtenido experimentalmente coeficiente de difusión para una trayectoria individual. - En elúnico modelo de difusión de Gauss, calcular la distribución de probabilidad estadística de D usando una ecuación 15

donde f (D) indica la distribución de probabilidad de D determinado por el análisis de CDF (véase 4.2.3.2), y D 0 es el coeficiente medio de difusión (determinado por el análisis de CDF, véase 4.2.3.2). - En el modelo de difusión doble gaussiana, el cálculo de la distribución de probabilidad estadística de D utilizando una ecuación 14

donde f (D j) denota la distribución de probabilidad de la j-ésima componente de D (D j) determinado por el análisis de CDF (véase 4.2.3.3), y D 0j es el coeficiente medio de difusión de la j-ésima componente (determinado por el CDF análisis, véase 4.2.3.3).
- En el modelo de difusión homogénea, calcular la distribución de probabilidad estadística de D utilizando una ecuación 22
Resultados
El perileno diimida-incorporada estrella 4-armado y en forma de 8 dicıclico poli (THF) s fueron sintetizados mediante el autoensamblaje electrostática y la fijación covalente (ESA-CF) proceso (Figura 1, Figura 2). Imágenes de fluorescencia de una sola molécula de lapso de tiempo se realizaron mediciones de la 4-armada (Figura 3a) y polímeros (Figura 3b) 8-forma. Las imágenes de fluorescencia de lapso de tiempo
Discusión
Los polímeros de 4-armados y en forma de 8 se prepararon mediante el protocolo ESA-CF (Figura 1), que es un paso crítico para la síntesis. 12,24 monofuncional y poli lineal bifuncional (THF) s con grupos terminales N -phenylpiperidinium eran sintetizado de acuerdo con el procedimiento anterior. 11 el intercambio iónico se llevó a cabo mediante reprecipitación de una solución en acetona de un precursor de polímero con contraiones triflato en una solución acuosa que...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported by a Grant-in-Aid for Scientific Research No. 22750122 (S.H.), No. 26288099 (T.Y.), and No. 23350050 (Y.T.) of the Japan Society for the Promotion of Science. S.H. is grateful for The Kurata Memorial Hitachi Science and Technology Foundation. The research reported in this publication was supported by the King Abdullah University of Science and Technology (S.H.).
Materiales
| Name | Company | Catalog Number | Comments |
| Materials | |||
| THF | Godo | ||
| Wakosil C-300 | Wako Pure Chemical Industries | ||
| Acetone | Godo | ||
| Toluene | Godo | ||
| n-Hexane | Godo | ||
| CHCl3 | Kanto Chemical | ||
| Bio-Beads S-X1 | Bio-Rad | ||
| Methyl triflate | Nacalai Tesque | ||
| Triflic anhydride | Nacalai Tesque | ||
| Potassium Hydroxide | Wako Pure Chemical Industries | ||
| Ethanol | Wako Pure Chemical Industries | ||
| Poly(tetrahydrofuran) | Aldrich | ||
| Chloroform | Wako Pure Chemical Industries | ||
| Immersion oil | Cargille | Type 37 / Type A | |
| Equipment | |||
| 2-Neck 100-ml round-bottom flask | |||
| Flask | |||
| Beaker | |||
| Funnel | |||
| Filter paper | Whatman | ||
| Reflux condenser | |||
| Syringe | |||
| Water bath | |||
| Magnetic stirrer | |||
| Rotary evaporator | |||
| Microscope cover slips (24 x 24 mm, No. 1) | Matsunami Glass | CO22241 | |
| Staining jar | AS ONE Corporation | 1-7934-01 | |
| Ultrasonic cleaner | VWR International | 142-0047 | |
| Inverted microscope | Olympus | IX71 | |
| Ar-Kr ion laser | Coherent | Innova 70C | |
| Berek compensator | Newport | 5540 | |
| Excitation filter | Semrock | LL01-488-12.5 | |
| Dichloric mirror | Omega optical | 500DRLP | |
| Emission filter | Semrock | BLP01-488R-25 | |
| Lens and mirror | Thorlabs | ||
| EM-CCD camera | Andor Technology | iXon | |
| Objective lens (100X, N.A. = 1.3) | Olympus | UPLFLN 100XOP | |
| Objective heater | Bioptechs | ||
| Preparative GPC | Japan Analytical Industry | LC-908 |
Referencias
- Honda, S., Yamamoto, T., Tezuka, Y. Topology-Directed Control on Thermal Stability: Micelles Formed from Linear and Cyclized Amphiphilic Block Copolymers. J. Am. Chem. Soc. 132 (30), 10251-10253 (2010).
- Honda, S., Yamamoto, T., Tezuka, Y. Tuneable enhancement of the salt and thermal stability of polymeric micelles by cyclized amphiphiles. Nat. Commun. 4, (2013).
- Jun, S., Mulder, B. Entropy-driven spatial organization of highly confined polymers: Lessons for the bacterial chromosome. Proc. Natl. Acad. Sci. U. S. A. 103 (33), 12388-12393 (2006).
- McLeish, T. Polymers without beginning or end. Science. 297 (5589), 2005-2006 (2002).
- McLeish, T. Polymer dynamics: Floored by the rings. Nat. Mater. 7 (12), 933-935 (2008).
- Roovers, J., Tezuka, Y. . Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. , 137-156 (2013).
- Klein, J. Evidence for reptation in an entangled polymer melt. Nature. 271 (5641), 143-145 (1978).
- Leger, L., Hervet, H., Rondelez, F. Reptation in entangled polymer-solutions by forced rayleigh light-scattering. Macromolecules. 14 (6), 1732-1738 (1981).
- von Meerwall, E. D., Amis, E. J., Ferry, J. D. Self-diffusion in solutions of polystyrene in tetrahydrofuran - comparison of concentration dependences of the diffusion-coefficients of polymers, and a ternary probe component. Macromolecules. 18 (2), 260-266 (1985).
- Kapnistos, M., et al. Unexpected power-law stress relaxation of entangled ring polymers. Nat. Mater. 7 (12), 997-1002 (2008).
- Adachi, K., Takasugi, H., Tezuka, Y. Telechelics having unstrained cyclic ammonium salt groups for electrostatic polymer self-assembly and ring-emitting covalent fixation. Macromolecules. 39 (17), 5585-5588 (2006).
- Oike, H., Imaizumi, H., Mouri, T., Yoshioka, Y., Uchibori, A., Tezuka, Y. Designing unusual polymer topologies by electrostatic self-assembly and covalent fixation. J. Am. Chem. Soc. 122 (40), 9592-9599 (2000).
- Yamamoto, T., Tezuka, Y. Topological polymer chemistry: a cyclic approach toward novel polymer properties and functions. Polym. Chem. 2 (9), 1930-1941 (2011).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Tezuka, Y. Single-molecule imaging reveals topological isomer-dependent diffusion by 4-armed star and dicyclic 8-shaped polymers. Polym. Chem. 6 (22), 4109-4115 (2015).
- Habuchi, S., Fujiwara, S., Yamamoto, T., Vacha, M., Tezuka, Y. Single-Molecule Study on Polymer Diffusion in a Melt State: Effect of Chain Topology. Anal. Chem. 85 (15), 7369-7376 (2013).
- Habuchi, S., Satoh, N., Yamamoto, T., Tezuka, Y., Vacha, M. Multimode Diffusion of Ring Polymer Molecules Revealed by a Single-Molecule Study. Angew. Chem. Int. Ed. 49 (8), 1418-1421 (2010).
- Habuchi, S., Tezuka, Y. . Topological Polymer Chemistry: Progress of Cyclic Polymers in Syntheses, Properties and Functions. , 265-290 (2013).
- Fernandez, P., Bayona, J. M. Use of off-line gel-remeation chromatography normal-phase liquid-chromatography fro the determination of polycyclic aromatic-compounds in environmental-samples and standard reference materials (air particulate matter and marine sediment). J. Chromatogr. 625 (2), 141-149 (1992).
- Biesenberger, J. A., Tan, M., Duvdevan, I., Maurer, T. Recycle gel permeation chromatography. 1. recycle principle and design. J. Polym. Sci. Pol. Lett. 9 (5), 353 (1971).
- Kusumi, A., Sako, Y., Yamamoto, M. Confined lateral diffusion of membrane-receptors as studied by single-particle tracking (nanovid microscopy) - effects of calcium-induced differentiation in cultured epithelial-cells. Biophys. J. 65 (5), 2021-2040 (1993).
- Schutz, G. J., Schindler, H., Schmidt, T. Single-molecule microscopy on model membranes reveals anomalous diffusion. Biophys. J. 73 (2), 1073-1080 (1997).
- Vrljic, M., Nishimura, S. Y., Brasselet, S., Moerner, W. E., McConnell, H. M. Translational diffusion of individual class II MHC membrane proteins in cells. Biophys. J. 83 (5), 2681-2692 (2002).
- Margineanu, A., et al. Photophysics of a water-soluble rylene dye: Comparison with other fluorescent molecules for biological applications. J. Phys. Chem. B. 108 (32), 12242-12251 (2004).
- Tezuka, Y., Oike, H. Self-assembly and covalent fixation for topological polymer chemistry. Macromol. Rapid Commun. 22 (13), 1017-1029 (2001).
- Deres, A., et al. The Origin of Heterogeneity of Polymer Dynamics near the Glass Temperature As Probed by Defocused Imaging. Macromolecules. 44 (24), 9703-9709 (2011).
- Flier, B. M. I., et al. Heterogeneous Diffusion in Thin Polymer Films As Observed by High-Temperature Single-Molecule Fluorescence Microscopy. J. Am. Chem. Soc. 134 (1), 480-488 (2012).
- Habuchi, S., Oba, T., Vacha, M. Multi-beam single-molecule defocused fluorescence imaging reveals local anisotropic nature of polymer thin films. Phys. Chem. Chem. Phys. 13 (15), 6970-6976 (2011).
- Zettl, U., et al. Self-Diffusion and Cooperative Diffusion in Semidilute Polymer Solutions As Measured by Fluorescence Correlation Spectroscopy. Macromolecules. 42 (24), 9537-9547 (2009).
- Kirstein, J., Platschek, B., Jung, C., Brown, R., Bein, T., Brauchle, C. Exploration of nanostructured channel systems with single-molecule probes. Nat. Mater. 6 (4), 303-310 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados