Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Conformaciones GPCR Proteína G-selectivos mide usando sensores FRET en un fluorómetro Ensayo de suspensión de células vivas
En este artículo
Resumen
Simple methods to detect the selective activation of G proteins by G protein-coupled receptors remain an outstanding challenge in cell signaling. Here, Fӧrster resonance energy transfer (FRET) biosensors have been developed by pairwise tethering a GPCR to G protein peptides to probe conformational changes at controlled concentrations in live cells.
Resumen
Fӧrster transferencia de energía de resonancia (FRET) a base de los estudios se han vuelto cada vez más común en la investigación de la señalización de GPCR. Nuestro grupo de investigación ha desarrollado un sensor de FRET intra-molecular para detectar la interacción entre las subunidades y GPCRs en células vivas después de la estimulación agonista Gα. Aquí, nos detalle el protocolo para la detección de cambios en FRET entre la β 2-adrenérgicos y el péptido C-terminal Gαs por tratamiento con hidrocloruro de isoproterenol 100 mM tal como se caracteriza anteriormente 1. Nuestro sensor FRET es un único polipéptido que consiste en serie de un GPCR de longitud completa, un fluoróforo aceptor de FRET (mCitrine), una ER / K SPASM (afinidad de proteína sistemática modulación fuerza) enlazador, un fluoróforo donante FRET (mCerulean), y un Gα C péptido-terminal. Este protocolo de preparación detalle celular, condiciones de transfección, la configuración del equipo, la ejecución del ensayo y análisis de datos. Este diseño experimental detecta pequeña changes en FRET indicativo de interacciones proteína-proteína, y también puede ser utilizado para comparar la fuerza de la interacción a través de ligandos y parejas de proteínas GPCR-G. Para mejorar la relación señal-ruido en nuestras mediciones, este protocolo requiere una precisión aumentada en todas las etapas, y se presenta aquí para permitir la ejecución reproducible.
Introducción
receptores acoplados a proteína G (GPCR) son receptores de siete transmembrana. El genoma humano solo contiene aproximadamente 800 genes que codifican para GPCRs, que se activan por una variedad de ligandos, incluyendo la luz, odorantes, hormonas, péptidos, fármacos y otras moléculas pequeñas. Casi el 30% de todos los productos farmacéuticos actualmente en el mercado de los GPCR diana, ya que juegan un papel importante en muchos estados de enfermedad 2. A pesar de décadas de un amplio trabajo realizado en esta familia de receptores, aún quedan cuestiones pendientes importantes en el campo, sobre todo en lo que respecta a los mecanismos moleculares que conducen a interacciones GPCR-efectoras. Hasta la fecha, sólo una estructura cristalina de alta resolución ha sido publicada, proporcionando información sobre la interacción entre la β 2-adrenérgicos (β 2-AR) y la proteína Gs 3. Junto con una amplia investigación en las últimas tres décadas, se reitera un componente estructural específico que es fundamental en esteinteracción: la subunidad Gα C-terminal. Esta estructura es importante tanto para la activación de la proteína G por el GPCR 4 y G selección proteína 5-6. Por lo tanto, la Gα C-terminal proporciona un vínculo crucial entre la estimulación del ligando GPCR y activación de la proteína G selectiva.
Las investigaciones realizadas durante la última década sugiere que los GPCR pueblan un amplio paisaje conformacional, con el ligando de unión a la estabilización de los subconjuntos de conformaciones GPCR. Aunque varias técnicas, incluyendo la cristalografía, RMN y espectroscopía de fluorescencia, y espectrometría de masas están disponibles para examinar el paisaje conformacional GPCR, hay una escasez de enfoques para dilucidar su significado funcional en la selección del efector 7. A continuación, se describe un enfoque basado en Fӧrster transferencia de energía de resonancia (FRET) para detectar la proteína G-selectiva conformaciones GPCR. FRET se basa en la proximidad y la orientación paralela de dos fluoróforos con la superposición de emisión (donante) unand excitación (aceptor) espectros 8. Como los fluoróforos donante y aceptor se acercan juntos como resultado de cualquiera de cambio conformacional en la proteína o una interacción proteína-proteína, la FRET entre ellos aumenta, y se puede medir usando una gama de métodos 8. Biosensores basados en FRET se han empleado ampliamente en el campo de GPCR 9. Se han utilizado para investigar los cambios de conformación en el GPCR mediante la inserción de donante y aceptor en el tercer bucle intracelular y GPCR C-terminal; sensores han sido diseñados para sondear GPCR y las interacciones efectoras mediante el etiquetado por separado el GPCR y el efector (G proteína subunidades / arrestins) con un par FRET 10; algunos sensores también detectan cambios conformacionales en la proteína G 11. Estos biosensores han permitido el campo para hacer una multitud de cuestiones pendientes, incluyendo cambios conformacionales en el GPCR y efector, la cinética de interacción GPCR-efectoras, y ligandos alostéricos 12. Nuestro grupoestaba particularmente interesado en la creación de un biosensor que puede detectar la proteína G específica conformaciones GPCR en condiciones agonistas impulsada. Este biosensor se basa en una tecnología desarrollada recientemente nombrado ESPASMO (sistemática afinidad de la proteína de modulación de fuerza) 13. ESPASMO implica la inmovilización interactuando dominios de la proteína utilizando un enlazador / ER K, que controla sus concentraciones eficaces. Flanqueando el enlazador con un par de FRET de fluoróforos crea una herramienta que puede reportar el estado de la interacción entre las proteínas 12. Anteriormente 1 del módulo ESPASMO se utilizó para atar el Gα C-terminal a un GPCR y controlar sus interacciones con fluoróforos FRET, mCitrine (se hace referencia en el presente Protocolo mediante su variante conocida, Amarillo Proteína Fluorescente (YFP), excitación / pico de emisión en 490/525 nm) y mCerulean (denominado en el presente Protocolo mediante su variante conocida comúnmente cian proteína fluorescente (PPC), de excitación / emisión de 430/475 nm pico). De N- a C-terminal, tsu codificado genéticamente único polipéptido contiene: una longitud total GPCR, aceptor de FRET (mCitrine / YFP), 10 nm ER / K enlazador, donante de FRET (mCerulean / CFP), y el péptido Gα C-terminal. En este estudio, los sensores se abrevian como péptido GPCR-enlazador-longitud Gα. Todos los componentes están separados por un no estructurada (Gly-Ser-Gly) 4 enlazador que permite la rotación libre de cada dominio. La caracterización detallada de este tipo de sensores se realizó previamente utilizando dos GPCRs prototípicos: β 2-AR y opsina 1.
Este sensor se transfecta transitoriamente en células HEK-293T y experimentos de células en vivo espectros de fluorescencia medida a base de fluorómetro del par FRET en unidades arbitrarias de cuentas por segundo (CPS) en presencia o ausencia de ligando. Estas mediciones se utilizan para calcular una relación de FRET entre los fluoróforos (YFP max / CFP max). Un cambio en FRET (ΔFRET), entonces se calcula restando la relación media de FRETde las muestras sin tratar de la relación de FRET de muestras tratadas con ligando. ΔFRET puede ser comparado a través de construcciones (β 2-AR-10 nm péptido-Gαs frente ß 2-AR-10-nm sin péptido). A continuación, detallamos el protocolo para expresar estos sensores en células HEK-293T en vivo, supervisamos su expresión, y la configuración, ejecución y análisis de la célula viva basada en FRET fluorómetro medida para no tratada en comparación con las condiciones tratados con el fármaco. Mientras que este protocolo es específico para la nm-Gαs sensor péptido β 2-AR-10 tratadas con 100 mM de bitartrato de isoproterenol, que puede ser optimizado para diferentes pares y ligandos GPCR-Gα.
Protocolo
1. Preparación de ADN
- Diseño sensor construye utilizando un esquema de clonación modular. Por favor hacer referencia al diseño del sensor β 2-AR 1 se ha detallado anteriormente.
- Preparar ADN de acuerdo con el protocolo miniprep kit comercial y eluir en solución 2 mM Tris-HCl, pH 8, a la concentración ≥ 750 ng / l, A260 / A280 de 1.7 a 1.9, A260 / 230 de 2,0 - de 2.29.
2. Preparación de cultivos celulares
- Cultura HEK-293T-Flp-n células en DMEM que contenía 4,5 g / L de D-glucosa, suplementado con 10% de FBS (inactivado por calor) (v / v), 1% de suplemento de L-glutamina, HEPES 20 mM, pH 7,5 a 37 ° C en atmósfera humidificada a 5% de CO 2. Manejar las células en una campana de seguridad biológica para las etapas posteriores.
- Permiten que las células crezcan a una monocapa confluente antes de pases en placas de seis pocillos. Tiempo para alcanzar una confluencia depende de la densidad inicial de chapado. Use platos quellegado hasta la confluencia en 1 - 2 días de chapado de seis pocillos chapado. Un plato tratada con cultivo confluente 10 cm de tejido tiene una densidad celular de aproximadamente 4 x 10 6 células / ml. Véase la Figura 1 para una imagen de crecimiento del cultivo celular.
- Lavar las células con 10 ml de PBS, y trypsinize con 0,25% de tripsina (véase el debate, el párrafo 2). Placa de 8 x 10 5 células / pocillo en 2 ml de medio de cultivo de tejidos tratados con seis platos bien y dejar que se adhieran durante 16 - 20 En hr.
3. Condiciones de transfección
- Escalonar las transfecciones para las construcciones que pueden requerir diferentes cantidades de tiempo para lograr una expresión óptima (entre 20 - 36 hr). Sincronizar condiciones para un tiempo de experimento unificado. También tienen un control no transfectadas bien en la densidad de células equivalente a utilizar para el ruido de fondo y la resta de dispersión durante el análisis.
- Llevar los reactivos de transfección a temperatura ambiente: medio de suero reducido, el ADN, reactivo de transfección.
- En uncampana de seguridad biológica se combinan los reactivos en un tubo estéril de microcentrífuga en el siguiente orden: mezclar 2 g de ADN con 100 l de suero reducido de medios de comunicación. Pico 6 l de reactivo de transfección en combinación de medios / DNA sin la superficie de la mezcla o en el lado del tubo de tocar. Configurar una reacción de transfección por pocillo. condiciones de transfección pueden ser optimizados (1 - 4 g de ADN, 3 - 6 l de reactivo de transfección) para lograr los niveles de expresión consistentes. Véase la Tabla 1 para relaciones más optimizadas.
- Se incuba la mezcla a temperatura ambiente en una campana de seguridad biológica de 15 - 30 min. No utilice la reacción si se deja incubar durante más de 30 minutos.
- Añadir reacción a las células de una manera gota a gota a través de bien y agitar suavemente seis pocillos para asegurar una buena mezcla. Añadir una reacción por pocillo.
- Después de 20 h de expresión, la fluorescencia monitor mediante microscopio de fluorescencia de cultivo de tejidos. Evaluar la expresión de la población con 10 veces la localización objetivo y proteínas en una célula a 40X. Observe para la expresión de proteínas en la membrana plasmática (PM). Si se observa la internalización sustancial, supervisar la transfección hasta que se detecta expresión significativa en AM.
4. Reactivo y la Preparación de
- Preparar 100 mM existencias de medicamentos y almacenar a -80 ° C: bitartrato de isoproterenol (100 mM en dH 2 O que contiene ácido ascórbico 300 mM). Hacer en hielo / en la cámara fría, y el flash-congelar inmediatamente. Las alícuotas se pueden hacer y utilizar hasta un año.
- Preparar Cell Buffer (~ 2 ml / condición) y guardar en un baño de agua a 37 °. Hacer de nuevo cada día. Consulte la Tabla 2 para celulares constituyentes de amortiguamiento.
- Preparar tampón de Drogas (10 ml) y almacenar a temperatura ambiente. Consulte la Tabla 2 para los componentes de amortiguación de Drogas.
- Lavado ácido cubetas utilizando HCl concentrado. Neutralizar con una base débil (1 M KOH), y lavar bien las cubetas con dH2O
- Preparar la estación de trabajo en torno a fluorómetro con varioscajas de 10, 200 y 1.000 l puntas de pipeta, un contador de tiempo establecido con una cuenta atrás de 10 minutos, una línea de vacío accesible con consejos para la limpieza de cubetas, toallitas tarea delicada, y la botella con atomizador con H2O ultrapura
- Calentar baño de agua externa para el fluorómetro y el calor del bloque de 37 ° C.
- Activar el fluorómetro; establecer programa de recolección de fluorescencia para la recogida de PPC a la excitación 430 nm, paso de banda 8 nm; rango de emisión de 450 nm - 600 nm, paso de banda de 4 nm. Para la recolección de YFP sólo como control del sensor (ver Discusión) conjunto de excitación a 490 nm, paso de banda 8 nm, rango de emisión 500 - 600 nm, paso de banda de 4 nm. configuración de la colección de la PPC se usarán para adquirir un espectro FRET en este experimento.
- Coloque doce 1,5 ml tubos de microcentrífuga en el bloque de calor, como se muestra en la Figura 2 a continuación. Estos tubos son soportes para tubos de alícuotas de células (500 l tubos de microcentrífuga.) Coloque un pequeño trozo de tejido en soportes 1 y 7 para amortiguar las cubetas colocado aquí.
Nota: Use cubetas separadas para la condición sin tratamiento y la condición del medicamento para prevenir la contaminación cruzada.

Figura 2. Tubo Microcentrífuga configurar y posición de referencia en el bloque de calor de la cubeta de muestras sin tratar está en la posición 1.; tubos de alícuotas de células se encuentran en las posiciones 2 - 6. Cubeta para las muestras tratadas con fármaco se encuentra en la posición 7; tubos de alícuotas de células se encuentran en las posiciones 8 - 12. Haga clic aquí para ver una versión más grande de esta figura.
- Llenar los titulares de 2 - 6 y 8 - 12 con ~ 750 l de agua para crear un mini 37 ° C baño de agua.
- Coloque diez tubos de microcentrífuga de 500 l de alícuotas de células en baños de mini-agua (titulares de 2 - 6, 8 - 12). Cada tubo será una repetición individual de la condición (5 untreated, 5 droga tratada).
- Monitor de células para la expresión (véase el paso 3.6).
5. Experimento y terminales de datos
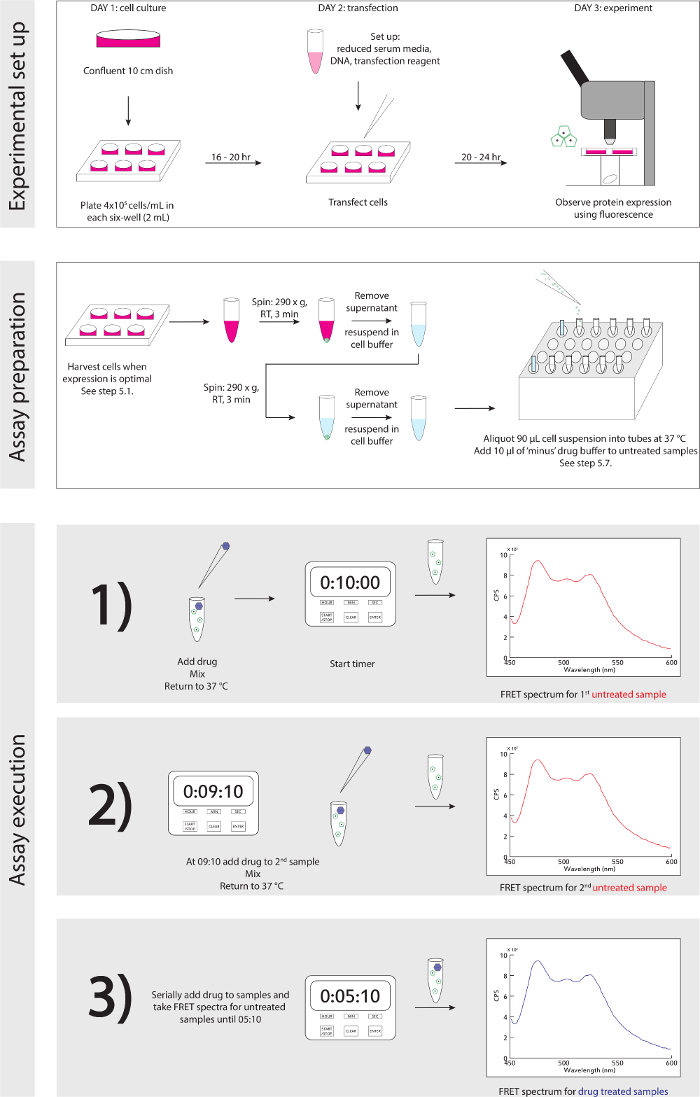
Figura 3. Esquema experimental. Una guía detallada paso a paso para el montaje experimental y ejecución. Por favor, haga clic aquí para ver una versión más grande de esta figura.
- Consulte la Figura 3 para esquemática experimental. Cuando las células están listas para ser cosechadas, basado en la expresión de proteína detectada con microscopio de fluorescencia (véase la discusión en el párrafo 4): en la campana de seguridad biológica, retire con cuidado ~ 1 ml de medios de comunicación, suspender las células en su cultura con un P1,000 y la transferencia de resuspensión en un tubo de microcentrífuga de 1,5 ml.
Nota: Evitar el uso de tripsina, ya que puede digerir el extremo N-terminal y /o en el bolsillo del sensor de GPCR de enlace. - Recuento de células para asegurar la densidad celular adecuada en la resuspensión. Optimizar el volumen de resuspensión de 4 x 10 6 células / ml.
- Girar las células en la centrifugadora de cubeta oscilante a temperatura ambiente, 290 xg durante 3 min. Aspirar el sobrenadante después de la centrifugación.
- Resuspender suavemente las células en 1 ml de tampón de la célula (almacenado a 37 ° C) y repetir el paso 5.3. Durante la segunda vuelta, se reúnen 100 mM de existencias de medicamentos alícuota de -80 ° C. Hacer una dilución 1: 100 en tampón de drogas por 1 mM de trabajo y mantener a temperatura ambiente.
- Después de la segunda centrifugación, eliminar el sobrenadante y las células suavemente resuspender en 1 ml de Cell Buffer (4 x 10 6 células / ml). Medida OD 600 de la muestra en el espectrofotómetro utilizando 1 ml de células y 1 ml de Cell Buffer como blanco. Prescindir de células en una cubeta de plástico desechable y traslado de regreso a un tubo de microcentrífuga inmediatamente después de espectrofotometría.
- Para un cel de control no transfectadasl espectro de condiciones, volver a suspender suavemente las células no transfectadas en 1 ml de tampón de la célula con P1,000 pipeta, añadir 90 l de células de cubeta y la adquisición de espectro de FRET a una excitación de 430 nm, paso de banda 8 nm, emisión a 450 - 600 nm, paso de banda de 4 nm. Recoge 3 - 5 espectros de repetición con frescos de 90 l de células. Guardar la acción de las células a 37 ° C entre las especificaciones, resuspender suavemente con P1,000 entre cada alícuota de la muestra, y enjuague cubeta con ultrapura H2O entre las muestras.
- Para las condiciones experimentales, alícuotas de 90 l de células transfectadas a cada uno de los 500 tubos mu l en soportes 2 - 6, 8 - 12 en el bloque de calor. Resuspender reserva de células con una pipeta P1,000 entre cada alícuota.
- Después se tomaron alícuotas de las células, añadir 10 l de tampón de drogas a los tubos 2 - 6 para ver estado las muestras no tratadas.
- Comience experimento mediante la adición de 10 l de solución de fármaco 1 mM en el tubo 8, iniciar el temporizador de cuenta atrás de 10 min, y mezclar suavemente tubo con P200 pipeta. Cerrar el tubo y la de regreso al 37° C bloque de calor.
- Inmediatamente recoger tubo 2, mezclar suavemente con P200 (utilizar una nueva punta), añadir 90 l de suspensión de células sin tratar a condición de cubeta, y el lugar en el fluorómetro.
- Adquirir espectro de FRET a una excitación de 430 nm, paso de banda 8 nm, emisión a 450 - 600 nm, paso de banda de 4 nm.
- A las 9 min - 10 seg, spike tubo 9 con 10 l de solución de fármaco 1 mM, mezclar suavemente con una P200 (utilizar la nueva punta), y el tubo para calentar el bloque de retorno.
- Repita los pasos 5.10 a 5.11 con el tubo 3 y 5.12 con el tubo 10.
- Repita los pasos 5.10 a 5.13 a intervalos de 1 min (08:10, 07:10, etc.) hasta que los espectros se recogen para todas las condiciones de las muestras sin tratar, y el fármaco ha sido añadido a todas las muestras de condición de drogas. Utilice una punta nueva para cada paso de la pipeta para evitar la contaminación cruzada.
- A los 5 minutos - 10 segundos, comenzar a mezclar tubo 8 (condición de drogas) suavemente con una pipeta P200, añadir 90 l de suspensión celular a cubeta separada para la muestra tratada de drogas y el lugar en el fluorómetro.
- adquirir Fespectro RET (véase el paso 5.11 para los ajustes).
- Repita los pasos 5.15 a 5.16 a intervalos de 1 min (04:10, 03:10, etc.) para las muestras restantes condición de drogas (tubos 9 - 12).
- Después de que termine el experimento, guardar archivos de proyecto, lavar bien las cubetas con H2O ultrapura, y volver a llenar los tubos para el próximo estado. Tenga cuidado para evitar la contaminación cruzada en la etapa de lavado. Cambiar la punta de la botella de H2O, así como en la línea de vacío en cada lavado.
Análisis 6. Datos
- Guarda y archivos de datos de exportación en SPC formato que se utilizará para el análisis. programas de análisis están disponibles para su descarga desde el sitio web de la publicación Sivaramakrishnan laboratorio.
- Crear archivos de ruta de software de análisis que incluyen los programas de análisis (v9, v15), archivos de muestras no transfectadas (véase el paso 5.6 para la recogida de espectro celular sin transfectar), el archivo de datos de salida, y los valores separados por comas (CSV) para la entrada de datos.
- Introduzca siguiente informaciónen un archivo CSV (ver ejemplo en la Tabla 3) y designar condiciones respectivas de cada muestra, incluyendo:
Nombre de archivo - archivos de gráficos individuales SPC
Receptor - designado que construyen GPCR se puso a prueba (por ejemplo, Β2)
Binder - designado la cual se probó variante de péptido de la construcción (por ejemplo, S)
Agonist - designar sin tratar (N) o condiciones tratados con el fármaco (D)
Directorio - la carpeta de la ruta en la que se guardan los archivos de SPC, por lo general organizados por fecha
OD - registró la densidad óptica de la muestra del espectrofotómetro - Introduzca los nombres de archivo para las muestras no transfectadas (paso 5.6) para restar de amortiguación de ruido y la dispersión de las muestras.
- Introduce las condiciones en el programa de análisis.
- Ejecutar programas para analizar las muestras dentro de las condiciones individuales (v9) ya través de condiciones (v15).
- Excluir archivos de ejemplo que son valores atípicos aparentes en el conjunto de datos, o ajustar para la resta, aumentando o disminuyendo el valor de la DO del indiviarchivos duales.
- Exportar datos a archivo de salida para el acceso a FRET calculado ratios (525 nm / 475 nm).
- Calcula ΔFRET restando el cociente medio de FRET para la condición no se trata de las relaciones de FRET individuales para las condiciones tratadas (drogas).
Resultados
Un esquema generalizado de la experimentación y la ejecución se detalla en la Figura 3.
Con el fin de detectar un cambio de FRET en el estrecho rango dinámico del sensor, que es fundamental para cumplir con los matices del sistema deben ser respetados. La calidad de la célula es imprescindible para la expresión de proteínas, así como la coherencia en la toma de muestras. La Figura 1 muestra imágenes de células cultivadas que crecen en una monocapa c...
Discusión
El rango dinámico ajustado de las mediciones de FRET en este sistema refuerza la necesidad de control de calidad sensibles en cada paso de este protocolo. Los pasos más importantes para garantizar un experimento exitoso de FRET son: 1) el cultivo de células, 2) la transfección 3) expresión de la proteína y 4) oportuna, precisa coordinación durante la ejecución del ensayo.
la salud celular y el mantenimiento de la calidad / placas pueden tener un impacto significativo en la relación ...
Divulgaciones
Los autores declaran que no tienen intereses en competencia.
Agradecimientos
RUM fue financiado por la beca de la Asociación Americana del Corazón Pre-doctoral (14PRE18560010). La investigación fue financiada por la subvención Asociación Americana del Corazón Desarrollo Científico (13SDG14270009) y el NIH (1DP2 CA186752-01 y 1-R01-GM-105646-01-A1) para SS
Materiales
| Name | Company | Catalog Number | Comments |
| B2-AR-10 nm-Gas peptide sensor | Addgene | 47438 | https://www.addgene.org/Sivaraj_Sivaramakrishnan/ |
| GeneJET Plasmid Miniprep Kit | Fermentas/Fisher Sci | FERK0503 | Elute in 2 mM Tris elution buffer |
| HEK-293T-Flp-n cells | Life Technologies | R78007 | |
| Trypsin (0.25%) | Life Technologies | 25200056 | |
| DMEM- high glucose | Life Technologies | 11960-044 | Warm in 37 °C water bath before use |
| FBS, certified, Heat inactivated, US origin | Life Technologies | 10082147 | |
| Glutamax I 100x | Life Technologies | 35050061 | |
| HEPES | Corning | MT25060CL | |
| Opti-MEM | Life Technologies | 31985-070 | Reduced serum media; Bring to RT before use |
| XtremeGene HP transfection reagenet | Roche | 6366236001 | Highly recommended for its consistency. Bring to RT before use |
| FluoroMax 4 | Horiba | Use with FluorEssence V3.8 software | |
| 3-mm path length quartz cuvette | Starna | NC9729944(16.45F-Q-3/z8.5) | May require cuvette holder/adaptor for use in Fluorometer, available from Starna |
| Sc100-S3 Heated Circulating water bath pump | Fisher Scientific | 13-874-826 | Warm to 37 °C before use |
| Thermomixer Heat Block | Eppendorf | 22670000 | Warm to 37 °C before use |
| Ultrapure DNA/RNAse free water | Life Technologies | 10977015 | Use at RT |
| D(+)-glucose, anhydrous | Sigma | G5767 | |
| aprotinin from bovine lung | Sigma | A1153 | |
| leupeptin hemisulfate | EMD | 10-897 | |
| L-ascorbic acid, reagent grade | Sigma | A0278 | |
| (-)-isoproterenol (+)-bitartrate | Sigma | I2760 | Use fresh aliquot each experiment |
Referencias
- Malik, R. U., et al. Detection of G Protein-selective G Protein-coupled Receptor (GPCR) Conformations in Live Cells. J. Biol. Chem. 288, 17167-17178 (2013).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat. Rev. Mol. Cell Bio. 9, 60-71 (2008).
- Rasmussen, S. G., et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477, 549-555 (2011).
- Alexander, N. S., et al. Energetic analysis of the rhodopsin-G-protein complex links the α5 helix to GDP release. Nat. Struct. Mol. Biol. 21 (1), 56-63 (2014).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Giα. Nature. 363, 274-276 (1993).
- Conklin, B. R., et al. Carboxyl-Terminal Mutations of Gqα and Gsα That Alter the Fidelity of Receptor Activation. Mol. Pharmacol. 50, 855-890 (1996).
- Onaran, H. O., Costa, T. Where have all the active receptor states gone. Nat. Chem. Bio. 8, 674-677 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21 (11), 1387-1395 (2003).
- Lohse, M. J., Nuber, S., Hoffman, C. Fluorescence/bioluminescence resonance energy transfer techniques to study G-protein-coupled receptor activation and signaling. Pharmacol Rev. 64 (2), 299-336 (2012).
- Vilardaga, J. P., Bünemann, M., Krasel, C., Castro, M., Lohse, M. J. Measurement of the millisecond activation switch of G protein-coupled receptors in living cells. Nat. Biotechnol. 21, 807-812 (2003).
- Bünemann, M., Frank, M., Lohse, M. J. Gi protein activation in intact cells involves subunit rearrangement rather than dissociation. Proc. Natl. Acad. Sci. USA. 100 (26), 16077-16082 (2003).
- Stumpf, A. D., Hoffman, C. Optical probes based on G protein-coupled receptors - added work or added value. Brit. J. Pharmacol. 173, 255-266 (2016).
- Sivaramakrishnan, S., Spudich, J. A. Systemic control of protein interaction using a modular ER/K α-helix linker. Proc. Natl. Acad. Sci. USA. 108, 20467-20472 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2 (12), 905-909 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados