Method Article
Un método eficaz para la síntesis de peptoides con monómeros de tipo mixto lisina / arginina del tipo y la evaluación de su actividad anti-Leishmania
En este artículo
Resumen
A protocol to synthesize peptoids with mixed cationic functionality in the same sequence is presented (lysine- and arginine-type monomers). Subsequent testing of these compounds against Leishmania mexicana, the protozoan parasites that cause cutaneous leishmaniasis, is also described.
Resumen
This protocol describes the manual solid-phase synthesis of linear peptoids that contain two differently functionalized cationic monomers. In this procedure amino functionalized 'lysine' and guanido functionalized 'arginine' peptoid monomers can be included within the same peptoid sequence. This procedure uses on-resin (N-(1-(4,4-dimethyl-2,6-dioxocyclohexylidene)ethyl) or Dde protection, orthogonal conditions to the Boc protection of lysine monomers. Subsequent deprotection allows an efficient on-resin guanidinylation reaction to form the arginine residues. The procedure is compatible with the commonly used submonomer method of peptoid synthesis, allowing simple peptoids to be made using common laboratory equipment and commercially available reagents. The representative synthesis, purification and characterization of two mixed peptoids is described. The evaluation of these compounds as potential anti-infectives in screening assays against Leishmania mexicana is also described. The protozoan parasite L. mexicana is a causative agent of cutaneous leishmaniasis, a neglected tropical disease that affects up to 12 million people worldwide.
Introducción
Peptoides (o poli- N-sustituido glycines) son una clase de péptidos miméticos que ofrecen propiedades similares a péptidos y como tal cada vez más están siendo investigados para aplicaciones medicinales y materiales. En los péptidos, la cadena lateral de cada aminoácido está conectado a la α-carbono de la cadena principal de amida; en peptoides las cadenas laterales se desplazan en el átomo de nitrógeno de la cadena principal. Fundamentalmente, esto da peptoides mayor resistencia a la proteolisis.
Los peptoides se sintetizan comúnmente por el método de submonómero por primera vez por Zuckermann et al., En donde los monómeros peptoides se pueden construir por haloacetylation secuencial de una funcionalidad amina unido a un soporte sólido y el posterior desplazamiento del halógeno con una amina primaria. 1 recientemente nuestro grupo ha desarrollado una adaptación a este método de submonómero para permitir lisina y de tipo arginina residuos peptoides que se incluirán dentro de la misma secuencia de peptoide para la frimero tiempo. 2 Este enfoque en fase sólida manual para peptoide síntesis utiliza reactivos disponibles comercialmente y equipo de laboratorio común, por lo que es accesible para la mayoría de los laboratorios. Los peptoides se han demostrado tener actividades prometedores contra una amplia gama de bacterias Gram negativas, Gram especies bacterianas y fúngicas positivos que son comparables a muchos péptidos antimicrobianos conocidos. 3-9
En nuestro trabajo, peptoides se han utilizado como nuevos compuestos anti-infecciosos para el tratamiento de la leishmaniasis enfermedad tropical desatendida. 5,10 La leishmaniasis es endémica en más de 80 países de todo el mundo y se estima que más de 12 millones de personas están infectadas en todo el mundo. El 11 enfermedad es causada por parásitos protozoarios que se transmiten por la picadura de un mosquito. especies de Leishmania pueden causar la leishmaniasis cutánea, una condición que conduce a la cicatrización y el daño a las membranas mucosas, o el Leis visceral en peligro la vidahmaniasis, que causa daño a los órganos fatal. No hay vacuna disponible actualmente para esta enfermedad y los tratamientos existentes se basan en un pequeño número de medicamentos que tienen efectos secundarios graves. Además, la resistencia a los fármacos existentes es un problema emergente y grave para que los nuevos tratamientos se necesitan desesperadamente para tratar con eficacia la leishmaniasis en el futuro. 12-16
En estas aplicaciones antimicrobianas, peptoides son a menudo diseñados para ser anfipático con una mezcla de catiónicos y monómeros hidrófobos. 3,4 Esto puede dar peptoides un grado de selectividad hacia células bacterianas, reducir la toxicidad para células de mamífero, y para mejorar su actividad como transportadores moleculares . 17-20 la mayoría de los peptoides anti-infecciosos en la literatura contiene cadenas laterales catiónicos que se componen exclusivamente de cualquiera de amino funcionalizado monómeros de tipo lisina o residuos de tipo arginina. quimeras de péptido-peptoides, en los que las cadenas catiónicos están compuestos de la unamino ácidos lisina o arginina, también se han sintetizado para examinar el efecto de grupos catiónicos sobre la actividad y la toxicidad. 21-25
peptoides poli-lisina se pueden sintetizar fácilmente utilizando comercialmente disponibles aminas protegidas con Boc. Los peptoides poli-arginina informaron puede hacerse utilizando un método que utiliza pirazol-1-carboxamidina como agente guanidinylation. 18 Sin embargo, esto sólo puede llevarse a cabo si el peptoide se ha escindido de la resina y la protección Boc en cadenas laterales eliminado, por lo cada residuo de tipo lisina dentro de la secuencia se transforma en un residuo de arginina. En un esfuerzo para ajustar las propiedades químicas y biológicas de los compuestos, se desarrolló un método que permite funcionalidad catiónica dual (por ejemplo, N Lys y Arg N) para ser incluidos en cualquier secuencia de peptoide dada para la primera vez. 2
En este documento, se describe la síntesis, purificación y caracterización de two nuevos peptoides que contienen ambos residuos lisina y de tipo arginina en la misma secuencia. El método utiliza ortogonal protección N-Boc y N -DDE en resina con pirazol-1-carboxamidina como reactivo guanidinylation. La evaluación biológica de estas peptoides se describe también en los ensayos de citotoxicidad contra Leishmania mexicana, el agente causante de la leishmaniasis cutánea. Esto proporciona un método práctico para acceder peptoides con funcionalidad catiónica dual y para evaluar su actividad biológica. Se espera que este método ayudará a la síntesis de peptoides anfipáticas por la comunidad peptoide en el futuro.
Protocolo
Síntesis 1. en fase sólida de peptoides
NOTA: Los peptoides se sintetizan manualmente mediante el procedimiento de submonómero de la síntesis de peptoide en fase sólida. Este método permite una alta eficiencia de acoplamiento y buenos rendimientos del producto final. Síntesis en fase sólida también permite exceso de reactivos a ser removidos fácilmente al final de cada paso y el método ha sido modificado para permitir (residuos es decir, de tipo arginina y de tipo lisina) diferentes monómeros catiónicos funcionalizados para ser incluido dentro de la misma secuencia de 1,2.
- Síntesis de un peptoide lineal
Precaución: Llevar a cabo evaluaciones de seguridad antes de iniciar la síntesis. Llevar a cabo todas las reacciones en una campana de humos y llevar equipo de protección individual adecuados, como (por ejemplo, guantes de nitrilo desechables, gafas de seguridad y bata de laboratorio apropiadas). Tener especial cuidado cuando se utilizan los siguientes reactivos y disolventes. Dimetilformamida (DMF) es un teratógeno y se sospecha dichloromethane (DCM) es un carcinógeno. N, N -diisopropylcarbodiimide '(DIC) y piperidina son peligrosos para los ojos, la piel, por inhalación respiratorias y pueden causar sensibilización de la piel. La hidracina es un posible carcinógeno, fatal si se inhala y causa severas quemaduras en la piel o los ojos. ácido bromoacético también es peligroso para la piel, los ojos y el tracto respiratorio y puede causar quemaduras al entrar en contacto. ácido trifluoroacético (TFA) es un líquido volátil y puede causar quemaduras graves por lo que manejar con cuidado. Se recomienda usar guantes para uso industrial.- Añadir 0,12 g de resina Rink Amide protegidos con Fmoc (0,1 mmol, carga típica 0,7 mmol / g) a un recipiente de reacción 20 ml de polipropileno cubierto con dos fritas. Añadir 5 ml de dimetilformamida (DMF) para hinchar la resina y dejar el recipiente en reposo durante al menos 60 minutos a temperatura ambiente. Escurrir el DMF utilizando una plataforma de extracción al vacío en fase sólida.
- Para desproteger el grupo Fmoc en la resina hinchada, añadir 2 ml de solución de piperidina (20% en DMF v / v). Colocar el recipiente enuna plataforma de agitación a temperatura ambiente (450 rpm) y agitar durante 5 min. Retire la solución a través de la estación de vacío.
- Repita la desprotección Fmoc con solución de piperidina 2 ml y agitar durante 15 min a temperatura ambiente. Escurrir la solución como antes.
- Lavar la resina mediante la adición de 2 ml de DMF y la mezcla de la resina para 30 seg. Escurrir el DMF y repetir tres veces más.
- Para la acetilación, añadir 1 ml de solución de ácido bromoacético (0,6 M en DMF) y N, solución -diisopropylcarbodiimide N '(DIC, 50% en DMF v / v). 0,2 ml Deja recipiente de reacción para agitar durante 20 min a temperatura ambiente. Escurrir la solución y se lava la resina con 2 ml DMF tres veces.
- Para el desplazamiento, añadir 1 ml de solución de amina (1,5 M en DMF). Agitar la resina durante 60 min a temperatura ambiente. Escurrir la solución y se lava la resina con 2 ml DMF tres veces.
- Para añadir un monómero de tipo arginina, siga el paso 1.7. Dependiendo de la secuencia de peptoide deseado, diferentes aminasserá añadido.
- Repita los pasos 1.1.4 y 1.1.5.
- Para incluir un monómero funcionalizado de guanidina (es decir, N Arg), añadir 1 ml de solución de diamina sin protección (1,5 M en DMF) a la resina y agitar durante 60 min a temperatura ambiente.
- Escurrir la solución y se lava la resina con 2 ml DMF tres veces.
- Añadir 2-acetyldimedone (0,2 g, 1 mmol en 0,5 ml de DMF, 10 equivalentes) para agregar el grupo Dde a la amina primaria gratuita y agitar durante 60 minutos a temperatura ambiente. Escurrir la solución y se lava la resina con 2 ml DMF tres veces.
- Continuar la síntesis submonómero como en 1.1.4 a 1.1.7 hasta que se realice la secuencia deseada. Añadir 2 ml de DMF para lavar la resina y repetir tres veces.
- Para desproteger el grupo Dde en resina, añadir solución de hidrazina 4 ml 2% (en DMF v / v) y agitar durante 3 min a temperatura ambiente. Escurrir la solución y repetir tres veces.
- Escurrir la solución y se lava la resina con 2 ml de DMF tres tIME.
- Añadir pirazol-1-carboxamidina (6 equivalentes por amina libre, es decir, por monómeros de N Arg, en el volumen mínimo de DMF) y N, N-diisopropiletilamina o DIPEA (6 equivalentes por amina libre) y agitar a temperatura ambiente durante 60 min .
- Escurrir la solución y se lava la resina con 2 ml de diclorometano tres veces. Deje que la resina se seque al aire durante 10 minutos y después la resina puede ser almacenado hasta que la escisión (sección 2).
- Para hacer una pausa en la síntesis, la resina se lava con 2 ml de DMF tres veces. Añadir 2 ml de DMF, tapar el recipiente para síntesis y dejar a temperatura ambiente en una campana extractora de humos.
NOTA: La síntesis puede ser una pausa después de cualquier etapa de desplazamiento (con excepción de la segunda etapa de desplazamiento como dicetopiperazinas puede formarse).
- La desprotección de la cadena lateral y la escisión de la resina
- Llevar a cabo un escinden de prueba para comprobar el progreso de la síntesis (la pureza y la masa) en cualquier momento durante la síntesis después de la displaescalones de cemento, adición o eliminación del grupo protector Dde o después de la secuencia final se ha hecho.
- Transferir aproximadamente 10 perlas de resina del recipiente de reacción en un cartucho nuevo fritado 8 ml de polipropileno.
- Añadir 1 ml de cóctel de escisión de ácido trifluoroacético (que contiene 95% de TFA, 2,5% H 2 O, 2,5% triisopropilsilano) y agitar durante 90 min a temperatura ambiente.
- Filtrar el cóctel de escisión TFA de la resina usando el recipiente de reacción sinterizado en un 10 ml matraz de fondo redondo.
- Se evapora el cóctel de escisión usando un evaporador rotatorio y volver a disolver el aceite resultante en 1 ml de acetonitrilo / agua para su presentación a LC-MS o HPLC analítica.
- Para la escisión final: en el mismo cartucho de reacción de polipropileno poroso utilizado para la síntesis, añadir 4 ml de cóctel de escisión TFA (95% de TFA, 2,5% H 2 O, 2,5% triisopropilsilano) y la tapa del recipiente. Agitar durante 90 min a temperatura ambiente.
- º filtrose TFA cóctel de escisión de la resina usando el recipiente de reacción sinterizado en un 50 ml matraz de fondo redondo.
- Se evapora el cóctel de escisión usando un evaporador rotatorio. Después de que el TFA se ha eliminado, el producto debe ser obtenido como un aceite. Para ayudar a la eliminación de TFA de este crudo, añadir éter dietílico 2 ml anhidro y el peptoide debería precipitar.
- O bien eliminar el éter dietílico con una pipeta y descartar o evaporarse en el evaporador rotativo. éter dietílico precipitación Repetir tres veces.
- Se disuelve el peptoide crudo en solución 10 ml de acetonitrilo / agua acidificada (50% de acetonitrilo, 0,1% de TFA en agua v / v). Transferir a un contenedor previamente pesado, se congela a 20 ° C y se liofiliza hasta un polvo seco.
- Llevar a cabo un escinden de prueba para comprobar el progreso de la síntesis (la pureza y la masa) en cualquier momento durante la síntesis después de la displaescalones de cemento, adición o eliminación del grupo protector Dde o después de la secuencia final se ha hecho.
2. Caracterización y purificación
NOTA: La síntesis peptoide se puede supervisar y el peptoide última evaluó a través de fase inversa analítica HPLC usando una columna C18 y elespectrometría de ectrospray-cromatografía líquida de masas (LC-MS). Todos los disolventes de HPLC de disolventes para LC-MS deben estar recién preparadas.
- HPLC analítica
- Se pesa 1 mg de peptoide en un pequeño frasco de vidrio. Añadir el volumen mínimo de acetonitrilo para disolver y diluir a 1 ml con agua. Asegúrese de que el peptoide se haya disuelto completamente.
- Inyectar 10 l a HPLC analítica (gradiente sugerido 0 - 100% de disolvente B durante 30 min, donde el disolvente A = 95% de agua, 5% de acetonitrilo, 0,05% de TFA y el disolvente B = 95% de acetonitrilo, 5% de agua, 0,03% de TFA) , según las instrucciones del fabricante.
- Visualizar espectro UV a 220 nm.
- ESI LC-MS
- Hacer 1 mg solución peptoide / ml como en el paso 2.1.1.
- Se inyecta 1 l de electropulverización LC-MS para determinar si el peso molecular del peptoide diana está presente, utilizando las instrucciones del fabricante.
- Compruebe la masa objetivo de la secuencia utilizando un peptoide Peptcalculadora OID, según las instrucciones de la calculadora. 26 Esta utilidad web también permite la asignación de cualquier producto supresión / adición observados en el espectro de masas. 26
- La HPLC preparativa de fase inversa
- Disolver peptoides crudo en 2 ml acidificados agua / acetonitrilo (95% de agua, 5% de MeCN, 0,1% de TFA) y se purifica por RP-HPLC preparativa usando el protocolo del fabricante. Determinar el gradiente por el tiempo de elución obtenido de HPLC analítica y la cantidad inyectada dependerá de las dimensiones de la columna.
- Visualizar el uso de un detector fijado en 220 nm.
- Recogen fracciones de 15 ml tubos de centrifugación, se congelan a 20 ° C y se liofiliza.
- Vuelva a analizar fracciones usando LC-MS y HPLC analítica de acuerdo con el protocolo del fabricante. Recombinar fracciones purificadas.
3. El ensayo biológico contra parásitos Leishmania mexicana
caución:. Las evaluaciones de seguridad deben llevarse a cabo antes de iniciar la síntesis de Leishmania mexicana se clasifica un peligro para el grupo 2 patógeno en el Reino Unido y medidas de control adecuadas deben estar en su lugar antes de comenzar la prueba. Todo el trabajo debe llevarse a cabo en una cabina de seguridad microbiológica clase 2 y los equipos de protección individual adecuados usados como (por ejemplo, guantes de nitrilo, gafas de seguridad y bata de laboratorio apropiadas).
- Subcultura de parásitos
- Descongelar 1 ml -150 ° C madre congelada Leishmania mexicana M379 mediante la colocación de vial en un baño de agua a 37 ° C durante 30 s.
- La transferencia de la solución madre de medio de insecto 10 ml de Schneider (a pH 7,0 suplementado con 15% de suero bovino fetal inactivado por calor y 1% de penicilina / estreptomicina) en un 25 cm matraz de cultivo celular 3 con un casquillo sin ventilación.
- Incubar a 26 ° C durante 72 hr.
- Examinar los parásitos bajo el microscopio (400x) para comprobar el estado. They debe ser promastigotos etapa de insectos, formas procíclicas en la fase de registro con muchas células en división.
- Mantener promastigotes procíclico por parásitos-sub cultivo a una concentración de 5 x 10 5 parásitos / ml cada tres días. Recuento de células utilizando un hemocitómetro Neubauer mejorada.
- Transformación de L. etapa mexicana de insectos en estadio axénicos de mamíferos forma amastigote 27
- Día 0: Preparar 10 ml de cultivo de parásitos en fase log a los 5 x 10 5 parásitos / ml en medio de insectos de Schneider (a pH 7,0 suplementado con suero bovino fetal al 15% inactivado por calor y 1% de penicilina / estreptomicina) en un 3 células 25 cm frasco de cultivo con una tapa sin aberturas de ventilación.
- Incubar a 26 ° C durante 48 hr.
- Día 3: Transferencia de 10 ml de cultivo a un tubo de centrífuga de 50 ml y centrifugar a 447 xg durante 5 min.
- Se retira el medio viejo y se añade medio de insectos 10 ml de Schneider (a pH 5,5 suplementado con 20% hcomer inactivada con suero bovino fetal y 1% de penicilina / estreptomicina). resuspender suavemente el sedimento de parásitos en el nuevo medio utilizando una pipeta.
- Contar el número de parásitos utilizando un hemocitómetro Neubauer mejorada. Diluir a una concentración de 5 x 10 5 parásitos / ml con pH 5,5 medio y la transferencia a un 25 cm matraz de cultivo de 3 celular.
- Incubar a 26 ° C durante aproximadamente 6 días.
- Día 9: Examinar los parásitos bajo el microscopio (400X). Deben estar en la no replicante, la etapa de promastigotes metacyclic infecciosa.
- Contar el número de parásitos utilizando un hemocitómetro Neubauer mejorada. Diluir a una concentración de 5 x 10 5 parásitos / ml con un pH medio de 5,5.
- Eliminar 10 ml de cultivo de células y transferir a un matraz de cultivo celular. Incubar a 32 ° C durante 5 días.
- Día 14: Salida aparición de parásitos bajo el microscopio (400X). Deben estar en la etapa de amastigote patógeno, que carece del carácter flageloISTIC de promastigotes, y listo para el ensayo.
- Ensayo de citotoxicidad sobre L. amastigotes axénicos mexicana.
NOTA: La prueba biológica de peptoides utiliza ensayos de alto rendimiento realizadas en placas de 96 pocillos. Este protocolo describe la prueba de L. Mexicana amastigotes axénicos, pero ensayos idénticos también pueden llevarse a cabo en los parásitos en fase de promastigotes en medios apropiados. Los compuestos se incuban con los parásitos a concentraciones de 3 - 100 M durante 60 min y después se incubaron durante 24 hr después de una dilución de 10 veces. Los resultados se obtuvieron mediante la medición de la fluorescencia de los pocillos después de la incubación con solución de viabilidad celular basado en la resazurina (por ejemplo, alamarBlue).- Preparar soluciones madre de compuestos. Pesar 1 mg del producto peptoide final purificado utilizando una balanza analítica. Añadir el volumen apropiado de dimetilsulfóxido de calidad de biología molecular (DMSO) a una concentración de 5 mM. Hacer 6 alícuotas ycongelar a -20 ° C.
- Se preparan soluciones de compuestos en placas de 96 pocillos (una disposición de la placa recomendada se puede ver en la sección de resultados, figura 6), por triplicado, 100-3 M. Añadir 2 l de solución madre 5 mM de cada compuesto en la fila superior (es decir, A). Añadir 48 l medio de insectos de Schneider fresco (a pH 5,5 y suero bovino fetal al 20% (FBS), 1% de penicilina / estreptomicina (P / S)) a la fila superior usando una pipeta multicanal. Añadir 25 l medio de insectos de Schneider a todas las demás filas (B - F).
- Llevar a cabo una dilución en serie con la pipeta 25 l de solución de la fila superior. Añadir a la fila de abajo y mezclar. Realizar diluciones hasta la última fila, donde la última solución de 25 l debe ser desechada.
- Utilice la anfotericina B (stocks 5 mM) como un control positivo y DMSO (solución 2%) como un control negativo por triplicado.
- Preparar la solución de parásito: cultura transferencia a un tubo de centrífuga de 50 ml y centrifugar a447 xg durante 5 min. Se retira el medio viejo y se añade medio de 10 ml de Schneider insectos (a pH 5,5 y 20% de FBS, 1% P / S).
- disolver suavemente el sedimento de parásitos en el nuevo medio con una pipeta y contar utilizando un hemocitómetro Neubauer mejorado. Diluir la cultura de 8 x 10 6 / ml parásitos.
- Añadir 25 l L. cultura mexicana a cada pocillo. Incubar las placas durante 60 minutos a 32 ° C.
- Retire la placa de la incubadora y eliminar la solución de 40 l de cada pocillo.
- Añadir 90 l de medio fresco y se incuba durante 24 horas a 32 ° C.
- Añadir 10 l solución de viabilidad celular basado en la resazurina a cada pocillo. Se incuba durante 4 horas a 32 ° C.
- Medir la fluorescencia utilizando un lector de placas (ex λ = 540 nm, λ em = 600 nm), según las instrucciones del fabricante. Analizar los datos mediante la eliminación de fondo promedio (de medio sólo pozos) y comparar la fluorescencia de los pozos después de la normalización con respecto atél DMSO controles.
Resultados
Como resultado representativo, la síntesis y caracterización de dos 12 peptoides de residuos que contienen dos monómeros de tipo lisina y monómeros del tipo de dos arginina cada se describirán. También se muestran los resultados posteriores de ensayo de citotoxicidad.
Dos peptoides [(N nArg N spe N SPE) (N ae N spe N spe)] 2 (a) y [(N hArg N spe N SPE) (N Lys N spe N spe)] (b) se sintetizaron 2 usando 120 mg Rink Amide resina cada (carga = 0,79 mmol / g). Todas las etapas de acetilación y de desplazamiento se llevaron a cabo como se describe anteriormente, con todos los reactivos adquiridos comercialmente. Para estos residuos, las siguientes aminas se utilizaron en la etapa de desplazamiento: spe N (S) - (-) - α-metilbencilamina, N ae N - (terc -butoxicarbonil) -1,2-diaminoethane, N Lys N - (terc -butoxicarbonil) -1,4-diaminobutano. Para los residuos derivado de arginina, se acoplaron los siguientes diaminas no protegidos: N hArg 1,4-diaminobutano o N nArg 1,2-diaminoetano, seguida por la protección en-resina con 2-acetyldimedone (Dde-OH). Después de toda la secuencia se había sintetizado, hidrazina desprotección del Dde produce aminas libres en guanidinylate.
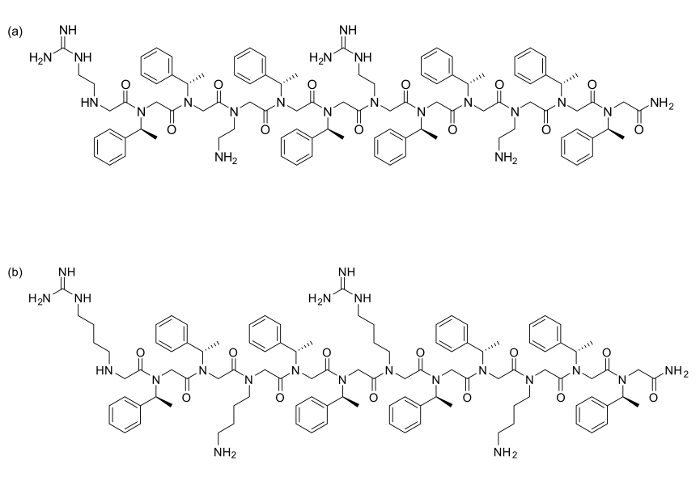
Figura 1. Estructuras de peptoides (a) [(N nArg N spe N SPE) (N ae N spe N spe)] 2 y (b) [(N hArg N spe N SPE) (N ng> Lys N N SPE SPE)] 2. Haga clic aquí para ver una versión más grande de esta figura.
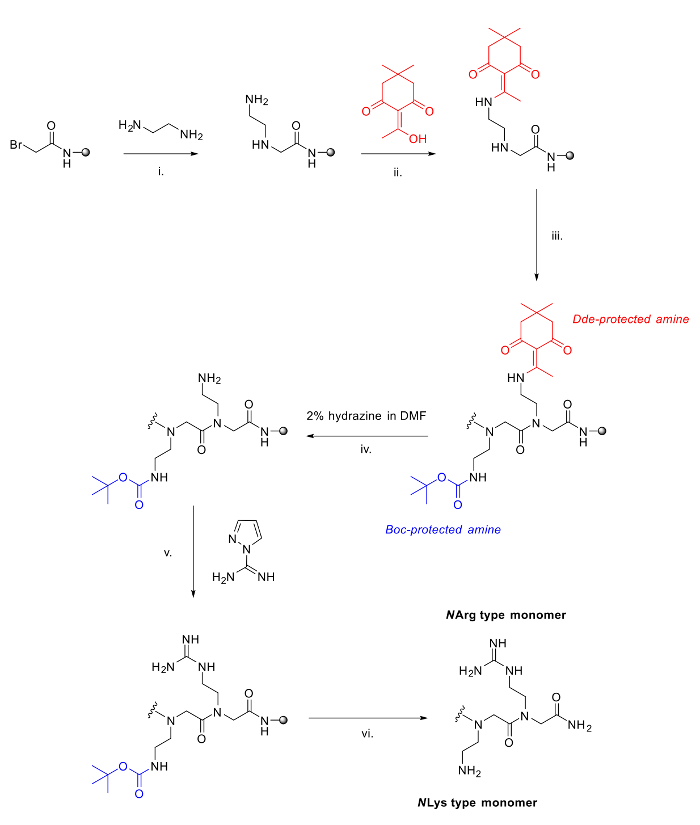
Figura 2. El método utilizado para sintetizar peptoides arginina / lisina mixtos. I. etapa de desplazamiento estándar en el método de submonómero con diamina; ii. Además de DDE-OH, 90 minutos para proteger amina libre; iii. Otras adiciones para extender la cadena peptoide utilizando el método de submonómero; iv. La desprotección de Dde usando 2% de hidrazina en DMF; . V Guanidinylation de la amina libre en la resina con pirazol-1-carboxamidina y DIPEA en DMF; vi. la escisión ácida de la resina y la desprotección de los grupos Boc.large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
Después de la escisión de la resina y liofilización, los productos brutos se obtuvieron como polvos blancos: (a) 154 mg, (b) 163 mg. Los productos se purificaron mediante RP-HPLC como se ha descrito con un máximo de 50 inyecciones mg usando una bomba de LC con un detector UV-vis (λ = 250 nm) sobre una columna analítica, 250 mm x 10 mm, 5 micras; caudal = 2 ml / min. Las fracciones correspondientes a la masa objetivo se combinaron y se obtuvieron como polvos blancos: (a) 54 mg (b) 65 mg, rendimiento final de aproximadamente 30% para las fracciones> 90% puros.
Las identidades compuestos finales después de la purificación fueron confirmadas por LC-MS (véase la figura 3) utilizando un espectrómetro de masas de triple cuadrupolo equipado con un UPLC y un detector de matriz de fotodiodos. espectrometría de masa exacta se llevó a cabo utilizando el mismo espectrómetro de t él [M + 2H] 2+. Los siguientes calculan y masas observadas fueron encontrados en estrecho acuerdo (Figura 4): (a) calculada = 896,0026 amu, observado = 896,0038 uma; (B) calculada = 952,0691 amu, observado = 952,0730 amu.
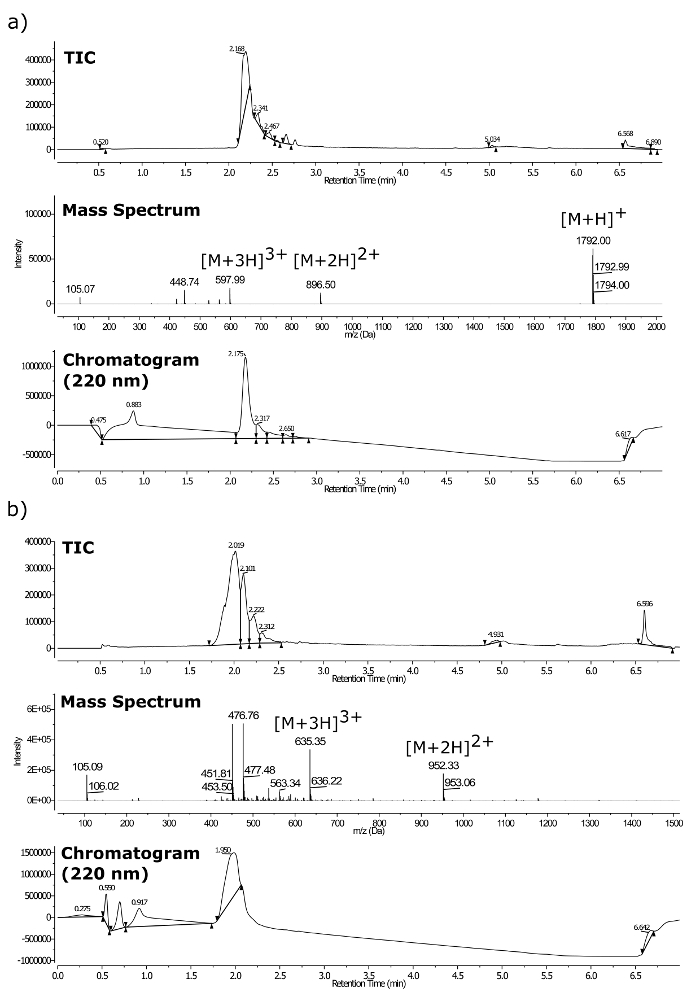
Figura 3. LC-MS para peptoides purificadas. (A) m / z = 1792 y (b) m / z = 1.903. Donde la parte superior es de TIC, el espectro de LC-MS medio, cromatograma UV inferior a 220 nm. Haga clic aquí para ver una versión más grande de esta figura.
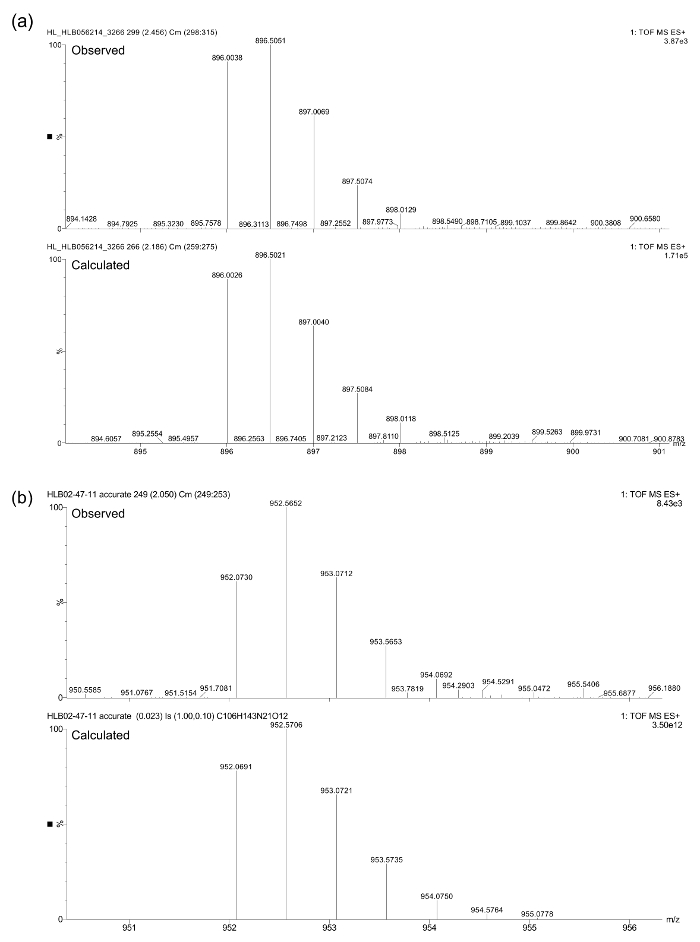
Figura 4. Los datos de espectrometría de masas exactas para peptoides (a) y (b).objetivo "https://www.jove.com/files/ftp_upload/54750/54750fig4large.jpg" = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.
La pureza del producto se evaluó mediante una RP-HPLC (bomba de LC con un detector UV-vis en una columna analítica, 4,6 mm x 100 mm, 3,5 micras; caudal = 1 ml / min) analítica, y se visualizó a 220 nm, la absorbancia de amida de cadena principal. la figura 5a y 5b muestran que los compuestos son homogéneos.
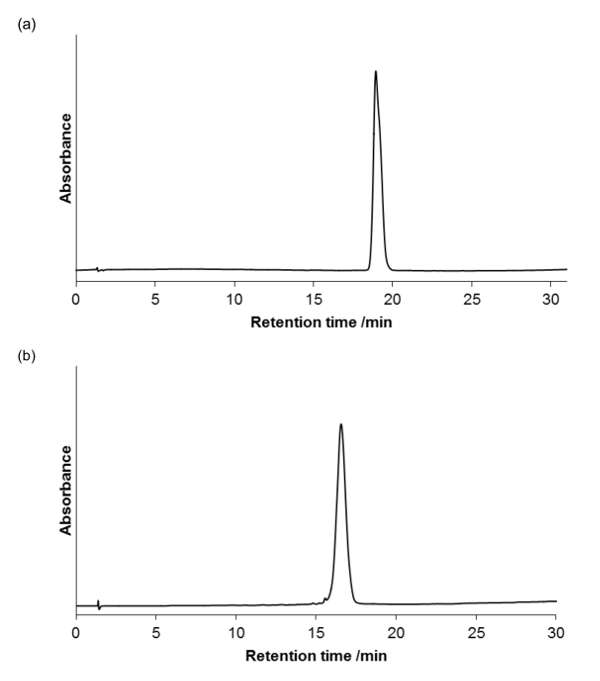
Figura 5. La HPLC analítica de los peptoides purificadas (a) y (b). Hay un gradiente de 0-100% de B durante 30 minutos, horno de columna a 40 ° C (A = 95% H 2 O, 5% MeCN, 0,05 % de TFA;. B = 95% MeCN, 5% de H2O, 0,03% de TFA) Por favor, click aquí para ver una versión más grande de esta figura.
Los peptoides purificadas (a) y (b) se ensayaron en ensayos de citotoxicidad contra L. amastigotes axénicos mexicana. Material congelado de L. mexicana se descongelaron y se transforma en la etapa de amastigote listo para el ensayo. 72 horas después de la descongelación, los parásitos deben ser promastigotos etapa de insectos en su forma procíclica, en la fase de registro con muchas células en división. En esta etapa los parásitos se puede transformar en la fase de amastigote mediante el cambio de pH y de temperatura descrito. 27 En el día 9 de la transformación, los parásitos estarán en la etapa de promastigote metacyclic infecciosa no replicante. Finalmente en el día 14, los parásitos deben estar en la fase amastigote patógena donde los parásitos carecen de flagelos característica de los promastigotes. 28
5 mM de soluciones madre de los compuestos se hicieron en el grado de cultivo celular DMSO y se ensayaron por triplicado enSe recogió un mínimo de dos ocasiones para asegurar un conjunto de datos robusta. Un plan de placa de 96 pocillos representativo se muestra en la Figura 6. Al final del ensayo, se añadió el reactivo de la viabilidad celular a cada pocillo y se midió la fluorescencia como se ha descrito para el cálculo de la viabilidad de los parásitos en cada concentración ensayada (véase la Figura 7 ). ED 50 valores se calculan como peptoide (a)> 100 M y peptoide (b) 37 mM, respectivamente. Las barras de error representan, muestran la variación entre los pozos como una desviación estándar, y se puede ver que estos son razonables para la mayoría de los bares.
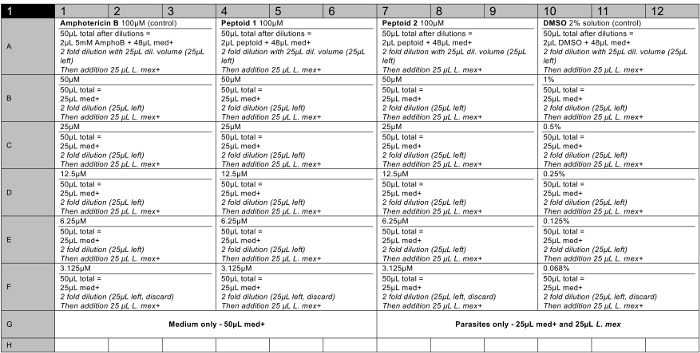
Figura 6. Representante 96 plan de placa de pocillos para un ensayo de citotoxicidad en 2 soluciones de peptoides (incluyendo los controles positivos y negativos). Med + = medio (medio de Schneider Insecto, pH 5,5, 20% de FBS, 1% P / S). L. Mex. =8 x 10 6 / ml de cultivo de parásitos en med +. AmphoB = 5 mM en DMSO. Peptoide = 5 mM solución madre en DMSO. Pozos vacíos deben contener agua estéril. Por favor, haga clic aquí para ver una versión más grande de esta figura.
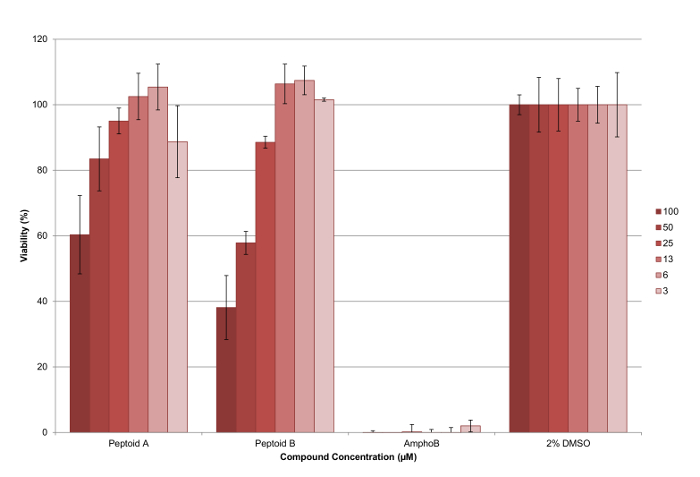
Figura 7. Los resultados de ensayo de citotoxicidad contra L. Mexicana axénicos parásitos amastigotes utilizando peptoide (a) y (b). Se puede observar que el peptoide (b) es más eficaz que peptoide (a) a reducir el porcentaje de parásitos viables, con los dos compuestos que tienen un efecto dependiente de la dosis. Las barras de error trazados muestran la variación entre los pozos como una desviación estándar. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los peptoides cada vez más se están estudiando en la biología química y campos de química médica en aplicaciones tales como nuevas terapias 3-5, agentes de suministro de células 18,20 y herramientas de diagnóstico. 29 Típicamente, estas secuencias son catiónicos para proporcionar un grado de selectividad para el patógeno más de células de mamíferos, la capacidad de penetrar a través de las membranas celulares y también ayudar a la solubilidad en sistemas acuosos. Hay numerosos ejemplos de peptoides catiónicos que contienen residuos de lisina o arginina únicamente mimético en la literatura. Sin embargo, hasta la fecha, la síntesis de peptoides que contienen ambos de estos residuos catiónicos en la misma secuencia se ha visto obstaculizado por la falta de un procedimiento sintético adecuado. El protocolo descrito aquí permite peptoides catiónicos mixtos para ser sintetizados de una manera eficiente y es altamente deseable, ya que ofrece una ruta para modular las propiedades biológicas y químicas de peptoides anfipáticas.
nt "> Nuestro método utiliza una adaptación a la síntesis peptoide submonómero de uso común y permite la adición de ambos monómeros lisina y de tipo arginina dentro de la misma secuencia. Utiliza acoplamientos temperatura ambiente y se estableció química del grupo protector por lo que se prevé que este método será útil para la mayoría de los grupos de investigación. para añadir protección ortogonal para el resto de tipo arginina, se añade una diamina sin protección en condiciones estándar de desplazamiento y, a continuación protegida en un acoplamiento 60 minutos con Dde-OH. una variedad de diaminas puede ser utilizado que permite cadenas laterales de 2 carbonos a 6 átomos de carbono largas para ser instalado, es decir, 1,2-diaminoetano de 1,6-diaminohexano, respectivamente. La protección de Dde-OH se disuelve bien en DMF y es un grupo protector muy eficiente y selectiva para aminas primarias. el grupo de protección de Dde hojas de aminas secundarias no afectado, por ejemplo, el N terminal sin protección de la cadena peptoide. 30 Una limitación es que la totalidad de la syntesis se llevó a cabo manualmente; sin embargo, se anticipa que las condiciones de acoplamiento desarrollados hacen el método susceptibles para su uso con péptido / sintetizadores de peptoides automatizados.La desprotección de la resina de los DDE grupos se lleva a cabo utilizando una solución de hidrazina 2% en DMF para dejar aminas libres que pueden ser guanidinylated en resina utilizando pirazol-1-carboxamidina. Seis equivalentes del pirazol-1-carboxamidina y seis equivalentes de DIPEA se utilizan por amina libre en la resina (es decir, seis equivalentes de cada monómero de tipo N Arg para ser instalado). De nuevo, esta reacción también es eficiente y el reactivo de pirazol-1-carboxamidina tiene buena solubilidad en DMF. La finalización de la reacción se ve típicamente a través de LC-MS después de 60 minutos a temperatura ambiente.
Debido a la versatilidad del método de submonómero, una amplia variedad de aminas primarias se puede utilizar en la etapa de desplazamiento así que las condiciones pueden necesitar ser optimizada para aumentar la efi acoplamientoeficiencia y rendimientos globales de productos o. 31 de la pureza para las secuencias descritas anteriormente, no hay condiciones especiales eran necesarias para acoplamientos exitosos. Sin embargo, los tiempos de desplazamiento más largos o concentraciones de amina superior podrían utilizarse para desplazamientos problemáticos (es decir, para las aminas nucleófilas o estéricamente voluminosos mal). Algunas aminas pueden no ser completamente soluble en DMF, en cuyo caso se recomienda para disolver estos en N-metil-2-pirrolidona (NMP), u otros disolventes apropiados para las reacciones en fase sólida en lugar como en un método integral anterior para la síntesis de submonómero de peptoides. 32 para incorporar monómeros que contienen heteroátomos no protegidos en las cadenas laterales, acetilación utilizando ácido cloroacético se ha demostrado ser eficaz por otros grupos. 33 Además, otras resinas se pueden utilizar con este método para producir peptoides con diferente funcionalización C terminal. Wang resinas y resinas de cloruro de 2-clorotritilo se utilizan rutinariamente en lasubmonómero síntesis de peptoides. Por ejemplo, este método se ha utilizado con éxito con resina de cloruro de 2-clorotritilo en nuestro grupo. 2 soportes sólidos diferentes requerirán un procedimiento de carga diferente a Rink Amide discute aquí (dependiendo de la resina específica utilizada) por lo que esta debe ser comprobado con la literatura antes de la síntesis.
De manera similar a la síntesis de péptidos, las condiciones para la escisión final de la resina peptoide fuera también se pueden optimizar para la secuencia específica. En este protocolo, un cóctel de escisión TFA se utiliza (con triisopropilsilano y agua como carroñeros). Los peptoides se presentan aquí sólo contenían protección Boc que es un grupo lábil razonablemente ácido. Para asegurar la desprotección completa de las secuencias con una mayor proporción de residuos protegidas o menos ácido protector lábil frente a los grupos, los tiempos de escisión más largos pueden ser necesarios (es decir, se recomiendan tiempos de escisión de más de 2 horas para secuencias que contienen Pbf o terciario-buéster Tyl grupos protegidos). carroñeros alternativos también pueden ser utilizados para las cadenas laterales especializados (por ejemplo, etanoditiol o 2-mercaptoetanol se utilizan a menudo en péptidos que tienen cadenas laterales que contienen azufre como la cisteína o metionina).
El ensayo biológico se presenta es una prueba de citotoxicidad estándar que se pueden modificar para adaptarse a diferentes líneas celulares. Es importante tener en cuenta que cada placa de 96 pocillos debería contener suficientes controles para permitir que la confianza en los resultados obtenidos. En este caso, la anfotericina B se usa como un control positivo, ya que es un fármaco conocido usado para tratar la enfermedad y se utiliza DMSO como control negativo, ya que es el disolvente utilizado para hacer las poblaciones de compuestos para el ensayo. Si se utilizan otras líneas celulares, controles alternativos adecuados, deben obtenerse y validados antes de su uso. L. mexicana se incuba con el peptoide a concentraciones entre 100 y 2 mM durante una hora, y después la solución parásito / peptoide se diluye porun factor de diez para la incubación durante la noche (es decir, los pozos inicialmente con 100 mM de stock peptoide se diluyeron a 10 mM).
El reactivo de la viabilidad celular se añade a cada pocillo (10% del volumen total así) al final del ensayo. Un cambio de color visible se observa entre los pocillos con parásitos viables (rosa), pocillos de control con parásitos viables (azul) y un espectro entre los números intermedios de parásitos viables. La fluorescencia es proporcional al número de células vivas y corresponde a la actividad metabólica de las células; resazurina colorante (no fluorescente) se convierte en la resorufina fluorescente mediante reacciones de reducción en las células metabólicamente activas. 34 En este ensayo, el tiempo de incubación con el reactivo de la viabilidad celular ha sido optimizado para L. mexicana. Los tiempos de incubación con el reactivo de viabilidad variará para las placas sembradas a diferentes concentraciones de células o con diferentes líneas celulares (por ejemplo, también se puede utilizar este métodocon células de mamífero). Dependiendo de la lector de placas exacto utilizado, consideraciones deben hacerse antes de que se tomen medidas de fluorescencia. Las burbujas de aire en los pozos deben ser removidos para asegurar lecturas exactas se pueden tomar. Algunos lectores de placas leen desde la parte inferior de las placas, en cuyo caso un fondo llano y placas de 96 pocillos deben ser utilizados. Otras máquinas pueden leer desde la parte superior de la placa, por lo que la tapa de la placa debe ser eliminado antes de la medición.
Por último, en el futuro, este protocolo puede ser compatible con sintetizadores automatizados que son capaces de hacer muchas secuencias en paralelo. Además, la síntesis de peptoides cíclicos también es posible con este método. Este protocolo debe proporcionar a los investigadores un procedimiento sintético práctico que se puede utilizar para acceder a nuevos andamios peptoides con ambos monómeros lisina y arginina de tipo, que pueden ser de uso en muchas aplicaciones, incluyendo materiales o campos medicinales.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Agradecemos al Consejo de Ingeniería y Ciencias Físicas de Investigación (EPSRC) para el apoyo financiero (HLB). También se agradece a sridevi Maalika Ramanoudjame por su ayuda durante el rodaje de este procedimiento.
Materiales
| Name | Company | Catalog Number | Comments |
| Polypropylene solid phase extraction cartridges with two frits | Crawford Scientific | 12131017 and 12131015 | 20 ml and 6 ml cartridges used in this preparation |
| Trifluoroacetic acid | Tokyo Chemical Industry (Europe) | T0431-100g | >98%; CAUTION: can cause severe burns and respiratory irritation |
| N,N'-diisopropylcarbodiimide | Sigma Aldrich | 38370-100ML | >98%; CAUTION: hazardous to eyes, skin and via respiratory inhalation, may also cause sensitisation |
| Dimethylformamide | Fischer Scientific | 10346180 | HPLC grade; CAUTION: suspected teratogen |
| Acetonitrile | Fischer Scientific | 10407440 | HPLC grade |
| Dichloromethane | Fischer Scientific | 10354263 | 99.8%; CAUTION: suspected carcinogen |
| Bromacetic acid | Sigma Aldrich | 17000-100G | >99%; CAUTION: causes burns and hazardous to skin, eyes and respiratory tract |
| (S)-(-)-alpha methylbenzylamine | Sigma Aldrich | 115568-100G | 98%; CAUTION: harmful if swallowed, toxic in contact with skin, causes severe skin burns and eye damage, used to synthesise the Nspe monomer |
| N-Boc 1,4-diaminobutane | Tokyo Chemical Industry (Europe) | A1373-25g | >98%; CAUTION: causes severe skin burns and eye damage, used to synthesise the NLys monomer |
| N-Boc 1,2-diaminoethane | Tokyo Chemical Industry (Europe) | A1371-25g | >97%; CAUTION: causes severe skin burns and eye damage, used to synthesise the Nae monomer |
| 1,2-diaminobutane | Sigma Aldrich | D13208-100G | 99%; CAUTION: flammable liquid and vapour, harmful if swallowed or inhaled, toxic in contact with skin, causes severe skin burns and eye damage, used in the synthesis of the NhArg monomer |
| 1,4-diaminoethane | Sigma Aldrich | 03550-250ML | >99.5%; CAUTION: flammable liquid and vapour, harmful if swallowed or inhaled, toxic in contact with skin, causes severe skin burns and eye damage, used in the synthesis of the NnArg monomer |
| 1H-pyrazole-1-carboxamidine HCl | Sigma Aldrich | 402516-10G | as HCl salt; CAUTION: harmful if swallowed and may cause an allergic skin reaction, causes serious eye damage |
| Hydrazine monohydrate | Sigma Aldrich | 207942-5G | reagent grade; CAUTION: suspected carcinogen, fatal if inhaled and causes severe burns to skin and eyes |
| 2-acetyl dimedone | Novabiochem | 8510150005 | Dde-OH |
| Rink Amide resin | Novabiochem | 8551190005 | 100-200 mesh, high loading |
| Piperidine | Sigma Aldrich | 411027-1L | >99.5%, a controlled substance, so adequate permission must be obtained before purchase; CAUTION: highly flammable liquid and vapour, harmful if swallowed and toxic in contact with skin or if inhaled, causes severe skin burns and eye damage, harmful to aquatic life with long lasting effects |
| Triisopropylsilane | Sigma Aldrich | 233781-50G | 98%; CAUTION: flammable liquid and vapour, causes skin irritation and serious eye irritation |
| alamarBlue | ThermoFischer | DAL1025 | Not classified as hazardous |
| Schneider's Insect Medium | Sigma Aldrich | S9895-1L | Powdered, medium must be made prior to use following manafacturers instructions; allow to warm to room temperature before use in biological assays |
| 96 well plates | VWR | 734-1793 | Flat bottom (to allow fluorescence measurement from the bottom), tissue-culture treated |
| Solvent reservoirs | VWR | 613-1182 | Used with multi channel pipette |
| Multi channel pipette | Eppendorf | 3122000043 | |
| Pipette tips | Starlab Group | S1111-3810, S1113-1810, S1111-6810 | Volume of tip dependent on pipette used. 10 µl, 10 - 200 µl and 1,000 µl recommended for assays |
| 25 cm3 cell culture flasks | VWR | 734-2312 | |
| 50 ml centrifuge tubes | VWR | 525-0791 | |
| dimethylsulphoxide (molecular biology grade) | Sigma Aldrich | D8418-50ML | Not classified as hazardous |
| Heat Inactivated Fetal Bovine Serum | ThermoFischer | 10082139-100mL | Gibco |
| Penicillin/Streptomycin | ThermoFischer | 15140148-20mL | Abbreviation: P/S |
| Amphotericin B | Sigma Aldrich | 46006-100mg | Amphotericin B trihydrate, VetranalTM analytical standard |
Referencias
- Zuckermann, R. N., Kerr, J. M., Kent, S. B. H., Moos, W. H. Efficient method for the preparation of peptoids oligo(N-substituted glycines) by submonomer solid-phase synthesis. J. Am. Chem. Soc. 114, 10646-10647 (1992).
- Bolt, H. L., Cobb, S. L. A practical method for the synthesis of peptoids containing both lysine-type and arginine-type monomers. Org. Biomol. Chem. 14, 1211-1215 (2016).
- Mojsoska, B., Zuckermann, R. N., Jenssen, H. Structure-activity relationship study of novel peptoids that mimic the structure of antimicrobial peptides. Antimicrob Agents Chemother. , (2015).
- Chongsiriwatana, N. P., et al. Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides. Proc. Natl. Acad. Sci. USA. 105, 2794-2799 (2008).
- Eggimann, G. A., Bolt, H. L., Denny, P. W., Cobb, S. L. Investigating the Anti-leishmanial Effects of Linear Peptoids. Chem Med Chem. 10, 233-237 (2015).
- Kapoor, R., et al. Antimicrobial Peptoids Are Effective against Pseudomonas aeruginosa Biofilms. Antimicrob. Agents Chemother. 55, 3054-3057 (2011).
- Ryge, T. S., Frimodt-Moller, N., Hansen, P. R. Antimicrobial activities of twenty lysine-peptoid hybrids against clinically relevant bacteria and fungi. Chemotherapy. 54, 152-156 (2008).
- Huang, M. L., Benson, M. A., Shin, S. B. Y., Torres, V. J., Kirshenbaum, K. Amphiphilic Cyclic Peptoids That Exhibit Antimicrobial Activity by Disrupting Staphylococcus aureus Membranes. Eur. J. Org. Chem. , 3560-3566 (2013).
- Huang, M. L., Shin, S. B. Y., Benson, M. A., Torres, V. J., Kirshenbaum, K. A Comparison of Linear and Cyclic Peptoid Oligomers as Potent Antimicrobial Agents. Chem Med Chem. 7, 114-122 (2012).
- Bolt, H. L., Eggimann, G. A., Denny, P. W., Cobb, S. L. Enlarging the Chemical Space of Anti-leishmanials: a Structure-Activity Relationship Study of Peptoids against Leishmania mexicana, a Causative Agent of Cutaneous Leishmaniasis. Med Chem Comm. , (2016).
- The World Health Organisation. Leishmaniasis. , Available from: http://www.who.int/leishmaniasis/en/ (2016).
- Chon, S. Y., et al. Antibiotic overuse and resistance in dermatology. Dermatologic therapy. 25, 55-69 (2012).
- Alvar, J., et al. Leishmaniasis Worldwide and Global Estimates of Its Incidence. PLOS ONE. 7, (2012).
- Croft, S. L., Barrett, M. P., Urbina, J. A. Chemotherapy of trypanosomiases and leishmaniasis. Trends Parasitol. 21, 508-512 (2005).
- Kedzierski, L. Leishmaniasis Vaccine: Where are We Today? J Global Infect Dis. 2, 177-185 (2010).
- Croft, S. L., Sundar, S., Fairlamb, A. H. Drug resistance in leishmaniasis. Clin Microbiol Rev. 19, 111-126 (2006).
- Huang, W., et al. Learning from Host-Defense Peptides: Cationic, Amphipathic Peptoids with Potent Anticancer Activity. PLOS ONE. 9, (2014).
- Wender, P. A., et al. The Design, Synthesis, and Evaluation of Molecules That Enable or Enhance Cellular Uptake: Peptoid Molecular Transporters. Proc. Natl. Acad. Sci. USA. 97, 13003-13008 (2000).
- Schröder, T., et al. Peptoidic Amino- and Guanidinium-Carrier Systems: Targeted Drug Delivery into the Cell Cytosol or the Nucleus. J. Med. Chem. 51, 376-379 (2008).
- Kömel, D. K., et al. Cell-penetrating peptoids: Introduction of novel cationic side chains. Eur. J. Med. Chem. 79, 231-243 (2014).
- Hein-Kristensen, L., Knapp, K. M., Franzyk, H., Gram, L. Bacterial membrane activity of α-peptide/β-peptoid chimeras: Influence of amino acid composition and chain length on the activity against different bacterial strains. BMC Microbiology. 11, 1-12 (2011).
- Su, Y., Doherty, T., Waring, A. J., Ruchala, P., Hong, M. Roles of Arginine and Lysine Residues in the Translocation of a Cell-Penetrating Peptide from (13)C, (31)P and (19)F Solid-State NMR. Biochem. 48, 4587-4595 (2009).
- Andreev, K., et al. Guanidino groups greatly enhance the action of antimicrobial peptidomimetics against bacterial cytoplasmic membranes. BBA Biomembranes. 1838, 2492-2502 (2014).
- Foged, C., et al. Cellular uptake and membrane-destabilising properties of alpha-peptide/beta-peptoid chimeras: lessons for the design of new cell-penetrating peptides. BBA Biomembranes. 1778, 2487-2495 (2008).
- Vedel, L., et al. Antiplasmodial and prehemolytic activities of alpha-peptide-beta-peptoid chimeras. Chem Bio Chem. 8, 1781-1784 (2007).
- Lear, S., Cobb, S. L. Pep-Calc.com: a set of web utilities for the calculation of peptide and peptoid properties and automatic mass spectral peak assignment. J Computer-Aided Mol Des. , 1-7 (2016).
- Bates, P. A. Complete developmental cycle of Leishmania mexicana in axenic culture. Parasitol. 108, 1-9 (1994).
- Gossage, S. M., Rogers, M. E., Bates, P. A. Two separate growth phases during the development of Leishmania in sand flies: implications for understanding the life cycle. Int J Parasitology. 33, 1027-1034 (2003).
- Seo, J., Lee, B. C., Zuckermann, R. N., et al. Comp Biomaterials. Ducheyne, P., et al. 2, Elsevier. 53-76 (2011).
- Nash, I. A., Bycroft, B. W., Chan, W. C. Dde - A selective primary amine protecting group: A facile solid phase synthetic approach to polyamine conjugates. Tetrahedron Lett. 37, 2625-2628 (1996).
- Culf, A. S., Ouellette, R. J. Solid-phase synthesis of N-substituted glycine oligomers (alpha-peptoids) and derivatives. Molecules. 15, 5282-5335 (2010).
- Tran, H., Gael, S. L., Connolly, M. D., Zuckermann, R. N. Solid-phase Submonomer Synthesis of Peptoid Polymers and their Self-Assembly into Highly-Ordered Nanosheets. J Vis Exp. , e3373(2011).
- Burkoth, T. S., Fafarman, A. T., Charych, D. H., Connolly, M. D., Zuckermann, R. N. Incorporation of unprotected heterocyclic side chains into peptoid oligomers via solid-phase submonomer synthesis. J. Am. Chem. Soc. 125, 8841-8845 (2003).
- Nakayama, G. R., Caton, M. C., Nova, M. P., Parandoosh, Z. Assessment of the Alamar Blue assay for cellular growth and viability in vitro. J Immunol Methods. 204, 205-208 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados