Method Article
Flujo Virometry para analizar antigénica Spectra de viriones y extracelular Vesículas
En este artículo
Resumen
Viruses or extracellular vesicles were immunocaptured with 15 nm magnetic nanoparticles coupled to antibodies recognizing surface antigens. The captured virions or vesicles were labeled with fluorescent antibodies against other surface antigens. The resultant complexes were separated in high magnetic field and analyzed with conventional flow cytometers triggered on fluorescence.
Resumen
Cells release small extracellular vesicles (EVs) into the surrounding media. Upon virus infection cells also release virions that have the same size of some of the EVs. Both virions and EVs carry proteins of the cells that generated them and are antigenically heterogeneous. In spite of their diversity, both viruses and EVs were characterized predominantly by bulk analysis. Here, we describe an original nanotechnology-based high throughput method that allows the characterization of antigens on individual small particles using regular flow cytometers. Viruses or extracellular vesicles were immunocaptured with 15 nm magnetic nanoparticles (MNPs) coupled to antibodies recognizing one of the surface antigens. The captured virions or vesicles were incubated with fluorescent antibodies against other surface antigens. The resultant complexes were separated on magnetic columns from unbound antibodies and analyzed with conventional flow cytometers triggered on fluorescence. This method has wide applications and can be used to characterize the antigenic composition of any viral- and non-viral small particles generated by cells in vivo and in vitro. Here, we provide examples of the usage of this method to evaluate the distribution of host cell markers on individual HIV-1 particles, to study the maturation of individual Dengue virions (DENV), and to investigate extracellular vesicles released into the bloodstream.
Introducción
Las células en los organismos multicelulares tienen muchas características individuales que pueden ser ya sea única para una célula particular o por lo menos pertenecen a grupos particulares de células. Incluso células clonadas cultivadas muestran características individuales como se evidencia por su morfología diversa. Además, la individualidad de una célula se refleja en los productos que se segrega. En el caso de la infección viral, partículas virales pueden llevar a las proteínas de las células que los producen. Por ejemplo, para el VIH muchas proteínas de la célula huésped se incrustan en la envoltura viral y virus que son generados por diferentes células pueden llevar estas proteínas características 1, 2 o "firmas de células".
Incluso sin la infección, las células liberan en el medio circundante pequeñas vesículas extracelulares (EVs). Biogénesis de estas vesículas y su estructura en muchos casos parece a la de los virus, especialmente retrovirus. En los últimos años se ha hecho evidenteque los vehículos eléctricos, los cuales fueron considerados inicialmente como "polvo de plaquetas" 3, constituyen un importante sistema fisiológico de la comunicación de célula a célula. Junto con otros dos sistemas de comunicación intercelular, es decir, las interacciones de contacto célula-célula y moléculas solubles liberados, los vehículos eléctricos coordinan la fisiología normal y se alteran en diversas patologías 4, 5 incluyendo infecciones virales 6, 7.
Aunque ambas partículas virales liberadas y vesículas extracelulares son muy diversos, que se caracterizan predominantemente por análisis de mayor en la que se pierden sus características individuales. Un método similar a la citometría de flujo, que fenotipos células en base a sus diferentes antígenos de superficie, es necesaria para caracterizar las partículas virales y similares a virus individuales. Desafortunadamente, los vehículos eléctricos o pequeños viriones no se pueden analizar utilizando cito flujo estándarmetría métodos porque son demasiado pequeños para generar la señal de dispersión de luz en la que la mayoría de los citómetros se basan para el disparo. Para evitar esta limitación, la fluorescencia de disparo se puede aplicar. Sin embargo, si los vehículos eléctricos o viriones se tiñen con anticuerpos fluorescentes es difícil para distinguirlos de los anticuerpos libres y sus agregados, debido a su fluorescencia similar y tamaños comparables.
Recientemente, hemos desarrollado un método de alto rendimiento basados en la nanotecnología que permite la caracterización de antígenos en pequeñas partículas individuales utilizando citómetros de flujo regular de 8, 9. Empleamos los micronutrientes en polvo a las partículas de inmunocaptura de interés, tal como ha sido descrito por otros grupos para diversas aplicaciones 10, 11, 12, 13; Sin embargo, nuestra nueva técnica permite la captura de especí individuoFIC objetivos seguidos por el fenotipo de estas partículas capturadas por citometría de flujo utilizando fluorescencia de disparo en lugar de dispersión de la luz, sin la interferencia de anticuerpos flotantes libres. Este método tiene amplias aplicaciones y se puede utilizar para caracterizar la composición antigénica de cualquier partícula pequeña viral- y no viral generada por las células in vivo e in vitro siempre que la disponibilidad de anticuerpos fluorescentes específicos contra los antígenos de superficie. Ya hemos aplicado esta técnica para estudiar varios problemas biológicos.
En particular, se evaluó la distribución de marcadores de células anfitrionas sobre el VIH-1 partículas individuales 9, se estudió la maduración del virus del dengue individuales (DENV) basados en el análisis de sus proteínas de superficie 14 y se investigaron los vehículos eléctricos liberadas en el torrente sanguíneo de voluntarios sanos y pacientes con síndrome coronario agudo (SCA). Aunque se basa en un principio similar, laaplicación de la nueva técnica requiere el desarrollo de protocolos específicos que se describen a continuación.
Protocolo
1. Acoplamiento de nanopartículas magnéticas (NPM)
- Utilice el procedimiento de ensamble comercial y reactivos para acoplar los micronutrientes en polvo con anticuerpos (Abs) (típicamente de 1 mg). Se usan nanopartículas de óxido de hierro con ácido carboxílico como grupos reactivos.
- Si los anticuerpos están en un mayor volumen de 0,5 ml, concentrar utilizando un concentrador de 100K. Girar a 2.000 xg durante 3-5 minutos.
- Al final del procedimiento, después de la adición de 10 l de la memoria intermedia de enfriamiento, transferir MNPs a un tubo de 12 mm x 75 mm y añadir tampón de almacenamiento / 3 ml de lavado. Se coloca el tubo en el orificio central de un separador magnético y dejar toda la noche a 4 ° C.
- Compruebe que MNPs tiene todos recogidos para el lado del tubo y, luego, con cuidado pipetear hacia fuera todo el líquido. Añadir 3 ml de tampón de lavado / almacenamiento fresco, y el lugar de nuevo en el imán.
- Después de varias horas, comprobar si los micronutrientes en polvo se recogen en el lado del tubo y luego pipeta el líquido. Utilizar 2 ml de tampón de lavado / almacenamientoresuspender el micronutrientes en polvo y almacenar a 4 ° C.
- Compruebe que el ABS se acoplan a los micronutrientes en polvo mediante su etiquetado con un fragmento de anticuerpo Fab fluorescente relevante (por ejemplo, cabra anti-ratón si se utiliza un anticuerpo monoclonal de ratón Ab para la captura como se describe en la sección 2) y se ejecutan en un citómetro de flujo.
2. El etiquetado anticuerpos acoplados a las NPM
- Combinar 60 l (3,9 x 10 12 partículas) de los micronutrientes en polvo (por condición) y 5 l (de una solución comercial / ml 200 mg) marcado con fragmentos Fab, específicos para el isotipo del Ab de captura en un tubo de microcentrífuga de 1,5 ml.
- Se incuba a temperatura ambiente (RT) durante 30 min con mezcla continua.
- Pre-humedecer un concentrador de 100K con 300 l de solución salina tamponada con fosfato (PBS) y el giro en una microcentrífuga a 1.500 xg durante 5 min.
- Purificar complejos marcados en 100K columna. Girar la mezcla de la etapa 2.2 en una microcentrífuga a 1.500 xg durante 5 min, se lava con 200 l de PBS, y recuperar en elvolumen inicial.
3. El uso de Etiquetada Ab-MNP Complejos para capturar las partículas de interés (virus o vehículos eléctricos)
- Se incuba previamente etiquetado micronutrientes en polvo 60 l (3,9 x 10 12 partículas) con el VIH (60 l) o la preparación VE (100 l).
- EV elaborar preparados usando varios métodos. Aquí, purificar vehículos eléctricos en gradientes de sacarosa, recogerlos a partir de plasma pobre en plaquetas utilizando reactivos de precipitación exosome o aislar directamente a partir de plasma 8.
NOTA: Las relaciones óptimas deben ser determinados para cada experimento y dependen de la concentración de virus / EV en la preparación. Fracción MNP-Ab debe ser ~ 10 6 en exceso en comparación con la concentración de la fracción de virus / EV.
- EV elaborar preparados usando varios métodos. Aquí, purificar vehículos eléctricos en gradientes de sacarosa, recogerlos a partir de plasma pobre en plaquetas utilizando reactivos de precipitación exosome o aislar directamente a partir de plasma 8.
- Incubar 40 minutos a 37 ° C con una mezcla suave en busca de virus, o 1 hora a 4 ° C para los vehículos eléctricos.
- Añadir 2,5% IgG de ratón / IgG humana para bloquear la unión de Fc, suavemente vórtice, incubar 3-5 minutos a temperatura ambiente.
- Añadir concentraciones recomendadas por el fabricante o tituladas de cada Abs detección e incubar adicional de 20 minutos a temperatura ambiente.
4. La separación de los viriones capturados-MNP (o EV) de anticuerpos no unidos Uso de las columnas magnéticas
- Preparar la columna de separación magnética para el uso mediante la colocación en un imán separador.
- Pre-humedecer la columna con 500 l de tampón de lavado (ácido etilendiaminotetraacético 2 mM (EDTA), 0,5% de albúmina de suero bovino (BSA) en PBS). Deje que el tampón de lavado fluya a través de la columna.
- Añadir los complejos MNP-virus / MNP-EV a la columna y dejar que todo el líquido fluya a través. Añadir 500 l de tampón de lavado a la columna, permitiendo que todo el volumen pase a través.
- Repetir el lavado con tampón de lavado 2 veces más.
- Retirar la columna del imán y lugar en 12 mm x mm tubo 75 para la recogida de los complejos MNP-virus / MNP-EV retenidas. Deje reposar la columna en el tubo fuera del imán durante 3 min. Añadir 200 l de PBS y dejarlas perlas fluyen hacia abajo por la gravedad, añadir otros 200 l de PBS y se fijan con 200 l de paraformaldehído al 4% después de la elución.
NOTA: El paraformaldehido es un posible carcinógeno y debe ser manejado en una campana ventilada y los guantes deben ser usados. - Para cuantificar viriones individuales / EVs utilizan la configuración de volumétricos en High Throughput Sampler (HTS) o justo antes de la adquisición añadir flujo bien mezclada citometría de perlas de recuento.
5. Análisis de los virus capturados-NPM / EV con un citómetro de flujo
- Calentar citómetro de flujo durante 30 minutos.
- Ejecutar bolas de control de calidad.
- Establecer el umbral de fluorescencia de cualquiera de los micronutrientes en polvo o etiquetados virus / EV. Utilice 0,22 micras filtrada PBS durante umbral para disminuir el fondo "ruido". Establecer el umbral mediante el ajuste de la tensión PMT en el nivel donde se filtra PBS no da, o muy pocos, eventos.
- Las muestras se ejecutan en baja. (Use un filtro de 0,04 micras en línea adicional para el fluido de revestimiento colocado en serie detrás de lafiltro estándar vaina de 0,2 micras para eliminar los falsos eventos más).
6. Evaluación de la eficiencia de la captura
- Capturar los vehículos eléctricos marcados con fluorescencia o con VIH MNP-Abs como se describe en el punto 3.1, 3.2. (Vehículos eléctricos pueden ser etiquetados, ya sea con un colorante de membrana o por medio de su carga 15; El VIH puede ser etiquetado, ya sea a través de tinte gen codificado 16, o con un colorante de la membrana 12, 17).
- Preparar la columna de separación magnética como se describe en (4.1 a 4.2).
- Añadir los complejos MNP-virus / MNP-EV a la columna y permite que todo el líquido fluya a través de (fluir a través de la fracción). Recoger el flujo a través de la fracción en el tubo.
- Proceder con la fracción retenida en la columna como se describe en (4,4-4,5).
- Repita el procedimiento de captura en el flujo a través de la fracción de 6,3 con posterior separación (4.1-4.5).
- Analizar las fracciones retenidas de primera capture y segunda captura mediante su ejecución en el citómetro de que se encuentra en el disparo sobre marcaje fluorescente de los vehículos eléctricos o el VIH. Para evaluar la eficiencia, compare el número de eventos en ambas fracciones.
7. Adaptación del Protocolo de aplicaciones especiales
NOTA: Mientras que el protocolo se puede aplicar a análisis de VIH y los vehículos eléctricos como se describe anteriormente, para el análisis de DENV las siguientes modificaciones deben introducirse:
- Incubar viriones con 1 M DiI en la oscuridad durante 30 min a TA. Después de la incubación purificar virus manchado por centrifugación en un medio de gradiente de densidad (10%, 20%, 25% y 35%) a 240.000 xg durante 1.5 horas a 4 ° C sin freno. Recoger la fracción de entre 20% y 25% de gradiente de densidad capas medianas 14.
- Incubar marcadas con Dil DENV 1 x 10 7 (60 l) con el fabricante recomienda o se titularon concentraciones de detección de Ab en presencia de 2,5% de IgG de ratón durante 20 min a RT.
- Incubcomió mezcla con pre-etiquetados de 60 l (3,9 x 10 12 partículas) complejos Ab-MNP captura durante 40 minutos a 37 ° C con una mezcla suave.
- complejos resultantes separadas de Abs sin unir en las columnas magnéticas como se describió anteriormente y analizar el citómetro de flujo.
Resultados
captura selectiva de los antígenos celulares por el VIH-1 viriones
Con "virometry flujo" Ahora es posible visualizar antígenos celulares en partículas virales individuales. A modo de ejemplo, nos hemos centrado en dos antígenos celulares realizadas por el VIH-1, LFA-1 y HLA-DR. Anteriormente se identificaron estos dos antígenos de VIH-1 las preparaciones analizadas en mayor 1. Preparamos MNPs acopla con uno de los anticuerpos contra la proteína Env del VIH, VRC01, y capturado con estas MNPs VIH-1 viriones (VIH-1 o VIH-LAI.04 1 SF162 producidas en células mononucleares de sangre periférica (PBMCs)). Además, estos viriones teñidas con 2G12, otro anticuerpo anti-Env. virometry flujo mostró una alta heterogeneidad del VIH-1 viriones en cuanto a la presencia de LFA-1 y HLA-DR. En promedio 16,7 ± 2,0% (n = 6) y 8,6 ± 0,3% (n = 3) del VIH-1 LAI.04 viriones llevadas a LFA-1 y HLA-DR,respectivamente. Sólo 4,8 ± 0,6% (n = 3) de todos los viriones fueron positivos para ambos antígenos. Por otra VIH-1 cepa, el VIH-1 SF162, estos antígenos estaban presentes en 20,0 ± 4,4% (n = 6) y 10,8 ± 1,3% (n = 6) de los viriones, respectivamente, mientras que ambos antígenos se realizaron por 6,5 ± 0,4% (Figura 1).
La distribución de las proteínas celulares era dependiente de las células que replican el virus. células Jurkat viriones antigénicamente diferentes de los producidos por PBMCs infectados producidos infectados por el VIH. Los viriones de VIH-1 LAI 0,4 producida por las células Jurkat llevaron a 1,6 ± 1,4% (n = 3) y 1,6 ± 0,7% (n = 4) LFA-1 y HLA-DR, respectivamente. Para el VIH-1 SF162 viriones producidos en células Jurkat, estos parámetros fueron 7,2 ± 2,5% (n = 3) y 5,6 ± 2,7% de (n = 4). Por lo tanto, el maquillaje antigénico (al menos para HLA-DR y LFA-1) fue diferente para el VIH-1 LAI.04 producido por dos células diferentestipos (p <0,02).
Flujo virometry como se aplica a la evaluación de virus Dengue
maduración DENV se asocia con la expresión de la proteína prM en los viriones. Aplicamos virometry flujo para evaluar qué fracción de DENV producida en células BHK-1 y en las células LoVo constituya virus maduros. Los viriones se tiñeron con un tinte lipídica Dil. Análisis de los viriones capturados individuales reveló prM en 48,2 ± 5,3% (n = 8) de DENVs. En contraste, 84,5 ± 3,4% (n = 4) de DENV producida en células LoVo realizadas prM. El resto de los viriones, respectivamente 51,8 ± 5,3% (n = 8) y 15,5 ± 3,4% (n = 4) fueron negativos prM (Figura 2). Por lo tanto, virometry de flujo puede utilizarse para distinguir DENV individuo completamente maduro de inmaduros (o parcialmente maduras) viriones DENV.
vesículas extracelulares liberados en el torrente sanguíneo de la saludvoluntarios y pacientes con síndrome coronario agudo (SCA)
Con el fin de investigar diferentes subconjuntos EV en pacientes con SCA y controles sanos, hemos capturado vehículos eléctricos de plasma pobre en plaquetas (PPP) por fluorescentes NPM-junto con anticuerpos contra CD31, CD41a, CD63 o. EVs capturados por CD31-NPM se tiñeron para CD41a y CD63, CD41a vehículos eléctricos captadas por las NPM-fueron teñidos para CD31 y CD63, y los vehículos eléctricos capturados por CD63-NPM fueron teñidos para CD31 y CD41a (Figura 3).
La cantidad de EVs capturado por CD31-MNPs y positiva para uno o dos de los anticuerpos de detección en pacientes con SCA era 3359 [2328; 5.472] EV / l en comparación con 1.272 [714; 2.157] EV / l en voluntarios sanos (p = 0,001). La cantidad total de vehículos eléctricos capturado por CD63 en pacientes con SCA en comparación con voluntarios sanos fue de 3,541 [1,318; 5.173] EV / l frente a 806 [488; 2.112] EV / l (p = 0,007). Había 4752 [3238; 7.173] EV / l en el plasma de los pacientes con SCA-CD41a capturados por los micronutrientes en polvo, mientras que en el plasma de voluntarios sanos este número fue significativamente menor, 2.623 [1.927; 4.188] EV / l (p = 0,015). En general, nuestros resultados indican que, mientras que las cantidades EV se incrementaron sobre todo en pacientes con SCA, la magnitud del aumento fue diferente en las distintas subpoblaciones de vehículos eléctricos.
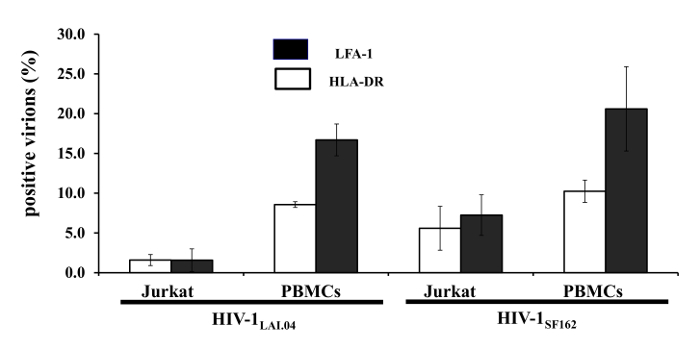
Figura 1: incorporación selectiva de antígenos celulares en el VIH-1 viriones de replicación en diferentes tipos de células. VIH (VIH-1 o VIH-LAI.04 1 SF162) viriones liberados por PBMCs o células Jurkat fueron capturadas con VRC01-MNPs y se tiñeron con segundo anticuerpo anti-gp120 2G12 y con anticuerpos específicos contra HLA-DR y LFA-1. Las preparaciones teñidas se sometieron a análisis de flujo para HLA-DR (barras blancas) y LFA-1 (ba negrors). Medias ± SEM de tres a seis experimentos 9. Haga clic aquí para ver una versión más grande de esta figura.
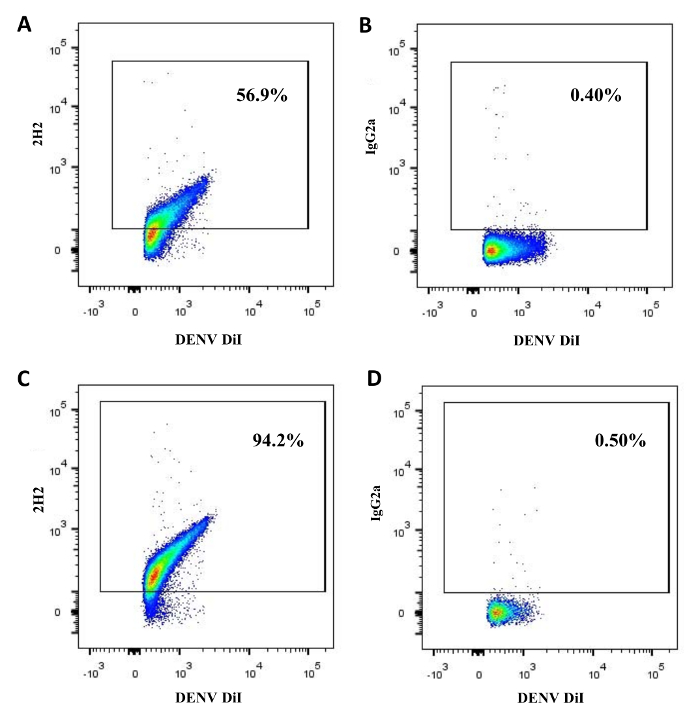
Figura 2: estado de maduración de los viriones DENV. DENV producido en células BHK-21 (A, B) o en células LoVo (C, D) se marcaron con el colorante lipídica DiI y, después de la ultracentrifugación en un medio de gradiente de densidad, se tiñeron para la proteína prM con 2H2 anticuerpos (A, C) o con control de isotipo IgG2a (B, D). Los viriones marcados fueron luego capturados con 3H5-1-MNPs y se sometieron a análisis 14 de flujo. Haga clic aquí para ver una versión más grande de estafigura.
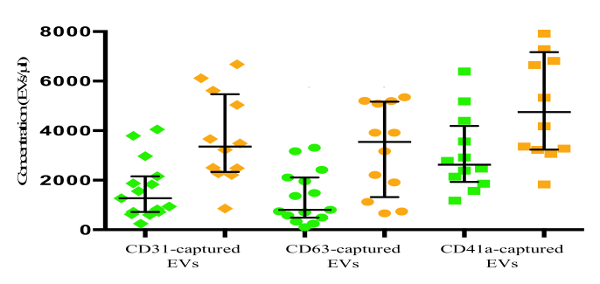
Figura 3: Análisis de los vehículos eléctricos de los pacientes con SCA y controles sanos. EVs en plasma fueron capturadas con CD31-NPM, CD63-NPM-CD41a o micronutrientes en polvo y se tiñeron con anticuerpos contra CD41a y CD63, CD31 y CD41a contra y en contra CD31 y CD63, respectivamente. EVs capturado, teñidas con al menos uno de los Abs detección, se visualizaron y se enumeran en el análisis de flujo. Los datos presentados como gráfico de puntos con la mediana y el rango intercuartílico (RIC). símbolos verdes: voluntarios sanos (controles), símbolos de color marrón: los pacientes con SCA. Haga clic aquí para ver una versión más grande de esta figura.
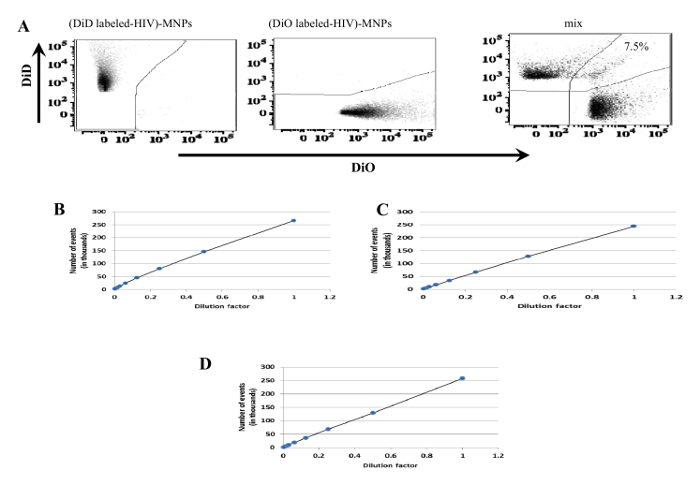
Figura 4: Evaluatien de la fracción de eventos de flujo que representan los viriones individuales. (A) VIH-1. Suspensión de viriones se dividió en dos partes y se tiñó con cualquiera DiD (panel izquierdo) o DiO (panel central). Después de mezclar, la suspensión, que contenía dos viriones diferencialmente manchadas, fue capturado con VRC01-MNPs y se sometió a fluir virometry (panel derecho). Agregados (eventos de dos colores) constituían menos del 10% del total de eventos. (B - D) DENV. La suspensión de viriones teñidas con DiI se diluyó en serie dos veces de 1: 2 a 1: 256 y adquirió con HTS en un citómetro de flujo (B). Dil-DENVs se marcaron con anticuerpos 2H2 (C) o con Dil-DENVs fueron capturados con 3H5-1-NPM (D). Las preparaciones C y D se diluyeron a continuación en serie dos veces de 1: 2 a 1: 256 y adquieren con HTS 14. no parecen viriones a agregarse ya que en todos los casos hayes una correlación lineal entre el factor de dilución y el número de los eventos. Haga clic aquí para ver una versión más grande de esta figura.
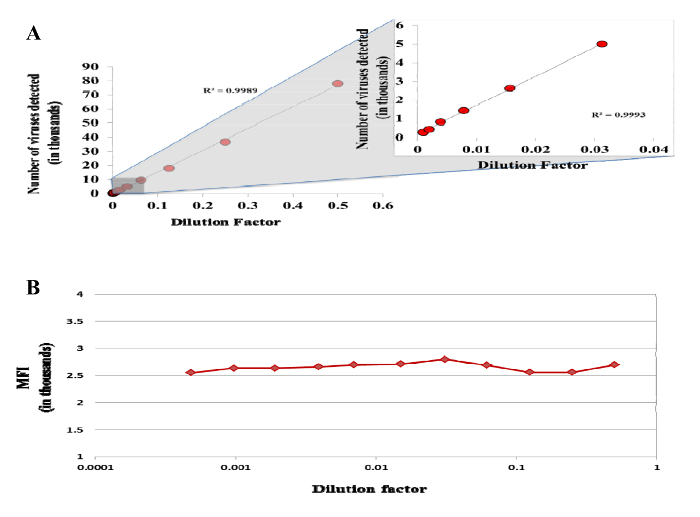
Figura 5: Detección de partículas individuales por citómetro de flujo. suspensión DENV teñido con DiI se diluyó en serie dos veces de 1: 2 a 1: 2048 y adquirió usando un HTS en un citómetro de flujo. (A) Número de virus detectados como una función del factor de dilución. (B) la intensidad media de fluorescencia (MFI) de 14 marcadas con Dil DENV. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Evaluación de la fracción de viriones y vesículas extracelulares capturadas con MNPs acoplados a anticuerpos específicos. Etiquetados VIH-1 viriones o vehículos eléctricos fueron capturadas con micronutrientes en polvo acoplados a anticuerpos específicos y sometidas a fluir virometry. Después de la separación en columnas magnéticas, el flujo a través (no retenido) fracciones se analizaron para determinar la presencia de viriones o vehículos eléctricos de interés que se perdieron en la primera carrera. (A) marcado viriones de VIH-1 BaL fueron capturadas con 2G12-MNPs (panel izquierdo). La fracción de flujo a través fue capturado y sometido a fluir virometry (panel derecho). En el primer ciclo se capturaron alrededor de 95% de los viriones de interés. (B) los vehículos eléctricos marcadas se capturaron con anti-CD81 y micronutrientes en polvo aislados en columnas magnéticas (panel izquierdo). La fracción de flujo a través fue re-capturada y analizada (panel derecho). En el primerociclo de aproximadamente el 99% de las vesículas de interés fueron capturados 8. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Citómetros de flujo convencionales siguen siendo la principal herramienta para el análisis de las células en función de sus características físicas y químicas a nivel individual 18. Los principios básicos de la citometría de flujo no se han modificado desde su desarrollo: una célula que pasa a través del haz de láser y dispersa la luz constituye un evento que desencadena la grabación de los espectros de fluorescencia emitida por anticuerpos fluorescentes unidos a las células. Las partículas más pequeñas por debajo de 300 nm no pueden ser detectados por la dispersión lateral de un citómetro ya que dispersan más luz bajo ángulos mayores a la que más citómetro de flujo no recoger la luz 18. La técnica descrita aquí, permite la identificación y el análisis de múltiples antígenos en numerosas virus o vehículos eléctricos individuales por los citómetros de flujo convencionales con fluorescencia de disparo.
Los pasos críticos en el protocolo son el acoplamiento de anticuerpos a MNPs. Nuestros experimentos se PERFORmed utilizando 15 nanopartículas de óxido de hierro nm con ácido carboxílico como un grupo reactivo como se describe anteriormente 9. Según el fabricante, cada 15 nm MNP se puede unir un máximo de 20 anticuerpos; ligamos aproximadamente el 10 por anticuerpos 15 nm MNP. Esta estimación se basa en la cantidad de anticuerpos antes y después del acoplamiento y el número de cuentas / ml, según lo determinado por la caracterización de nanopartículas y la instrumentación de encolado. En principio, el acoplamiento puede causar la agregación de partículas y no es deseable. Para comprobar que la agregación no está sucediendo con nuestro protocolo, se verificó esto con la caracterización de nanopartículas y la instrumentación de tamaño. Este instrumento mide el diámetro hidrodinámico de las partículas, que incluye las capas de revestimiento y de anticuerpos en lugar de sólo el núcleo 15 nm. Se encontró que la mayoría de perlas acopladas se encuentran en un único pico (media de pico a 64,7 ± 4,2 nm con 90% de todos los eventos siguientes 73 ± 7,3 nm). La mezcla de Ab-MNP complexes con viriones o los vehículos eléctricos en la proporción adecuada es importante para que los micronutrientes en polvo se encuentran en la concentración de varios pedidos superiores a EVs / viriones. Esto es fundamental para garantizar que los vehículos eléctricos individuales / viriones se analizan. Evitar coincidencias de los eventos mediante la ejecución de citómetro de flujo a baja. Asegurar para activar la adquisición de fluorescencia y el uso de controles volumétricos para medir la concentración de las entidades capturadas.
Sin embargo, MNPs puede agregar vehículos eléctricos o viriones por reticulación o por la unión de dos o más viriones a la misma nanopartícula. Para comprobar esto, una prueba para la agregación tal como se describe en la Figura 4 tiene que ser realizada. viriones o EVs Incluso capturados individualmente pueden entrar al mismo tiempo el haz de láser del citómetro de flujo. Esto crearía falsa positividad para dos antígenos diferentes. Para evitar esto, el citómetro de flujo debe establecerse como se describe y las preparaciones se debe diluir. Uno puede comprobar si la coincidencia está ocurriendo mediante el uso de la mismaestrategia que se describe en el punto anterior. Además, la falta de coincidencia podría ser verificado mediante el análisis de diluciones en serie de la preparación y que demuestra que el número de eventos disminuye linealmente con la dilución, mientras que la intensidad de fluorescencia media de un antígeno de fluorescencia de colores se mantiene constante en todas las diluciones (Figura 5). Otro problema es que muy pocos virus / vehículos eléctricos pueden ser capturados. Esto puede ser debido a la verdadera escasez de virus / vehículos eléctricos que transportan antígenos a través del cual son capturados por específico MNPs. Alternativamente, la eficacia de la captura es baja, debido a diversas razones (por ejemplo, acoplamiento ineficiente de los anticuerpos frente a MNPs, la desviación de las relaciones de MNPs a viriones / EVs desarrollados para este protocolo, etc.). Para evitar esta última posibilidad, la eficiencia de captura debe ser evaluado específicamente. Por lo general, la eficiencia debe ser aproximadamente el 90% como en la figura 6.
Diferentes anticuerpos pueden interferir debido aimpedimento estérico entre sí o con los anticuerpos acoplados a MNPs. Para comprobar que esto no ocurrió un protocolo de captura inversa debe ser probado (como se describe en la Sección 7. Brevemente, los viriones o los vehículos eléctricos deben ser primero teñidas con Abs detección fluorescente y luego capturado por los complejos Ab-MNP con posterior separación del ABS libre flotantes en columnas magnéticas.
virometry Flow tiene ventajas significativas con respecto a los métodos existentes de análisis de la composición antigénica de los viriones o los vehículos eléctricos. métodos bioquímicos de rutina informan de la presencia general de proteínas particulares en las preparaciones, pero no proporcionan información sobre la heterogeneidad de los viriones o los vehículos eléctricos. Esto incluye inmunocaptura de viriones o vehículos eléctricos en las partículas grandes disponibles en el mercado. Tales partículas son típicamente de varias micras de diámetro y cada uno de ellos pueden capturar cientos o miles de viriones o los vehículos eléctricos. Por lo tanto, ninguna de las medias de análisis posteriores las propiedades de los viriones / EVcapturado por una partícula. Por el contrario, virometry flujo utiliza MNPs de 10 a 15 nm de diámetro y con el protocolo descrito al menos 90% de los eventos representan un único virión o solo EV.
La principal limitación es que toda la población de viriones o los vehículos eléctricos en la preparación no puede ser analizado, pero sólo aquellos que son capturados. Por lo tanto, la elección del antígeno a través del cual se capturan los viriones o los vehículos eléctricos se vuelve crítica. También, a diferencia de flujo de citometría el número de diferentes antígenos (el número de anticuerpos fluorescentes contra diferentes antígenos) está limitada por la pequeña superficie de los viriones o los vehículos eléctricos. Por último, los diferentes anticuerpos pueden interferir estéricamente entre sí de nuevo debido a la pequeña superficie (en comparación con las células).
El protocolo actual puede ser adaptado para el análisis de cualquier virus o EV de cualquier origen, siempre que los anticuerpos específicos a través de la que pueden ser capturados están disponibles. El análisis de los antígenos de permiso de viriones individuos investigadores abordar la patogénesis de diferentes fracciones de las poblaciones virales. Por otra parte, la identificación de los vehículos eléctricos individuales en el plasma puede hacer que sea posible rastrear el origen de los vehículos eléctricos a las células y de informarles sobre las condiciones normales o patológicas de estas células y los órganos en los que residen.
Divulgaciones
The authors declare no conflict of interest.
Agradecimientos
This work of AA, SZ, WF, J-C.G, and LM was supported by the NICHD Intramural Program. The work of MV was supported by the Russian Federation Government grant #14.B25.31.0016.
Materiales
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Carboxyl Magnetic Iron Oxide Nanoparticles Conjugation Kits | Ocean Nanotech | ICK-15-005 | |
| Amicon Ultra-4 Centrifugal Filter Unit with Ultracel-100 membrane | Millipore | UFC810024 | |
| 5 ml Round Bottom PP Test Tube, without Cap | Falcon | 352002 | |
| DEPC treated water | Quality Biological | 351-068-131 | |
| SuperMAG-01 magnetic separator | Ocean Nanotech | SuperMAG-01 | |
| Zenon R-Phycoerythrin Mouse IgG1 Labeling Kit | Thermo Fisher Scientific | Z25055 | |
| Nanosep Centrifugal Devices with Omega Membrane 100k | Pall Corp | OD100C34 | |
| EDTA 0.5 M | Corning Cellgro | 46-034-CI | |
| Bovine Serum Albumin solution | Sigma-Aldrich | A9576-50ML | |
| PBS | Gibco | 10010-23 | |
| Paraformaldehyde, EM Grade, Purified | EMS | 15710 | |
| 123 count eBeads | eBioscience | 01-1234-42 | |
| CytoCount beads | Dako | S2366 | |
| AccuCheck count beads | Invitrogen | PCB100 | |
| Cytometer Setup & Tracking Beads Kit (CST) | BD Bioscience | 642412 | |
| Vybrant DiI Cell-Labeling Solution | Thermo Fisher Scientific | V22885 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| µMACS column | Miltenyi Biotec | 130-042-701 | |
| OctoMACS Separator magnet | Miltenyi Biotec | 130-042-108 | |
| Nanodrop | ThermoFisher | none | |
| NanoSight NS300 | Malvern | none | |
| BD LSRII flow cytometer | BD Bioscience | none | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Flowjo software | Flowjo | ||
| BD FACSDiva software | BD |
Referencias
- Tremblay, M. J., Fortin, J. F., Cantin, R. The acquisition of host-encoded proteins by nascent HIV-1. Immunol Today. 19 (8), 346-351 (1998).
- Santos, S., Obukhov, Y., Nekhai, S., Bukrinsky, M., Iordanskiy, S. Virus-producing cells determine the host protein profiles of HIV-1 virion cores. Retrovirology. 9, 65(2012).
- Wolf, P. The nature and significance of platelet products in human plasma. Br J Haematol. 13 (3), 269-288 (1967).
- Piccin, A., Murphy, W. G., Smith, O. P. Circulating microparticles: pathophysiology and clinical implications. Blood Rev. 21 (3), 157-171 (2007).
- Bernal-Mizrachi, L., et al. High levels of circulating endothelial microparticles in patients with acute coronary syndromes. Am Heart J. 145 (6), 962-970 (2003).
- Rozmyslowicz, T., et al. Platelet- and megakaryocyte-derived microparticles transfer CXCR4 receptor to CXCR4-null cells and make them susceptible to infection by X4-HIV. Aids. 17 (1), 33-42 (2003).
- Bhattarai, N., et al. GB virus C particles inhibit T cell activation via envelope E2 protein-mediated inhibition of TCR signaling. J Immunol. 190 (12), 6351-6359 (2013).
- Arakelyan, A., Ivanova, O., Vasilieva, E., Grivel, J. C., Margolis, L. Antigenic composition of single nano-sized extracellular blood vesicles. Nanomedicine. 11 (3), 489-498 (2015).
- Arakelyan, A., Fitzgerald, W., Margolis, L., Grivel, J. C. Nanoparticle-based flow virometry for the analysis of individual virions. J Clin Invest. 123 (9), 3716-3727 (2013).
- Yang, H., Liang, W., He, N., Deng, Y., Li, Z. Chemiluminescent labels released from long spacer arm-functionalized magnetic particles: a novel strategy for ultrasensitive and highly selective detection of pathogen infections. ACS Appl Mater Interfaces. 7 (1), 774-781 (2015).
- Tang, Y., et al. Highly sensitive and rapid detection of Pseudomonas aeruginosa based on magnetic enrichment and magnetic separation. Theranostics. 3 (2), 85-92 (2013).
- Borlido, L., Azevedo, A. M., Roque, A. C., Aires-Barros, M. R. Magnetic separations in biotechnology. Biotechnol Adv. 31 (8), 1374-1385 (2013).
- Xi, Z., et al. Selection of HBsAg-Specific DNA Aptamers Based on Carboxylated Magnetic Nanoparticles and Their Application in the Rapid and Simple Detection of Hepatitis B Virus Infection. ACS Appl Mater Interfaces. 7 (21), 11215-11223 (2015).
- Zicari, S., et al. Evaluation of the maturation of individual Dengue virions with flow virometry. Virology. 488, 20-27 (2016).
- Lai, C. P., et al. Visualization and tracking of tumour extracellular vesicle delivery and RNA translation using multiplexed reporters. Nat Commun. 6, 7029(2015).
- McDonald, D., et al. Visualization of the intracellular behavior of HIV in living cells. J Cell Biol. 159 (3), 441-452 (2002).
- Morcock, D. R., et al. Elimination of retroviral infectivity by N-ethylmaleimide with preservation of functional envelope glycoproteins. J Virol. 79 (3), 1533-1542 (2005).
- Shapiro, H. M. Practical Flow Cytometry. , John Wiley & Sons, Inc. 101-223 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados