Method Article
Preparación y cultivo de células precursoras miogénica / mioblastos primarios de músculo esquelético de los seres humanos adultos y envejecidos
En este artículo
Resumen
Este protocolo describe un método robusto, reproducible y simple de aislamiento y cultivo de células de mioblastos progenitoras del músculo esquelético de adultos y personas de edad avanzada. Los músculos que se usan aquí incluyen los músculos del pie y de la pierna. Este enfoque permite el aislamiento de una población enriquecida de mioblastos primarios para los estudios funcionales.
Resumen
homeostasis del músculo esquelético depende del crecimiento muscular (hipertrofia), la atrofia y la regeneración. Durante el envejecimiento y en varias enfermedades, se produce pérdida de masa muscular. La pérdida de masa muscular y la función está asociada con el tipo de fibra muscular atrofia, el tipo de fibra de conmutación, la regeneración del músculo defectuoso asociado con la disfunción de las células satélite, células madre de músculo, y otros procesos patofisiológicos. Estos cambios están asociados con los cambios en intracelular, así como nichos locales y sistémicos. Además de los modelos de roedores más comunes de envejecimiento muscular, existe la necesidad de estudiar la homeostasis y desgaste del músculo utilizando modelos humanos, los cuales, debido a las implicaciones éticas, consisten principalmente en cultivos in vitro. A pesar del amplio uso de células progenitoras humanas miogénica (PSM) y mioblastos primarios en la miogénesis, hay datos limitados sobre el uso de cultivos de mioblastos y miotubos primarios humanos para estudiar los mecanismos moleculares que regulan diferentes aspectos de mus asociada a la edademaciación CLE, ayudando en la validación de los mecanismos del envejecimiento propuesto en el músculo de roedores. El uso de PSM humanos, mioblastos primarios y miotubos aisladas de adultos y mayores de personas, proporciona un modelo fisiológicamente relevantes de los mecanismos moleculares de los procesos asociados con el crecimiento muscular, atrofia y la regeneración. A continuación se describe en detalle un protocolo robusta, de bajo costo, reproducible y eficiente para el aislamiento y mantenimiento de PSM humanos y su progenie - mioblastos y miotubos a partir de muestras de músculo humano utilizando digestión enzimática. Por otra parte, se ha determinado el número de pases en el que los mioblastos primarios de adultos y personas de edad se someten a la senescencia en un cultivo in vitro. Finalmente, se muestra la capacidad de transfectar estas mioblastos y la capacidad de caracterizar su capacidad de proliferación y diferenciación y proponer su idoneidad para la realización de estudios funcionales de los mecanismos moleculares de la miogénesis y desgaste muscular in vitro.
Introducción
la pérdida de las enfermedades ya relacionada con la edad progresiva de la masa y de la función músculo esquelético resulta en la fragilidad, la disminución de la fuerza y la disminución de la calidad de vida de las personas de edad avanzada. Representa el músculo esquelético de masa corporal aproximadamente el 40% 1. Durante el envejecimiento y la enfermedad, la atrofia progresiva de miofibras individuales y reducción de la calidad del músculo debido a la infiltración de la grasa y la fibrosis se produce 1, 2, 3, 4, 5, 6. Recientemente, se ha propuesto que las diferencias específicas de las especies en el envejecimiento del músculo esquelético se producen, en concreto que la pérdida de fibra muscular se produce en roedores, no se puede producir en los seres humanos 7. Sin embargo, las fibras musculares restantes de los mamíferos de edad se caracterizan por una mayor susceptibilidad a daños y deterioro de regeneración 8. La reparación del músculo adulto y mantenimiento está mediada por células satélite 9, 10. Tras la lesión muscular y otras señales pertinentes, las células satélite se activan y proliferan. Un subconjunto de las células vuelve al estado de reposo y el resto progresa en mioblastos (células progenitoras miogénica - PSM). Esto contribuye a la reparación de la miofibrilar existente 11. La funcionalidad de las células satélite determina el éxito de la regeneración muscular y los cambios en la disponibilidad de células satélite con el envejecimiento ha sido demostrada 12, 13, 14, 15. Por otra parte, las células satélite de músculo de los seres humanos de edad y roedores muestran un interruptor de perfil transcripcional y la reducción de potencial de regeneración 16, 17, 18, 19. Las células satélite de músculo de ratones viejos y los seres humanos también se ha demostrado que someterse a la senescencia que resulta en su funcionalidad reducida 20.
La línea celular más establecida que permite el estudio de la homeostasis del músculo es la línea celular murina C2C12 21. Una cantidad significativa de estudios también han utilizado mioblastos primarios murinos 22. Estos cultivos han llevado a una comprensión significativa de los procesos que ocurren durante la hipertrofia enfermedad muscular y envejecimiento 23, 24, 25, 26 murina y la miogénesis vertebrados así como la regeneración muscular, atrofia myotube / miofibras, y. Más recientemente, varios grupos han descrito el uso de mioblastos primarios humanos para estudiar la miogénesis y el envejecimiento muscular. Sin embargo, hay una falta de consenso con regards a diferencias entre los mioblastos primarios aislados del músculo de los seres humanos adultos y mayores de 27, 28, 29, 30, 31. A pesar de las diferencias que se caracterizan en el entorno local y sistémica que ocurren durante el desarrollo, el envejecimiento y la enfermedad de 6, 32, 33, 34, in vitro mioblastos y miotubos culturas siguen siendo las herramientas más accesibles para el estudio de los mecanismos moleculares asociados con el desarrollo muscular, el crecimiento y la atrofia. Además, estos estudios proporcionan no sólo un sólido, pero también una relativamente rápida, de bajo costo y de alto rendimiento en herramienta vitro. Por otra parte, las implicaciones éticas asociadas con los estudios de los músculos humanos significan que para los experimentos funcionales que implican la manipulación de la expresión génica , In vitro mioblastos y miotubos culturas humanas siguen siendo la única alternativa disponible para los organismos modelo de vertebrados.
Aquí, se muestra un protocolo experimental simple para robusta, de bajo costo, y reproducible aislamiento de mioblastos primarios, o PSM, desde el músculo de adultos y personas de edad avanzada y describir las condiciones normalizadas de cultivo in vitro (Figura 1). Como cultivos primarios de fibroblastos muscular suelen contener, además de los mioblastos, se recomienda un paso preplating el objetivo de mejorar la pureza y la calidad de los mioblastos primarios. En resumen, hemos establecido un protocolo que permite el aislamiento eficiente y reproducible, la cultura y los estudios funcionales de PSM / mioblastos primarios enriquecidos y funcionales de músculo esquelético de los adultos y las personas de edad avanzada.
Protocolo
Toda la experimentación en el tejido humano descrito en este documento fue aprobado previamente por la Universidad de Liverpool, Hospital Aintree Hospital Universitario y Comité de Ética de Investigación región suroeste de Gales (Número de Registro: 13 / WA / 0374) y los experimentos se realizaron según orientación de buenas prácticas. La Universidad de Liverpool actuó como patrocinador de la ética para este estudio. Todos los donantes han dado su consentimiento informado para la inscripción de este estudio. Los músculos se aislaron de las personas (IMC <25): adultos: 30 ± 2,8 años y la edad: 69 ± 5 años.
1. Preparación para la Cultura
- El recubrimiento de las superficies con la cultura laminina
- Preparar una solución de trabajo de 10 mg / ml de laminina en 1X DPBS (fosfato de Dulbecco solución salina tamponada).
- Pipetear una cantidad mínima de solución de laminina para cubrir completamente la superficie sobre la que van a ser plateado (Tabla 1) las células. incubar tque la cultura plato de al menos 30 minutos en un humidificado 37 ° C, 5% de CO2 antes en placas de las células. Manejar laminina cuidadosamente, evitando el uso de vórtice. La solución de trabajo de 10 mg / ml de laminina diluido en DPBS se puede almacenar a 4 ° C y re-utilizar varias veces.
- Use un 60 mm (20 cm2) placa de Petri o 2 pocillos de una placa de 6 pocillos (2 x 10 cm 2) por ~ 18 - 19 mg de músculo esquelético a la placa de las células (5,50 x 10 4 células en total). Realizar el recuento de células en todo momento cuando placas células para estudios funcionales.
Nota: Las muestras se obtuvieron originalmente de cirugías del pie (extensor corto de los dedos, tibial anterior o los músculos abductores halluces) de las pacientes (adultos: 30 ± 2,8 años, edad: 69 ± 5 años de edad, IMC <25).
- Preparación de la solución enzimática
- Preparar CaCl mM de solución de trabajo 250 2: 277 mg de Stock CaCl2 en 10 ml 1x DPBS. Se filtra la tanlución con una membrana de filtro de 0,2 micras y se almacena a 4 ° C.
- Preparar una solución de trabajo de 1,5 U / ml de colagenasa D, 2,4 U / ml de dispasa II y CaCl 2,5 mM 2 en DMEM libre de suero (de Eagle Modificado de Dulbecco Medium) (Tabla 2).
- Mezclar bien y filtrar la solución enzimática a través de una membrana de 0,2 micras filtro para la esterilización. Preparar la solución enzimática con antelación y congelar abajo (-20 ° C) en alícuotas para su uso futuro.
2. La digestión del tejido: La disociación mecánica y enzimática
- Tras la recogida de muestras, mantener el músculo a 4 ° C en DPBS hasta que la digestión. Preparar un volumen mínimo de 2 ml de la colagenasa-dispasa-CaCl solución 2 por 18 - 19 mg de tejido muscular y se caliente a 37 ° C antes de la disociación del tejido.
- Sumergir la biopsia muscular brevemente en 70% de etanol, se lava con DPBS frescas y colocar el tejido en una nueva placa de Petri con 1 ml de enzimáticasolución.
- Desechar todo el tejido fibrótico y grasa como sea posible y desgarrar el músculo rápidamente pero con cuidado en trozos pequeños, pero distinguibles (aproximadamente> 0,5 mm 2) con unas tijeras estériles o un bisturí quirúrgico (hoja nº 10).
- Transferir la muestra en un tubo de 50 ml con 1 ml restantes de la colagenasa-dispasa-CaCl 2.
- Incubar el tejido en 37 ° C hasta 30 - 40 min. Mover el tejido muscular agitando suavemente el tubo cada 5 - 10 minutos a.
- Cubra las pipetas con medios para evitar la adherencia de las células liberadas a las paredes de plástico de las pipetas. Añadir 2 volúmenes de medio de crecimiento estéril, por ejemplo, 4 ml de DMEM 20% de FBS (suero bovino fetal), 1% de L-glutamina y 1% P / S (penicilina-estreptomicina), para detener la digestión.
- Pipetear arriba y abajo varias veces con una pipeta de 5 ml para ayudar a la liberación de las células de las fibras musculares.
NOTA: La muestra está completamente disociado por lo general debido a su pequeño tamaño. MARIDOin embargo, en caso de restos de músculo todavía permanecen, utilice una segunda incubación con el resto de piezas de músculo y con una solución enzimática fresca. - Filtrar la solución a través de un músculo filtro de células 70 micras sobre un tubo cónico de 50 mL. Se lavan las células restantes con más medios de comunicación y el filtro a través del filtro.
- Centrifugar a 443 xg durante 5 min a temperatura ambiente para sedimentar las células. Desechar el sobrenadante con cuidado.
- Disolver el precipitado en F-12 medios de comunicación (F-12 Nutrient Mix de Ham), 20% de FBS, 10% HS (suero de caballo), 1% P / S, 1% α-glutamina y 2,5 ng / ml de FGF-b ( recombinante humana de fibroblastos básico del factor de crecimiento). A continuación, use 4 ml de medio por 60 mm placa de Petri.
3. siembra de células
- Se recoge el recipiente de cultivo previamente recubierto con 10 mg / ml de laminina de la incubadora (sección 1.1).
- Retirar con cuidado el exceso de laminina de la placa de cultivo, y evite tocar la superficie (o podría interferir en la estructura de la proteína). lavarla placa de cultivo con DPBS (opcional).
- Placa de las células directamente en el recipiente recubierto de laminina y se incuba durante 24 h en un humidificado 37 ° C, 5% de CO 2 incubadora.
- Visualizar las células bajo el microscopio de campo brillante (ampliación total de 100X) al día siguiente. Ronda de células pequeñas unidas a la superficie y los restos restantes se pueden ver en los medios de cultivo.
- Cambiar los medios de comunicación a frescas F-12 medios complementados con 20% de FBS, 10% hs, 1% P / S, 1% α-glutamina y 2,5 ng / ml de FGF-b.
4. Cultura y pases de células
- Cambiar el soporte de cada 2 - 3 D y dividir las células tan pronto como grupos de células son visibles bajo el microscopio (aumento de 100X total, el ejemplo de la Figura 2, las células de las personas de edad, el paso 0, después de 7 d) con el fin de evitar espontánea diferenciación.
- En el primer paso (P1), cambiar el medio a DMEM de alta glucosa complementado con 20% de FBS, 10% hs, 1%P / S, 1% α-glutamina. Evitar el uso de FGF-b de este punto, como FGF es un potente mitógeno y factor importante en el comienzo de la cultura, pero que puede promover el crecimiento excesivo de los fibroblastos si se utiliza más tiempo en cultivo.
- Para los pases de células:
- Retire el medio y se lavan las células dos veces con DPBS.
- Añadir un volumen mínimo de 0,25% de EDTA-tripsina para cubrir la superficie de las células. Agite con cuidado para asegurar que todas las células están cubiertas por la solución de desprendimiento, se incuba durante 10 segundos a temperatura ambiente, y retirarla.
- Se incuban las células en un humidificado 37 ° C, 5% de CO2 durante 3 - 5 min. Golpee suavemente y se les presentarán bajo el microscopio de luz brillante (ampliación total de 100X) que las células se redondean, pero no separarse completamente de la superficie. Si no se observa cambio en las células, se incuba durante 5 min más.
- Añadir 5 ml de medio de crecimiento (DMEM de alta glucosa complementado con FBS al 20%, el 10% del SA, 1% P / S, 1% α-glutamina) para recoger las células, mezclarbien y transferir las células con los nuevos medios de comunicación en un matraz T75. Se lavan las células restantes se repiten este paso con otros 5 ml de medio de crecimiento (10 ml en total para un frasco T75).
- Para la presiembra (preferible en el primero paso), se incuban las células en un humidificado 37 ° C, 5% de CO 2 incubadora durante 40 min. Recoger el sobrenadante de las células que no se unen y se incuba en un nuevo matraz T75. Esto debe enriquecer la cultura en mioblastos, ya que la mayoría de los fibroblastos debería haber fijado en el primer matraz.
- Cambiar el soporte de cada 2 - 3 D y dividir las células 1 a 4, tan pronto como llegan a 70% de confluencia para un rendimiento máximo.
- Para la diferenciación, una vez que las células alcanzaron 70 a 80% de confluencia, cambiar el medio de cultivo a medio de diferenciación (DM): DMEM de alta glucosa complementado con 2% SA, 1% P / S, 1% α-glutamina. Las células deben diferenciarse dentro de 5-7 d dependiendo de la calidad y la pureza de la c mioblastosultura.
5. Las transfecciones Protocolo
- Seed 50.000 células / pocillo en una placa de 12 pocillos para los ensayos de MF 20, la senescencia y viabilidad. células de cultivos en cubreobjetos o en un plato cubierto con laminina. Para la tinción de Ki67, sembrar 25.000 células / pocillo en una placa de 12 pocillos.
- Para las transfecciones, siga el procedimiento del fabricante usando 5 l de reactivo de transfección, 100 nM de control de microRNA imitan o inhibidor, 100 nM de microRNA imitan o 100 nM de inhibidor microRNA por pocillo, con un volumen total de 1 ml.
- Cambio de medio de diferenciación 6 h después de la transfección (DMEM de alta glucosa complementado con un 2% del SA, 1% P / S, 1% α-glutamina). Para los experimentos de proliferación, teñir las células 2 días después de la transfección; para la senescencia, 7 días después de la transfección; y para la tinción de MF20, siete días después de la transfección.
6. La inmunotinción de las células
- Ki67, MyoD y MF 20 inmunotinción
- Preparar el bloque 1 (10% hs y 0,1% de Triton-X en PBS) y el bloque 2 (10% del SA y 0,05% de Triton-X en soluciones de PBS). Utilizar 500 l de reactivo por pocillo de una placa de 12 pocillos.
NOTA: Realice los siguientes pasos utilizando un agitador durante las etapas de incubación. - Retire el papel de las células.
- Enjuagar las células con PBS.
- Fijar las células con metanol frío durante 10 minutos en un agitador.
- Eliminar el metanol de las células y enjuagar 3 veces con PBS durante 5 min cada vez.
- Añadir bloque 1 solución y se incuban las células en un agitador a temperatura ambiente durante 1 h.
- Añadir solución de anticuerpo primario: para la tinción de Ki67, utilice mAb de conejo para Ki67 (dilución 1: 1000 en el bloque 2); para MyoD, utilice MyoD1 (D8G3) mAb XP conejo (1: 100 dilución en el bloque 2); para MF 20 tinción, el uso MYH1E (MF 20) anticuerpo primario (DSHB, dilución 1: 1.000 en el bloque 2).
- Se incuban las células con el anticuerpo primario durante 1 h (RT) a O / N (4 ° C) en un eje de balancín.
- Recoger el AB primario (que puede ser reutilizado varias veces si storojo a 4 ° C).
- Enjuagar las células 3 veces con PBS, 5 minutos cada vez.
- Añadir el anticuerpo secundario apropiado: para Ki67 o tinción MyoD, IgG de cabra anti-conejo (H + L) de anticuerpo secundario, Alexa Fluor 488 conjugado (dilución 1: 1000 en PBS); para MF 20 de la tinción, de cabra anti-IgG de ratón (H + L) de anticuerpo secundario, Alexa Fluor 488 conjugado (dilución 1: 1000 en PBS).
- Envolver la placa que contiene las células y se incuba el anticuerpo secundario durante 2 h en la oscuridad en un agitador a temperatura ambiente.
- Enjuagar las células 3 veces con PBS durante 5 minutos cada vez.
- Añadir solución de DAPI (dilución 1: 1000 en PBS) a las células y se incuba en el eje de balancín a temperatura ambiente durante 5 a 10 min.
- Enjuagar las células 3 veces con PBS durante 5 minutos cada vez.
- Añadir 1 ml de PBS fresco.
- Montar las células sobre los cubreobjetos en solución de montaje o sellar la placa que contiene las células en PBS con Parafilm para evitar la evaporación.
- Almacenar a 4 ° C.
- Visualizar las células conel microscopio de fluorescencia tan pronto como sea posible (no más de 2 semanas).
- Preparar el bloque 1 (10% hs y 0,1% de Triton-X en PBS) y el bloque 2 (10% del SA y 0,05% de Triton-X en soluciones de PBS). Utilizar 500 l de reactivo por pocillo de una placa de 12 pocillos.
- ensayo de viabilidad
- Retire el papel de las células.
- Enjuagar las células en PBS.
- Añadir 1: 1000 bromuro de etidio y 1: 1000 naranja de acridina diluido en PBS.
Precaución: Tenga cuidado y trabajar dentro de las regulaciones de salud y seguridad - bromuro de etidio es un agente cancerígeno. - Envolver la placa que contiene las células en solución de tinción y se incuba a RT en el eje de balancín de 5 min.
- Tomar imágenes de las células con el microscopio de fluorescencia: canal verde de naranja de acridina; canal rojo para el bromuro de etidio.
Resultados
PSM / mioblastos primarios deben ser visibles 24 h después de la siembra sobre la superficie recubiertas con laminina (Figura 2). Las células deben adoptar una forma de tipo huso y deben expresar MyoD todavía en el paso 4 (Figura 1A, B). Los fibroblastos se pueden distinguir por su morfología en forma de estrella y la falta de expresión de MyoD (Figura 1 B, C). Una vez que las células se unen al día siguiente, los medios de comunicación deben ser reemplazados por medios bFGF frescas. Los medios de cultivo deben ser reemplazados cada 48 h.
Los resultados representativos se muestran aquí y los datos publicados de nuestro objetivo de laboratorio 22 para soportar el protocolo de aislamiento y cultivo y demostrar las diferentes técnicas que se pueden utilizar para los estudios funcionales de mioblastos humanos primarios. la proliferación de mioblastos puede ser estudiada usando inmunotinción Ki67 y la viabilidad utilizando staining por ensayo de viabilidad celular (Figura 3). Para la diferenciación, los medios de cultivo se debe cambiar a los medios de diferenciación. Miotubos deben formar en de 5 - 7 d y ser miosina de cadena pesada positivo (Figura 3). Tenga en cuenta que la formación de miotubos puede ser menos eficiente cuando los mioblastos se aíslan del músculo de las personas de edad (Figura 3). La senescencia (SA-β-galactosidasa) tinción también se puede realizar con el fin de establecer el porcentaje de células senescentes en el cultivo (Figura 3). Hemos observado que con las culturas más largos (figura 3, paso 4), más mioblastos aislados del músculo de las personas de edad muestran la senescencia.
Para los estudios funcionales, la expresión génica y microRNA se puede manipular con la entrega mediada por los reactivos de transfección lipófila de vectores de expresión, siRNAs, imita y antimiRs microARN (Figura 4). Esto permite la 40 -70% de eficiencia de la transfección con los niveles de genes / microARN estar arriba o hacia abajo reguladas dentro de un rango fisiológico (Figura 4; 22).
| recipiente de cultivo | Aprox. Área (por pocillo) | Volumen de 10 mg / ml de laminina |
| placa de 35 mm | 10 cm 2 | 1 ml |
| placa de 60 mm | 20 cm 2 | 2 ml |
| plato de 100 mm | 60 cm 2 | 4 ml |
| placa de 24 pocillos | 2 cm 2 | 200 l / pocillo |
| placa de 12 pocillos | 4 cm 2 | 500 l / pocillo |
| placa de 6 pocillos | 10 cm 2 | 1 ml / pocillo |
| T25 | 25 cm 2 | 3 ml |
| T75 | 75 cm 2 | 5 ml |
Tabla 1. Recomendadas volúmenes mínimos de laminina-DPBS solución (10 mg / ml) para el recubrimiento de Cultura superficie.
| La actividad específica de masa / Molar | concentración final | Masa o volumen necesario para la solución de 10 ml | |
| colagenasa D | 0,15 U / mg | 10 mg / ml (1,5 U / ml) | 100 mg |
| dispasa II | 0,5 U / mg | 4,8 mg / ml (2,4 U / ml) | 48 mg |
| 250 mM CaCl 2 | 1100.98 g / mol | 2,5 mM | 100 l |
Tabla 2. Preparación de enzimas para la digestión del músculo.
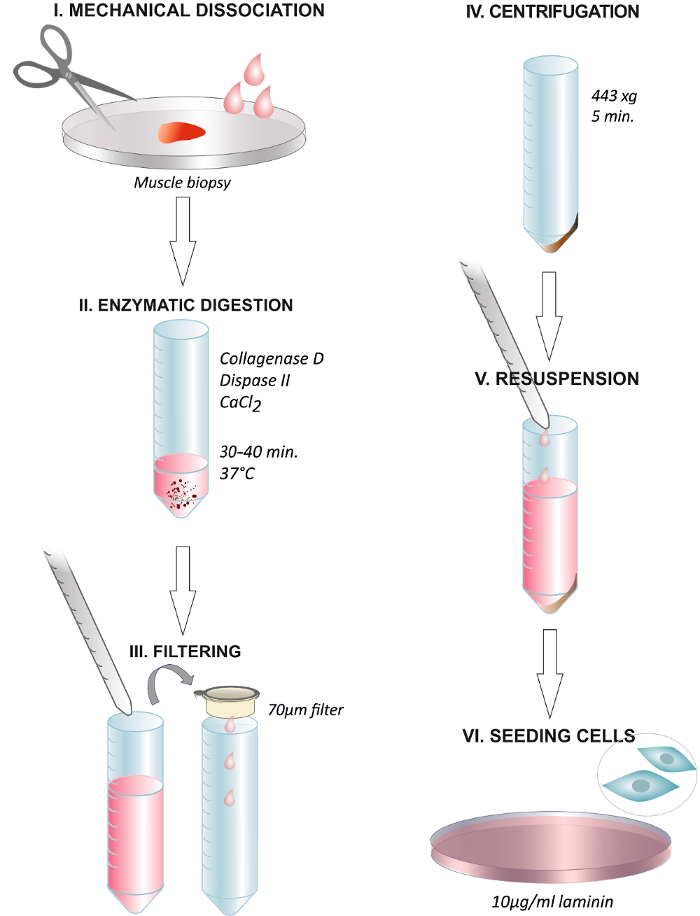
Figura 1. Resumen gráfico que resume las etapas del Protocolo. La disociación de la biopsia de músculo humano con unas tijeras o con un escalpelo quirúrgico (I). La incubación con la solución enzimática a 37 ° C durante 30 - 40 min (II). Fin de la digestión mediante la adición de medio de cultivo y filtrar la solución a través de un filtro de membrana de 70 micras en un tubo de centrífuga (III). La centrifugación a 443 xg durante 5 min (IV). Descartar el sobrenadante y resuspender en medio de crecimiento que contiene 2,5 ng / ml de FGF (V). En placas las células en un plato cubierto con 1081; g / ml de laminina y el cambio de los medios de comunicación después de 24 h (VI). Haga clic aquí para ver una versión más grande de esta figura.
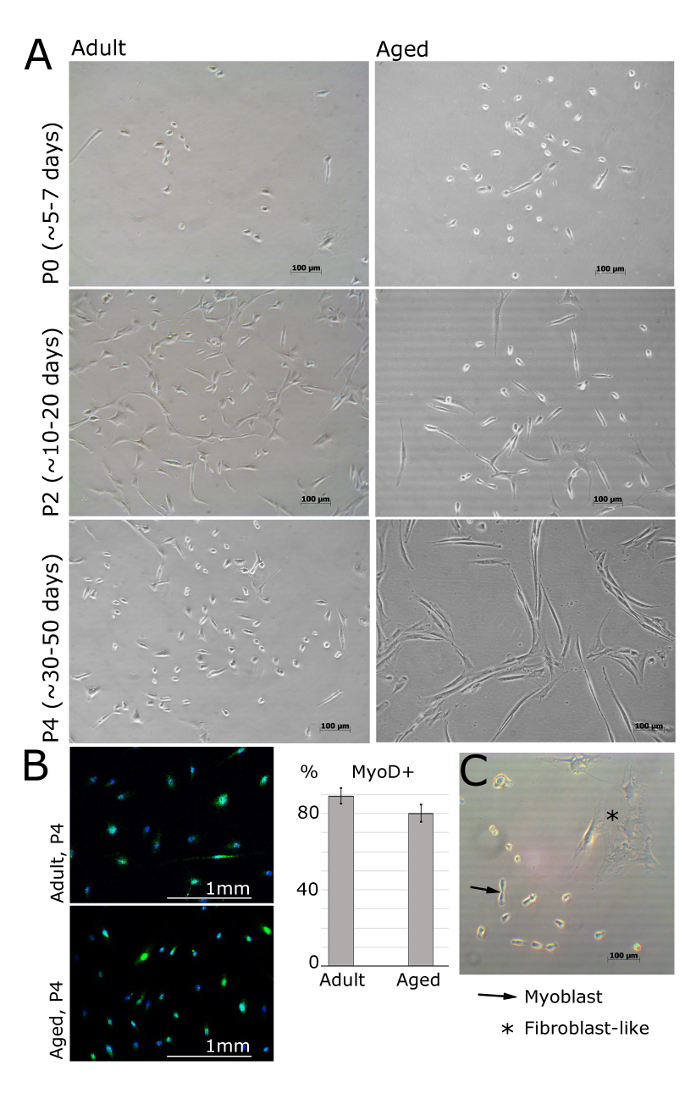
Figura 2. Los mioblastos de músculo aisladas de seres humanos adultos y envejecidos en diferentes pasajes. A. Imágenes representan mioblastos aislados de extensor corto de los dedos, tibial anterior o abductores halluces músculos de pacientes de sexo femenino (adulto: 30 ± 2,8 años, edad: 69 ± 5 años de edad, IMC <25). En el pase 0 y después de 5 días de haber sido plateado, las células siguen siendo redondo y pequeño, pero visibles bajo el microscopio de luz brillante (A). Los mioblastos entonces adoptar una forma alargada, como se muestra en el paso 2 (A). MyoD se expresa en mioblastos, pero no en fibroblastos (B). se muestra la cuantificación de las células MyoD-positiva; Las barras de error muestran la desviación estándar; n = 3 (B). Imagen representativa demostrar las diferencias entre los mioblastos y la morfología de fibroblastos (C). Haga clic aquí para ver una versión más grande de esta figura.
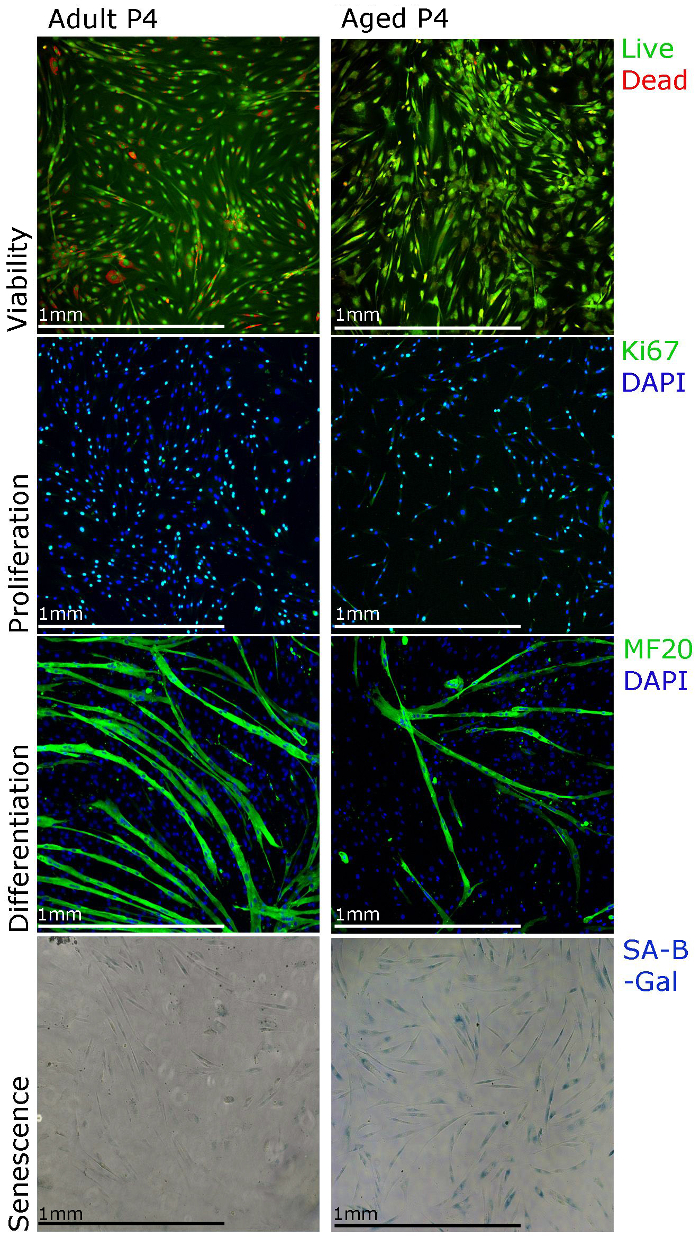
Figura 3. Los mioblastos humanos primarios se pueden caracterizar mediante diferentes técnicas de tinción. La viabilidad de las células puede visualizarse mediante la tinción para los ensayos de viabilidad celular, la proliferación se puede evaluar usando Ki67 inmunotinción, la diferenciación se puede evaluar usando MF20 (cadena pesada de la miosina) inmunotinción y la senescencia se pueden visualizar utilizando la senescencia asociado galactosidasa beta (SA-β-galactosidasa ) tinción. ecsource.jove.com/files/ftp_upload/55047/55047fig3large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
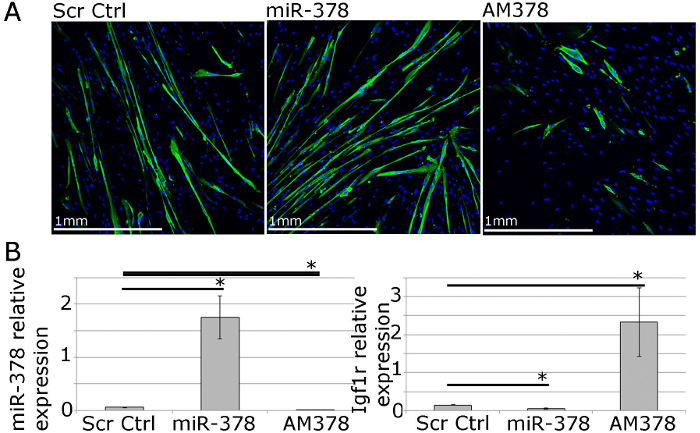
Figura 4. Los mioblastos humanos primarios pueden ser utilizados para estudios funcionales de la homeostasis del músculo in vitro. A. MF20 (miosina de cadena pesada) inmunotinción de miotubos primarios diferenciados de los humanos adultos que muestran los efectos de la sobreexpresión o la inhibición de miR-378 en myotube tamaño y número. B. qPCR muestra la expresión relativa de miR-378 y IGF1R, validado gen diana de miR-378, miR-378 tras la sobreexpresión o la inhibición de mioblastos humanos primarios. Expresión relativa a Rnu-6 y β-2-microglobulina, respectivamente, se muestra. Las barras de error muestran SEM; n = 3, * - p <0,05, prueba t de Student.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
Discusión
A continuación, presentamos un método simple, robusta, de bajo costo, eficiente y reproducible de aislar células progenitoras de músculo / mioblastos primarios de los adultos y los ancianos a los humanos de extensor corto digitorium, tibial anterior o halluces abductores músculos. Este protocolo tiene como objetivo permitir que los estudios que utilizan mioblastos primarios humanos de adultos y mayores de seres humanos, especialmente cuando los métodos más sofisticados, tales como FACS- o MACS-clasificación, no son posibles o no es práctico.
El método de aislamiento presentado en este manuscrito dura aproximadamente 2 horas. Durante el aislamiento muscular, el músculo se lavó en etanol al 70% con el fin de evitar la contaminación. Antes de la disociación enzimática del músculo, es importante para cortar el músculo en pedazos pequeños pero visibles, y evitar daños en las células del exceso de picar carne. Los resultados de digestión en la disociación de miofibras y la liberación de las células satélite y células precursoras miogénicas. En nuestro caso de ~ 20 mg de músculo esquelético, uno de 60 mm(20 cm 2) placa de Petri fue el área de la superficie más adecuada para recoger las células. Células cultivadas en placas sobre una superficie más grande mostraron reducción de la proliferación, mientras que las células en placas sobre una superficie más pequeña mostró un aumento de la muerte celular y la aglutinación.
Tras el aislamiento, las células se cultivaron y se expandieron en placas de laminina-cubierta. El uso de superficies no revestidas tendió a disminuir el éxito del aislamiento. Por esta razón, las células se pueden cosechar preferiblemente sobre una superficie pre-recubierto directamente después del aislamiento. culturas fibroblastos enriquecidos predominarán en lugar de células mioblastos derivados de si las células se recogen en una superficie no revestida directamente después del aislamiento. Además de la laminina, el uso de otras soluciones de fijación celular, como Matrigel y reactivos a base de colágeno se puede utilizar. soluciones de recubrimiento pueden incluir factores de crecimiento y otros compuestos que promuevan el crecimiento celular, pero estos podrían alterar el comportamiento de las células y por lo tanto los resultados experimentales. Ennuestra experiencia, 10 mg / ml de laminina es la concentración óptima y el reactivo de revestimiento apropiado para las células satélite y de fijación de mioblastos y la proliferación ya que carece de cualquier factor de crecimiento u otros complementos. Por otra parte, la laminina está naturalmente presente en la lámina basal, directamente relacionado con el sarcolema, que desempeña una función clave en la unión de las células satélite y la migración a través de la fibra del músculo esquelético.
Los suplementos de los medios de cultivo también pueden tener una influencia perjudicial sobre el comportamiento de la mioblastos primaria. Para los grupos de factor de ejemplo crecimiento, tales como FGFs o IGFs, tienen efectos pleiotrópicos en cultivos de mioblastos primarios, con FGF-2 controlando tanto mitogénica y programado respuesta muerte celular 31. Por tanto, es necesario controlar rigurosamente las condiciones de cultivo, especialmente por las diferencias en el comportamiento de los mioblastos primarios aislados a partir de músculo de adultos y mayores de las personas son muy probable que sea debido a la pureza of las culturas y la probabilidad de fibroblastos que invaden los mioblastos en cultivo durante cultivos a largo plazo 35. Hemos utilizado 1-hora pre-chapado de las células durante la primera división en una superficie no recubierta con el fin de disminuir la contaminación de los cultivos con fibroblastos.
El método se describe es adecuado para el aislamiento de células progenitoras myogenic de los músculos de los seres humanos adultos y ancianos. La célula aislada consta de una población myogenic representante de células como se indica por un alto porcentaje de células miogénicas (expresión MyoD y propiedades miogénicas visualizadas por inmunotinción MF20 en las figuras 1 y 2) y se puede utilizar como un modelo in vitro para los estudios funcionales de los procesos asociado con la homeostasis del músculo.
Estudios previos han caracterizado el aislamiento y diferencias en las propiedades, o la falta de ella, de mioblastos humanos primarios a partir deadultos y personas mayores de 6, 20, 27, 28, 29, 30, 31, 35, 6 3, 37, 38. La existencia de geriátrica y / o no funcional PSM humano se ha demostrado 6, 20, 22. Sin embargo, no hay diferencia en el comportamiento de PSM humanos recién aislados también se ha demostrado 27. El protocolo permite el aislamiento de mioblastos primarios que retienen al menos parcialmente su fenotipo, como la reducción senescencia potencial o de proliferación de mioblastos primarios aislados a partir de músculo de las personas de edad y permite el uso de estoscélulas para estudios funcionales de los mecanismos moleculares de la homeostasis del músculo durante el envejecimiento 22.
Los mioblastos primarios aislados usando el método descrito aquí se pueden utilizar no sólo para los estudios de la diferenciación miogénica sino también a investigar los cambios intracelulares, tales como cambios en la expresión génica que se producen en las células precursoras miogénicas humanos durante el envejecimiento. Sin embargo, los cambios que se producen en las células durante la prolongada cultivo ex vivo deben tenerse en cuenta al analizar los cambios fenotípicos y genotípicos ocurren durante el envejecimiento. Recomendamos el uso de células recién aisladas para este fin.
Por otra parte, el método de cultivo de mioblastos primarios se describe aquí permite la expansión y relativamente cultivo a largo plazo de mioblastos humanos primarios, lo que permite robustos estudios funcionales in vitro. Hemos demostrado previamente que las células progenitoras myogenic aislados usando nuestro método se pueden utilizar tanto para el perfil de expresión y functional estudios de los procesos asociados con el envejecimiento muscular 22. Este método es aplicable también a los músculos de adultos y roedores viejos y permite el aislamiento de un cultivo enriquecido de mioblastos que se puede utilizar para el perfil de los cambios genéticos y epigenéticos durante el envejecimiento y estudios funcionales 22. Las limitaciones de este método incluyen el uso de, en algún grado, la población mixta de células en lugar de una población pura de células satélite, que se puede obtener usando métodos más sofisticados publicado el 6, 28, 29, 39, 40, 41, 42, 43.
Se presenta un protocolo simplificado, asequible y reproducible para el aislamiento de células mioblastos primarios de los adultos y ancianoslos seres humanos. En nuestra experiencia, los métodos disponibles, más sofisticadas de aislamiento y cultivo de mioblastos humanos primarios (como MACS- o FACS-ordenados células satélite) son ideales para algunos tipos de estudios, como perfiles proteómicos o cambios de transcriptómica en las células. Sin embargo, estos métodos son caros, requieren por lo menos algún nivel de experiencia, y puede resultar difícil debido a la tasa proliferativa baja de las culturas y los fibroblastos overgrowing mioblastos mioblastos primarios puros.
Se presenta un protocolo reproducible, que permite que el simple aislamiento y cultivo de mioblastos humanos primarios para su uso en estudios funcionales. Además, se propone el uso de laminina 42 y el uso limitado de bFGF como factores clave para el éxito de una cultura 44. También proponemos evitar el estrés generado por centrifugación cuando se dividen las células y una etapa de pre-recubrimiento en el primer pasaje 45. En resumen, tenemosoptimizado un protocolo eficiente para el aislamiento y cultivo de mioblastos primarios / PSM de los músculos de los adultos y los seres humanos de edad que también es aplicable a los músculos de roedores y permite la expresión y estudios funcionales de la homeostasis del músculo.
Divulgaciones
There is nothing to disclose.
Agradecimientos
This work is supported by the Biotechnology and Biological Sciences Research Council (BBSRC; BB/L021668/1), the MRC and Arthritis Research UK as part of the MRC - Arthritis Research UK Centre for Integrated Research into Musculoskeletal Ageing (CIMA) and the Wellcome Trust Institutional Strategic Support Fund (097826/Z/11/A). The authors would like to thank Dr Dada Pisconti (University of Liverpool) for her expertise and advice in the isolation of muscle progenitor cells.
Materiales
| Name | Company | Catalog Number | Comments |
| 60 mm Petri dishes | Greiner Bio One | 628160 | Cellstar Cell culture dish, PS, 60/15 MM, VENTS. |
| Cell culture plates (6-well) | Sigma-Aldrich | CLS3516 | Corning Costar cell culture plates. 6-well, flat bottom (Individually wrapped) . |
| Cell culture plates (12-well) | Greiner bio-one | 657 160 | Cellstar Cell culture Multiwell Plates. |
| Culture flasks | Greiner Bio One | 690175 (25 cm2); 658175 (75 cm2). | Cellstar Filter Cap Cell Culture Flasks. |
| Standard Disposable Scalpel | Granton | 91310 | Sterile stainless steel blade, pattern: 10. |
| Pipettes | Greiner bio-one | 606 180 (5 mL); 607 180 (10 mL); 760 180 (25 mL) | Cellstar Serological Pipettes. |
| Pasteur plastic pipettes | Starlab | E1414-0311 | 3.0 mL Graduated Pasteur Pipette (Sterile), Ind. Wrapped. |
| Syringe | BD | 300613 | 20 mL BD eccentric tip syringe. |
| 0.2 µm filters | Gilson | ALG422A | Sterile Syringe Filters CA 0.2 µm 33 mm Pk50. |
| Cell strainers | Fisher Scientific | 11597522 | Cell culture strainer sterile individually packed 70 µm polypropylene. |
| Collagenase D | Roche | 11088882001 | Collagenase D; Activity: ≥0.15 U/mg |
| Dispase II | Sigma-Aldrich | D4693 | Dispase II Protease from Bacillus polymyx. Activity: ≥0.5 U/mg solid. |
| CaCl2 | Sigma-Aldrich | 449709 | Calcium chloride, anhydrous, beads, −10 mesh, ≥99.9% trace metals basis |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane. 1 mg/mL. |
| DMEM-high glucose | Sigma-Aldrich | D5671 | Dulbecco’s Modified Eagle’s Medium - high glucose. With 4,500 mg/L glucose and sodium bicarbonate, without L-glutamine and sodium pyruvate. |
| F-12 media | Gibco | 21765029 | Ham's F-12 Nutrient Mix. 1x + L-glutamine. |
| FGF-b | PetroTech | 100-18B | Recombinant human basic Fibroblast Growth Factor. |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Fetal Bovine Serum. |
| Horse serum (HS) | Sigma-Aldrich | H1270 | Horse Serum. Donor herd, USA origin, sterile-filtered. |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Penicillin-Streptomycin with 10,000 units penicillin and 10 mg streptomycin per mL in 0.9% NaCl, sterile-filtered. |
| L-Glutamine | Sigma-Aldrich | G7513 | L-Glutamine solution. 200 mM, solution, sterile-filtered. |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | Trypsin-EDTA solution. 0.25%, sterile-filtered. |
| TrypLE Express | Gibco | 12604-013 | TrypLE Express Enzyme (1x), no phenol red. |
| DPBS (cell culture) | Sigma-Aldrich | D8537 | Dulbecco’s Phosphate-buffered Saline. Modified, without calcium chloride and magnesium chloride. |
| PBS (immunostaining) | Sigma-Aldrich | P4417-50TAB | Phosphate-buffered saline tablet. One tablet per 200 mL of deionized water (0.01 M phosphate buffer, 0.0027 M potassium chloride and 0.137 M sodium chloride, pH 7.4). |
| Methanol | Fisher | M/4000/PC17 | Methanol Analytical Reagent Grade |
| Triton X-100 | Sigma-Aldrich | T8787 | Triton X-100 for molecular biology. |
| anti-MF 20 antibody | DSHB | MF20-c 2ea 211 µg/ml. | MYH1E (MF 20) Mouse mAb. |
| anti-MyoD antibody | Cell Signaling Technology | 13812P | MyoD1 (D8G3) XP Rabbit mAb. |
| anti-Ki67 antibody | Abcam | ab16667 | Rabbit mAb to Ki67 [SP6]. |
| Anti-mouse 488 secondary antibody | Invitrogen | A-11029 | Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| Anti-rabbit 488 secondary antibody | ThermoFisher Scientific | A-11034 | Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| DAPI | Sigma-Aldrich | Sigma-Aldrich | DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) |
| Senescence β-Galactosidase Staining Kit | Cell Signaling Technology | 9860 | Senescence β-Galactosidase Staining kit. |
| DMSO | Sigma-Aldrich | 41639 | Dimethyl sulfoxide. BioUltra, for molecular biology, ≥99.5% (GC). |
| Acridine Orange | Sigma-Aldrich | A8097 | Acridine Orange hydrochloride solution, 10 mg/mL in H2O. |
| Ethidium bromide | Sigma-Aldrich | E1510 | Ethidium bromide solution. BioReagent, for molecular biology, 10 mg/mL in H2O. |
| Lipofectamine 2000 | ThermoFisher Scientific | 11668019 | Lipofectamine 2000 Transfection Reagent |
| Scramble control for transfections | Qiagen | 1027271 | miScript Inhibitor Neg. Control (5 nmol) |
| Hsa-miR-378a-3p miScript Primer Assay | Qiagen | 218300 | Hs_miR-422b_1 miScript Primer Assay (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Anti-hsa-miR-378a-3p miScript miRNA Inhibitor | Qiagen | 219300 | Anti-hsa-miR-378a-3p miScript miRNA Inhibitor (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Megafuge 2.0 R Centrifuge | Heraeus | 75003085 | n/a |
| Centrifuge rotor | Heraeus | 3360 | Heraeus Sepatech Megafuge Centrifuge Rotor BS4402/A. Max. radius: 15.5 cm. |
| Eclipse Ti-E Inverted Microscope System | Nikon | n/a | Eyepieces: CFI 10X/22; Total magnification: 100X (MF20, Live/dead and Ki67). |
| Axiovert 200 inverted microscope | Carl Zeiss | n/a | Eyepieces: Carl Zeiss 1016-758 W-PI 10X/25; Total magnification: 100X (Senescence β-Galactosidase Staining). |
| Axiovert 25 inverted microscope | Carl Zeiss | n/a | Eyepieces: E-PL 10X/20. Total magnification: 100X (bright field). |
| Diaphot Inverted Tissue Culture Microscope | Nikon | n/a | Eyepiece: CFWN 10X/20. Total magnification: 100X (bright field). |
| Hydromount | National Diagnostics | HS-106 | Hydromount |
Referencias
- Hughes, V. A., et al. Longitudinal muscle strength changes in older adults: influence of muscle mass, physical activity, and health. J Gerontol A Biol Sci. 56, B209-B217 (2001).
- Ryall, J. G., Schertzer, J. D., Lynch, G. S. Cellular and molecular mechanisms underlying age-related skeletal muscle wasting and weakness. Biogerontology. 9, 213-228 (2008).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nat Cell Biol. 12, 143-152 (2010).
- Lexell, J., Taylor, C. C., Sjostrom, M. What is the cause of the ageing atrophy? Total number, size and proportion of different fiber types studied in whole vastus lateralis muscle from 15- to 83-year-old men. J Neurol Sci. 84, 275-294 (1988).
- Grounds, M. D. Reasons for the degeneration of ageing skeletal muscle: a central role for IGF-1 signalling. Biogerontology. 3, 19-24 (2002).
- Carlson, M. E., et al. Molecular aging and rejuvenation of human muscle stem cells. EMBO Mol Med. 1, 381-391 (2009).
- Brown, D. M., Goljanek-Whysall, K. microRNAs: Modulators of the underlying pathophysiology of sarcopenia?. Ageing Res Rev. 24, 263-273 (2015).
- Brooks, S. V., Faulkner, J. A. Contraction-induced injury: recovery of skeletal muscles in young and old mice. Am J Physiol. 258, C436-C442 (1990).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138, 3639-3646 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Charge, S. B., Rudnicki, M. A. Cellular and molecular regulation of muscle regeneration. Physiol Rev. 84, 209-238 (2004).
- Brack, A. S., Rando, T. A. Intrinsic changes and extrinsic influences of myogenic stem cell function during aging. Stem cell Rev. 3, 226-237 (2007).
- Kadi, F., Charifi, N., Henriksson, J. The number of satellite cells in slow and fast fibres from human vastus lateralis muscle. Histochem Cell Biol. 126, 83-87 (2006).
- Verdijk, L. B., et al. Satellite cell content is specifically reduced in type II skeletal muscle fibers in the elderly. Am J Physiol Endocrinol Metab. 292, E151-E157 (2007).
- Collins, C. A., Zammit, P. S., Ruiz, A. P., Morgan, J. E., Partridge, T. A. A population of myogenic stem cells that survives skeletal muscle aging. Stem cells. 25, 885-894 (2007).
- Bortoli, S., et al. Gene expression profiling of human satellite cells during muscular aging using cDNA arrays. Gene. 321, 145-154 (2003).
- Thalacker-Mercer, A. E., Dell'Italia, L. J., Cui, X., Cross, J. M., Bamman, M. M. Differential genomic responses in old vs. young humans despite similar levels of modest muscle damage after resistance loading. Physiol Genomics. 40, 141-149 (2010).
- Jejurikar, S. S., et al. Aging increases the susceptibility of skeletal muscle derived satellite cells to apoptosis. Exp Gerontol. 41, 828-836 (2006).
- McArdle, A., Dillmann, W. H., Mestril, R., Faulkner, J. A., Jackson, M. J. Overexpression of HSP70 in mouse skeletal muscle protects against muscle damage and age-related muscle dysfunction. FASEB J. 18, 355-357 (2004).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506, 316-321 (2014).
- Cornelison, D. D. Context matters: in vivo and in vitro influences on muscle satellite cell activity. J Cell Biochem. 105, 663-669 (2008).
- Soriano-Arroquia, A., McCormick, R., Molloy, A. P., McArdle, A., Goljanek-Whysall, K. Age-related changes in miR-143-3p:Igfbp5 interactions affect muscle regeneration. ageing cell. 15, 361-369 (2016).
- Goljanek-Whysall, K., et al. Regulation of multiple target genes by miR-1 and miR-206 is pivotal for C2C12 myoblast differentiation. J Cell Sci. 125, 3590-3600 (2012).
- Georgantas, R. W., et al. Inhibition of myogenic microRNAs 1, 133, and 206 by inflammatory cytokines links inflammation and muscle degeneration in adult inflammatory myopathies. Arthritis Rheumatol. 66, 1022-1033 (2014).
- Sharples, A. P., Al-Shanti, N., Stewart, C. E. C2 and C2C12 murine skeletal myoblast models of atrophic and hypertrophic potential: relevance to disease and ageing?. Journal of cellular physiology. 225, 240-250 (2010).
- Hidestrand, M., et al. Sca-1-expressing nonmyogenic cells contribute to fibrosis in aged skeletal muscle. J Gerontol A Biol Sci Med Sci. 63, 566-579 (2008).
- Alsharidah, M., et al. Primary human muscle precursor cells obtained from young and old donors produce similar proliferative, differentiation and senescent profiles in culture. ageing cell. 12, 333-344 (2013).
- Agley, C. C., Rowlerson, A. M., Velloso, C. P., Lazarus, N. L., Harridge, S. D. Isolation and quantitative immunocytochemical characterization of primary myogenic cells and fibroblasts from human skeletal muscle. J Vis Exp. , (2015).
- Pietrangelo, T., et al. Molecular basis of the myogenic profile of aged human skeletal muscle satellite cells during differentiation. Exp Gerontol. 44, 523-531 (2009).
- Webster, C., Pavlath, G. K., Parks, D. R., Walsh, F. S., Blau, H. M. Isolation of human myoblasts with the fluorescence-activated cell sorter. Exp Cell Res. 174, 252-265 (1988).
- Woods, K., Marrone, A., Smith, J. Programmed cell death and senescence in skeletal muscle stem cells. Annals of the New York Academy of Sciences. , 331-335 (2000).
- Chakkalakal, J. V., Jones, K. M., Basson, M. A., Brack, A. S. The aged niche disrupts muscle stem cell quiescence. Nature. 490, 355-360 (2012).
- Cornelison, D. D., et al. Essential and separable roles for Syndecan-3 and Syndecan-4 in skeletal muscle development and regeneration. Genes & development. 18, 2231-2236 (2004).
- Pisconti, A., Cornelison, D. D., Olguin, H. C., Antwine, T. L., Olwin, B. B. Syndecan-3 and Notch cooperate in regulating adult myogenesis. J Cell Biol. 190, 427-441 (2010).
- Schafer, R., et al. Age dependence of the human skeletal muscle stem cell in forming muscle tissue. Artificial organs. 30, 130-140 (2006).
- Castiglioni, A., et al. Isolation of progenitors that exhibit myogenic/osteogenic bipotency in vitro by fluorescence-activated cell sorting from human fetal muscle. Stem cell reports. 2, 92-106 (2014).
- Stewart, J. D., et al. Characterization of proliferating human skeletal muscle-derived cells in vitro: differential modulation of myoblast markers by TGF-beta2. J Cell Physiol. 196, 70-78 (2003).
- Wagner, W., et al. Aging and replicative senescence have related effects on human stem and progenitor cells. PloS one. 4, e5846 (2009).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 735-744 (2001).
- Gaster, M., Beck-Nielsen, H., Schroder, H. D. Proliferation conditions for human satellite cells. The fractional content of satellite cells. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 726-734 (2001).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods Mol Biol. 798, 21-52 (2012).
- Chowdhury, S. R., et al. One-Step Purification of Human Skeletal Muscle Myoblasts and Subsequent Expansion Using Laminin-Coated Surface. Tissue engineering. Part C, Methods. 21, 1135-1142 (2015).
- Mamchaoui, K., et al. Immortalized pathological human myoblasts: towards a universal tool for the study of neuromuscular disorders. Skeletal muscle. 1, 34 (2011).
- Natarajan, A., Lemos, D. R., Rossi, F. M. Fibro/adipogenic progenitors: a double-edged sword in skeletal muscle regeneration. Cell cycle. 9, 2045-2046 (2010).
- Ciofani, G., et al. Hypergravity effects on myoblast proliferation and differentiation. J Biosci Bioeng. 113, 258-261 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados