Method Article
La medición de células T Alorreactividad recurriendo a imágenes de Citometría de Flujo
En este artículo
Resumen
Este documento describe un método para medir alorreactividad en una población mixta de células T usando flujo de imágenes citometría.
Resumen
es probable que sea crucial para el éxito de la reducción o retirada de la inmunosupresión la medición de la reactividad inmunológica a los antígenos del donante en receptores de trasplante. La reacción de leucocitos mixtos (MLR), limitando ensayos de dilución, y la hipersensibilidad de ensayo de tipo retardado trans-vivo (DTH) han sido aplicados a esta pregunta, pero estos métodos han limitado la capacidad de predicción y / o importantes limitaciones prácticas que reducen su utilidad. flujo de imágenes citometría es una técnica que combina los poderes cuantitativos multiparamétricos de citometría de flujo con las capacidades de imágenes de microscopía de fluorescencia. Recientemente hemos hecho uso de un enfoque de citometría de flujo de formación de imágenes para definir la proporción de células T del receptor capaces de formar sinapsis inmunes maduras con células presentadoras de antígeno (APCs) donantes. Utilizando un modelo de trasplante de corazón de ratón bien caracterizados, hemos demostrado que la frecuencia de las sinapsis inmunes in vitro entre T-APC Membreventos de contacto ane predijeron fuertemente resultado en el rechazo de aloinjertos, la tolerancia, y una situación en la que la supervivencia del trasplante depende de las células T reguladoras inducidas. La frecuencia de los contactos T-APC aumentó con las células T de los ratones durante el rechazo agudo y disminuyó con células T de ratones prestados que no responde a aloantígeno. La adición de las células T reguladoras en el sistema in vitro reduce prolongados contactos T-APC. Fundamentalmente, este efecto también se observó con policlonal humana expandida, de origen natural las células T reguladoras, que son conocidos para controlar el rechazo de tejidos humanos en modelos de ratón humanizado. Un mayor desarrollo de este enfoque puede permitir una caracterización más profunda del compartimento de células T alorreactivas en receptores de trasplante. En el futuro, el desarrollo y la evaluación de este método utilizando células humanas pueden formar la base para ensayos utilizados para seleccionar a los pacientes para la minimización de la inmunosupresión, y puede ser utilizado para medir el impacto de tolerógenoic terapias en la clínica.
Introducción
trasplante de órganos sólidos ha transformado el cuidado de pacientes con enfermedades terminales del riñón, el hígado, el corazón y los pulmones. Debido a las disparidades en los antígenos mayores y menores de histocompatibilidad, sin embargo, los aloinjertos son rechazados rápidamente por las células T del receptor si no se utilizan fármacos inmunosupresores. Estos agentes tienen numerosos efectos adversos, incluyendo los riesgos de cáncer y disfunción orgánica. Por consiguiente, un objetivo de mayor importancia clínica es disminuir la dosis de inmunosupresión para el nivel mínimo necesario para evitar el rechazo del injerto. Este nivel puede variar dependiendo del grado de activación del sistema inmune innato; el grado de donante-receptor desajuste aloantígeno; y las diferencias entre pacientes en la función inmune, farmacocinética, y farmacodinámica.
Por desgracia, los médicos de trasplante no tienen ninguna herramienta para evaluar con precisión la reactividad de los donantes en pacientes individuales 1. el mixtareacción de leucocitos (MLR) puede detectar la reactividad de los donantes, pero falla para predecir de forma fiable los resultados de injerto 2, 3. Limitación de ensayos de dilución, ELISPOT de citocinas, y el ensayo de trans-vivo ya sea medir un rango limitado de respuestas o no son prácticos firmas 4, 5, 6, 7, 8 .Gene perfiles de expresión han revelado relacionados con la tolerancia operacional 9, 10, 11, 12 y rechazo 13, 14, 15, pero estos no siempre son generalizables a través de poblaciones 16 y puede en última instancia, tienen una utilidad limitada en pacientes individuales. Analy basada en la secuenciases del receptor de células T (TCR) de células T en la sangre periférica 17 o la proliferación en la MLR 18 también se han desarrollado pero requieren validación adicional.
Conceptualmente, sería deseable tener un ensayo que detecta las medidas necesarias más tempranos en destinatario activación de células T por un antígeno del donante. Desde el cultivo de células sobre días (como en el MLR) se puede introducir artefactos, tal prueba sería idealmente no requiere la medición de eventos aguas abajo, tales como la proliferación o la función efectora. Igualmente, sin embargo, también sería deseable para que la prueba depende de algún elemento de función de las células T, ya que las evaluaciones puramente descriptivos (Por ejemplo, TCR secuenciación) puede ser incapaz de distinguir entre las células T anérgicas y funcionales.
Numerosos estudios han indicado que se requiere prolongado contacto T-APC para la formación de una sinapsis inmune, que es una primera esencialpaso en la respuesta de células T 19, 20, 21, 22. Recientemente hemos informado de que, durante dinámica in vitro de formación de imágenes lapso de tiempo, aproximadamente 5 - 10% de ratón células T CD4 + se forman contactos de larga duración con células de médula alogénica derivadas de médula dendríticas (BMDCs) 23. La frecuencia de contacto prolongado se aumentó en los animales que rechazaron un injerto, mientras que en ratones previamente vuelto tolerantes a los mismos antígenos, se mantuvo en niveles observados en ratones no transplantado 23. Interacciones prolongados se redujeron en presencia de receptor Tregs y el aumento en su ausencia, y se observó un fenómeno similar utilizando células T humanas y DCs alogénicas derivadas de monocitos (moDCs) 23.
Sin embargo, la enumeración de los contactos prolongados hizo dentro de un populatio policlonal de células Tn es mucho tiempo y mano de obra intensiva. Por lo tanto, hemos hecho uso de imágenes de citometría de flujo para examinar la formación de sinapsis inmune alogénico. flujo Imaging incorpora citometría de las capacidades de adquisición y análisis de datos multiparamétricos de citometría de flujo convencional con las capacidades de formación de imágenes de una sola célula de microscopía de fluorescencia. Esta técnica ha sido utilizada por otros investigadores para estudiar la formación de sinapsis inmune por las células T monoclonales 24, 26, 27 o en presencia de superantígenos 28. En tales configuraciones, sin embargo, la frecuencia de células T que responden varía de 30-100%, mientras que las células T alorreactivas generalmente se estiman para representar el 5-15% del repertorio total de células T 29, 30, 31, 32. Es importante destacar, puso de manifiesto que el flujo de imágenes citometría puede producir avery medida comparable de alorreactivas frecuencia de células T 23 y que los cambios en la frecuencia de sinapsis dentro de una población de células T policlonales son predictivos de la evolución del injerto 23. Actualmente, este enfoque ha sido optimizado para medir la alorreactividad directa de las células T CD4 +, pero, en principio, también podría ser desarrollado para examinar las células T CD8 + y la vía indirecta. Alorreactividad indirecta se cree que es cada vez más relevante en tiempos más largos después del trasplante 33. Actualmente estamos desarrollando este método para utilizar células humanas, lo que permitirá para las pruebas en pacientes. Por lo tanto, en el futuro, el enfoque general puede ser útil para la evaluación funcional de las respuestas de células T en los receptores de trasplante antes del trasplante; inmediatamente después del trasplante; y en el largo plazo, cuando la minimización de drogas se convierte en un objetivo importante.
Protocolo
1. Preparar los reactivos y materiales necesarios
- Preparar solución salina tamponada con fosfato (PBS) que contiene 2% de suero bovino fetal (FBS) ( "tampón de lavado"). Preparar PBS con 2% de FCS que contienen 0,1% de detergente no iónico ( "tampón de Perm-lavado", véase la Tabla de Materiales). Preparar PBS con 1,5% de formaldehído.
NOTA: ¡CUIDADO! El formaldehído es corrosivo y potencialmente cancerígenos y debe ser manejado mientras que use el equipo de protección personal adecuado. - Prepare PBS que contenía 2% de FBS y 0,5 mM de ácido etilendiaminotetraacético (EDTA) para la separación magnética de células ( "tampón MCS").
- Preparar 50 mg / ml de isotiocianato de faloidina-fluoresceína (faloidina-FITC) en sulfóxido de dimetilo (DMSO). Preparar un 1 mg / ml tinción nuclear (por ejemplo, 1 mg / ml 7-aminoactinomicina D (7-AAD) en DMSO o bis-benzimida colorante; ver la Tabla de Materiales) en DMSO. Preparar anticuerpos marcados con fluorocromos apropiados para las células de interés yla formación de imágenes citómetro de flujo.
- Obtener los tejidos animales (por ejemplo, los ganglios linfáticos y el bazo) como una fuente de células T y los tejidos animales alogénico (por ejemplo, bazo y médula ósea) como una fuente de células o progenitores presentadoras de antígeno.
- Preparar medio de cultivo celular (por ejemplo, medio Roswell Park Memorial Institute (RPMI) 1640 o medio Eagle modificado de Dulbecco (DMEM) suplementado con 10% FBS), 50 mM 2-mercaptoetanol, penicilina y estreptomicina y obtener 24- y / o 96- así placas de cultivo celular.
2. Preparar células presentadoras de antígeno
NOTA: En teoría, cualquier población de APC podría examinarse con este método. células inmaduras ósea de ratón derivadas de la médula dendríticas (DC) como APC fueron demandados en este caso. Existen muchos protocolos para la generación de estas células (por ejemplo, las referencias 34 y 35). Brevemente, se utilizó el siguiente protocolo.
- ósea Flush de fémures y tibias en RPMI 1640 o DMEM.
- Pasar las células suspendidas a través de un filtro de células de 70 micras para eliminar pequeños trozos de hueso y los residuos.
- Sedimentar las células por centrifugación y después lisar glóbulos rojos usando un tampón de cloruro de amonio durante 5 min a temperatura ambiente.
- Sedimentar las células por centrifugación (400 xg, 5 min) y resuspender el sedimento celular.
- Lavar las células en de 5 - 10 ml de tampón de lavado, pellet por centrifugación (400 xg, 5 min), y volver a suspender el sedimento celular.
- Enriquecer precursores hematopoyéticos más de una columna de separación celular mediante el etiquetado de las células con biotina anti-CD3 (5 g / ml), anti-B220 (5 g / ml), anti-MHC clase II (1 mg / ml) y anti-CD11b (/ ml 5 g) anticuerpos.
- Sedimentar las células por centrifugación (400 xg, 5 min) y volver a suspender el sedimento celular.
- Se incuban las células con microperlas magnéticas anti-biotina (ver la Tabla de Materiales) a 4 ° C durante 10 min.
- Lavar y sedimentar las células (400 xg, 5 min) y re-suspend en 1 ml de tampón de MCS antes de retirar las células marcadas usando una gran selección positiva columna (LS) magnético de separación de células cebada con 3 ml de tampón de MCS y se coloca en su imán. Lavar la columna 3 veces con 3 ml de tampón MCS; el flujo a través contendrá las células deseadas.
- Cultivar las células que pasan a través de la columna durante 6 días en medio RPMI 1640 o DMEM suplementado con 2 ng / ml de granulocitos recombinante de ratón macrófagos, factor estimulante de colonias (GM-CSF) y 2 ng / ml de β1 de factor de crecimiento transformante recombinante humano (TGFß1) . Reemplazar la mitad del medio cada 2 días con medio completo fresco que contiene 2 ng / ml de GM-CSF y TGFß1.
NOTA: TGFß1 humana tiene actividad en células de ratón. Los datos han sido generados usando estos países en desarrollo inmaduro. Otras células (por ejemplo, células y DC maduras B) pueden ser adecuados como APCs, pero no se han probado en este ensayo. - Criopreservar DCs en 90% de suero / 10% de DMSO y almacenar en nitrógeno líquido; recuperar elel día de uso. Antes de su uso, contar el número de países en desarrollo viables en un hemocitómetro usando exclusión de azul de tripano. Vuelva a suspender el sedimento celular en medio de cultivo a la densidad apropiada (véase el paso 4.1) antes de su uso en la sección 4.
3. Preparar las células T
- Use métodos de selección negativa para evitar inadvertidamente la transmisión de señales de activación o de inhibición a las células.
NOTA: En este ejemplo, las células T CD4 + se prepararon para el análisis.- Para preparar las células T CD4 + a partir del bazo del ratón, triturar el bazo a través de un filtro de células de 70 micras usando el émbolo de una jeringa. Lavar el filtro de células con tampón de lavado.
- Sedimentar las células en suspensión por centrifugación (400 xg, 5 min) y luego lisar los glóbulos rojos resuspendiendo el sedimento en un tampón de cloruro de amonio durante 5 min a temperatura ambiente.
- Sedimentar las células por centrifugación (400 xg, 5 min) y resuspender el sedimento.
- Lavar la células en 5 - 10 ml de tampón de lavado y pellet por centrifugación (400 xg, 5 min). Vuelva a suspender el sedimento.
- Teñir las células con anticuerpos biotinilados a CD8, mayor de histocompatibilidad clase II (MHC II, 1 mg / ml) y CD19 (5 g / ml). Incubar durante 10 min a 4 ° C.
- Se lavan las células en 10 ml de tampón de lavado y pellet por centrifugación (400 xg, 5 min). Vuelva a suspender el sedimento.
- Se incuban las células con microperlas magnéticas anti-biotina (ver la Tabla de Materiales) de acuerdo con las instrucciones del fabricante.
- Se lavan las células en 10 ml de tampón de lavado y pellet por centrifugación (400 xg, 5 min); resuspender el pellet.
- Vuelva a suspender las células en 1 ml de tampón de MCS y enriquecer las células T CD4 + a través de una columna de separación celular magnética cebado con 3 ml de tampón de MCS en un imán. Lavar la columna 3 veces con 3 ml de tampón de MCS. Columna de flujo a través contendrá las células T enriquecidas.
- Por cytome flujo estándartratar, evaluar la pureza de las células T usando una alícuota de las células seleccionadas negativamente. Teñir las células usando un conjugado de fluorocromo-estreptavidina (para identificar cualquier célula marcados con biotina que deberían haber sido eliminadas en la columna) y un anticuerpo o anticuerpos para identificar la población de células T de interés (CD4 en este caso); una pureza de ≥85% es aceptable 23.
- Contar las células T en un hemocitómetro por exclusión de azul de tripano (≥90% de viabilidad es aceptable).
NOTA: tampón MCS contiene EDTA, que debe ser eliminado antes del ensayo. Para lograr esto, sedimentar las células por centrifugación (400 xg, 5 min) y lavar en 1 ml de tampón de lavado. Sedimentar las células de nuevo (400 xg, 5 min) y volver a suspender en medio de cultivo a la densidad apropiada (véase el paso 4.1).
- Contar las células T en un hemocitómetro por exclusión de azul de tripano (≥90% de viabilidad es aceptable).
4. Co-incuban las células y DCS T
- las células T de semillas y las CD en un 2: 1 T: relación de DC en una placa de cultivo celular de 24 pocillos o de 96 pocillos. Asegurarse de que el volumen de cultivo final es ≤500 l para placas de 24 pocillos o ≤50 l para placas de 96 pocillos.
NOTA: Pequeños volúmenes estimulan las interacciones célula-célula y permitir espacio para la memoria intermedia posterior fijación.- Ajustar el número de células precisas empíricamente, sino como una guía general, use 1 x 10 6 células T y 0,5 x 10 6 DCs por pocillo (placa de 96 pocillos). Estos deben considerarse el número mínimo de células, porque el uso de un menor número de células hace que la enumeración de las sinapsis inmune difíciles.
- Para aumentar el número de células, configurar pocillos replicados y la piscina después de la etapa 5 (fijación).
NOTA: Al configurar pocillos duplicados, es aconsejable sembrar las CD en todos los pozos primera y células T de semillas luego en todos los pozos; esto minimiza discrepancias en tiempo de incubación entre los pozos.
- Para aumentar el número de células, configurar pocillos replicados y la piscina después de la etapa 5 (fijación).
- Ajustar el número de células precisas empíricamente, sino como una guía general, use 1 x 10 6 células T y 0,5 x 10 6 DCs por pocillo (placa de 96 pocillos). Estos deben considerarse el número mínimo de células, porque el uso de un menor número de células hace que la enumeración de las sinapsis inmune difíciles.
- Incubar la placa durante 4 h a 37 ° C en una atmósfera de 5% de CO2.
- Añadir 3 veces el volumen de cultivo de 1,5% de formaldehído en PBS a cada pocillo e incubar a temperatura ambiente durante 30 min; tt es importante fijar células antes de retirarlos de la placa para reducir al mínimo la interrupción de las interacciones célula-célula.
- Transferencia de las células en la placa en tubos para el lavado y la tinción posterior. En esta etapa, a un lado las células adicionales para los controles de una sola mancha. Además de estos controles, todo el cultivo debe ser manchado con el cóctel de anticuerpos (véase la etapa 4.1.1).
6. Las células Stain
- células de la mancha en 100! l de tampón de lavado que contiene un cóctel de los anticuerpos conjugados con fluorocromo deseados para 30 min a temperatura ambiente, protegidos de la luz.
NOTA: El cóctel incluye anticuerpos de células específicas y APC-T específicas. Los fluorocromos deben ser elegidos de tal manera que pueden distinguirse utilizando la configuración de la formación de imágenes citómetro de flujo. en texperimenta se muestra aquí, azul fluoróforo conjugado con CD11b (5 mg / ml, véase la Tabla de Materiales) y CD90.2 APC-conjugado (5 g / ml) fueron utilizados. - Lavar las células en 1 ml de tampón de lavado y centrifugar durante 5 min a 400 x g. Decantar el sobrenadante. Vuelva a suspender las células en tampón Perm-lavado que contiene faloidina FITC a 0,05-0,5 g / ml y se incuba durante 30 min a temperatura ambiente protegido de la luz.
NOTA: Las concentraciones faloidina FITC de aproximadamente 0,1 g / ml funciona bien para las células de ratón, pero se espera que la concentración apropiada para variar por proveedor, tipo de célula, y el flujo de imágenes citómetro. - Lavar las células en 1 ml de tampón de Perm / lavado y centrifugar durante 5 min a 400 x g. Decantar el sobrenadante. Vuelva a suspender las células en tampón Perm / lavado que contiene colorante nuclear a la concentración apropiada (por ejemplo, aproximadamente 25 mg / ml 7-AAD) y se incuba durante 30 min a temperatura ambiente protegido de la luz.
- Lavar la células en 1 ml de tampón de Perm / lavado y centrifugar durante 5 min a 400 x g. Decantar el sobrenadante. Lavar las células una vez en tampón de lavado, pellet, y volver a suspender en 50 - 100! L de tampón de lavado, la transferencia de las células a tubos de microcentrífuga pequeñas, capsulado.
- Proceder a la adquisición de datos inmediatamente o almacenar las células a 4 ° C protegido de la luz durante hasta varios días antes de la adquisición de imágenes en el citómetro de flujo.
Nota: Las celdas se han almacenado con éxito en este camino para un máximo de 7 días. almacenamiento más largo puede ser posible, pero no ha sido probado.
7. adquirir datos
- Inicializar y configurar el flujo de imágenes citómetro de acuerdo con las instrucciones del fabricante. Asegurar la estabilidad del núcleo flujo antes de recoger los datos.
- Reservar un canal para la adquisición de imágenes de campo claro. Adquirir datos de control de una sola mancha con el canal de campo claro apagado.
- Haga clic en el botón "Cargar" y inseta un tubo que contiene una muestra totalmente manchado (una muestra que ha sido teñido con todos los fluorocromos requeridos) en el soporte.
- En la ventana de "espacio de trabajo", seleccionar y crear un nuevo diagrama de dispersión con la relación de aspecto en los singletes de la zona y de la puerta, donde la relación de aspecto está cerca de 1. Crear un nuevo diagrama de dispersión para cada canal utilizado (intensidad del canal en el eje horizontal) .
- Para cada fluorocromo, compruebe la población positiva y, si es necesario, ajustar la tensión de láser en el cuadro de "Iluminación".
- Descargar el tubo y cargar el primer tubo manchados sola.
- En el cuadro "Configuración de Adquisición", escriba el nombre de la muestra y establecer el número de eventos que deben ser recogidos; si se trata de una sola mancha (para controles de compensación), 1.000 - 2.000 eventos son suficientes.
- En el cuadro de "Canales", seleccionar los canales que cada muestra ha sido teñidas con. Para los controles de una sola mancha, todos los canales deben ser seleccionados con brightfield y el lado de dispersión fuera. Haga clic en el botón "Grabar" en el cuadro "Adquisición"; cuando el número de eventos alcanza el umbral especificado, la adquisición se detendrá automáticamente.
- Haga clic en el botón "Return" para descargar el tubo. Repita los pasos 7.2.4 - 7.2.6 para cada control de una sola mancha. Dependiendo del citómetro y software, puede que no sea posible establecer todas las puertas que se muestran en la Figura 1 durante la adquisición (más gating precisa se realiza durante el análisis; véase la sección 8).
- Adquirir muestras como para las muestras manchadas individuales (en el paso 7.2), pero en el cuadro de "canales", seleccionar todos los canales que se requieren, incluyendo el canal de campo claro.
- Antes de la grabación de datos, comprobar para confirmar que la intensidad del canal es apropiada para identificar las poblaciones de células deseadas. Si no es así, ajustar la configuración de láser y volver a grabar los controles de una sola mancha utilizando los nuevos valores, como se describe en el paso 7.2.
- Para cadamuestra, adquirir varias decenas de miles de eventos.
NOTA: En la mayoría de condiciones, los eventos de contacto célula-célula son una pequeña minoría del número total de células (la mayoría son células individuales). En general, es deseable tener al menos 100 eventos en la puerta de contactos de membrana final.
8. Analizar los Datos
- Analizar los datos adquiridos en el flujo de imágenes citómetro utilizando el software analítico disponible de forma gratuita desde el sitio web del fabricante (una cuenta de usuario se debe crear, ver la Tabla de Materiales).
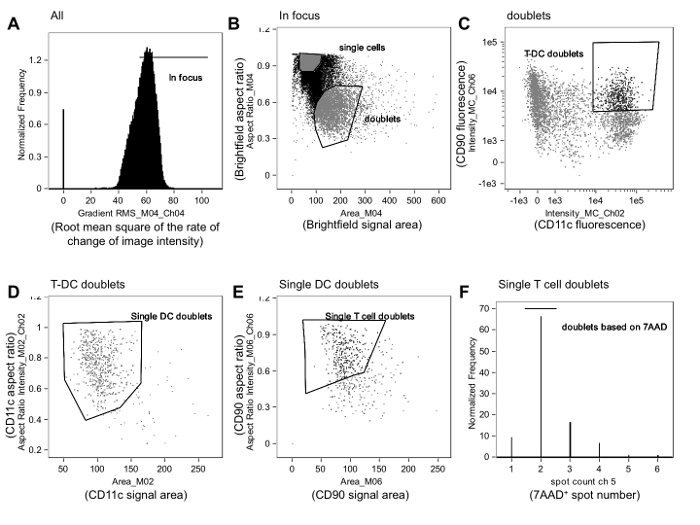
Figura 1. Estrategia de apertura de puerta se utiliza para identificar alorreactivas inmunes sinapsis. A. En foco eventos son una verja de todos los eventos mediante la revisión de imágenes de células en función de la raíz cuadrada media de la tasa de cambio del perfil de intensidad de la imagen (Gradiente RMS) utilizando el campo claro Channel (Canal 4, Ch04), como se describe en el texto. B. Entre los acontecimientos en-enfoque, dobletes se distinguen de las células individuales mediante el trazado de la relación de aspecto en comparación con el área para el canal de campo claro. Las células individuales se agrupan cerca de la relación de aspecto de 1 y tener un área más pequeña, mientras que dobletes están cerca de 0,5 y tienen un área más grande. C. La intensidad de fluorescencia de la APC (en este caso, un marcador de células dendríticas [DC], CD11c) A continuación, se representó frente a la intensidad de fluorescencia del marcador de células T (en este caso, CD90.2), y los acontecimientos de doble positivas son cerradas. Fronteras de la puerta se pueden refinar mediante la revisión de imágenes de eventos cerca de las fronteras. Dobletes D. T-APC son entonces refinados para que contengan sólo una APC mediante el trazado de la relación de aspecto en comparación con la zona del marcador de APC (CD11c, Ch02). Dobletes E. Estos single-APC son entonces refinados para que contengan sólo una célula T por el trazado de la relación de aspecto en comparación con el área dedel marcador de células T (CD90.2, CH06). F. Finalmente, los eventos que contienen sólo dos núcleos se seleccionan mediante el trazado de un histograma de la recuento de manchas en el canal de tinción nuclear (7-AAD, CH05) y gating eventos que contienen sólo los puntos 2 7-AAD-positivos (es decir, núcleos). Los acontecimientos de esta puerta se analizan para el contacto de la membrana y la formación de sinapsis, tal como se describe en la Figura 2. Los datos se analizaron de una manera ciega con respecto a la asignación de tratamiento y son de un experimento publicado previamente 23. Haga clic aquí para ver una versión más grande de esta figura.
NOTA: La estrategia gating se describe en esta sección y se representa en la Figura 1. Análisis de flujo de formación de imágenes datos de citometría se debe realizar de una manera ciega con respecto a la asignación del tratamiento. Aunque creemos que las sinapsis inmune y no synaptic contactos se distinguen generalmente fácilmente (ver a continuación y en las Figuras 2 y 3), el cegamiento deben minimizar el sesgo que surge de la subjetividad inherente a análisis de imagen.
- Generar una matriz de compensación por la carga de los archivos de datos de control de una sola mancha en el asistente de compensación. Después de cargar los archivos manchados individuales, seleccionar los canales fluorescentes utilizados en el experimento.
NOTA: El software genera automáticamente una matriz de compensación, pero esto debe ser validado manualmente para asegurar que se seleccionaron las poblaciones positivas correctas.- Doble clic en un valor en la matriz y añadir el gráfico a la zona de análisis. Crear una nueva puerta si es necesario excluir ningún células / dobletes / falsos positivos muertos; esta nueva población positiva refinado se puede seleccionar en la caja de matriz en el menú desplegable para cada canal hacia abajo.
- Repita este procedimiento para cada canal. Haga clic en "Finalizar" para guardar el compensation matriz (archivo .ctm).
- Obtener un fichero de análisis de datos (.daf) del archivo en bruto (.rif) cargando el archivo .rif en el software de análisis y la aplicación de la matriz de compensación.
- Una vez que se cargan los datos, realizar gating para identificar eventos de contacto de células T de APC.
NOTA: Una estrategia típica gating implica la identificación de eventos en el foco, la selección de dobletes basado en criterios de tamaño (el área frente a la relación de aspecto del evento), y la selección de T dobletes de células-APC como eventos que son de doble positivo para la célula T y marcadores de APC (Figura 1A-C).
NOTA: La relación de aspecto es la relación de la anchura de un evento para su altura, lo que permite la discriminación de las células individuales (relación de cerca de 1) a partir de dobletes (relación de cerca de 0,5). - Identificar eventos en-foco mediante el trazado de la raíz cuadrada media de la velocidad de cambio del perfil de intensidad de imagen (RMS gradiente) en el canal de campo claro (Figura 1A). Haga clic en el the gradiente de RMS histograma para visualizar los eventos celulares en recipientes individuales y luego colocar una puerta de exclusión de eventos fuera de foco.
- Trazar la zona frente a la relación de aspecto del canal de campo claro y dibujar una puerta que identifica dobletes basada en la forma y tamaño (Figura 1B) evento. Revisión de imágenes de eventos justo dentro y fuera de la frontera de esta puerta puede ayudar al analista para refinar el tamaño y la posición de la puerta. A continuación, construir una gráfica de estos eventos doblete en las que aparece la intensidad del marcador de células T en un eje y la intensidad del marcador de APC aparece en la otra. Dibuje una puerta doblete T-APC que contiene eventos positivos para ambos marcadores.
- Entre los eventos doblete de células T de APC, seleccionar los eventos que contienen sólo una célula T y una APC.
- Para ello, mediante el trazado de la relación de aspecto en comparación con el área para el marcador de APC y por gating en dobletes que contienen un único APC (Figura 1D). Representar gráficamente la relación de aspecto en comparación con el área de la marca de las células Ter y la puerta a dobletes que contienen una sola célula T (Figura 1E).
NOTA: El refinamiento adicional se puede lograr mediante el trazado de un histograma de la función de recuento de manchas tal como se aplica a la fluorescencia tinción nuclear y gating en eventos con sólo dos puntos (Figura 1F).
- Para ello, mediante el trazado de la relación de aspecto en comparación con el área para el marcador de APC y por gating en dobletes que contienen un único APC (Figura 1D). Representar gráficamente la relación de aspecto en comparación con el área de la marca de las células Ter y la puerta a dobletes que contienen una sola célula T (Figura 1E).
- En algunos casos, las dos células dentro de un doblete no estarán en contacto; para identificar las células en contacto una con otra, definir máscaras de objeto para APCs y células T.
- Utilice la opción "Máscaras" en el menú Análisis para abrir el administrador Máscaras y definir una nueva máscara. Escriba un nombre, como "máscara objeto de células T". Haga clic en el botón "Función", y en el cuadro de diálogo, elija "Objeto".
- Seleccione el canal en el que se detecta el marcador de células T (por ejemplo, CH06). Haga clic en Aceptar."
NOTA: "Objeto (M06, CH06, Tight)" se muestra en el cuadro Función. Esta máscara de objeto por defecto por lo general WORks bien pero puede requerir la optimización. - Repita este procedimiento para crear una máscara de objeto de APC en el canal apropiado.
- Después de identificar las máscaras de APC y células T, determinar contacto con la membrana por el trazado de la intensidad de fluorescencia marcador de células T en la máscara objeto APC contra la intensidad de fluorescencia de APC en la máscara objeto de células T. En esta trama, dibujar una puerta que incluye sólo las células en contacto entre sí.
NOTA: Por lo general, hay poblaciones de doble positivas y de doble negativo bastante claro (Figura 2A). La frontera entre las poblaciones de doble positivos y negativos de doble puede ajustarse mediante la revisión de las imágenes de campo claro de células en la región fronteriza para asegurar que las células están en contacto se encuentran dentro de la puerta y que se excluyen las células que no están en contacto. - En esta etapa, revisar manualmente las imágenes faloidina FITC de eventos dentro de esta puerta para distinguir las sinapsis inmunes maduras de simple contacto célula-célula. TSE La función de "imágenes de etiquetas" para marcar estas imágenes.
NOTA: El porcentaje de eventos etiquetados (sinapsis inmune) en el interior de esta puerta se puede utilizar como un índice de alorreactividad directa en la población de células T en estudio.
Resultados
Este método se utilizó para investigar CD4 + alorreactividad de las células T en ratones vuelto tolerantes a aloantígenos del donante antes de heterotópico trasplante de aloinjerto cardiaco. Ratones CBA (H-2 K) se les dio un protocolo de tolerización que consiste de un donante-específica (B6, H-2 b) transfusión de sangre se combina con una de no-agotamiento anticuerpo CD4 un mes antes de recibir un trasplante cardíaco B6. Este protocolo da como resultado la supervivencia del aloinjerto a largo plazo que es dependiente de células T reguladoras Foxp3 + 36, 37. Siete días después del trasplante, se obtuvieron las células T CD4 + esplénicas de tolerantes y receptores no tolerantes de aloinjertos cardíacos B6 y se co-incubaron con DCs derivadas de médula ósea B6 de acuerdo con este protocolo. La Figura 2 muestra los datos representativos de este experimento. La puerta de contactos de membrana se muestra en la Figura 2A, con punto de mira verdes colocan en un evento sináptica (panel de la izquierda, 1) y en un evento no sináptica (panel derecho). La Figura 2B muestra los canales de campo claro y fluorescencia para este evento. Para reducir el sesgo, los datos fueron analizados por un observador ciego para la asignación de tratamiento 23. Como se muestra en varios ejemplos en la Figura 3, ambos de no tolerantes (Figura 3A-B) y tolerantes (Figura 3C-D) los receptores CBA de corazones B6, sinapsis se distinguen fácilmente de contactos no sinápticas por la presencia de una cresta FITC-positivo densa en la interfaz T-APC. Estos resultados muestran que la detección visual de las sinapsis inmunes producidas por las células T del receptor rastrea con el grado de alorreactividad en el receptor.
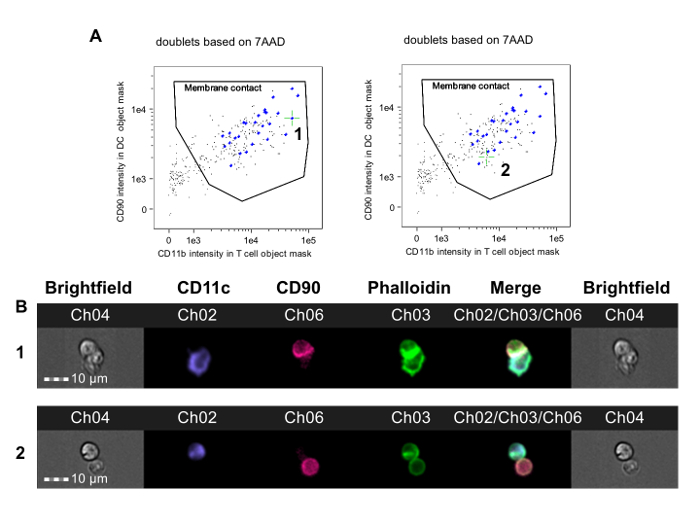
Figura 2. Identificación de T-APC dobletes con membranaContacto y la formación de sinapsis inmune. Se analizan Eventos en la puerta doblete final (Figura 1F). A. fluorescencia marcador de células T en la máscara objeto APC se representa frente a APC fluorescencia marcador en la máscara objeto DC. Algunos eventos tienen un doblete de APC y una célula T sin contacto célula-célula y aparecen en la esquina inferior izquierda de la trama (imágenes no se muestra). Una puerta de contacto membrana así se puede extraer que incluye sólo dobletes en el que las células T y APCs están en contacto. Las imágenes de cada evento en esta puerta se revisan para detectar evidencia de reordenamiento del citoesqueleto de actina en el canal de faloidina-FITC y se pueden etiquetar con el software de análisis. El panel izquierdo indica un evento sinapsis inmune (con la etiqueta 1 y se indica por retículos verde), mientras que el panel de la derecha indica un evento de contactos de membrana sin la formación de sinapsis inmune (con la etiqueta 2 y se indica por retículos verde). La determinación de la formación de sinapsis requiere revisión manual de estosimágenes, se muestra en B. B. La fila superior muestra de campo claro y fluorescencia de canal imágenes para un doblete con una sinapsis inmune (corresponde al caso 1 en A); La fila inferior muestra un doblete con contactos de membrana, pero que carece de la formación de sinapsis (corresponde al caso 2 en A). Los datos se analizaron de una manera ciega con respecto a la asignación de tratamiento y son de un experimento publicado previamente 23. Haga clic aquí para ver una versión más grande de esta figura.
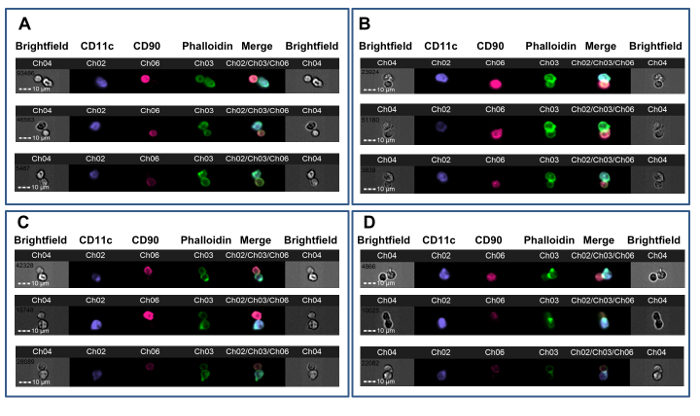
Figura 3. Ejemplos de T-APC Synapse de formación. Ratones CBA recibieron aloinjertos cardiacos de donantes B6 después de que cualquiera no pre-tratamiento (AB) o después de la inducción de tolerancia con sangre entera B6 debajo de la cubierta de un anticuerpo anti-CD4 de no-agotamiento ( rong> CD). Después de 7 días, se ensayaron las células T CD4 + esplénicas para la formación de sinapsis con DCs B6. A. Tres ejemplos de dobletes no sinápticas con contactos de membrana a partir de un animal no tolerizado. B. Tres ejemplos de las sinapsis inmune de un animal no tolerizado. C. Tres ejemplos de dobletes no sinápticas con contacto con la membrana de un animal tolerizado. D. Tres ejemplos de las sinapsis inmune de un animal tolerizado. la formación de sinapsis se indica por la presencia de una cresta brillante, FITC-positiva en la interfaz T-APC (Ch03). Los datos se analizaron de una manera ciega con respecto a la asignación de tratamiento y son de un experimento publicado previamente 23. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1. Los anticuerpos y colorantes utilizados en este estudio. anticuerpos conjugados con fluorocromo, colorantes, proveedores y concentraciones recomendadas se presentan en la tabla. El flujo de imágenes citómetro de canal que se utiliza para detectar cada fluorocromo también se muestra en la tabla.
Discusión
Flujo Imaging citometría se ha utilizado para demostrar la formación de sinapsis inmune entre las células T monoclonales y APCs o en presencia de superantígenos 24, 25, 26, 27, 28. Este método aprovecha el hecho de que después de un T productiva de células-APC contacto, la célula T reorganiza su citoesqueleto de actina, polarizando hacia el sitio de contacto 21. Este reordenamiento no se produce sin la señalización de TCR, y por lo tanto es un correlato temprana de activación de células T 19, 20, 21. El método que aquí se presenta este enfoque se adapta a la medida de alorreactiva frecuencia de células T policlonales en poblaciones de células T. Como tal, es posible que en el futuro servirá de base para el desarrollo de ensayos para reactivi donante ty en el trasplante clínico.
Aunque aún no se han realizado comparaciones directas, la detección de alorreactivas sinapsis inmune parece tener capacidad de predicción superior a la MLR convencional. Por ejemplo, el trabajo previo ha demostrado que, en el protocolo de tolerización descrito anteriormente, los resultados de una MLR fallan para correlacionar de forma fiable con el resultado de injerto 2.
Un número de ensayos se han desarrollado para el estado operacionalmente tolerantes en los seres humanos 9, 10, 11, aunque éstos no miden la función de células efectoras en respuesta a aloantígeno. Por el contrario, IFN ELISPOT ensayos de la función 8 medida efectora de las células T pero no puede capturar el espectro completo de la secreción de citoquinas que pueden ser relevantes para el rechazo agudo y crónico de aloinjerto, tales como IL-17 38,> 39. El ensayo de dilución limitante 4, que es un trabajo intensivo, y el ensayo de trans-vivo 6, que requiere ratones, tienen limitaciones prácticas significativas que pudieran obstaculizar su aplicación en un entorno clínico. Las recientes mejoras en el análisis de células en proliferación mediante el análisis de secuencia de TCR de las células T que responden en la MLR pueden ser de valor, pero al igual que el ensayo que aquí se presenta, requerirá una validación adicional en estudios clínicos 18, 40.
Un mayor desarrollo del ensayo de detección de sinapsis inmunológica, será necesario que un número importante de preguntas ser contestadas. En primer lugar, el ensayo como se desarrolló sólo mide alorreactividad directa. La vía directa implica la presentación de alogénicas complejos MHC / péptido en las APC derivadas del donante. Estos últimos son generalmente eliminado rápidamente después del trasplante, y aún más presentación aloantígeno es carried a cabo por APCs receptores que presentan donante intacta MHC (vía semi-directa) o antígenos del donante procesa en auto MHC (vía indirecta). La vía indirecta es un importante motor de rechazo de aloinjerto crónica 33, 41.
En principio, debería ser posible detectar sinapsis inmunes indirectos usando este ensayo, pero indirectamente células T alorreactivas tener una frecuencia mucho más baja que los directos 42, 43, lo que significa que se requiere el análisis de un mayor número de eventos. Una segunda consideración es que sólo hemos probado este ensayo usando células T CD4 +, mientras que las células T CD8 + también son un componente importante de la respuesta anti-donante. Una vez más, debe ser posible detectar sinapsis + T CD8 células APC utilizando este método. Otra limitación es que el método requiere la revisión manual y el análisis de imágenes de células en el memb definitivaRane puerta de contacto, y actualmente estamos trabajando en la automatización de este paso.
Por último, el método requiere pruebas y el desarrollo en seres humanos, y se están realizando actualmente estudios preliminares con muestras humanas. Un análisis más detallado fenotípica subconjunto de células T (es decir, efector, la memoria, de regulación, etc.) en combinación con la detección de las sinapsis inmune en receptores de trasplante representaría un enfoque poderoso para caracterizar el repertorio de células T alorreactivas y será un enfoque importante para trabajo futuro.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
SCJ fue apoyado por una Sociedad Internacional de Trasplante de Corazón y Pulmón beca de investigación y una Real Colegio de Médicos y Cirujanos de Canadá Detweiler Viajar Fellowship.SM fue apoyado en parte por una Sociedad Internacional para el corazón y el Premio del trasplante pulmonar Desarrollo de Carrera (a SCJ). SS fue apoyada por los Institutos Nacionales de Salud Oxford Research Investigación Biomédica Centre.JH es el receptor de una beca de investigación de riñón UK Crítico no clínica. Este trabajo fue financiado por las siguientes subvenciones a AB y KW: un Wellcome Trust Grant Program (082519Z07Z), una Fundación Británica del Corazón Grant Program (PG / 10 / 62.28504), y el Programa Marco de la UE 7 (un estudio; BioDRIM). Los autores desean agradecer a Michael Sistema de Salud Sinaí, Toronto Parsons y el Servicio de Citometría de Flujo Core en el Instituto de Investigación Lunenfeld-Tanenbaum, para proporcionar el acceso y el apoyo con el instrumento ImageStream Mark X.
Materiales
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered saline | Various | Varies | |
| Ethylenediamenetetraacetic acid, 0.5 M solution | Thermo Fisher Scientific | AM9260G | |
| Triton X-100 nonionic detergent | Sigma-Aldrich | X100 | |
| Beta-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D8418 | |
| Formaldehyde | Sigma-Aldrich | F1635 | Solution is 37% formaldehyde and so must be diluted 25 times for 1.5% solution |
| Cell strainers, 70 μm pore size | Fisher Scientific | 08-771-2 | |
| Phalloidin-fluorescein isothiocyanate | Sigma-Aldrich | P5282 | |
| 7-aminoactinomycin D | Thermo Fisher Scientific | A1310 | Reconstitute in DMSO |
| Allophycocyanin-conjugated anti-mouse CD90.2 | eBioscience | 17-0902 | |
| Pacific blue-conjugated anti-mouse CD11b | eBioscience | 48-0112 | Pacific blue has been replaced by eFluor 450 |
| Biotinylated anti-mouse CD3 | eBioscience | 13-0032 | |
| Biotinylated anti-mouse MHC class II | eBioscience | 13-5321 | |
| Biotinylated anti-mouse B220 | eBioscience | 13-0452 | |
| Biotinylated anti-mouse CD8 | eBioscience | 13-0081 | |
| Biotinylated anti-mouse CD19 | eBioscience | 13-0193 | |
| Anti-biotin microbeads | Miltenyi Biotec | 130-090-485 | |
| LS columns | Miltenyi Biotec | 130-042-401 | |
| MidiMACS magnetic cell separator | MIltenyi Biotec | 130-042-302 | |
| recombinant mouse GM-CSF | Peprotech | 315-03 | |
| recombinant human TGFβ1 | Peprotech | 100-21 | Human TGFβ1 has activity on mouse cells |
| Amnis ImageStream X Mark II | Amnis/EMD Millipore | N/A | Imaging flow cytometer; details available at http://www.emdmillipore.com/ |
| IDEAS Software | Amnis/EMD Millipore | N/A | Free download (registration required): https://www.amnis.com/index.php/page/Display/login%20%20 |
| Cell culture medium | Various | Varies | |
| Fetal bovine serum | Various | Varies | |
| Cell culture plates | Various | Varies |
Referencias
- Cravedi, P., Heeger, P. S. Immunologic monitoring in transplantation revisited. Curr Opin Organ Transplant. 17 (1), 26-32 (2012).
- Pearson, T. C., et al. The assessment of transplantation tolerance induced by anti-CD4 monoclonal antibody in the murine model. Transplantation. 55 (2), 361-367 (1993).
- Strober, S., Benike, C., Krishnaswamy, S., Engleman, E. G., Grumet, F. C. Clinical transplantation tolerance twelve years after prospective withdrawal of immunosuppressive drugs: studies of chimerism and anti-donor reactivity. Transplantation. 69 (8), 1549-1554 (2000).
- Fussell, S. T., Donnellan, M., Cooley, M. A., Farrell, C. Cytotoxic T lymphocyte precursor frequency does not correlate with either the incidence or severity of graft-versus-host disease after matched unrelated donor bone marrow transplantation. Transplantation. 57 (5), 673-676 (1994).
- Roelen, D. L., et al. Relevance of cytotoxic alloreactivity under different immunosuppressive regimens in clinical islet cell transplantation. Clin Exp Immunol. 156 (1), 141-148 (2009).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J Clin Invest. 106 (1), 145-155 (2000).
- Poggio, E. D., Clemente, M., Hricik, D. E., Heeger, P. S. Panel of reactive T cells as a measurement of primed cellular alloimmunity in kidney transplant candidates. J Am Soc Nephrol. 17 (2), 564-572 (2006).
- Zitzner, J. R., Tambur, A. R. Role of ELISPOT Assays in Risk Assessment Pre- and Post-Kidney Transplantation. Cells. 1 (2), 100-110 (2012).
- Newell, K. A., et al. Identification of a B cell signature associated with renal transplant tolerance in humans. J Clin Invest. 120 (6), 1836-1847 (2010).
- Brouard, S., et al. Identification of a peripheral blood transcriptional biomarker panel associated with operational renal allograft tolerance. Proc Natl Acad Sci U S A. 104 (39), 15448-15453 (2007).
- Sagoo, P., et al. Development of a cross-platform biomarker signature to detect renal transplant tolerance in humans. J Clin Invest. 120 (6), 1848-1861 (2010).
- Halloran, P. F., Famulski, K. S., Reeve, J. Molecular assessment of disease states in kidney transplant biopsy samples. Nat Rev Nephrol. 12 (9), 534-548 (2016).
- Li, L., et al. Identification of common blood gene signatures for the diagnosis of renal and cardiac acute allograft rejection. PLoS One. 8 (12), e82153(2013).
- Khatri, P., et al. A common rejection module (CRM) for acute rejection across multiple organs identifies novel therapeutics for organ transplantation. J Exp Med. 210 (11), 2205-2221 (2013).
- Halloran, P. F., et al. Microarray diagnosis of antibody-mediated rejection in kidney transplant biopsies: an international prospective study (INTERCOM). Am J Transplant. 13 (11), 2865-2874 (2013).
- Mastoridis, S., Issa, F., Wood, K. J. Novel biomarkers and functional assays to monitor cell-therapy-induced tolerance in organ transplantation. Curr Opin Organ Transplant. 20 (1), 64-71 (2015).
- Miqueu, P., et al. Analysis of the peripheral T-cell repertoire in kidney transplant patients. Eur J Immunol. 40 (11), 3280-3290 (2010).
- Morris, H., et al. Tracking donor-reactive T cells: Evidence for clonal deletion in tolerant kidney transplant patients. Sci Transl Med. 7 (272), 272ra210(2015).
- Dustin, M. L., Bromley, S. K., Kan, Z., Peterson, D. A., Unanue, E. R. Antigen receptor engagement delivers a stop signal to migrating T lymphocytes. Proc Natl Acad Sci U S A. 94 (8), 3909-3913 (1997).
- Goldsmith, M. A., Weiss, A. Early signal transduction by the antigen receptor without commitment to T cell activation. Science. 240 (4855), 1029-1031 (1988).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Stoll, S., Delon, J., Brotz, T. M., Germain, R. N. Dynamic imaging of T cell-dendritic cell interactions in lymph nodes. Science. 296 (5574), 1873-1876 (2002).
- Juvet, S. C., Sanderson, S., Hester, J., Wood, K. J., Bushell, A. Quantification of CD4(+) T Cell Alloreactivity and Its Control by Regulatory T Cells Using Time-Lapse Microscopy and Immune Synapse Detection. Am J Transplant. 16 (5), 1394-1407 (2016).
- Ahmed, F., Friend, S., George, T. C., Barteneva, N., Lieberman, J. Numbers matter: quantitative and dynamic analysis of the formation of an immunological synapse using imaging flow cytometry. J Immunol Methods. 347 (1-2), 79-86 (2009).
- Burbach, B. J., et al. Distinct regulation of integrin-dependent T cell conjugate formation and NF-kappa B activation by the adapter protein ADAP. J Immunol. 181 (7), 4840-4851 (2008).
- Markey, K. A., et al. Cross-dressing by donor dendritic cells after allogeneic bone marrow transplantation contributes to formation of the immunological synapse and maximizes responses to indirectly presented antigen. J Immunol. 192 (11), 5426-5433 (2014).
- Moreau, H. D., et al. Dynamic in situ cytometry uncovers T cell receptor signaling during immunological synapses and kinapses in vivo. Immunity. 37 (2), 351-363 (2012).
- Wabnitz, G. H., Nessmann, A., Kirchgessner, H., Samstag, Y. InFlow microscopy of human leukocytes: A tool for quantitative analysis of actin rearrangements in the immune synapse. J Immunol Methods. , (2015).
- Ford, W. L., Simmonds, S. J., Atkins, R. C. Early cellular events in a systemic graft-vs.-host reaction. II. Autoradiographic estimates of the frequency of donor lymphocytes which respond to each Ag-B-determined antigenic complex. J Exp Med. 141 (3), 681-696 (1975).
- Macedo, C., et al. Contribution of naive and memory T-cell populations to the human alloimmune response. Am J Transplant. 9 (9), 2057-2066 (2009).
- Noorchashm, H., et al. A direct method for the calculation of alloreactive CD4+ T cell precursor frequency. Transplantation. 67 (9), 1281-1284 (1999).
- Suchin, E. J., et al. Quantifying the frequency of alloreactive T cells in vivo: new answers to an old question. J Immunol. 166 (2), 973-981 (2001).
- Lee, R. S., et al. Indirect recognition of allopeptides promotes the development of cardiac allograft vasculopathy. Proc Natl Acad Sci U S A. 98 (6), 3276-3281 (2001).
- Pickl, W. F., et al. Molecular and functional characteristics of dendritic cells generated from highly purified CD14+ peripheral blood monocytes. J Immunol. 157 (9), 3850-3859 (1996).
- Inaba, K., et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J Exp Med. 176 (6), 1693-1702 (1992).
- Francis, R. S., et al. Induction of transplantation tolerance converts potential effector T cells into graft-protective regulatory T cells. Eur J Immunol. 41 (3), 726-738 (2011).
- Saitovitch, D., Bushell, A., Mabbs, D. W., Morris, P. J., Wood, K. J. Kinetics of induction of transplantation tolerance with a nondepleting anti-Cd4 monoclonal antibody and donor-specific transfusion before transplantation. A critical period of time is required for development of immunological unresponsiveness. Transplantation. 61 (11), 1642-1647 (1996).
- Faust, S. M., et al. Role of T cell TGFbeta signaling and IL-17 in allograft acceptance and fibrosis associated with chronic rejection. J Immunol. 183 (11), 7297-7306 (2009).
- Yuan, X., et al. A novel role of CD4 Th17 cells in mediating cardiac allograft rejection and vasculopathy. J Exp Med. 205 (13), 3133-3144 (2008).
- Emerson, R. O., Mathew, J. M., Konieczna, I. M., Robins, H. S., Leventhal, J. R. Defining the alloreactive T cell repertoire using high-throughput sequencing of mixed lymphocyte reaction culture. PLoS One. 9 (11), e111943(2014).
- Stanford, R. E., Ahmed, S., Hodson, M., Banner, N. R., Rose, M. L. A role for indirect allorecognition in lung transplant recipients with obliterative bronchiolitis. Am J Transplant. 3 (6), 736-742 (2003).
- Benichou, G., Valujskikh, A., Heeger, P. S. Contributions of direct and indirect T cell alloreactivity during allograft rejection in mice. J Immunol. 162 (1), 352-358 (1999).
- Liu, Z., et al. Contribution of direct and indirect recognition pathways to T cell alloreactivity. J Exp Med. 177 (6), 1643-1650 (1993).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados