Method Article
Método electrofisiológico para grabaciones de abrazadera de voltaje de células enteras
En este artículo
Resumen
Las grabaciones de células enteras de los fotorreceptores de Drosophila melanogaster permiten medir las colisiones oscuras espontáneas, los baches cuánticos, las respuestas macroscópicas a la luz y las relaciones tensión-corriente bajo diversas condiciones. En combinación con las herramientas de manipulación genética de D. melanogaster , este método permite el estudio de la vía omnipresente de señalización de los inositol-lípidos y su objetivo, el canal TRP.
Resumen
Las grabaciones de tensión de células enteras de los fotorreceptores de Drosophila melanogaster han revolucionado el campo de la transducción visual de invertebrados, permitiendo el uso de la genética molecular de D. melanogaster para estudiar los canales de señalización de inositol-lípidos y Potencial de Receptor Transitorio (TRP) al nivel de una sola molécula. Un puñado de laboratorios han dominado esta poderosa técnica, que permite el análisis de las respuestas fisiológicas a la luz bajo condiciones altamente controladas. Esta técnica permite el control sobre los medios intracelulares y extracelulares; La tensión de la membrana; Y la rápida aplicación de compuestos farmacológicos, tales como una variedad de indicadores iónicos o de pH, a los medios intracelulares y extracelulares. Con una relación señal / ruido excepcionalmente alta, este método permite medir las corrientes unitarias oscuras espontáneas y inducidas por la luz ( es decir, espontáneas y cuánticas) y las corrientes inducidas por la luz (LIC) macroscópicas del sinGle D. melanogaster fotorreceptores. Este protocolo describe, con gran detalle, todos los pasos clave necesarios para llevar a cabo esta técnica, que incluye grabaciones electrofisiológicas y ópticas. Se describe el procedimiento de disección de retina de la mosca para el logro de ommatidia aislada ex vivo intacta y viable en la cámara de baño. También se detallan los equipos necesarios para realizar mediciones de células enteras y de fluorescencia. Finalmente, se explican las dificultades en el uso de esta delicada preparación durante experimentos prolongados.
Introducción
Los extensos estudios genéticos de la mosca de la fruta, Drosophila melanogaster ( D. melanogaster) , iniciada hace más de 100 años, han establecido la mosca de D. melanogaster como un modelo experimental extremadamente útil para la disección genética de procesos biológicos complejos. La metodología descrita a continuación combina el poder acumulado de la genética molecular de D. melanogaster con la alta relación señal / ruido de las grabaciones de parches de parche de células enteras. Esta combinación permite estudiar la fototransducción de D. melanogaster como modelo de señalización de inositol-lípidos y regulación y activación de canales de TRP, tanto en el medio nativo como en la mayor resolución de moléculas individuales.
La aplicación del método de registro de células enteras a los fotorreceptores de D. melanogaster ha revolucionado el estudio de la fototransducción de invertebrados. Este método fue desarrollado por Hardie 1 e indepPor Ranganathan y colegas hace 2 ~ 26 años y fue diseñado para explotar las herramientas de manipulación genética extensa de D. melanogaster y utilizarlos para descubrir los mecanismos de la fototransducción y la señalización de inositol-lípidos. Al principio, esta técnica sufría una rápida reducción de la sensibilidad a la luz y un bajo rendimiento de ommatidia durante el proceso de disección, lo que impidió realizar estudios cuantitativos detallados. Más tarde, la adición de ATP y NAD a la pipeta de parche aumentó dramáticamente la idoneidad de la preparación para grabaciones cuantitativas prolongadas. Posteriormente, se realizó una caracterización extensiva del mecanismo de transducción de señal a nivel molecular.
Actualmente, la fototransducción de D. melanogaster es uno de los pocos sistemas en los que la señalización de fosfoinositidos y los canales de TRP pueden estudiarse ex vivo en resolución de molécula única. Esto hace que la fototransducción de D. melanogaster y el yoThodology desarrollado para estudiar este mecanismo un sistema modelo altamente sensible. Este protocolo describe cómo disecar la retina de D. melanogaster y separar mecánicamente la ommatidia aislada de las células del pigmento circundante (glia). Esto permite la formación de un giga-sello y una abrazadera de parche de células enteras en los cuerpos de las células fotorreceptoras. Afortunadamente, la mayoría de las proteínas de señalización están confinadas al rhabdomere y no difunden. Además, hay un buffer de Ca 2+ inmóvil llamado calphotin, localizado entre el compartimiento que señala y el cuerpo celular 3 , 4 , y un nivel alto de la expresión del intercambiador de Na + / Ca 2+ (CalX) en el microvilli. En conjunto, el confinamiento de proteínas al rhabdomere, el tampón de calphotin y la alta expresión del CalX permiten registros de células enteras relativamente prolongados ( es decir, hasta 20 minutos), sin la pérdida de componentes esencialesDel proceso de fototransducción y manteniendo al mismo tiempo una alta sensibilidad a la luz. El siguiente protocolo describe cómo obtener ommatidia aislada y realizar grabaciones de células enteras que parecen preservar las propiedades nativas de la cascada de fototransducción. Se realizaron experimentos de parches de parche de células enteras en cucaracha disociada ( Periplaneta americana ) 6 y grillo ( Gryllus bimaculatus ) 7 ommatidia de manera similar a la descrita para D. melanogaster . Además, se realizaron experimentos de fijación de parche en fotorreceptores disociados del almeja de archivo ( Lima scabra ) y vieira ( Pecten irradians ) de una manera ligeramente diferente a la realizada en D. melanogaster , permitiendo tanto mediciones de células enteras 8 como monocanales 9 . Aquí se describen los principales logros obtenidos en D. melanogaster utilizando esta técnica. La discusión iIncluye la descripción de algunos escollos y limitaciones de esta técnica.
Protocolo
1. Preparación del reactivo
NOTA: Prepare todas las soluciones de acuerdo con las instrucciones de las Tablas 1-4 .
- Llenar una jeringa de 10 ml con solución extracelular (ES o ES-0Ca 2+ , según se requiera, ver tabla 1 ) y mantenerla en hielo.
- Prepare un vial de Trituration Solution (TS, ver Tabla 2 , es decir, ES o ES-0Ca 2+ + FBS y sacarosa) y guárdelo en hielo.
- Preparar suficiente ES para el experimento y mantener esto en hielo hasta que sea necesario.
NOTA: No se requiere perfusión continua del baño, por lo que el volumen de ES no necesita ser más de unas pocas docenas de mL. - Utilizando un filtro de PVDF de 22 μm, cargue la solución intracelular (ver Tabla 3 o Tabla 4 ) en una jeringuilla de 1 ml con una punta alargada de relleno de electrodo. Mantenga esto en hielo.
2. Configuración general de las herramientas de disección
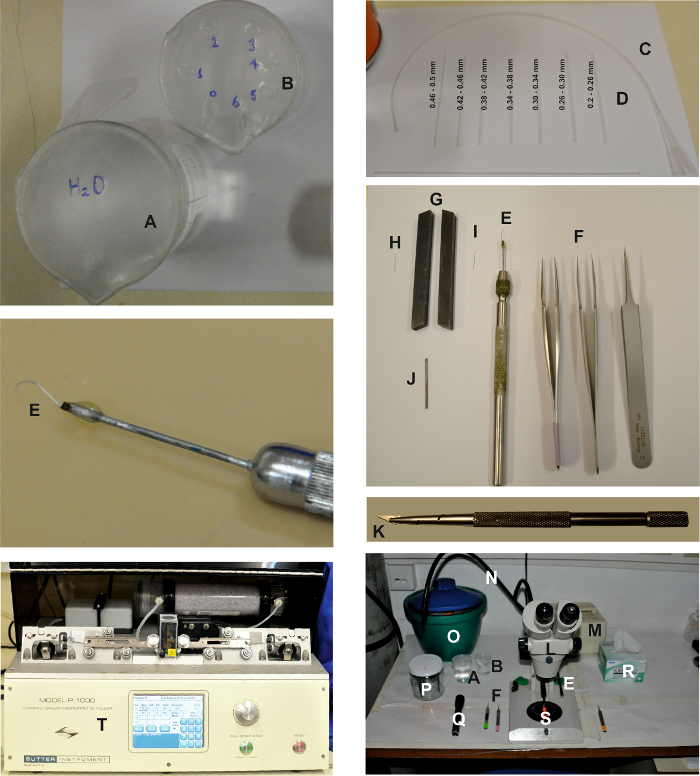
Figura 1: Herramientas y dispositivos necesarios para realizar la preparación aislada de Ommatidia. Las imágenes muestran los diversos dispositivos necesarios para crear la preparación de ommatidia aislada, como se describe en el protocolo detallado anterior. Dos vasos de precipitados, uno llenado de agua ( A ) y el otro lleno de etanol ( B ) para limpiar las pipetas de trituración ( D ), que están conectadas a la tubería ( C ). Las herramientas de disección son: 2 pares de pinzas finas y 1 par de pinzas gruesas ( F ) y una cuchara de retina ( E ). Con el fin de preparar el scooper de retina, se presiona una aguja de microdisección ( H ) entre dos herramientas de torno que actúan como un vicio ( G ) para aplanar la parte superior de la aguja ( I ). Entonces está conectado a un pi alargado Ece de metal con pegamento ( J ) y montado sobre un soporte de aguja ( E ). Cuchilla de la hoja de afeitar y soporte: Romper y montar una pequeña viruta triangular de una cuchilla de afeitar usando un sostenedor de la hoja de afeitar ( K ). El área de trabajo de disección está compuesta por una fuente de luz binocular ( L ) y una fuente de luz roja fría (( M), ) con dos guías de luz ( N ). Se colocan a ambos lados del binocular las herramientas de disección, incluyendo las pinzas ( F ), la retina scooper ( E ), los vasos ( A y B ), una linterna con filtro rojo ( Q ) y delicados limpiaparabrisas ( R ). También se colocan en la mesa un cubo de hielo con el ES, el FBS-ES, las jeringas de solución intracelular, la placa de Petri de 60 mm ( S ) y el soporte de electrodo ( P ). Los electrodos de registro se extraen con un extractor horizontal ( T ).E.com/files/ftp_upload/55627/55627fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
- Construir una cuchara de retina para aislar la retina.
- Insertar el punto (1-4 mm) de una aguja de micro disección (aguja entomológica, 12 mm de longitud, 0.1 mm de diámetro) entre las dos mordazas del tornillo y aplanarlo golpeando con un martillo pequeño.
- Montar la aguja aplastada en un soporte de aguja microdisectable (vea la Tabla de Materiales ).
- Usando un par de pinzas, curve el extremo aplanado de la aguja para formar un gancho con una curvatura de ~ 2,5 mm.
- Crear pipetas de trituración para la separación ommatidia.
- Colocar un capilar de vidrio de 1,2 x 0,68 mm (OD x ID) sobre una llama abierta y pulirlo con fuego para reducir su apertura.
- Mida el tamaño de la abertura capilar bajo un microscopio. Ordenar las pipetas de trituración ommatidial creadas en seveN grupos según el tamaño de sus aberturas ( es decir, 0,2-0,5 mm). Almacenarlos en recipientes apropiados separados ( por ejemplo , tubos de ensayo).
- Llenar un vaso pequeño con agua destilada doble (DDW) y otro vaso pequeño con etanol al 70%. Cubrir cada vaso con una lámina de parafina.
- Punch un pequeño agujero en la hoja de la película de parafina que cubre el vaso de precipitados DDW (véase la figura 1A ).
- Punch siete agujeros pequeños en la hoja de la película de parafina que cubre el vaso de etanol y el número de los agujeros de 0 a 6 (ver la figura 1B ).
- Coloque una pipeta de trituración ommatidial de cada grupo de tamaño en cada agujero de la película de parafina, de manera que la pipeta con la abertura más grande se encuentre en el 0º agujero y la pipeta con la abertura más pequeña se encuentre en el 6º agujero.
- Conecte una punta de pipeta de 200 μL de plástico a un tubo de polietileno de 35 cm de largo, 1,57 x 1,14 mm (OD x ID). ConexiónT el otro extremo de la tubería a una de las pipetas de trituración ommatidial con la abertura más grande ( es decir 0,46 - 0,5 mm), asegurándose de que el extremo puntiagudo de la pipeta de trituración no esté mirando hacia el tubo.
- Prepare pipetas de registro de células enteras tirando de las pipetas de pinza de remiendo de un filamento de borosilicato de 1 x 0,58 mm (OD x ID) que contenga capilares de vidrio.
NOTA: La resistencia de las pipetas debe ser de 8-15 MΩ cuando se usa solución intracelular basada en gluconato de potasio (IS1). Puede utilizarse cualquier extractor de pipeta de parche adecuado (por ejemplo, véase la Tabla de Materiales ). El pulido de fuego no es necesario. - Prepare una cámara de grabación (vea la Figura 2 ) fijando un cubreobjetos (ver la Tabla de Materiales ) al fondo de la cámara del baño usando parafina fundida o grasa de silicona de alto vacío. Utilice cualquier cámara casera o comercial adecuada que permita el acceso de los electrodos y la perfusión.
- Monte el baño en el escenario de un microscopio invertido. Coloque el tubo del sistema de perfusión, el sistema de succión y la tierra ( es decir , el hilo Ag-AgCl / pellet) en el baño (vea la Tabla de Materiales y la Figura 2 ).
- Coloque dos pares de pinzas # 5 finas ( Figura 1 ) en la superficie de trabajo para su uso durante la disección de la retina y los pasos de aislamiento ommatidia.
3. D. melanogaster Criando
- Levante D. Melanogaster vuela a una baja densidad de población ( es decir, ~ 20 moscas en una botella de 6 onzas) en botellas que contengan harina de maíz estándar a 19-24 ° C.
NOTA: Es preferible trabajar con moscas oscuras adaptadas. Para mantener una alta sensibilidad a la luz, reducir la diversidad y evitar la degeneración de la retina en las moscas mutantes. - Detrás de las moscas en la oscuridad durante al menos 24 h antes del experimento.
NOTA: Las moscas utilizadas para los experimentos deben(<2 h) y todavía suave, pálido, y mostrar el meconio. Ommatidia también se puede preparar fácilmente a partir de pupas, aunque su sensibilidad a la luz es entonces fuertemente dependiente de la edad de 10 años.
4. Disección de Retina y Aislamiento de Ommatidia: Opción 1
NOTA: Realice todos los pasos siguientes bajo el microscopio de zoom estereoscópico usando una amplificación adecuada para ver correctamente la preparación (Ver Figura 1 ).
- Coloque cuatro gotas de ES-0Ca 2+ y una gota de solución de TS en una placa de Petri de 60 mm que se ha dado vuelta.
- Usando pinzas ásperas, coger un recién cerrado (<2 h después de eclosión) volar por sus alas o cuerpo. A partir de este punto, realice todos los procedimientos rápidamente y bajo iluminación de color rojo tenue a 20 ± 1 ° C.
- Mientras sigue agarrando la mosca con las pinzas rugosas, utilice el primer par de pinzas finas para separar la cabeza de la mosca del cuerpo. SubmeLa cabeza en la primera gota ES-0Ca 2+ .
- Disecar la cabeza por la mitad a lo largo del plano sagital usando el segundo par de finas pinzas. Asegúrese de que, al final de este paso, ambos ojos estén intactos.
- Transferir la mitad de la cabeza a la segunda gota ES-0Ca 2+ y la otra mitad a la tercera gota ES-0Ca 2+ .
- Usando las pinzas finas, quitar la mayor cantidad de tejido alrededor del ojo como sea posible y asegúrese de que no se cause daño a la retina.
- Agarrar firmemente el borde de una córnea con las pinzas finas y sacar la retina con la cuchara.
NOTA: Al completar este paso, la córnea se dejará vacía e intacta, separada de una retina intacta. - Enjuague la pipeta de trituración conectada a la tubería con DDW y llene la pipeta con una pequeña cantidad de ES-0Ca 2+ de la cuarta gota.
NOTA: Este paso debe realizarse cada vez que se use una nueva pipeta separadora ommatidia y se retireM el vaso de etanol (la solución que llena la pipeta debe coincidir con la solución en la que está sumergida la retina). - Aspirar suavemente por la boca para extraer la retina aislada en la pipeta. Tenga mucho cuidado de no aspirar burbujas de aire en la pipeta.
- Transferir la retina aislada a la gota de TS. Realice también los pasos 4.6-4.10 en el segundo ojo.
- Limpie las gotas de ES-0Ca 2+ usando toallitas delicadas, dejando sólo la gota de TS conteniendo ambas retina en la placa de Petri. Añadir seis gotas más de TS a la parte superior de la placa de Petri. Transferir ambas retinas a una de las otras gotas de TS.
- Reemplace la pipeta de trituración con una pipeta de una abertura de menor diámetro. Enjuague como se describe en el paso 4.8, utilizando TS como solución para llenar la pipeta.
- Aspirar y expirar rápidamente y repetidamente ambas retina en la solución para comenzar la separación de ommatidia aislada despojada de células de pigmento de toda la retina.
NOTA: el omma aisladoTidia son visibles en la caída de TS, ya medida que progresa el proceso de aislamiento, la caída de TS se hace menos translúcida. - Transfiera las restantes retina a la próxima gota de TS. Llene la pipeta con toda la gota TS anterior (que contiene la ommatidia aislada) y expirar la gota en la cámara del baño.
- Repita los pasos 4.12-4.14 para lograr máxima ommatidia aislada. Espere aproximadamente 1 min para permitir que la ommatidia aislada se hunda y se una al fondo de la cámara del baño.
- Usando el sistema de perfusión, inicie el flujo de ES-0Ca 2+ con Ca2 + 1,5 mM en la cámara del baño. Asegúrese de que la cámara esté completamente llena de la solución, de abajo hacia arriba, y que el suelo esté completamente sumergido en la solución. Continúe lavando el baño 4-5x.
5. Disección de Retina y Aislamiento de Ommatidia: Opción 2
Nota: Realice todos los pasos siguientes bajo el microscopio de zoom estereoscópico, utilizando un ampliAdecuada para ver adecuadamente la preparación (ver Figura 1 ).
- Preparar un chip y un porta-cuchilla. Romper y montar un pequeño chip triangular de una hoja de afeitar con un portacuchillas ( Figura 1 ).
- Prepare un plato / bloque de disección de silicona de acuerdo con las instrucciones del fabricante (vea la Tabla de Materiales ).
- Para la disección, cree una gota grande (<0,5 ml) de solución ES en el bloque de disección de silicona. Añadir dos gotas de "reservorio" (~ 50 μl cada una) de solución de TS a una placa de Petri de 60 mm
- Inmovilice una mosca recién cerrada (<2 h post-eclosión) en un tubo de vidrio sobre hielo y recójala por sus alas usando pinzas. A partir de este punto, realice todos los procedimientos rápidamente y bajo iluminación de color rojo tenue a 20 ± 1 ° C.
- Sosteniendo la mosca con las pinzas, cortar la cabeza de la mosca con un chip de hoja de afeitar montado en un soporte. Recoger un alfiler de insectos (12 mm de largo,0,1 mm de diámetro) con las pinzas y perforar la cabeza entre los ojos.
- Sumergir brevemente la cabeza en etanol al 70%; Esto evita que se formen burbujas de aire en la superficie de la cabeza / ojo. Pin la cabeza debajo de la gota de ES en el plato de disección de silicona.
- Cortar ambos ojos usando el chip de la hoja de afeitar usando un movimiento de aserrado a lo largo de la línea del borde frontal del ojo.
- Agarrar firmemente el borde de una córnea con las pinzas finas.
- Recoger la retina con la cuchara.
NOTA: Al completar este paso, la córnea se dejará vacía e intacta, separada de una retina intacta. - Sin dañar la retina, use las pinzas y scooper para quitar suavemente los sacos de aire adheridos y exceso de tejido cerebral.
NOTA: La preparación de retina aislada también es útil para análisis Western blot de proteínas 11 de retina no específicas, histología de montaje completo y formación de imágenes de retina total. También se pueden realizar grabaciones de pinzasOtoreceptors de toda la retina 12 . - Tomar la pipeta de trituración con el diámetro más grande, conectarla a la tubería y rellenar la pipeta con una pequeña cantidad de TS de una de las gotas del depósito en la placa de Petri por succión suave ( es decir, por la boca). Realice este paso cada vez que se use una nueva pipeta trituradora ommatidia.
- Golpe suavemente el TS sobre las dos retinae por la boca y después dibuje las retinae aisladas en la pipeta usando succión suave. Tenga cuidado de no introducir burbujas de aire en la pipeta.
- Transferir las retina aisladas a la placa de Petri, formando una pequeña gota (~ 20 μL), y lavarlas una o dos veces con TS de una de las gotas del reservorio.
- Incubar las retina en la oscuridad durante 20-25 min.
- Reemplazar la pipeta de trituración ommatidia con una pipeta con una abertura de menor diámetro (utilizando una TS fresca de una de las gotas del depósito como en el paso 4.6 para rellenar la pipeta).
- RápidamenteAspirar y expirar ambos retina en una pequeña gota (~ 20 μL) para comenzar la separación de la ommatidia aislada.
NOTA: En la primera etapa, la glia pigmentada circundante se desintegrará, dejando pequeños restos visibles en la solución. - Después de que se hayan acumulado pequeños desechos substanciales, pero antes de que se hayan separado muchos ommatidios, use TS fresco de una de las gotas del depósito y transfiera las retina a una nueva gota pequeña.
- Seleccione una pipeta de trituración de menor diámetro, rellene y continúe triturando.
NOTA: A medida que la ommatidia comienza a separarse, sus formas alargadas deben ser claramente visibles bajo el alto poder del estereomicroscopio. Si es necesario, siga cambiando las pipetas de trituración a diámetros más pequeños hasta que un buen rendimiento de ommatidia sea visible - Una vez que un rendimiento razonable de ommatidia son visibles y la gota ya no es translúcida, llenar la pipeta con toda la gota que contiene la ommatidia aislada y expirar la gota suavemente en laParte inferior de la cámara de baño precargada con ES.
- Espere aproximadamente 1 min para permitir que la ommatidia aislada se hunda y se asiente en el fondo de la cámara del baño.
- Usando el sistema de perfusión, inicie el flujo de ES en la cámara del baño. Asegúrese de que la cámara esté completamente llena de la solución, de abajo hacia arriba, y que el suelo esté totalmente sumergido en la solución. Continúe lavando el baño 4-5x.
NOTA: A partir de entonces, no se requiere perfusión continua, aunque el baño debe ser enjuagado brevemente antes de introducir una nueva pipeta de parche.
6. Grabación de células enteras

Figura 2: Visión general de la configuración electrofisiológica y óptica. La instalación contiene una jaula de Faraday de hierro, pintada de negro ( F ). La parte delantera está cubierta con una cortina negra con malla de cobre dentro. Esta configuraciónPermite que la preparación quede totalmente cerrada de cualquier luz extraviada y es adecuada para registrar golpes espontáneos oscuros. El microscopio de fluorescencia invertido ( A ) se fija a una mesa anti-vibración ( E ). El aparato de grabación de fotorreceptor consiste en una cámara de baño de vidrio acrílico ( O ) hecha en casa con una entrada de perfusión ( Q ), una pipeta de succión ( S ) y una masa de plata-cloruro de plata ( P ). La cámara del baño se monta en la platina del microscopio ( T ) con un adaptador hecho en casa. La pipeta de registro se conecta a través de un alambre de plata-cloruro de plata a un soporte de vidrio acrílico, que está conectado a la etapa del cabezal del amplificador ( C ). La etapa de cabeza se monta entonces en un micromanipulador grueso que está montado en un micromanipulador mecánico XYZ fino ( B ). El sistema de perfusión ( D ) está compuesto por un juego de jeringas, mientras que el flujo de líquidoD está controlada por válvulas de presión ( H ). El bastidor está conectado eléctricamente a la misma masa central a la que está conectado todo el equipo dentro de la jaula de Faraday y consiste en un amplificador ( N ), un osciloscopio ( J ), un generador de impulsos / funciones ( K ), un A D ( L ), un controlador de perfusión ( I ) y una rueda de filtro y un controlador de obturador ( M ). Para los experimentos de formación de imágenes, una cámara CCD refrigerada (-110 ° C, véase la tabla de materiales ) está conectada a través de un puerto lateral ( G ). Haga clic aquí para ver una versión más grande de esta figura.
NOTA: Durante todos los pasos siguientes, use sólo iluminación de luz roja tenue y asegúrese de que la exposición de la ommatidia a la luz es mínima ( es decir ,Apague la fuente de luz de disección y la iluminación roja de la cámara utilizada para ver la ommatidia al realizar tareas que no requieren ver el ommatidio). Además, realice todos los pasos siguientes de acuerdo con el protocolo electrofisiológico estándar.
- Bajo un microscopio invertido (objetivo 40X), inspeccione cuidadosamente toda la ommatidia en el baño y elija un ommatidio adecuado para el experimento.
- Asegúrese de que la membrana externa del ommatidio es lisa e intacta, que el eje largo está aproximadamente en ángulo recto con respecto a la dirección de aproximación del electrodo (como se ve en la figura 3A ) y que la sección distal del ommatidio no está rodeada por ninguna Exceso de tejido. Coloque el ommaticio elegido en el eje óptico de la lente objetivo (en el centro del campo de visión) para asegurar una iluminación uniforme.
- Llenar una pipeta con una solución intracelular (IS1 o IS2).
NOTA: Para meaAsegúrese de que la respuesta de intensidad y el análisis de impacto, utilice IS1. Para medir el potencial de inversión de los canales sensibles a la luz, utilice IS2. - Monte la pipeta de parche sobre el soporte del electrodo.
- Soplar en la pipeta por la boca, a través del tubo conectado al sostenedor del electrodo, haciéndolo llenar con la presión positiva. Cierre la válvula del tubo para mantener la presión.
- Usando el micromanipulador, inserte el electrodo en la cámara del baño.
- Orientar el electrodo cerca de la sección distal del ommatidio, de manera que no haya contacto entre el electrodo y el ommatidio, hasta que se pueda observar un pequeño hoyuelo (debido a la presión positiva en la pipeta) en el ommatidio.
- Abra el software de grabación (consulte la Tabla de materiales ). Abra el "módulo de prueba de membrana" para aplicar pulsos de voltaje cuadrado continuo de 2 mV a una velocidad de 100 Hz.
- Ajuste el potencial de unión a "cero", ajustando el kno apropiadoB en el amplificador de la abrazadera del remiendo para poner la base del pulso cuadrado a la corriente "cero"
NOTA: La configuración electrofisiológica incluye una etapa de cabeza ( es decir , amplificación de primera etapa) conectada a un amplificador ( es decir , amplificación de segunda etapa). La señal analógica amplificada se convierte en una señal digital utilizando el convertidor A / D, que es controlado por software instalado en un PC. - Suelte la presión positiva en la pipeta abriendo la válvula del tubo conectado al soporte del electrodo. Suavemente crear presión negativa en la pipeta por succión fuera del tubo, lo que lleva a la asociación de la pipeta a la membrana celular. Cierre la válvula del tubo para mantener la presión.
- Asegúrese de que la resistencia del electrodo vista en la pantalla del ordenador se eleve a 100 - 150 MΩ. Libere la presión negativa en la pipeta abriendo manualmente la válvula del tubo conectado al soporte del electrodo.
- Asegúrese de que elLa resistencia al ectrodo se eleva a al menos 1-2 GΩ.
NOTA: En este punto, se ha formado un sello entre el electrodo y el fotorreceptor. - Desplace las corrientes capacitivas de la pipeta ajustando el mando apropiado en el amplificador de la abrazadera de parche.
- Crear rápidos, cortos y fuertes ataques de presión negativa en el electrodo, succión por la boca fuera del tubo conectado al soporte del electrodo para "romper" en la membrana del fotorreceptor y crear una configuración de células enteras. Alternativamente, utilice el botón "Zap" para aplicar pulsos eléctricos rectangulares cortos, comenzando con una duración de "0,1 ms", o aplique una combinación de ambos métodos.
NOTA: La generación de la configuración de células enteras se revela mediante un aumento repentino en la capacidad de la pipeta (típicamente ~ 60 pF para un fotorreceptor R1-6 de tipo salvaje, una capacitancia de sólo ~ 20 pF indica una grabación de un fotorreceptor R7, una capacitancia por encima ~ 90 pF indica una grabación de dosFotorreceptores). - Ajuste el potencial de retención del fotorreceptor a la tensión requerida (normalmente, -70 mV), manualmente usando el mando apropiado en el amplificador de la abrazadera de parche.
NOTA: Es posible realizar este paso después de haber obtenido un sello (paso 6.11) y antes de que se haya logrado la configuración de célula completa. - Desplazar las corrientes capacitivas y la resistencia en serie (un valor de resistencia en serie medido mayor de 25 MΩ indica que la pipeta del electrodo ha sido obstruida) y, si es necesario ( es decir, para corrientes más grandes), aplique la compensación de resistencia en serie usando los botones apropiados en el amplificador .
- Cierre la cortina delantera negra de la jaula de Faraday para obtener la oscuridad máxima y el aislamiento eléctrico.
- Comenzar el proceso de grabación utilizando el software y administrar estímulos luminosos y / o sustancias farmacológicas de acuerdo con el procedimiento experimental deseado.
7. Simultáneo WhOle-Cell Recordings y Ca 2+ Imaging
- Para los indicadores de Ca 2+ genéticamente codificados, aislar la ommatidia como se describe anteriormente utilizando melanogaster D. moscas que expresan GCaMP6f [ 13] . Utilice una cámara CCD (consulte la Tabla de Materiales ) para la medición de fluorescencia y asegúrese de que el microscopio esté equipado con filtros de excitación y emisión adecuados y un espejo dicroico (ver Tabla de Materiales ).
- Para el uso del indicador de Ca 2+ exógeno ( Figura 4 , véase la Tabla de Materiales ), aísle la ommatidia como se ha descrito anteriormente. Además, asegúrese de que la solución de la pipeta incluye un indicador de calcio de 20-100 μM.
- Utilice el software de imágenes (consulte la Tabla de materiales ) para adquirir imágenes a una velocidad de 40 Hz. Realizar la adquisición de la imagen durante un período de oscuridad de 10 s, seguido de una luz intensa de 2 sMulación.
- Utilice el software de creación de imágenes y defina una región de interés (ROI). Mida la intensidad de la fluorescencia en el ROI. Promediar la fluorescencia oscura (F D ) y restarla de las grabaciones de fluorescencia durante la estimulación de la luz (F L ) (F L -F D ). Normalizar estas mediciones de acuerdo con la intensidad de fluorescencia al inicio de la estimulación de la luz (F L 0 ).
Resultados
El método descrito ha permitido el registro preciso de las corrientes unitarias fundamentales que generan golpes cuánticos espontáneos y evocados por la luz, que suman para producir la respuesta macroscópica a la luz, en condiciones definidas. También permitió la comparación entre las moscas de tipo salvaje y mutantes que tienen defectos en las moléculas críticas de señalización ( Figuras 3 y 5 ) 14 , 15 , 16 , 17 , 18 . Además, la capacidad de medir el potencial de inversión en condiciones bi-iónicas reveló propiedades biofísicas fundamentales de TRP y TRP-como (TRPL) canales [ 18 , 19] . También permitió la medición de los efectos de las sustituciones de aminoácidos en la región de poros de TRP que modificó su Ca 2 +Permeabilidad 20 .
La respuesta lumínica obtenida por las grabaciones de células enteras de pinzas de parche depende linealmente de la intensidad de la luz durante al menos 4 órdenes de magnitud. Esto no pudo ser resuelto mediante el uso de ERG y métodos de registro intracelular. Por consiguiente, una serie de respuestas a breves destellos de intensidad creciente y una gráfica de la función de respuesta de intensidad revelaron una linealidad estricta de la respuesta instantánea con una intensidad luminosa creciente. La linealidad estricta sostiene por lo menos varios cientos de pA, pero es discutible si a partir de entonces es la linealidad o control de la abrazadera que se rompe ( Figura 6 ). Estos resultados sugieren que las respuestas macroscópicas a la luz son una suma lineal de las respuestas unitarias a la luz ( es decir, golpes cuánticos).
Se ha establecido bien mediante grabaciones de voltaje que la luz tenue estimulación indFluctuaciones de voltaje discretas ( es decir, golpes cuánticos) en la mayoría de las especies de invertebrados. Los golpes cuánticos de D. melanogaster resultan de la apertura concertada de ~ 15 canales TRP y ~ 2 canales TRPL en el pico de la protuberancia 18 . Cada bache es generado por la absorción de un solo fotón, mientras que la respuesta macroscópica a luces más intensas es la suma de estas respuestas elementales 14 , 21 . Los baches varían significativamente en latencia, tiempo y amplitud, incluso cuando las condiciones de estímulo son idénticas. La generación de topes es un proceso estocástico descrito por las estadísticas de Poisson, en el que cada fotón efectivamente absorbido provoca sólo una protuberancia. La relación single-bump de fotón único requiere que cada paso en la cascada incluya no sólo un eficiente mecanismo de activación, sino también un mecanismo de "apagado" igualmente eficaz. La ventaja funcional es la producción de unContador de fotones muy sensible con una respuesta transitoria rápida muy adecuada tanto a la sensibilidad como a la resolución temporal requerida por el sistema visual. El requisito de un mecanismo de apagado eficaz se revela cuando el fotopigmento activo ( es decir , metarhodopsina, M) o su objetivo, el Gq $ α $, falla en inactivarse y conduce a la producción continua de bultos mucho tiempo después de que se apaga la luz ( Figura 3 ) 15 , 22 , 23 , 24 .
La protuberancia representa la actividad cooperativa de los canales TRP / TRPL en un microvillus. Como tal, cualquier hipótesis de activación de canal debería explicar también la activación cooperativa del canal. Recientemente, Hardie y sus colegas han demostrado que la luz evoca contracciones rápidas de los fotorreceptores, lo que sugiere que la sensibilidad a la luzLos canales e (TRP / TRPL) pueden ser cerrados mecánicamente 25 . Esta activación mecánica, junto con los protones observados liberados por PIP mediada por la hidrólisis PIP 2 , promover la apertura de los canales TRP / TRPL y explicar la naturaleza cooperativa de la producción de topes [ 26] . En la actualidad, los fotorreceptores de melanogaster de D. melanogaster son uno de los pocos sistemas en los que se pueden estudiar los canales de señalización de fosfoinositidos y TRP in vivo , lo que hace que la fototransducción de D. melanogaster y la metodología desarrollada para estudiar este mecanismo sean un sistema modelo muy valioso.
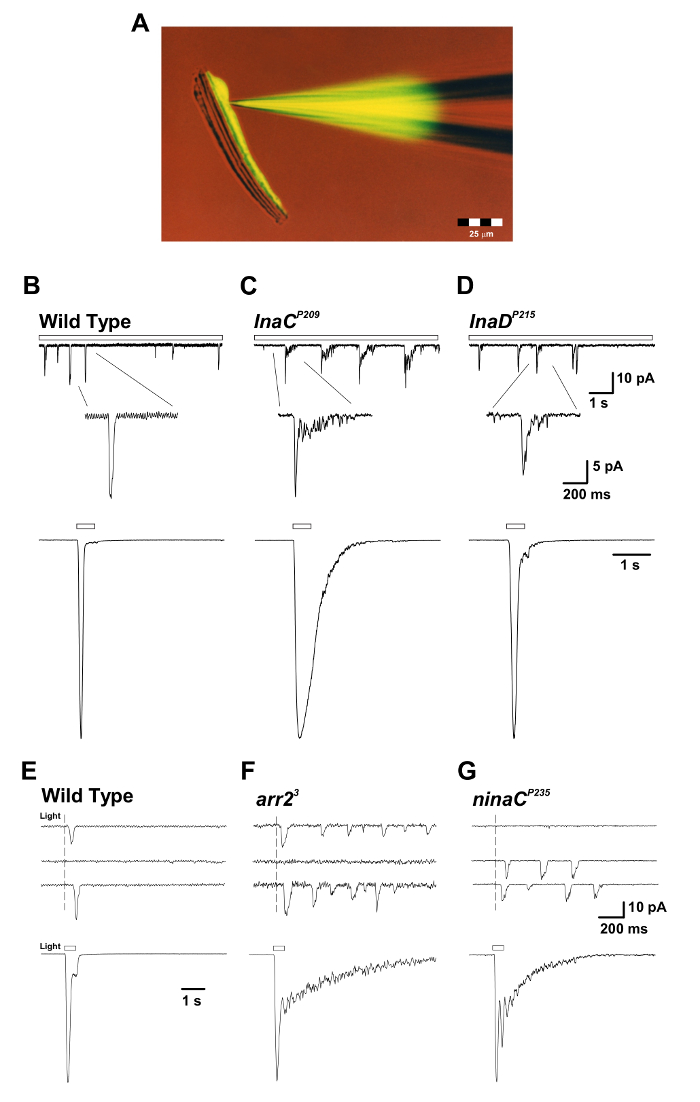
Figura 3: Los mutantes inaC P209 e inaD P215 revelan la terminación de respuesta lenta de la respuesta macroscópica a la luz y de los solapamientos de un solo Quantum. ( A ) El aislado prema de ommatidiumCon una pipeta de parche llena de colorante Lucifer Yellow CH fluorescente (excitación: 430 nm, emisión: 540 nm) durante una grabación de células enteras. Obsérvese que el colorante fluorescente difundió y etiquetó un solo cuerpo de célula fotorreceptor y que los cuerpos de células fotorreceptoras se separan de sus axones alargados pero aún mantienen la viabilidad. Esta preparación es adecuada para grabaciones simultáneas de células enteras y experimentos de formación de imágenes. ( BD ) Paneles superiores: Respuesta de voltaje de células enteras a las luces débiles continuas (barra abierta) en WT, inaC P209 y inaD P215 . Se observa una terminación lenta de los baches en los mutantes inaC P209 e inaD P215 en relación con las moscas WT. La inserción de abajo muestra la forma ampliada de solapas. Paneles inferiores: La célula entera normalizada registró las respuestas macroscópicas a un pulso luminoso de 500 ms (1,5 x 10 5 fotones por s) del tipo salvaje anterior Y moscas mutantes. (EG) Paneles superiores: Respuestas de choque cuántico con voltaje de la célula entera a una luz breve (1 ms), provocando respuestas de un solo fotón en las moscas mutantes de tipo salvaje, arr2 3 y ninaC P235 . Obsérvese el tren de colisiones observado en las moscas mutantes arr2 3 y ninaC P235 en respuesta a una sola absorción de fotones. Paneles inferiores: El voltaje de la célula entera sujetó las respuestas normalizadas a un pulso luminoso de 500 ms (1,5 x 104 fotones / s) en los mutantes correspondientes. Obsérvese la terminación lenta de las respuestas macroscópicas observadas en arr2 3 Y ninaC P235 mutante moscas en relación con WT. Haga clic aquí para ver una versión más grande de esta figura.
D / 55627 / 55627fig.jpg "/>
Figura 4: Celular Ca 2 + Dynamics Siguiendo la señal inducida Ca 2 + Influjo es afectado por Calphotin. Una serie de tiempo de fotorreceptor imágenes de tipo salvaje y Cpn 1% moscas que muestra la fluorescencia del Ca 2 + indicador durante la estimulación de luz. Las imágenes de intensidad bruta se representan mediante la codificación de falsos colores (barra = 10 μm, las puntas de flecha indican la pipeta). Figura reimpresa con permiso de Weiss et al. 4 . Haga clic aquí para ver una versión más grande de esta figura.
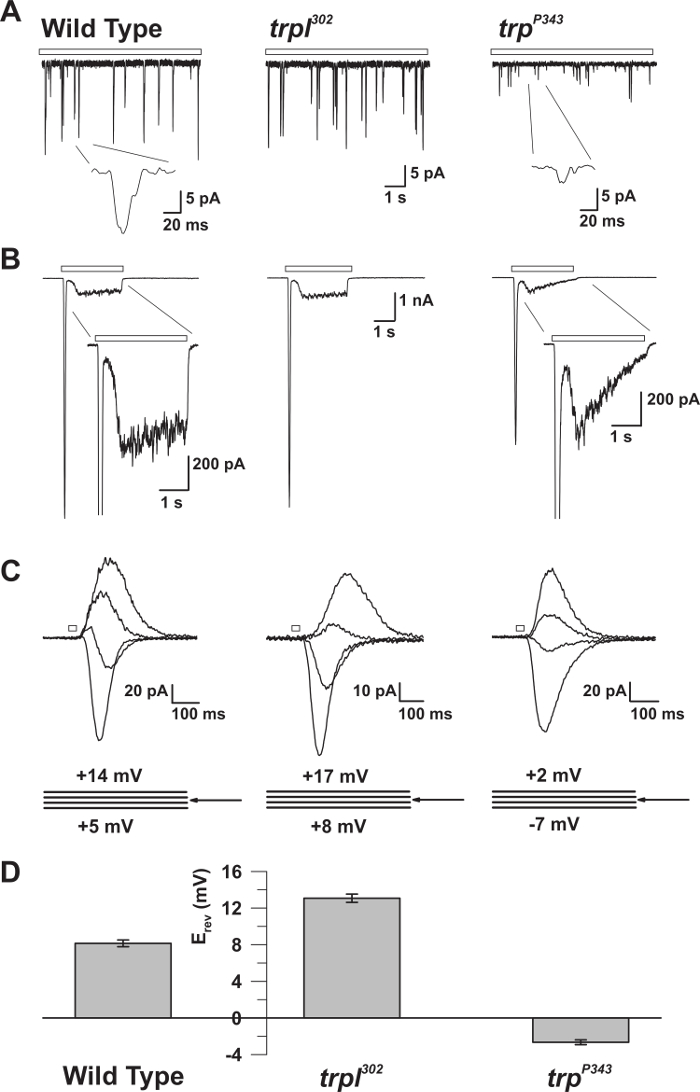
Figura 5: Propiedades electrofisiológicas de los mutantes WT, trp y trpl. ( A ) Abrazadera de voltaje de la célula entera reco(Bum) en WT, trpl 302 y trp P343 moscas mutantes nulas. Se observan amplitudes altamente reducidas de trp P34 3 protuberancias. Recuadro: Se muestran los solos quánticos amplificados únicos de las moscas mutantes nulas de tipo salvaje y trp P343 . ( B ) Grabaciones de sujeción de voltaje de células enteras en respuesta a un impulso luminoso de 3 s de tipo salvaje y los mutantes correspondientes. Se observa la respuesta transitoria de estado estacionario del mutante trp P343 . Inserción: se muestran las respuestas de luz ampliada de WT y mutante trp P343. ( C ) Una familia de corrientes inducidas por la luz superpuestas de las cepas de mosca anteriores, obtenidas en respuesta a un impulso de luz de 20 ms, a intervalos de voltaje de 3 mV, medida alrededor del potencial de inversión (E rev ). ( D ) Un histograma que representa la media E rev de tipo salvaje y los diversos mutanTs Las barras de error son el SEM El potencial de inversión (E rev ) de WT está entre el positivo E rev de trpl 302 , que expresa sólo TRP, y el E rev del trp P343 mutante nulo, que expresa sólo TRPL. Haga clic aquí para ver una versión más grande de esta figura.
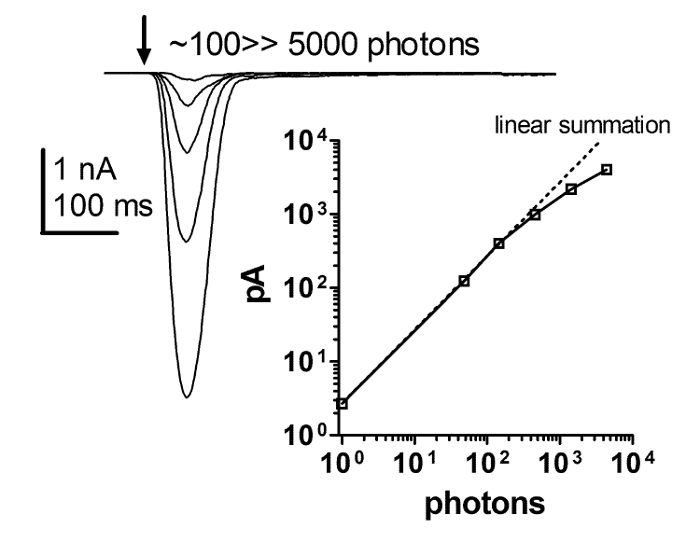
Figura 6: La respuesta del flash es estrictamente lineal con el aumento de la intensidad de la luz.
Una serie de respuestas de corriente a breves destellos de aumento de la intensidad de luz y un gráfico de la dependencia de la amplitud de pico de la respuesta de luz sobre la intensidad creciente de luz breve parpadea. Esta relación revela una linealidad estricta entre la respuesta instantánea y el aumento de la intensidad luminosa. Esta estricta linealidadSe mantiene hasta por lo menos varios cientos de pA, con una intensidad de luz que abarca más de 4 órdenes de magnitud, mientras que es discutible si es la linealidad o el control de la abrazadera que se rompe a continuación. Haga clic aquí para ver una versión más grande de esta figura.
| PH | 7,15 (ajustar con NaOH) |
| Reactivo | Concentración (mM) |
| NaCl | 120 |
| KCl | 5 |
| MgCl $ ₂ $ | 4 |
| TES | 10 |
| Prolina | 25 |
| Alanina | 5 |
| Almacenar a -20 ° C. | |
| Nota: Esta solución es nominalmente libre de Ca2 + pero no tiene tampones de Ca2 + añadidos y por lo tanto tendrá aproximadamente 5 - 10 μM de traza de Ca2 + . Solución extracelular (ES) = ES-0Ca2 + con CaCl2 1,5 mM, preparada añadiendo CaCl2 a partir de una solución madre 0,5 o 1 M a ES-0Ca2 + . | |
Tabla 1: Solución extracelular libre de Ca +2 (ES). Descripción química y las cantidades específicas requeridas para producir ES libre de Ca +2 .
| Reactivo | Cantidad |
| FBS | 15 ml |
| Sacarosa | 1,5 g |
| Se divide en alícuotas de 150 μL en viales de 1,5 ml y se almacena a -20ºC. 76; C. | |
| Solución de trituración (TS) | Llenar 1 vial de 150 mL de la solución madre con 1.350 mL ES o ES-0Ca 2+ , para que coincida con la solución utilizada durante la disección. |
Tabla 2: Suero Bovino Fetal (FBS) + Sacarosa - Solución Stock. Descripción química y las cantidades específicas requeridas para producir suero bovino fetal (FBS) + solución de sacarosa - stock.
| PH | 7,15 (ajustar con KOH) |
| Reactivo | Concentración (mM) |
| Gluconato de potasio (Kglu) | 140 |
| MgCl $ ₂ $ | 2 |
| TES | 10 |
| La sal de magnesio ATP (MgATP) | 4 |
| GTP (Na _ { 2 } GTP) | 0,4 |
| Β-nicotinamida adenina dinucleótido hidrato (NAD) | 1 |
| Almacenar a -20 ° C. |
TABLA 3 Solución intracelular (IS1). Descripción química y las cantidades específicas requeridas para producir IS1, que se utiliza sobre todo para la respuesta de la intensidad y las medidas del choque del quántum.
| PH | 7,15 (ajustar con CsOH) |
| Reactivo | Concentración (mM) |
| CsCl | 120 |
| MgCl $ ₂ $ | 2 |
| TES | 10 |
| La sal de magnesio ATP (MgATP) | 4 |
| GTP (Na _ { 2 } GTP) | 0,4 |
| Β-nicotinamida adenina dinucleótido hidrato (NAD) | 1 |
| El cloruro de tetra-etil-amonio (TAE) | 15 |
| Almacenar a -20 ° C. |
Tabla 4: Solución intracelular (IS2). Descripción química y las cantidades específicas requeridas para producir la solución intracelular IS2, que se utiliza sobre todo para las medidas del potencial de inversión de la corriente inducida por la luz.
Discusión
La aplicación de grabaciones de células enteras a los fotorreceptores de D. melanogaster permitió el descubrimiento y la elucidación funcional de nuevas proteínas de señalización, como los canales TRP 27 , 28 , 29 e INAD 30 , 31 , 32 de la proteína andamiaje. Desde la introducción inicial de esta técnica, permitió la resolución de preguntas básicas a largo plazo sobre el mecanismo iónico y la dependencia de voltaje de la respuesta de luz. Esto ocurrió debido a la capacidad conferida de controlar con precisión el voltaje de la membrana y la composición iónica extracelular e intracelular 19 , 28 .
Un obstáculo importante de la técnica de pinzamiento de remiendo en D. melanogaster ha sido la fragilidad de la aislada prema de ommatidiaracionar. Estudios detallados han revelado que la integridad de la maquinaria de fototransducción depende críticamente del suministro continuo de ATP, especialmente durante la exposición a la luz, lo que conduce a un gran consumo de ATP. Por desgracia, el rayado mecánico de las células de pigmento ( es decir, glia), que se requiere para alcanzar la membrana fotorreceptor con la pipeta patch, elimina la principal fuente de metabolitos necesarios para la producción de ATP [ 33] . La aplicación de ATP exógeno en la pipeta de registro sólo cumple parcialmente el requisito de grandes cantidades de ATP. Un corto suministro de ATP conduce a la activación espontánea de los canales TRP ya la disociación de la maquinaria de fototransducción de los canales activados por luz, causando un gran aumento de Ca 2 + celular y la abolición de la respuesta normal a la luz 34 , 35 . Esta secuencia de eventos no se debe al daño de laFotorreceptores por el procedimiento de disección, sino más bien al agotamiento celular de ATP. Para evitar que se produzca esta secuencia de eventos y para mantener las respuestas de luz normales, los fotorreceptores no deben ser expuestos a luces intensas, que consumen grandes cantidades de ATP. Además, NAD debe ser incluido en la pipeta de grabación, presumiblemente para facilitar la producción de ATP en las mitocondrias [ 18 , 36] . Para las mediciones de los baches espontáneos y cuánticos, la dificultad anterior es mínima porque sólo se utilizan luces débiles. En la práctica, se puede mantener una grabación estable de células enteras durante ~ 20-25 min, aunque existe una tendencia a que la cinética de respuesta se ralentice durante este periodo. Una sola preparación de ommatidia disociada puede permanecer viable hasta 2 h.
Una deficiencia adicional de la preparación de ommatidia aislada es la inaccesibilidad de los microvellosidades, lo que se traduce en la inaccesibilidad del TRP yTRPL a la pipeta de grabación, evitando las grabaciones de un solo canal. Utilizando un método que desarrollaron, Bacigalupo y sus colegas lograron registrar directamente la actividad de un solo canal del rhabdomere 37 . Sin embargo, esta actividad de canal difiere de la de los canales TRPL heterólogamente expresado en células de cultivo de tejidos [ 38] y de la actividad del canal TRP derivados de análisis de ruido de disparo obtenido de ommatidia aislados [ 34] . Presumiblemente, el procedimiento de disección dañó en gran medida las células fotorreceptoras cuando se usa este método.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
La parte experimental de esta investigación fue apoyada por donaciones de la Fundación Nacional de Ciencias Bi-Israel (a BM e IL), la Fundación de Ciencia de Israel (ISF), la Deutsch-Israelische Projektkooperation (DIP) (a BM) y la Biotechnology Y el Consejo de Investigación en Ciencias Biológicas (BBSRC Grant números: BB / M007006 / 1 y BB / D007585 / 1) a RCH
Materiales
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 5 mL syringe | |||
| 1 mL syringe with elongated tip | |||
| Petri dish | 60 mm | ||
| Syringe filters | Millex | 22 µm PVDF filter | |
| Capillaries (for omatidia separation) | Glass, 1.2 x 0.68 mm (~7.5 cm each) | ||
| Polyethylene Tubing | Becton Dickinson | 1.57 x 1.14 mm (35 cm) | |
| 2 small beakers | 50 mL or less | ||
| 2 paraffin film sheets | Parafilm M | ~5 x 5 cm | |
| Bath chamber | home-made | ||
| Cover slips | 22 x 22 mm No. 0 | ||
| Paraplast Plus | Sigma | Paraffin – polyisobutylene mixture | To glue the coverslip onto the bottom of the bath chamber |
| Ground | Warner Instruments | 64-1288 | Hybrid Assembly Ag-AgCl Wire Assembly |
| Headless micro dissection needle | Entomology, 12 mm | ||
| Micro dissecting needle holder | |||
| Vise | |||
| 2 fine tweezers + 1 rough tweezers | Dumont #5, Biology | 0.05 x 0.02 mm, length 110 mm, Inox | |
| Stereoscopic zoom Microscope | Nikon | SMZ-2B | |
| Cold light source | Schott | KL1500 LCD | |
| Filter (Color) for cold light source | Schott | RG620 | |
| Delicate wipers | Kimtech | Kimwipes | |
| Electrode holder | Warner Instruments | QSW-T10P | Q series Holders compatible with Axon amplifiers, straight body style |
| Silver Wire | Warner Instruments | 0.25 mm diameter, needs to be chloridized | |
| Micromanipulator | Sutter Instruments | MP 85 | Huxley-Wall Style Micromanipulator |
| Faraday cage | home made | Electromagnetic noise shielding and black front curtain | |
| Anti-vibration Table | Newport | VW-3036-OPT-01 | |
| Osilloscope | GW | GOS-622G | |
| Perfusion system | Warner Instruments | VC-8P | Pinch valve control system |
| Perfusion valve controller | Scientific instruments | BPS-8 | |
| Suction system | |||
| Amplifier | Molecular Device | Axopatch-1D | |
| Head-stage | Molecular Device | CV - 4 | Gain: x 1/100 |
| A/D converter | Molecular Device | Digidata 1440A | |
| Clampex | Molecular Device | 10 | software |
| pCLAMP | Molecular Device | 10 | software |
| Light source (Xenon Arc lamp) | Sutter Instruments | Lambda LS | |
| Light detector | home made | phototransistor | |
| Filter wheel and shutter controller | Sutter Instruments | Lambda 10-2 with a Uniblitz shutter | |
| Filters (Natural density filter) | Chroma | 6,5,4,3,2,1,0.5,0.3 | |
| Filter (Color) | Schott | OG590, Edge filter | |
| Xenon Flash Lamp system | Dr. Rapp OptoElecftronic | JML-C2 | |
| Light guide | Quartz | ||
| Pulse generator | AMPI | Master 8 | |
| Microscope | Olympus | IX71, Inverted | |
| Red illumination filter (Microscope) | RG630 / RG645 ø45mm | ||
| Microscope objective | Olympus | X60/0.9 UplanFL N air or X60/1.25 UplanFI oil | |
| CCD Camera | Andor | iXon DU885K | |
| NIS Element | Nikon | AR | software |
| Ca+2 indicator | Invitrogen | Calcium green 5N | |
| Excitation & emission filters and dichroic mirror | Chroma | 19002 - AT - GFP/FITC Longpass set | |
| Vertical pipette puller | Narishige | Model PP83 | Use either vertical or horizontal puller, as preferred. |
| Horizontal pipette puller | Sutter Instrument | Model P-1000 Flaming/Brown Micropipette Puller | |
| Filament | Sutter Instrument | 3 mm trough or square box | |
| Capillaries | Harvard Apparatus | borosilicate glass capillaries | 1 x 0.58 mm |
Referencias
- Hardie, R. C. Whole-cell recordings of the light induced current in dissociated Drosophila photoreceptors: evidence for feedback by calcium permeating the light-sensitive channels. Proc. R. Soc. Lond. B. 245, 203-210 (1991).
- Ranganathan, R., Harris, G. L., Stevens, C. F., Zuker, C. S. A Drosophila mutant defective in extracellular calcium- dependent photoreceptor deactivation and rapid desensitization. Nature. 354, 230-232 (1991).
- Martin, J. H., Benzer, S., Rudnicka, M., Miller, C. A. Calphotin: a Drosophila photoreceptor cell calcium-binding protein. Proc. Natl. Acad. Sci. U.S.A. 90 (4), 1531-1535 (1993).
- Weiss, S., et al. Compartmentalization and Ca2+ buffering are essential for prevention of light-induced retinal degeneration. J Neurosci. 32 (42), 14696-14708 (2012).
- Wang, T., et al. Light activation, adaptation, and cell survival functions of the Na + /Ca 2+ exchanger CalX. Neuron. 45 (3), 367-378 (2005).
- Weckstrom, M., Hardie, R. C., Laughlin, S. B. Voltage-activated potassium channels in blowfly photoreceptors and their role in light adaptation. J. Physiol. Lond. 440, (1991).
- Frolov, R. V., Immonen, E. V., Weckström, M. Performance of blue- and green-sensitive photoreceptors of the cricket Gryllus bimaculatus. J Comp Physiol A Neuroethol Sens Neural Behav Physiol. 200 (3), 209-219 (2014).
- Nasi, E. Whole-cell clamp of dissociated photoreceptors from the eye of Lima scabra. J Gen Physiol. 97 (1), 35-54 (1991).
- Nasi, E., Gomez, M. P. Light-activated ion channels in solitary photoreceptors of the scallop Pecten irradians. J. Gen. Physiol. 99, 747-769 (1992).
- Hardie, R. C., Peretz, A., Pollock, J. A., Minke, B. Ca 2+ limits the development of the light response in Drosophila photoreceptors. Proc. R. Soc. Lond. B. Biol. Sci. 252, 223-229 (1993).
- Kohn, E., et al. Functional Cooperation between the IP3 Receptor and Phospholipase C Secures the High Sensitivity to Light of Drosophila Photoreceptors In Vivo. J Neurosci. 35 (6), 2530-2546 (2015).
- Hevers, W., Hardie, R. C. Serotonin modulates the voltage dependence of delayed rectifier and Shaker potassium channels in Drosophila photoreceptors. Neuron. 14 (4), 845-856 (1995).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Henderson, S. R., Reuss, H., Hardie, R. C. Single photon responses in Drosophila photoreceptors and their regulation by Ca 2. J. Physiol. Lond. 524 (Pt 1), 179-194 (2000).
- Scott, K., Zuker, C. S. Assembly of the Drosophila phototransduction cascade into a signalling complex shapes elementary responses. Nature. 395 (6704), 805-808 (1998).
- Elia, N., Frechter, S., Gedi, Y., Minke, B., Selinger, Z. Excess of G betae over G qalphae in vivo prevents dark, spontaneous activity of Drosophila photoreceptors. J. Cell Biol. 171 (3), 517-526 (2005).
- Katz, B., Minke, B. Phospholipase C-Mediated Suppression of Dark Noise Enables Single-Photon Detection in Drosophila Photoreceptors. J. Neurosci. 32 (8), 2722-2733 (2012).
- Hardie, R. C., et al. Molecular basis of amplification in Drosophila phototransduction. Roles for G protein, phospholipase C, and diacylglycerol kinase. Neuron. 36 (4), 689-701 (2002).
- Reuss, H., Mojet, M. H., Chyb, S., Hardie, R. C. In vivo analysis of the Drosophila light-sensitive channels, TRP and TRPL. Neuron. 19, 1249-1259 (1997).
- Liu, C. H., et al. In vivo identification and manipulation of the Ca 2+ selectivity filter in the Drosophila transient receptor potential channel. J. Neurosci. 27 (3), 604-615 (2007).
- Ahmad, S. T., Natochin, M., Barren, B., Artemyev, N. O., O'Tousa, J. E. Heterologous expression of bovine rhodopsin in Drosophila photoreceptor cells. Invest Ophthalmol Vis Sci. 47 (9), 3722-3728 (2006).
- Scott, K., Sun, Y., Beckingham, K., Zuker, C. S. Calmodulin regulation of Drosophila light-activated channels and receptor function mediates termination of the light response in vivo. Cell. 91 (3), 375-383 (1997).
- Liu, C. H., et al. Ca 2+ -dependent metarhodopsin inactivation mediated by calmodulin and NINAC myosin III. Neuron. 59 (5), 778-789 (2008).
- Cook, B., et al. Phospholipase C and termination of G-protein-mediated signalling in vivo. Nat. Cell Biol. 2 (5), 296-301 (2000).
- Hardie, R. C., Franze, K. Photomechanical responses in Drosophila photoreceptors. Science. 338 (6104), 260-263 (2012).
- Huang, J., et al. Activation of TRP channels by protons and phosphoinositide depletion in Drosophila photoreceptors. Curr. Biol. 20 (3), 189-197 (2010).
- Minke, B., Wu, C. F., Pak, W. L. Isolation of light-induce response of the central retinular cells from the electroretinogram of Drosophila. J. Comp. Physiol. 98, 345-355 (1975).
- Hardie, R. C., Minke, B. The trp gene is essential for a light-activated Ca2+ channel in Drosophila photoreceptors. Neuron. 8, 643-651 (1992).
- Niemeyer, B. A., Suzuki, E., Scott, K., Jalink, K., Zuker, C. S. The Drosophila light-activated conductance is composed of the two channels TRP and TRPL. Cell. 85 (5), 651-659 (1996).
- Huber, A., et al. The transient receptor potential protein (Trp), a putative store- operated Ca 2+ channel essential for phosphoinositide-mediated photoreception, forms a signaling complex with NorpA, InaC and InaD. EMBO J. 15 (24), 7036-7045 (1996).
- Shieh, B. H., Niemeyer, B. A novel protein encoded by the InaD gene regulates recovery of visual transduction in Drosophila. Neuron. 14 (1), 201-210 (1995).
- Tsunoda, S., et al. A multivalent PDZ-domain protein assembles signalling complexes in a G-protein-coupled cascade. Nature. 388 (6639), 243-249 (1997).
- Tsacopoulos, M., Veuthey, A. L., Saravelos, S. G., Perrottet, P., Tsoupras, G. Glial cells transform glucose to alanine, which fuels the neurons in the honeybee retina. J. Neurosci. 14 (3 Pt 1), 1339-1351 (1994).
- Hardie, R. C., Minke, B. Spontaneous activation of light-sensitive channels in Drosophila photoreceptors. J. Gen. Physiol. 103, 389-407 (1994).
- Agam, K., et al. Metabolic stress reversibly activates the Drosophila light-sensitive channels TRP and TRPL in vivo. J Neurosci. 20 (15), 5748-5755 (2000).
- Agam, K., Frechter, S., Minke, B. Activation of the Drosophila TRP and TRPL channels requires both Ca2+ and protein dephosphorylation. Cell Calcium. 35 (2), 87-105 (2004).
- Delgado, R., Muñoz, Y., Peña-Cortés, H., Giavalisco, P., Bacigalupo, J. Diacylglycerol activates the light-dependent channel TRP in the photosensitive microvilli of Drosophila melanogaster photoreceptors. J Neurosci. 34 (19), 6679-6686 (2014).
- Parnas, M., Katz, B., Minke, B. Open channel block by Ca2+ underlies the voltage dependence of Drosophila TRPL channel. J. Gen. Physiol. 129 (1), 17-28 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados