Method Article
Glycoproteomics de la matriz extracelular: Un método para el análisis glucopéptidos Intacto El uso de la espectrometría de masas
En este artículo
Resumen
Este documento describe una metodología para preparar muestras de tejido cardiovascular para el análisis de MS que permite (1) el análisis de composición de proteínas ECM, (2) la identificación de los sitios de glicosilación, y (3) la caracterización de la composición de formas de glicano. Esta metodología se puede aplicar, con modificaciones menores, para el estudio de la ECM en otros tejidos.
Resumen
La fibrosis es una característica de muchas enfermedades cardiovasculares y está asociada con la secreción exacerbada y deposición de la matriz extracelular (ECM). Uso de la proteómica, hemos identificado previamente más de 150 ECM y las proteínas ECM-asociado en los tejidos cardiovasculares. En particular, muchas proteínas ECM están glicosiladas. Esta modificación post-traduccional afecta el plegamiento de proteínas, la solubilidad, la unión, y la degradación. Hemos desarrollado una extracción secuencial y el método de enriquecimiento para las proteínas ECM que es compatible con la espectrometría de masas de cromatografía líquida en tándem posterior análisis (LC-MS / MS) de glicopéptidos intactas. La estrategia se basa en incubaciones secuenciales con NaCl, SDS para la descelularización de tejidos, y clorhidrato de guanidina para la solubilización de proteínas de la MEC. Los recientes avances en LC-MS / MS incluyen métodos de fragmentación, tales como combinaciones de disociación colisión de alta energía (HCD) y la transferencia de electrones de disociación (ETD), que permitenel análisis de la composición directa de glicopéptidos de proteínas de la MEC. En el presente trabajo, se describe un método para preparar el ECM a partir de muestras de tejido. El método no sólo permite perfiles de proteínas, sino también la evaluación y caracterización de la glicosilación por análisis de MS.
Introducción
La fibrosis es una característica de muchas enfermedades. Los fibroblastos proliferan y se diferencian hacia fenotipos altamente sintéticos, que se asocian con la secreción exacerbada y la deposición de matriz extracelular (ECM) 1. deposición excesiva de ECM puede continuar, incluso después de la lesión inicial ha disminuido, lo que lleva a un deterioro funcional. Uso de la proteómica, hemos identificado previamente más de 150 ECM y las proteínas ECM-asociado en el tejido cardíaco 2, 3. No son sólo las proteínas estructurales, sino también proteínas matricellular y proteasas que contribuyen a la remodelación continua y adaptación dinámica del corazón. En particular, muchas proteínas ECM están glicosiladas 4. Esta modificación post-traduccional (PTM) implica la adición de residuos de azúcar a ciertas posiciones de aminoácidos, y que afecta el plegamiento de proteínas, la solubilidad, la unión, y la degradación de 5 .
Hay dos tipos principales de glicosilación que se producen en los mamíferos. (1) N-glicosilación se produce en el nitrógeno carboxamido de residuos de asparagina (Asn) dentro de la secuencia de consenso Asn-Xaa-Thr / Ser, donde Xaa es cualquier aminoácido excepto prolina. (2) En O-glicosilación, residuos de azúcar se unen a serina y treonina residuos (Ser, Thr) o, en un grado mucho menor, a hidroxiprolina e hidroxilisina. Si bien O-glicosilación puede ocurrir en una variedad de grupos de proteínas, N-glicosilación se limita a las proteínas secretadas o dominios extracelulares de proteínas de la membrana 5. Esto hace que la N-glicosilación en un objetivo atractivo cuando se estudia el ECM.
Proteómica establece un nuevo estándar para el análisis de cambios en las proteínas en la enfermedad. Hasta el momento, la mayoría de los estudios de proteómica se han centrado en las proteínas intracelulares 6. Esto se debe principalmente a las siguientes razones. En primer lugar, la abundancia de las proteínas intracelulares obstaculizan la identificación de componentes de ECM escasos. Esto es particularmente crucial en el tejido cardíaco, en la que representan proteínas mitocondriales y myofilament de una gran proporción del contenido de proteína 7. En segundo lugar, las proteínas ECM integrales son fuertemente reticulado y difícil de solubilizar. Por último, la presencia de PTM abundantes (es decir, glicosilación) altera la masa molecular, carga, y las propiedades electroforéticas de los péptidos, que afecta tanto a la separación y la identificación por cromatografía líquida espectrometría de masas tándem (LC-MS / MS). En los últimos años, hemos desarrollado y perfeccionado un método de extracción secuencial y el enriquecimiento de las proteínas ECM que es compatible con el posterior análisis de espectrometría de masas (MS). La estrategia se basa en las incubaciones secuenciales.
El primer paso se lleva a cabo con NaCl, un tampón iónico que facilita la extracción de las proteínas ECM asociada y ECM débilmente unida, así como las proteínas ECM recién sintetizadas. se is detergente libre, no desnaturalizante, no disruptiva de las membranas celulares, y susceptible para más ensayos bioquímicos 8. Entonces, descelularización se consigue con dodecil sulfato sódico (SDS). En este paso, una baja concentración de SDS asegura desestabilización de la membrana y la liberación de proteínas intracelulares, mientras que la prevención de la interrupción de los componentes de ECM no integrales más solubles. Finalmente, las proteínas de ECM se extraen con un tampón de hidrocloruro de guanidina (GuHCl). GuHCl es eficaz en la extracción de proteínas y proteoglicanos fuertemente reticulados a partir de tejidos tales como tendones, cartílagos 9 10, los vasos 11, 12, 13 y el corazón 2, 3. Hemos aplicado este fraccionamiento bioquímico, en combinación con LC-MS / MS, para explorar la remodelación de ECM en la enfermedad cardiovascular 2 , 3, 11, 12, 13, 14. Los recientes avances en la EM incluyen nuevos métodos de fragmentación, tales como combinaciones de disociación de mayor energía de colisión (HCD) y la transferencia de electrones de disociación (ETD), que permiten el análisis directo de glicopéptidos intactas 3, 15.
Aquí se describe una metodología para preparar ECM para el análisis de MS que permite el análisis de la composición de proteínas, la identificación de los sitios de glicosilación, y la caracterización de las formas de glicano. En comparación con los análisis previos de ECM glicosilación 16, esta metodología permite la evaluación directa de los cambios de composición en los perfiles de glicosilación de una manera específica del sitio utilizando MS. Hemos aplicado esta metodología a los tejidos cardiovasculares. Sin embargo, puede alpor lo que debe aplicarse, con modificaciones menores, para el estudio de la ECM en otras muestras de tejido y puede proporcionar información sin precedentes sobre la biología de ECM.
Protocolo
El estudio fue aprobado por el Comité Ético de Investigación Local Wandsworth (número de referencia: 06 / Q0803 / 37) y recibió la aprobación institucional de la oficina de investigación y desarrollo. Todos los pacientes dieron su consentimiento informado por escrito.
1. Extracción de Proteínas de la Matriz Extracelular
NOTA: Los tejidos auriculares humanos utilizados para estos experimentos se obtuvieron de los apéndices auriculares durante el bypass cardiopulmonar, justo después de la parada cardiopléjica del corazón. Todas las muestras se recogieron en el Hospital de St George, Londres, Reino Unido. Todas las muestras de tejido deben ser congeladas a -80 ° C. No utilice muestras conservadas con fijadores, tales como paraformaldehído, que las proteínas de entrecruzamiento.
- Preparar todos los tampones de extracción antes de los experimentos, según la Tabla 1, con el fin de minimizar el tiempo entre las etapas de extracción. Llevar a cabo todas las incubaciones a temperatura ambiente (RT) en un ambiente de temperatura controlada(Es decir, ~ 20 ° C) para garantizar la coherencia entre las extracciones.
- Pesar 20-50 mg de tejido. Si varias muestras se van a extraer, cortar y les pesará uno a uno para evitar la descongelación completa de los tejidos. El uso de un bisturí, dado el tejido en 3-4 trozos más pequeños (es decir, 2-3 mm) y colocarlos juntos en tubos de 1,5 mL.
- Añadir 500! L de solución salina tamponada con fosfato enfriada con hielo (PBS; véase la Tabla 1 y la Tabla de Materiales) y llevar a cabo cinco lavados para minimizar la contaminación de la sangre.
- Extracción Paso 1: La incubación con NaCl Buffer
- Después de lavar con PBS, colocar las muestras en tubos de 1,5 mL con tapones de rosca. Añadir NaCl (véase la Tabla 1) a 10 veces (v: w) el peso del tejido. Vortex los tubos a TA durante 1 h a una velocidad mínima (es decir, 600 rpm).
NOTA: una baja velocidad de vórtice es crítica para evitar la ruptura mecánica del tejido durante este paso.Utilice un adaptador de espuma para colocar todos los tubos durante la extracción. - La transferencia de los extractos a nuevos tubos y centrifugar a 16.000 xg durante 10 min a 4 ° C. Guarde los extractos a -20 ° C hasta su uso. Brevemente lavar los gránulos de tejido restantes con tampón de NaCl fresco. Utilice el mismo tipo de tampón (es decir, 100 l de tampón de NaCl) para lavar para prevenir la extracción de otras proteínas con diferentes solubilidades (es decir, las proteínas no extraíbles con NaCl).
- Después del lavado, asegurar la eliminación completa de la memoria intermedia para minimizar la superposición en el contenido de proteína con etapas de extracción subsiguientes. Desechar el tampón NaCl utilizado para el lavado.
NOTA: La relación entre el volumen de tampón y el peso del tejido es importante para una extracción reproducible. Una relación de 10: 1 (v: w) para las extracciones de NaCl y SDS y 5: 1 para la etapa de GuHCl proporcionan cantidades suficientes de proteína sin saturar la memoria intermedia. Las concentraciones de proteína son de aproximadamente 1-2 g / l después de extraction.
- Después de lavar con PBS, colocar las muestras en tubos de 1,5 mL con tapones de rosca. Añadir NaCl (véase la Tabla 1) a 10 veces (v: w) el peso del tejido. Vortex los tubos a TA durante 1 h a una velocidad mínima (es decir, 600 rpm).
- Extracción Paso 2: descelularización con SDS Buffer
- Añadir tampón SDS (Tabla 1) a diez veces (v: w) el peso del tejido; el uso de bajas concentraciones de SDS (es decir, 0,1%) es crítica para evitar la pérdida de proteínas de la MEC durante la descelularización. Vortex los tubos a TA durante 16 h a una velocidad mínima (es decir, 600 rpm).
NOTA: Una velocidad de vórtice de la baja minimiza la rotura mecánica de la ECM. - La transferencia de los extractos a nuevos tubos. Centrifugar a 16.000 xg durante 10 min a 4 ° C; almacenar a -20 ° C hasta su uso. Brevemente lavar los gránulos de tejido restantes con dd H 2 O para eliminar el SDS. Garantizar la eliminación completa del líquido después del lavado.
- Añadir tampón SDS (Tabla 1) a diez veces (v: w) el peso del tejido; el uso de bajas concentraciones de SDS (es decir, 0,1%) es crítica para evitar la pérdida de proteínas de la MEC durante la descelularización. Vortex los tubos a TA durante 16 h a una velocidad mínima (es decir, 600 rpm).
- Extracción Paso 3: La incubación con GuHCl Buffer
- Añadir tampón de GuHCl (Tabla 1) a cinco veces (v: v) el peso del tejido. Vortex los tubos a TA durante 72 h a la velocidad máxima (es decir, 3200 rpm); vórtex vigoroso facilita la ruptura mecánica de la ECM.
- La transferencia de los extractos a nuevos tubos. Centrifugar a 16.000 × g durante 10 min a 4 ° C y se almacena a -20 ° C hasta su uso.
2. Cuantificación de proteínas y precipitación
NOTA: Debido a la presencia de detergentes, el tampón de SDS es incompatible con la cuantificación directa de proteínas en base a mediciones de la absorbancia a 280 nm. Para asegurar la cuantificación reproducible, utilizar ensayos colorimétricos para todos los extractos de proteínas 17.
- Cuantificación.
- Preparar normas para una curva de calibración utilizando albúmina de suero bovino (BSA) diluida en serie en el tampón de extracción apropiado (es decir, NaCl, SDS, o GuHCl) 17. Durante este tiempo, descongelar los extractos de la muestra.
- Diluir las muestras en tampón de extracción para obtener concentraciones dentro deel intervalo lineal de la absorbancia; una dilución 1:10 (v: v) produce resultados satisfactorios. Diluir las muestras de GuHCl con una cantidad igual de ddH2O para la cuantificación, como el ensayo colorimétrico no es compatible con concentraciones de> 4 M GuHCl.
- Utilice un ácido bicinconínico (BCA) a base de ensayo colorimétrico 17 (véase la Tabla de Materiales), siguiendo las instrucciones del fabricante para los ensayos en placas de 96 pocillos; se recomienda realizar mediciones al menos por duplicado.
- Después de incubar durante 30 min, tomar lecturas de absorbancia a una longitud de onda de 570 nm con el fin de calcular la concentración de proteína usando la curva de calibración estándar de BSA 17.
- la precipitación de proteínas
- Descongelar GuHCl extrae a TA. Alícuota de 10 g de proteína para cada muestra en nuevos tubos. Para un análisis glicopéptido directa, alícuota de 50 g. Añadir 10 veces el volumen de etanol y incubate durante la noche a -20 ° C.
NOTA: GuHCl no es compatible con otras reacciones enzimáticas y la mayoría de las aplicaciones electroforéticas. La eliminación de GuHCl se requiere antes de desglicosilación y tripsina digestión. La solubilidad de GuHCl en etanol y, a la inversa, la baja solubilidad de las proteínas permite la eliminación eficaz de GuHCl mientras produciendo aproximadamente una recuperación del 98% de las proteínas 18. - Centrifugar las muestras a 16.000 × g durante 30 min a 4 ° C y aspirar el sobrenadante. Tenga cuidado de no perturbar el sedimento precipitado. Se secan los gránulos para 15 min utilizando un concentrador de vacío (véase la Tabla de Materiales) a TA.
NOTA: El protocolo se puede detener aquí y los gránulos secos se almacenó a -20 ° C hasta su uso. - Opcionalmente, ejecute una electroforesis en gel como control de calidad (QC, ver los Métodos Suplementarios).
- Descongelar GuHCl extrae a TA. Alícuota de 10 g de proteína para cada muestra en nuevos tubos. Para un análisis glicopéptido directa, alícuota de 50 g. Añadir 10 veces el volumen de etanol y incubate durante la noche a -20 ° C.
3. La desglicosilación secuencial para elEvaluación de la N-glicosilación ocupación del sitio
- Durante el secado de la muestra (véase la etapa 2.2.2), preparar el tampón de desglicosilación contiene desramificación enzimas de desglicosilación, según la Tabla 1. Véase la Tabla de materiales para los detalles del producto.
- Añadir 10 l de tampón de desglicosilación que contiene enzimas para cada muestra. Asegúrese de que la resuspensión de pellets apropiada mediante la realización de un vórtice rápido y spin-down de las muestras.
NOTA: La eliminación de monómeros de azúcar que utilizan enzimas de desramificación es esencial para la eliminación posterior y completa de sacáridos complejos O-ligados y facilita la escisión posterior de azúcares ligados a N por PNGasa-F. - Incubar durante 2 h a 25 ° C para permitir la eliminación de sulfato de heparán por heparinasa II.Increase la temperatura a 37 ° C y se incuba durante 36 h con agitación suave.
NOTA: Teniendo en cuenta los volúmenes de reacción bajas y tiempos de incubación prolongados, agitadores uso incubadora y herméticamente empacar múltiples bañera de 1,5 mles dentro de un tubo cónico de 50 ml que se inclina dentro de la incubadora a aproximadamente 45 °. - Después de 36 h, centrifugar las muestras durante 1 min a 16.000 xg y se evapora el H 2 O de las muestras utilizando un concentrador de vacío a TA durante aproximadamente 45 min.
- Resuspender las muestras secas con 10 l de H 2 18 O que contiene 50 U / ml PNGasa-F, que escinde todos los glicanos ligados a asparagina en una reacción de desamidación.
NOTA: El ácido aspártico resultante lleva una masa de más de 2,98 Da, indicativo de la presencia de N-glicosilación durante el análisis de MS. - Incubar durante 36 h a 37 ° C con agitación constante en la incubadora con agitación.
4. Dentro de la solución de digestión con tripsina
NOTA: Este paso debe llevarse a cabo para ambos (es decir, utilizados para el análisis glicopéptido directa) y desglicosiladas muestras no desglicosilada (es decir, que se utiliza para la evaluación de oc glicanocupancy).
- Use 10 g de proteína total para la evaluación de la ocupación del sitio de N-glicosilación (como se indica en el paso anterior). Para las muestras destinadas a análisis glicopéptido directa, usar 50 g de proteína como la cantidad de partida.
NOTA: Los siguientes pasos se describen, por 10 g de proteína. Escala hasta evolumes Th (es decir, 5 veces para 50 mg) según se requiera. - Desnaturalizar las proteínas en cada alícuota de la muestra usando 9 M urea y 3 M de tiourea, con concentraciones finales de 6 M urea y tiourea 2 M, respectivamente (por ejemplo, para una muestra de 10 l, 20 l de urea / tiourea).
- Reducir las proteínas mediante la adición de ditiotreitol 100 mM (DTT, 3,33 l, concentración final: 10 mM). Incubar a 37 ° C durante 1 h con agitación a 240 rpm.
- Enfriar las muestras a RT antes de realizar la alquilación mediante la adición de 0,5 M de yodoacetamida (3,7! L, concentración final: 50 mM). Incubar en la oscuridad durante 1 h.
- Utilice pre-enfriada (-20° C) acetona (6 veces el volumen de la muestra) para incuban las muestras durante la noche a -20 ° C. Precipitado mediante centrifugación a 14.000 xg durante 25 min a 4 ° C.
- Aspirar el sobrenadante. Tenga cuidado de no perturbar el sedimento precipitado. Secar los gránulos de proteínas utilizando un concentrador de vacío durante 30 min a TA.
- Resuspender en 20 l de 0,1 M de bicarbonato de trietilamonio (TEAB), pH 8,2, que contiene tripsina (0,01 mg / l) y digerir durante la noche a 37 ° C y 240 rpm.
- Detener la digestión mediante la acidificación de las muestras con ácido trifluoroacético 10% (TFA, 2! L de una concentración final de 1% de TFA).
5. Péptido Liberador de Uso de las columnas C18
NOTA: La eliminación de interferir contaminantes de la mezcla de péptidos después de la digestión reduce ion supresión y mejora la relación señal-ruido y la cobertura de secuencia. Este paso debe llevarse a cabo tanto para sa no desglicosilada y desglicosiladamples.
- Activar la resina en la placa de C18 de centrifugado (ver la Tabla de Materiales) usando 200 l de metanol por pocillo y se centrifuga a 1.000 xg durante 1 min.
- Lavar mediante la adición de 200! L por pocillo de 80% de acetonitrilo (ACN) y 0,1% de TFA en H 2 O. Se centrifuga a 1.000 xg durante 1 min.
- Equilibrar mediante la adición de 200! L por pocillo de 1% de ACN y 0.1% de TFA en H 2 O. Se centrifuga a 1.000 xg durante 1 min. Repita este paso dos veces más.
- Cargar las muestras (todo el volumen) de la etapa 4 en los pocillos que contienen la resina y se centrifuga a 1.500 xg durante 1 min. Actualizar el flujo a través de una segunda vez y repetir la centrifugación.
- Lavar mediante la adición de 200! L por pocillo de 1% de ACN y 0.1% de TFA en H 2 O. Se centrifuga a 1.500 xg durante 1 min. Repita este paso dos veces más.
- Eluir las muestras con 170 l por pocillo de 50% de ACN, 0,1% de TFA en H 2 O. Se centrifuga a 1.500 xg durante 1 min. Repita el paso anteriory combinar el eluato recogido.
- Se seca el material eluido usando un concentrador de vacío durante 2 h a TA. Si no se utiliza inmediatamente, mantener las muestras secas a -80 ° C hasta su uso.
NOTA: muestras desglicosilada destinados a la identificación de proteínas son sólo listo para usar para LC-MS / MS después de este paso. Los pasos 6 y 7 no son necesarios para estas muestras. - Descongelar y resuspender las muestras desglicosiladas en 2% de ACN y 0,05% de TFA en H 2 O a una concentración final de proteína de 0,5 g / l. Proceder con el paso 6 para el análisis glicopéptido directa de muestras no desglicosiladas.
- Opcionalmente, filtrar los péptidos antes del marcaje con etiquetas de masa en tándem (TMT); ver los Métodos Suplementarios para fitration péptido.
6. El marcado con TMT (para el análisis directo a glucopéptidos solamente)
- Descongelar y resuspender los gránulos secos en 50 l de TEAB 50 mM para obtener una concentración de 1 g / l.
- Resusped el 0,8-mg vial de TMT Zero (TMT 0, véase la Tabla de Materiales) de reactivo en 41 l de ACN. Siga recommendantions del fabricante para la resuspensión.
- Etiquetar las muestras de péptido en una proporción de 50 g péptidos a 0,4 mg TMT 0 (es decir, 50 l de péptidos a 20,5 l de TMT 0). Incubar a TA durante 1 h.
- Se detiene la reacción de marcado mediante la adición de 5% de hidroxilamina en una proporción 6: 100 (es decir, 4,23 l de 5% de hidroxilamina). Incubar a TA durante 15 min.
- Secar las muestras de péptidos TMT 0 itrio durante 1 h a RT utilizando un concentrador de vacío. Resuspender en 10 l de ddH 2 O.
NOTA: Debido a los residuos de glicano, glicopéptidos visualizar una masa molecular mayor que péptidos no glicosilados. TMT 0 aumenta el estado de carga de glicopéptidos. Esto reduce su masa relativa para cargar ratios (m / z) y facilita ETD fragmentación.
7. glicopéptido Enriquecimiento
- Utilice tampones de reacción proporcionadas en el kit (véase la Tabla de Materiales).
- Añadir 50 l de tampón de unión a cada muestra de 10! L de la etapa 6.5. Vortex la solución de resina glycocapture hasta que se hace homogénea. Use un ion híbrido interacción hidrófila cromatografía líquida (ZIC-HILIC) basado en capturar 15.
- Alícuota de 50 l de la suspensión de resina a nuevos tubos de 1,5 mL. Girar durante 1 min a 2500 xg y eliminar el sobrenadante. Añadir 60 l de muestra (es decir, la muestra con tampón de unión) a los tubos que contienen los gránulos de resina. Mezclar utilizando una pipeta y se incuba a TA durante 20 min en agitación a 1.200 rpm.
- Centrifugar durante 2 minutos a 2000 xg y transferir el sobrenadante a nuevos tubos. Mantener los tubos. Añadir 150! L de tampón de lavado a los tubos de resina. Mezclar utilizando una pipeta y se incuba a TA durante 10 min en agitación a 1.200 rpm.
- Centrifugado durante 2 min a 2.500 x g. Transferirel sobrenadante a los mismos tubos (de la etapa 7.4). Repetir el lavado dos veces los pasos.
- Añadir 75 l de tampón de elución y se mezcla usando una pipeta. Agitar a 1.200 rpm durante 5 min a RT y centrifugar los tubos durante 2 minutos a 2500 x g. La transferencia de los sobrenadantes a nuevos tubos de 1,5 mL. Repetir las etapas de lavado y luego transferir el sobrenadante eluato al mismo tubo.
- Centrifugar los tubos que contienen el material eluido (es decir, glicopéptidos) durante 2 min a 2.500 x g. Transferir el sobrenadante a nuevos tubos para asegurar la eliminación de cualquier resina restante de los pasos anteriores.
- Secar los total 150 l de eluato utilizando un concentrador de vacío durante aproximadamente 2 h a TA. Resuspender los glicopéptidos-down se seca en 15 l de 2% de ACN y 0,05% de TFA en ddH 2 O.
- Proceder a realizar LC-MS / MS utilizando fragmentación HCD para analizar la composición de proteínas ECM, y LC-MS / MS utilizando HCD y fragmentación ETD para la caracterización glicopéptido. Véase la sección 8.
Análisis 8. Espectrometría de Masas
- Realizar LC-MS / MS utilizando fragmentación HCD para analizar la composición de proteínas ECM; ver los Métodos Suplementarios para más detalles.
- Realizar LC-MS / MS utilizando HCD y fragmentación ETD para la caracterización de glicopéptido (ver los Métodos Suplementarios para detalles); la muestra enriquecida debe ser comparado con el material de entrada no enriquecido 15.
NOTA: Las descripciones detalladas de los métodos de LC-MS / MS para el análisis indirecto glicopéptido, análisis glicopéptido directa, y la búsqueda de la base de datos se proporcionan en los métodos suplementarios. Se anima a los investigadores interesados en la caracterización de proteínas ECM y la composición de glicanos mediante espectrometría de masas para referirse a las publicaciones anteriores 3, 11, 15.
Resultados
Un flujo de trabajo esquemática del protocolo se proporciona en la Figura 1.
protocolo de extracción de ECM
La eficiencia de la extracción se puede monitorizar mediante la ejecución de alícuotas forman cada extracto en geles de acrilamida Bis-Tris y el uso de la tinción de plata para la visualización. La Figura 2A muestra la complementariedad del NaCl, SDS y GuHCl extrae después de la extracción secuencial. Este control de calidad permite la identificación de problemas potenciales con calidad de la muestra, tales como la degradación de proteínas excesiva. Después de la extracción, las glicoproteínas de ECM son abundantes en los extractos GuHCl (Figura 2B).
desglicosilación
Para evaluar la eficiencia de la desglicosilación, un control no desglicosilada se debe ejecutar en paralelo. Tiempos de desglicosilación tienen que ser adecuados para lograr una eliminación completa y homogénea de los residuos de azúcar, como se ejemplifica en la Figura 3A. La Figura 3B muestra un ejemplo representativo de muestras de manera eficiente desglicosilada por la adición de enzimas para la eliminación de GAG y de desglicosilación enzimas que se dirigen más pequeños oligosacáridos N- y O-ligados.
Glycoproteomics
El protocolo para la evaluación de la ocupación de NxT / S sequons mejora la cobertura secuencia de la proteína de glicoproteínas de ECM después MS (Figura 3C) y permite una selección inicial de la presencia de glicoproteínas. Esto ayuda a reducir el tiempo de búsqueda de glicopéptidos, como bases de datos se pueden personalizar para contener glicoproteínas identificadas previamente. HCD-ETD fragmentación se utiliza para la identificación y caracterización composicional de oligosacáridos unidos a ECM g lycoproteins. La Figura 4A muestra un espectro representativo obtenido para un péptido marcado con 18 O después de la desglicosilación (análisis glicopéptido indirecta). La figura 4B es un ejemplo representativo de un espectro obtenido después del análisis de glicopéptidos intactas a partir de extractos de ECM (análisis glicopéptido directo).
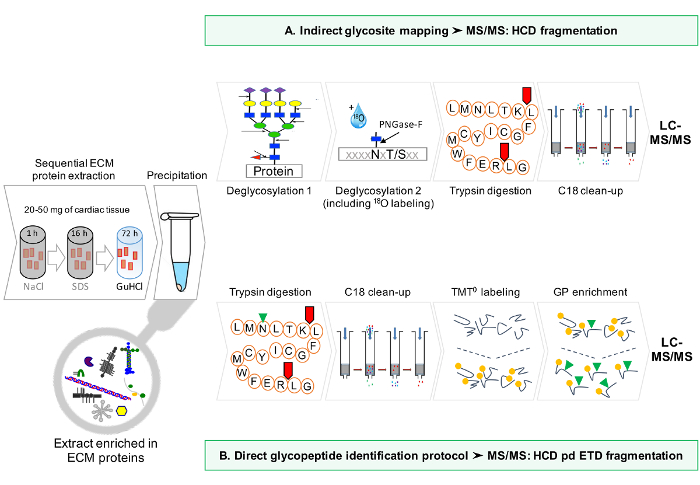
Figura 1: Método general. (A) Después del enriquecimiento secuencial para las proteínas ECM, los análisis LC-MS / MS se realizan en los extractos desglicosiladas. (B) Alternativamente, los extractos de ECM no desglicosiladas se enriquecen más lejos para glicopéptidos. Haga clic aquí para ver una versión más grande de esta figura.
2" src = "/ files / ftp_upload / 55674 / 55674fig2.jpg" />
Figura 2: Extracción de ECM proteínas. (A) Los 3 extractos diferente del procedimiento de extracción secuencial ( "Inglés Quickstep") son complementarios en su contenido de proteínas. Mientras que los extractos de SDS se enriquecen en las proteínas intracelulares, extractos de GuHCl contienen la mayoría de las proteínas de ECM. fraccionamiento éxito es visualizado por el diferente patrón de tinción de plata. Proteínas (B) de ECM tales como la pequeña ricas en leucina proteoglicanos decorina, biglicano y mimecano se detectan predominantemente en los extractos de GuHCl, con poca presencia en los extractos de SDS y NaCl. Haga clic aquí para ver una versión más grande de esta figura.
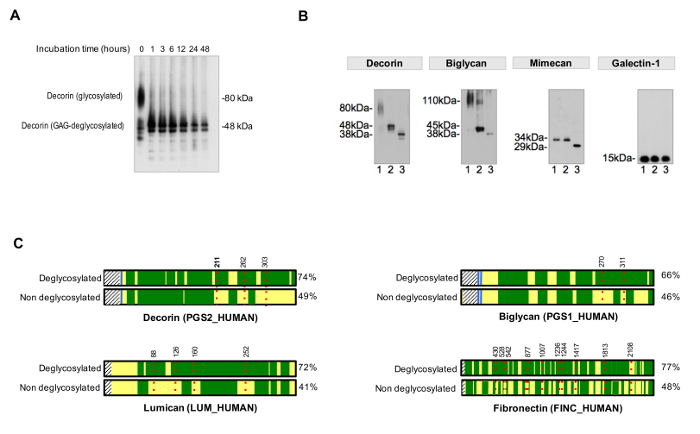
Figura 3. Análisis de Glycosylation. Se requieren (A) los tiempos de incubación apropiados para desglicosilación completa. El ejemplo muestra el efecto del tiempo de incubación durante la eliminación de cadenas de glicosaminoglicanos de la decorina glicoproteína. Glicoproteínas (B) ECM están decoradas con cadenas grandes y repetitivas de glicosaminoglicano y N- corto y diversa y oligosacáridos O-ligados. El carril 1 en cada una de las inmunotransferencias representa extractos cardiacos no tratados. Carril 2 contiene extractos tratados con enzimas que digieren glicosaminoglicanos. Las muestras en el carril 3 contienen, además, las enzimas para la eliminación de oligossacharides enlaces-O N- y. La galectina-1 no está glicosilada, por lo tanto, no hay cambio en el tamaño de la proteína. Adaptado de Lynch M, et al. 4 (C) En LC-MS / MS análisis, las muestras tratadas con PNGasa-F en presencia de H 2 18 O lograr una mejor cobertura de secuencia (%, en el lado derecho) en comparación con muestras no desglicosiladas. rezonas verdes arca representan la cobertura de secuencia por LC-MS / MS. Los rojos, líneas de puntos representan glycosites, con números que indican su posición de aminoácido. La detección de glicosilación de decorina en la posición Asn 211 (N, resaltado en negrita) se muestra en detalle como ejemplo en la figura 4. Por favor, haga clic aquí para ver una versión más grande de esta figura.
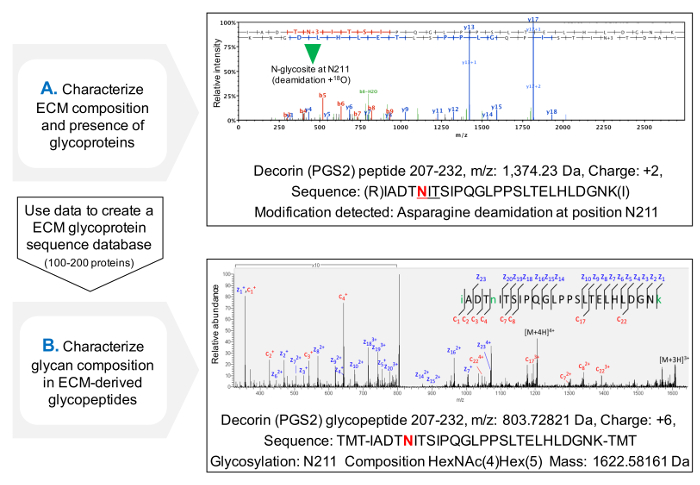
Figura 4. Análisis de glucopéptidos por MS. (A) El uso de un enfoque de la proteómica escopeta en ECM extractos enriquecidos, glicopéptidos se pueden identificar por la presencia de asparagines deamidadas dentro NxT / S sequons y se marcaron con 18 O. El ejemplo muestra un espectro de HCD MS / MS para un péptido de decorina contiene el previamente glicosilada Asn 211. Los datos obtenidos se pueden utilizarpara crear una base de datos personalizada de glucoproteínas de la MEC. (B) HCD-ETD fragmentación se utiliza para analizar el glicopéptido extracto enriquecido de ECM. El espectro ETD MS / MS permite la caracterización de la composición de glicanos. Haga clic aquí para ver una versión más grande de esta figura.
| A. soluciones de archivo | |
| DTT (ditiotreitol, C 4 H 10 O 2 S 2) | DTT 100 mM en ddH 2 O. 1 |
| EDTA (ácido etilendiaminotetraacético, C 10 H 16 N 2 O 8) | 250 mM de EDTA en ddH 2 O, pH 8,0. |
| GuHCl (clorhidrato de guanidina, CH 6 ClN 3) | 8 M GuHCl enddH 2 O. |
| IAA (yodoacetamida, C 2 H 4 INO) | IAA 500 mM en ddH 2 O. 1,2 |
| Na acetato (acetato de sodio, C 2 H 3 NaO 2) | 1 M de acetato de Na en ddH 2 O, pH 5,8. |
| NaCl (cloruro de sodio, NaCl) | 1 M de NaCl en ddH 2 O. |
| Na dibásico de fosfato (fosfato disódico, Na 2 H 2 PO 4) | 1 fosfato dibásico de M Na en dd H 2 O, pH 6,8. |
| SDS (dodecil sulfato de sodio, NaCl 12 H 25 SO 4) | 1% de SDS (35 mM) en ddH 2 O. 3 |
| TFA (ácido trifluoroacético, C 2 HF 3 O 2) | 10% de TFA (1,2 M) en ddH 2 O. |
| TEAB (bicarbonato de trietilamonio, C 7 H 17 NO 3) | TEAB 1 M en en ddH2O, pH 8,5 |
| Tiourea (tiourea, CH 4 N 2 S) | Tiourea 3 M en ddH 2 O. |
| Tris-HCl (Tris-clorhidrato de (NH 11 C 4 O 3 [HCl]) | 100 mM Tris-HCl en ddH 2 O, pH 7,5. |
| Urea (Urea, CH 4 N 2 O) | 9 M urea en ddH 2 O. |
| B. tampones de reacción | |
| limpieza de tampón de equilibrio C18 | 1% de ACN, 0,1% de TFA en ddH2O |
| limpieza de tampón de lavado columna C18 | 80% de ACN, 0,1% de TFA en H 2 O |
| limpieza de tampón de elución C18 | 50% de acetonitrilo, 0,1% de TFA en ddH2O |
| La desglicosilación Buffer (4x) | NaCl 600 mM y 200 mM fosfato de Na en ddH 2 O, pH 6,8. |
| Tampón de GuHCl 4 | Hidrocloruro de guanidina 4 M, 50 acetato de Na mM y EDTA 25 mM en ddH 2 O, pH 5,8. Añadir 1: 100 (v: v) de cóctel de inhibidores de proteinasa antes de su uso. |
| Tampón de NaCl 4 | 0,5 M NaCl, 10 mM Tris-HCl y EDTA 25 mM en ddH 2 O, pH 7,5. Añadir 1: 100 (v: v) de cóctel de inhibidores de proteinasa antes de su uso. |
| PBS (1x) | 1,7 mM KH 2 PO 4, 5 mM Na 2 HPO 4, NaCl 150 mM, pH 7,4. Añadir EDTA 25 mM y 1: 100 (v: v) de cóctel de inhibidores de proteinasa antes de su uso. |
| tampón de muestra (4x) | Tris 100 mM, 2% SDS, 40% de glicerol, 0,02% de azul de bromofenol en ddH 2 O, pH 6,8. Añadir 10% de ß-mercaptoetanol antes de su uso. |
| Tampón SDS 4 | 0,1% de SDS y EDTA 25 mM en ddH 2 O. Añadir 1: 100 (v: v) de cóctel de inhibidores de proteinasa befel uso de mineral. |
| C. enzimas | |
| ABC condroitinasa 5 | 0,5 U / ml en tampón de desglicosilación (1x) |
| queratanasa 5 | 0,1 U / ml en tampón de desglicosilación (1x) |
| Heparinasa II 5 | 0,1 U / ml en tampón de desglicosilación (1x) |
| α2-3,6,8,9-neuraminidasa (sialidasa) 5 | 0,025 U / ml en tampón de desglicosilación (1x) |
| β1,4-galactosidasa 5 | 0,015 U / ml en tampón de desglicosilación (1x) |
| ß-N-Acetilglucosaminidasa 5 | 0,25 U / ml en tampón de desglicosilación (1x) |
| Endo-α-N-acetilgalactosaminidasa (O-glicosidasa) 5 | 0,013 U / ml en tampón de desglicosilación (1x) |
| PNGasa-F (N-glicosidasa F) 6 | 50 U / ml en H 2 O 18 |
| tripsina | 0,01 g / l en tampón TEAB |
| Notas del cuadro. | |
| 1 Mantenga solución madre congeladas a -20 ° C. | |
| 2 IAA debe mantenerse protegido de la luz. | |
| 3 SDS cristaliza fácilmente a <20 ° C. Con el fin de facilitar la solubilización de SDS (solución madre) 1%, calentar el tampón bajo el agua caliente del grifo. | |
| 4 tampones de extracción pueden ser almacenados a temperatura ambiente. Añadir cóctel de amplio espectro de inhibidores de proteinasas como se indica antes de su uso. | |
| 5 Estas enzimas deben añadirse durante la primera etapa de desglicosilación. | |
| 6 PNGasa-F debe ser añadido durante la segunda etapa de desglicosilación. | |
Tabla 1: Soluciones madre, tampones de reacción y enzimas. Esta tabla muestra la composición de cada tampón de solución madre y de reacción requerido para la extracción y el procesamiento subsiguiente (incluyendo digestiones enzimáticas) de proteínas ECM cardíacas antes del análisis MS.
Discusión
Este protocolo ha sido optimizado proteómica en los últimos años en nuestro laboratorio. Aquí, utilizamos el tejido cardíaco, pero sólo pequeños ajustes pueden ser necesarios para su aplicación a otros tejidos. Por ejemplo, el protocolo de extracción tiene que tomar la celularidad del tejido en consideración. tejido cardíaco es altamente celular en comparación con el tejido vascular. Al utilizar tejido vascular, la concentración de SDS puede ser menor (es decir, 0,08%) y el tiempo de descelularización es más corto (es decir, 4 h) 11, 12, 13. El uso de enzimas de desglicosilación es crucial para el análisis de LC-MS / MS de la composición de ECM. Sin embargo, los tiempos de incubación necesitan ser ajustados para diferentes tipos de tejidos. Por ejemplo, heparinasa II tiempos de incubación prolongados requeridos a 25 ° C utilizando las muestras como la piel, que son ricos en proteínas de la membrana basal (por ejemplo, la agrina, perlecan) (datos no mostrados). Análisis glicopéptido directa se puede realizar en medios condicionados de células en cultivo 15. etapas de enriquecimiento puede no ser necesaria para el análisis de este subproteoma simplificado. Similar a los extractos de GuHCl, extractos de NaCl también son susceptibles para el análisis glycoproteomics con modificaciones menores. Otros protocolos de extracción para el enriquecimiento de proteínas de la MEC pueden adaptarse para caracterizar glicopéptidos ECM 19, 20.
La glicosilación es el más complejo PTM 5. La identificación indirecta de glicopéptidos se logra mediante la detección de desamidada Asn con incorporado 18 O a una NxT / S sequon. Desamidada Asn en otras posiciones puede representar falsos positivos. Del mismo modo, N-glicosilación debe ser considerada en el contexto de las ontologías de proteínas: las proteínas intracelulares que contienen un NxT / S sequon no estar glicosilados, pero pueden dar lugar a falsos positivos. Como searc actualh algoritmos no permiten la proyección de PTM en secuencias predeterminadas solamente (es decir, Asn en NxT / S), se requiere filtrado manual de los datos. Identificación de presencia / ausencia de glicosilación en estas posiciones se puede comparar entre muestras y control de enfermedades. No hay enzima equivalente a PNGasa F para O-desglicosilación (es decir, la introducción de un desplazamiento de masa en treonina o serina). Por lo tanto, la identificación de O-glicosilación se limita a análisis glicopéptido directa. análisis glicopéptido directa se utiliza para obtener información sobre la composición de los azúcares unidos a las proteínas, pero no proporciona información estructural de los glicanos. Además, la composición glicano es el resultado de la síntesis de glucano y el procesamiento después de la secreción.
Nuestro método de extracción de 3 pasos para proteínas ECM ( "Inglés Quickstep") 6 ha permitido la caracterización de la ECM en una variedad de tejidos cardiovasculares. El fraccionamiento del tejidoen varios extractos se requiere para obtener un proteoma ECM simplificada como se discutió en otro lugar 6. Las proteínas intracelulares de otro modo contribuir a un rango dinámico excesivo de las abundancias de proteínas dentro de los extractos que pudieran obstaculizar la identificación de proteínas ECM menos abundantes. Además, las proteínas intracelulares llevan O-glicosilaciones 5 que complicarían ECM enriquecimiento glicopéptido y posterior análisis MS. Otros autores aplicaron metodologías de extracción similares para caracterizar, por ejemplo, de pulmón 21 y los tejidos de cartílago 10, sin embargo no persiguieron el análisis de la glicosilación. Los análisis previos de la glicosilación centrado en la identificación de sólo glycosites, requiere la eliminación del glicano desde el núcleo de proteína, y no puede evaluar O-glicosilación 22, 23. matrices de lectina y enriquecimiento químico están disponibles para la evaluación de los glicanos típES de muestras biológicas, en función de su especificidad de unión, pero estas técnicas no pueden asignar tipos de glicanos a proteínas específicas 24 ni pueden evaluar los sitios de glicosilación.
Inicialmente, se utilizó electroforesis en gel antes de LC-MS / MS de las proteínas de ECM. Aunque la separación de gel es útil en la obtención de fracciones de proteína simplificados susceptibles de análisis LC-MS / MS, los últimos instrumentos ofrecen velocidades más rápido de exploración. Por lo tanto, la etapa de separación electroforética se puede omitir. Esto proporciona una ventaja adicional como proteínas ECM grandes, que son retenidos en la parte superior del gel, se analizan de manera más eficiente. Sin embargo, la información sobre el Mw de las proteínas intactas se pierde. La etapa de evaporación antes de la PNGasa F desglicosilación garantiza la eliminación completa de regular de H 2 O para minimizar falsos negativos. Residuos de azúcar (es decir, masas de glicano variables) interfieren con la separación por LC y comprometen la posterior identificación de péptidos por MS / MS. A pTambién se recomienda una-desglicosilación protocolo para el análisis de proteómica de proteínas ECM no se centraron en la glicosilación.
Proteómica pueden proporcionar información sin precedentes en el ECM. Más allá de soporte estructural, glicanos unidos a la ECM son esenciales para la interacción huésped-patógeno, la comunicación célula-célula y la respuesta inmune 25, es decir, rechazo de aloinjerto después de un trasplante de órganos. Glycoproteomics serán una herramienta esencial en glicobiológica.
Divulgaciones
Ninguna.
Agradecimientos
JBB es un establecimiento de la carrera Fellow en el Centro de la Fundación Británica del Corazón del Rey. MM es un miembro principal de la British Heart Foundation (FS / 13/2/29892). El estudio fue apoyado por una iniciativa de excelencia (centros de competencia para una excelente Technologies - COMET) de la Agencia de Promoción de la Investigación de Austria FFG: "Centro de Investigación de Excelencia en Vascular Envejecimiento - Tirol, VASCage" (número K-Proyecto 843536) y la Investigación Biomédica INDH centro con sede en la National Health Service Foundation Trust Santo Tomás de Guy y y el Kings College de Londres, en colaboración con el hospital Kings College.
Materiales
| Name | Company | Catalog Number | Comments |
| A. Chemicals | |||
| Acetonitrile, MS-grade (ACN, C2H3N) | Thermo Scientific | 51101 | 5.2-5.8, 6.2, 7.11, Supp 2, 3, 4 |
| Cocktail of proteinase inhibitors | Sigma-Aldrich | P8340 | 1.3, 1.4.1, 1.5.1, 1.6.1 |
| Disodium phosphate (Na2H2PO4) | Sigma-Aldrich | S7907 | 3.1 |
| Dithiotreitol (DTT, C4H10O2S2) | Sigma-Aldrich | D0632 | 4.3 |
| Ethylenediaminetetraacetic acid (EDTA, C10H16N2O8) | Sigma-Aldrich | E9884 | 1.3, 1.4.1, 1.5.1, 1.6.1 |
| Ethanol (C2H6O) | VWR | 437433T | 2.2.1 |
| Guanidine hydrochloride (GuHCl, CH6ClN3) | Sigma-Aldrich | G3272 | 1.6.1 |
| Glycerol (C3H8O3) | Acros organics | 158920025 | Suppl 1.1 |
| H2O LC-MS Cromasolv | Sigma-Aldrich | 39253-1L-R | Throughout the protocol |
| H218O | Taiyo Nippon Sanso | FO3-0027 | 3.5 |
| Hydroxylamine (HA, H3NO) | Sigma-Aldrich | 467804 | 6.4 |
| Iodoacetamide (IAA, C2H4INO) | Sigma-Aldrich | A3221 | 4.4 |
| Phosphate-buffered Saline (PBS), 10x | Lonza | 51226 | 1.3 |
| Sodium acetate (C2H3NaO2) | Sigma-Aldrich | S7545 | 1.6.1 |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | 1.4.1, 3.2 |
| Sodium dodecyl sulfate (SDS, NaC12H25SO4) | Sigma-Aldrich | 466143 | 1.5.1 |
| Triethylammonium bicarbonate (TEAB, C7H17NO3) | Sigma-Aldrich | 11268 | 4.7, 6.1 |
| Trifluoroacetic acid (TFA, C2HF3O2) | Sigma-Aldrich | T62200 | 4.8, 5.2-5.8, 7.11, Supp 2, 3 |
| Thiourea (CH4N2S) | Sigma-Aldrich | T8656 | 4.2 |
| Tris-hydrochloride (Tris-HCl, NH11C4O3[HCl]) | Sigma-Aldrich | T3253 | 1.4.1, Suppl 1. |
| Urea (CH4N2O) | Sigma-Aldrich | U1250 | 4.2 |
| Name | Company | Catalog Number | Comments |
| B. Enzymes | |||
| α2-3,6,8,9-Neuraminidase (Sialidase) | EDM Millipore | 362280 (KP0012) | 3.1 |
| β1,4-Galactosidase | EDM Millipore | 362280 (KP0004) | 3.1 |
| β-N-Acetylglucosaminidase | EDM Millipore | 362280 (KP0013) | 3.1 |
| Chondroitinase ABC | Sigma-Aldrich | C3667 | 3.1 |
| Endo-α-N-acetylgalactosaminidase (O-glycosidase) | EDM Millipore | 362280 (KP0011) | 3.1 |
| Heparinase II | Sigma-Aldrich | H6512 | 3.1 |
| Keratanase | Sigma-Aldrich | G6920 | 3.1 |
| PNGase-F (N-Glycosidase F) | EDM Millipore | 362280 (KP0001) | 3.5 |
| Trypsin | Thermo Scientific | 90057 | 4.7 |
| Name | Company | Catalog Number | Comments |
| C. Reagent kits | |||
| 30 kDa MWCO spin filters | Amicon, Millipore | 10256744 | 5.9, Suppl 2 |
| Macro SpinColumn C-18, 96-Well Plate | Harvard Apparatus | 74-5657 | 5.1 |
| NuPAGE Novex BisTris Acrylamide Gels | Thermo-Scientific | NP0322PK2 | Suppl 1 |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | 2.1.3 |
| ProteoExtract Glycopeptide Enrichment Kit | Merk Millipore | 72103 | 7 |
| Tandem mass tag 0 (TMT0) | Thermo Scientific | 900067 | 6.2, 6.3 |
| Name | Company | Catalog Number | Comments |
| D. Equipment and software | |||
| Acclaim PepMap100 C18 Trap, 5 mm x 300 µm, 5 µm, 100 Å | Thermo Scientific | 160454 | Suppl 3, 4 |
| Acclaim PepMap100 C18, 50 cm x 75 µm, 3 µm, 100 Å | Thermo Scientific | 164570 | Suppl 3 |
| Byonic Search Engine | Protein Metrics | Version 2.9.30 | Suppl 5 |
| Dionex UltiMate 3000 RSLCnano | Thermo Scientific | n/a | Suppl 3, 4 |
| EASY-Spray Ion Source | Thermo Scientific | ES081 | Suppl 4 |
| EASY-Spray PepMap RSLC C18, 50 cm x 75 µm, 2 μm, 100 Å | Thermo Scientific | ES803 | Suppl 4 |
| Mascot Search Engine | Matrix Science | Version 2.3.01 | Suppl 3 |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | IQLAAEGAAPFADBMBHQ | Suppl 4 |
| Proteome Discoverer Software | Thermo Scientific | Version 2.1.1.21 | Suppl 3, 5 |
| Picoview Nanospray Source | New Objective | 550 | Suppl 3 |
| Q Exactive HF Mass Spectrometer | Thermo Scientific | IQLAAEGAAPFALGMBFZ | Suppl 3 |
| Savant SpeedVac Concentrator | Thermo Scientific | SPD131DDA | 2.2.2, 3.4, 4.6, 5.7, 6.5, 7.11 |
| Scaffold Software | Proteome Software | Version 4.3.2 | Suppl 3 |
Referencias
- Porter, K. E., Turner, N. A. Cardiac fibroblasts: at the heart of myocardial remodeling. Pharmacol. Ther. 123 (2), 255-278 (2009).
- Barallobre-Barreiro, J., et al. Proteomics analysis of cardiac extracellular matrix remodeling in a porcine model of ischemia/reperfusion injury. Circulation. 125 (6), 789-802 (2012).
- Barallobre-Barreiro, J., et al. Glycoproteomics reveals decorin peptides with anti-myostatin activity in human atrial fibrillation. Circulation. 134 (11), 817-832 (2016).
- Lynch, M., Barallobre-Barreiro, J., Jahangiri, M., Mayr, M. Vascular proteomics in metabolic and cardiovascular diseases. J. Intern. Med. 280 (4), 325-338 (2016).
- Varki, A., Lowe, J. B., Varki, A. Biological Roles of Glycans. Essentials of glycobiology. 2nd ed. , (2009).
- Barallobre-Barreiro, J., Lynch, M., Yin, X., Mayr, M. Systems biology - opportunities and challenges: The application of proteomics to study the cardiovascular extracellular matrix. Cardiovasc. Res. , (2016).
- Agnetti, G., Husberg, C., Van Eyk, J. E. Divide and conquer: the application of organelle proteomics to heart failure. Circ. Res. 108 (4), 512-526 (2011).
- Mason, R. M., Mayes, R. W. Extraction of cartilage protein-polysaccharides with inorganic salt solutions. Biochem. J. 131 (13), 535-540 (1973).
- Vogel, K. G., Peters, J. A. Isolation of proteoglycans from tendon. Methods. Mol. Biol. 171, 9-17 (2001).
- Wilson, R., et al. Comprehensive profiling of cartilage extracellular matrix formation and maturation using sequential extraction and label-free quantitative proteomics. Mol. Cell. Proteomics. 9 (6), 1296-1313 (2010).
- Barallobre-Barreiro, J., et al. Extracellular matrix remodeling in response to venous hypertension: proteomics of human varicose veins. Cardiovasc. Res. 110 (3), 419-430 (2016).
- Didangelos, A., Yin, X., Mandal, K., Baumert, M., Jahangiri, M., Mayr, M. Proteomics characterization of extracellular space components in the human aorta. Mol. Cell. Proteomics. 9 (9), 2048-2062 (2010).
- Didangelos, A., et al. Extracellular matrix composition and remodeling in human abdominal aortic aneurysms: a proteomics approach. Mol. Cell. Proteomics. 10 (8), (2011).
- Grandoch, M., et al. Loss of biglycan enhances thrombin generation in apolipoprotein E-deficient mice: Implications for inflammation and atherosclerosis. Arterioscler Thromb. Vasc. Biol. 36 (5), e41-e50 (2016).
- Yin, X., Bern, M., Xing, Q., Ho, J., Viner, R., Mayr, M. Glycoproteomic analysis of the secretome of human endothelial cells. Mol. Cell. Proteomics. 12 (4), 956-978 (2013).
- Parker, B. L., et al. Quantitative N-linked glycoproteomics of myocardial ischemia and reperfusion injury reveals early remodeling in the extracellular environment. Mol. Cell. Proteomics. 10 (8), (2011).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal. Biochem. 150 (1), 76-85 (1985).
- Pepinsky, R. B. Selective precipitation of proteins from guanidine hydrochloride-containing solutions with ethanol. Anal. Biochem. 195 (1), 177-181 (1991).
- de Castro-Brás, L. E., et al. Texas 3-step decellularization protocol: looking at the cardiac extracellular matrix. J. Proteomics. 86, 43-52 (2013).
- Naba, A., Clauser, K. R., Hynes, R. O. Enrichment of extracellular matrix proteins from tissues and digestion into peptides for mass spectrometry analysis. J Vis Exp. (101), e53057 (2015).
- Decaris, M. L., et al. Proteomic analysis of altered extracellular matrix turnover in bleomycin-induced pulmonary fibrosis. Mol. Cell. Proteomics. 13 (7), 1741-1752 (2014).
- Zhang, H., Li, X. J., Martin, D. B., Aebersold, R. Identification and quantification of N-linked glycoproteins using hydrazide chemistry, stable isotope labeling and mass spectrometry. Nat. Biotechnol. 21 (6), 660-666 (2003).
- Parker, B. L., et al. Site-specific glycan-peptide analysis for determination of N-glycoproteome heterogeneity. J. Proteome Res. 12 (12), 5791-5800 (2013).
- Li, Y., et al. Simultaneous analysis of glycosylated and sialylated prostate-specific antigen revealing differential distribution of glycosylated prostate-specific antigen isoforms in prostate cancer tissues. Anal. Chem. 83 (1), 240-245 (2011).
- Rienks, M., Papageorgiou, A. P., Frangogiannis, N. G., Heymans, S. Myocardial extracellular matrix: an ever-changing and diverse entity. Circ. Res. 114 (5), 872-888 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados