Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición de la Absorción de Glucosa y Respuesta a la Estimulación de la Insulina en
En este artículo
Resumen
En este método, las células musculares primarias humanas se cultivan in vitro para obtener miotubos diferenciados y se miden las tasas de captación de glucosa. Proporcionamos un protocolo detallado para cuantificar las tasas en los estados basales y estimulados con insulina usando [3H] 2-desoxi-D-Glucosa radiomarcada.
Resumen
El músculo esquelético es el mayor depósito de glucosa en mamíferos y contribuye en gran medida a la homeostasis de la glucosa. Evaluación de la sensibilidad a la insulina de las células musculares es de gran importancia para todos los estudios dedicados a explorar el metabolismo de la glucosa muscular y la caracterización de las alteraciones metabólicas. En las células musculares, las proteínas del transportador de glucosa tipo 4 (GLUT4) se trasladan a la membrana plasmática en respuesta a la insulina, permitiendo así la entrada masiva de glucosa en la célula. La capacidad de las células musculares para responder a la insulina mediante el aumento de la tasa de captación de glucosa es una de las lecturas estándar para cuantificar la sensibilidad de las células musculares a la insulina. Los miotubos primarios humanos son un modelo in vitro adecuado, ya que las células mantienen muchas características del fenotipo del donante, incluyendo la sensibilidad a la insulina. Este modelo in vitro también es adecuado para la prueba de cualquier compuesto que pueda afectar la capacidad de respuesta a la insulina. Las mediciones de la tasa de captación de glucosa en myotubes diferenciados reflejanSensibilidad a la insulina.
En este método, las células musculares primarias humanas se cultivan in vitro para obtener miotubos diferenciados, y se miden las tasas de captación de glucosa con y sin estimulación con insulina. Proporcionamos un protocolo detallado para cuantificar las tasas de transporte de glucosa pasiva y activa usando [3H] 2-desoxi-D-Glucosa radiomarcada ([3H] 2dG). Se proporcionan métodos de cálculo para cuantificar las tasas basales activas y estimuladas con insulina, así como el doble de estimulación.
Introducción
El músculo esquelético es el mayor depósito de glucosa en mamíferos y contribuye en gran medida a la homeostasis de la glucosa. Este tejido sensible a la insulina es el sitio primario de la captación de glucosa que se desencadena por la estimulación de insulina [ 1] .
En la diabetes tipo 2, la resistencia a la insulina se observa en varios tejidos, incluyendo el músculo esquelético, y conduce a una concentración de glucosa sanguínea por encima de lo normal. Por lo tanto, es de gran relevancia determinar el nivel de sensibilidad a la insulina de este tejido y sus células, ya sea que se pretenda caracterizar un defecto en un sujeto, o evaluar la eficacia de un tratamiento con la intención de mejorarlo. En sujetos humanos o animales, la técnica estándar de oro para evaluar la sensibilidad a la insulina es la pinza hiperinsulinémica-euglicémica. Introducido por DeFronzo en 1979 2 y modificado desde 3 , 4 entonces, el método permite cuantificar todo el cuerpo aNd de los tejidos sensibilidad a la insulina medida como la tasa de glucosa a ser perfundida bajo la estimulación de insulina para mantener la concentración normal de glucosa en sangre.
La exploración de la sensibilidad a la insulina también se puede realizar a nivel celular utilizando modelos musculares in vitro , y la medición de las tasas de captación de glucosa sigue siendo una herramienta eficiente y confiable para cuantificar la respuesta biológica de la célula a la estimulación con insulina 5 , 6 , 7 . De hecho, la medición de la captación de glucosa cuantifica la respuesta biológica celular a la estimulación de la insulina, desde la unión de la insulina a su receptor a la translocación de vesículas enriquecidas con GLUT4, e incluyendo la señalización intracelular y fosforilación cascadas [ 8] .
Esto es de gran interés para las muestras humanas, ya que los miotubos diferenciados mantienen muchas características del fenotipo del donante, incluyendo la propiedad metabólicaY trastornos observados en el paciente 9 , 10 , 11 , 12 . Los miotubos muestra similitudes estructurales, metabólicas y fenotípicas con el músculo esquelético 13 , 14 , incluyendo la expresión de los transportadores de glucosa 15 y la maquinaria de señalización de insulina celular 16 . Por lo tanto, la medición de la captación de glucosa en los miotubos primarios es relevante para caracterizar el fenotipo muscular de un donante, o investigar el efecto de una intervención (fármaco, nutrición o actividad física) sobre la sensibilidad a la insulina en la célula muscular.
La medición de la captación de glucosa en los miotubos cultivados también es una herramienta confiable cuando se realizan experimentos que modifican la sensibilidad a la insulina 17 , 18 . El in vitro es adecuado para la prueba de cualquier compuesto que podría mejorar la respuesta a la insulina, o podría prevenir o revertir la resistencia a la insulina adquirida o inducida 19 , 20 , 21 , 22 , 23 .
Aquí describimos un protocolo detallado para cultivar y diferenciar los miotubos humanos y para medir las tasas de captación de glucosa celular. El método es aplicable a cualquier fuente de células precursoras musculares humanas, ya sean procedentes de preparaciones en laboratorio, colaboración o proveedores comercialmente disponibles. Las líneas de células musculares inmortalizadas, como C2C12 y L6, respectivamente de origen de ratón y rata, también se puede utilizar para la medición de la captación de glucosa con este protocolo [ 7] .
Proporcionamos un protocolo detallado para cuantificar las tasas en estados basales e insulin-estimulados usando radiomarcado [ 3 H] 2dG. TEl uso de un análogo de glucosa marcado permite una determinación precisa de la entrada de glucosa con material de partida reducido, una condición común cuando se trabaja con células primarias. La molécula de glucosa modificada es incapaz de entrar en las vías metabólicas y, por tanto, se acumula dentro de la célula, permitiendo una cuantificación fiable a través de la radiactividad celular total. Las condiciones experimentales incluyen el uso de un inhibidor del transporte de la glucosa (citocalasina B), y las mediciones se realizan con y sin insulina. Esta combinación permite la determinación de las tasas de entrada activa de glucosa, así como el cálculo del cambio de pliegue para el índice de respuesta a la insulina. El método se presenta con una dosis de insulina durante un único tiempo de incubación, pero el protocolo puede modificarse fácilmente para la dosis de respuesta o experimentos con el tiempo 12 .
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparación de medios y soluciones de cultivo celular
- Preparación de medios de cultivo
- Preparar el medio de proliferación (PM) suplementando el medio F-10 de Ham con glutamina (2 mM), penicilina / estreptomicina (5 μg / mL final), 2% de suero de ternera fetal (FCS) y suero al 2%.
- Preparar el medio de diferenciación (DM) mediante la adición de medio de Eagle modificado de Dulbecco (DMEM) con glutamina (2 mM), penicilina / estreptomicina (5 μg / mL final) y FCS al 2%.
- Preparación de soluciones de captación de glucosa
Precaución: El manejo de materiales radiactivos sólo es permitido en un área restringida y controlada por personal autorizado. Los materiales y residuos deben ser manejados de acuerdo con los procedimientos, directrices y legislación locales.- Para preparar solución salina tamponada con fosfato de X-Dulbecco (X-DPBS), se prepara una solución de DPBS que contiene 0,2% (p / v) (concentración final) de albúmina de suero bovinoUmin (BSA). Filtrar la solución a través de un filtro de 0,2 μm. Almacenar a 4 ° C.
- Para preparar una solución fría de 2-desoxi-D-glucosa (2dG), se pesan 16,4 mg de 2dG y se solubilizan en 10 ml de agua destilada para obtener una solución 10 mM. Almacenar a 4 ° C.
- Añadir 600 μl de 2dG frío y 6 μl de [3H] 2dG radiomarcado a 5400 μL de X-DPBS para obtener la solución 2dG (2dG *) radiomarcada.
NOTA: La concentración final es 1 mM 2dG y el etiquetado es de 1 μCi / mL.- Separar una alícuota de 20 μl (TC20) de solución 2dG * radiomarcada.
- Preparación de mezclas de incubación
- Para la mezcla de citocalasina B, añadir 2 μl de citocalasina B 20 mM a 2 ml de solución 2dG * radiomarcada.
NOTA: La solución madre de citochalasina B se encuentra a 10 mg / ml en dimetilsulfóxido (DMSO). - Para la mezcla de DMSO, añadir 4 μl de DMSO a los 4 ml restantes de solución 2dG * radiomarcada.
- Para la mezcla de citocalasina B, añadir 2 μl de citocalasina B 20 mM a 2 ml de solución 2dG * radiomarcada.
2. Cultura de las células musculares primarias humanas
- Sembrado de placas de 6 pocillos con células de músculo humano satélite
NOTA: Utilizar en casa (ver la referencia 24 para más detalles) o células de satélite de músculo humano comercialmente disponibles de un vial congelado (que contiene 250.000 células). Se da el siguiente procedimiento para 250.000 células con el fin de obtener una placa de 6 pocillos necesaria para la medición de la captación de glucosa en una sola condición.- Descongelar rápidamente los viales congelados de las preparaciones internas de células musculares del músculo humano en agua pre-calentada (37 ° C) hasta que sólo queda un pequeño bloque de hielo en el vial.
- Verter directamente en un tubo de plástico de 50 ml que contiene 10 ml de PM pre-calentado (37 ° C).
- Centrifugar durante 5 min a 500 xg y desechar el sobrenadante.
- Resuspender suavemente el sedimento celular con 18 ml de MP pre-calentado (para obtener 42.000 células por3 ml de medio). Distribuir 3 ml en cada pocillo de una placa de 6 pocillos (9,6 cm 2 ).
NOTA: Se requieren los seis pocillos individuales de una placa para realizar una medición duplicada de la absorción de glucosa en las siguientes condiciones: inhibición del transporte pasivo (pocillos 1 y 2), tasa basal (pocillos 3 y 4) y tasa estimulada por insulina (pocillos 5 y 6). Repita el mismo número de placas de seis pocillos que los distintos tratamientos que se necesitan. - Incubar en condiciones de cultivo estándar (37 ° C, 5% CO 2 ) hasta que las células alcancen el 90% de confluencia.
NOTA: Este paso dura entre 48 y 72 horas dependiendo del lote de celdas. No cambie de medio durante este paso.
- Diferenciación de las células musculares
- Retirar PM (después de 48-72 h) y reemplazar con DM precalentada (3 ml por pocillo). Incubar a 37 ° C, 5% de CO 2 .
NOTA: La diferenciación dura cinco días para alcanzar un estado estable en el que las células están alineadas y polinucleadas. Normalmente, elLos miotubos se cultivan en un medio de glucosa de 1 g / l. Por lo tanto, para evitar el agotamiento de la glucosa durante el cultivo, llenar la placa con 3 ml de medio para asegurar que suficiente sustrato de glucosa está disponible para las células en todo momento. - Reemplace el medio DM cada dos días.
NOTA: A partir de este punto, los miotubos son estables hasta 7 días sin ningún cambio significativo y la medición de la captación de glucosa puede realizarse en cualquier momento.
- Retirar PM (después de 48-72 h) y reemplazar con DM precalentada (3 ml por pocillo). Incubar a 37 ° C, 5% de CO 2 .
- Tratamiento con células musculares (opcional)
NOTA: Los miotubos primarios pueden ser tratados durante varios días para inducir la modificación (prueba de fármacos, inhibidores / activadores de la vía de señalización, etc. ) antes de la estimulación de la insulina y las mediciones de absorción de glucosa. Las células musculares pueden someterse a cualquier tratamiento que pueda tener un impacto en la sensibilidad a la insulina, y la medición de la captación de glucosa cuantificará este impacto. Por ejemplo, la incubación de células musculares con el palmitato de ácido graso saturado promueve la resistencia a la insulina, y las células muestran una reducción de iNsulin estimuló la captación de glucosa.- Preparar 12 ml de DM suplementado con BSA al 10% (sin ácidos grasos) y 0,5 ml de palmitato (PALM). Preparar 12 ml de DM suplementado con BSA al 10% (solo libre de ácidos grasos).
- Preparar dos placas de 6 pocillos con miotubos primarios humanos y cultivarlos como se describe en las secciones 2.1 y 2.2 (con 5 días de diferenciación).
- El dıa 5, se lava cada pocillo con 2 ml de PBS. A una placa, agregue 2 mL de DM que contenga PALM. A la otra placa agregue 2 mL de BSA que contenga solamente DM.
- Incubar durante 48 h a 37 ° C, 5% de CO 2 .
3. Estimulación de la insulina
- Lavar las células musculares diferenciadas dos veces con 2 ml de PBS.
- Quitar PBS cuidadosamente e incubar con 3 mL de DM sin FCS durante 3 h (37 ° C, 5% CO 2 ) para el agotamiento del suero.
- Reemplace el medio en todos los pocillos con 3 mL de DM sin FCS. Añadir 100 nM de insulina a los pocillos 5 y 6.
- Incubar el cultivo de miotubos humanos1 h (37ºC, CO _ { 2 } al 5%).
4. Captación de glucosa
- Después de 1 h de estimulación con insulina, lavar los pocillos dos veces con X-DPBS (1 ml por lavado).
- Añadir 1 mL de mezcla de citocalasina B a los pocillos 1 y 2 y 1 mL de mezcla de DMSO a los pocillos 3 - 6. Incubar durante 15 min (37ºC, 5% CO 2 ). Al final de la incubación, colocar inmediatamente la placa sobre hielo.
5. Lisis celular
- Lavar las células dos veces con 1 ml de PBS enfriado con hielo.
- Lyse las células en cada pocillo con 600 μ l de 50 mM NaOH. Incubar en hielo durante 5 min y mezclar suavemente con rotación orbital lenta.
NOTA: Si el lisado es demasiado viscoso, diluir con hasta 1,5 ml de NaOH. - Usando una pipeta, resuspender y recoger el lisado celular.
6. Determinación de la glucosa radiomarcada
- Poner 400 μl de cada lisado celular en un vial de cuentaje por centelleo líquido. Preparar un vial de control negativo con 400Μl de NaOH 50 mM y un vial de control positivo con 20 μl de TC20 (de la etapa 1.2.3.1).
- Añada 4 ml de solución líquida de centelleo a cada vial. Cierre la tapa y mezcle bien cada vial (1-2 s).
- Inserte cada vial en un contador de centelleo líquido y mida la radiactividad de acuerdo con las instrucciones del fabricante. Registro de recuentos por minuto (CPM) para cada vial de centelleo durante 10 min.
NOTA: CPM = "desintegraciones por minuto" x "eficiencia de recuento".
7. Tasa de captación de glucosa
- Utilizar el lisado restante (200 μl; del paso 5.2) para medir la concentración de proteína. Determinar la concentración de proteína de cada lisado celular utilizando Bradford 25 o un método equivalente. Calcular la cantidad de proteína total (Q) en mg para cada pocillo.
- Para obtener TC1 (el valor para 1 μl de 2dG * radiomarcado), divida el valor CPM de TC20 por 20.
- Para cada vial, calcule tLa tasa de captación de glucosa como sigue:
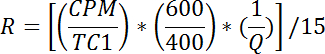
NOTA: R se mide en pmol / mg / min. La media de R para los pozos 1 - 2 da la velocidad de transporte pasivo, R p . La media de R para los pozos 3-4 da la tasa de transporte total basal, R bt . La media de R para los pozos 5-6 da la tasa de transporte total estimulada por insulina, R it .- Calcular la velocidad basal de transporte activo (R ba ) como sigue:
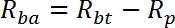
- Calcular la velocidad de transporte activo estimulada por insulina (R ia ) como sigue:
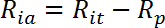
NOTA: En células sensibles a la insulina como los miotubos, las tasas de captación de glucosa se representan generalmente por tres valores: R ba , R ia , y la estimulación de la insulina veces como R ia / R ba .
- Calcular la velocidad basal de transporte activo (R ba ) como sigue:
Access restricted. Please log in or start a trial to view this content.
Resultados
El día 3, los mioblastos llegan a confluencia ( Figura 1A ). Los mioblastos en esta etapa son típicamente mononucleados. Se cambió el medio y al día 8 se completó la diferenciación ( Figura 1B ) (sección de protocolo 2). Después de 5 días de diferenciación, los miotubos están alineados y típicamente polinucleados. Los miotubos primarios humanos se sometieron a un tratamiento con palmitato o BSA sólo antes de la medi...
Access restricted. Please log in or start a trial to view this content.
Discusión
La captación de glucosa es una medida biológica clave para probar activadores o inhibidores en el cultivo celular y cómo afectan el uso de glucosa, y la capacidad de la célula para responder a la insulina. El método descrito aquí ha demostrado ser rápido y fiable y ha sido ampliamente utilizado en muchos estudios utilizando miotubos primarios de sujetos sanos y / o pacientes afectados metabólicamente 6 , 7 , 10 ,
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores reconocen a Anne Charrié en el servicio de Radiobiología (Hospital Lyon-Sud) y en Fond National Suisse (FNS) por su apoyo financiero.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Human primary muscle cell | In house preparation from human skeletal muscle biopsies | In house preparation from human skeletal muscle biopsies | If not available, use commercial source |
| Human primary muscle cell | Promocell | C-12530 | Should be cultured with associated media C23060 and C23061 |
| 6-well plate | Corning | 356400 | BioCoat Collagen I Multiwell Plates |
| Ham's F10 | Dutscher | L0145-500 | 1 g/L glucose |
| Glutamine | Dutscher | X0551-100 | |
| penicilin/streptomycin 100x | Thermo fisher scientific | 15140122 | |
| Serum substitute UltroserG | Pall France | 15950.017 | serum substitute in text |
| DMEM low glucose | Dutscher | L0064-500 | 1 g/L glucose |
| Fetal Calf Serum | Eurobio | CVFSVF00-01 | |
| Dulbecco's Phosphate-Buffered Saline | Dutscher | L0625-500 | Contains Mg2+ (0.5 mM) and Ca2+ (0.9 mM) |
| Insulin solution human | Sigma-Aldrich | I9278 | |
| 2-deoxy-D-glucose | Sigma-Aldrich | D6134 | |
| Albumin bovine | euromedex | 04-100-812-E | |
| fatty acid-free BSA | Roche | 10,775,835,001 | |
| palmitate | Sigma-Aldrich | P0500 | |
| Deoxy-D-glucose, 2-[1,2-3H (N)] | PerkinElmer | NET328A001MC | Specific Activity: 5 - 10 Ci (185-370GBq)/mmol, 1 mCi (37MBq |
| Cytochalasin B | Sigma-Aldrich | c2743 | |
| PICO PRIAS VIAL 6 mL | PerkinElmer | 6000192 | |
| ultima gold MW CA | PerkinElmer | 6013159 | scintillation liquid |
| bêta counter | PerkinElmer | 2900TR |
Referencias
- Stump, C. S., Henriksen, E. J., Wei, Y., Sowers, J. R. The metabolic syndrome: role of skeletal muscle metabolism. Ann Med. 38 (6), 389-402 (2006).
- DeFronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Fossum, E., Hoieggen, A., Moan, A., Nordby, G., Kjeldsen, S. E. Insulin sensitivity relates to other cardiovascular risk factors in young men: validation of some modifications of the hyperinsulinaemic, isoglycaemic glucose clamp technique. Blood Press Suppl. 2, 113-119 (1997).
- Heise, T., et al. Euglycaemic glucose clamp: what it can and cannot do, and how to do it. Diabetes Obes Metab. 18 (10), 962-972 (2016).
- Sell, H., Jensen, J., Eckel, J. Measurement of insulin sensitivity in skeletal muscle in vitro. Methods Mol Biol. 933, 255-263 (2012).
- Sarabia, V., Lam, L., Burdett, E., Leiter, L. A., Klip, A. Glucose transport in human skeletal muscle cells in culture. Stimulation by insulin and metformin. J Clin Invest. 90 (4), 1386-1395 (1992).
- Sarabia, V., Ramlal, T., Klip, A. Glucose uptake in human and animal muscle cells in culture. Biochem Cell Biol. 68 (2), 536-542 (1990).
- Richter, E. A., Hargreaves, M. Exercise, GLUT4, and skeletal muscle glucose uptake. Physiol Rev. 93 (3), 993-1017 (2013).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. Apmis. 109 (11), 735-744 (2001).
- Bouzakri, K., et al. Reduced activation of phosphatidylinositol-3 kinase and increased serine 636 phosphorylation of insulin receptor substrate-1 in primary culture of skeletal muscle cells from patients with type 2 diabetes. Diabetes. 52 (6), 1319-1325 (2003).
- Scheele, C., et al. Satellite cells derived from obese humans with type 2 diabetes and differentiated into myocytes in vitro exhibit abnormal response to IL-6. PLoS One. 7 (6), e39657(2012).
- Jackson, S., et al. Decreased insulin responsiveness of glucose uptake in cultured human skeletal muscle cells from insulin-resistant nondiabetic relatives of type 2 diabetic families. Diabetes. 49 (7), 1169-1177 (2000).
- Aas, V., et al. Are cultured human myotubes far from home? Cell Tissue Res. 354 (3), 671-682 (2013).
- Bakke, S. S., et al. Myotubes from severely obese type 2 diabetic subjects accumulate less lipids and show higher lipolytic rate than myotubes from severely obese non-diabetic subjects. PLoS One. 10 (3), e0119556(2015).
- Stuart, C. A., et al. Hexose transporter mRNAs for GLUT4, GLUT5, and GLUT12 predominate in human muscle. Am J Physiol Endocrinol Metab. 291 (5), E1067-E1073 (2006).
- Al-Khalili, L., et al. Insulin action in cultured human skeletal muscle cells during differentiation: assessment of cell surface GLUT4 and GLUT1 content. Cell Mol Life Sci. 60 (5), 991-998 (2003).
- Tsuka, S., et al. Promotion of insulin-induced glucose uptake in C2C12 myotubes by osteocalcin. Biochem Biophys Res Commun. 459 (3), 437-442 (2015).
- Gorbunov, E. A., Nicoll, J., Myslivets, A. A., Kachaeva, E. V., Tarasov, S. A. Subetta Enhances Sensitivity of Human Muscle Cells to Insulin. Bull Exp Biol Med. 159 (4), 463-465 (2015).
- Breen, D. M., Sanli, T., Giacca, A., Tsiani, E. Stimulation of muscle cell glucose uptake by resveratrol through sirtuins and AMPK. Biochem Biophys Res Commun. 374 (1), 117-122 (2008).
- Pinnamaneni, S. K., Southgate, R. J., Febbraio, M. A., Watt, M. J. Stearoyl CoA desaturase 1 is elevated in obesity but protects against fatty acid-induced skeletal muscle insulin resistance in vitro. Diabetologia. 49 (12), 3027-3037 (2006).
- Gastebois, C., et al. Transition from physical activity to inactivity increases skeletal muscle miR-148b content and triggers insulin resistance. Physiol Rep. 4 (17), (2016).
- Naimi, M., Tsakiridis, T., Stamatatos, T. C., Alexandropoulos, D. I., Tsiani, E. Increased skeletal muscle glucose uptake by rosemary extract through AMPK activation. Appl Physiol Nutr Metab. 40 (4), 407-413 (2015).
- Feng, Y. Z., et al. PPARdelta activation in human myotubes increases mitochondrial fatty acid oxidative capacity and reduces glucose utilization by a switch in substrate preference. Arch Physiol Biochem. 120 (1), 12-21 (2014).
- Perrin, L., et al. Human skeletal myotubes display a cell-autonomous circadian clock implicated in basal myokine secretion. Mol Metab. 4 (11), 834-845 (2015).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Bouzakri, K., et al. Malonyl CoenzymeA decarboxylase regulates lipid and glucose metabolism in human skeletal muscle. Diabetes. 57 (6), 1508-1516 (2008).
- Shemyakin, A., et al. Endothelin-1 reduces glucose uptake in human skeletal muscle in vivo and in vitro. Diabetes. 60 (8), 2061-2067 (2011).
- Alkhateeb, H., Chabowski, A., Glatz, J. F., Luiken, J. F., Bonen, A. Two phases of palmitate-induced insulin resistance in skeletal muscle: impaired GLUT4 translocation is followed by a reduced GLUT4 intrinsic activity. Am J Physiol Endocrinol Metab. 293 (3), E783-E793 (2007).
- Coll, T., et al. Oleate reverses palmitate-induced insulin resistance and inflammation in skeletal muscle cells. J Biol Chem. 283 (17), 11107-11116 (2008).
- Gaster, M., Rustan, A. C., Beck-Nielsen, H. Differential utilization of saturated palmitate and unsaturated oleate: evidence from cultured myotubes. Diabetes. 54 (3), 648-656 (2005).
- Hage Hassan, R., et al. Endoplasmic reticulum stress does not mediate palmitate-induced insulin resistance in mouse and human muscle cells. Diabetologia. 55 (1), 204-214 (2012).
- Haghani, K., Pashaei, S., Vakili, S., Taheripak, G., Bakhtiyari, S. TNF-alpha knockdown alleviates palmitate-induced insulin resistance in C2C12 skeletal muscle cells. Biochem Biophys Res Commun. 460 (4), 977-982 (2015).
- Hommelberg, P. P., et al. Palmitate-induced skeletal muscle insulin resistance does not require NF-kappaB activation. Cell Mol Life Sci. 68 (7), 1215-1225 (2011).
- Yang, M., et al. Saturated fatty acid palmitate-induced insulin resistance is accompanied with myotube loss and the impaired expression of health benefit myokine genes in C2C12 myotubes. Lipids Health Dis. 12, 104(2013).
- Peng, G., et al. Oleate blocks palmitate-induced abnormal lipid distribution, endoplasmic reticulum expansion and stress, and insulin resistance in skeletal muscle. Endocrinology. 152 (6), 2206-2218 (2011).
- Lambernd, S., et al. Contractile activity of human skeletal muscle cells prevents insulin resistance by inhibiting pro-inflammatory signalling pathways. Diabetologia. 55 (4), 1128-1139 (2012).
- Nikolic, N., et al. Electrical pulse stimulation of cultured human skeletal muscle cells as an in vitro model of exercise. PLoS One. 7 (3), e33203(2012).
- Hsu, F. L., et al. Antidiabetic effects of pterosin A, a small-molecular-weight natural product, on diabetic mouse models. Diabetes. 62 (2), 628-638 (2013).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Catalano, K. J., et al. Insulin resistance induced by hyperinsulinemia coincides with a persistent alteration at the insulin receptor tyrosine kinase domain. PLoS One. 9 (9), e108693(2014).
- Liu, H. Y., et al. Insulin is a stronger inducer of insulin resistance than hyperglycemia in mice with type 1 diabetes mellitus (T1DM). J Biol Chem. 284 (40), 27090-27100 (2009).
- Renstrom, F., Buren, J., Svensson, M., Eriksson, J. W. Insulin resistance induced by high glucose and high insulin precedes insulin receptor substrate 1 protein depletion in human adipocytes. Metabolism. 56 (2), 190-198 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados