Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Iontoforesis en tiempo real con tetrametilamonio para cuantificar la fracción de volumen y la tortuosidad del espacio extracelular cerebral
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe la iontoforesis en tiempo real, un método que mide los parámetros físicos del espacio extracelular (ECS) de los cerebros vivos. La difusión de una molécula inerte liberada en el ECS se utiliza para calcular la fracción volumétrica de ECS y la tortuosidad. Es ideal para estudiar cambios reversibles agudos en ECS cerebral.
Resumen
Esta revisión describe los conceptos básicos y el protocolo para realizar el método de iontoforesis en tiempo real (RTI), el patrón oro para explorar y cuantificar el espacio extracelular (ECS) del cerebro vivo. El ECS rodea todas las células cerebrales y contiene tanto el líquido intersticial como la matriz extracelular. El transporte de muchas sustancias necesarias para la actividad cerebral, incluyendo neurotransmisores, hormonas y nutrientes, se produce por difusión a través de la ECS. Los cambios en el volumen y la geometría de este espacio ocurren durante los procesos cerebrales normales, como el sueño, y condiciones patológicas, como la isquemia. Sin embargo, la estructura y la regulación de ECS cerebral, particularmente en estados enfermos, sigue siendo en gran parte inexplorada. El método RTI mide dos parámetros físicos del cerebro vivo: fracción volumétrica y tortuosidad. La fracción de volumen es la proporción de volumen de tejido ocupado por ECS. La tortuosidad es una medida del impedimento relativo que una sustancia encuentra cuando se difunde a través de un cerebroEn comparación con un medio sin obstrucciones. En RTI, una molécula inerte es pulsada desde un microelectrodo fuente en el cerebro ECS. A medida que las moléculas se difunden lejos de esta fuente, la concentración cambiante del ion se mide con el tiempo usando un microelectrodo selectivo de iones situado aproximadamente a 100 μm de distancia. A partir de la curva de difusión resultante, tanto la fracción volumétrica como la tortuosidad pueden ser calculadas. Esta técnica se ha utilizado en rebanadas cerebrales de múltiples especies (incluyendo seres humanos) e in vivo para estudiar los cambios agudos y crónicos de ECS. A diferencia de otros métodos, RTI se puede utilizar para examinar tanto los cambios reversibles e irreversibles de la ECS cerebral en tiempo real.
Introducción
El espacio extracelular (ECS) es la red de canales interconectados exteriores a todas las células cerebrales y contiene tanto fluido intersticial como matriz extracelular ( Figura 1a y Figura 1b ). La distribución de muchas sustancias necesarias para la función de las células cerebrales, incluyendo nutrientes, hormonas y neurotransmisores, se produce por difusión a través de la ECS. Los cambios en los parámetros físicos de este espacio, incluyendo el volumen, la geometría y la matriz extracelular, pueden afectar drásticamente la difusión a través de la ECS y las concentraciones de iones locales que bañan las células cerebrales, que tienen un profundo impacto en la función de las células cerebrales 1 , 2 .
La iontoforesis en tiempo real (RTI) se utiliza para determinar dos características estructurales de una región del cerebro: fracción volumétrica y tortuosidad 3 , 4 ,"Xref"> 5. La fracción de volumen ( α ) es la proporción de volumen de tejido ocupado por la ECS ( V ECS ) con respecto al volumen de tejido total ( tejido V ) en un volumen elemental representativo;
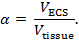
La tortuosidad ( λ ) es el obstáculo relativo que una sustancia encuentra cuando se difunde a través de una región del cerebro en comparación con un medio sin obstrucciones;

Donde D * (cm 2 s -1 ) es el coeficiente de difusión efectiva de la sustancia en el cerebro y D (cm 2 s -1 ) es el coeficiente de difusión libre de la sustancia en un medio libre, tal como gel de agarosa diluido.
Hoy en día, la sustancia de sonda más comúnmente utilizada para la RTI es el tetrametilamonio catiónico pequeño (TMA). TMA tiene un peso molecular de 74 g / mol, se disocia completamente en solución y tiene una carga positiva. RTI estudios con este ion han demostrado que α  0,2 y λ
0,2 y λ  1,6 1 , 2 . Esto significa que el ECS es aproximadamente el 20% del volumen total del cerebro y que la difusión de una pequeña molécula inerte ocurre aproximadamente 2,5 veces más lenta en el ECS que en un medio sin obstrucciones 3 . Sin embargo, ambos α y λ varían con la edad, región y estado del cerebro y en condiciones patológicas 1 . Las alteraciones de estos parámetros se han relacionado con el desarrollo del cerebro, el envejecimiento, el sueño, la epilepsia y muchos otros procesos y enfermedades fundamentales del cerebro 1, 6 . Mientras que otras técnicas miden α y λ , RTI puede medir tanto en regiones localizadas de tejido vivo en tiempo real. Por esta razón, RTI se ha convertido en una herramienta indispensable para investigar los cambios en α y λ durante desafíos agudos y reversibles.
1,6 1 , 2 . Esto significa que el ECS es aproximadamente el 20% del volumen total del cerebro y que la difusión de una pequeña molécula inerte ocurre aproximadamente 2,5 veces más lenta en el ECS que en un medio sin obstrucciones 3 . Sin embargo, ambos α y λ varían con la edad, región y estado del cerebro y en condiciones patológicas 1 . Las alteraciones de estos parámetros se han relacionado con el desarrollo del cerebro, el envejecimiento, el sueño, la epilepsia y muchos otros procesos y enfermedades fundamentales del cerebro 1, 6 . Mientras que otras técnicas miden α y λ , RTI puede medir tanto en regiones localizadas de tejido vivo en tiempo real. Por esta razón, RTI se ha convertido en una herramienta indispensable para investigar los cambios en α y λ durante desafíos agudos y reversibles.
La teoría que apoya RTI fue originalmente validada por Nicholson y Phillips, y la técnica se ha utilizado ampliamente desde entonces 4 , 7 . Los experimentos que emplean RTI comienzan con la liberación de un pulso de TMA desde un microelectrodo fuente por iontoforesis en un gel de agarosa diluido. Una vez expulsados, los iones se difunden libremente lejos de la fuente puntual, eligiendo entre un número potencialmente infinito de trayectos aleatorios ( Figura 1d ). La concentración cambiante del ion se mide con el tiempo utilizando un microelectrodo selectivo de iones (ISM) situado aproximadamente100 μm de distancia ( Figura 1c ). Los cambios en la concentración de TMA se representan gráficamente y se ajustan a una curva que permite calcular tanto el D como el número de transporte del microelectrodo de iontoforesis (parámetros discutidos en el Protocolo). Con estos valores, el procedimiento se repite en una región cerebral de interés para obtener D * y para calcular tanto α como λ . El control del microelectrodo de iontoforesis, la recopilación de datos, la representación gráfica y la adaptación de la curva de concentración de TMA y el cálculo de los parámetros experimentales son típicamente realizados por los programas Wanda y Walter, específicamente diseñados para este fin (el software y sus manuales son Libremente disponible de los autores a petición).
La sección del Protocolo de esta revisión describe los procedimientos básicos necesarios para diseñar y realizar la RTI en rodajas de cerebro de roedores. La técnica también se ha utilizado en la no-barraIncluyendo los cortes del cerebro humano y las preparaciones in vivo del cerebro 1 , 4 , 6 , 8 , 9 . La sección Resultados representativos proporciona resultados ideales y no ideales para resaltar matices en la interpretación de datos. Finalmente, la sección de Discusión abarca brevemente técnicas de resolución de problemas, limitaciones de RTI, técnicas alternativas usadas para estudiar el ECS y aplicaciones futuras de RTI.

Figura 1: Diagramas de difusión a través de ECS. (A) Diagrama de ECS: Demuestra el tamaño y la ubicación de la ECS en una sección de cerebro típico. El amarillo marca el ECS entre los procesos grises de las células cerebrales. El volumen de ECS es aproximadamente 20% del volumen de tejido total ( es decir, la fracción de volumen = 0.2) en condiciones fisiológicas. B ) Diagrama ampliado del ECS: Destaca los parámetros físicos que contribuyen a la tortuosidad, incluyendo la geometría de las células cerebrales (gris) y la matriz extracelular (diagrama como una malla de glicosaminoglicanos multicolores y proteoglicanos). ( C ) Diagrama 3D de difusión de una fuente puntual: Demuestra el movimiento neto de moléculas inertes de una fuente iontoforética a una ISM. Excluyendo barreras de difusión y captación celular, las moléculas se difunden hacia el exterior en todas las direcciones, produciendo un frente de concentración esférica. El ISM cuantifica la concentración local de las moléculas inertes liberadas de la fuente iontoforética. D ) Simulación por computadora de la difusión en ECS del cerebro: [Extremo izquierdo] Configuración para la simulación de Monte Carlo; Las esferas verdes representan los procesos de las células cerebrales y la cruz roja representa una fuente puntual. Esta configuración modela el tejido cerebral diagrama en la Figura 1a . [Imágenes medias] 3 y6 moléculas que realizan movimientos al azar mientras que difunden a través del espacio extracelular del cerebro, demostrado en 2 dimensiones. [Derecha] Caminatas aleatorias de muchas moléculas liberadas de la fuente puntual. El movimiento neto de todas las moléculas desde la fuente puntual está hacia fuera como se representa en la Figura 1c . Los paseos aleatorios acumulados delimitan los espacios entre las celdas ( es decir, el ECS, véase la referencia 5 para una explicación adicional). Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los procedimientos con animales, usados para obtener muestras de tejido, fueron aprobados por el comité de ética animal en el SUNY Downstate Medical Center.
1. Preparación de soluciones y equipos
- Preparar una solución de relleno de NaCl 150 mM para el barril de referencia del ISM. Guárdelo en una jeringa de 10 ml unida a un filtro de 0,22 μm (para eliminar bacterias o partículas).
- Preparar una solución de relleno de cloruro TMA (TMA-Cl) 150 mM para los microelectrodos. Guárdelo en una jeringa de 10 ml unida a un filtro de 0,22 μm. Prepare las soluciones de TMA-Cl (en este protocolo) de una solución madre de 5 M para asegurar la concentración correcta.
- Chloridize por lo menos cuatro alambres de plata para la fabricación de microelectrodes sumergiendo los alambres en lejía (hypochlorite de sodio) por lo menos 2 h. Retire el exceso de lejía con etanol y deje que los cables se sequen.
- Preparar 50 ml de agarosa al 0,3% en NaCl 150 mM y TMA-Cl 0,5 mM en un vaso de precipitadosY cubrirlo. Utilice agarosa pulverizada y razonablemente fresca para asegurar buenas mediciones de difusión.
- Calentar y mezclar la solución de agarosa con una barra de agitación para disolverla. Deje que la solución se enfríe a temperatura ambiente. Guárdelo a 4 ° C durante 1 semana.
- Preparar un electrodo (tierra) indiferente hecho de agarosa al 4% en KCl 1 M (direcciones en el Suplemento A)
- Fabricar una pequeña taza porosa que puede caber en la cámara experimental y que permite la continuidad eléctrica entre su contenido y el entorno exterior ( Figura 2a ). Coloque un anillo de metal en la parte inferior de esta taza para evitar que flote cuando se sumerge parcialmente en agua.
- Utilizar la dilución en serie de un stock de TMA-Cl de 5 M para preparar cinco soluciones de 100 ml de TMA-Cl para la calibración de los ISM. Las soluciones deben tener concentraciones finales de 0,5, 1, 2, 4 y 8 mM de TMA-Cl, todas en NaCl 150 mM. Guarde las soluciones de calibración en un recipiente sellable para evitar la evaporación.
2. Configuración electrónica
- Conectar los componentes de la instalación experimental RTI de acuerdo con el diagrama de bloques de la Figura 2b ; Incluyen un amplificador con dos canales de entrada (uno de los cuales debe ser de muy alta impedancia para el cañón selectivo de iones del ISM), un filtro de paso bajo ajustado a 10 Hz, un registrador gráfico, un A / D + D / A , Una unidad iontoforética (o un amplificador capaz de suministrar impulsos de corriente constante), y una computadora (PC) que ejecuta los programas Wanda y Walter. Inspeccione la configuración electrónica para confirmar que todas las conexiones están en su lugar.
- Escudo de la configuración experimental en un recinto conectado a tierra (como una jaula de Faraday), si es necesario, como ISMs tienen una alta resistencia y son sensibles a los artefactos creados por el movimiento cercano.
- Crear una estación dedicada de calibración ISM que consta de un amplificador de entrada doble, un registrador gráfico, un titular ISM apropiado, y un electrodo de tierra indiferente. Si es posible,Proteger el recinto. Omita este paso si los ISM se calibran en la configuración experimental (paso 3.29)

Figura 2: Copa Experimental Porosa y Configuración Electrónica. (A) taza experimental poroso: Una malla porosa se utiliza para crear una taza experimental que permite la continuidad eléctrica entre la agarosa (interior) y el fluido de baño experimental (exterior). Un anillo de metal se une al fondo de la copa para evitar que la copa flote en la solución de baño. ( B ) Diagrama de bloques de la configuración RTI (pasos 2.1 y 2.2): Un ISM está conectado a un amplificador (amplificador). El ISM tiene dos barriles. Uno contiene el intercambiador de iones líquidos (LIX) en la punta y genera un voltaje proporcional al logaritmo de la concentración de TMA en la punta junto con la tensión ambiente local; ThE la trayectoria de la señal está representada por una línea roja. El otro barril del ISM es conocido como el barril de referencia y mide la tensión ambiental en la punta del ISM; Está conectada por una trayectoria de señal azul. El amplificador tiene dos etapas llamadas de cabeza que se conectan al ISM; Estas unidades tienen una ganancia de 1 (x1) y coinciden con la alta impedancia del microelectrodo a la baja impedancia del resto del circuito del amplificador. La etapa de cabeza conectada al tambor selectivo de iones debe ser capaz de igualar una resistencia de entrada de aproximadamente 1.000 MΩ, mientras que la resistencia del cilindro de referencia es típicamente de aproximadamente 10 MΩ. Después de salir de la etapa de cabeza, la tensión desde el barril de referencia se invierte y se resta de la tensión en el tambor selectivo de iones utilizando un amplificador de suma (Σ) para obtener la tensión de la señal de ión puro. Las salidas del amplificador pasan a una unidad de acondicionamiento de señal que proporciona amplificación adicional y un filtro de paso bajo multipolar (≤ 10 Hz, normalmente un Bessel fiLter), que elimina el ruido y previene aliasing de señal en el convertidor analógico-digital (A / D). Las salidas del filtro también se muestran en un registrador de gráfico de banda. El convertidor A / D digitaliza las señales y las envía a un ordenador personal (PC). El PC también genera una señal digital que es convertida por un convertidor digital-analógico (D / A) a un impulso de voltaje analógico que se alimenta a la unidad de iontoforesis, que convierte el voltaje a un impulso de corriente de amplitud constante y lo envía Al microelectrodo de iontoforesis. El trayecto de la señal de iontoforesis está representado por una línea verde. La adquisición de datos y la señal de iontoforesis están bajo el control del programa Wanda, que genera un archivo de salida para cada registro de difusión en forma de registro de voltaje versus tiempo, junto con todos los parámetros que definen el experimento. Un segundo programa, Walter, lee el archivo de salida y utiliza datos de calibración ISM para convertir las tensiones digitalizadas en concentraciones. La concentración veLas curvas de tiempo rsus se ajustan entonces en Walter a la solución apropiada a la ecuación de difusión. D yn t se extraen si el medio es agarosa, y λ y α se extraen si el medio es el cerebro. Las señales analógicas son líneas sólidas; Las señales digitales son líneas punteadas. También hay un electrodo de tierra indiferente (no mostrado) en el baño que contiene la rebanada. Líneas rojas = señal de iones, Líneas azules = señal de referencia, Líneas verdes = comando de iontoforesis, Líneas sólidas = analógicas, Líneas punteadas = digital. Haga clic aquí para ver una versión más grande de esta figura.3. Preparación y calibración de microelectrodos selectivos de iones
- Fabricar ISM utilizando el protocolo a continuación un día antes del experimento. Hacer ISMs en lotes para asegurarse de que al menos dos de trabajo en el día del experimento.
NOTA: La mayoría de los ISMs son estables durante un día odos. La fabricación de ISM es sensible a la humedad ya las condiciones atmosféricas. No todos los microelectrodos se calibrarán con éxito. - Retirar aproximadamente 0,5 cm de vidrio al final de uno de los barriles de un capilar de vidrio de borosilicato de doble cañón usando un par de pinzas de edad.
- Chip un solo barril en el extremo opuesto del capilar ( Figura 3a ]. Asegúrese de que el tabique no esté dañado (crítico). Precaución: Use gafas protectoras para evitar lesiones debido al cristal del proyectil.
- Coloque el capilar en una botella de acetona durante al menos 1 h para eliminar los contaminantes.
- Retirar el capilar de la acetona y pulverizar gas nitrógeno limpio, seco, comprimido o aire a través de él para eliminar cualquier exceso de acetona. Eliminar toda la acetona en el capilar, ya que la acetona residual puede interferir con la silanización (crucial).
- Fabricar la punta de la micropipeta en un extractor vertical o horizontal. Adapte los parámetros para tirar de una pipeta con unaPunta afilada, de aproximadamente 1 μm o menos de diámetro. Al final de esta etapa, un capilar se convertirá en dos pipetas ( Figura 3a ).
- Visualice una sola micropipeta bajo un microscopio compuesto, erguido con un objetivo de 10X. Cortar la punta usando una lámina de microscopio de vidrio de modo que el diámetro final de la punta ( es decir, ambos barriles) esté entre 2 y 5 μm ( Figura 3b ). A partir de ahora, esta pipeta se denominará ISM.
- Llenar el barril desmenuzado del ISM con solución de referencia de NaCl 150 mM a través de la abertura en el lado astillado usando una jeringa de 10 ml unida a un filtro de 0,22 μm y una aguja de 28 G, 97 mm ( Figura 3b ). No llenar el barril más allá de tres cuartos de la altura del cañón.
- Llene el barril sin astillas del ISM con una solución de relleno TMA-Cl 150 mM. Toque suavemente el ISM para eliminar cualquier burbuja de aire de la solución. Compruebe si hay burbujas debajo del micrófonoRoscopio usado para chipping la punta.
- Llama la parte posterior del ISM con un quemador Bunsen para asegurar que no se produzca comunicación de la solución de relleno a través del tabique en la parte posterior del ISM. Asegúrese de que la parte superior de la cuarta parte del ISM esté seca después de la llama.
- Inserte un alambre de plata cloridizado en la solución de referencia del ISM y doble el alambre que sobresale del capilar para marcarlo como el barril de referencia ( Figura 3c ). Asegúrese de que el alambre está sumergido en la solución de relleno y permanece en solución durante todo el experimento.
- Deslice una longitud corta de tubo de politetrafluoroetileno (aproximadamente 20 cm de largo) sobre la punta de una aguja de jeringa de 25 G. Coloque el otro extremo de la tubería en la parte posterior del barril selectivo de iones. Asegúrese de que el tubo esté en el barril pero encima de la solución de relleno ( Figura 3c ).
- Calentar un palo de cera dental con una hornilla de Bunsen y sellar el tubo y el silvEn sus respectivos barriles ( Figura 3c ). Asegúrese de que se produzca un sellado de aire completo alrededor del tubo de plástico en el barril selectivo de iones (crítico).
- Preparar un pequeño recipiente de vidrio transparente (5 ml o menos) de clorotrimetilsilano al 4% en xileno. Precaución: Los xilenos y los silanos son muy peligrosos para la salud; Maneje ambos productos químicos dentro de una campana extractora y deséchelos apropiadamente.
- Coloque el recipiente delante de un microscopio de disección estéreo montado horizontalmente en una campana extractora. Asegure el ISM verticalmente sobre el contenedor usando un micromanipulador ( Figura 3d ).
- Sumerja la punta del microelectrodo en la solución de clorotrimetilsilano.
- Conecte una jeringa vacía de 10 ml a la aguja de calibre 25 que conduce al ISM. Aplicar presión de aire positiva de la jeringa hasta que se forme una burbuja de solución de TMA-Cl; Este paso debe realizarse bajo visualización directa a través del microscopio.
- Toque suavemente el soporte ISM para eliminar la burbuja de la punta.
- Dibuje la solución de clorotrimetilsilano a una altura de aproximadamente 1.500 μm en la punta del ISM usando presión negativa en la jeringa de 10 ml.
- Expulsar completamente la solución de clorotrimetilsilano desde la punta del ISM hasta que se forme una burbuja de solución de TMA-Cl en la punta ( Figura 3d ).
- Repita los pasos 3.19 y 3.20 cinco veces. Asegúrese de que una columna uniforme, ininterrumpida de fluido es atraído hacia dentro de la punta cada vez. Si no se puede extraer ninguna solución en la punta, compruebe si la tubería está bloqueada, si el sello de aire está incompleto o si la punta del ISM está bloqueada.
- Vaciar toda la solución de clorotrimetilsilano de la punta hasta que se genere una burbuja de solución de TMA-Cl.
- Mientras se mantiene la presión positiva sobre la jeringa, retire el ISM de la solución de xileno. Asegúrese de que toda la solución de xileno es expulsada de la punta del ISM, ya que el exceso de xileno arruinará el excColgador creado en pasos posteriores.
- Coloque la punta del ISM en un recipiente pequeño y transparente (ya sea el intercambiador o una pequeña cubeta) que sostiene el intercambiador de iones líquidos (LIX) para TMA. Realice este paso bajo la visualización directa usando la configuración horizontal del microscopio.
- Aplique una pequeña cantidad de presión negativa para extraer una cantidad mínima de LIX en la punta ( es decir, tan pronto como LIX se ve entrando en la punta, deje de aplicar presión negativa).
- Desconecte la jeringa de 10 ml de la tubería y permita que el ISM para sentarse durante 5 min. Durante ese tiempo, el LIX entrará en la punta silanizada hasta alcanzar un estado de equilibrio.
- Quitar el ISM del LIX. Saque el tubo del intercambiador (mientras retira la menor cantidad de cera posible). Coloque un alambre de plata cloridizado en la pequeña abertura creada en el extremo posterior del ISM. Selle el alambre en el relleno del barril intercambiador con cera fundida.
- Permitir que el ISM se sienteDurante al menos 30 min. Conecte los ISM completos al borde interior de un vaso usando cualquier adhesivo flexible y temporal.
- Calibre el ISM registrando el voltaje medido por el ISM en cada solución de calibración hecha en el paso 1.8.
NOTA: La calibración se puede realizar en una estación de calibración (ver paso 2.3) o en la configuración experimental. Este procedimiento se describe en el Suplemento B y en Haack et al 10 . - Si la calibración del ISM tuvo éxito para varios ISM, haga una pausa aquí hasta el día del uso previsto. Si no, fabrique más ISMs.
- El día del experimento, vuelva a calibrar el microelectrodo (ver paso 3.29).

Figura 3: Preparación de un microelectrodo selectivo de iones. (A) ISM después de astillado de nuevo los extremos de un capilar y tirando (pasos 3.2 a 3.6): Una sola barril en ambos extremos oEl vidrio capilar es astillado. Un ISM se genera tirando de un capilar de vidrio de doble cañón para generar dos micropipetas con puntas finas. ( B ) ISM después de rellenar ambos barriles (pasos 3.7-3.9): La punta de un único ISM se astilla a un diámetro de 2-5 μm. El barril selectivo de iones se rellena con TMA-Cl, y el barril de referencia se rellena con NaCl. ( C ) ISM antes del revestimiento con clorotrimetilsilano (etapas 3.11-3.13): Se inserta un alambre de plata cloridizado en el cilindro de referencia. El tubo de politetrafluoroetileno (PTFE) se conecta a una aguja de 25 G y se inserta en el barril selectivo de iones. Un sello hermético en la parte superior de ambos barriles se crea usando la cera dental. ( D ) Recubrimiento de una micropipeta con clorotrimetilsilano (etapas 3.15-3.26): [Ampliación baja] Un ISM suspendido en clorotrimetilsilano en línea con un estereomicroscopio montado horizontalmente. [Alto aumento] La vista a través de un estereomicrosc horizontalmente montadoOpe de una punta ISM en solución de clorotrimetilsilano. Después de la visualización de la punta a través de un microscopio, se expulsa una pequeña cantidad de solución de TMA-Cl del barril selectivo de iones (suficiente para generar una pequeña burbuja de solución de TMA-Cl). El soporte de ISM se hace girar para liberar una burbuja de solución de TMA-Cl y luego el clorotrimetilsilano se extrae en la punta. Este ciclo se repite varias veces. Después de que todo el clorotrimetilsilano es expulsado del ISM, el ISM se coloca en el intercambiador de iones lıquidos (LIX) para TMA y LIX es aspirado en la punta del barril selectivo de iones. Haga clic aquí para ver una versión más grande de esta figura.4. Preparación de microelectrodos de iontoforesis
NOTA: Los microelectrodos de iontoforesis deben fabricarse el día del experimento.
- Tire de un capilar de vidrio de borosilicato de doble cañón en una vertical u hoExtractor rizontal Adapte los parámetros para tirar de una pipeta similar a las micropipetas extraídas en el paso 3.6 ( Figura 4a ).
- Colocar la micropipeta bajo el microscopio compuesto utilizado en el paso 3.7 y cortar la punta utilizando un portaobjetos de microscopio de vidrio para que el diámetro resultante esté entre 2 y 5 μm ( Figura 4a ).
- Llenar ambos barriles con la solución de relleno TMA-Cl 150 mM usando una jeringa de 10 ml unida a un filtro de 0,22 μm y una aguja de 28 G, 97 mm ( Figura 4a ).
- Toque ligeramente la micropipeta para asegurarse de que no queden burbujas de aire en la solución de ambos barriles.
- Coloque los cables de plata cloridada en ambos barriles de la micropipeta. Asegúrese de que los cables sean lo suficientemente profundos en las soluciones de relleno para que permanezcan en contacto con las soluciones durante todo el experimento.
- Sellar los cables en los barriles con cera dental caliente. Suavemente enclavamiento Los alambres retorciéndolos uno alrededor del otro (microelectrodo completo mostrado en la Figura 4b ).
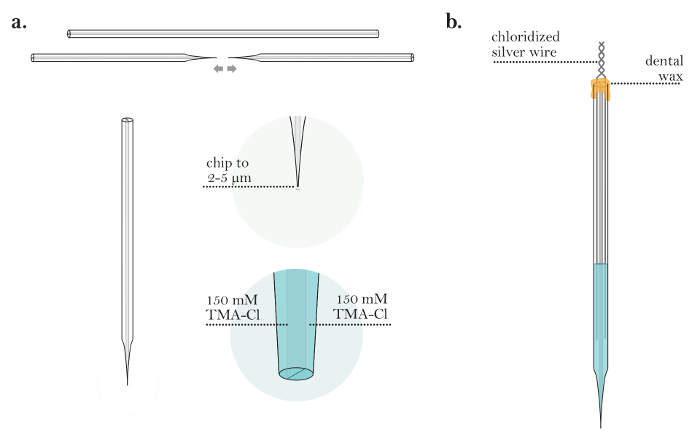
Figura 4: Preparación de un microelectrodo de iontoforesis. (A) microelectrodo iontoforesis después de rellenar los dos cañones (pasos 4.1 a 4.3): Un microelectrodo iontoforesis se extrae de un tubo capilar. La punta del microelectrodo se astilla hasta un diámetro de 2-5 μm. Ambos barriles del microelectrodo de iontoforesis se llenan con solución de TMA-Cl. B ) Microelectrodo de iontoforesis completado (etapas 4.5-4.6): Un microelectrodo de iontoforesis con dos alambres de plata clorados insertados en los barriles. Los barriles del microelectrodo se sellan con cera, y los alambres de plata se retuercen juntos en la parte posterior del microelectrodo./files/ftp_upload/55755/55755fig4large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.5. Preparación de líquido cefalorraquídeo artificial y rodajas de tejidos cerebrales de roedores
- Preparar 1 L de líquido cefalorraquídeo artificial (ACSF) con una composición adecuada para el experimento y añadir 0,5 mM de TMA-Cl a la misma.
NOTA: El TMA-Cl es necesario para establecer una concentración de fondo de TMA durante el experimento. - Preparar rodajas de cerebro de roedor con un grosor de 400 μm de acuerdo con los protocolos estándar 11 , 12 . Utilice el ACSF preparado en el paso 5.1 para la disección y el mantenimiento de las rodajas de cerebro.
6. Iontoforesis en tiempo real en Agarosa
- Encienda el ordenador que ejecuta los programas Walter y Wanda.
NOTA: Estos programas están disponibles libremente bajo petición. Si bien este software no es esencial, la programación similarSoftware o realizar el análisis a mano de otro modo sería necesario. - Ejecutar ACSF a través de la cámara de inmersión a una velocidad apropiada ( por ejemplo, 2 ml / min). Ajuste el controlador de temperatura a una temperatura deseada y burbujee ACSF con 95% O 2 /5% CO 2 (u otra mezcla de gas apropiada) durante la duración del experimento.
- Monte un electrodo indiferente (tierra) en un soporte adecuado y sumerja la punta en el ACSF que atraviesa la cámara de inmersión. Conecte el cable al suelo de la configuración de grabación.
- Llenar la copa porosa (realizada en el paso 1.7) con la agarosa al 0,3% preparada previamente y colocarla en la cámara de inmersión. Asegúrese de que la solución no pase por encima de la copa.
- Asegure un ISM calibrado al porta-pipeta de un micromanipulador y un microelectrodo de iontoforesis al segundo. Coloque los soportes en un ángulo apropiado para la configuración ( Figura 5a ).
- ConectarEl ISM y los hilos de microelectrodo de iontoforesis a sus respectivas etapas principales del amplificador de grabación. Alternativamente, conecte directamente al amplificador (dependiendo de la configuración).
- Asegúrese de que el peso / posicionamiento de los cables o clips de conexión no provoca ningún movimiento de los microelectrodos, ya que pequeñas fluctuaciones en el posicionamiento pueden influir en los resultados.
- Encienda la configuración electrónica (desde el paso 2). Comienza Walter y Wanda en instancias separadas.
- En la GUI de Wanda, haga clic en "Calibrar" ( Figura 6a ). En la caja de Calibración ( Figura 6b ), rellene los voltajes medidos durante la calibración ISM (paso 3.29) y haga clic en "Ajustar datos".
NOTA: Esto permite ajustar a la siguiente representación de la ecuación de Nicolsky (alternativamente ajustar la ecuación por otro medio para obtener M y K ):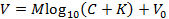
SuE, V es la tensión medida (mV), M es la pendiente de Nicolsky (mV), C es la concentración de ion (mM), K es la interferencia (mM) y V 0 es la tensión de desplazamiento (mV) 3 . - Haga clic en "Aceptar" en el cuadro Calibrar para transferir automáticamente la pendiente ( M ) y la interferencia ( K ) generada en el paso 6.9 a la GUI principal.
NOTA: Aquí, K representa la interferencia de Na, que es generalmente insignificante. - En el lado izquierdo de la GUI, asegúrese de que todos los parámetros experimentales se ajusten en las entradas correspondientes ( Figura 6a ).
- En el cuadro Método de origen, ajuste la fuente a la fuente iontoforética (predeterminada), la "Duración de grabación" a "200 s" (predeterminado), "Pulse Begin" a "10 s" A "60 s" (predeterminado), la "Corriente de polarización" a "20 nA" (predeterminado), la"Main Current" a "100 nA" (predeterminado), y el "Factor de conversión" a un valor apropiado.
- En la caja del electrodo de medición, ajuste "Baño C" a la concentración de TMA contenida dentro de la solución del baño (expresada en mM). Ajuste el "Gain Total", "Canal de Salida", "Canal ISM" y "Canal Ref." A los valores apropiados para el sistema de adquisición de datos en uso.
NOTA: El "factor de conversión" debe ajustarse a un valor apropiado (específico para la unidad iontoforética en uso). Este valor especifica la cantidad de corriente que se pasa para una tensión aplicada dada desde el convertidor D / A (nA / mV).
- Coloque una sonda de temperatura en la taza de agar. Registre la temperatura medida en la entrada "Temperatura" en el cuadro "Electrodo de medición" de la GUI ( Figura 6a ).
- Encienda el iluminador de la sub-etapa. Si es necesario, encienda la cámara conectada al micrófonoRoscopio y monitor de cámara.
- Bajar los microelectrodos por lo menos 1000 μm de profundidad en la agarosa y centrarlos en la taza ( Figura 5b ). Visualizarlos bajo el microscopio usando un objetivo 10X (objetivo de inmersión en agua con una distancia de trabajo larga).
- Desplazar el voltaje en el amplificador a 0 mV para los canales de referencia y ISM con el fin de establecer el voltaje registrado en la agarosa como voltaje de línea de base.
- En el amplificador de dos canales, mueva manualmente el conector de canal ISM a la salida de sustracción de tensión para establecer la "restauración" entre los canales de referencia y ISM.
NOTA: La sustracción asegura que los cambios de voltaje en el canal ISM reflejen solo los cambios en la concentración de TMA. - Mueva el ISM para que toque la punta del microelectrodo de iontoforesis. Centrar las puntas entre sí en los tres ejes direccionales.
- Cero las posiciones relativas de ambos microelectrodos en laCajas de control del micromanipulador. Asegúrese de que los microelectrodos están centrados con precisión y precisión (crítica).
- Mueva el ISM a 120 μm del microelectrodo de iontoforesis en un eje (eje izquierda-derecha, figura 5b ). Introduzca esta distancia en el cuadro "Electrodo de medición" de la GUI ( Figura 6a ).
- Inicie una grabación haciendo clic en "Adquirir" en la GUI ( Figura 6a ); Permite al programa grabar una grabación completa.
NOTA: El microelectrodo de iontoforesis recibe una corriente de polarización constante. Después de hacer clic en "Adquirir", hay un breve retraso antes de que se aplique la corriente principal por un tiempo limitado. - Repita el paso 6.20 dos o tres veces más. Espere hasta que la señal de TMA vuelva a la línea de base antes de adquirir nuevos registros; El programa guardará cada registro para su posterior análisis.
- Compruebe el espaciamiento de los dos microelectrodos moviendo el ISM hacia atrás tO la posición cero especificada por la caja de control. Si los microelectrodos ya no están centrados, vuelva a centrarlos utilizando la misma estrategia que en el paso 6.17. Registre cualquier cambio en la posición de los electrodos.
NOTA: Si el espaciado cambia en más del 2% aproximadamente, los registros adquiridos en el paso 6.19 no pueden ser considerados exactos y deben tomarse nuevos.

Figura 5: Configuración para Experimentos en Agar. (A) el programa de instalación para el experimento en agar diluido (pasos 6.1 a 6.5): Un pequeño recipiente poroso lleno de agar diluido colocado en una cámara de perfusión en funcionamiento. Un microelectrodo de iontoforesis (lado izquierdo) y un ISM (lado derecho) son sostenidos por microelectrodos; Los soportes de microelectrodos se encajan en los brazos de micromanipuladores robóticos. Una sonda de temperatura se coloca en gel de agar, y un electrodo de tierra indiferente es plDentro de la cámara de inmersión. (B) Vista ampliada de microelectrodos en agar: Un microelectrodo iontoforesis (lado izquierdo) y un ISM (lado derecho) se visualizan en agar utilizando un objetivo de inmersión 10X agua (objetivo inmersos aquí en NaCl 150 mM). Los microelectrodos se colocan usando micromanipuladores a una profundidad de 1.000 μm; La separación entre microelectrodos es de 120 μm. Haga clic aquí para ver una versión más grande de esta figura.
Figura 6: Interfaz de software de computadora Wanda. (A) Navegando Wanda interfaz gráfica de usuario (GUI): La pantalla que aparece después de abrir el software Wanda. En la caja (1), se seleccionan el medio apropiado, molécula de iontoforesis y técnica. (2) Se hace clic en "Calibrar" para abrirLa caja de calibración Wanda. Después de calibrar el ISM (véase la Figura 6b y el Suplemento B), el ISM se coloca en agar o cerebro, como se describe en los pasos 6 y 8 del protocolo. En la casilla (6), se introducen todos los valores apropiados para el experimento que se está realizando. (7) Se hace clic en "Adquirir" para tomar una grabación; Un gráfico de voltaje en función del tiempo aparece en la parte superior derecha de la GUI de Wanda. ( B ) Calibración de ISM en Wanda : La ventana que se abre después de hacer clic en (2) "Calibrar" en la GUI de Wanda. Los valores del paso 3.29 se introducen en el recuadro (3), y (4) se selecciona "Ajustar datos". Se confirma que la curva de calibración es lineal. (5) Se hace clic en "Aceptar" para volver a la GUI de Wanda. Haga clic aquí para ver una versión más grande de esta figura.7. Análisis de datos de agarosa
- Abre elWalter en el ordenador (PC). En el menú "0. Registros de:", haga clic en el botón "Wanda / VOLTORO" para leer los registros generados por Wanda ( Figura 7a ). Asumiendo que se requiere salida a una hoja de cálculo, abra el software apropiado. Haga clic en "Hoja 1,3" en el "1. Escribir Excel?" ( Figura 7b ).
- En la siguiente ventana emergente, seleccione los registros a leer y haga clic en "Abrir" ( Figura 7b ); Tenga en cuenta que los registros se graficarán automáticamente. Para comenzar el procedimiento de ajuste, realice los siguientes pasos.
- En el menú "2. Opciones", haga clic en el botón "select rec". En la ventana emergente " Figura 2 ", use el ratón para mover los retículos sobre el primer registro que se va a procesar ( Figura 7c ); Pulse el botón del ratón para elegir el registro.
- Haga clic enN "curva de ajuste" en el menú. Seleccione el número deseado de iteraciones de ajuste; Utilice al menos 20 iteraciones de ajuste para obtener un ajuste preciso de los datos.
- En el menú, seleccione "todos" para ajustar todos los puntos de datos y seleccione "continuar"; El programa ajustará la curva mostrada. Observe el procedimiento de ajuste y compare el registro experimental con la curva mejor ajustada obtenida.
- Seleccione la opción para escribir el resultado en el programa de hoja de cálculo correspondiente haciendo clic en "Excel" en el menú "7. Resultados" ( Figura 7d ). Nota (y registro) los siguientes datos crítico que será utilizado para determinar la funcionalidad del microelectrodo iontoforesis: 'D (E5)', 'Referencia D (E5)', 'r_app', número de transporte 'n t', 'aparente n t'.
NOTA: " D (E5) ": Coeficiente de difusión libre medidoTx 10 ^ { 5} (cm ^ { 2} / s); " Referencia D (E5) ": Coeficiente teórico de difusión libre x 10 5 (cm 2 / s). Este valor se extrae de una base de datos de Walter basada en el ion, el medio y la entrada de temperatura. " R_app ": Espaciamiento aparente del microelectrodo (cm), calculado sobre la base de la medida y referencia D (E5) . " N t ": Número de transporte (sin dimensiones). Este número determina la fracción de la corriente de iontoforesis que se utiliza para liberar TMA 4. " Aparente nt ": Número de transporte aparente (adimensional). Se trata de un número de transporte calculado a partir de r_app . Este número debe estar cerca de la N medida t. - Repita los pasos 7.1-7.3 para cada uno de los registros para un par elegido de microelectrodos.
- Determine si el microelectrodo de iontoforesis puede usarse haciendo lo siguiente.
- Comparar " r_app" con el r real ( es decir, 120 μm); Este criterio se cumple si los valores medios de todos los ensayos están dentro del 4% uno de otro.
- Comparar " D (E5)" con la Referencia D (E5) ; Este criterio se cumple si los valores promedio de todos los ensayos están dentro del 8% de los demás.
- Comparar la " n t " entre ensayos con el mismo microelectrodo; Este criterio se cumple si los valores medios de todos los ensayos se encuentran dentro del 10% uno de otro.
- Si no se cumple uno de los criterios del paso 7.5, solucione el microelectrodo de iontoforesis o comience a probar otro.
- Si el microelectrodo de iontoforesis se considera adecuado para el experimento, registre el número de transporte promedio de todos los ensayos en el campo "Transporte Núm N" en la GUI de Wanda ( Figura 6a ).
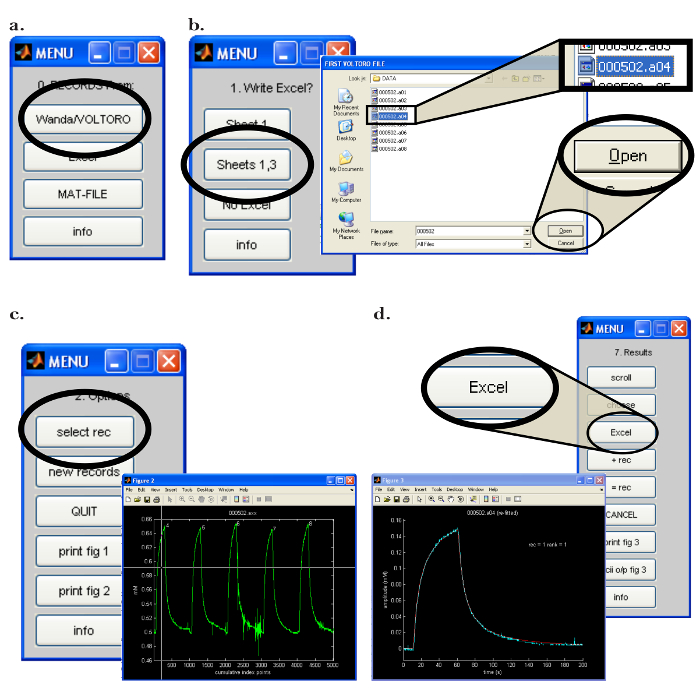
Figura 7: Interfaz de software de la computadora Walter. (A) Elegir el programa de recolección de datos en Walter: "Los registros de 0.:" Se abre el menú después de iniciar el software de Walter. La opción de cargar los registros guardados por Wanda se selecciona haciendo clic en el botón "Wanda / Voltoro". ( B ) Elección de la ubicación de salida de los datos y análisis de datos en Walter: [Izquierda] Después de abrir el programa de hoja de cálculo apropiado, se selecciona "Hojas 1,3" para enviar todo el análisis de datos de Walter al programa de hojas de cálculo abierto anteriormente. [Derecha] Después de seleccionar la ubicación de salida del análisis de datos, se abre una ventana emergente que permite al usuario elegir la primera y la última grabación que Walter lea. ( C ) Elegir la grabación para analizar en Walter: [Derecha] Después de que los archivos a leer sean elegidos, una ventana emergente se abrirá con todos los registros elegidosJugado como un gráfico (" Figura 2 "). [Izquierda] En el menú "2.Options", se hace clic en "select rec", y el ratón se utiliza para mover el retículo para identificar la primera grabación para el análisis; Se presiona el botón del ratón para elegir la grabación. ( D ) Exportación del análisis de datos de Walter a una hoja de cálculo: Después de ajustar los datos, aparece una ventana emergente y el menú "7. Resultados". [Izquierda] Gráfico de la grabación seleccionada (azul) con la curva de difusión incorporada generada por Walter (rojo). [Derecha] El menú "7. Resultados" permite al usuario escribir los datos del análisis en un programa de hoja de cálculo haciendo clic en el botón "Excel". Haga clic aquí para ver una versión más grande de esta figura.8. Iontoforesis en tiempo real en cortes cerebrales
- Coloque un cerebro de 400 μm de grosorPiojos en la cámara de grabación, asegurándose de que está completamente sumergido en el flujo de ACSF. Coloque la rebanada con un pincel de acuarela y suavemente asegure con una rejilla.
- Mueva el microelectrodo de iontoforesis y el ISM por encima del campo de interés en la porción de cerebro. Sumergirse tanto en el flujo de ACSF, pero por encima de la rebanada.
- Offset el voltaje para los canales de referencia y de detección de iones a "0" mV. Espere a que la tensión en ambos canales se estabilice. En el registrador gráfico, marque el voltaje medido en el canal de detección de iones del ISM. Use esto para calcular el parámetro V de línea de base en Wanda.
- Coloque el ISM y el microelectrodo de iontoforesis de 200 μm de profundidad en la rebanada y 120 μm de distancia entre sí. Espere a que la estabilización de la señal después de mover el microelectrodo en la rebanada de cerebro.
NOTA: La corriente de polarización aplicada al microelectrodo de iontoforesis causa una pequeña acumulación de TMA. Es un error común tomar arEcording demasiado pronto y subestimar la acumulación de señal. - En el registrador gráfico, marque el voltaje estabilizado medido en el segmento del cerebro en el canal de detección de iones del ISM. Calcule la diferencia de voltaje entre la señal de TMA medida en el paso 8.3 y el paso 8.4 e ingrese este valor en el campo "Baseline V (mV)" en el cuadro Electrodo de medición de la GUI de Wanda ( Figura 6a ).
- En el lado izquierdo de la GUI, asegúrese de que todos los parámetros experimentales se registran / entran correctamente. Ajuste "Medio" a "Cerebro", "Número de transporte" al valor medio calculado para el microelectrodo de iontoforesis en la etapa 7.4 y "Temperatura" a la temperatura del baño que contiene la rebanada.
NOTA: V debe registrarse para cada conjunto de mediciones. La línea de base V será convertida por Wanda en el parámetro basal C (mM) ( es decir, la concentración de TMA en el tejido cerebral). - Comience la grabación haciendo clic en "Adquirir" y permitir que tome una grabación completa. Espere hasta que la señal TMA vuelva a la línea de base antes de adquirir una nueva grabación.
- Tome dos o tres grabaciones sucesivas antes de retirar los microelectrodos de la ubicación del cerebro elegido. Introduzca la temperatura medida en el software Wanda inmediatamente antes de cada grabación.
- Mueva ambos microelectrodos diagonalmente hacia atrás a la superficie de la rebanada. Elevar ambos a al menos 50 μm por encima de la rebanada. Utilizando el registrador de gráficos, determine cualquier cambio entre el V medido ahora y su medición del paso 8.3.
- Centrar las puntas del ISM y los microelectrodos iontoforéticos relativos entre sí en los ejes x, y, y z. Obtenga los cambios de espaciado, si los hubiera, de la pantalla de la caja de control del micromanipulador.
9. Análisis de los datos cerebrales
- Abra una nueva hoja de cálculo para la salida del análisis.
- Repita los pasos 7.1-7.4 en Walter a analyzLas grabaciones tomadas del cerebro.
- Escriba los datos en el programa de hoja de cálculo haciendo clic en "Excel" en el menú Walter. Registre la fracción volumétrica α del ECS cerebral; Λ , tortuosidad del cerebro ECS; Y k (s -1 ), el aclaramiento no específico.
10. Comprobación del número de transporte y calibración ISM
- Mida el número de transporte ISM ( n t ) al final del experimento usando el protocolo siguiente. Por otra parte, comprobar n t después de los ensayos críticos o cuando las medidas parecen anómalas. Sin embargo, la comprobación de n t demasiadas veces puede resultar en un trauma en la porción del cerebro.
- Tome nuevas grabaciones en agarosa. Véanse los pasos 6.4, 6.11, 6.12, 6.14, 6.15 y 6.17-6.22.
- Repita los pasos 7.1-7.4 en Walter para obtener la n t de las nuevas grabaciones de agarosa. Inspeccione la hoja de cálculo: si la n t ha cambiado por másDel 10% de la n t obtenida antes de las mediciones cerebrales, los datos obtenidos con este microelectrodo iontoforético no son fiables.
- Realice una nueva calibración (consulte el paso 3.29) para el ISM después de que se hayan recopilado todos los datos del cerebro. Utilice los datos de calibración ISM recién obtenidos como entrada en el cuadro Calibrar Wanda (ver los pasos 6.9 y 6.10) y compruebe que el valor de la pendiente difiere en menos del 10% de la calibración anterior.
NOTA: Los datos obtenidos con este ISM no son fiables si el valor de la pendiente difiere en más del 10% de la calibración anterior.
Access restricted. Please log in or start a trial to view this content.
Resultados
La utilidad de la técnica RTI se demuestra en un experimento diseñado para medir los cambios en α y durante un desafío hipoosmolar ( Figura 8 y Figura 9 ). Se ha demostrado previamente que la reducción de la osmolaridad de la ECS mediante lavado sobre ACSF hipotónico producirá una disminución en α y un aumento en λ 13 .
Access restricted. Please log in or start a trial to view this content.
Discusión
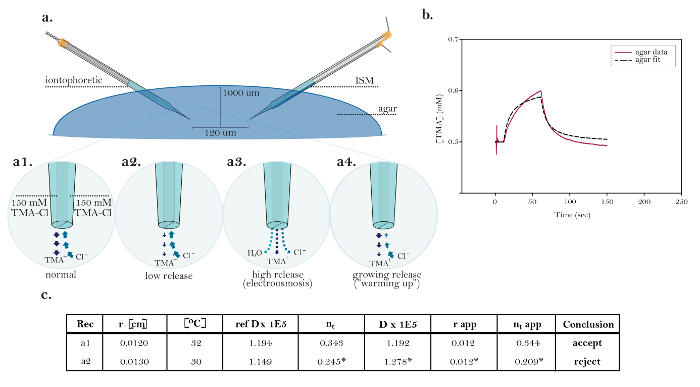
Figura 10: Datos no ideales que demuestran problemas técnicos comunes. (A) Los diagramas de problemas técnicos comunes con microelectrodos de iontoforesis: Comparación de la liberación normal de TMA de un microelectrodo funcionamiento iontoforesis con tres fuentes que demuestran problemas técnicos. [Aumento alto, a1] La corriente en una fuente iontoforética ideal es llevada igualmente por la ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
El trabajo fue apoyado por NIH NINDS concesión R01 NS047557.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate - do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5 mm x 16 mm) |
| objective 5X dry | Olympus | MPlan N | |
| objective 10X water immersion | Olympus | UMPlan FL N | 10X objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22 µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
Referencias
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. Michael, A. C., Borland, L. M. , CRC press. 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes,, Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados