Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Evaluación neuroconductual en un modelo murino de lesión de cerebro hipóxico-isquémica Neonatal
En este artículo
Resumen
Se realizó oclusión unilateral de la arteria carótida en día postnatal 7-10 CD-1 ratón cachorros para crear un modelo de (HI) hipóxico-isquémica neonatal e investigó los efectos de la lesión cerebral HI. Estudiamos las funciones neuroconductuales en estos ratones, en comparación con ratones normales no funcionan.
Resumen
Se realizó oclusión unilateral de la arteria carótida en ratones CD-1 para crear un modelo de (HI) hipóxico-isquémica neonatal y se investigaron los efectos de lesión de cerebro de HI neonatal mediante el estudio de las funciones neuroconductuales en estos ratones frente a no funcionar (es decir, ratones normales). Durante el estudio, se utilizó método de arroz-Vannucci para inducir daño de cerebro de HI neonatal en ratones de 7-10 (P7-10) día postnatal. La operación de HI fue realizada en los cachorros por la ligadura unilateral de la arteria carótida y la exposición a la hipoxia (8% O2 y 92% N2 de 90 min). Una semana después de la operación, los cerebros dañados fueron evaluados con el ojo desnudo a través del cráneo semitransparente y se clasificaron en subgrupos basados en la ausencia (grupo "ninguna lesión cortical") o presencia (grupo de "lesión cortical") de la lesión cortical, como una lesión en el hemisferio derecho. En la semana 6, se realizaron las siguientes pruebas neuroconductuales para evaluar las funciones cognitivas y motoras: escalera (PAT), tarea de evitación pasiva a prueba y prueba de fuerza de agarre. Estas pruebas conductuales son útiles en la determinación de los efectos de lesión de cerebro de HI neonatal y se utilizan en otros modelos murinos de enfermedades neurodegenerativas. En este estudio, neonatal HI cerebro lesiones los ratones mostraron déficit motor que corresponde a daño del hemisferio derecho. Resultados de la prueba de comportamiento son relevantes a los déficits observados en pacientes humanos de HI neonatales, tales como parálisis cerebral o pacientes con accidente cerebrovascular neonatal. En este estudio, un modelo de ratón de lesión de cerebro de HI neonatal fue había establecido y mostró diferentes grados de déficit motor y deterioro cognitivo en comparación con ratones no operados. Este trabajo proporciona información básica sobre el modelo de ratón de HI. Imágenes de MRI demuestran los fenotipos diferentes, separados según la severidad del daño cerebral por pruebas de motor y cognitivas.
Introducción
Lesión de cerebro de HI neonatal ocurre durante la primera infancia (aproximadamente dos pacientes por cada 1.000 niños)1,2,3,4,5. Estudios sobre lesiones de cerebro de HI neonatal son importantes, y usando un neonatal HI cerebro lesiones ratón modelo establecido puede facilitar en vivo investigación preclínica en lesión de cerebro de HI.
Los modelos HI tradicionales se utilizan en ratas adultas6. Para el modelo del recién nacido, comúnmente se utiliza el método de arroz Vannucci P7 ratas7,8. Sin embargo, puesto que ratas y ratones son ligeramente diferentes de9,10, aunque sean ambos roedores, realizamos un método modificado de arroz Vannucci en CD-1 cachorros en P7-10, basado en estudios anteriores que mostraron que P7-10 es el período con oligodendrocitos inmaduros, correspondiente a humanos término P011,12. El modelo de ratón de HI neonatal se establece a través de tanto la ligadura de la arteria carotídea unilateral y la exposición de los ratones a la hipoxia con oxígeno de 8% en P7-10 cachorros.
Los ratones sometidos al procedimiento mostraron diversos grados de lesiones cerebrales en la zona posterolateral del hemisferio derecho. Para identificar el déficit cognoscitivos y motor, evaluaciones neuroconductuales basadas en el PAT, se realizaron a prueba y prueba de fuerza de agarre de la escalera. Se analizaron las diferencias entre los no operados (es decir, normal) y ratones de HI. Este trabajo presenta información básica sobre el modelo de ratón de HI. Las imágenes de MRI demuestran los fenotipos diferentes, separados según la severidad de daños de cerebro usando las pruebas de motores y cognitivas.
Protocolo
Todos los animales fueron alojados en una jaula estándar (27 x 22,5 x 14 cm3) en un centro acreditado por la Asociación para la evaluación y acreditación de laboratorio Animal Care (AAALAC) y dado comida y agua ad libitum en alterna 12 h luz/oscuridad ciclos. Los autores siguieron las normas de protección de los animales y los procedimientos experimentales fueron aprobados por el cuidado institucional de animales y uso Comité de Yonsei University College of Medicine (IACUC Nº 2010-0252; 2013-0220).
1. ratón modelo HI Neonatal de lesión de cerebro
- Anestesiar los cachorros con isoflurano.
- Coloque los cachorros (menos de 5) en un cuadro de anestesia y cierre la tapa.
- Encienda el sistema de anestesia durante aproximadamente 15 minutos; ajustar el gas y el isoflurane utilizando una máquina de anestesia superior de la tabla. Ajustar el flujómetro del oxígeno a 1,5 L/min ajustar el vaporizador de isoflurano al 3-5% para la inducción de la anestesia.
- Después de 15 minutos, ajustar el vaporizador de isoflurano al 1-2% para el mantenimiento de la anestesia.
- Coloque un cachorro completamente anestesiado bajo un microscopio de disección (abdomen hacia el investigador) y asegúrelo con cinta.
- Haga una incisión de ~0.7-mm en el cuello con unas tijeras esterilizadas.
- Cuidadosamente retire el tejido adiposo con unas pinzas esterilizadas y exponer la arteria carótida derecho unilateral.
- Ligar la arteria carótida derecho unilateral con una sutura absorbible 5-0.
- Sutura de la incisión en el cuello con sutura 5-0.
- Coloque cada cachorro en una cámara hipóxica caliente de 37 ° C durante 1 hora para la recuperación. No cierre la tapa de la cámara.
- 1 h después de la cirugía, cuando los cachorros son totalmente despiertos, cerrar la tapa de la cámara de hipoxia y disminución de los niveles de gas para establecer condiciones hipóxicas (8% O2 y 92% N2).
- Después de 90 minutos de hipoxia, devuelva los cachorros a sus jaulas.
- Una semana después de la lesión cerebral de HI, repita el paso 1.
- Después de la anestesia, hacer una incisión en el cuero cabelludo con tijeras esterilizadas y pinzas para identificar la lesión de cerebro en la zona posterolateral del hemisferio derecho.
Nota: Este tratamiento induce hipoxia en cachorros. La presencia y el grado de lesión cerebral en los ratones se evalúa visualmente con el ojo desnudo a través del cráneo semitransparente. Según lo determinado por el tamaño o volumen de la decoloración (es decir, la lesión de cerebro), los cachorros se clasifican en grupos. Si no hay ninguna lesión cortical visible, el ratón se clasifica en el grupo de "ninguna lesión cortical". Si hay una lesión cortical visible (es decir, una lesión en el hemisferio derecho), el ratón se clasifica en el grupo de "lesión cortical". Dado que la clasificación de los ratones en grupos se realiza una semana después de la operación, las agrupaciones pueden ser modificadas cuando la morfología de las muestras de cerebro está claramente definida en el momento de sacrificio1,2,3, 4.
- Después de la anestesia, hacer una incisión en el cuero cabelludo con tijeras esterilizadas y pinzas para identificar la lesión de cerebro en la zona posterolateral del hemisferio derecho.
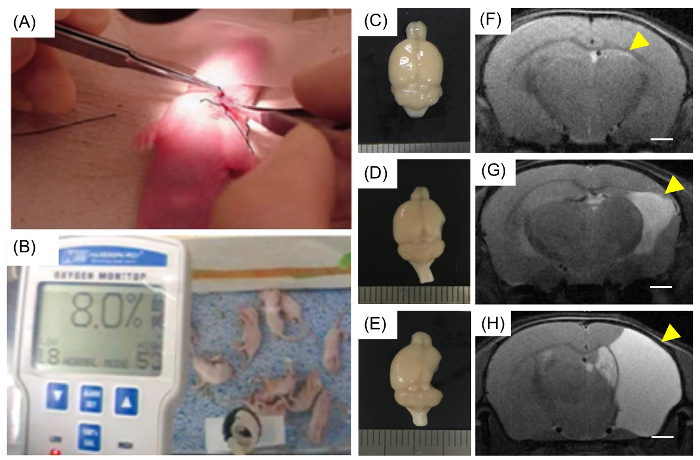
Figura 1: Modelado de lesión de cerebro de HI neonatal en ratones.
(A) una cría de ratón de siete días de edad había sometido a una cirugía, y la arteria carótida derecho unilateral fue ligada. (B) los cachorros se colocaron en una cámara hipóxica durante 90 minutos con el 8% O2 y 92% N2. (C, D y E) Los cerebros con lesiones HI neonatal demostraron varios gravedad del daño y fueron categorizados basado en el grado de daño. En la semana 14, se obtuvieron los cerebros y las lesiones fueron visualizadas. (C) imagen de un cerebro clasificado como "no cortical lesión". Ambos (D) y (E) se clasificaron en el grupo de "lesión cortical". (F, G y H) Representante de MRI (c), (D) y ratones (E), respectivamente. (F) los daños en el hipocampo se indicaron con una flecha amarilla, y las lesiones en el hemisferio derecho también se indican con flechas amarillas (G y H). Barras de escala = 1 mm haga clic aquí para ver una versión más grande de esta figura.
2. neonatales pruebas conductuales
Nota: Aquí, el comportamiento se realizaron pruebas en 6 semanas de edad.
-
Tarea de evitación pasiva.
Nota: Para evaluar la función de memoria basada en el aprendizaje y la evitación de un estímulo aversivo, una compartimiento de dos paso por PAT debe ser llevado a cabo13,14,15,16.- Coloque el ratón en el compartimiento brillante de la caja de transporte de plexiglás (41,5 × 21 × 35 cm3) de un aparato PAT.
- Después de 30 s, abra la puerta de guillotina y registrar el tiempo de latencia para el ratón para moverse en el compartimiento oscuro (hasta 300 s).
- Cierre la puerta de guillotina cuando las cuatro extremidades del ratón están completamente dentro del compartimiento oscuro.
- Administrar choque eléctrico pie (0,5 mA) durante 2 s y el ratón de vuelta a su jaula.
- Vuelva a colocar el ratón en el compartimiento brillante 24 h después del choque eléctrico de pie.
- Abrir la guillotina puerta 10 s después de que el ratón se coloca completamente en el compartimiento brillante y registrar el tiempo de latencia para el ratón para moverse en el compartimiento oscuro (hasta 300 s).
-
Prueba de marcha de la escalera.
Nota: La tarea de caminar de peldaño de escalera permite la discriminación entre sutiles alteraciones de la función motora combinando cualitativo y cuantitativo análisis del experto a pie17,18.- Encienda una cámara de vídeo.
- Coloque el ratón en el panel de inicio de la escalera y comenzar inmediatamente la grabación.
- Grabar el vídeo, centrado en las extremidades de ratón.
- Detener la grabación cuando el ratón toca el último panel de la escalera. Repetir el viaje de ida y cuatro veces.
- Analizar la grabación de vídeo y contar manualmente el número de combinaciones de cada forelimb, como sigue:
- Juego de grabación de vídeo en un ordenador a una velocidad lenta (0.1 x) y contar los pasos manualmente.
-
Prueba de fuerza de agarre.
Nota: La prueba de fuerza de agarre se realiza con un medidor de fuerza de agarre, que incluye un calibrador de tensión de vaivén.- Fijar el aparato de la fuerza de agarre sobre un panel de acrílico.
- Poner un ratón en el panel de acrílico y mantenga su cola.
- Mueva la mano que sujeta la cola para que puedan alcanzar el ratón y agarre del alambre de metal del aparato.
- Permite múltiples ensayos hasta que el ratón agarra un pedazo triangular de alambre de metal (2 mm de diámetro); la fuerza máxima es automáticamente registrada en gramos por el aparato.
Nota: Usar la fuerza media de tres ensayos para el análisis19,20,21.
Resultados
Todos los datos se expresan como media ± error estándar de la media (SEM). La comparación de variables entre los dos grupos se realizó con un independiente o pareadas t-Pruebe el software de estadística SPSS. Un p-valor < 0.05 se consideró estadísticamente significativo.
El cerebro con lesión HI neonatal demostró diferente severidad del daño y se categorizaron en consecuencia (fig...
Discusión
En este estudio, inducida por la lesión cerebral HI en un ratón P7-10 CD-1 neonatal e identifica la lesión de cerebro con déficit cognitivos y motor correspondientes. Durante este procedimiento, oclusión de la arteria carótida derecho unilateral era crítica. En este paso, la arteria podría ser dañada y rasgada. Cachorros más que experimentado un desgarro de la arteria murieron. Por el contrario, si investigadores habían ligada otra vena de la sangre en lugar de la arteria carótida derecho unilateral, el cereb...
Divulgaciones
Los autores tienen intereses que compiten.
Agradecimientos
Este estudio fue apoyado por subvenciones del National Research Foundation (NRF-2014R1A2A1A11052042; 2015M3A9B4067068), el Ministerio de ciencia y tecnología, República de Corea, Coreano salud tecnología R & D proyecto (HI16C1012), Ministerio de salud y Bienestar, República de Corea y el programa de asistencia de investigación de "Dongwha" Facultad de Facultad de medicina (6-2016-0126) de la Universidad de Yonsei.
Materiales
| Name | Company | Catalog Number | Comments |
| Hypoxic chamber | Jeung Do Bio & Plant Co | Experimental Builder | |
| PAT apparatus | Jeung Do Bio & Plant Co | Experimental Builder | |
| The ladder rung walking | Jeung Do Bio & Plant Co | Experimental Builder | |
| SDI Grip Strength System | San Diego Instruments Inc. | ||
| Grip-Strength Meter | Ugo Basile | 47200 | |
| Harvard Apparatus Fluovac anesthetizing system | Harvard Apparatus | ||
| Anesthetizing box | acryl box | ||
| I-Fran Liquid (Isofluorane) | Hana Pharm. Co., Ltd. | General Anesthetics ( isoflurane 100ml) | |
| CD-1 mice | Orient Co., Ltd. | ||
| Blue Nylon Mono Non-Absorbbable suture 5-0 50cm | Ailee Co., Ltd. | NB 521 | |
| IBM SPSS Statistics | IBM | Ver. 23 |
Referencias
- Yager, J. Y. Animal models of hypoxic-ischemic brain damage in the newborn. Semin Pediatr Neurol. 11 (1), 31-46 (2004).
- Vannucci, R. C., et al. Rat model of perinatal hypoxic-ischemic brain damage. J Neurosci Res. 55 (2), 158-163 (1999).
- Im, S. H., et al. Induction of striatal neurogenesis enhances functional recovery in an adult animal model of neonatal hypoxic-ischemic brain injury. Neuroscience. 169 (1), 259-268 (2010).
- Clowry, G. J., Basuodan, R., Chan, F. What are the Best Animal Models for Testing Early Intervention in Cerebral Palsy?. Front Neurol. 5 (258), 1-17 (2014).
- Colver, A., Fairhurst, C., Pharoah, P. O. Cerebral palsy. Lancet. 383 (9924), 1240-1249 (2014).
- Levine, S. Anoxic-ischemic encephalopathy in rats. Am J Pathol. 36, 1-17 (1960).
- Rice 3rd, J. E., Vannucci, R. C., Brierley, J. B. The influence of immaturity on hypoxic-ischemic brain damage in the rat. Ann Neurol. 9 (2), 131-141 (1981).
- Lafemina, M. J., Sheldon, R. A., Ferriero, D. M. Acute hypoxia-ischemia results in hydrogen peroxide accumulation in neonatal but not adult mouse brain. Pediatr Res. 59 (5), 680-683 (2006).
- Brazel, C. Y., Rosti 3rd, R. T., Boyce, S., Rothstein, R. P., Levison, S. W. Perinatal hypoxia/ischemia damages and depletes progenitors from the mouse subventricular zone. Dev Neurosci. 26 (2-4), 266-274 (2004).
- Buono, K. D., et al. Mechanisms of mouse neural precursor expansion after neonatal hypoxia-ischemia. J Neurosci. 35 (23), 8855-8865 (2015).
- Rumajogee, P., Bregman, T., Miller, S. P., Yager, J. Y., Fehlings, M. G. Rodent Hypoxia-Ischemia Models for Cerebral Palsy Research: A Systematic Review. Front Neurol. 7 (57), 1-20 (2016).
- Hagberg, H., Peebles, D., Mallard, C. Models of white matter injury: comparison of infectious, hypoxic-ischemic, and excitotoxic insults. Ment Retard Dev Disabil Res Rev. 8 (1), 30-38 (2002).
- Wi, S., Yu, J. H., Kim, M., Cho, S. R. In Vivo Expression of Reprogramming Factors Increases Hippocampal Neurogenesis and Synaptic Plasticity in Chronic Hypoxic-Ischemic Brain Injury. Neural Plast. 2016 (2580837), 1-11 (2016).
- Lu, Y., Christian, K., Lu, B. BDNF: a key regulator for protein synthesis-dependent LTP and long-term memory?. Neurobiol Learn Mem. 89 (3), 312-323 (2008).
- Manabe, T., et al. Facilitation of long-term potentiation and memory in mice lacking nociceptin receptors. Nature. 394 (6693), 577-581 (1998).
- Alonso, M., et al. BDNF-triggered events in the rat hippocampus are required for both short- and long-term memory formation. Hippocampus. 12 (4), 551-560 (2002).
- Seo, J. H., et al. In Situ Pluripotency Factor Expression Promotes Functional Recovery From Cerebral Ischemia. Mol Ther. 24 (9), 1538-1549 (2016).
- Kim, M. S., et al. Environmental enrichment enhances synaptic plasticity by internalization of striatal dopamine transporters. J Cereb Blood Flow Metab. 36 (12), 2122-2133 (2015).
- Lee, M. Y., et al. Alteration of synaptic activity-regulating genes underlying functional improvement by long-term exposure to an enriched environment in the adult brain. Neurorehabil Neural Repair. 27 (6), 561-574 (2013).
- Rha, D. W., et al. Effects of constraint-induced movement therapy on neurogenesis and functional recovery after early hypoxic-ischemic injury in mice. Dev Med Child Neurol. 53 (4), 327-333 (2011).
- Chong, H. J., Cho, S. R., Jeong, E., Kim, S. J. Finger exercise with keyboard playing in adults with cerebral palsy: A preliminary study. J Exerc Rehabil. 9 (4), 420-425 (2013).
- Chong, H. J., Cho, S. R., Kim, S. J. Hand rehabilitation using MIDI keyboard playing in adolescents with brain damage: a preliminary study. NeuroRehabilitation. 34 (1), 147-155 (2014).
- Seo, J. H., Yu, J. H., Suh, H., Kim, M. S., Cho, S. R. Fibroblast growth factor-2 induced by enriched environment enhances angiogenesis and motor function in chronic hypoxic-ischemic brain injury. PLoS One. 8 (9), e74405 (2013).
- Washington, P. M., et al. The effect of injury severity on behavior: a phenotypic study of cognitive and emotional deficits after mild, moderate, and severe controlled cortical impact injury in mice. J Neurotrauma. 29 (13), 2283-2296 (2012).
- Cho, S. R., et al. Astroglial Activation by an Enriched Environment after Transplantation of Mesenchymal Stem Cells Enhances Angiogenesis after Hypoxic-Ischemic Brain Injury. Int J Mol Sci. 17 (9), 1-15 (2016).
- Tsuji, M., et al. A novel reproducible model of neonatal stroke in mice: comparison with a hypoxia-ischemia model. Exp Neurol. 247, 218-225 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados