Method Article
Slice Patch Clamp técnica para analizar la plasticidad inducida por el aprendizaje
En este artículo
Resumen
La técnica de abrazadera del remiendo de rebanada es un método eficaz para el análisis de los cambios inducidos por el aprendizaje en las propiedades intrínsecas y la plasticidad de las sinapsis excitatorias o inhibitorias.
Resumen
La técnica de abrazadera del remiendo de rebanada es una poderosa herramienta para la investigación de aprendizaje inducido por plasticidad neuronal en regiones específicas del cerebro. Para analizar el aprendizaje motor inducida por plasticidad, capacitamos a las ratas usando una tarea de la barra de rotor acelerado. Las ratas realizan la tarea 10 veces a intervalos de 30 s para 1 o 2 días. Desempeño mejoró significativamente en los días de entrenamiento en comparación con el primer ensayo. Luego preparamos rebanadas de cerebro agudo de la corteza motora primaria (M1) en ratas entrenadas y no entrenadas. Abrazadera de la corriente de análisis mostró cambios dinámicos en la reclinación potencial de membrana, umbral de spike, afterhyperpolarization y resistencia de membrana en neuronas piramidales de capa II/III. Inyección de corriente inducida por muchos puntos más en las ratas entrenados 2 días que en los controles no entrenados.
Para analizar el aprendizaje contextual inducido plasticidad, capacitamos a las ratas mediante una tarea de evitación inhibitoria (IA). Después de experimentar el choque de pie en el lado oscuro de un cuadro, las ratas aprendieron a evitarlo, en el lado iluminado. Preparamos agudas rebanadas hippocampal de inexperto, entrenado por la IA, impar y recorrido por ratas. Abrazadera de tensión análisis fue utilizada para registrar secuencialmente miniatura excitatorio y el inhibitorio postsynaptic corrientes (mEPSCs y mIPSCs) de la misma neurona CA1. Encontramos diferentes amplitudes medias de mEPSC y mIPSC en cada neurona CA1, sugiriendo que cada neurona tenía diferentes concentraciones postsynaptic en sus sinapsis inhibitorias y excitatorias. Por otra parte, en comparación con controles no entrenados, entrenados IA ratas tenían mayor amplitud mEPSC y mIPSC, con amplia diversidad. Estos resultados sugirieron que aprendizaje contextual crea diversidad postsináptica de sinapsis tanto excitatorias como inhibitorias en cada neurona CA1.
Receptores AMPA o GABAA parecen mediar las corrientes postsinápticas, desde tratamiento de baño con CNQX o bicuculina bloqueado los eventos mEPSC o mIPSC, respectivamente. Esta técnica puede utilizarse para estudiar diferentes tipos de aprendizaje en otras regiones como la corteza sensorial y la amígdala.
Introducción
La técnica de clamp de parche, desarrollada por Neher y Sakmann, ha sido ampliamente utilizada para los experimentos electrofisiológicos1. El parche de celulares abrazadera técnica2 puede utilizarse para grabar intracelular corriente o voltaje usando el sello gigaohm de la membrana celular. La técnica de la pinza de corriente nos permite analizar las diferencias en las propiedades de la membrana como reclinación potencial, resistencia y capacitancia3. La técnica de la voltaje pinza nos permite analizar la plasticidad sináptica inducida por el aprendizaje en las sinapsis tanto excitatorias como inhibitorias.
La corteza motora primaria (M1) es una región central que es crítica para realizar movimientos voluntarios cualificados. Estudios electrofisiológicos demostraron el desarrollo de la potenciación a largo plazo (LTP)-como la plasticidad de la capa II/III excitatorio sinapsis después de calificada formación motor4. Por otra parte, en vivo estudios la proyección de imagen demostró la remodelación de espinas dendríticas M1 después un experto llegando a tarea5,6. Sin embargo, la plasticidad sináptica e intrínseca inducida por el aprendizaje no se ha demostrado en las neuronas de M1.
Nos informó recientemente que una tarea de la barra de rotor había promovido cambios dinámicos en glutamatérgicos y GABAérgicos sinapsis alteración la plasticidad intrínseca en M1 capa II/III neuronas7. Aquí utilizamos la técnica de abrazadera del remiendo de rebanada para investigar plasticidad inducida por el aprendizaje. Esta técnica también puede utilizarse para investigar otros tipos de plasticidad dependiente de la experiencia en otras regiones del cerebro. Por ejemplo, input sensorial en la corteza del cañón puede fortalecer entrada excitatoria mediada por receptor AMPA en la capa II/III neuronas8y miedo localización acondicionado consolida las entradas excitatorias sobre las neuronas de la amígdala lateral, que es necesaria para miedo de memoria9. Por otra parte, el aprendizaje contextual crea diversidad en cuanto a la entrada sináptica excitatoria y la inhibitoria en hipocampo CA1 neuronas10,11.
Protocolo
todos los procedimientos quirúrgicos y alojamiento de los animales estaban de acuerdo con las directrices de animales experimentación de Yamaguchi University School of Medicine y fueron aprobados por el cuidado de Animal institucional y Comité uso de Yamaguchi Universidad.
1. animales
- Use 4 a 5 semanas de edad hombres ratas Sprague-Dawley (postnatales 28 a 31 días de edad).
- Casa de las ratas en jaulas individuales (40 cm x 25 cm x 25 cm) mantenidas a una temperatura constante (23 ° C ± de 1 ° C) en un ciclo de 12 h luz/oscuridad. Dar ratas acceso ad libitum a agua y alimentos.
2. Prueba de la barra de rotor
- investigar habilidad motor de aprendizaje, sujeto a cada rata para la prueba de la barra del rotor (diámetro de rod de 7 cm, ancho de carril 8,9 cm, altura de caída 26,7 cm) para 1 o 2 días consecutivos ( figura 1A en Kida et al., 2016 < sup clase = "xref" > 7). Realizar la tarea en una habitación tranquila, con control de temperatura (23 ± 1 ° C). No molestar ni manipule las ratas antes de la prueba
- Configurar la barra de rotor a modo de aceleración, que aumenta linealmente de 4 vueltas/min a 40 vueltas/min (8 π/min a 80 π/min) en 5 min.
- Colocar la rata en la varilla giratoria descansa. Confirmar que todos los miembros están en la barra de.
- Medir la latencia a la caída de la varilla giratoria para evaluar el rendimiento del motor.
- Permite a cada rata 10 intentos (ensayos) con intervalos de 30 s.
- Si la rata cae de la varilla giratoria, ajústelo en la barra otra vez después de un intervalo de 10-20 s.
- Sacrificio de la rata con una sobredosis de pentobarbital (400 mg/kg) 30 min después del juicio final. Ratas control se inyectan con la misma dosis de la anestesia en sus jaulas hogar.
3. Prueba de evitación inhibitoria
- para investigar el aprendizaje contextual, ratas del sujeto a una prueba de evitación inhibitoria (IA) ( figura 1 en Mitsushima et al., 2011, 2013 10 , 11) Evite cualquier experiencia episódica en el día del experimento, como el contacto con otros, cambios de jaula o de limpieza. Realizar la tarea en una habitación tranquila, con control de temperatura (23 ± 1 ° C).
Nota: El aparato de entrenamiento IA es una caja de acrílico de dos cámaras (longitud 33 cm, ancho 58 cm, altura 33 cm). Tiene un encendido seguro y un choque oscuro que están separados por una puerta de la trampa ( figura 1). - Colocar la rata en el lado seguro (lit) de la caja iluminada. Manejar la rata suavemente sin estrés.
- Esperar un a corto plazo (10 a 20 s) para aclimatarse a la rata para el medio ambiente.
- Abrir la puerta corredera para permitir que la rata entrar en el cuadro oscuro a voluntad.
- Medir la latencia (s) antes de que la rata entra en el nuevo lado oscuro de la caja. La latencia de la primera prueba representa la rata de ' rendimiento de s antes de entrenar.
- Después de la entrada en el lado oscuro, cierre la puerta y aplique un choque de pie eléctrica revuelto (2 s, 1.6 mA) mediante varillas de acero eléctricos en el piso de la caja. Permiten que las ratas de recorrido explorar el aparato de entrenamiento durante 1 minuto sin ser sorprendido. Casa ratas en una jaula iluminada choque durante varios días y de pronto darán el choque sin experiencias episódicas. Manejar suavemente sin destacar en ningún grupo.
- Mantener cada rata en la caja oscura para 10 s antes de volver a la jaula casa.
- En 30 min después del choque del pie, otra vez colocar la rata en el lado iluminado de la caja. Medir la latencia para entrar en el lado oscuro.
- Volver la rata en la jaula casa.
- En 60 minutos después del choque, sacrificar la rata con una sobredosis de pentobarbital (400 mg/kg). Manejar la rata suavemente e inyectar la anestesia por vía intraperitoneal. En las ratas control no entrenado, inyectar la anestesia en sus jaulas hogar sin la experiencia descrita.
4. Buffer de disección
- disolver cristales de 0,195 g NaH 2 PO 4-2 H 2 O, 0,188 g KCl, 0,074 g CaCl 2, 1,423 g MgCl 2-6 H 2 O y 12,579 g de cloruro de colina en agua ultrapura (900 mL a 950 mL) . Vea la tabla 1.
- Disolver cristales de ácido ascórbico de 2,340 g, sal del sodio de ácido pirúvico 0,342 g, 2,100 g NaHCO 3 y 4,500 g de glucosa.
- Agregar agua hasta 1000 mL. El rango de osmolalidad será entre 290 mOsm/L y 300 mOsm/L. osmolalidad de ajuste mediante la adición de agua ultrapura, si es en el rango de.
- De la burbuja la solución con 5% CO 2 95% O 2 gas mezcla a temperaturas frías durante 5 minutos antes de su uso.
5. Líquido cefalorraquídeo artificial (aCSF)
- disolver cristales de 0,186 g KCl, NaCl, de 6,700 g y 0,156 g NaH 2 PO 4-2 H 2 O en agua ultrapura (900 mL a 950 mL). Consulte la tabla 2.
- Burbuja con la mezcla de gas de 5 min.
- Disolver cristales de 1,800 g glucosa y 2,184 g NaHCO 3 y agregar entonces 4 mL MgCl 2 y 4 mL de CaCl 2 de 1 M stock soluciones.
- Agregar agua hasta 1000 mL. El rango de osmolalidad será entre 290 mOsm/L y 295 mOsm/L. osmolalidad de ajustar mediante la adición de agua ultrapura, si es en el rango de.
- La burbuja con el antes de la mezcla de gas usar.
6. Soluciones intracelulares
- para grabaciones de abrazadera de la corriente (cuadro 3), disolver 0,0746 g KCl, 6,089 g gluconato de K, g 0,476 HEPES, g 0,0456 EGTA y 500 μl MgCl 2 de 1 M stock solución en 180 mL de agua ultrapura (ajustar el pH a 7.2 con KOH).
- Añadir 0,4408 g Na 2 - ATP, g 0,0418 Na 3 - GTP y g 0,510 Na-fosfocreatina. Añadir agua a 200 mL y ajustar el pH a 7.35 con KOH.
- Ajustar la osmolalidad a alrededor de 290 mOsm/L de agua ultrapura.
- Tienda como alícuotas de 1 mL en el congelador (-30 ° C).
- Para grabaciones de abrazadera de tensión (tabla 4), disolver 5,244 g CsMeSO 3 g 0,672 CsCl, 0,476 g HEPES, g 0,0456 EGTA y 500 μl MgCl 2 de 1 M stock soluciones en 180 mL de agua ultrapura. Ajustar el pH a 7.2 con CsOH. Para las grabaciones de mEPSP y mIPSP, utilice concentración modificada de 5,814 g CsMeSO 3 y 0,252 g CsCl para ajustar el potencial de reversión de la GABA A receptor respuesta 11.
- Añadir 0,4408 g Na 2 - ATP, g 0,0418 Na 3 - GTP y g 0,510 Na-fosfocreatina. Añadir agua a 200 mL y ajustar el pH a 7.35 con CsOH.
- Ajustar la osmolalidad a alrededor de 290 mOsm/L de agua ultrapura.
- Tienda como alícuotas de 1 mL en el congelador (-30 ° C).
7. Preparación de la rebanada
- previo al sacrificio, enfriamiento de todas las herramientas de disección con hielo picado ( figura 2A). Añadir 500 mL de agua fría en el recipiente de hielo para aumentar la superficie de contacto. Este procedimiento fue descrito previamente 10 , 11 , 12.
Nota: Las herramientas aquí son: tijeras grandes, tijeras de iris, una espátula, una micro espátula, pinzas, pinzas, un vaso de precipitados de 200 mL de acero inoxidable, una cuchilla para recortar, una jeringa de perfusión cardiaca 120 mL con buffer de disección con la mezcla de gases, de cerebro un tubo de silicona (20 cm) conectado a una aguja de calibre 18 aplanada, una etapa de disección del cerebro de acero inoxidable (espesor = 3 mm, φ = 12 cm) y una etapa de montaje para el vibratome (φ = 5 cm). - Sacrificar la rata 30 minutos después de completar el paradigma conductual por anestesiar con sobredosis de pentobarbital (400 mg/kg peso corporal). Realizar la preparación corte rápidamente para asegurar que los cortes son tan saludables como posible 10 , 11 , 12. El cerebro extrProtocolo de actuación cumple todas las normas veterinarias de nuestra Universidad.
- Relleno de burbujas de una jeringa de 120 mL con tampón de disección fría (tabla 1) con 5% CO 2 95% O 2 gas mezcla. Eliminar las posibles burbujas de aire antes de la perfusión.
- Después de exponer el corazón, inserte la aguja en la parte posterior del ventrículo izquierdo.
- Transcardial de realizar la perfusión del cerebro manualmente con la jeringa. Las ratas más grandes requieren más tampón de disección para perfusión. Sumergir el cerebro con tampón de disección helada por 5 min burbuja el búfer continuamente durante la sumersión.
- Recortar la parte posterior del cerebro en un paralelo de ángulo en la orientación dendrítica de la región cortical de destino usando una hoja. Puesto que el cerebro es de pie en el escenario de la disección con el fondo del extremo cortado, el ángulo inicial determina el ángulo de todos los sectores posteriores del cerebro. Este paso es muy importante ( figura 2B). Un ángulo incorrecto puede cortar a través de las neuronas piramidales objetivo.
Nota: Las herramientas aquí son: una cuchilla para corte de cerebro, un papel de filtro (φ = 10 cm), una etapa de disección del cerebro de acero inoxidable (espesor = 3 mm, φ = 12 cm), una espátula, un pegamento, un gotero y una etapa de montaje para el vibratome (φ = 5 cm). - Corte rebanadas de cerebro coronales gruesa 350 μm con un vibratome. Llenar la sala de disección con tampón helada burbujas con 5% CO 2 95% O 2 gas mezcla ( figura 2). El búfer de burbuja continuamente durante la rebanada del cerebro.
- Recortar la periferia de la zona de destino con unas tijeras de iris.
- Lavado las rodajas cortadas en temperatura ambiente aCSF burbujearon con 5% CO 2 / 95% de O 2 (tabla 2). Rodajas de
- mantener la recortada en una cámara de interfaz hasta que la grabación está realizan ( Figura 2D y E). Incubación durante 1 hora en la cámara mejora la condición de las células, pero los fenotipos cambian si los cortes se incuban durante más de 10 horas. Cierre la tapa de la cámara para encerrar los gases y el líquido en pequeñas gotas de aCSF.
8. Abrazadera del remiendo de celulares
Nota: grabaciones de celulares requieren un amplificador y un filtro de paso bajo que se establece en una frecuencia de corte de 5 kHz. Las señales son digitalizadas y almacenadas en un PC. Se analizan los datos almacenados fuera de línea ( Figura 3A).
- Crear electrodos de vidrio utilizando un extractor horizontal. Llenar los electrodos con una solución adecuada (tablas 3 y 4) utilizando una jeringa de 1 mL de polietileno normal conectado a un tubo de cristal fino y un filtro de 0,22 μm.
- Antes del contacto con la célula, mantener presión positiva y ajustar la corriente a cero pipeta.
- Después formando un gigaohm, aplicar presión negativa a la ruptura de la membrana de la célula (célula entera configuración figura 3F).
9. Análisis de la abrazadera de la corriente
- propiedades de la membrana celular
- llenan el parche grabación pipetas con la solución intracelular para grabaciones de abrazadera de la corriente (cuadro 3). La resistencia de la pipeta es entre MΩ 4 y 7 MΩ en la aCSF.
- Después de rupturas de la membrana, mantener la tensión de la membrana a -60 mV en modo V-CLAMP. Luego, cambiar de " baño " modo a " celular " modo en la prueba de la membrana utilizando el software para medir las propiedades intrínsecas de la célula como la capacitancia de la membrana, la resistencia y la constante de tiempo.
- Estudio de inyección actual
- después de registrar las propiedades intrínsecas de la célula, cambia el modo de V-CLAMP a pista (I = 0) /I-CLAMP NORMAL para la inyección actual. Tenga en cuenta que el potencial de Unión líquida no debe ser corregido 10.
- Inyectar corriente en la célula para la Sra. 300 cambia la intensidad de la corriente de paso a paso de − 100 pA a pA +550 con aumentos de 50 pA. Contar el número de espigas (potenciales de acción) sacados por las inyecciones actuales.
- Medir la tensión mínima necesaria para provocar un potencial de acción (esto es el voltaje de umbral).
- Calcular la amplitud de afterhyperpolarization como la diferencia entre la tensión en la iniciación de la espiga y el voltaje más bajo alcanzado durante el afterhyperpolarization 7.
10. Análisis de abrazadera de tensión
- AMPA/NMDA la relación
Nota: relación de la AMPA/NMDA es una forma convencional de evaluar postsináptico plasticidad glutamatérgica sinapsis excitatorias 7 , 8 , 9 , 10 , 11. sin embargo, tenga en cuenta que aumentos concomitantes en ambos componentes no pueden cambiar el cociente 13.- Perfuse la sala de grabación con solución fisiológica burbujeada con la mezcla de gases y mantener la temperatura a 22 ° C a 25 picrotoxin de 0.1mm ° C. Agregue a la solución para bloquear el GABA A - respuesta mediada por y añadir 4 μm 2- chloroadenosine para estabilizar la respuesta neural evocada 14.
- Llenar el parche pipetas con la solución intracelular para abrazadera de tensión de grabación grabaciones (tabla 4). Comprobar la resistencia de la pipeta de la grabación en la aCSF. La resistencia está entre MΩ 4 y 7 MΩ.
- Para la grabación en neuronas piramidales de capa II/III en el M1, coloque un tungsteno bipolar estimular electrodo 200 μm a 300 μm lateral a las células a ser grabado, debajo de la superficie pial de la región de la representación del miembro anterior (2 mm lateral a la de la línea media) 15 , 16 , 17.
- Para la grabación en una neurona piramidal CA1, coloque el estimulante electrodo 200 μm a 300 μm lateral (fibra colateral de Schaffer) o medial (vía temporoammonic) a las células que va a ser grabado ( figura 3B).
- Aumentar la intensidad del estímulo hasta la respuesta sináptica > 10 pa.
- Calcular el cociente NMDA/AMPA como el cociente de la corriente máxima medida en − 60 mV a la corriente medida a + 40 mV en 150 ms después del inicio del estímulo. Tenga en cuenta que rastros de 50 a 100 deben promediarse para calcular el cociente de.
- Grabaciones actuales postsinápticas miniatura
Nota: corrientes postsinápticas excitatorias de miniatura (mEPSCs) se cree que corresponden a las respuestas que se produce por la liberación presináptica de una sola vesícula de glutamato 18 . Por el contrario, corrientes postsinápticas inhibitorios de miniatura (mIPSCs) se cree que corresponden a las respuestas que se produce por la liberación presináptica de una sola vesícula de GABA 18. Aumento en las amplitudes de mEPSCs y mIPSCs refleja la transmisión postsináptica fortalecimiento, mientras que aumenta en el caso de frecuencia reflejan aumentos en el número de sinapsis funcionales o la probabilidad de liberación presináptica 11 .- Llene la pipeta de la grabación de parche con solución intracelular modificado (cuadro 4) para ajustar el potencial de reversión de la corriente mediada por el receptor GABA A -60 mV.
- Tetrodotoxin de agregar 0.5 μm al baño para bloquear los potenciales de acción espontáneos.
- Mantener la tensión a -60 mV a rECORD los acontecimientos mEPSC por 5 min
- Cambio la explotación potencial de 0 mV a mIPSC registro de eventos durante 5 minutos. Ya que las neuronas de M1 inversión ligeramente superior potencial de corrientes mediada por receptor AMPA, las mIPSCs de las neuronas de M1 se registran entre + 15 mV con APV de 0,1 mM.
- Espere unos minutos para estabilizar la corriente.
- Registrar los eventos de mIPSC de 5 min.
- Detectar los eventos de la miniatura con el software y utilizar eventos sobre 10 pA para el análisis. Contar el número de eventos mEPSCs o mIPSCs por 5 min determinar la frecuencia. Promedio de las amplitudes de los eventos para obtener la amplitud media.
- Confirmar si tratamiento de baño con el μm 10 CNQX o con 10 μm bicuculina metiodida bloquea los eventos mEPSCs y mIPSCs, respectivamente.
- Análisis de Paired-pulso
Nota: plasticidad presináptica puede ser analizada mediante análisis de junto-pulso. Un aumento en la frecuencia del pulso apareado sugiere una disminución en el presynaptic glutamato o GABA liberar probabilidad 7 , 10 , 11.- Analizar las sinapsis excitatorias, añadir picrotoxin 0,1 mM y registrar la respuesta a -60 mV. Aunque hemos añadido 4 μm 2-chloroadenosine para el baño, tenemos que tener en cuenta que la droga afecta a la probabilidad de liberación presináptica 14.
- Analizar las sinapsis inhibitorias, Añadir 0,1 mM APV y 4 μm 2-chloroadenosine para el baño y grabar la respuesta a 0 mV. En las neuronas de M1, registrar la respuesta en + 15 mV.
- Aplicar pulsos pareados con un intervalo inter-estímulo de ms de 100 o 200 ms.
- Registrar rastros alternativamente 50 a 100 a cada uno potencial y promedio de los valores.
- Calcular el cociente de pulso sincronizado como la relación entre el segundo pico en el primer pico de la corriente postsináptica.
Resultados
Como hemos descrito recientemente7, formación de barra del rotor (figura 1A) inducida por cambios dinámicos en la plasticidad intrínseca de las neuronas piramidales del M1 capa II/III. Medición de la latencia hasta que las ratas caigan de la varilla giratoria nos permite estimar el rendimiento de aprendizaje especializado de la rata. Latencia mayor indica mejor rendimiento del motor. El día 1 de entrenamiento, las ratas mejoraron su desempeño de barra del rotor hasta que el juicio terminó. El día 2, las ratas logrado niveles casi asintótica en la sesión promedio puntaje (figura 1B). En comparación con la latencia en el primer ensayo, análisis post-hoc mostraron mejoras significativas en las pruebas finales en los días de entrenamiento (figura 1).
Figura 4A muestra un ejemplo de análisis de la abrazadera de la corriente en que las propiedades neuronales cambiaron después de aprendizaje motor habilidades. Inyecciones de pA 400 y 500 pA corrientes eran necesarias para inducir a potenciales de acción en el grupo no entrenado y en las ratas entrenadas de 1 día, respectivamente. En cambio, la inyección de sólo una pA 150 actual era suficiente para generar potenciales de acción en las ratas entrenados 2 días. La relación entre la intensidad de corriente y el número de potenciales de acción se muestra en la Figura 4B. PA tan poco como 50 actual era suficiente para provocar picos en ratas entrenadas 2 días; en contraste, 1 día entrenadas ratas respondieron con menos potenciales de acción que las ratas no entrenadas a 350 pA corrientes más altas. Por otra parte, la figura 4 muestra que 1 día entrenadas ratas mostraron menor reposo potencial, mayor punto umbral y afterhyperpolarization más profundo, mientras que ratas entrenadas 2 días mostraron mayor potencial de reposo (figura 4) y resistencia () membrana Figura 4).
Como Describimos previamente11, formación de IA (figura 1) inducida por plasticidad postsináptico en las sinapsis inhibitorias y excitatorias de las neuronas de CA1 hipocampales. Midiendo la latencia en la caja de luz, podríamos estimar el rendimiento de aprendizaje contextual de la rata. Figura 1E muestra los resultados de la tarea IA. Después del choque eléctrico sincronizado, las ratas aprenden a evitar el lado oscuro de la casilla y permanecer en el lado iluminado, que generalmente no prefieren. Por lo tanto, la tendencia a evitar el lado oscuro indica la adquisición de memorias contextuales.
La figura 5 muestra un ejemplo de análisis de la abrazadera de tensión en que miniatura postsynaptic corrientes cambiaron drásticamente después de aprendizaje contextual. Para investigar la plasticidad inducida por el aprendizaje, el espontáneo mEPSCs mediada por el AMPA y GABAA-mediadas mIPSCs fueron registrados secuencialmente en presencia de 0.5 tetrodotoxin μm (figura 5A y B). Como se muestra en diagramas de dos dimensiones (figura 5), cada neurona CA1 tenía diferentes amplitudes medias de mEPSCs y mIPSCs. Aunque las amplitudes eran bajas y mostraron una distribución estrecha en inexperimentados, desapareado, y ratas de recorrido, eran diversas en ratas entrenado por la IA (tabla 5). ANOVA seguido de análisis post-hoc mostró un aumento significativo en las amplitudes medias de mEPSC y mIPSC en ratas entrenado por la IA (figura 5E), sugiriendo inducida por el aprendizaje plasticidad postsináptico en las neuronas de CA1.
Por otra parte, cada neurona CA1 exhibieron diferentes frecuencias mEPSC y mIPSC (figura 5). Aunque las frecuencias son bajas y mostraron una distribución estrecha en inexperimentados, desapareado, y ratas de recorrido, eran diversas en ratas entrenado por la IA (tabla 6). ANOVA seguido de análisis post-hoc mostró un aumento significativo en las frecuencias de los eventos mEPSC y mIPSC en ratas entrenado por la IA (figura 5F). Hay dos posibles interpretaciones de estos resultados. La primera es que el aprendizaje contextual aumentó el número de sinapsis funcionales de las neuronas. La otra es que el aprendizaje contextual aumenta la probabilidad de liberación presináptica de glutamato y GABA.
Para examinar más plasticidad presináptica, también realizamos pulso empareja estímulos, según ha informado previamente de10,11.
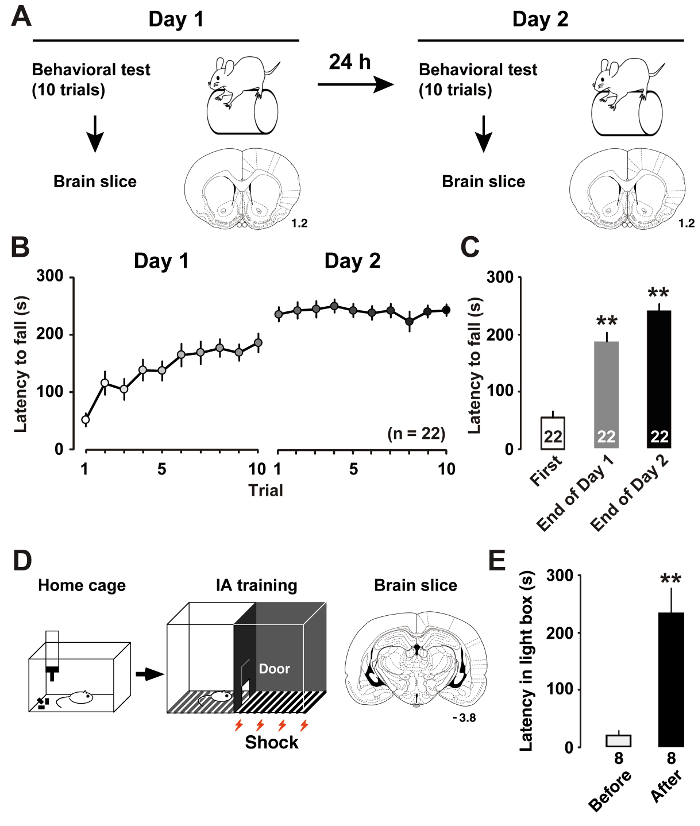
Figura 1 : Rendimiento después de un entrenamiento de aprendizaje.
A: el diseño experimental muestra la formación de la barra de rotor y corte coronal del cerebro. B: la latencia media al caer desde el cañón de barra de rotor aceleración. C: la latencia media al caer de la barra en la primera y las pruebas finales de entrenamiento los días 1 y 27. P< 0.01 vs primer ensayo. D: esquema de la rebanada del cerebro de tarea y coronal de evitación inhibitoria (IA). E: la latencia media para entrar en el cuadro oscuro antes y después de IA formación11. P< 0.01 vs antes de entrenar IA. Los números de las secciones coronales indican la distancia anterior bregma en mm. El número de animales se muestra en la parte inferior de las barras. Barras de error indican SEM. haga clic aquí para ver una versión más grande de esta figura.
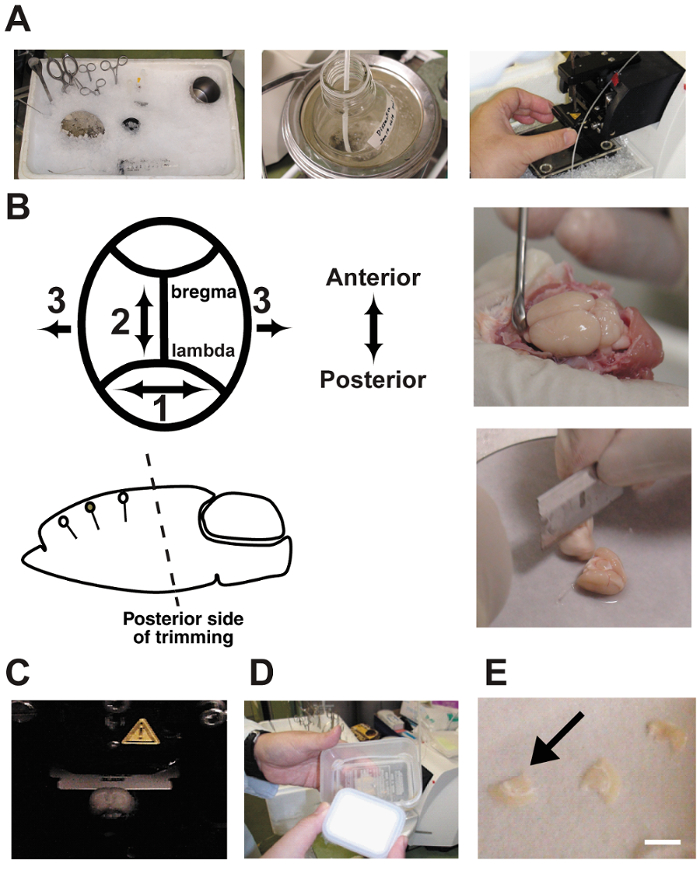
Figura 2 : Cortar procedimientos.
A: las fotografías muestran la preparación de rodajas de cerebro agudo. Las herramientas de disección se enfriaron en antes del uso de hielo triturado. B: la disección y corte de cerebro. Tenga en cuenta que el ángulo de corte en la parte posterior debe estar orientado en paralelo con la orientación dendrítica. C: cortar el cerebro en una cámara de vibratome. El cerebro está bañado en tampón de disección y burbujeado continuamente con una mezcla de gas 5% CO295% O2 . D: una cámara de interfaz hace de dos recipientes de plástico y un tubo de silicona. La cámara se llena de CSF artificial y burbujeada continuamente con la mezcla de gases. E: rebanadas de cerebro se colocaron sobre papel filtro húmedo en la cámara.Bar = 5 mm. haga clic aquí para ver una versión más grande de esta figura.
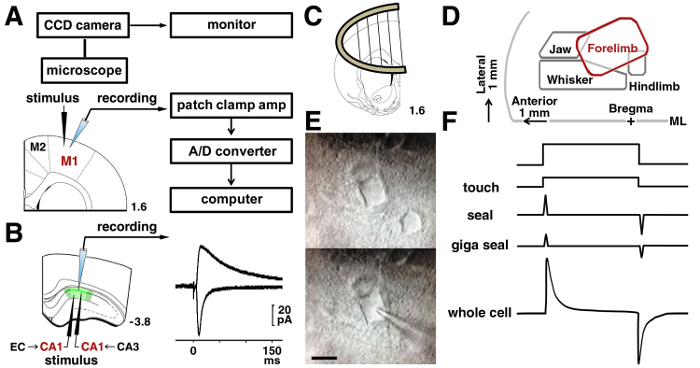
Figura 3 : Procedimientos de Patch clamp.
A: el sistema de abrazadera del remiendo para registrar las señales eléctricas de una neurona. En la corteza de motor de rata se muestran la ubicación de la estimulante y electrodos de grabación en las neuronas de capa II/III. B: para analizar las sinapsis de una neurona piramidal CA1 de Schaffer, un electrodo de estimulación fue colocado en el radiatum del estrato. Para analizar temporoammonic sinapsis, un electrodo de estimulación se colocó a la moleculare del estrato. Representante de rastros de evocados AMPA y NMDA receptor-medió excitatory postsynaptic corrientes en la misma neurona CA1 se muestran. C: un ancla de slice fue utilizado para estabilizar el segmento en la cámara de grabación. D: un mapa de representación en la corteza de motor, basado en los trabajos publicados15,16,17. ML = línea media. E: Micrografías de IR-DIC de M1 capa de neuronas II/III antes de (alto) y durante la grabación (inferior). Bar = 10 μm. F: cambios en la pipeta de corriente antes de tocar (parte superior) y en la ruptura de la membrana (parte inferior). Haga clic aquí para ver una versión más grande de esta figura.
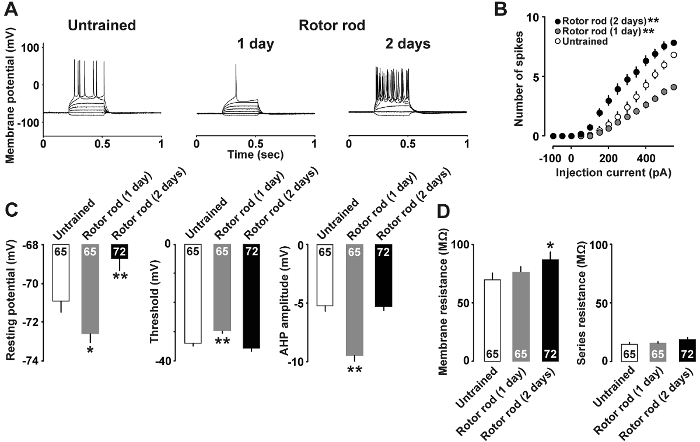
Figura 4 : Resultados representativos del análisis de corriente abrazadera7 .
A: vestigios representativos de potenciales de acción registran después de la inducción con las inyecciones actuales. B: relación entre promedio actual de la entrada (pA) vs salida potencial de acción (número de espigas) en rebanadas de cerebro inexpertos (barras abiertas), formado de 1 día (barras grises) y ratas entrenadas 2 días (barras llenas). C: reclinación potencial umbral y afterhyperpolarization de las neuronas de capa II/III. D: resistencia de la membrana y resistencia de las neuronas. Utilizamos 9-10 ratas de cada grupo. Se muestra el número de células en cada barra. Barras de error indican la SEM. *P< 0.05, **P< 0.01 vs sin entrenamiento. Haga clic aquí para ver una versión más grande de esta figura.
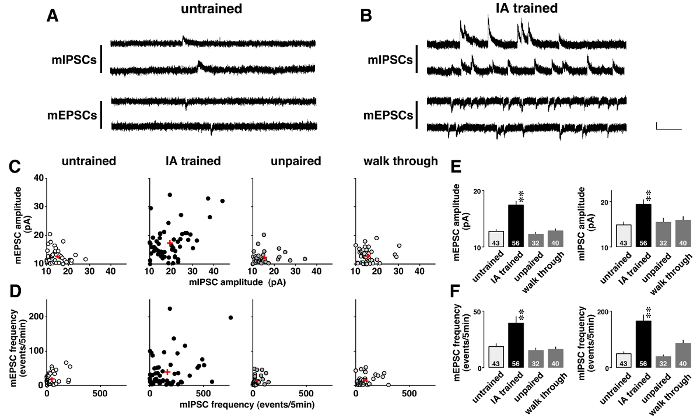
Figura 5 : Resultados representativos de la abrazadera de tensión análisis11 .
Vestigios representativos de miniatura excitatorio y el inhibitorio postsynaptic corrientes (mEPSCs y mIPSCs) inexperto (A) y la evitación inhibitoria (IA)-entrenado ratas (B). mEPSCs a-60 mV y mIPSCs en 0 mV fueron medidos secuencialmente en la misma neurona piramidal CA1 en presencia de tetrodotoxina (0,5 μm). Barra vertical = 20 pA, barra horizontal = 200 msec. C: dos dimensiones de parcelas de la media mE (I) PSC amplitudes en inexperimentados, IA-entrenado, desapareado y recorrido por las ratas. D: parcelas bidimensionales de mí (I) PSC frecuencias en los 4 grupos. Nota que cada neurona CA1 exhibieron diferentes mE (I) significa frecuencias y amplitudes PSC. Formación de IA no sólo consolidó las amplitudes medias (E) pero también aumentaron las frecuencias de mí (I) eventos PSC (F). Utilizamos 4-6 ratas en cada grupo. El número de células se muestra en la parte inferior de las barras. Signos más rojo (C, D) y barras con líneas verticales (E, F) indican la media ± SEM. **P< 0.01 vs inexperimentados ratas. Haga clic aquí para ver una versión más grande de esta figura.
| Buffer de disección (Total 1L) | ||
| NaH2PO4 • 2 H2O | 0,195 g | 1.25 mmol/L |
| KCl | g 0,188 | 2.5 mmol/L |
| CaCl2 | g 0,074 | 0.5 mmol/L |
| MgCl2 • 6 H2O | 1,423 g | 7.0 mmol/L |
| Cloruro de colina | 12,579 g | 90 mmol/L |
| Ácido ascórbico | g 2,340 | 11,6 mmol/L |
| Ácido pirúvico | 0,342 g | 3.1 mmol/L |
| NaHCO3 | 2,100 g | 25 mmol/L |
| Glucosa | 4,500 g | 25 mmol/L |
Tabla 1: Una receta para el búfer de disección
| LCR artificial (Total 1L) | ||
| KCl | 0,186 g | 2.5 mmol/L |
| NaCl | 6,700 g | 114,6 mmol/L |
| NaH2PO4 •2H2O | 0,156 g | 1 mmol/L |
| Glucosa | 1,800 g | 10 mmol/L |
| NaHCO3 | 2,184 g | 26 mmol/L |
| 1M de MgCl2 | 4 mL | 4 mmol/L |
| 1M CaCl2 | 4 mL | 4 mmol/L |
Tabla 2: Una receta para artificial del líquido cerebroespinal (CFS)
| Solución intracelular para la pinza amperimétrica (Total 200 mL) | ||
| KCl | 0,0746 g | 5 mmol/L |
| Gluconato de K | 6,089 g | 130 mmol/L |
| HEPES | g 0,476 | 10 mmol/L |
| EGTA | g 0,0456 | 0,6 mmol/L |
| 1M de MgCl2 | 500 ΜL | 2.5 mmol/L |
| Na2 ATP | 0,4408 g | 4 mmol/L |
| Na3 GTP | 0,0418 g | 0.4 mmol/L |
| Fosfocreatina na | g 0,510 | 10 mmol/L |
Tabla 3: Grabación de una receta para una solución intracelular para la pinza de corriente
| Solución intracelular para abrazadera de tensión (Total 200 mL) | ||||
| CsMeSO3 | 5 | |||
Tabla 4: Una receta para una solución intracelular para abrazadera de tensión de grabación
| Parámetros | sin entrenamiento | Entrenado de IA | no apareados | caminar a través de | |
| amplitud mEPSC | Varianza | 5.8 | 32.1 | 4.7 | 5.9 |
| Desviación estándar | 2.4 | 5.7 | 2.2 | 2.4 | |
| Coeficiente de variación | 0.189 | 0.326 | 0.177 | 0.190 | |
| amplitud mIPSC | Varianza | 17.1 | 56,7 | 31.8 | 20.7 |
| Desviación estándar | 4.1 | 7.5 | 5.6 | 4.5 | |
| Coeficiente de variación | 0.279 | 0.387 | 0.367 | 0.286 |
Tabla 5: La diversidad de miniatura inhibitorias y excitatorias postsinápticos actual (mEPSC y mIPSC) las amplitudes de evitación inhibitoria (IA)-entrenado ratas
| Parámetros | sin entrenamiento | Entrenado de IA | no apareados | caminar a través de | |
| mEPSC frecuencia | Varianza | 278 | 2195 | 188 | 195 |
| Desviación estándar | 17 | 47 | 14 | 14 | |
| Coeficiente de variación | 0.902 | 1.198 | 0.893 | 0.874 | |
| mIPSC frecuencia | Varianza | 3282 | 27212 | 1385 | 5135 |
| Desviación estándar | 57 | 165 | 37 | 72 | |
| Coeficiente de variación | 1.195 | 1.006 | 0.955 | 0.836 |
Tabla 6: La diversidad de miniatura inhibitorias y excitatorias postsinápticos actual (mEPSC y mIPSC) las frecuencias en evitación inhibitoria (IA)-entrenado ratas
Discusión
La limitación principal de la técnica de abrazadera del remiendo de rebanada es la grabación en preparación de la rebanada, que puede no reflejar lo que sucede en vivo. Aunque en vivo corriente-abrazadera análisis es más fiable, técnicamente es difícil obtener suficientes datos de animales conscientes. Dado que cada neurona piramidal tiene propiedades celulares diferentes, es necesario un número adecuado de células para analizar adecuadamente las diferencias en las neuronas después del entrenamiento. Además, análisis de tensión-abrazadera requiere tratamiento continuo con CNQX, APV o bicuculina para determinar la naturaleza de las respuestas postsinápticas. Para analizar las respuestas de miniatura inducidas por una única vesícula de glutamato o GABA, continuado tratamiento con tetrodotoxina es necesario bloquear los potenciales de acción espontáneos. Aunque la recientemente desarrollada técnica de imagen multi-photon es potente para el análisis de los cambios morfológicos en las sinapsis excitatorias19, una técnica de sujeción parche combinado es necesario analizar la función de las sinapsis en vivo. Actualmente es muy difícil analizar los cambios morfológicos en las sinapsis inhibitorias, puesto que más inhibitorias sinapsis forman espinas. En este momento, la abrazadera del remiendo rebanada sería la técnica más adecuada para analizar propiedades de celda o las funciones de sinapsis excitatoria/inhibitoria en animales entrenados.
Mediante el análisis de la abrazadera de la corriente (figura 4), nos informó recientemente plasticidad intrínseca inducida por el aprendizaje motor en neuronas de capa II/III. Concretamente, el 1 día entrenadas ratas mostró una disminución significativa en la reclinación potencial de membrana y un aumento en el umbral de la espiga. Las ratas entrenadas 2 días mostraron un aumento significativo en la reclinación potencial de la membrana que condujo a mayor excitabilidad. Estos resultados sugirieron hay cambios dinámicos en la plasticidad intrínseca del M1 la neuronas de capa II/III en ratas entrenadas. Abrazadera de tensión adicional análisis reveló un aumento en la proporción de junto-pulso en 1 día entrenadas ratas, sugiriendo que hubo una disminución transitoria en la presináptica GABA release probabilidad7. Por lo tanto es posible que desinhibición de GABA en la capa II/III sinapsis podría desencadenar la plasticidad inducida por el aprendizaje resultante de la M1. En apoyo de esto, preparación de la rebanada de la M1 requiere baño tratamiento con un bloqueador de los receptores GABAA para inducir LTP20.
Análisis de potenciales postsinápticos miniatura es una manera poderosa para detectar la plasticidad sináptica en los animales entrenados de IA. Secuencial de grabación de mEPSCs y mIPSCs en una sola neurona CA1 permite el análisis de la fuerza sináptica excitatoria/inhibitoria de cada neurona individual. Desde un solo mE (I) PSC respuesta es atribuida a una única vesícula de glutamato o GABA, un aumento en el yo (I) PSC amplitud sugiere fortalecer la postsináptica. ME usando (I) análisis del PSC, se encontraron diferencias individuales en la fuerza de entrada excitatoria/inhibitoria en cada neurona CA1 (figura 5). Formación de IA claramente promueve la diversidad en la fuerza sináptica, pero esto no fue observado en otros grupos (tabla 5).
Sináptica inducida por el aprendizaje de la diversidad se puede analizar matemáticamente. Mediante el cálculo de la probabilidad de aparición de cada punto, los datos de cada neurona se pueden convertir en uno mismo-entropía (bit) utilizando la teoría de la información de Claude E. Shannon21. Un punto con una probabilidad de aparición alta (alrededor del nivel medio) indica bajo uno mismo-entropía, mientras que un punto con una probabilidad muy rara (un punto desviado) indica alta uno mismo-entropía. En comparación con las ratas no entrenadas, la uno mismo-entropía por neurona aumentó claramente en IA entrenó ratas aunque no desapareada o recorrido ratas22. Este análisis sugiere que hubo un aumento de información intra-CA1 después el aprendizaje contextual.
La técnica de abrazadera del remiendo de rebanada puede utilizarse también para localización miedo acondicionado estudios en la amígdala lateral9 y para estudios de la experiencia sensorial en la corteza de barril8. Por otra parte, esta técnica puede utilizarse con varias otras técnicas para posteriores investigaciones. Por ejemplo, la mediada por el virus de la proteína verde fluorescente (GFP)-gene etiquetada entrega técnica puede combinarse con la técnica de patch clamp para analizar la función de moléculas específicas. Además, la microinyección focal de un trazador retrógrado puede utilizarse para visualizar neuronas específicas de ese proyecto en un área específica. Entonces, usando la técnica de la abrazadera de la corriente, propiedades específicas de la célula pueden ser analizadas en el visualizado neuronas23. Además, combina dos fotones láser-microscopía con dos fotones láser uncaging de glutamato se ha utilizado para demostrar el crecimiento específico de la columna vertebral y la respuesta de la EPSC en ratón cortical de la capa de neuronas piramidales de II/III19. Así, se mejora la técnica de abrazadera del remiendo de rebanada combinando con productos químicos nuevos, genes y técnicas de manipulación de la foto.
Divulgaciones
Los autores no declaran conflictos de interés. Confirmamos que hemos podido leer la posición de la revista sobre cuestiones relacionadas con la publicación ética, y afirmamos que este informe es coherente con las directrices. Los fundadores no tenían ningún papel en el diseño del estudio, recopilación de datos o análisis, la decisión de publicar o la preparación del manuscrito.
Agradecimientos
Nos gustaría agradecer al Dr. pata-Min-Thein-Oo, Dr. Han-Thiri-Zin y Sra. H. Tsurutani su asistencia técnica. Este proyecto fue apoyado por subvenciones para jóvenes científicos (H.K. y Y.S.), B investigación científica (D.M.), C de investigación científica (D.M.) y la investigación científica en áreas innovadoras (D.M.), desde el Ministerio de educación, cultura, deportes, ciencia, y Tecnología de Japón.
Materiales
| Name | Company | Catalog Number | Comments |
| Rota-Rod Treadmills | Med Associates Inc. | ENV577 | |
| inhibitory avoidance box | Shinano Seisakusho | ||
| Pentobarbital | Kyoritsu Seiyaku | ||
| Blade | Nisshin EM Co., Ltd | LC05Z | |
| Cardiac perfusion syringe | JMS Co., Ltd | JS-S00S | |
| Vibratome | Leica Microsystems | VT-1200 | |
| Horizontal puller | Sutter Instrument | Model P97 | |
| Microfilm 34 gauge | World Precision Instruments, Inc | MF34G-5 | |
| 0.22 µm filter | Millipore | SLGVR04NL | |
| Axopatch–1D amplifier | Axon Instruments | ||
| Digidata 1440 AD board | Axon Instruments | ||
| pCLAMP 10 software | Axon Instruments | ||
| Upright Microscope | Olympus | BX51WI | |
| CCD camera | Olympus | U-CMAD3 | |
| Camera controller | Hamamatsu Photonics K.K. | C2741 | |
| Stimulator | Nihon Kohden | SEN-3301 | |
| Isolator | Nihon Kohden | SS-104J | |
| Motorized manipulator | Sutter Instrument | MP-285 | |
| Micromanipulator | Narishige | NMN-21 | |
| Peristaltic Pump | Gilson, Inc | MINIPULS® 3 | |
| Glass capillary | Narishige | GD-1.5 | |
| Ag/AgCl electrode | World Precision Instruments, Inc | EP4 | |
| Slice Anchor | Warner instruments | 64-0252 | |
| Stimulus electrode | Unique Medical Co., Ltd | KU201-025B | |
| Materials | Company | Catalog Number | Comments |
| Dissection buffer/ artificial CSF | |||
| NaH2PO4 • 2H2O | Sigma-Aldrich Co. | C1426 | |
| KCl | Wako Pure Chemical Industries | 163-03545 | |
| CaCl2 | Wako Pure Chemical Industries | 039-00475 | |
| MgCl2 • 6H2O | Wako Pure Chemical Industries | 135-00165 | |
| Choline chloride | Sigma-Aldrich Co. | C7527 | |
| Ascorbic acid | Wako Pure Chemical Industries | 190-01255 | |
| Pyruvic acid Na | Wako Pure Chemical Industries | 199-03062 | |
| NaHCO3 | Sigma-Aldrich Co. | 28-1850-5 | |
| Glucose | Sigma-Aldrich Co. | 07-0680-5 | |
| Materials | Company | Catalog Number | Comments |
| Intracellular solution | |||
| K-Gluconate | Sigma-Aldrich Co. | G4500 | |
| HEPES | Wako Pure Chemical Industries | 346-01373 | |
| EGTA | Wako Pure Chemical Industries | 348-01311 | |
| Na2 ATP | Nacalai Tesque | 01072-24 | |
| Na3 GTP | Sigma-Aldrich Co. | G-8877 | |
| Na phosphocreatine | Sigma-Aldrich Co. | P-7936 | |
| CsMeSO3 | Sigma-Aldrich Co. | C1426 | |
| CsCl | Wako Pure Chemical Industries | 033-01953 | |
| Materials | Company | Catalog Number | Comments |
| Drugs in aCSF | |||
| 2-Chloroadenosine | Sigma-Aldrich Co. | C5134 | |
| Picrotoxin | Sigma-Aldrich Co. | P-1675 | |
| Tetrodotoxin | Wako Pure Chemical Industries | 207-15901 | |
| CNQX | Sigma-Aldrich Co. | C239 | |
| APV | Sigma-Aldrich Co. | A5282 |
Referencias
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Arch. 414 (5), 600-612 (1989).
- Rioult-Pedotti, M. S., Friedman, D., Donoghue, J. P. . Learning-induced LTP in neocortex. Science. 290 (5491), 533-536 (2000).
- Yang, G., Pan, F., Gan, W. B. Stably maintained dendritic spines are associated with lifelong memories. Nature. 462 (7275), 920-924 (2009).
- Xu, T., et al. Rapid formation and selective stabilization of synapses for enduring motor memories. Nature. 462 (7275), 915-919 (2009).
- Kida, H., et al. Motor Training Promotes Both Synaptic and Intrinsic Plasticity of Layer II/III. Pyramidal Neurons in the Primary Motor Cortex. Cereb Cortex. 26 (8), 3494-3507 (2016).
- Takahashi, T., Svoboda, K., Malinow, R. Experience strengthening transmission by driving AMPA receptors into synapses. Science. 299 (5612), 1585-1588 (2003).
- Rumpel, S., LeDoux, J., Zador, A., Malinow, R. Postsynaptic receptor trafficking underlying a form of associative learning. Science. 308 (5718), 83-88 (2005).
- Mitsushima, D., Ishihara, K., Sano, A., Kessels, H. W., Takahashi, T. Contextual learning requires synaptic AMPA receptor delivery in the hippocampus. Proc Natl Acad Sci U S A. 108 (30), 12503-12508 (2011).
- Mitsushima, D., Sano, A., Takahashi, T. A cholinergic trigger drives learning-induced plasticity at hippocampal synapses. Nat Commun. 4, 2760 (2013).
- Kida, H., Mitsushima, D. Patch Clamp Technique in Brain Slices: Recording of Neuronal Activity in the Rat Primary Motor Cortex. Yamaguchi Medical Journal. 63, (2014).
- Watt, A. J., van Rossum, M. C., MacLeod, K. M., Nelson, S. B., Turrigiano, G. G. Activity coregulates quantal AMPA and NMDA currents at neocortical synapses. Neuron. 26 (3), 659-670 (2000).
- Baidan, L. V., Zholos, A. V., Wood, J. D. Modulation of calcium currents by G-proteins and adenosine receptors in myenteric neurones cultured from adult guinea-pig small intestine. Br J Pharmacol. 116 (2), 1882-1886 (1995).
- Tandon, S., Kambi, N., Jain, N. Overlapping representations of the neck and whiskers in the rat motor cortex revealed by mapping at different anaesthetic depths. Eur J Neurosci. 27 (1), 228-237 (2008).
- Adachi, K., Murray, G. M., Lee, J. C., Sessle, B. J. Noxious lingual stimulation influences the excitability of the face primary motor cerebral cortex (face MI) in the rat. J Neurophysiol. 100 (3), 1234-1244 (2008).
- Tennant, K. A., et al. The organization of the forelimb representation of the C57BL/6 mouse motor cortex as defined by intracortical microstimulation and cytoarchitecture. Cereb Cortex. 21 (4), 865-876 (2011).
- Pinheiro, P. S., Mulle, C. Presynaptic glutamate receptors: physiological functions and mechanisms of action. Nat Rev Neurosci. 9 (6), 423-436 (2008).
- Kwon, H. B., Sabatini, B. L. Glutamate induces de novo growth of functional spines in developing cortex. Nature. 474 (7349), 100-104 (2011).
- Hess, G., Donoghue, J. P. Long-term potentiation of horizontal connections provides a mechanism to reorganize cortical motor maps. J Neurophysiol. 71 (6), 2543-2547 (1994).
- Shannon, C. E. A mathematical theory of communication. Bell Sys Tech J. 27, (1948).
- Ono, K. M., D, Learning creates diversity of excitatory and inhibitory synapses in the hippocampal CA1: a possible amount of information at a single synapse. J Physiol Sci. 67, (2017).
- Wang, L., Conner, J. M., Rickert, J., Tuszynski, M. H. Structural plasticity within highly specific neuronal populations identifies a unique parcellation of motor learning in the adult brain. Proc Natl Acad Sci U S A. 108 (6), 2545-2550 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados