Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Evaluación in vivo de las propiedades mecánicas y viscoelásticas de la lengua de rata
En este artículo
Resumen
Se describe un procedimiento quirúrgico en un modelo anestésico de rata para determinar el tono muscular y las propiedades viscoelásticas de la lengua. El procedimiento consiste en la estimulación específica de los nervios hipoglosos y la aplicación de la fuerza pasiva Lissajous / curvas de deformación en el músculo.
Resumen
La lengua es un músculo altamente inervado y vascularizado hidrostático en el suelo de la boca de la mayoría de los vertebrados. Sus funciones principales incluyen el apoyo a la masticación y la deglución, así como la detección del gusto y la fonética. En consecuencia, la fuerza y el volumen de la lengua pueden afectar la capacidad de los vertebrados para llevar a cabo actividades básicas tales como alimentación, comunicación y respiración. Los pacientes humanos con apnea del sueño tienen lenguas agrandadas, caracterizadas por la reducción del tono muscular y aumento de la grasa intramuscular que puede ser visualizada y cuantificada por resonancia magnética (MRI). Las capacidades para medir la generación de fuerza y las propiedades viscoelásticas de la lengua constituyen herramientas importantes para obtener información funcional correlacionada con los datos de imágenes. Aquí, presentamos técnicas para medir la producción de la fuerza de la lengua en ratas Zucker anestesiadas mediante estimulación eléctrica de los nervios hipoglosos y para determinar las propiedades viscoelásticas oF la lengua aplicando curvas de fuerza / deformación pasivas de Lissajous.
Introducción
La lengua proporciona apoyo esencial para la masticación, la deglución, la detección del gusto y el habla. La presencia de musculatura extrínseca e intrínseca, con innervación y anatomía / función distintas, explica la singularidad de este hidrostato muscular. Los recientes avances en las técnicas de imagen han proporcionado una visión más detallada de su compleja anatomía 1 . La disminución de la funcionalidad de la lengua, la atrofia de la lengua, la disfagia y los impedimentos del habla son también manifestaciones comunes de condiciones miopáticas como Parkinson 2 , Esclerosis Lateral Amiotrófica (ALS) 3 , Distrofia Miotónica (MD) 4 y otras miopatías.
Los cambios en la composición muscular asociados con estados patológicos comunes afectan las propiedades mecánicas y viscoelásticas de la lengua. Por ejemplo, el análisis funcional de la fuerza de la lengua ha descubierto cambios en las propiedades contráctiles asociadas con el envejecimientoSs = "xref"> 5 , 6 , hipoxia 7 , 8 y obesidad 9 , 10 . En el caso de la distrofia muscular, el aumento de la fibrosis conduce a una mayor rigidez muscular, lo que se traduce en menor cumplimiento a la deformación cuando se aplica un protocolo de deformación de Lissajous [ 11] . Por el contrario, los cambios en el contenido de grasa muscular, como los documentados en pacientes obesos, alteran tanto las propiedades metabólicas 12 como las mecánicas del músculo esquelético 13 , 14 y se predice que aumentan el cumplimiento muscular a la deformación. El aumento de la grasa de la lengua también se correlaciona con el desarrollo de la apnea obstructiva del sueño (OSA) en los seres humanos 17 por el aumento del volumen de la lengua hasta el punto de parcial oclusión de las vías respiratorias superiores (apnea) 15 , 16 . SimIlarly a los seres humanos, la infiltración de la grasa de la lengüeta se ha documentado en ratas zucker obesas 10 , sugiriendo que este modelo es una herramienta valiosa para estudiar los efectos de la infiltración gorda en la fisiología de la lengüeta.
Medir la fuerza de la lengua requiere técnicas quirúrgicas delicadas para aislar y estimular bilateralmente los nervios hipoglosos 17 , 18 . Tales técnicas han sido previamente descritas en las ratas 5 , 17 , 19 , 20 , conejos 21 y humanos 22 , 23 , pero con ayudas visuales limitadas para el investigador. Debido a su naturaleza altamente técnica, la disponibilidad de un protocolo detallado mejoraría significativamente la accesibilidad y reproducibilidad de esta técnica. El objetivo de nuestro paradigma experimental esUestra una técnica válida y confiable para medir la fuerza y las propiedades viscoelásticas de la lengua en un modelo de rata. Para lograr esto, la rata es anestesiada, los nervios hipoglosos están expuestos y la tráquea se canula para asegurar el libre acceso a la lengua del animal. Un bucle de sutura conecta entonces la punta de la lengüeta a un transductor de fuerza, capaz de controlar tanto la fuerza como la longitud, mientras que dos electrodos bipolares de gancho estimulan los nervios hipoglosos para inducir la contracción de la lengua. Después de que se completa la medición de la fuerza, las capacidades de control de longitud del transductor de fuerza se utilizan para cambiar rápidamente la longitud de la lengua, de acuerdo con un protocolo de onda senoidal con amplitud fija (curvas de Lissajous), duración y frecuencia, permitiendo derivar Sus propiedades viscoelásticas 11 , 24 . El protocolo guiará al investigador a través de los pasos de disección, el posicionamiento del animal en el platfo experimentalRm, colocación de electrodos y finalmente a la adquisición y análisis de los datos de fuerza y viscoelasticidad.
Protocolo
Todos los procedimientos incluyendo sujetos animales han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Pensilvania (Protocolo número 805822). El procedimiento descrito es terminal y no requiere la utilización de condiciones asépticas o productos de calidad farmacéutica.
1. Procedimientos Quirúrgicos
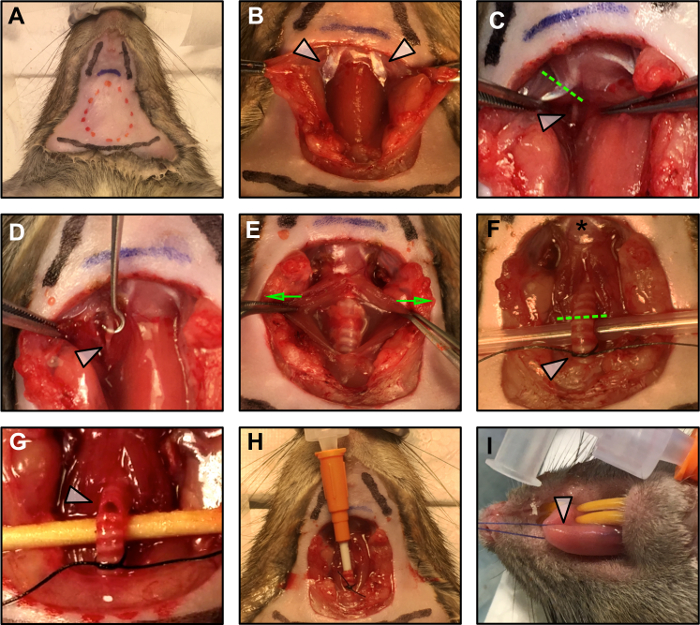
Figura 1: Procedimientos quirúrgicos.
(A) Demarcación del plan quirúrgico. La línea roja discontinua indica el área de la incisión. Dos líneas negras indican la posición de la mandíbula, mientras que la línea negra inferior marca la posición del tórax. La línea azul indica el hueso hioides. (B) Exposición del vientre posterior del músculo digástrico (flechas) después de la disección romo del tejido adiposo, del sublingual y del submaxill Glándulas cerebrales. (C) Resección del vientre posterior del músculo digástrico (línea verde discontinua) para exponer el nervio hipogloso (flecha blanca). (D) El nervio hipogloso (flecha blanca) se despeja de la fascia circundante. (E) La tráquea se expone separando suavemente el músculo liso a su alrededor (las flechas verdes indican la dirección de la fuerza aplicada), y se levanta (F) para prepararse para la intubación. La estrella indica la inserción de la lengua en el hueso hioides. La línea verde discontinua marca el punto de incisión para la intubación. La flecha blanca indica el nudo suelto preparado para asegurar la cánula en su sitio una vez insertado. (G) Incisión de la tráquea para la canulación. (H) La cánula traqueal se inserta y se asegura en su lugar con un nudo cuadrado. (I) Aplicación de la sutura a la lengua.Target = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.
- Anestesia y preparación para la cirugía
- Coloque la rata en la cámara de inducción con un 4% de anestesia con isoflurano.
- Colocar al animal en decúbito supino sobre una fuente de calor y mantener la anestesia con 1 - 3% de isoflurano de una nosecone, asegurando una frecuencia respiratoria de por lo menos 70 respiraciones por minuto.
- Afeita el área del cuello con una crema para eliminar el vello y la depilación. Cuando utilice la crema depiladora, esparza la crema con un aplicador con punta de algodón hasta que se elimine la piel. La exposición prolongada a la crema de depilación puede causar irritación de la piel.
- Limpie el campo quirúrgico con alcohol al 70% ( Figura 1A ).
- Compruebe el patrón de respiración del animal y los reflejos (falta de un reflejo pinchazo) antes de proceder con la incisión inicial. La monitorización y evaluación continua de la profundidad de la anestesia es esencialFrecuencia respiratoria del cordón umbilical y falta de reflejos cada 10 min); El animal necesita estar bajo un plano de anestesia profundo y quirúrgico durante todo el procedimiento.
- Identificación de los Nervios Hipoglosos
- Abra el campo quirúrgico con un par de tijeras operativas resecando y retirando la piel como se indica por la línea de puntos rojos en la Figura 1A .
- Blunt disecar a través de cualquier tejido graso, las glándulas sublinguales y submaxilares y la capa muscular que rodea a la tráquea.
NOTA: Sea conservador durante la disección. Utilice disección romo siempre que sea posible y tenga cuidado de no dañar los vasos sanguíneos del cuello. - Identificar el vientre posterior del músculo digástrico (PD) lateral a la tráquea ( Figura 1B - flechas blancas). El nervio hipogloso corre debajo de este músculo ( Figura 1C - flecha blanca). Con el electrocauterio, reseta el PD proxAl hueso hioides ( Figura 1C - línea de puntos).
NOTA: No deje que el nervio o el tejido alrededor de él se sequen. Añadir una gota de aceite mineral en el nervio para protegerlo. Para evitar la contracción muscular debido a la propagación en el campo del estímulo de los electrodos, cuidadosamente cauterizar el tejido muscular en los posibles sitios de contacto alrededor del nervio. - Usando un par de pinzas finas, disecar el nervio hipogloso de la fascia circundante. Con la ayuda de un gancho, asegúrese de que al menos 3 mm del nervio están disponibles para la conexión del electrodo bipolar ( Figura 1D ).
- Utilizando pinzas hemostáticas micro, aplastar el nervio hipogloso distalmente desde el hueso hioides ( Figura 1D - flecha blanca) como sea posible para evitar la propagación retrógrada del estímulo. Aplastar el nervio aplicando presión sobre él con la pinza hemostática micro durante 5 s. Cuando el hemostasoma agarra el nervio, un breve tBruja en la base de la lengua debe ser visible.
- Repita el procedimiento para el otro lado.
- Intubación traqueal
- Exponga la tráquea separando suavemente los músculos lisos circundantes por disección romo ( Figura 1E - como se indica por las flechas verdes).
NOTA: Sea conservador y utilice preferiblemente una disección romo. Comparar el diámetro de la cánula con el de la tráquea. La cánula debe encajar correctamente en la tráquea y debe permanecer estable insertada después de ser suturada como se describe en los pasos 1.3.2 a 1.3.5. - Levante suavemente la tráquea con un par de pinzas de sutura y pase una sutura 4-0 por debajo, cerca del tórax. Ate un nudo suelto inicial entre el sexto y el séptimo anillo de la laringe ( Figura 1F - flecha blanca). Este nudo se cerrará una vez que se inserte la cánula para mantenerla en su sitio.
- Deslice el vástago de un(Lubricar la pipeta con aceite mineral para facilitar la inserción) debajo de la tráquea para levantarla y facilitar la inserción de la cánula (cánula IV 14 gx 3,25 ").
- Cortar una pequeña incisión entre el cuarto y el quinto anillos de la laringe ( Figura 1G - flecha blanca). Después de la primera incisión, la abertura tenderá a esparcirse, por lo tanto ser conservador al hacer el corte inicial para evitar la resección completa de la tráquea.
NOTA: Antes de realizar la incisión de la tráquea, asegúrese de que la cánula está lista y la entrega de la anestesia está encendida. - Comenzar la administración de la anestesia a través de la cánula e insertarla suavemente en la incisión, avanzando suavemente dentro de la tráquea a lo largo de aproximadamente 5 anillos. Asegure la cánula en su lugar con la sutura, para crear un sello hermético ( Figura 1H ).
NOTA: Asegurarse de que ningún fluido entre en la tráquea picada paraOcación. Una vez que la tráquea se incisa, el animal estará respirando aire ambiente. Por lo tanto, es importante insertar rápidamente la cánula de modo que se mantenga el suministro de la anestesia. Cuando / si se mueve el animal, controlar la posición correcta de la cánula en la tráquea. - Retire suavemente el animal de la nariz.
NOTA: El uso de anestésicos inyectables en lugar de isoflurano puede simplificar el procedimiento al eliminar la necesidad de intubación traqueal y limpiar el espacio de trabajo experimental del exceso de tubo.
- Exponga la tráquea separando suavemente los músculos lisos circundantes por disección romo ( Figura 1E - como se indica por las flechas verdes).
- Sutura de lengua
- Remoje una pieza de 20 cm de largo de sutura 5/0 (sugerimos Silk, trenzado negro) en PBS.
- Mientras mantiene abierta la boca de la rata, sostenga suavemente la punta de la lengua con la pinza de sutura.
- Pase la sutura medialmente a través de la punta de la lengua ( Figura 1I - flecha blanca) prestando atención a mantener la lengua húmeda con solución salina para evitar posibles tejidosdañar.
- Ate un bucle de aproximadamente 4 cm de ancho (el diámetro puede cambiar en función de la distancia entre el animal y el transductor de fuerza).
NOTA: Asegúrese de que la sutura y la lengua estén húmedas para facilitar la inserción y evitar lesiones innecesarias del tejido.
2. Configuración Experimental
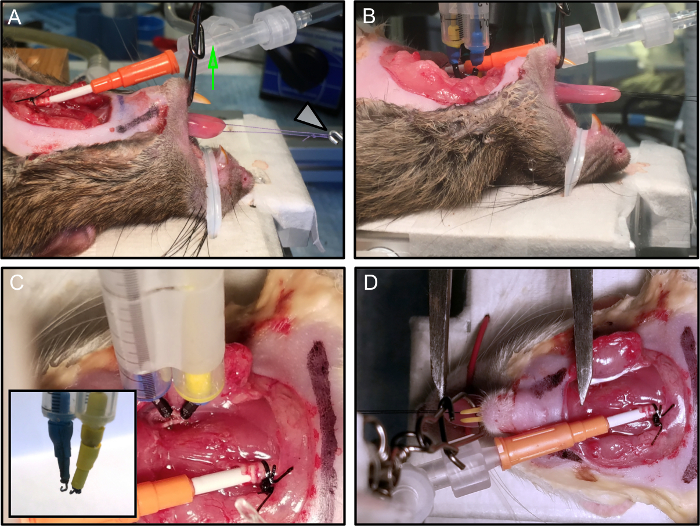
Figura 2: Posicionamiento y sujeción del animal.
(A) El ratón está situado en la plataforma experimental. La mandíbula está asegurada y la boca se mantiene abierta mediante la aplicación de una tensión vertical (flecha verde). El bucle de sutura está conectado al transductor de fuerza (flecha blanca). (B) Los electrodos están conectados. (C) Cada electrodo, montado en un micromanipulador, está conectado de forma estable al nervio. La incrustación muestra la terminación de tEngancha el electrodo. (D) La longitud óptima de la lengua se mide con una pinza de Vernier, desde la inserción a nivel del hueso hioide hasta la punta de la lengua. En esta imagen, los electrodos se retiraron para mayor claridad. Haga clic aquí para ver una versión más grande de esta figura.
Nota: Coloque el animal en decúbito supino sobre la bandeja calentada del aparato, utilizando las siguientes medidas de seguridad para evitar el movimiento durante el experimento.
- Asegure la nariz de la rata a la bandeja con una corbata metálica revestida de plástico conectada directamente a la plataforma calentada ( Figura 2A , 2B ).
- Mantener la boca de la rata abierta mediante la aplicación de tensión vertical (use un giro de 3 vías atado a la línea de monofilamento de prueba de 9 kg y mantenga en su lugar con un palo de la cámara) ( Figura 2A - flecha verde).
NOTA: Un enfoque alternativo para estabilizar la rata es usar una mordaza bucal de roedores o una modificación personalizada de la misma. Es esencial que la boca se mantenga abierta y estable para evitar movimientos del cuello que puedan afectar la calidad de las mediciones. - Conecte el bucle de sutura al transductor de fuerza ( Figura 2A - flecha blanca).
- Usando cinta quirúrgica, inmovilizar las extremidades y el abdomen de la rata para limitar los movimientos durante las estimulaciones.
- Aplicar los dos electrodos bipolares de gancho estimulante a los nervios hipoglosos disecados, proximalmente al sitio de trituración ( Figura 2C ).
- Utilizar electrodos bipolares estimulantes hechos a medida a partir de un par de electrodos de aguja de calibre 29 de acero de calidad quirúrgica, mantenidos juntos a una distancia de 2 mm entre sí usando un soporte de plástico (aquí se usaron dos pipetas serológicas de 1 mL).
- Doble las puntas de los electrodos de aguja en forma de ganchoLo suficientemente pequeño para formar un contacto estable con el nervio (~ 1 mm de diámetro) ( Figura 2C - incrustación).
- Conecte los dos alambres de cada electrodo a un poste de unión doble apilable con toma jack banana x BNC, y luego conecte al módulo estimulador de un Sistema de Prueba Muscular in situ (Tabla 3) usando un divisor BNC.
NOTA: Asegúrese de que el animal esté estable y que el cuello y la lengüeta estén alineados con la palanca del transductor de fuerza. Continúe monitoreando la frecuencia respiratoria y asegúrese de que las restricciones no interfieran con la respiración.
3. Longitud óptima (L 0 ) y determinación de fuerza isométrica máxima
- Ajuste la longitud de la lengua gradualmente y aplique estimulaciones isométricas de la contracción hasta que se obtenga una fuerza máxima.
- Defina L 0 como la longitud a la que la fuerza de contracción isométrica ( Tabla 1 ) es máxima y registre para la posterior normalización deLas mediciones de fuerza, ya que cambia para cada animal. Usando un calibrador Vernier, mida la longitud de la lengua desde la inserción a nivel del hueso hioides ( Figura 2D ) hasta la punta de la lengua.
NOTA: El posicionamiento correcto de los electrodos es esencial para asegurar un contacto óptimo con los nervios. El posicionamiento óptimo debe ejercer fuerzas similares y aditivas al estimular uno de los dos nervios o ambos, respectivamente.
- Defina L 0 como la longitud a la que la fuerza de contracción isométrica ( Tabla 1 ) es máxima y registre para la posterior normalización deLas mediciones de fuerza, ya que cambia para cada animal. Usando un calibrador Vernier, mida la longitud de la lengua desde la inserción a nivel del hueso hioides ( Figura 2D ) hasta la punta de la lengua.
- Antes de iniciar el experimento, conectar ambos electrodos al estimulador y administrar una prueba de estimulación tetánica ( Tabla 1 ). Durante esta contracción, controlar al animal para asegurarse de que la posición es estable, y comprobar las contracciones visibles no deseados de los músculos del cuello.
- Medir la fuerza isométrica mediante la aplicación de un twitch seguido después de 20 s por una estimulación tetánica. Repita los estímulos 3 veces permitiendo 4 minutos de recuperación entre los ciclos de estimulación (un ciclo incluye un twitch y encendidoY la estimulación tetánica), y registrar las máximas contracciones y fuerzas tetánicas.
- Mantener la lengua húmeda en todo momento mediante la aplicación de unas gotas de PBS entre las contracciones.
NOTA: Si los músculos del cuello se contraen, cambie cuidadosamente el posicionamiento de los electrodos para que no toquen ningún tejido muscular circundante y, si es necesario, cauterice el tejido en contacto con los electrodos.
4. Determinación de propiedades viscoelásticas (curvas de Lissajous)
- Deje reposar la lengua durante 3 - 5 min después de la determinación de la fuerza isométrica. Realizar las curvas de Lissajous comenzando en L 0 , por lo tanto la posición del animal y del transductor de la fuerza nunca debe ser cambiada.
- Sin estimular los nervios hipoglosos, aplicar ciclos de estiramientos pasivos ( Tabla 2 ) con desplazamiento creciente (d) es decir 5, 10, 15, 20, 25, 30, 35, 40, 50% de L0 (amplitudes más altas pueden requerir un doble Controlador de modo conR valores de excursión que el 305C-LR). Por ejemplo, una amplitud de 40% de L $ _ { 0 } $ causará la deformación de la lengüeta de + 20% de L $ to $ a -20% de L $. $.
- Utilice una frecuencia senoidal fija de 2 Hz con 10 repeticiones en cada ciclo, para una duración total de 5 s cada ciclo. Los cambios de la frecuencia sinusoidal se han utilizado en el pasado con tejidos como el diafragma 24 y podrían adoptarse para modificar el protocolo experimental.
- Deje 30 s entre cada ciclo y asegúrese de que la lengua esté húmeda durante todo el procedimiento.
NOTA: Mantenga la lengua húmeda durante el procedimiento añadiendo unas gotas de PBS. Asegúrese de que la sujeción que sostiene la mandíbula permanece estable en su lugar durante los estiramientos, particularmente cuando el desplazamiento alcanza el 40% o más.
- Inmediatamente después de la finalización del experimento, mientras el animal está todavía bajo un plano quirúrgico profundo de anestesia, eutanasia el animal de acuerdo con el animal aprobado IACUC protOcol. Disecar la lengua para su posterior procesamiento ( es decir, secado congelado o almacenamiento para análisis bioquímicos).
Resultados
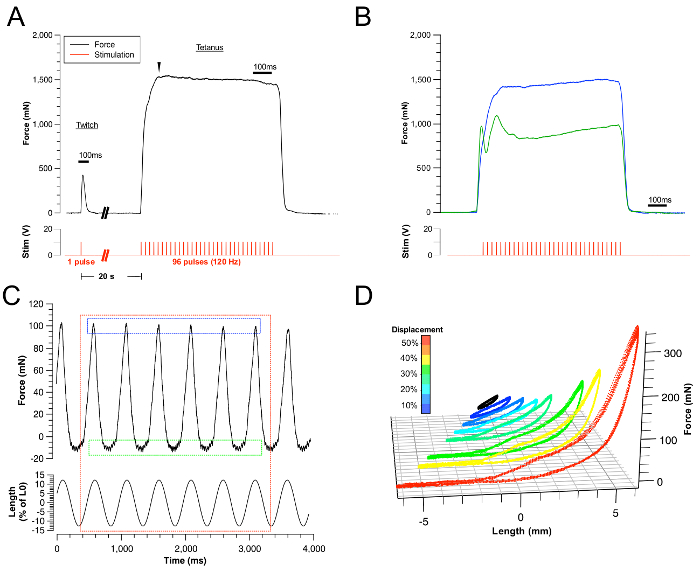
Figura 3: Resultados representativos.
(A) Ejemplos de trazas exitosas de fuerza de contracción y tetánica. La estimulación correspondiente está representada por el trazo rojo. (B) Ejemplo de contracciones tetánicas de la lengua fallidas debido a la contracción submáxima (traza azul) y estimulación indirecta de los músculos del cuello. ...
Discusión
Se prevé que los cambios en el metabolismo y / o la composición de la lengua, por ejemplo , la infiltración de la grasa de la lengua como consecuencia de la obesidad, causen cambios cuantificables de los parámetros evaluados por nuestro protocolo. La cuantificación de la fuerza de la lengua es de gran interés ya que un desequilibrio entre la actividad protrusiva y retrusiva o el debilitamiento general de la lengua puede resultar en la oclusión de la vía aérea superior 15 . Las t...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue apoyada por dos Institutos Nacionales de Subsidios de Salud: HL089447 ("Obesidad y OSA: Comprender la Importancia de la Grasa de Lengua y la Función Metabólica") y HL094307 ("Comprender la Relación entre la Obesidad y la Grasa de la Lengua")
Materiales
| Name | Company | Catalog Number | Comments |
| SurgiSuite (heated Surgical tray) | Kent Scientific | SurgiSuite-LG | Includes heated platform |
| LED Lighting and Magnification Kit | Kent Scientific | SURGI- 5003 | |
| RC2 Rodent Circuit Controller | VetEquip | 922100 | |
| Isoflurane | Butler Schein Animal Health Supply | 29405 | |
| Alcohol Prep | Webcol | 6818 | |
| Cotton-tipped applicators | MediChoice | WOD1002 | |
| Hair clipper | Conair | ||
| Hair remover lotion | Nair | ||
| Medical tape | Transpore | 3M | |
| D-PBS | Corning | 21-030-CM | |
| Operating Scissors | World Precision Instruments | 503717-12 | |
| Hemostatic Forceps | Merit | 97-458 | Any tissue forceps can be used instead |
| Microdissecting Forceps, Angled, Serrated, 10.2 cm, SS | World Precision Instruments | 504479 | |
| Suture Tying Forceps | Fine Science Tools | 18025-10 | |
| Blunt Micro Hook | Fine Science Tools | 10062-12 | |
| Microhemostat | Fine Science Tools | 12075-14 | |
| Thermal cautery | WPI | 501292 | Disposable cauteries are available at lower cost |
| IV 14g x 3.25" cannula | BD | B-D382268H | For tracheal cannulation |
| Braided silk non-absorbable suture size 4-0 | Harvard Apparatus | SP104 | For stabilization of the tracheal cannula |
| Braided non-absorbable silk 5/0 suture | Surgik LC, USA | ESILRC15387550 | For suturing the tongue |
| Plastic-coated metal twist-tie (or electrical wire) | For securing the rat's nose to the platform | ||
| Camera stick | |||
| 3 way-swivel and Trilene 9 Kg test monofilament line | Berkley | For securing the jaw and maintaining the mouth open | |
| Camera stick with adjustable angle | For supporting the 3 way-swivel and maintaining the mouth open. | ||
| in situ Muscle Test System | Aurora Scientific | 809C | This system is designed for mice and was modified by extending the platform. Alternatively the rat-specific 806D system can be used. |
| Dual-Mode Muscle lever (force transducer) | Aurora Scientific | 305C-LR | 309C offers higher excursion capabilities than 305C-LR. Link for more information and specifications: http://aurorascientific.com/products/muscle-physiology/dual-mode-muscle-levers/ |
| Needle Electrodes (surgical steel, 29 gauge) | AD Instruments | MLA1204 | 300C is recommended for use in mice. |
| Magnetic Stands | World Precision Instruments | M10 | Used for making the bipolar stimulating hook electrodes |
| Kite Manual Micromanipulator | World Precision Instruments | KITE-R and KITE-L | Require a steel plate |
| Stackable Double Binding Post with Banana Jack x BNC Jack | McMaster Carr | 6704K13 | |
| Carbon fiber composites digital caliper | VWR | 36934-152 |
Referencias
- Sanders, I., Mu, L. A three-dimensional atlas of human tongue muscles. Anat Rec (Hoboken). 296 (7), 1102-1114 (2013).
- Ciucci, M. R., et al. Tongue force and timing deficits in a rat model of Parkinson disease. Behav Brain Res. 222 (2), 315-320 (2011).
- Easterling, C., Antinoja, J., Cashin, S., Barkhaus, P. E. Changes in tongue pressure, pulmonary function, and salivary flow in patients with amyotrophic lateral sclerosis. Dysphagia. 28 (2), 217-225 (2013).
- Wang, Z. J., Huang, X. S. Images in clinical medicine. Myotonia of the tongue. N Engl J Med. 365 (15), e32 (2011).
- Ota, F., Connor, N. P., Konopacki, R. Alterations in contractile properties of tongue muscles in old rats. Ann Otol Rhinol Laryngol. 114 (10), 799-803 (2005).
- Schwarz, E. C., Thompson, J. M., Connor, N. P., Behan, M. The Effects of Aging on Hypoglossal Motoneurons in Rats. Dysphagia. 24 (1), 40 (2008).
- Pae, E. -. K., Wu, J., Nguyen, D., Monti, R., Harper, R. M. Geniohyoid muscle properties and myosin heavy chain composition are altered after short-term intermittent hypoxic exposure. J Appl Physiol. 98 (3), 889-894 (2005).
- Fuller, D. D., Fregosi, R. F. Fatiguing contractions of tongue protrudor and retractor muscles: influence of systemic hypoxia. J Appl Physiol. 88 (6), 2123-2130 (2000).
- Ray, A. D., Farkas, G. A., Pendergast, D. R. In-situ mechanical characteristics of the tongue are not altered in the obese Zucker rat. Sleep. 32 (7), 957 (2009).
- Brennick, M. J., et al. Tongue fat infiltration in obese versus lean Zucker rats. Sleep. 37 (6), 1095-1102 (2014).
- Stedman, H. H., Sweeney, H. L., Shrager, J. B., Maguire, H. C., Panettieri, R. A., Petrof, B., Narusawa, M., Leferovich, J. M., Sladky, J. T., Kelly, A. M. The mdx mouse diaphragm reproduces the degenerative changes of Duchenne muscular dystrophy. Nature. 352 (6335), 536-539 (1991).
- Goodpaster, B. H., Wolf, D. Skeletal muscle lipid accumulation in obesity, insulin resistance, and type 2 diabetes. Pediatr Diabetes. 5 (4), 219-226 (2004).
- Loro, E., et al. IL-15Rα is a determinant of muscle fuel utilization, and its loss protects against obesity. Am J Physiol Regul Integr Comp Physiol. 309 (8), R835-R844 (2015).
- Rahemi, H., Nigam, N., Wakeling, J. M. The effect of intramuscular fat on skeletal muscle mechanics: implications for the elderly and obese. J R Soc Interface. 12 (109), 20150365 (2015).
- Kim, A. M., et al. Tongue fat and its relationship to obstructive sleep apnea. Sleep. 37 (10), 1639-1648 (2014).
- Kim, A. M., et al. Metabolic activity of the tongue in obstructive sleep apnea. A novel application of FDG positron emission tomography imaging. Am J Respir Crit Care Med. 189 (11), 1416-1425 (2014).
- Gilliam, E. E., Goldberg, S. J. Contractile properties of the tongue muscles: effects of hypoglossal nerve and extracellular motoneuron stimulation in rat. J Neurophysiol. 74 (2), 547-555 (1995).
- Sokoloff, A. J. Localization and contractile properties of intrinsic longitudinal motor units of the rat tongue. J Neurophysiol. 84 (2), 827-835 (2000).
- Becker, B. J., Russell, J. A., Connor, N. P. Effects of aging on evoked retrusive tongue actions. Arch Oral Biol. 60 (6), 966-971 (2015).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle Nerve. 47 (2), 230-240 (2013).
- Seo, J., et al. Nerve cuff electrode using embedded magnets and its application to hypoglossal nerve stimulation. J Neural Eng. 13 (6), 066014 (2016).
- Friedman, M., et al. Targeted hypoglossal nerve stimulation for the treatment of obstructive sleep apnea: Six-month results. Laryngoscope. 126 (11), 2618-2623 (2016).
- Heiser, C., Maurer, J. T., Steffen, A. Functional outcome of tongue motions with selective hypoglossal nerve stimulation in patients with obstructive sleep apnea. Sleep Breath. 20 (2), 553-560 (2016).
- Syme, D. A. Passive viscoelastic work of isolated rat, Rattus norvegicus, diaphragm muscle. J Physiol. 424, 301-315 (1990).
- Connor, N. P., et al. Effect of tongue exercise on protrusive force and muscle fiber area in aging rats. J Speech Lang Hear Res. 52 (3), 732-744 (2009).
- Schaser, A. J., Stang, K., Connor, N. P., Behan, M. The effect of age and tongue exercise on BDNF and TrkB in the hypoglossal nucleus of rats. Behav Brain Res. 226 (1), 235-241 (2012).
- Puhan, M. A., et al. Didgeridoo playing as alternative treatment for obstructive sleep apnea syndrome: randomised controlled trial. BMJ. 332 (7536), 266-270 (2006).
- Guimarães, K. C., Drager, L. F., Genta, P. R., Marcondes, B. F., Lorenzi-Filho, G. Effects of oropharyngeal exercises on patients with moderate obstructive sleep apnea syndrome. Am J Respir Crit Care Med. 179 (10), 962-966 (2009).
- Ueda, H., Almeida, F. R., Chen, H., Lowe, A. A. Effect of 2 jaw exercises on occlusal function in patients with obstructive sleep apnea during oral appliance therapy: a randomized controlled trial. Am J Orthod Dentofacial Orthop. 135 (4), 430 (2009).
- Strollo, P. J., et al. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med. 370 (2), 139-149 (2014).
- Perrier, P., Payan, Y., Zandipour, M., Perkell, J. Influences of tongue biomechanics on speech movements during the production of velar stop consonants: A modeling study. J Acoust Soc Am. 114 (3), 1582-1599 (2003).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle & nerve. 47 (2), 230-240 (2013).
- Brady, J. P., et al. AlphaB-crystallin in lens development and muscle integrity: a gene knockout approach. Invest Ophthalmol Vis Sci. 42 (12), 2924-2934 (2001).
- Spassov, A., et al. Differential expression of myosin heavy chain isoforms in the masticatory muscles of dystrophin-deficient mice. Eur J Orthod. , ciq113 (2010).
- Lever, T. E., et al. Videofluoroscopic Validation of a Translational Murine Model of Presbyphagia. Dysphagia. 30 (3), 328-342 (2015).
- Gantois, I., et al. Ablation of D1 dopamine receptor-expressing cells generates mice with seizures, dystonia, hyperactivity, and impaired oral behavior. Proc Natl Acad Sci. 104 (10), 4182-4187 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados