Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Usando un Chip de microfluidos adaptado olfativo para la proyección de imagen de la actividad Neuronal en respuesta a las feromonas en las neuronas de cabeza de macho de C. Elegans
En este artículo
Resumen
El uso de un chip olfativo de"adaptado" para la proyección de imagen del calcio eficiente de los machos de C. elegans se describe aquí. También se muestran estudios de exposición masculina a glicerol y una feromona.
Resumen
El uso de indicadores de calcio ha mejorado enormemente nuestra comprensión de la dinámica neuronal y regulación. El nematodo Caenorhabditis elegans, con su sistema nervioso completamente mapeado y anatomía transparente, presenta un modelo ideal para comprender la dinámica neural en tiempo real utilizando indicadores de calcio. En combinación con tecnologías de microfluidos y diseños experimentales, estudios de proyección de imagen de calcio utilizando estos indicadores se realizan en animales de movimiento libre y atrapados. Sin embargo, la mayoría de los estudios anterior utilizando dispositivos de captura, como el chip olfativo descrito en Chronis et al., tiene dispositivos diseñados para el uso en el hermafrodita más comunes, como el hombre menos común es morfológico y estructural disímiles. Un chip adaptado olfativo fue diseñado y fabricado para incrementar la eficiencia en masculino imagen neuronal con el uso de los animales adultos jóvenes. Una vez se incorporó en el gusano que se carga del puerto para rotar los animales y para permitir la separación de las neuronas individuales dentro de un par bilateral en proyección de imagen de 2D. Gusanos son expuestos a un flujo controlado de odorante en el dispositivo de microfluidos, como se ha descrito en estudios previos de hermafrodita. Oscilaciones de calcio se analizan utilizando el software de la abrir-fuente ImageJ. El procedimiento descrito en este documento debe permitir un aumento en la cantidad de hombre basado en C. elegans calcio proyección de imagen estudia, profundizando nuestra comprensión de los mecanismos de señalización neuronal del sexo.
Introducción
Dispositivos microfluídicos proporcionan mayor acceso a precisamente ambientes controlados, en donde animales, tales como el nematodo C. elegans, pueden ser manipuladas experimentalmente1. Estos estudios incluyen ensayos de comportamiento, estudios de imagen del calcio o incluso proyecciones de fenotipos específicos, dando lugar a medidas más exactas de los resultados experimentales1,2,3,4, 5,6. Microfluídica proporciona condiciones líquidas en pequeña escala a través del cual se pueden ejecutar experimentos detallados utilizando cantidades mínimas de reactivos. Hay una producción constante de nuevos diseños de dispositivos microfluídicos y el uso de cada uno varía, de arenas que permiten el movimiento sinusoidal natural de C. elegans en los análisis de comportamiento y estudios de imagen neurales atrapar los dispositivos usados en la proyección de imagen neuronal y olfativas, dispositivos que permiten análisis fenotípico de alto rendimiento en genética pantallas4,5,6,7. Después de la fabricación de un molde maestro, dispositivos microfluídicos son económicos construir — dada la reutilización del maestro y fácil de usar, que permite la generación rápida de datos a través de estudios de alto rendimiento. La fabricación de dispositivos con polímeros como el polidimetilsiloxano (PDMS) permite la creación de nuevos dispositivos dentro de las horas.
Estudios de imagen del calcio utilizan indicadores de calcio genéticamente codificados (GECIs) expresados en las células diana para medir la dinámica neural de las células en tiempo real8,9,10,11. La naturaleza transparente de C. elegans permite la grabación de los fluorescentes niveles de estas proteínas en animales vivos. Tradicionalmente, GECIs dependen de la proteína fluorescente verde (GFP)-basado en sensor GFP-Calmodulin-M13 péptido (GCaMP), aunque estudios más recientes han adaptado estos sensores para permitir mejor cocientes signal-to-noise y perfiles de excitación rojo-cambiado de puesto. Tras el desarrollo de GCaMP3, han variado las proteínas con estas especificaciones, incluyendo sensores como GCaMP6s y GCaMP6f (lento y rápido de la fluorescencia de las tasas, respectivamente), así como de Peptide de la Calmodulin-RFP-M13 (RCaMP), que tiene un rojo-cambiado de puesto Perfil de activación. La combinación de estos GECIs con secuencias de promotor de genes específicos de células de C. elegans puede atacar las células de interés, las neuronas sensoriales particularmente12,13,14,15 , 16.
Mientras que la facilidad de uso de C. elegans en estudios de microfluidos es evidente, casi todos los estudios se han centrado en hermafroditas. A pesar de los varones sólo representan 0.01-0.02% de la población de tipo salvaje, invaluables resultados pueden derivarse de su caracterización. Mientras que el conectoma físico del sistema nervioso hermafrodita se ha trazado completamente para décadas17, el conectoma masculino sigue siendo incompleta, especialmente en la región central de los animales18. El uso de la proyección de imagen de calcio en hombres ayudarán a generar una comprensión del sistema nervioso masculino y las diferencias que surgen entre los dos sexos. El tamaño más pequeño de los machos adultos de C. elegans previene la captura eficaz y fiable en los puertos de carga de dispositivos olfativos tradicionales diseñados para hermafroditas más grandes. Para hacer frente a esto, una versión modificada del Chip olfativa Chronis19 fue desarrollada con un puerto de carga más estrecho, una altura más baja del canal y se convierte en el gusano puerto de cargamento (que rotan el animal), lo que permite la visualización de izquierda bilateral pares de neuronales. Este diseño permite: (1) la captura efectiva de jóvenes machos, (2) una orientación más confiable del animal para la visualización de ambos miembros de neuronas pares bilaterales y (3) la proyección de imagen exacta de la actividad neuronal en las neuronas masculinas.
Cada vez más, los estudios demuestran que los machos de C. elegans responden diferentemente que hermafroditas a una variedad de ascarosides (ascr), o nematodo feromonas20,21,22,23 ,24. Por lo tanto, desarrollar una comprensión de la dinámica neuronal y representaciones dentro el conectoma masculino se ha convertido en aún más pertinente. Macho de C. elegans contiene 87 neuronas específicas por sexo no está presentes en el hermafrodita25,26, alterando el conectoma en como-formas aún por determinar. Pudiendo esta única dinámica neural de la imagen nos permitirá entender mejor las respuestas específicas por sexo y las representaciones neurales.
Este protocolo describe el uso de un chip olfativo hombre adaptado para la proyección de imagen neuronal del hombre C. elegans chemosensation. La neurona nociceptiva que Ash responde confiablemente a glicerol de 1 M en los machos, consistentes con anteriores hermafrodita estudios27. Exposición a ascarosides puede provocar respuestas que son variables de animal a animal, que requieren un mayor número de animales a ensayar. La respuesta de las neuronas del CEM hombre específicos se ha demostrado previamente, a través Electrofisiología y calcio, los estudios por imágenes para responder variable a ascaroside #323.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. fabricación de dispositivo
Nota: ver referencia 1.
Nota: el silicio moldea maestro fueron fabricado usando las técnicas estándar photolithographic para patrones photoresist SU-8 con un silicio principal 1 , 7. Patrones de dibujos de la oblea se imprimieron 25.000 ppp. El hombre adaptado de dispositivo un Chip olfativa Chronis diseño 19 con un cambio en el gusano puerto de cargamento, adaptando un diseño de M. Zimmer (correspondencia personal, 2016). Una vuelta se incluye para controlar la rotación de los animales. La anchura del gusano canal Puerto de carga es reducida a 50 μm. Todos los canales son 32 μm de altura. Una vez que un molde principal del silicio es disponible para el usuario, el usuario puede seguir el posterior protocolo, como se describió anteriormente 1.
- Agente de base y curado de mezcla PDMS en una proporción 10:1 en peso.
- Homogeneizar con pipetas de transferencia.
- Desgasificar la mezcla en un desecador de vacío de 1 h, hasta quitan todas las burbujas visibles.
- Vierta la mezcla en un maestro del molde de silicio en un plato de 150 mm de diámetro hasta 5 mm de espesor (100 g). Utilice una pipeta Pasteur para eliminar burbujas o polvo que se han introducido a la mezcla de.
- Hornear a 65 ° C durante al menos 3 horas o durante la noche.
- Cortar el PDMS del molde con un bisturí y cortan los dispositivos separados utilizando una hoja de afeitar.
- Perforar los orificios de entrada y salida con un sacador cutáneo de 1 mm.
- Limpie los orificios con dH 2 O, etanol y otra vez con dH 2 O para quitar las partículas de los golpes. Secar el dispositivo en un pulso de corriente de aire.
- Limpiar ambos lados de la canal y la parte superior del aparato con cinta adhesiva, quitar cualquier polvo o residuo restante en el dispositivo para permitir la vinculación exitosa.
- Plasma-bond el dispositivo, canal hacia abajo, a un vaso de tapa no. 1.
Vidrio de cubierta
- exponer y dispositivo (canal hacia arriba) al plasma de aire mediante condiciones que permitan la vinculación apropiada, por ejemplo de 100 W durante 30 s o 24 W en 60 s.
Nota: Configuración se puede ajustar para mejorar la eficiencia de la Unión. Las condiciones de vinculación de plasma no son tan críticas como la limpieza apropiada al tratar de mejorar la eficiencia de la Unión. No se adherirá un dispositivo lo suficientemente limpio, incluso en condiciones de plasma ideal. - Invertir el vidrio de cubierta en el lado del canal del dispositivo y presione hacia abajo con el pulgar durante 5 s.
- exponer y dispositivo (canal hacia arriba) al plasma de aire mediante condiciones que permitan la vinculación apropiada, por ejemplo de 100 W durante 30 s o 24 W en 60 s.
2. Preparación de buffer
- diluido 1 x S basales (100 mM NaCl y 0.05 M KPO 4, pH 6.0) de una bolsa estéril de 10 x.
- Diluir 1 M tetramisole stock a una concentración final de 1 mM de 1 x S basales para todos tampón soluciones.
- Añadir fluoresceína a ambos el " control de flujo " y " buffer " embalses.
- Crear un stock de 100 mg/mL de fluoresceína en 1 x S basales.
- Diluir la acción a concentraciones finales de 1 μg/mL en el control de flujo y 0,1 μg/mL en el búfer de.
- Crear los estímulos.
- Glicerol diluido a una concentración final de 1 M en 1 S basales de X.
- Diluido ascaroside #3 (ascr #3) a una concentración final de 1 μm en 1 X S basales.
3. Configuración de dispositivo
Nota: ver 1.

figura 1. Instalación de dispositivos microfluídicos. (A) reservorios y la tubería. Jeringa de 30 mL sin un émbolo sirve como el " embalse. " esto está conectado a una válvula Luer con tres opciones de flujo. Un enchufe está conectado a una jeringa de 3 mL con un émbolo, mientras que el otro está conectado a una aguja (naranja) que se inserta en la tubería que se conecta al dispositivo de microfluidos. (B) el total configuración de los microfluidos experimento de la proyección de imagen. El dispositivo se coloca en un escenario de un microscopio de epifluorescencia invertida, por encima de las lentes del objetivo. El " control de flujo " buffer viaja a través de una válvula de 3 vías que está controlada por una unidad en el estante encima de la configuración. Líneas que contienen tampones se insertan luego en los puertos de dispositivo apropiado. (C) los puertos del dispositivo microfluídico. El " control de flujo " puertos flanquean los otros puertos de entrada: el " estímulo " y " buffer " puertos. El " toma " puerto es el puerto de la derecha. Debido a la ubicación de la arena de carga del gusano, el " gusano de carga " puerto es el puerto más central en el dispositivo. haga clic aquí para ver una versión más grande de esta figura.
- Prepare tres embalses líquidos conectando una jeringa de 30 o 60 mL para válvula de 3 vías Luer, con una jeringa de 3 mL y aguja conectada a la válvula Luer así (como en la figura 1A). Conectar la aguja al tubo que se extiende hasta el dispositivo de microfluidos (como en la figura 1A -B).
- Sacar las burbujas de aire del depósito y tubería.
- Llene la jeringa de 3 mL con tubo conectado con 1 x S basales e insertarla en la salida de Puerto
- Suavemente aplique presión en la jeringa hasta que el buffer aparece en la parte superior de los orificios de entrada.
- Conectar el control de flujo, buffer y tubería de estímulo a los orificios de entrada apropiado (como en la figura 1B -C), asegurando que las gotas de líquido están presentes en el puerto de carga orificio y el tubo de búfer que se unirá.
- Otra vez, suavemente aplique presión sobre la jeringa que está conectada al puerto de salida hasta que aparezcan gotitas en el gusano carga entrada puerto.
- Inserte un perno de bloqueo sólido en el gusano que se carga del puerto
- Retire el orificio de salida de la jeringa y conectar la línea de salida conectada a la aspiradora de casa (-670 Torres).
- Inspeccione el dispositivo para las burbujas en el flujo de los canales, visualmente y mediante video confirmación a través de un software compatible con la cámara utilizada, como el software de la abrir-fuente Micro-Manger. Vea el paso 6 para consejos sobre el uso de Micro-Director.
- Si hay burbujas, esperar a que desaloje o sean absorbidas por el PDMS de pared antes de introducir cualquier animal, la presencia de burbujas alterará el flujo adecuado de líquidos a través del dispositivo.
- Usando un filtro GFP, confirmar la dinámica de flujo apropiado dentro del dispositivo antes de gusano carga accionando la válvula de 3 vías y observando el cambio de amortiguadores.
- Determine la dinámica de flujo adecuado: observar la fluoresceína presente en las soluciones tampón y control de flujo ( Figura 2D -2E) cuando se cambia el valor de control de flujo pulsando el control botón correspondiente a la válvula de 3 vías en el enlace de la válvula ( figura 1B).
- Después de abrir el Micro-Manager, haga clic en " Live " para observar una imagen en vivo del dispositivo. Encienda la fuente de luz fluorescente para observar el flujo de búferes en el dispositivo ( Figura 2D -2E).
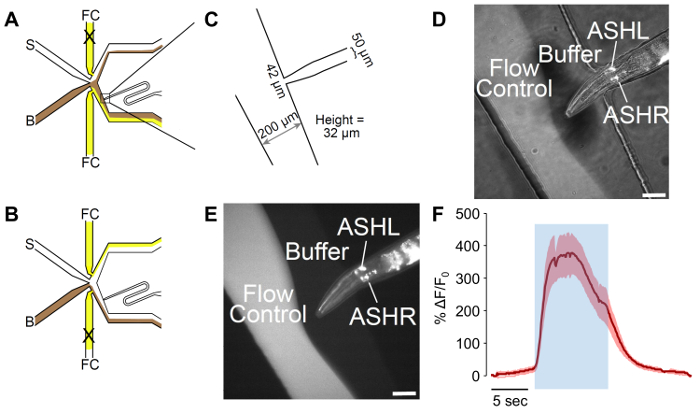
Figura 2: Un chip olfativa microfluídicos adaptados al hombre. (A) el flujo de los patrones del dispositivo cuando el gusano se expone al buffer. Tampón (B) se muestra en color marrón, y control de flujo (FC) se muestra en amarillo, con el estímulo (S) en blanco. El gusano puerto de cargamento ha sido adaptado para incluir una curva, que permite mejor control de la orientación de gusano. (B) el flujo de los patrones del dispositivo cuando el gusano está expuesto a los estímulos. Tampón (B) se muestra en color marrón, y control de flujo (FC) se muestra en amarillo, con el estímulo (S) en blanco. (C) mediciones del dispositivo adaptada como fabricados. El gusano puerto de carga termina en una 42 μm de apertura, con un canal de μm 50 diseñado para el hombre ancho. La altura de los canales es 32 μm, a pesar de un objetivo de 25 μm en el diseño. (D-E) A atrapado hombre expresando p sra-6:: GCaMP3. El promotor de la sra-6 no es específica de la ceniza, y alguna expresión puede observarse en la neurona ASI, aunque no hay oscilaciones de calcio fueron observados en ASI. La imagen es (D) una combinación de la iluminación de campo claro y fluorescente, mientras que (E) sólo es fluorescente. Las barras de escala denotan 42 μm. (F) ceniza la neurona responde a la estimulación de glicerol de 1 M con fuerte actividad de los nervios. El área azul indica el tiempo del estímulo de 1 M glicerol. La región sombreada denota el error estándar, n = 20 pulsos de siete gusanos. Los rastros rojos denotan las respuestas despolarizantes. Los ejes muestran ΔF/F 0. La barra de escala indica 5 s. haga clic aquí para ver una versión más grande de esta figura.
4. preparación de animal
Nota: ver referencia 23.
- Las respuestas de la ceniza de la proyección de imagen a glicerol de 1 M.
- Lugar aproximadamente 20 C. elegans machos que son positivos para p sra-6:: expresión de matriz GCaMP3 sobre una placa de agar de nematodos crecimiento medio (NGM) sembrado con césped de OP50 e. coli. Utilice un marcador de la inyección o las expresiones del GECI fluorescente para la identificación de animales positivos matriz.
Nota: Animales positivos matriz se fluorescencia según el GECI utilizado (es decir, animales expresando GCaMP se fluorescencia verde bajo el estímulo de la luz azul, mientras que RCaMP animales fluorescencia roja bajo el estímulo de luz verde). Marcadores de coinyección pueden extenderse de otras proteínas fluorescentes GFP y RFP, a marcadores fenotípicos, como rol-6, o rescatar un fenotipo dominante, tales como la mutación de pha-1 28.- Si recogiendo inmediatamente antes del ensayo, selección de machos jóvenes. Si escoger el día antes del ensayo, selección varones larvas L4.
- Lugar aproximadamente 20 C. elegans machos que son positivos para p sra-6:: expresión de matriz GCaMP3 sobre una placa de agar de nematodos crecimiento medio (NGM) sembrado con césped de OP50 e. coli. Utilice un marcador de la inyección o las expresiones del GECI fluorescente para la identificación de animales positivos matriz.
- Las respuestas de la CEM a 1 μm ascr #3 la proyección de imagen.
- Pick L4 C. elegans aproximadamente 20 machos (fkEx98 [p pkd-2::GCaMP::SL2::dsRED + pBX-1]; PHA-1 (e2123ts); lo-5 (e1490); Lite-1 (ce314)) que son positivos para la expresión de marcadores de coinyección dsRed.
Nota: dsRed expresión dentro de las neuronas de ray de la historia hombre es más fácil de observar y confirmar que la expresión de GCaMP dentro de las cuatro neuronas CEM. - Aislar estos hombres hermafroditas en una placa de agar NGM sembrado con césped de OP50 e. coli para 5-14 h antes de realizar el experimento de la proyección de imagen.
Nota: Los machos no aislados de un mínimo de 5 h no responden conductualmente a ascr #3 y por lo tanto pueden presentar incluso menos oscilaciones de calcio a la ascaroside que observa aquí.
- Pick L4 C. elegans aproximadamente 20 machos (fkEx98 [p pkd-2::GCaMP::SL2::dsRED + pBX-1]; PHA-1 (e2123ts); lo-5 (e1490); Lite-1 (ce314)) que son positivos para la expresión de marcadores de coinyección dsRed.
5. Carga animal
Nota: ver refefence 1.
- Elegir un gusano sobre una placa de agar NGM no sembrada utilizando técnicas de mantenimiento estándar gusano.
- Pick gusanos por llameante pico (hecho de alambre de platino aplanado), recogiendo las bacterias a la selección, y " untar " un gusano para recogerlo. Coloque con cuidado el gusano sobre la placa de nuevo, lo que le permite arrastrarse apagado en su propia.
- Añadir aproximadamente 5 mL de 1 x S basales a la placa no sembrada, tal que la placa se inunda.
- Dibujar el gusano dentro de una jeringa de carga (es decir, jeringa de 3 mL con tubería adjunta) que ha sido previamente llenada con 1 x S basales.
- No deje de chupar el gusano solamente en el tubo, no en la jeringa de.
Nota: Si el gusano viaja en la jeringa, es casi imposible conseguir nuevamente dentro del tubo.
- No deje de chupar el gusano solamente en el tubo, no en la jeringa de.
- Apagar el vacío para detener el flujo girando la válvula Luer de salida.
- Quitar el pasador sólido bloqueo el gusano carga puerto
- Gire la válvula Luer conectada al puerto de salida ( figura 1B), por lo que está ventilando.
Nota: Utilice un video en vivo mientras se carga el gusano para confirmar la ubicación y orientación de los animales (pasos 5.8-5.13). - Introducir el gusano de tubo en el gusano que se carga del puerto de carga
- Suavemente aplique presión en la jeringa hasta que el gusano aparece en el canal de carga.
- Si el gusano comienza a entrar en el canal primero la cola, tirando el émbolo de la jeringa para evitar que el gusano en el canal.
- Interruptor entre aplicación y revertir la presión hasta que la cabeza entra en el canal primero.
- Abierto el vacío girando la válvula de 3 vías Luer conectado al puerto de salida para abrirlo al vacío en lugar de ambiente.
- Presionar manualmente presionando el émbolo de la jeringa para orientar y colocar la cabeza del gusano que se expone al canal de flujo tampón, pero no hasta ahora que la cabeza puede moverse libremente ( figura 2 D-2E).
6. Estímulo y la adquisición de
- utilizando un software de código abierto microscopia, como Micro-Manager, grabar mediante la captura de imágenes como una pila TIFF a 10 fotogramas/s utilizando excitación de luz azul (470 nm) para 30 s.
- Ajustar la exposición en el menú principal a 100 ms.
- Open " Acq multi-D. " desde el menú principal del software. Establecer la " número de " a " 300, " y el " intervalo " a " 0. " haga clic en " adquirir! " para adquirir el video.
- Aplicar un pulso de s 10 del estímulo 5 s después de iniciar la adquisición. Ajustar la duración de la aplicación del estímulo como se desee.
- Después de la adquisición de 5 s de video, cambiar la válvula de 3 vías controla el buffer de control de flujo para aplicar el estímulo en el animal sometido a prueba. Haga clic en el botón izquierdo en el enlace de la válvula ( figura 1B).
- Después de 10 s de exposición del estímulo (este tiempo puede ser ajustado como deseada por el usuario), alteran el flujo de reservas pulsando nuevamente el botón izquierdo en el enlace de la válvula.
- Registros en búfer sólo hasta la ventana del 30-s para permitir que la fluorescencia de GECI volver a base.
- Repetir según lo deseado. Esperar 30 s entre el final de la adquisición y la iniciación de la prueba siguiente.
7. Análisis de imágenes
- abrir la pila TIFF con el software de la abrir-fuente, ImageJ, arrastrando el archivo en la ventana de ImageJ.
- Con el cursor, haga clic en y arrastre para definir la región de interés (ROI) alrededor de la neurona de interés. La región con el soma de la neurona de interés (como en la Figura 3A).
- Trama de la z-pila de la intensidad de la fluorescencia del ROI a través de pilas haciendo clic en abrir-> imagen - > pilas - > parcela z perfil.
- Haga clic en " lista de " en la ventana que se abre. Haga clic en Editar - > Copy para copiar los valores. Pegar los valores en un programa de hoja de cálculo.
- Analizar la fluorescencia de fondo para cada pulso arrastrando el ROI a una región del gusano que no contiene la expresión de GCaMP.
- Realizar a fondo cada impulso restando el valor de fluorescencia de fondo del valor de intensidad de fluorescencia de neuronas.
- Calcular ΔF/F 0 para cada fotograma de cada pulso.
- Calcular F 0 como el valor de la intensidad media del ROI para el primer 1 s de la adquisición (por ejemplo, Marcos 1-10).
- Calcular ΔF/F 0 dividiendo el valor de fondo resta para el marco de interés por el valor calculado de 0 F.
- Repita para cada neurona reflejada y cada pulso estímulo.
- Para las neuronas con perfiles de respuesta coherentes, tales como ceniza, promedio de los pulsos para cada neurona y calcular el SEM (como en la figura 2F).
- Parcela promedio de ΔF/F 0 con SEM en el tiempo para cada neurona.
Nota: En este caso, es práctica común incluir heatmaps de las respuestas neuronales individuales de cada ensayo así. En las neuronas que no exhiben cambios consistentes en oscilaciones de calcio sobre la exposición a estímulos a través de estímulos repetidos, o en distintos individuos 23, pueden ser más aplicable a pulso individual rastros (como en figura 4). Ver la discusión para más detalles sobre la determinación de cómo mostrar los datos.
Access restricted. Please log in or start a trial to view this content.
Resultados
Un ejemplo de la configuración de dispositivo general puede verse en la figura 1A-B. Figura 1A representa la construcción del reservorio apropiado y configuración. Figura 1B muestra las conexiones de los embalses al dispositivo de microfluidos. Figura 1 muestra un dispositivo de microfluidos con puertos individuales para claridad.
Access restricted. Please log in or start a trial to view this content.
Discusión
El chip olfativo hombre adaptado incorpora una vuelta en un puerto de carga más estrecho, que permite más control de la orientación y para la eficiente captura de machos de C. elegans. Esto permite la visualización de los miembros derecho e izquierdos de pares bilaterales neuronales, sin necesidad de amontonamiento de z. Esta curva permite una orientación de vertical 100% del tiempo en gusanos donde solamente un par bilateral está dirigido con un marcador fluorescente, como ceniza (Fig...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a Manuel Zimmer por facilitarnos el archivo de diseño inicial que fue adaptado para el uso con los varones; Frank Schroeder para la síntesis y de ascr #3; Ross Lagoy para el insight y la asistencia con la proyección de imagen y análisis; y Laura Aurilio para la fabricación principal y que, junto a Christopher Chute, contribuyó a la revisión de este manuscrito. Fondos para este trabajo se prestó bajo la subvención de institutos nacionales de salud 1R01DC016058-01 (J.S.), la concesión del National Science Foundation CBET 1605679 (D.R.A.) y la Burroughs Wellcome carrera premio en interfaz científica (D.R.A.).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Silicon Wafer | University Wafer | 452 | |
| SU-8 2035 | MicroChem | Y111070-0500L1GL | |
| Developer | MicroChem | Y020100-4000L1PE | |
| Wafer Mask | Cad/Art Services | - | Custom order. Printed at 25,000 dpi. |
| Sylgard-184 | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| 1.0 mm Dermal Punches | Acuderm Inc. | P150 | |
| Soft Tubing | Cole-Palmer | EW-06419-01 | |
| Hard Tubing | IDEX Health & Science | 1622 | |
| Pins | New England Small Tube | NE-1027-12 | |
| Blocking Pins | New England Small Tube | 0.415/0.425" OD x .500 Long | Batch PB07027 |
| 3 mL syringes | BD | 309657 | |
| 30 mL syringes | Vitality Medical | 302832 | Used as buffer reservoirs. |
| Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer | Component Supply Company | NE-231PL-50 | |
| Stopcocks with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile | Cole-Palmer | EW-30600-07 | |
| Fisherfinest Premium Cover Glass | Fisher Scientific | 12-548-5M | |
| Mercator Control System LF-5 Plasma System | Mercator | LF-5 | |
| Scotch Tape | Scotch | BSN43575 | |
| Series 20 Chamber | Warner Instruments | P-2 | |
| Vacuum Desicator | Bel-Art Scienceware | 420250000 | 24 cm inner diameter. |
| Weigh Boats | Cole-Palmer | EW-01017-27 | |
| Classic Plus Balance | Mettler Toledo | PB1501-S/FACT | |
| Glass Pasteur Pipettes | Cole-Palmer | EW-25554-06 | |
| Transfer pipettes | Genesee Scientific | 30-202 | |
| Oven | Sheldon Manufacturing Inc | 9120993 | Model Number: 1500E. |
| 60 mm, non-vented, sharp edge Petri dishes | TriTech Research | T3308 | |
| Zeiss Axio Observer.A1 | Zeiss | - | |
| Hammamatsu Orca Flash 4.0 Digital CMOS | Hammamatsu | C11440-22CU | |
| Blue Fluorescent Light | Lumencor | SOLA SM6-LCR-SA | 24-30V/7.9A DC. |
| Illumination Adaptor | Zeiss | 423302-0000 | |
| Series 1 and 2 Miniature Inert PTFE Isolation Valve | Parker | 001-0017-900 | 3-way valve for controlling flow. |
| ValveLink8.2® | AutoMate Scientific | 01-18 | Flow Switch Controller |
| Micro Manager | Micro-Manager | - | Free software, can be downloaded at: https://www.micro-manager.org/wiki/Download_Micro-Manager_Latest_Release |
| ImageJ | ImageJ | - | Free software, can be downloaded at: https://imagej.nih.gov/ij/download.html |
| Agar, Bacteriological Grade | Apex | 9012-36-6 | |
| Peptone | Apex | 20-260 | |
| CaCl2 | VWR | BDH0224-1KG | |
| MgSO4 | Sigma-Aldrich | 230391-1kg | |
| Cholesterol | Alfa Aesar | A11470 | |
| Ethanol | Sigma-Aldrich | 270741-4L | |
| Tetramisole | Sigma-Aldrich | L9756-10(G) | Store at 4 °C. |
| Fluorescein | Sigma-Aldrich | FD2000S-250mg | Light Sensitive. Store in photoprotective vials. |
| Glycerol | Sigma-Aldrich | G6279-1L | |
| Ascaroside #3 | - | - | Synthesized in the Schroeder Lab (Cornell University). |
| NaCl | Genesee Scientific | 18-215 | |
| KH2PO4 | BDH | BDH9268.25 | |
| K2HPO4 | J.T. Baker | 3252-025 | |
| ASH GCaMP3 line | - | - | CX10979 (KyEx2865 [psra-6::GCAMP3 @ 100 ng/uL]). Developed in Bargmann lab. Provided from Albrecht Lab library. |
| CEM GCaMP6 line | - | - | JSR49 (FkEx98[ppkd-2::GCaMP::SL2::dsRED + pBX-1]; pha-1(e2123ts); him-5(e1490); lite-1(ce314)). Developed by Robyn Lints. Provided from Srinivasan Lab library. |
| E. coli (OP50) | Caenorhabditis Genetics Center | OP50 | |
| "Reservoir" | - | - | To create a Reservoir: A "30 mL syringe", is connected to a "Stopcock with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile", which is connected to a "3 mL syringe" and a "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer". The "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer" is then inserted into "Soft Tubing" approximately 1/3 of the way down the needle. |
Referencias
- Lagoy, R. C., Albrecht, D. R. Microfluidic Devices for Behavioral Analysis, Microscopy, and Neuronal Imaging in Caenorhabditis elegans. Methods Mol Biol. 1327, 159-179 (2015).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Curr Opin Neurobiol. 19 (5), 561-567 (2009).
- Chronis, N. Worm chips: Microtools for C. elegans biology. Lab on a Chip. 10 (4), 432-437 (2010).
- Lee, H., Crane, M. M., Zhang, Y., Lu, H. Quantitative screening of genes regulating tryptophan hydroxylase transcription in Caenorhabditis elegans using microfluidics and an adaptive algorithm. Integr Biol (Camb). 5 (2), 372-380 (2013).
- Lockery, S. R., et al. A microfluidic device for whole-animal drug screening using electrophysiological measures in the nematode C. elegans. Lab Chip. 12 (12), 2211-2220 (2012).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nat Commun. 7, 13023(2016).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 110 (45), E4266-E4273 (2013).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Front Mol Neuro. 6, 2(2013).
- Badura, A., Sun, X. R., Giovannucci, A., Lynch, L. A., Wang, S. S. H. Fast calcium sensor proteins for monitoring neural activity. Neurophotonics. 1 (2), 025008(2014).
- Tatro, E. T. Brain-wide imaging of neurons in action. Front Neural Circuits. 8, 31(2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat Methods. 6 (12), 875-881 (2009).
- Greene, J. S., et al. Balancing selection shapes density-dependent foraging behaviour. Nature. 539 (7628), 254-258 (2016).
- Greene, J. S., Dobosiewicz, M., Butcher, R. A., McGrath, P. T., Bargmann, C. I. Regulatory changes in two chemoreceptor genes contribute to a Caenorhabditis elegans QTL for foraging behavior. Elife. 5, (2016).
- Kim, K., et al. Two Chemoreceptors Mediate Developmental Effects of Dauer Pheromone in C. elegans. Science. 326 (5955), 994-998 (2009).
- McGrath, P. T., et al. Parallel evolution of domesticated Caenorhabditis species targets pheromone receptor genes. Nature. 477 (7364), 321-325 (2011).
- Schmitt, C., Schultheis, C., Husson, S. J., Liewald, J. F., Gottschalk, A. Specific Expression of Channelrhodopsin-2 in Single Neurons of Caenorhabditis elegans. PLoS ONE. 7 (8), e43164(2012).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Nervous System of the Nematode Caenorhabditis elegans. Phil Trans of the Royal Soc of Lon. 314 (1165), 1(1986).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat Meth. 4 (9), 727-731 (2007).
- Chute, C. D., Srinivasan, J. Chemical mating cues in C. elegans. Semin Cell Dev Biol. 33, 18-24 (2014).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook. , 1-22 (2013).
- Narayan, A., et al. Contrasting responses within a single neuron class enable sex-specific attraction in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 113 (10), E1392-E1401 (2016).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Sammut, M., et al. Glia-derived neurons are required for sex-specific learning in C. elegans. Nature. 526 (7573), 385-390 (2015).
- Sulston, J. E., Albertson, D. G., Thomson, J. N. The Caenorhabditis elegans male: postembryonic development of nongonadal structures. Dev Biol. 78 (2), 542-576 (1980).
- Hilliard, M. A., et al. In vivo imaging of C. elegans ASH neurons: cellular response and adaptation to chemical repellents. The EMBO Journal. 24 (1), 63-72 (2005).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Cáceres, I. dC., Valmas, N., Hilliard, M. A., Lu, H. Laterally Orienting C. elegans Using Geometry at Microscale for High-Throughput Visual Screens in Neurodegeneration and Neuronal Development Studies. PLoS ONE. 7 (4), e35037(2012).
- Schrodel, T., Prevedel, R., Aumayr, K., Zimmer, M., Vaziri, A. Brain-wide 3D imaging of neuronal activity in Caenorhabditis elegans with sculpted light. Nat Methods. 10 (10), 1013-1020 (2013).
- García, L. R., Portman, D. S. Neural circuits for sexually dimorphic and sexually divergent behaviors in Caenorhabditis elegans. Curr Opin Neurobiol. 38, 46-52 (2016).
- Clokey, G. V., Jacobson, L. A. The autofluorescent "lipofuscin granules" in the intestinal cells of Caenorhabditis elegans are secondary lysosomes. Mech Ageing Dev. 35 (1), 79-94 (1986).
- Coburn, C., et al. Anthranilate Fluorescence Marks a Calcium-Propagated Necrotic Wave That Promotes Organismal Death in C. elegans. PLoS Biology. 11 (7), e1001613(2013).
- Macosko, E. Z., et al. A hub-and-spoke circuit drives pheromone attraction and social behaviour in C. elegans. Nature. 458 (7242), 1171-1175 (2009).
- Park, D., et al. Interaction of structure-specific and promiscuous G-protein-coupled receptors mediates small-molecule signaling in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 109 (25), 9917-9922 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados