Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Extracción de muestras y cuantificación cromatográfica simultánea de doxorrubicina y mitomicina C siguiendo la combinación del fármaco en nanopartículas en ratones con tumores
En este artículo
Resumen
Este protocolo describe un proceso analítico eficaz y práctico de la extracción de muestra y determinación simultánea de múltiples fármacos, doxorrubicina (DOX), mitomycin C (MMC) y un metabolito DOX cardio tóxico, doxorubicinol (DOXol), en lo biológico muestras de un modelo de tumor de mama preclínicos tratadas con nanopartículas formulaciones de combinación de fármacos sinérgicos.
Resumen
Quimioterapia de combinación se utiliza con frecuencia en la clínica para el tratamiento del cáncer; sin embargo, los efectos adversos asociados al tejido normal pueden limitar su beneficio terapéutico. Combinación de fármacos basados en nanopartículas se ha demostrado para mitigar los problemas planteados por la terapia de la combinación libre de drogas. Nuestros estudios previos han demostrado que la combinación de dos fármacos contra el cáncer, doxorrubicina (DOX) y mitomicina C (MMC), produce un efecto sinérgico contra ambos murino y células de cáncer de mama en vitro. DOX y MMC Co cargados de lípidos de polímero híbrido nanopartículas (DMPLN) omite varias bombas transportador de eflujo que confieren multirresistencia y demostraron mayor eficacia en modelos de tumores de mama. En comparación con las formas de solución convencional, tal eficacia superior de DMPLN fue atribuida a la farmacocinética sincronizada de DOX y MMC y biodisponibilidad intracelular creciente de drogas dentro de las células del tumor de nanocarrier PLN.
Para evaluar la farmacocinética y la bio-distribución de co administra DOX y MMC en solución libre y formas de nanopartículas, un método simple y eficiente Análisis de múltiples fármacos con alto rendimiento de fase inversa de la cromatografía líquida (HPLC) fue desarrollado. En contraste con métodos previamente divulgados que analizan individualmente DOX o MMC en el plasma, este nuevo método HPLC es capaz de cuantificar simultáneamente DOX, MMC y un metabolito importante de DOX cardio tóxico, doxorubicinol (DOXol), en diversas matrices biológicas ( por ejemplo, sangre, tumor de mama y el corazón). Una doble punta de prueba fluorescente y ultravioleta absorbente 4-methylumbelliferone (4-MU) se utilizó como estándar interno (I.S.) para la detección de un solo paso de múltiples análisis de drogas con longitudes de onda de detección diferentes. Este método fue aplicado con éxito para determinar la concentración de DOX y MMC por enfoques de solución y nanopartículas en sangre entera y tejidos varios en un modelo Murino ortotópico mama tumor. El método analítico que se presenta es una herramienta útil para el análisis clínico previo de entrega basados en nanopartículas de combinaciones de fármacos.
Introducción
La quimioterapia es una modalidad de tratamiento primario para muchos tipos de cáncer, pero a menudo se asocia con efectos adversos graves y eficacia limitada debido a la resistencia a los medicamentos y otros factores1,2,3. Para mejorar el resultado de la quimioterapia, se han aplicado regímenes de combinación de fármacos en la clínica basada en consideraciones tales como la no superposición de toxicidades, diferentes mecanismos de acción de los fármacos y drogas no-cross resistencia4,5 , 6. en los ensayos clínicos, una mejor tasa de respuesta del tumor a menudo se observó utilizando simultáneamente administra combinaciones de fármacos en comparación con un régimen de drogas secuencial entrega7,8. Sin embargo, debido a la bio-distribución óptima de droga libre formas, inyección simultánea de múltiples drogas puede causar toxicidad prominente tejido normal que compensa el efecto terapéutico9,10,11. Administración de fármacos basados en Nanocarrier ha demostrado para alterar la farmacocinética y la bio-distribución de medicamentos encapsulados, mejorar la acumulación orientada a tumor12,13,14. Como los revisados en nuestros últimos artículos, nanopartículas cargadas junto con combinaciones de fármacos sinérgicos han demostrado la capacidad para mitigar los problemas de combinaciones de medicamentos libre, debido a su controlada entrega Co temporal y espacial de múltiples drogas al tejido del tumor, permitiendo efectos sinérgicos de la droga contra el cáncer de células de4,15,16. Como resultado, han demostrado una eficacia terapéutica superior y baja toxicidad en ambos estudios preclínicos y clínicos4,17,18.
Nuestros en vitro estudios anteriores encontraron que la combinación de dos fármacos contra el cáncer, doxorrubicina (DOX) y mitomicina C (MMC), produce un efecto sinérgico contra varias líneas de células de cáncer de mama y, además, co carga DOX y MMC en lípidos de polímero híbrido nanopartículas (DMPLN) superaron varios resistente a múltiples fármacos asociados emanación bombas (por ejemplo, P-glicoproteína y proteína resistente al cáncer de mama)19,20,21. In vivo, DMPLN permitió entrega cooperación espacial y temporal de DOX y MMC a los sitios del tumor y mayor biodisponibilidad de los fármacos dentro de células de cáncer, como lo indica la moderación de la formación de los metabolitos DOX doxorubicinol (DOXol)22. Como resultado, el DMPLN mayor apoptosis de las células tumorales, inhibición del crecimiento tumoral y supervivencia prolongada host para libre combinación de DOX y MMC o liposomal DOX formulación22,23,24, 25.
Analizando la cantidad de drogas realizada conjuntamente por un nanocarrier es fundamental para el diseño de formulaciones de nanopartículas efectivas. Se han desarrollado muchos métodos para analizar el nivel de plasma de dosis únicas de DOX o MMC utilizando cromatografía líquida de alto rendimiento (HPLC) solo o en combinación con la espectrometría de masas (MS)26,27,28 , 29 , 30 , 31 , 32 , 33 , 34. sin embargo, estos métodos son a menudo lentos y poco práctico para la terapia de combinación ya que un gran número de muestras biológicas deben prepararse por separado para el análisis de múltiples fármacos (a veces incluidos los metabilitos de la droga). Además de la Unión a proteínas plasmáticas fuerte de DOX y MMC, células de sangre rojas también tienen una gran capacidad para enlazar y concentrar muchas drogas anticáncer35,36. Así, el análisis del plasma para DOX o MMC puede ofuscar concentraciones de la droga de sangre real. El presente trabajo (figura 1) describe un simple y sólido método de análisis de drogas múltiples mediante HPLC de fase inversa simultáneamente extraer y cuantificar DOX, MMC y el DOX metabolito doxorubicinol (DOXol) de sangre entera y tejidos varios ( por ejemplo, tumores). Se ha aplicado con éxito para determinar la farmacocinética y bio-distribución de DOX y MMC, así como la formación de DOXol después de la administración de fármacos vía libres soluciones o formas de nanopartículas (es decir, DMPLN y DOX liposomal) en un orthotopically implantar modelo de tumor de mama murino ratones después de intravenoso (i.v.) de inyección22.
Protocolo
todos los experimentos en animales fueron aprobados por el cuidado Comité de Universidad red de Salud Animal del Instituto de cáncer de Ontario y realizados de acuerdo con el Consejo Canadiense sobre directrices de cuidado Animal.
1. preparación de muestras biológicas
- recoger la sangre, los órganos principales y tumor de mama en momentos predeterminados después de la administración intravenosa (i.v.) de drogas que contienen formulaciones (p. ej., DMPLN, DOX liposómica)
- inyectar un i.v. de ratón con tumores de mama con una formulación que contiene el medicamento preparada.
- Anestesiar el ratón en momentos señalados (por ejemplo, 15 min) dando inhalables 2% isoflurano en un compartimiento sellado.
- Pone el ratón anestesiado en su espalda y puso su nariz a través de una boquilla que suministra constantemente 2% isoflurano.
Nota: Para asegurarse de que el ratón somete a anestesia profunda, Pellizque suavemente extremidades delanteras del ratón y buscar cualquier movimiento que crispa. - Limpiar las regiones de tórax y abdomen con etanol al 70% y llevar a cabo un procedimiento terminal de punción cardiaca en los ratones anestesiados profundos usando una jeringa heparinizada 1 mL y una aguja de 23 G.
- Recoge la sangre en un etiquetado sodio heparina rocía el tubo de plástico y agite suavemente el tubo para asegurarse de recoger sangre entra en contacto con la heparina revestida de la pared del tubo. Recoger un mínimo de 50 μl de sangre entera. Siempre mantenga las muestras en hielo.
- Cinta de los cuatro miembros del ratón para fijarlo y abrir la cavidad abdominal y la caja torácica del ratón utilizando un par de tijeras y pinzas. Cambio de los intestinos al lado y empujar el hígado hacia arriba para exponer suficientemente la vena porta. Cortar la vena porta para el drenaje de sangre.
- Inundar el cuerpo de todo ratón con 50 mL de solución salina 0.9% helada a través del corazón utilizando una jeringa de 10 mL con una aguja de 25 G.
Nota: Doblar la aguja a 90° para guiar la jeringa a la vena porta. - Órganos de impuestos especiales en el siguiente orden: corazón, pulmón, hígado, bazo, riñones. Luego, separar el tumor del pecho de los tejidos conectivos circundantes mediante un par de tijeras de incisión en la almohadilla de grasa mamaria derecha del ratón. Recoja todos los órganos individualmente en tubos de polipropileno de 1.5 mL y congélelos rápidamente en nitrógeno líquido.
Nota: separar la vesícula biliar desde el hígado. - Almacenar la sangre a 4 ° C y suprimido los tejidos en el congelador de-80 ° C hasta su posterior análisis HPLC.
- Extracto de DOX, MMC y DOXol de matrices biológicas.
- Pesan todos los tejidos disecados congelados rápidamente y transferir a un tubo cónico de fondo redondeado de 13 mL. Para evitar posibles drogas metabolismo o degradación, mantener las muestras en hielo.
- Agregar de 1-5 mL de tampón de lisis celular helada en el tubo de.
Nota: El volumen de buffer a utilizar depende del peso de tejido basado en la razón tejido-buffer de 1 g: 5 mL (w/v); para pequeños órganos, como corazón y bazo, la proporción es de 1 g: 2 mL. - Utilizar un movimiento de movimiento arriba-abajo para homogeneizar las muestras de tejido en el hielo a una velocidad de 18.000 rpm usando un homogeneizador de mano eléctrica.
Nota: Homogeneización completa requiere aproximadamente 3 a 5 repeticiones de un proceso de homogeneización cortos de menos de 15 s, seguido del enfriamiento con hielo entre cada corto homogeneización del tejido. - Lavar la sonda de generador de dientes de Sierra de 10 mm de la homogeneizadora con agua destilada desionizada (DDI) H 2 O, etanol al 70% y luego DDI H 2 O entre cada muestra de tejido para evitar la contaminación cruzada.
- Transferir 50 μl de homogenado de tejidos o sangre entera en un tubo de microcentrífuga polipropileno de 1.5 mL y spike con 5 μl de una interna estándar (I.S.) 4-methylumbelliferone (4-MU) (2000 ng/mL) en el tubo de.
Nota: solución 4-MU se preparó en metanol aquí. - Añadir 250 μl de un solvente de extracción helada al tubo que contiene sangre o tejido homogeneizado.
Nota: El disolvente de extracción consiste en 60% acetonitrilo (ACN) y acetato de amonio 40% (5 mM) con pH ajustado a pH = 3,5 con 0.05% de ácido fórmico. Utilizar una muestra de 1:5 (v/v): solvente de extracción relación. - Vortex vigorosamente la mezcla durante 2 min, centrifugar a 3.000 x g de fuerza a 4 o C por 10 min y pipetee 200 μL de sobrenadante en otro tubo de microcentrífuga fresco previamente enfriada.
- Evapórese sobrenadante a 60 ° C bajo una corriente lenta de nitrógeno con la protección de la luz.
- Reconstituir el residuo seco con 100 μl de metanol helada, vortex vigorosamente por 30 s y centrifugue a 3000 x g a 4 ° C por 5 min otra
- Transferir el sobrenadante a un inserto HPLC frasco y colocar frascos de la muestra en una bandeja de automuestreador para la inyección.
2. Instrumentación HPLC y parámetros de operación
- fase móvil HPLC preparar con reproducibilidad consistente
- medida de grado HPLC H 2 O utilizando una probeta graduada de 500 mL.
- Medir 500 mL de acetonitrilo grado HPLC (ACN) usando un cilindro graduado separado.
- Con cuidado añada 0,5 mL de ácido trifluoroacético (TFA) (PRECAUCIÓN) en cada una de 500 mL de H 2 O y la CAN para obtener la fase móvil de H 2 O y ACN que contiene 0.1% TFA, respectivamente.
Nota: TFA es corrosivo y tóxico y debe ser manejado bajo una campana de laboratorio. Todas las mezclas solventes están preparadas a temperatura ambiente. - Fases móviles filtro a través de un filtro de membrana de nylon con un 0.45 μm tamaño de poro y transferir en limpiamos botellas de depósito HPLC.
- Instrumentación instalación HPLC para la detección simultánea de DOX, MMC y DOXol y I.S. 4-MU.
- Interruptor de la bomba de gradiente de gasser, muestreador automático, detector del arsenal del fotodiodo y multi detector de fluorescencia de λ.
- Entrada a las condiciones iniciales de la composición de la fase móvil a 16,5% H 2 O (0.1% TFA) y 83,5% ACN (0.1% TFA) (v/v).
- Ajustar el detector de UV en dos canales, uno en 310 nm para 4-MU (I.S.) y el otro en 360 nm para MMC.
- Activado el detector de fluorescencia de dos canales, uno en λ ex / em λ = 365/445 nm 4-MU y el otro en λ ex / λ em = 480 nm/560 nm para DOX y DOXol, respectivamente.
- Fijar un caudal isocrática de 1,0 mL/min.
- Equilibrar una columna de 18 preinstalado de fase inversa C (4,6 mm x 250 mm, 5 μm) a temperatura ambiente durante 10 min para el establecimiento de la referencia.
- Separar drogas (DOX, MMC, DOXol y 4-MU) usando la condición gradiente de fase móvil.
- Inyectar 15 μl de muestras extraídas y concentradas a utilizar el muestreador automático.
- Poco a poco cambiar la condición inicial de la fase móvil (consulte el protocolo paso 2.2.2) al 100% ACN (0.1% TFA) sobre 18 minutos usando la bomba de gradiente automatizada.
Nota: Durante el proceso de separación, cuatro canales (dos absorbentes de UV y dos fluorescentes) aparecen simultáneamente con cada canal que muestra un medicamento compuesto (consulte el paso protocolo 2.2.3 y 2.2.4). - Mantener el 100% de ACN (0.1% TFA) por 1 min y luego retorno a la condición de fase móvil inicial en 1 minuto
- Volver a acondicionar la columna con la fase móvil inicial en el flujo de 1,5 mL/min durante 4 min para la siguiente inyección muestra.
3. Validación de HPLC
- preparación de estándares de trabajo de DOX, MMC y DOXol y 4-MU (I.S.).
- Pesar por separado 1 mg de polvo de droga DOX y MMC (PRECAUCIÓN) y 4-MU en un dulce pequeño peso de papel (3 x 3 pulgadas 2).
Tenga en cuenta que todos los medicamentos contra el cáncer son considerados un peligro para la salud que puede causar mutagenicidad toxicidad y la célula de germen aguda en la inhalación o ingestión. Deben manipularse cuidadosamente con guantes y máscaras de. - Transferir la pesada DOX, MMC y 4-MU en un tubo nuevo de microcentrífuga polipropileno individual 1.5 mL.
- Añada 1 mL de metanfetaminaanol y agitar brevemente para obtener 1 mg/mL concentración de DOX y MMC.
- Agregar 1 mL de metanol a un vial previamente pesado 1 mg de DOXol (PRECAUCIÓN) y vortex brevemente para obtener concentración de 1 mg/mL de DOXol.
Nota: DOXol es un metabolito de cardio tóxica y debe manipularse con cuidado. - Pipeta 20 μl de las soluciones madre preparadas de DOX, MMC, DOXol y 4-MU en un nuevo separar el tubo de microcentrífuga polipropileno de 1.5 mL y añadir 980 μl de metanol para obtener un estándar de trabajo de 20 μg/mL de cada droga.
- Diluir 20 μg/mL de DOX, MMC y DOXol con metanol para obtener los estándares de trabajo de 50 ng - 20 μg/ml para DOX, MMC y DOXol y 2000 ng/mL para I.S. 4-MU.
- Sello de la tapa del tubo de soluciones de trabajo con un estrecho trozo de cubierta de la película de parafina para evitar la evaporación del metanol, envuelva el tubo entero con papel de aluminio para evitar la exposición a la luz directa y conservar a -20 ° C.
- Pesar por separado 1 mg de polvo de droga DOX y MMC (PRECAUCIÓN) y 4-MU en un dulce pequeño peso de papel (3 x 3 pulgadas 2).
- Determinar la linealidad, precisión y exactitud de DOX, MMC y DOXol en matrices biológicas (es decir, sangre y tumor homogeneizado).
- Al mismo tiempo punto 5 μl de estándares de trabajo de DOX y DOXol (50 ng/mL - 20 μg/mL), MMC (1.000 ng/mL - 16 μg/mL) y 4-MU (2 μg/mL) en 50 μl de sangre entera en blanco o tejido homogeneizado en tubos de microcentrífuga de polipropileno para obtener la curva de concentración estándar que van desde 5-2000 ng/mL para los compuestos de la droga y 200 ng/mL para 4-MU (I.S.).
- Realizar el ensayo de extracción de droga se describe en el protocolo 1.2.
- Uso de baja, mediana y alta concentración de DOX y DOXol (50, 500 y 2.000 ng/mL) y MMC (100, 1000, 2.000 ng/mL) para precisión intra y inter día.
Nota: Preparar concentraciones estándar frescas en el día del análisis.
- Análisis de muestras
- inyectar 15 μl de la muestra usando el muestreador automático.
- Poco a poco cambie la fase móvil sobre 0 a 18 minutos, aumento de la composición de ACN en el intervalo de.
- Después de 18 minutos, mantenga la condición de fase móvil durante 1 minuto
- Regresar a la condición inicial durante los próximos 2 minutos y volver a equilibrar durante 4 minutos antes de la inyección siguiente.
- Después de cada muestra ejecute, tenga en cuenta que los picos de los compuestos de la droga con su tiempo de retención se muestran como sigue: MMC, DOXol, 4-MU (I.S.) y DOX.
- Integrar el área de pico en la curva (AUC) de los compuestos de drogas utilizando el software HPLC.
- Calcular la relación AUC entre drogas individual compuesto y I.S. (ecuación 1) y las curvas estándar preparadas bajo los mismos procedimientos de extracción para determinar las concentraciones de la droga de DOX, MMC y DOXol en formulación DMPLN.
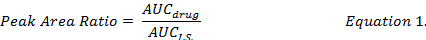
- calcular el porcentaje de recuperación de drogas (ecuación 2) mediante la comparación de las concentraciones de medicamento reconstituidas con metanol de los extractos de las muestras biológicas con picos para que de la norma (" limpio ") solución en metanol de la droga.
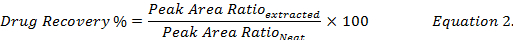
Resultados
Dos medicamentos contra el cáncer, DOX y MMC, así como el metabolito DOX, DOXol, fueron detectado simultáneamente sin ninguna interferencia biológica bajo las mismas condiciones HPLC de gradiente aplicada utilizando 4-MU como el I.S. para los detectores de UV y fluorescencia. DOX, MMC, DOXol y 4 MU estaban bien separados unos de otros con tiempos de retención de 5,7 min para MMC, 10,4 min DOXol, 10,9 min 4-MU y min 11,1 para DOX (figura 2). Cada medicame...
Discusión
En comparación con otros métodos cromatográficos que permitan la detección de especies de un solo medicamento a la vez, el presente Protocolo HPLC es capaz de cuantificar simultáneamente tres compuestos de la droga (DOX, MMC y DOXol) en la misma matriz biológica sin necesidad de cambiar la fase móvil. Este método de preparación y el análisis se ha aplicado con éxito para determinar la farmacocinética y bio-distribución de dos sistemas de entrega de medicamentos basados en nanopartículas (es decir, ...
Divulgaciones
Los autores no tienen ninguna competencia de intereses financieros y conflictos de intereses.
Agradecimientos
Los autores reconocen agradecidos la donación de equipo de Ciencias naturales e Ingeniería de investigación (NSERC) Consejo de Canadá para HPLC, la subvención de funcionamiento del Instituto canadiense de investigación de la salud (CIHR) y canadiense de investigación de cáncer de mama (CBCR) Alianza a X.Y. Wu y la beca de la Universidad de Toronto para R.X. Zhang y Zhang T..
Materiales
| Name | Company | Catalog Number | Comments |
| Doxorubicin | Polymed Theraeutics | 111023 | Anticancer drug |
| Mitomycin C | Polymed Theraeutics | 060814 | Anticancer drug |
| Doxorubicinol (DOXol) | Toronto Research Chemicals | D558020 | Metabolite of DOX |
| 4-Methylumbelliferone sodium salt | Sigma-Aldrich | M1508 | Internal standard |
| Myristic Acid | Sigma-Aldrich | 544-63-8 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (100) Stearate | Spectrum | M1402 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (40) Stearate | Sigma-Aldrich | P3440 | Materials for poly-lipid hybrid nanoparticles |
| Pluronic F68 (PF68) | BASF Corp. | 9003-11-6 | Materials for poly-lipid hybrid nanoparticles |
| Ultrasonication (UP100H) | Hielscher, Ultrasound Technology | NA | Nanoparticle preparation |
| Water Bath (ISOTEMP 3016HS) | Fisher Scientific | NA | Nanoparticle preparation |
| Liposomal Doxorubicin (Caelyx) | Janssen | Purchased from the pharmacy Princess Margaret Hospital | Clinically-approved nanoparticle formulation |
| HPLC-graded Methanol | Caledon Chemicals | 6701-7-40 | HPLC mobile phase composition |
| HPLC-graded H2O | Caledon Chemicals | 8801-7-40 | HPLC mobile phase composition |
| HPLC-graded Acetonitrile | Caledon Chemicals | 1401-7-40 | HPLC mobile phase composition |
| Trifluoroacetic Acid | Sigma-Aldrich | 302031 | HPLC mobile phase composition |
| 0.45 μm Nylon Membrane Filter Paper | Whatman | WHA7404004 | HPLC mobile phase preparation |
| 1cc Plastic Syringes | Becton, Dickinson and Company | 2606-309659 | Treatment injection |
| 5cc Plastic Syringes | Becton, Dickinson and Company | 2608-309646 | Tissue collections |
| 30G 1/2 Needles | Becton, Dickinson and Company | 305106 | Treatment injection |
| 25G 5/8 Needles | Becton, Dickinson and Company | 305122 | Tissue collections |
| Sterile 0.9% Saline | Univeristy of Toronto House Brand | 1011 | Tissue perfusion |
| 13 ml Rounded-bottom conical tube | SARSTEDT | 62.515.006 | Prolyprolene, tissue homogenization |
| Alpha Minimum Essential Medium (MEM) | Gibco | 12571063 | Cell medium |
| 1 x Phosphate Buffer Saline | Gibco | 10010023 | Tissue homogenization |
| Triton X-100 | Sigma-Aldrich | X100-100 ML | Tissue homogenization |
| Formic acid | Caledon Chemicals | 1/5/3840 | Adjust pH for extraction solvent |
| Sodium heparin sprayed plastic tubes | Becton, Dickinson and Company | 367878 | Blood collection |
| Analytical Weigh Balance | Sartorius | CPA225D | NA |
| pH meters | Fisher Scientific | 13-637-671 | accumet BASIC |
| Vortex Mixter | Fisher Scientific | 02-215-365 | Vortexing samples at desired speed |
| 1.5 ml Microcentrifuge Tube | Fisherbrand | 2043-05408129 | Prolyprolene |
| Model 1000 homogenizer | Fisher Scientific | 08-451-672 | Tissue homogenization |
| Centrifuge 5702R | Eppendorf | 5702R | Extraction preparation |
| Heated Evaporator System | Glas-Col | NA | Sample reconstitution |
| HPLC Screw Thread Vials | DIKMA | 5320 | HPLC sample injection |
| HPLC Screw Caps with PTFE White Silicone Septa | DIKMA | 5325 | HPLC sample injection |
| HPLC Polypropylene Insert | Agilent Technologies | 5182-0549 | Maximum volume 250 μl, HPLC sample injection |
| Xbridge C18 Column | Waters Corporation | 186003117 | Drug analysis |
| Gradient pump | Waters Corporation | W600 | Drug analysis |
| Auto-sampler | Waters Corporation | W2707 | Drug analysis |
| Photodiode array detector | Waters Corporation | W2998 | Drug analysis |
| Multi λ fluoresence detector | Waters Corporation | W2475 | Drug analysis |
| EMPOWER 2 | Waters Corporation | NA | Data analysis software |
| Scientist | Micromath | NA | Pharmacokinetic analysis |
| Female Balb/c Mice | Jackson Laboratory | 001026 | In vivo |
| EMT6/WT Breast Cancer Cells | Provided by Dr. Ian Tannock; Ontario Cancer Institute | NA | In vivo |
Referencias
- Holohan, C., Van Schaeybroeck, S., Longley, D. B., Johnston, P. G. Cancer Drug Resistance: An Evolving Paradigm. Nat. Rev. Cancer. 13 (10), 714-726 (2013).
- Szakacs, G., Paterson, J. K., Ludwig, J. A., Booth-Genthe, C., Gottesman, M. M. Targeting Multidrug Resistance in Cancer. Nat Rev Drug Discov. 5 (3), 219-234 (2006).
- Kong, A. -. N. T., Kong, A. .. N. .. T. .. ,. . Inflammation, Oxidative Stress, and Cancer: Dietary Approaches for Cancer Prevention. , (2013).
- Zhang, R. X., Wong, H. L., Xue, H. Y., Eoh, J. Y., Wu, X. Y. Nanomedicine of Synergistic Drug Combinations for Cancer Therapy - Strategies and Perspectives. J Control Release. 240, 489-503 (2016).
- Webster, R. M. Combination Therapies in Oncology. Nat. Rev. Drug. Discov. 15 (2), 81-82 (2016).
- Waterhouse, D. N., Gelmon, K. A., Klasa, R., Chi, K., Huntsman, D., Ramsay, E., Wasan, E., Edwards, L., Tucker, C., Zastre, J., Wang, Y. Z., Yapp, D., Dragowska, W., Dunn, S., Dedhar, S., Bally, M. B. Development and Assessment of Conventional and Targeted Drug Combinations for Use in the Treatment of Aggressive Breast Cancers. Curr Cancer Drug Targets. 6 (6), 455-489 (2006).
- Cancello, G., Bagnardi, V., Sangalli, C., Montagna, E., Dellapasqua, S., Sporchia, A., Iorfida, M., Viale, G., Barberis, M., Veronesi, P., Luini, A., Intra, M., Goldhirsch, A., Colleoni, M. Phase Ii Study with Epirubicin, Cisplatin, and Infusional Fluorouracil Followed by Weekly Paclitaxel with Metronomic Cyclophosphamide as a Preoperative Treatment of Triple-Negative Breast Cancer. Clin Breast Cancer. 15 (4), 259-265 (2015).
- Masuda, N., Higaki, K., Takano, T., Matsunami, N., Morimoto, T., Ohtani, S., Mizutani, M., Miyamoto, T., Kuroi, K., Ohno, S., Morita, S., Toi, M. A Phase Ii Study of Metronomic Paclitaxel/Cyclophosphamide/Capecitabine Followed by 5-Fluorouracil/Epirubicin/Cyclophosphamide as Preoperative Chemotherapy for Triple-Negative or Low Hormone Receptor Expressing/Her2-Negative Primary Breast Cancer. Cancer Chemother Pharmacol. 74 (2), 229-238 (2014).
- Carrick, S., Parker, S., Thornton, C. E., Ghersi, D., Simes, J., Wilcken, N. Single Agent Versus Combination Chemotherapy for Metastatic Breast Cancer. Cochrane Database Syst Rev. 15 (2), 003372 (2009).
- Cardoso, F., Bedard, P. L., Winer, E. P., Pagani, O., Senkus-Konefka, E., Fallowfield, L. J., Kyriakides, S., Costa, A., Cufer, T., Albain, K. S., Force, E. -. M. T. International Guidelines for Management of Metastatic Breast Cancer: Combination Vs Sequential Single-Agent Chemotherapy. J Natl Cancer Inst. 101 (17), 1174-1181 (2009).
- Alba, E., Martin, M., Ramos, M., Adrover, E., Balil, A., Jara, C., Barnadas, A., Fernandez-Aramburo, A., Sanchez-Rovira, P., Amenedo, M., Casado, A. Multicenter Randomized Trial Comparing Sequential with Concomitant Administration of Doxorubicin and Docetaxel as First-Line Treatment of Metastatic Breast Cancer: A Spanish Breast Cancer Research Group (Geicam-9903) Phase Iii. J Clinn Oncol. 22 (13), 2587-2593 (2004).
- Sadat, S. M., Saeidnia, S., Nazarali, A. J., Haddadi, A. Nano-Pharmaceutical Formulations for Targeted Drug Delivery against Her2 in Breast Cancer. Curr. Cancer Drug Targets. 15 (1), 71-86 (2015).
- Devadasu, V. R., Wadsworth, R. M., Ravi Kumar, M. N. V. Tissue Localization of Nanoparticles Is Altered Due to Hypoxia Resulting in Poor Efficacy of Curcumin Nanoparticles in Pulmonary Hypertension. Eur. J. Pharm. Biopharm. 80 (3), 578-584 (2012).
- Li, S. D., Huang, L. Pharmacokinetics and Biodistribution of Nanoparticles. Mol. Pharm. 5 (4), 496-504 (2008).
- Zhang, R. X., Ahmed, T., Li, L. Y., Li, J., Abbasi, A. Z., Wu, X. Y. Design of Nanocarriers for Nanoscale Drug Delivery to Enhance Cancer Treatment Using Hybrid Polymer and Lipid Building Blocks. Nanoscale. 9 (4), 1334-1355 (2017).
- Wang, X., Li, S., Shi, Y., Chuan, X., Li, J., Zhong, T., Zhang, H., Dai, W., He, B., Zhang, Q. The Development of Site-Specific Drug Delivery Nanocarriers Based on Receptor Mediation. J. Control. Release. 193, 139-153 (2014).
- Batist, G., Gelmon, K. A., Chi, K. N., Miller, W. H., Chia, S. K., Mayer, L. D., Swenson, C. E., Janoff, A. S., Louie, A. C. Safety, Pharmacokinetics, and Efficacy of Cpx-1 Liposome Injection in Patients with Advanced Solid Tumors. Clin Cancer Res. 15 (2), 692-700 (2009).
- Mayer, L. D., Harasym, T. O., Tardi, P. G., Harasym, N. L., Shew, C. R., Johnstone, S. A., Ramsay, E. C., Bally, M. B., Janoff, A. S. Ratiometric Dosing of Anticancer Drug Combinations: Controlling Drug Ratios after Systemic Administration Regulates Therapeutic Activity in Tumor-Bearing Mice. Mol. Cancer Ther. 5 (7), 1854-1863 (2006).
- Prasad, P., Cheng, J., Shuhendler, A., Rauth, A. M., Wu, X. Y. A Novel Nanoparticle Formulation Overcomes Multiple Types of Membrane Efflux Pumps in Human Breast Cancer Cells. Drug Deliv Transl Res. 2 (2), 95-105 (2012).
- Shuhendler, A. J., Cheung, R. Y., Manias, J., Connor, A., Rauth, A. M., Wu, X. Y. A Novel Doxorubicin-Mitomycin C Co-Encapsulated Nanoparticle Formulation Exhibits Anti-Cancer Synergy in Multidrug Resistant Human Breast Cancer Cells. Breast Cancer Res Treat. 119 (2), 255-269 (2010).
- Shuhendler, A. J., O'Brien, P. J., Rauth, A. M., Wu, X. Y. On the Synergistic Effect of Doxorubicin and Mitomycin C against Breast Cancer Cells. Drug Metabol. Drug Interact. 22 (4), 201-233 (2007).
- Zhang, R. X., Cai, P., Zhang, T., Chen, K., Li, J., Cheng, J., Pang, K. S., Adissu, H. A., Rauth, A. M., Wu, X. Y. Polymer-Lipid Hybrid Nanoparticles Synchronize Pharmacokinetics of Co-Encapsulated Doxorubicin-Mitomycin C and Enable Their Spatiotemporal Co-Delivery and Local Bioavailability in Breast Tumor. Nanomedicine. 12 (5), 1279-1290 (2016).
- Zhang, T., Prasad, P., Cai, P., He, C., Shan, D., Rauth, A. M., Wu, X. Y. Dual-Targeted Hybrid Nanoparticles of Synergistic Drugs for Treating Lung Metastases of Triple Negative Breast Cancer in Mice. Acta Pharmacol Sin. , 1-13 (2017).
- Shuhendler, A. J., Prasad, P., Zhang, R. X., Amini, M. A., Sun, M., Liu, P. P., Bristow, R. G., Rauth, A. M., Wu, X. Y. Synergistic Nanoparticulate Drug Combination Overcomes Multidrug Resistance, Increases Efficacy, and Reduces Cardiotoxicity in a Nonimmunocompromised Breast Tumor Model. Mol Pharm. 11 (8), 2659-2674 (2014).
- Prasad, P., Shuhendler, A., Cai, P., Rauth, A. M., Wu, X. Y. Doxorubicin and Mitomycin C Co-Loaded Polymer-Lipid Hybrid Nanoparticles Inhibit Growth of Sensitive and Multidrug Resistant Human Mammary Tumor Xenografts. Cancer Lett. 334 (2), 263-273 (2013).
- Rafiei, P., Michel, D., Haddadi, A. Application of a Rapid Esi-Ms/Ms Method for Quantitative Analysis of Docetaxel in Polymeric Matrices of Plga and Plga-Peg Nanoparticles through Direct Injection to Mass Spectrometer. Am. J. Anal. Chem. 6 (2), 164-175 (2015).
- Daeihamed, M., Haeri, A., Dadashzadeh, S. A Simple and Sensitive Hplc Method for Fluorescence Quantitation of Doxorubicin in Micro-Volume Plasma: Applications to Pharmacokinetic Studies in Rats. Iran. J. Pharm. Res. 14, 33-42 (2015).
- Alhareth, K., Vauthier, C., Gueutin, C., Ponchel, G., Moussa, F. Hplc Quantification of Doxorubicin in Plasma and Tissues of Rats Treated with Doxorubicin Loaded Poly(Alkylcyanoacrylate) Nanoparticles. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 887-888, 128-132 (2012).
- Al-Abd, A. M., Kim, N. H., Song, S. C., Lee, S. J., Kuh, H. J. A Simple Hplc Method for Doxorubicin in Plasma and Tissues of Nude Mice. Arch Pharm Res. 32 (4), 605-611 (2009).
- Loadman, P. M., Calabrese, C. R. Separation Methods for Anthraquinone Related Anti-Cancer Drugs. J. Chromatogr. B Biomed. Sci. Appl. 764 (1-2), 193-206 (2001).
- Zhang, Z. D., Guetens, G., De Boeck, G., Van Cauwenberghe, K., Maes, R. A., Ardiet, C., van Oosterom, A. T., Highley, M., de Bruijn, E. A., Tjaden, U. R. Simultaneous Determination of the Peptide-Mitomycin Kw-2149 and Its Metabolites in Plasma by High-Performance Liquid Chromatography. J. Chromatogr. B Biomed. Sci. Appl. 739 (2), 281-289 (2000).
- Alvarez-Cedron, L., Sayalero, M. L., Lanao, J. M. High-Performance Liquid Chromatographic Validated Assay of Doxorubicin in Rat Plasma and Tissues. J. Chromatogr. B Biomed. Sci. Appl. 721 (2), 271-278 (1999).
- Paroni, R., Arcelloni, C., De Vecchi, E., Fermo, I., Mauri, D., Colombo, R. Plasma Mitomycin C Concentrations Determined by Hplc Coupled to Solid-Phase Extraction. Clin. Chem. 43 (4), 615-618 (1997).
- Song, D., Au, J. L. Direct Injection Isocratic High-Performance Liquid Chromatographic Analysis of Mitomycin C in Plasma. J Chromatogr B Biomed Appl. 676 (1), 165-168 (1996).
- Schrijvers, D. Role of Red Blood Cells in Pharmacokinetics of Chemotherapeutic Agents. Clin. Pharmacokinet. 42 (9), 779-791 (2003).
- Colombo, T., Broggini, M., Garattini, S., Donelli, M. G. Differential Adriamycin Distribution to Blood Components. Eur. J. Drug Metab. Pharmacokinet. 6 (2), 115-122 (1981).
- Maeda, H., Nakamura, H., Fang, J. The Epr Effect for Macromolecular Drug Delivery to Solid Tumors: Improvement of Tumor Uptake, Lowering of Systemic Toxicity, and Distinct Tumor Imaging in Vivo. Adv. Drug Deliv. Rev. 65 (1), 71-79 (2013).
- Gustafson, D. L., Rastatter, J. C., Colombo, T., Long, M. E. Doxorubicin Pharmacokinetics: Macromolecule Binding, Metabolism, and Excretion in the Context of a Physiologic Model. J. Pharm. Sci. 91 (6), 1488-1501 (2002).
- Gabizon, A., Shiota, R., Papahadjopoulos, D. Pharmacokinetics and Tissue Distribution of Doxorubicin Encapsulated in Stable Liposomes with Long Circulation Times. J. Natl. Cancer Inst. 81 (19), 1484-1488 (1989).
- Motlagh, N. S., Parvin, P., Ghasemi, F., Atyabi, F. Fluorescence Properties of Several Chemotherapy Drugs: Doxorubicin, Paclitaxel and Bleomycin. Biomed Opt Express. 7 (6), 2400-2406 (2016).
- Mohan, P., Rapoport, N. Doxorubicin as a Molecular Nanotheranostic Agent: Effect of Doxorubicin Encapsulation in Micelles or Nanoemulsions on the Ultrasound-Mediated Intracellular Delivery and Nuclear Trafficking. Mol Pharm. 7 (6), 1959-1973 (2010).
- Cielecka-Piontek, J., Jelińska, A., Zając, M., Sobczak, M., Bartold, A., Oszczapowicz, I. A Comparison of the Stability of Doxorubicin and Daunorubicin in Solid State. J. Pharm. Biomed Anal. 50 (4), 576-579 (2009).
- Gilbert, C. M., McGeary, R. P., Filippich, L. J., Norris, R. L. G., Charles, B. G. Simultaneous Liquid Chromatographic Determination of Doxorubicin and Its Major Metabolite Doxorubicinol in Parrot Plasma. J. chromatogr. B Analyt. Technol. Biomed. Life sci. 826 (1-2), 273-276 (2005).
- Liu, Z. S., Li, Y. M., Jiang, S. X., Chen, L. R. Direct Injection Analysis of Mitomycin C in Biological Fluids by Multidemension High Performance Liquid Chromatography with a Micellar Mobile Phase. J. Liq. Chromatogr. Relat. Technol. 19 (8), 1255-1265 (1996).
- Zhou, Y., He, C., Chen, K., Ni, J., Cai, Y., Guo, X., Wu, X. Y. A New Method for Evaluating Actual Drug Release Kinetics of Nanoparticles inside Dialysis Devices Via Numerical Deconvolution. J. Control. Release. 243, 11-20 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados