Method Article
Un en Vivo Dúo color método de proyección de imagen dinámica Vascular tras lesión medular contundente
En este artículo
Resumen
Introducimos un en vivo imagen método utilizando dos diferentes tintes fluorescentes para seguir la dinámicos cambios vasculares espinales tras una lesión contundente de la médula espinal en ratas Sprague-Dawley adultas.
Resumen
Lesión de la médula espinal (SCI) causa significativa interrupción vascular en el sitio de la lesión. Patología vascular se produce inmediatamente después de SCI y continúa a lo largo de la fase aguda de la lesión. De hecho, las células endoteliales parecen ser el primero en morir después de un contundente SCI. Los primeros eventos vasculares, incluyendo aumento de la permeabilidad de la barrera sangre-medular (BSCB), inducen el edema vasogenic y contribuyan a eventos perjudiciales lesión secundaria causadas por mecanismos de lesiones complejas. Dirigidos a la disrupción vascular, por lo tanto, podrían ser una estrategia clave para reducir la cascada de lesión secundaria que contribuyen a trastornos histológicos y funcionales después de la médula espinal. Estudios anteriores fueron realizados sobre todo en muestras post mortem y eran incapaces de capturar los cambios dinámicos de la red vascular. En este estudio, hemos desarrollado un en vivo duo-color dos fotones método imagenológico para monitorear los cambios dinámicos vasculares agudos tras contundente SCI. Este enfoque permite detectar el flujo sanguíneo, diámetro del vaso y otras patologías vasculares en varios sitios de la misma rata antes y después de la lesión. En general, este método proporciona un lugar excelente para investigar la dinámica vascular.
Introducción
Lesión traumática de la médula espinal (SCI) es una lesión común que conduce a deterioro de la función de motor, sensorial y autónoma. Según la nacional médula espinal lesión estadística centro (NSCISC) en el año 2016, aproximadamente 282.000 personas fueron afectadas, mientras que 69% de ellos eran principalmente debido a accidentes de tráfico o caídas1. Estos pacientes a menudo requieren de cuidados intensivos; sin embargo, no hay tratamiento eficaz está disponible. Por lo tanto, se necesitan urgentemente nuevas estrategias eficaces hacia SCI.
SCI se divide principalmente en dos fases: lesión primaria y lesión secundaria. La lesión primaria comprende el insulto físico causando necrosis hemorrágica en el sitio de impacto2, seguido de una serie de eventos de lesión secundaria, tales como inflamación, apoptosis celular y desmielinización de los axones restantes, que progresivamente a la expansión del déficit funcional y morfológica3,4,5,6. La hemorragia es el primer signo visible de la lesión, indicando una interrupción vascular inmediata en la fase aguda de SCI7,8. Una estrategia neuroprotectora para reducir el daño vascular temprano podría mejorar la recuperación de pacientes, pero esto requiere una mejor comprensión del mecanismo fisiopatológico de los primeros eventos vasculares después de la lesión.
A pesar de estudios previos usando varios métodos para el estudio de la vasculatura de la médula espinal, siguen siendo limitaciones significativas. La desventaja más común es estudiar solamente post mortem muestras, por ejemplo, hidrógeno separación9, autorradiografía10, microangiogram8, moldes de corrosión vascular11e immunohistochemistry12 ,13. Aunque flujometría Doppler láser proporciona monitoreo en tiempo real no invasiva de de flujo de sangre de la médula espinal14, es incapaz de distinguir entre los sistemas vasculares y detectar alteraciones morfológicas vasculares. MRI poner en contraste-realzado dinámico (DCE-MRI) también es no invasiva, pero que genera imágenes de baja resolución y requiere una infraestructura costosa15.
Aunque en vivo proyección de imagen usando 2 fotones láser microscopía (2P-LSM) ha sido desarrollado para el estudio de vasodynamics en la corteza16,17,18, tiene un número limitado de estudios demostraron cambios vasculares después de un SCI. Tang et al han mostrado cambios en flujo de sangre en el borde del sitio de la lesión en una Hemisección modelo19, pero la proyección de imagen después de una lesión contundente es más difícil por dos razones. En primer lugar, una ventana óptica de vidrio tradicional sobre el sitio de lesión no sostener el impacto mecánico y siguen siendo funcional para la proyección de imagen. En segundo lugar, la salida del trazador en la parenquimia debido a hemorragia crea dificultad con la proyección de imagen de la lesión.
Aquí presentamos un método de imagen de novela duo-color, que permite obtener imágenes del mismo embarcaciones individuales en momentos antes y después de la lesión. Además, proporciona un perfil temporal espacial de cambios dinámicos vasculares tras un contundente SCI. También tiene el potencial para la proyección de imagen en múltiples puntos del tiempo después de la lesión. Este protocolo se puede aplicar directamente a animales transgénicos para estudiar la interacción de neurovascular.
Protocolo
Se realizaron todos los procedimientos de manejo quirúrgico y animal aprobado bajo la guía para el cuidado y uso de animales de laboratorio (National Research Council) y las directrices de la Indiana University School de medicina institucional Animal Care y el uso Comité.
1. quirúrgico preparación
- Esterilizar todas las herramientas quirúrgicas incluyendo el estabilizador de la columna vertebral. Limpiar la mesa y todos los alrededores con etanol al 70%. Para la preparación de la intervención quirúrgica no supervivencia, coloque una almohadilla de limpieza quirúrgica en la parte superior a 37 ° C cojín de calefacción.
- Rata de Sprague Dawley (SD) seis semana de edad de uso para este estudio. Pesan y anestesiar la rata con una inyección intraperitoneal de ketamina (87,7 mg/kg) y xilacina (12,3 mg/kg) de mezcla. Confirmar escenario adecuado de anestesia cuando el animal deja de responder a un estímulo del pellizco del dedo del pie. Inyectar por vía subcutánea 0.01-0.05 mg/kg de buprenorfina y 5mg/kg de carprofeno antes de la cirugía.
- Afeitarse la rata en 2 zonas: la región cervical de la espina dorsal en la espalda y la región del cuello en el lado de la mama. Limpiar las áreas de la piel con betadine lavado quirúrgico y toallitas de alcohol al 70%. Aplique el ungüento de ojo para evitar el ojo seco durante la cirugía. Coloque el animal en posición decúbito supina en la almohadilla de limpieza quirúrgica.
2. cateterización de la vena yugular externos
- Localizar la vena yugular externa por encontrar el punto de pulso cerca de la clavícula y corte con un par de tijeras pequeñas primavera para hacer una incisión vertical en el terreno, que es el punto de Cruz de 3 puntos anatómicos: caudal ramus de la mandíbula derecha, tubérculo mayor del húmero y manubrio (figura 1A). Aislar el vaso usando una primavera tijeras y pinzas finas. Atar el extremo distal con sutura quirúrgica estéril 1 línea (figura 1)20.
- Preparar una jeringa de 1 mL llena con suero fisiológico y conectar con un catéter especializado de una aguja de calibre 21 (figura 1B). Hacer una pequeña incisión con un micro tijeras en el buque y deslice el catéter dentro del vaso.
- Asegure la aguja atar tanto el extremo proximal y distal (figura 1). El catéter especializado se hace de una aguja de calibre 21. Rutina la punta plana y la soldadura con una pieza de 2 mm de la punta de cortan de otra aguja de calibre 21. Esto puede evitar que el catéter se fuera.
Nota: Una pequeña cantidad de sangre que circula dentro de la aguja indica que la aguja ha entrado con éxito en un vaso sanguíneo.
- Asegure la aguja atar tanto el extremo proximal y distal (figura 1). El catéter especializado se hace de una aguja de calibre 21. Rutina la punta plana y la soldadura con una pieza de 2 mm de la punta de cortan de otra aguja de calibre 21. Esto puede evitar que el catéter se fuera.
3. estabilización columna vertebral y laminectomía C5-C7
- Coloque el animal en una posición propensa. Cortar la piel a lo largo de la línea media con una hoja de bisturí Nº 15 en los niveles deseados de espinales. Disecar las capas musculares de la 5th a 7th vértebras cervicales (C5-C7) bilateralmente para exponer las facetas laterales (figura 2A)21.
Nota: Ubicar la segunda vértebra torácica (T2) por encontrar el punto entre los omóplatos. Contar hacia arriba desde la vértebra T2 encontrar vértebra C721,22,23,24. - Estabilizar la columna vertebral de la rata usando un aparato estabilizador modificado. Hacer un corte en ambos lados del hueso vertebral lateral. Deslice los brazos de acero inoxidable por debajo de las facetas del proceso transversal expuesta y apriete los tornillos para garantizar la estabilidad (figura 2B).
- Retire con cuidado las láminas de C5-C7 (laminectomía, figura 2).
- Coloque un pedazo pequeño de gelfoam empapado de solución salina en la parte superior la duramadre expuesta para mantenerla hidratada (Figura 2D).
4. instalación de dos fotones (2P) proyección de imagen de ventana
- Pequeños trozos de materia de gelfoam en el boquete entre los músculos y los huesos vertebrales, también una línea delgada de gelfoam entre médula espinal y los huesos vertebrales de la materia, entonces utilice pegamento adhesivo tejido para sellar la zona músculo-hueso. Esperar 5 min para la sequedad completa (Figura 2E).
Nota: Este paso previene con eficacia el futuro sangrado dentro de la ventana y la filtración de soluciones de inmersión. - Preparar el agar al 4% con ddH2O en el microondas. Después de que el agar se disuelva completamente, espere hasta que vuelva a una temperatura tangible. Llene una jeringa estéril de 1 mL con solución de agar y pipa en el borde de la ventana para construir una pared (Figura 2E). La solución se solidifica rápidamente y se mantiene flexible para permitir que la lente u objetivo se mueva libremente.
- Cuando esté listo para la proyección de imagen, eliminar el líquido de inmersión de gelfoam y lugar dentro de la ventana para 2P proyección de imagen (figura 2F). Transferir el animal estabilizado dentro de la cámara oscura de 2 fotones microscopio y colocar la ventana de proyección de imagen de 2P directamente debajo de la lente. Baje cuidadosamente la lente en la ventana de imagen.
5. la inyección del primer colorante fluorescente y proyección de imagen de línea de base
- Preparar 0,5 mL de RHODAMINA B isotiocianato-dextrano (peso molecular promedio de 4 mg/mL ~ 70kDa) en solución salina. Llene una jeringa estéril de 1 mL con la solución y conecte la jeringa al catéter previamente instalado.
Nota: Preparar la solución colorante fluorescente antes de que se recomienda utilizar. - Inyectar el tinte primero presionando la jeringa muy lentamente (figura 3B). En primer lugar, utilice el ocular para identificar el área de interés. Utilizar una cámara de carga dispositivo acoplado (CCD) para adquirir una imagen de campo claro de los patrones de vasos sanguíneos superficiales en baja magnificación como imagen de referencia. Cambiar al modo escaneo láser abrir el 2P imaging software para la recogida de ambas imágenes y datos de barrido de línea.
- Seleccione la correcta P 2 laser excitación longitud de onda, potencia y fluorescente canal (canal rojo para el primer tinte) para que coincida con los fluoróforos en el tejido de la imagen y luego realizar en vivo la proyección de imagen (figura 3E). Mantener al animal en una almohadilla de calefacción durante todo el proceso.
6. C7 lesión contundente con dispositivo de LISA
- Realizar una herida de contusión C7 línea media usando un dispositivo del aparato de sistema de lesiones de Louisville (LISA) según un protocolo previamente establecido25,26.
- En Resumen, coloque el animal en el escenario de LISA después de calibración.
7. inyección de segundo colorante fluorescente y la proyección de imagen de la lesión
- 0,5 mL de fluoresceína isotiocianato-dextrano (4 mg/mL, peso molecular promedio ~ 70 kDa) se preparan en solución salina igual que en 5.1. Llene la solución en una jeringa estéril de 1 mL y conecte con el catéter previamente instalado.
- La espalda animal estabilizada dentro de la cámara oscura del microscopio 2P la transferencia y cambio de imagen la misma área con el canal rojo para el primer colorante y el canal verde para el segundo colorante (figuras 3D & G).
- Al final de la proyección de imagen, suelte la rata desde el dispositivo de estabilización espinal y limpiar la pared de agar.
8. animal sacrificio
- Después de la proyección de imagen, sacrificar la rata después de la perfusión de transcardial protocolo27. Recolectar las muestras de la médula espinal y fijarlos en el 4% PFA.
9. Análisis de datos offline: Cuantificación de diámetros de recipiente
- Transferir los archivos de imagen a una estación de trabajo para análisis fuera de línea.
- Abrir ImageJ y seleccione "archivo" y seleccione guardado previamente los datos en bruto y abra el archivo de imagen asociado (Figura 4B).
- Calibrar la imagen seleccionando "Analizar" seguido por "Set Scale" (figura 4). El valor en "La distancia en píxeles" es calculado utilizando la ecuación mostrada en la Figura 4A. La calibración de la lente óptica de 2 fotones determina el valor predeterminado en la ecuación. El valor de "opticalZoom" se encuentra en Excel Extensible Markup Languagefile (archivo XML) asociado con el archivo de imagen (Figura 4B).
- Trazar una línea perpendicular al eje longitudinal de la embarcación (figura 41 & E1) y seleccionar "Analizar" seguido por "Medida". La medida del diámetro del vaso se muestra en la ventana de resultados (figura 42 & E2). Repita 3 veces en toda la nave para adquirir el valor medio.
10. línea análisis de datos: Cuantificación de glóbulos rojos (RBC) velocidad de la célula
- Transferir los archivos de barrido de línea a la estación de trabajo para el análisis.
- Inicie el software ImageJ y seleccione "archivo" y seleccione guardado previamente los datos en bruto y abrir todos los archivos asociados de barrido de línea con el nombre de extensión ".ome".
- Abra "Imagen" y seleccione "Stacks" seguidos de "imágenes a la pila". Convertir todos los archivos de OME en un archivo del TIFF imagen pila.
- Iniciar Matlab software y haga clic en "Abrir", seleccione Archivo de código de "LSPIV_parallel.m". Nota: El código de Matlab para LS-PIV se puede descargar en https://sourceforge.net/projects/lspivsupplement/files/18
- Seleccione las órdenes siguientes: "Ejecutar" > "Cambiar carpeta" > "arteria". Elija el archivo del TIFF imagen pila generado en 10.3.
- Escriba "S" y presiona Enter.
- Poner un cursor a la izquierda y derecha de la imagen respectivamente, y el programa comienza a procesar los datos.
- Al final del programa, introducir 2 valores para calcular la lectura final: "valor de la conversión del pixel_meter" y "valor de conversión de tiempo de la exploración". Ambos pueden encontrarse en el archivo XML asociado con datos de línea de exploración. El valor final se expresa como la media y desviación estándar de la velocidad en las unidades de milímetro por segundo (m/s).
Resultados
El método es capaz de monitorizar en vivo dinámica espinal cambios vasculares en vasos individuales pre- y poste-traumática la médula espinal. En primer lugar, se instala un catéter a través de la vena yugular externa para proporcionar el acceso para las inyecciones subsiguientes colorante fluorescente (figura 1A-C, figura 3). En el segundo paso, se utiliza un aparato especializado para estabilizar la expuesta C5-C7 (figura 1-F, figura 2A-B). Este paso de estabilización puede eliminar artefactos de respiración y proporcionar proyección de imagen constante. Tras laminectomía (figura 2), el siguiente paso es la instalación de 2 P imagen ventana sobre C5-C7 (Figura 2D-F). Minimizar el tejido periférico sangrado alrededor de la ventana imagen columna vertebral es fundamental para la proyección de imagen vascular exitosa. El siguiente paso es inyectar colorante fluorescente de rodamina-dextran (rojo) vía el catéter ya mencionado hito y mapa de la red vascular como la línea de base (Figura 3A-B, E). Después de lesión contundente de la línea media de C7 con severidad, FITC-los dextranos (verde) se introduce en los puntos de tiempo deseado después de la lesión (Figura 3A & D). La belleza del método duo-color es que uno todavía puede detectar la estructura vascular utilizando el tinte de segundo cuando el primer tinte ya ha filtrado hacia fuera en parénquima debido a la lesión (figura 3).
Durante la sesión de imágenes es recomendable para mantener el animal en un cojín de calefacción para mantener la temperatura del cuerpo después de la inducción de la anestesia.
Utilizando nuestro método de duo-color, la velocity de diámetro y glóbulos rojos (RBC velocidad) de embarcaciones individuales puede ser medido y calculado. De diámetro, uno puede utilizar ImageJ para medir el buque en su diámetro más grande para 3 repeticiones después de la calibración (figura 4). Para velocidad, imágenes de barrido de línea se miden utilizando el programa de Matlab (MATLAB R2013a) para calcular la velocidad (figura 5) RBC del18. Basado en el diámetro del vaso, morfología y velocidad del flujo de sangre, los vasos se pueden clasificar en 2 categorías: arteria y vena (ver tabla 1).
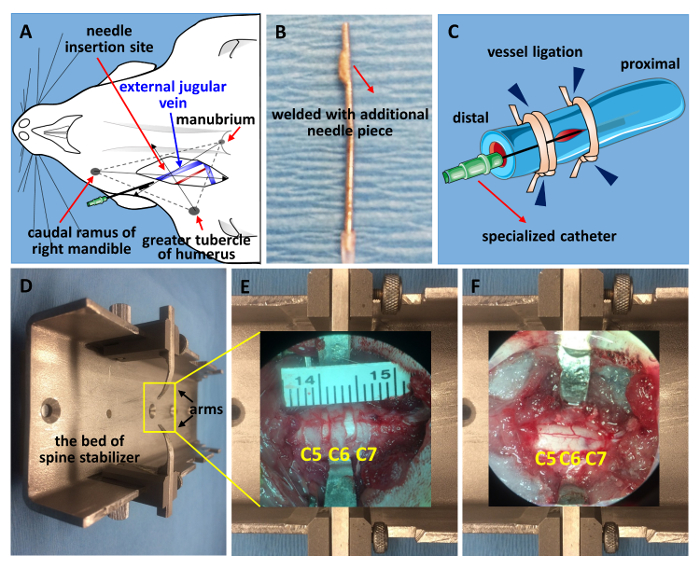
Figura 1 . Vena yugular estabilización de cateterización y la columna vertebral.
(A) un dibujo esquemático para localizar la vena yugular externa. (B) el catéter especializado de una aguja de calibre 21. La punta era tierra plana y soldada con autógena con un trozo de punta de 2 milímetros de otra aguja de calibre 21. (C) un diagrama esquemático de la cateterización. El extremo distal está ligado en primer lugar, seguido por estabilización del catéter proximal, terminando con la fijación de la aguja junto con el buque (ligadura de vasos, puntas de flecha azul). (D) una imagen del estabilizador de la columna modificado. Aparecerá una ventana de C5-C7 antes laminectomía (E) y después de laminectomy y contundente SCI (F) . Haga clic aquí para ver una versión más grande de esta figura.
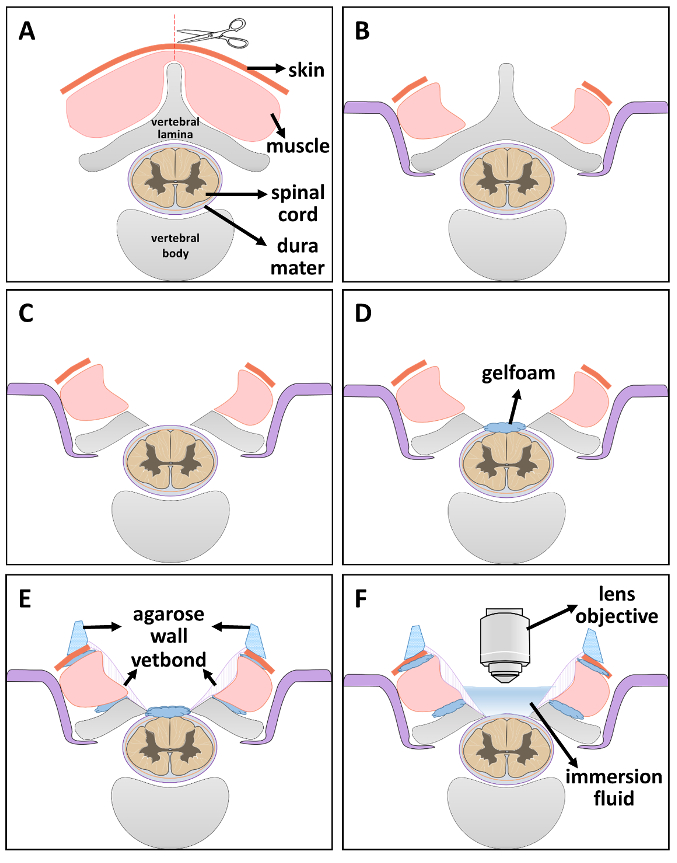
Figura 2 . Diagrama esquemático de la instalación de la ventana óptica paso a paso.
(A) paso 1: exponer la vértebra por corte de piel y músculo a lo largo de la línea media. (B) paso 2: estabilización de la columna vertebral. (C) paso 3: laminectomía. (D) paso 4: mantener la humedad de la médula espinal mediante la colocación de una pieza de gelfoam empapado de solución salina. (E) paso 5: sellar las brechas con estéril gelfoam y vetbond. Después del secado, una capa de agar pared está construida sobre el borde de la ventana. (F) paso 6: cuando esté listo para la proyección de imagen, eliminar el líquido de inmersión gelfoam y lugar interior P 2 ventana de imagen. Haga clic aquí para ver una versión más grande de esta figura.
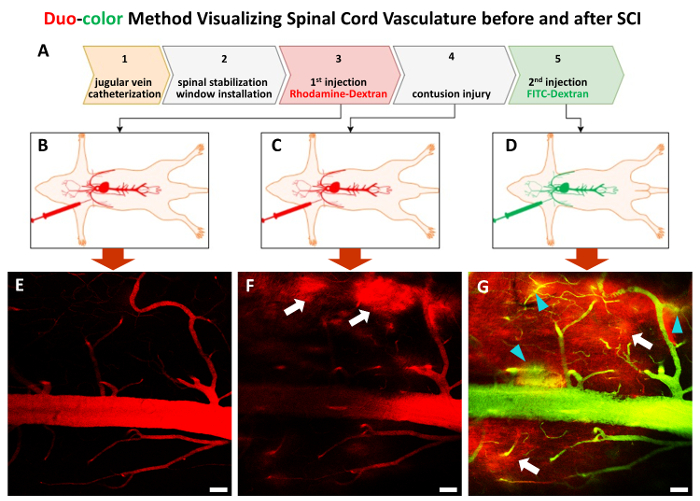
Figura 3 . La en vivo procedimiento de método duo-color paso a paso.
El procedimiento consiste en 5 pasos (A). Siguiendo el paso 1 y paso 2, un par de marcadores de dextrano con un tamaño de aproximadamente 70 KDa son inyectado en secuencia para etiquetar la vasculatura de la médula espinal antes de (B y C) y después de la contundente SCI (D). (E)-(G) imágenes representativas 2P Mostrar la vasculatura de la médula espinal en el paso 3 al paso 5. Flechas blancas señalan colorante rojo de la primera ola que áreas (F y G), puntas de flecha turquesa Mostrar la salida de la segunda ola el tinte verde (G). Barra de escala = 50 μm. haga clic aquí para ver una versión más grande de esta figura.
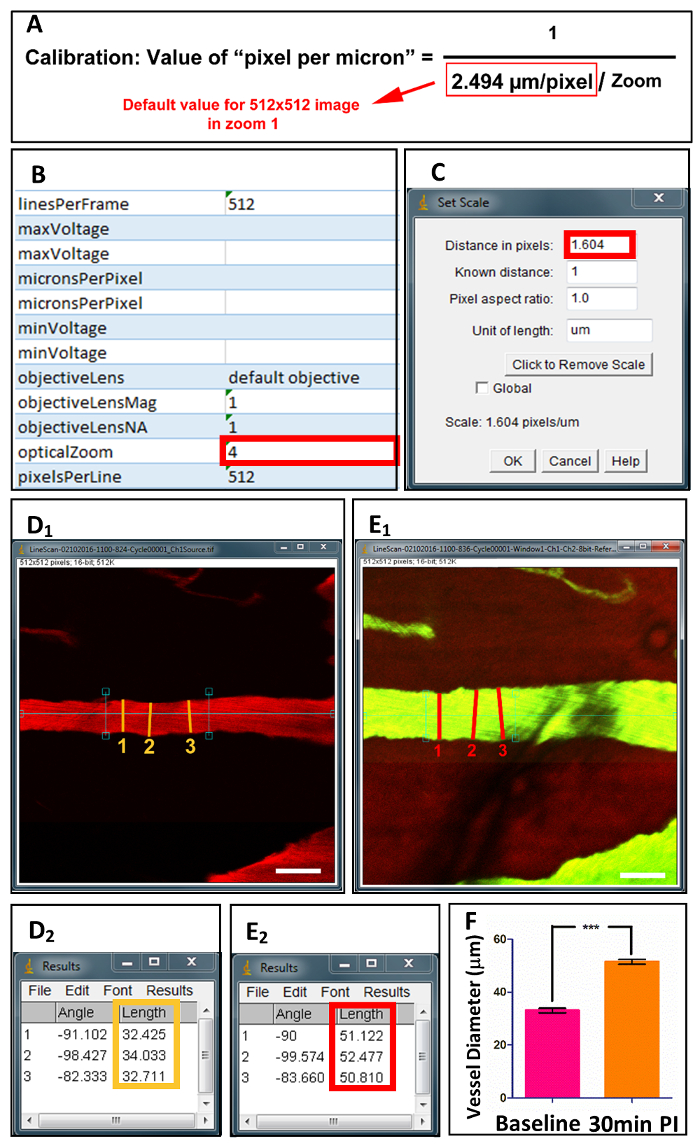
Figura 4 . Adquisición y cuantificación de diámetros de vasos espinales.
Después de la preparación, archivos de imagen solo se adquieren bajo microscopia de P 2, junto con archivos XML de los valores calibrados (B). (A) la ecuación muestra el cálculo de "pixel por micrones", basada en valores de zoom óptico. Después de la calibración en ImageJ (C), diámetros de recipiente se miden en 3 puntos en el eje longitudinal antes de (D1) y después (E1) lesiones. (D2) y (E2) muestra los valores medidos. (F) cuantificación de diámetros de recipiente al inicio y 30 minutos después de la lesión. Barra de escala = 50 μm. los datos se muestran como media ± SD, *** p < 0.0001, pruebas de t pareadas de dos colas.Haga clic aquí para ver una versión más grande de esta figura.
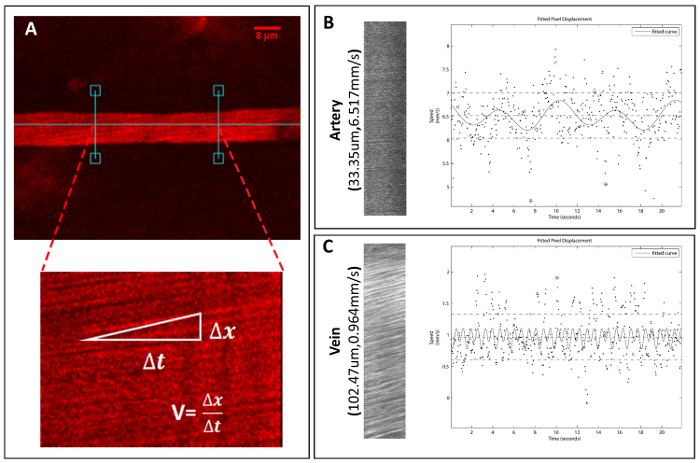
Figura 5 . Adquisición y cuantificación de la velocidad del buque espinal.
Archivos de imagen de barrido de línea se adquieren bajo microscopia de P 2 para calcular velocidades vaso único. (A) un ejemplo de un método para evaluar la velocidad de los vasos sanguíneos RBC y vaso seleccionado. (B) un ejemplo arterial de imagen de barrido de línea y el archivo de trama correspondientes para el cálculo de la velocidad, así como un ejemplo de una vena (C). Haga clic aquí para ver una versión más grande de esta figura.
| Arteria | Vena | |
| Morfología | Pared del vaso recto, liso, grueso | Ramas, asperezas |
| Velocidad del flujo de sangre | Rápido | Lento pero varía |
| Diámetro | 30-80 μm | 100-250 μm |
Tabla 1: Criterios para la identificación de tipos de buque
Discusión
Un reto para los estudios vasculares después de SCI es la limitación técnica porque las técnicas tradicionales se limita en gran medida a cambios en la estructura vascular en muestras post mortem. Esta novela en vivo imagen método descrito anteriormente permite medición dinámica del flujo sanguíneo y relacionados con parámetros (velocidad y vaso diámetro) 2P-LSM en ratas vivas. También permite la examinación repetida en los mismos conjuntos de vasos en diferentes puntos temporales tras contundente SCI. Anteriores técnicas de imagen de 2 fotones microscopía fueron incapaces de captar estructuras vasculares post traumas debido a la salida de un solo palpador. Nuestro diseño duo-color permite proyección de imagen vascular dinámico para modelos traumáticos. Además, la flexibilidad de este método proporciona una oportunidad para generar un perfil temporal-espacial de los cambios vasculares agudos después de la médula espinal.
Hay varios pasos críticos en nuestra en vivo duo-color método de imagen. En primer lugar, es fundamental para asegurar la estabilidad física de antes de la proyección de imagen de Time-lapse, particularmente reduciendo artefactos de movimiento respiratorio de la médula espinal. Diseñamos la forma de abrazaderas espinales para elevar la altura de la vértebra espinal ligeramente durante la estabilización. Así el movimiento de la médula espinal correlacionar a los animales de respiración puede ser reducido considerablemente (figura 1-F, 2B). Se recomienda comprobar la estabilidad de la médula espinal antes del comienzo de cada sesión de imagen. Si la médula espinal no puede conseguir la estabilidad, el ajuste debe hacerse a la alineación y apriete de las abrazaderas de la médula espinal. En segundo lugar, periférico tejido (hueso, capa de músculo y piel) sangrado en la ventana de imagen podría el riesgo de contaminación de la vista. Para una sesión suave de imágenes, gelfoam y tejido pegamento adhesivo debe aplicarse a los tejidos circundantes para la prevención eficaz. En tercer lugar, los tintes fluorescentes que elegimos tienen un tamaño similar como la albúmina (66 kDa), que es la proteína del plasma sanguíneo principal alto peso molecular. En condiciones homeostáticas, los tintes se conservaron en gran parte dentro de la nave similar como albúmina28. Después de la lesión, los tintes pasan por la estructura endotelial interrumpida y se filtraron en la parenquimia, causando una significativa mayor intensidad fluorescente en el área periférica de la vasculatura (figura 3F-G). Además, hay dos razones por qué elegimos la cateterización de la vena yugular externa. En primer lugar, puede proporcionar una ruta accesible sistemáticamente de la entrega en cualquier momento del experimento. En segundo lugar, puede utilizarse como una vía para la inyección de tratamiento futuro.
Aunque nuestro método en vivo duo-color es capaz de proporcionar un nuevo lugar para estudios de proyección de imagen vasculares traumáticos, es necesario abordar algunas advertencias con respecto a esta técnica. Actualmente, esta técnica está diseñada para evaluar los cambios vasculares en 2 puntos del tiempo (línea de base y 1 punto de tiempo posterior a la lesión), pero es factible cambiar a varios puntos de tiempo si se dispone de canales y tintes fluorescentes adicionales. Aunque hay varios estudios con ventana de vidrio implantado crónica imagen intravital, ninguno de ellos puede proporcionar información de base sobre el mismo buque después de lesión traumática19,29,30, 31,32. A diferencia de estos estudios, nuestra ventana es una ventana de cristal no. Esto es conveniente para la proyección de imagen previa y posterior a la lesión, pero puede ser un reto para el restablecimiento de la ventana para la observación a largo plazo. Nuestras futuras investigaciones está trabajando en la mejora técnica de proyección de imagen de crónica. El sistema vascular se compone de varios tipos de vasos (arteria, vena y capilar) y cada uno es diferente en los aspectos de la morfología y función. Diferenciación entre tipos de buque durante proyección de imagen podría ayudar a provocar un claro patrón de cambios vasculares. El protocolo de arriba depende el observador identificar los vasos basados en morfología y velocidad; sin embargo, un colorante específico de la arteria puede añadirse fácilmente a dar una clasificación más definitiva entre buque tipo33.
Esta técnica es no sólo limitada a evaluaciones en contundente y otros modelos traumáticas, lesión del agolpamiento y lesión por radiación, pero también en estudios centrados en la interrupción de la BSCB, permeabilidad vascular así como cambia. Además de SCI, podría ser utilizado para el estudio de los cambios vasculares siguiendo otras enfermedades neurodegenerativas como la esclerosis lateral amiotrófica (ELA) y esclerosis múltiple (EM). Además, podría ser transferible a un modelo animal transgénico para el estudio de la interacción dinámica neurovascular. Como una herramienta de detección de gran alcance, futuros estudios podrían utilizar la técnica descrita aquí para evaluar la eficacia del tratamiento para la lesión de la médula espinal.
En conclusión, en vivo duo-color método es una herramienta de acercamiento confiable y en tiempo real, en vivo para la evaluación dinámicos cambios vasculares, que es ideal para la caracterización del perfil vascular temporal espacial y detección de tratamientos a reducir los daños secundarios después de la médula espinal.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado en parte por NIH NS059622, NS073636, DOD CDMRP W81XWH-12-1-0562, mérito de premio I01 BX002356 del Departamento de Asuntos Veteranos de Estados Unidos, Craig H Neilsen Fundación 296749, Indiana de la médula espinal y cerebro lesiones Research Foundation ( ISCBIRF) del Estado Departamento de salud de Indiana (019919) y Mari Hulman George fondos de dotación.
Materiales
| Name | Company | Catalog Number | Comments |
| Purdue Products Betadine Surgical Scrub | Fisher Scientific | 19-027132 | Skin sterilization |
| Ketamine (87.7 mg/kg)/Xylazine (12.3 mg/kg) | Patterson Veterinary | 07-881-9413, 07-890-5745 | Anesthetic agent |
| Buprenorphine(0.03 mg/mL) | Patterson Veterinary | 07-891-9756 | Pain relief agent |
| Carprofen | Patterson Veterinary | 07-844-7425 | Non-steroidal anti-inflammatory drug |
| Dukal Gauze Sponges | Fisher Scientific | 22-415-490 | Skin sterilization |
| Decon Ethanol 200 Proof | Fisher Scientific | 04-355-450 | Skin sterilization |
| Artificial Tears Eye Ointment | Webster Veterinary | 07-870-5261 | Prevent drying eyes |
| Cotton Tipped Applicators | Fisher Scientific | 1006015 | |
| Rhodamine B isothiocyanate–Dextran | Sigma-Aldrich | R9379 | Average mol wt 70kDa |
| Fluorescein isothiocyanate–dextran | Sigma-Aldrich | 46945 | Average mol wt 70kDa |
| Instrument Sterilizer | Fine Science Tools | 18000-50 | for sterilizing surgery tool |
| Spine stabilizer set | Custom Manufactured from Norton Neuroscience Institute | Contact Y. Ping Zhang for details. (yipingzhang50@gmail.com) | |
| Vetbond | 3M Animal Care Products | 1469SB | Tissue adhesive Glue |
| Gelfoam | Henry Schein | 9083300 | Stop bleeding |
| Noyes Spring Scissors | F.S.T | 15013-12 | |
| Fine Forceps- Dumont #5 | F.S.T | 11254-20 | |
| Rongeur | Fine Science Tools | 16021-14 | laminectomy |
| Surgical Retractor | Fine Science Tools | 17005-04 | |
| Scalpel | Fine Science Tools | 10003-12 | skin cut |
| Scalpel Blade #15 | Royal-Tek | BS2982 | skin cut |
| micro angled scissors | World Precision Instruments | 500260 | Can be from any vendor |
| 3-0 vicryl sutures | Ethicon | J393H | Can be from any vendor |
| Silk Black Braided Non-Absorbable Suture, 3-0, C-7, Reverse Cutting, 18" | LOOK | 786 | Can be from any vendor |
| 1 ml syringe | Henke Sass Wolf | 4010.200.V0 | Can be from any vendor |
| 21 gauge needle | BD | 305165 | Can be from any vendor |
| Agar | Sigma-Aldrich | A1296 | Can be from any vendor |
| Two-photon Laser Scanning Microscope | Bruker Fluorescence Microscopy | ||
| LISA device | Custom Manufactured from Norton Neuroscience Institute | Contact Y. Ping Zhang for details. (yipingzhang50@gmail.com) | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| HCImage Live | Hamamatsu Corporation | Imaging software | |
| PrairieView | Prairie Technologies/Bruker | Two-photon imaging software | |
| ImageJ | Image analysis software | ||
| Matlab statistics toolbox | The MathWorks, Inc. | https://www.mathworks.com/products/statistics.html?s_tid=srchtitle | Image analysis software |
Referencias
- National Spinal Cord Injury Statistical Center. Spinal Cord Injury Facts and Figures at a Glance. SCI Data Sheet 2016. , (2016).
- Dumont, R. J., et al. Acute spinal cord injury, part I: pathophysiologic mechanisms. Clin Neuropharmacol. 24 (5), 254-264 (2001).
- Beattie, M. S., Farooqui, A. A., Bresnahan, J. C. Review of current evidence for apoptosis after spinal cord injury. J Neurotrauma. 17 (10), 915-925 (2000).
- Liu, N. K., et al. A novel role of phospholipase A2 in mediating spinal cord secondary injury. Ann Neurol. 59 (4), 606-619 (2006).
- Wu, X., Xu, X. M. RhoA/Rho kinase in spinal cord injury. Neural Regen Res. 11 (1), 23-27 (2016).
- Li, X. G., et al. Combination of methylprednisolone and rosiglitazone promotes recovery of neurological function after spinal cord injury. Neural Regen Res. 11 (10), 1678-1684 (2016).
- Kulkarni, M. V., et al. Acute spinal cord injury: MR imaging at 1.5. T. Radiology. 164 (3), 837-843 (1987).
- Tator, C. H., Koyanagi, I. Vascular mechanisms in the pathophysiology of human spinal cord injury. J Neurosurg. 86 (3), 483-492 (1997).
- Kobrine, A. I., Doyle, T. F., Martins, A. N. Spinal cord blood flow in the rhesus monkey by the hydrogen clearance method. Surg Neurol. 2 (3), 197-200 (1974).
- Rivlin, A. S., Tator, C. H. Regional spinal cord blood flow in rats after severe cord trauma. J Neurosurg. 49 (6), 844-853 (1978).
- Koyanagi, I., Tator, C. H., Theriault, E. Silicone rubber microangiography of acute spinal cord injury in the rat. Neurosurgery. 32 (2), 260-268 (1993).
- Noble, L. J., Wrathall, J. R. Correlative analyses of lesion development and functional status after graded spinal cord contusive injuries in the rat. Exp Neurol. 103 (1), 34-40 (1989).
- Maikos, J. T., Shreiber, D. I. Immediate damage to the blood-spinal cord barrier due to mechanical trauma. J Neurotrauma. 24 (3), 492-507 (2007).
- Tei, R., Kaido, T., Nakase, H., Sakaki, T. Secondary spinal cord hypoperfusion of circumscribed areas after injury in rats. Neurol Res. 27 (4), 403-408 (2005).
- Cohen, D. M., et al. Blood-spinal cord barrier permeability in experimental spinal cord injury: dynamic contrast-enhanced MRI. NMR Biomed. 22 (3), 332-341 (2009).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extend arteriole capacity. Proc Natl Acad Sci U S A. 108 (20), 8473-8478 (2011).
- Schaffer, C. B., et al. Two-photon imaging of cortical surface microvessels reveals a robust redistribution in blood flow after vascular occlusion. PLoS Biol. 4 (2), e22 (2006).
- Kim, T. N., et al. Line-scanning particle image velocimetry: an optical approach for quantifying a wide range of blood flow speeds in live animals. PLoS One. 7 (6), e38590 (2012).
- Tang, P., et al. In vivo two-photon imaging of axonal dieback, blood flow, and calcium influx with methylprednisolone therapy after spinal cord injury. Sci Rep. 5, 9691 (2015).
- Thrivikraman, K. V., Huot, R. L., Plotsky, P. M. Jugular vein catheterization for repeated blood sampling in the unrestrained conscious rat. Brain Res Brain Res Protoc. 10 (2), 84-94 (2002).
- Walker, M. J., et al. A novel vertebral stabilization method for producing contusive spinal cord injury. J Vis Exp. (95), e50149 (2015).
- Anderson, K. D., Sharp, K. G., Steward, O. Bilateral cervical contusion spinal cord injury in rats. Exp Neurol. 220 (1), 9-22 (2009).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. J Vis Exp. (78), (2013).
- Lepore, A. C. Intraspinal cell transplantation for targeting cervical ventral horn in amyotrophic lateral sclerosis and traumatic spinal cord injury. J Vis Exp. (55), (2011).
- Zhang, Y. P., et al. Spinal cord contusion based on precise vertebral stabilization and tissue displacement measured by combined assessment to discriminate small functional differences. J Neurotrauma. 25 (10), 1227-1240 (2008).
- Wu, X., et al. A Tissue Displacement-based Contusive Spinal Cord Injury Model in Mice. J Vis Exp. (124), (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- Egawa, G., et al. Intravital analysis of vascular permeability in mice using two-photon microscopy. Sci Rep. 3, 1932 (2013).
- Farrar, M. J., et al. Chronic in vivo imaging in the mouse spinal cord using an implanted chamber. Nat Methods. 9 (3), 297-302 (2012).
- Evans, T. A., Barkauskas, D. S., Myers, J. T., Huang, A. Y. Intravital imaging of axonal interactions with microglia and macrophages in a mouse dorsal column crush injury. J Vis Exp. (93), e52228 (2014).
- Davalos, D., Akassoglou, K. In vivo imaging of the mouse spinal cord using two-photon microscopy. J Vis Exp. (59), e2760 (2012).
- Davalos, D., et al. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169 (1), 1-7 (2008).
- Shen, Z., Lu, Z., Chhatbar, P. Y., O'Herron, P., Kara, P. An artery-specific fluorescent dye for studying neurovascular coupling. Nat Methods. 9 (3), 273-276 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados