Method Article
3D ultraestructura mitocondrial del músculo de vuelo indirecto de Drosophila revelado por tomografía electrónica serie-sección
En este artículo
Resumen
En este protocolo, demostramos la aplicación de la tomografía electrónica serie-sección para dilucidar la estructura mitocondrial en músculo de vuelo indirecto de Drosophila .
Resumen
Las mitocondrias son las principales compañías celulares que producen ATP, lípidos y metabolitos, así como regulan el calcio homeostasis y muerte celular. La ultraestructura de la única rica en cristae doble membrana de este orgánulo se arregla elegante para llevar a cabo funciones múltiples dividiendo biomoléculas. La ultraestructura mitocondrial está íntimamente ligada con varias funciones; sin embargo, los detalles de estas relaciones de estructura y función están sólo empezando a describir. Aquí, demostramos la aplicación de la tomografía electrónica serie-sección para dilucidar la estructura mitocondrial en músculo de vuelo indirecto de Drosophila . Tomografía electrónica serie-sección puede adaptarse a cualquier estructura celular en tres dimensiones de estudio.
Introducción
La microscopia electrónica es una herramienta valiosa para estudiar el contexto estructural de organelos que llevan a cabo procesos celulares y subcelulares asambleas. Se han desarrollado métodos para preservar la ultraestructura de tejidos o células, ya sea por fijación química con aldehídos o por alta presión (HPF) de congelación seguida de congelación de sustitución (FS)1,2. Los bloques integrados muestra luego se ser seccionados, manchados y observados con un microscopio electrónico de transmisión (TEM). La muestra de HPF también podría ser procesada bajo condición de crio, como dividiendo el cryo o por la viga de ion enfocada (FIB) fresado y observados por cryo-EM3,4.
Aunque EM de la fino-sección proporciona penetraciones morfológicas informativos, las imágenes 2D sólo pueden revelar la ultraestructura de una sección particular. Cómo se organiza la ultraestructura en un volumen 3D sigue siendo obscured. Para poder visualizar la ultraestructura celular en tres dimensiones, un método de tomografía electrónica fue desarrollado donde serie de imágenes de inclinación se adquirió nuevo proyecta para generar una reconstrucción tomográfica5 (figura 1). Puede recoger una serie de doble inclinación girando la muestra 90° y adquisición de una segunda serie de inclinación. Esto minimizará la cuña que faltan artefactos que resultan de ángulos limitado muestreo y mejoran la resolución de la tomografía de tórax.
Aquí, describimos el uso de tomografía electrónica serie-sección para el estudio de la ultraestructura mitocondrial de Drosophila vuelo indirecto músculo (IFM)6,7,8,9 . Para obtener reconstrucciones 3D que cubre todas mitocondrias (aproximadamente 2.5 μm de espesor), se obtuvieron las secciones seriales de bloques de tejido IFM de Drosophila . Los tomogramas de cada sección se colectaron individualmente usando software de recopilación automática de datos. Reconstrucciones tomográficas fueron generadas y los tomogramas serie se unieron con el paquete IMOD para obtener un volumen reconstruido de una mitocondria entera. Los tomogramas se unieron fueron analizados mediante software 3D. Las densidades de los cristae mitocondriales fueron segmentadas para generar un modelo de segmentación que reveló la organización en tres dimensiones.
Protocolo
1. sección tejidos de Drosophila mediante un microtomo de cuchilla vibrante
- Anestesiar de Drosophila en el hielo y sumergir cada mosca solo en 1 mL de agarosa fusión baja del 4% en tampón fosfato. Permita que la agarosa se solidifique en el hielo. Por lo general, 4-6 moscas fueron procesados.
- Utilice un microtomo de cuchilla vibrante sección de gel de agarosa incrustado Drosophila en rebanadas con 100 μm de grosor y sumerja en solución de fijador que contiene glutaraldehído al 2,5% en tampón fosfato de 0,1 M.
Nota: Vibratome seccionamiento es preferido porque la arquitectura del tejido se mantiene más intacta en comparación con otros métodos. Por otra parte, pinzas de disección permite diseccionar IFM en la solución fijadora que contiene glutaraldehído al 2,5% en tampón fosfato de 0,1 M.
2. preparar muestras de EM por el método de sustitución (HPF/FS) congelación y congelación de alta presión
- Lávese las secciones de tejido en 3 gotas (~ 150 μL) de tampón de fosfato, seguida de 2 gotas (~ 100 μL) de solución tampón fosfato con 20% de BSA. Coloque las secciones en portadores de oro para HPF con tampón y 20% BSA.
- Carga de la muestra que contiene portadores en un congelador de alta presión según el manual del usuario.
- Después de la congelación, portadores del titular bajo nitrógeno líquido de liberación y transferencia a un dispositivo de sustitución de congelación enfriado a-140 ° C.
- Realizar el protocolo de congelación de sustitución como se muestra en la tabla 1, con el coctel que contiene glutaraldehído al 2%, tetróxido de osmio 2% y 0,1% acetato de uranilo en acetona de FS.
- Con cuidado retire a los ejemplares de los portadores con una aguja e incrustar a las muestras en resina a temperatura ambiente. Polimerizar la resina a 65 ° C por 16 h.
Nota: Protocolos de FS deben ser modificados para preparar otros tipos de muestras. HPF/FS se prefiere preservar la ultraestructura y minimizar la pérdida de contenido celular.- Como alternativa, aplicar un protocolo de fijación química. Fijar a las muestras con glutaraldehído al 2,5% durante la noche, lavado con tampones y luego fijar con tetróxido de osmio 1% para 2 h. lavado y deshidratar con concentraciones de etanol de ascendente entonces infiltrarse e incrustar a las muestras en resina de Spurr antes de polimerizar a 65 ° C para 16 h.
3. prepare la serie-secciones de los especímenes para tomografía de electrones
- Corte los bloques de la muestra para exponer la cara deseada del bloque que contiene el tejido.
- Trate previamente las partículas de oro (10 nm de diámetro) con 1% de BSA durante 30 minutos lavado y suspender partículas de oro en tampón PBS. Superposición de partículas de oro en rejillas de ranura cobre revestidas con película de carbón para crear marcadores de referencia.
- Compruebe en el TEM para tener suficientes marcadores fiduciales (marcadores de al menos 5-10) en el campo de visión de la adquisición de la tomografía.
- Corte las secciones seriales, 200-250 nm de espesor, utilizando un ultramicrótomo.
- Recoger las secciones seriales en rejillas de ranura con un lazo perfecto para secciones delgadas.
- Mancha de las secciones con citrato de plomo de Reynold durante 10 minutos.
- Superponer una segunda capa de partículas de oro Fiduciario en la parte superior de las secciones.
4. recoger la tomografía electrónica de doble inclinación
- Carga la rejilla sobre un soporte de doble eje tomografía e inserte en el microscopio electrónico de transmisión operando a 200 kV.
- Alinee el microscopio en el foco de eucentric.
- Configurar el software de colección automática de datos. Ajustar y alinear el haz de electrones en el ajuste de proyección de imagen de múltiples escalas. Consulte el manual de usuario para detalles de la operación10 (figura 2).
- Adquirir referencias oscuras y brillantes de la cámara en un área vacía sin película de carbono bajo la configuración de la colección de tomografía.
- Recoger un atlas de rejilla en la ampliación baja. Seleccione las mitocondrias en las secciones seriales como objetivos para la recogida de la tomografía.
- Adquirir una serie de inclinación de-60 ° a + 60 ° con incrementos de 2 ° en eje-A para cada destino.
Nota: Los ángulos de inclinación se va limitados mecánicamente por el diseño de las mordazas. El titular de bloquear el haz en los ángulos de inclinación alta. - Para recoger la segunda serie de inclinación, girar el soporte de la muestra 90°. Adquirir un nuevo atlas. Seleccionar la posición correspondiente y adquirir la serie de inclinación en el eje B de cada destino.
Nota: Otros paquetes de software, tales como SerialEM y Xplore3D, están disponibles para la colección automática de datos.
5. reconstruir los tomogramas 3D y sub-volúmenes segmento utilizando el Software
- Reconstruir los tomogramas de imágenes de inclinación de doble eje con IMOD software11.
- Refiérase al manual de usuario para más detalles de la operación.
- Alinee la serie de inclinación individual por las posiciones de oro marcadores fiduciales. Reconstruir los tomogramas por el método de proyección hacia atrás o por el método de la técnica de reconstrucción iterativa simultánea (RIS) para ambos ejes-A y eje-B, respectivamente (figura 3).
- Combinan los tomogramas de ejes A y B de eje para generar un tomograma doble inclinación con menor falta artefacto de cuña.
- Se unen los tomogramas doble inclinación de secciones seriadas para obtener reconstrucciones que cubre el volumen de la mitocondria entera. Modelo de las brechas entre las secciones seriales el programa IMOD.
- Recortar los tomogramas se unieron y bin a un tamaño deseado para la segmentación de volumen.
- Analizar se unió a los tomogramas seriales software de 3D.
- Refiérase al manual de usuario para más detalles de la operación.
- Los tomogramas con un filtro gaussiano (u otro método deseado) para mejorar el contraste de características y reducir las densidades de fondo del filtro.
- Segmento de la ultraestructura de las mitocondrias ya sea manualmente o automáticamente.
- Mostrar modelos de segmentación para permitir la inspección en 3D.
- Generar películas utilizando herramientas disponibles en 3D.
Resultados
Aplicamos la tomografía electrónica serie-sección para analizar las características estructurales de los cristae mitocondriales que refleja su estado energético y el envejecimiento. Hemos demostrado que las mitocondrias de Drosophila IFM forman integrada cristae y matriz de la red en 3D (figura 4)7. Además, moscas mutantes con un fenotipo de envejecimiento acelerado y defecto de replicación de ADN mitocondrial acumulan mitocondrias que contienen subsecciones de cebolla-como remolino núcleo (figura 5)7.
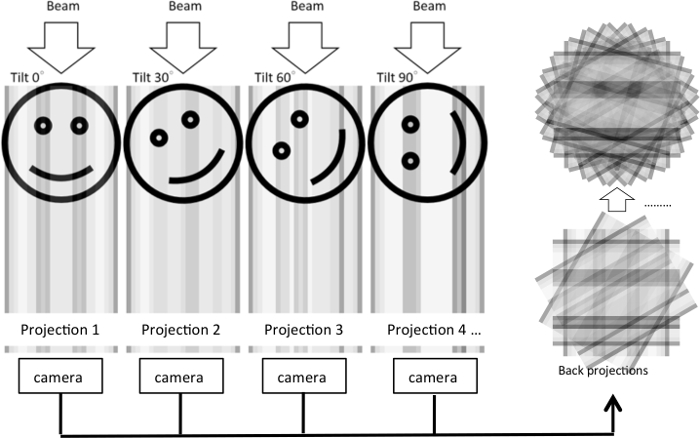
Figura 1: ilustración de reconstrucción de la tomografía de electrones de una serie de inclinación. En el experimento, un haz de electrones pasa a través de un objeto en 3D como el objeto se inclina a los varios grados. Para cada condición de inclinación, una proyección 2D es generada y capturada con una cámara. Las proyecciones 2D luego se proyectan hacia atrás para reconstruir el objeto en 3D basado en el teorema central de la rebanada. El mismo proceso se muestra en la ilustración, una imagen 2D original que se proyecta en una sola dimensión bajo diferentes ángulos de inclinación. Las proyecciones de 1D se utilizan para reconstruir la imagen 2D. Haga clic aquí para ver una versión más grande de esta figura.
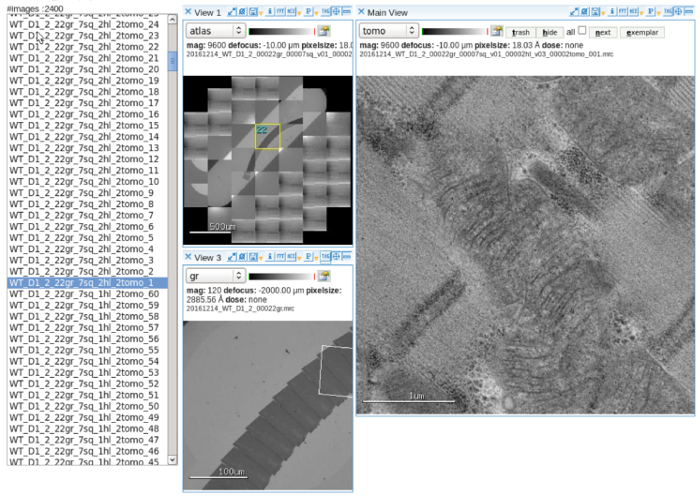
Figura 2: colección automática de datos. Una pantalla de visor de imagen de software que muestra el atlas de una cuadrícula de ranura que contiene secciones seriales, multi-escala targeting de mitocondrias y adquirió inclinación imágenes. Barra de escala = (panel superior izquierdo) de 500 μm, 100 μm (panel inferior izquierdo), 1 μm (panel derecho). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Sección serie electrón la tomografía de una sola mitocondria en músculo de vuelo indirecto de Drosophila . Imágenes 2D (A) y (B) los tomogramas 3D de secciones seriadas que cubre todo el volumen de una mitocondria. (C) la sección de serie se unió a los tomogramas se proyectan para crear una sección longitudinal, con el eje z que se muestra verticalmente. En particular, tejido seccionado condujo a la pérdida de material, dejando huecos entre los tomogramas se unió a. Barra de escala = 500 nm. Haga clic aquí para ver una versión más grande de esta figura.
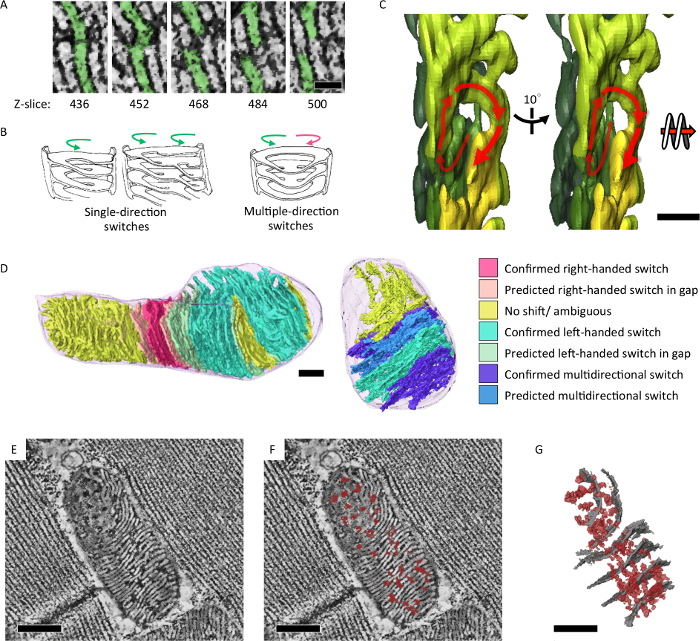
Figura 4: cristae intra-mitocondrias y red matriz revelada en 3D integrados. (A) láminas de reconstrucciones tomográficas de electrones mitocondrial mostrando los interruptores entre membranas laminares a través del eje z. (B) las ilustraciones de los cristae observado patrones de espirales de la derecha manos y zurdos de la conmutación. (C) segmentación tomográfica ilustrando una espiral zurda en 3D Cristae (D) cambio de los patrones fueron analizados y color representa en el modelo de segmentación (E, F). Slice tomográfico mostrando lateral matriz confluencia (densidades oscuras, marcado en rojo) a través de membranas cristae (densidades de blanco). Segmentación (G) modelo de la tomografía en (E) muestra la confluencia de matriz lateral (en rojo) y representante cristae (en gris). Barra de escala = 50 nm (A), 200 nanómetro (C) y 300 nm (D, E, F, G). La figura fue la reimpresión de Jiang et al. 7 por favor haga clic aquí para ver una versión más grande de esta figura.
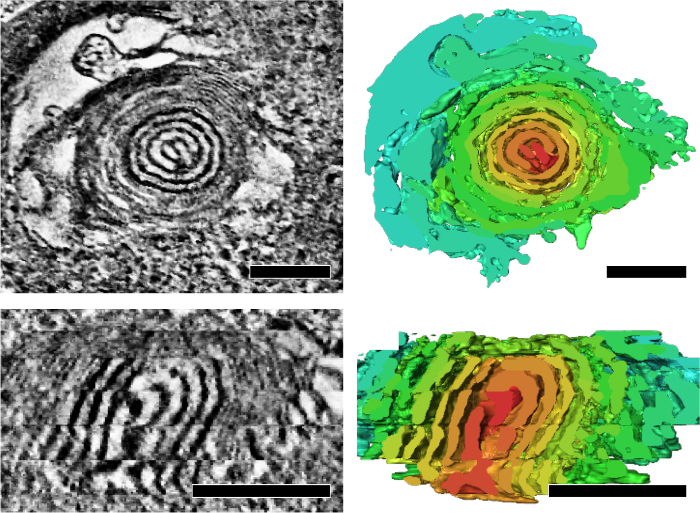
Figura 5: las mitocondrias con corazones que remolinan de cebolla-como acumularon en moscas con defectos mitocondriales de la replicación del ADN durante el envejecimiento. Representante cortes tomográficos y la segmentación correspondiente (paneles de la derecha) que muestra una vista transversal (arriba) y una vista de sección longitudinal (abajo) de un núcleo de remolino. Segmentación de volumen está indicado por la representación de color arbitrario para resaltar la base Remolina. Barra de escala: 200 nm. La figura fue la reimpresión de Jiang et al. 7 por favor haga clic aquí para ver una versión más grande de esta figura.
| Paso | Temp | Tiempo | Solución | |||
| 1 | -140 ° C a 0-9 ° C | 30 min | Nitrógeno líquido | |||
| 2 | -90 ° C | 96 horas | Cóctel de FS | |||
| 3 | -90 ° C a-60 ° C | 6 h (5 ° C) | Cóctel de FS | |||
| 4 | -60 ° C | 12 hr | Cóctel de FS | |||
| 5 | -60 ° C a-25 ° C | 7 h (5 ° C) | Cóctel de FS | |||
| 6 | -25 ° C | 12 hr | Cóctel de FS | |||
| 7 | -25 ° C a 0 ° C | 5 h (5 ° C) | Cóctel de FS | |||
| 8 | 0 ° C | 1 hr x 3 veces | Acetona | |||
| 9 | A la temperatura ambiente | Infiltración de resina | ||||
Tabla 1: Protocolo de congelación de-sustitución.
Discusión
En este protocolo, se describe un flujo de trabajo optimizado para la aplicación de la tomografía electrónica serie-sección para estudiar 3D ultraestructura mitocondrial del músculo de vuelo indirecto de Drosophila . Preservación de la ultraestructura de la muestra es el principal desafío técnico para este tipo de análisis. Para mejor preservar ultraestructura dos metodológicos incluyeron los pasos. En primer lugar, tejido fue muestreado por el seccionamiento con micrótomo de cuchilla de vibración con el fin de mantener la arquitectura de tejido tanto como sea posible. En segundo lugar, un protocolo de HPF/FS fue optimizado para preservar la ultraestructura orgánulo durante la preparación de bloques de muestra incorporado. Las muestras fueron congeladas bajo alta presión, que disminuye el punto de congelación del agua y reduce la formación de cristales de hielo que dañan la ultraestructura1. Muestras de espesor 0,1 mm puede ser vitrificado instantáneamente y luego sometido a congelación de sustitución para generar bloques de muestras para análisis de EM. Se observó la conservación mejorada de ultraestructura por HPF/FS, comparado con métodos de fijación química. Usando esta serie de pasos para la preparación de la muestra, preservación de las membranas dobles mitocondriales y membranas cristae mejoró dramáticamente.
Obtención de secciones seriadas de la muestra es el paso más difícil del método. Como el haz de electrones ha limitado poder de penetración, el espesor de la sección se limita a cualquiera de los dos 250 nm o 500 nm con un TEM operando a 200 kV o 300 kV, respectivamente. Porque el grosor de una mitocondria puede ser más de 2 μm, las secciones seriales están obligadas a obtener reconstrucciones de volumen completo. Sin embargo, recuperar un número suficiente de secciones seriadas para abarcar un organelle entero es un desafío técnico. Recortar la cara de bloque para ser tan plano como sea posible entre las bases de la distorsión trapezoidal puede permitir una cuadrícula de ranura acomodar más secciones y así cubrir mayores volúmenes. Además, utiliza un circuito perfecto para secciones finas aumenta la tasa de éxito de la transferencia de las secciones seriadas a la red.
Tomografía de serie-sección electrónica puede realizarse con equipo estándar de la base de la EM. Sin embargo, el método tiene algunas limitaciones inevitables que surgen de restricciones técnicas. Uno es que el material es inevitablemente perdido entre las secciones seriales, dejando huecos en la reconstrucción se unieron. En segundo lugar es el que falta artefacto de cuña, que surge debido a la inclinación limitada que es alcanzables. Esta restricción se produce porque el sostenedor del espécimen no se puede activar en una rotación completa sin necesidad de bloquear el haz de electrones. A pesar de estas limitaciones, la tomografía electrónica serie-sección ofrece suficiente resolución para revelar la ultraestructura celular y organelas en 3D.
Para la proyección de imagen de escala más pequeña, tomography del cryo-electrón es una tecnología emergente que puede utilizarse para obtener la estructura de macromoleculares complejos y ensambles en situ en resolución nanómetro o el angstrom en combinación con sub-tomográfica reconstrucción3. En esta aplicación, las células están enrarecidas por seccionamiento o por haz de iones enfocado fresado bajo nitrógeno líquido. Los tomogramas se recogen condiciones de cryo donde se conservan estructuras moleculares cerca el estado nativo sin fijación química, deshidratación o incrustación. En el otro extremo de la escala, para analizar los volúmenes grandes de tejido a expensas de la resolución, microscopía electrónica de serie de cara de bloque es una modalidad atractiva aunque necesita un instrumento específico4.
Divulgaciones
Los autores declaran que no tienen intereses financieros que compiten.
Agradecimientos
Los estudios fueron realizados en la base de EM en el Instituto de biología celular y organísmica y el núcleo de cryo-EM de la Academia Sinica, Taipei, Taiwán. El trabajo fue apoyado por la Academia Sínica y más.
Materiales
| Name | Company | Catalog Number | Comments |
| vibrating blade microtome | Leica | VT1200S | Tissue sectioning |
| high-pressure freezer | Leica | EM HPM100 | Specimen preparation |
| freeze-substitution device | Leica | EM AFS2 | Specimen preparation |
| ultramicrotome | Leica | EM UC7 | Ultra-thin sectioning |
| dual-axis tomography holder | Fischione | Model 2040 | tomography collection |
| transmission electron microscope | FEI | Tecnai F20 | tomography collection |
| CCD | Gatan | UltraScan 1000 | tomography collection |
| Leginon | NRAMM/AMI | tomography collection | |
| IMOD | Boulder Laboratory for 3-D Electron Microscopy of Cells | Tomography reconstruction | |
| Avizo 3D | FEI | Tomography analysis |
Referencias
- Dahl, R., Staehelin, L. A. High-pressure freezing for the preservation of biological structure: theory and practice. J Electron Microsc Tech. 13 (3), 165-174 (1989).
- Sabatini, D. D., Bensch, K., Barrnett, R. J. Cytochemistry and electron microscopy. The preservation of cellular ultrastructure and enzymatic activity by aldehyde fixation. J Cell Biol. 17, 19-58 (1963).
- Rigort, A., et al. Micromachining tools and correlative approaches for cellular cryo-electron tomography. J Struct Biol. 172 (2), 169-179 (2010).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biol. 2 (11), e329 (2004).
- Lucic, V., Forster, F., Baumeister, W. Structural studies by electron tomography: from cells to molecules. Annu Rev Biochem. 74, 833-865 (2005).
- Soto, G. E., et al. Serial section electron tomography: a method for three-dimensional reconstruction of large structures. Neuroimage. 1 (3), 230-243 (1994).
- Jiang, Y. F., et al. Electron tomographic analysis reveals ultrastructural features of mitochondrial cristae architecture which reflect energetic state and aging. SciRep. 7, 45474 (2017).
- Cogliati, S., Enriquez, J. A., Scorrano, L. Mitochondrial Cristae: Where Beauty Meets Functionality. TrendsBiochemSci. 41 (3), 261-273 (2016).
- Friedman, J. R., Nunnari, J. Mitochondrial form and function. Nature. 505 (7483), 335-343 (2014).
- Suloway, C., et al. Fully automated, sequential tilt-series acquisition with Leginon. J Struct Biol. 167 (1), 11-18 (2009).
- Mastronarde, D. N., Held, S. R. Automated tilt series alignment and tomographic reconstruction in IMOD. J Struct Biol. 197 (2), 102-113 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados