Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Investigar los efectos perjudiciales de baja presión Plasma esterilización sobre la supervivencia de vivir el Bacillus subtilis esporas usando el celular microscopia
En este artículo
Resumen
Este protocolo ilustra los pasos consecutivos importantes requeridos para evaluar la importancia del monitoreo de parámetros de vitalidad y procesos de reparación del ADN en la reactivación de las esporas de Bacillus subtilis después del tratamiento con plasma de baja presión por seguimiento proteínas a través del tiempo-resolved de la microscopia confocal y microscopía electrónica de barrido de reparación del ADN marcado con fluorescencia.
Resumen
Esterilización de plasma es una alternativa prometedora a métodos convencionales de esterilización industrial, clínico, y vuelos espaciales. Descargas de plasma (LPP) de baja presión contienen un amplio espectro de especies activas, que conducen a la rápida inactivación microbiana. Para estudiar la eficacia y los mecanismos de esterilización por LPP, utilizamos las esporas del organismo prueba Bacillus subtilis debido a su extraordinaria resistencia contra procedimientos de esterilización convencionales. Se describe la producción de monocapas de esporas B. subtilis , el proceso de esterilización por plasma de baja presión en un reactor de plasma inductivamente acoplado doble, la caracterización de la morfología de la espora mediante microscopía electrónica (SEM) y la Análisis de germinación y consecuencia de esporas por microscopía de células vivas. Un objetivo importante de especies de plasma es material genómico (DNA) y la reparación de lesiones de DNA inducida por plasma al renacimiento de la espora es crucial para la supervivencia del organismo. Aquí, estudiamos la capacidad de germinación de las esporas y el papel de ADN reparación durante la germinación de las esporas y consecuencia después del tratamiento con LPP por seguimiento marcado con fluorescencia ADN reparación proteínas (RecA) con microscopía de fluorescencia confocal tiempo resuelto. Tratados y monocapas de espora sin tratar son activadas para la germinación y visualizarse con un microscopio confocal invertido vivo de la célula con el tiempo a seguir la reacción de esporas individuales. Nuestras observaciones revelan que la fracción de germinación y rebasar las esporas depende de la duración del tratamiento de LPP llegando a un mínimo después de 120 s. RecA-YFP (proteína de la fluorescencia amarilla) fluorescencia fue detectada solamente en algunas esporas y desarrollada en todas rebasar las células con una elevación leve de las esporas tratadas con LPP. Por otra parte, algunas de las bacterias vegetativas derivan de esporas LPP tratados mostraron un aumento en el citoplasma y tendían a lyse. Los métodos descritos para el análisis de esporas individuales podrían ser ejemplares para el estudio de otros aspectos de la germinación de las esporas y consecuencia.
Introducción
Una meta importante de la exploración espacial es la búsqueda de firmas de las formas de vida y biomoléculas en otros cuerpos planetarios y lunas de nuestro sistema solar. La transferencia de microorganismos o biomoléculas de origen terrestre a las áreas críticas de exploración es de particular riesgo para impactar el desarrollo y la integridad de las misiones de detección de vida en cuerpos planetarios como Marte y Europa1. Las normas internacionales de protección planetaria, establecida por el Comité de investigaciones espaciales (COSPAR) en 1967, imponer regulaciones estrictas en misiones tripuladas y robóticas a otros planetas, sus lunas, asteroides y otros cuerpos celestes y regular la limpieza y esterilización de una nave espacial y componentes de hardware crítico previo para poner en marcha con el fin de eliminar contaminantes microorganismos terrestres y evitar la contaminación cruzada de los cuerpos celestes2. En la última década, la aplicación de plasma no térmico ha ganado gran atención en la investigación biomédica y nutricional, así como en vuelos espaciales tripulados aplicaciones3,4,5. Esterilización de plasma es una alternativa prometedora distinta a los métodos convencionales de esterilización ya que ofrece rápido y eficaz de inactivación microbiana6, mientras que siendo suave para sensibles y materiales lábiles al calor. Descargas de plasma contienen una mezcla de agentes reactivas como los radicales libres, partículas cargadas, neutral/excitado átomos, fotones de la radiación ultravioleta (UV) y el espectro de vacío ultravioleta (VUV) que conducen a la rápida inactivación microbiana3. En este estudio, utilizamos plasma de baja presión generada por la doble fuente de plasma acoplado inductivamente de baja presión (fenotipo)7,8 para inactivar las endosporas de Bacillus subtilis distribuidas en la superficie de ensayo de vidrio.
Bacterias Gram-positivas de la familia Bacillaceae están ampliamente distribuidas en hábitats naturales de suelo, sedimentos y aire, así como en ambientes inusuales tales como instalaciones de sala limpia y la estación espacial internacional9,10 ,11. La característica más distintiva del género Bacillus es la capacidad para formar endosporas latentes muy resistentes (en lo sucesivo como esporas) para sobrevivir condiciones desfavorables, tales como agotamiento de nutrientes12. Las esporas son generalmente mucho más resistentes que sus homólogos de la célula vegetativa a una variedad de tratamientos y de presiones ambientales, incluyendo calor, UV, radiación gamma, desecación, perturbaciones mecánicas y productos químicos tóxicos, tales como oxidantes fuertes o agentes de cambio de pH (revisados en referencias13,14) y por lo tanto, son objetos ideales para probar la eficacia de los métodos de inactivación microbiana. Puesto que el ADN genómico es un objetivo importante del tratamiento plasma de bacterias15,16, la reparación de las lesiones de DNA inducida por plasma (por ejemplo, rompe la doble cadena de ADN) en esporas avivamiento es crucial para la supervivencia de las bacterias13, 17.
Así, estudiamos la capacidad de germinación de las esporas y el papel de la reparación de la DNA durante la germinación de las esporas y consecuencia después de tratar las esporas con plasma de argón de baja presión por esporas individuales siguientes y reparar su expresión de ADN marcado con fluorescencia proteína RecA con microscopía de fluorescencia confocal tiempo resuelto. Le damos una instrucción paso a paso de la preparación de esporas B. subtilis en monocapas para lograr resultados reproducibles, el tratamiento de las monocapas de espora con plasma de baja presión para la esterilización, la preparación de plasma tratado esporas para evaluación ultraestructural mediante microscopía electrónica (SEM) y análisis de microscopía de células vivas en el nivel de esporas individuales en concierto con el monitoreo del ADN activado reparación de procesos que ocurren dentro de la célula en respuesta al tratamiento de plasma.
Protocolo
1. producción de esporas de bacillus subtilis y purificación
- Para la producción de esporas, transferir una cultura noche 5 mL de la cepa B. subtilis , suplementado con antibióticos apropiados, al medio de esporulación Schaeffer líquido de 200 mL de doble resistencia (por litro caldo nutritivo de 16 g, KCl 2 g, 0,5 g de MgSO 4* 7 H2O, 2 mL 1 M Ca (NO3)2, 2 mL 0.1 M MnCl2 * • 4 H2O, 1 mM 2 mL FeSO4, 2 mL de glucosa 50% (w/v)18) y cultivar con aireación vigorosa a 37 ° C por 72 h o hasta > 95% de la cultura ha esporulado. Se utilizan las esporas de las cepas siguientes: B. subtilis PY79 (tipo salvaje) B. subtilis PY79ΔrecA:: neo (deficiencia de la proteína de reparación de ADN RecA) B. subtilis PY79 recA-yfp:: cat (RecA fundido con amarillo proteína fluorescente [YFP]19).
- Recoger esporas por centrifugación durante 15 minutos a 3.000 x g en tubos de 50 mL y purificar las muestras de lavado repetido los pasos (hasta 15 veces) mediante estéril destilada H2O y verifique estado de pureza y germinación por microscopia de contraste de fase. Asegúrese de que suspensiones de esporas consisten de esporas de la fase luminosa (> 99%) y están libres de células vegetativas (barras), las esporas germinadas (aspecto negro / gris) y restos de células, de lo contrario más experimentos de microscopia pueden ser disturbados. Lavar la muestra hasta que se alcanza la pureza deseada.
- Determinar la concentración de esporas por chapado a 50 μl de las diluciones seriadas 10 veces en LB-agar (es decir: uso 30 μl de muestra + 270 μl de agua estéril para un 1:10 dilución. Tomar 30 μl de la dilución particular a 270 μl de H2O para una dilución de 1: 100 y así sucesivamente) para calcular la UFC (unidades formadoras de colonias) e Incube las placas a 37 ° C durante la noche. Después de la determinación de UFC, ajustar la muestra a 109 esporas / mL de concentrar o diluir con agua estéril.
2. preparación de esporas depositadas en Aerosol Bacillus subtilis
Nota: La acumulación y superposición de las esporas pueden dar sombrear efectos durante el tratamiento, resultando en la cinética de inactivación falsificados. Para minimizar este problema, preparar muestras de esporas por una técnica de deposición de aerosoles20. Brevemente, controlar el inyector de dos sustancias de alta precisión con un contador de tiempo eléctrico que regula el rendimiento líquido en conjunto con el flujo de gas portador presurizado (aquí N2). Dispersar la muestra líquida inyectada a través de la boquilla usando la corriente de gas nitrógeno.
- Coloque un portador de muestras en forma de diapositivas microscópicas esterilizadas (para cinética de supervivencia) o redonda 25 mm cubreobjetos (fluorescente seguimiento de la reparación del ADN procesos/cLSM; microscopía de láser confocal) dentro el aerosol eléctricamente funcionado rociando la unidad en la alineación de la boquilla. La concentración de esporas usadas debe corresponder a un céntuplo de la concentración final deseada.
- Transferir 1 mL del cultivo de esporas a la entrada de boquilla de fluido e iniciar el proceso de pulverización de 0,1 s a una presión de 1,3 bar. La suspensión de esporas rociado (1 x 107) forma una fina película en la diapositiva microscópica que se seca rápidamente en segundos para formar una monocapa de espora uniformemente distribuidas. Almacenar los portadores de la muestra tratada en un recipiente estéril a temperatura ambiente.
3. baja presión Plasma tratamiento
- Preparar el sistema de plasma para el tratamiento de muestras biológicas y operar el sistema en 5 Pa con plasma de argón de 500 W durante 5 minutos. Por esto, todas las superficies en el sistema de limpiado y calentadas. Esto reduce pegarse de las moléculas del aire ambiente, es decir, nitrógeno, oxígeno y agua, mientras que el sistema de ventilación. Tras el pretratamiento del sistema, la cámara de ventilación y coloque cuidadosamente las muestras en el centro de la vasija del reactor con la ayuda de estantes de vidrio.
- Utilice al menos tres réplicas biológicas. Cerrar la cámara y evacuar por debajo de 2 PA llenar luego, el gas de proceso en la cámara. Regulan la presión en el sistema a 5 PA.
- Después del tiempo de proceso definido, el suministro de energía y gas y ventilación cuidadosamente el sistema para evitar soplar las muestras de lo portamuestras. Después de la ventilación, quite las muestras y colocar las muestras para el siguiente parámetro en el sistema. De controles tratados de plasma no exponen las muestras al vacío sólo (5 Pa) en presencia de los gases de proceso equivalente a la vez más aplicada del plasma.
4. recuperación y evaluación de la supervivencia de la espora
- Preparar una solución de autoclave 10% acetato de polivinilo (PVA) y cubrir el portamuestra con aproximadamente 500 μl y dejarlos al aire para 4 h. tira apagado la capa seca de PVA (ahora contiene la muestra de esporas) utilizando pinzas estériles y transfiera 2 ml tubo de reacción. Añadir 1 mL de agua estéril en el tubo y disolver la capa PVA mediante Vortex. Este procedimiento conduce a > 95% de recuperación de esporas y no afecta a su capacidad de germinación21.
- En serie, diluir la muestra a 1:10 en agua estéril en una placa de 96 pocillos (es decir, 270 μl estériles H2O + dilución de muestra/ex 30 μL). Placa de 50 μl de cada dilución en agar nutritivo caldo de lisogenia (LB), incubar las placas a 37 ° C durante una noche y enumerar el número de colonias crecidas (UFC).
5. vivo microscopia celular y seguimiento de los procesos de reparación del ADN en la germinación de esporas
- Para los experimentos de germinación, preparación de un 1 mm espesor 1,5% LB-agar pad, hirviendo 700 μl de medio y pipeta en una caja de Petri estéril de la microscopia. Después de 10 min, corte un 8 x 8 mm x 1 pad mm LB-agar con un bisturí estéril y transferir el agar cuidadosamente sobre las monocapas de la espora que descansan sobre cubreobjetos de vidrio de 25 mm.
Nota: Este paso es crucial para la visualización de esporas individuales y permitir después su reacción hacia la activación de la germinación inducida por el agar nutriente. Así, el LB-agar sirve dos propósitos, (1) fijar las esporas en la superficie, que evita la relocalización a lo largo de la superficie y fuera de foco óptico y (2) activar la espora para germinar. - Después de cubrir la muestra con el agar, transferir el cubreobjetos de vidrio rápidamente en una proyección de imagen de cámara y microscopio las muestras con un microscopio de escaneo láser confocal automatizado con óptica invertida con un 63 X / 1.3 plano apocromática objetivo de inmersión de aceite.
-
Realizar la proyección de imagen de fluorescencia (YFP) con una excitación puede detectarse entre 520 y 560 nm longitud de onda de 514 nm y de emisión.
- Grabar imágenes de campo claro en modo usando uno de los multiplicadores de la foto (ruta de la luz transmitida) de exploración.
- Grabar serie de Time-lapse con una energía del laser del 2,6% y ajuste la abertura confocal a 5 unidades luminosas y con una frecuencia de muestra de 1 marco por 30 s de 0 h a 5 h, según el experimento. Es de destacar que altas dosis de monocromática láser iluminación a 514 nm inhibir totalmente la germinación (figura 1A, B).
- Mantener las muestras a 37 ° C (humedad del aire ambiente) en una fase de calentamiento durante el proceso de proyección de imagen. Utilice al menos tres réplicas biológicas para cada condición. En el caso de agregación de la espora, espora varias capas distribución o contaminación por partículas de polvo, bloqueo del tratamiento de plasma ("sombreado") podría ocurrir y permitir la germinación de las esporas sombreadas (figura 1C, D).
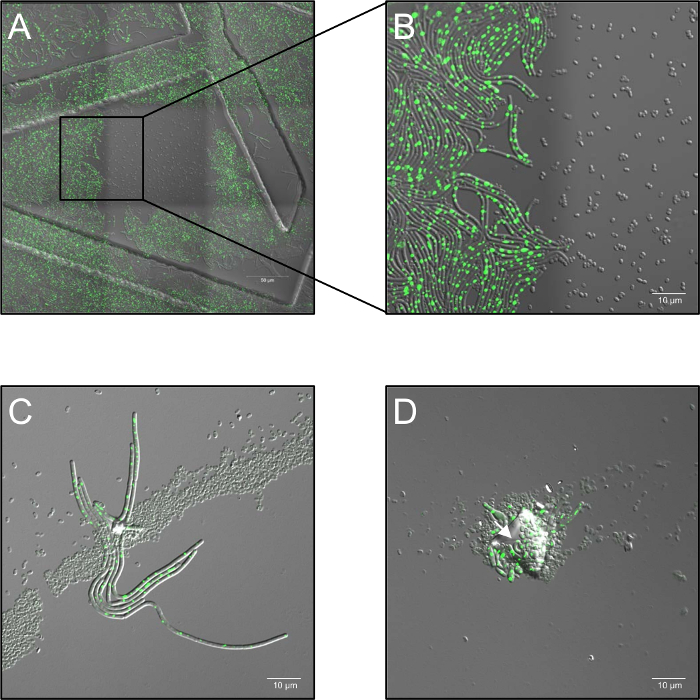
Figura 1: posibles problemas observaron durante la microscopía de fluorescencia confocal vivo de la célula de plasma tratado esporas. (A, B) Inhibición de la germinación de las esporas por altas dosis de monocromático (514 nm) láser de iluminación. (A) Resumen (3 x 3 cuadros cosidos) de B. subtilis (LAS72, RecA-YFP) esporas 180 min después de la iniciación de la germinación. El marco en el medio fue expuesto a intervalos 30 s a altas dosis de luz láser (514 nm, energía del laser de 70%), mientras que las regiones circundantes (= Marcos) no fueron iluminadas (imagen fusionada de canal de campo claro y fluorescencia de RecA-YFP; ordenó las estructuras causados por el uso de platos con una cuadrícula impresa 500 μm la proyección de imagen de 35 mm). (B) muestra un 4 X vista magnificada de la frontera entre la región iluminada y no iluminada mostrando que las esporas, que se expusieron a altas dosis de iluminación láser monocromática no germinan y crecen hacia fuera, mientras que las esporas en regiones no iluminadas se recuperan completamente a las bacterias vegetativas expresando fluorescencia brillante de RecA-YFP (señal verde). (C, D) Las esporas cubrieron por partículas de contaminantes o múltiples capas de esporas (flechas) parece proteger esporas subyacentes de la inactivación por tratamiento de plasma y permiten que su germinación y consecuencia ("efecto sombra"). (C) las esporas eran tratados con plasma de 60 s e imagen 180 min después de la iniciación de la germinación o en (D) para 120 s y reflejada después de 240 min. haga clic aquí para ver una versión más grande de esta figura.
6. microscopía electrónica (SEM)
- Utilizar microscopía electrónica para proporcionar información ultraestructural acerca de la morfología superficial de esporas de plasma tratado en comparación con controles no tratados. Capa de monocapas de esporas secas en cubreobjetos con oro-paladio (3 nm) mediante el uso de un recubridor sputter. Utilizar un microscopio electrónico de barrido de emisión de campo para las muestras, operadas a 5 kV voltaje de aceleración entre un detector de electrónica de secundaria en el lente para revelar el contraste de la topografía de la proyección de imagen.
7. Análisis de datos
- Determinar la supervivencia de la espora del cociente N/N0, donde N es la media de UFC de las muestras tratadas y N0 es la media de UFC de controles no tratados de vacío. Trama de inactivación de esporas por el tratamiento de plasma de argón en función del tiempo (en segundos). Expresar todos los datos como medias y desviaciones estándar (n = 3).
- Analizar imágenes obtenidas por proyección de imagen de células vivas usando el software de imágenes. Cuantificar la proporción de germinación de la espora y rebasar después del tratamiento de plasma, recuento de esporas en representante de marcos al principio del experimento, así como después de 4 h. Para la determinación de la significación en los análisis de supervivencia de esporas, utilizar pruebas de ANOVA unidireccionales (análisis de varianza) con software estadístico). Valores de P < 0.05 se consideró como estadísticamente significativa.
Resultados
Supervivencia de los tratados con plasma B. subtilis esporas
Tratamiento del plasma de las esporas B. subtilis había utilizado en este estudio muestran una disminución en la supervivencia con aumento de la duración del tratamiento de plasma (figura 2). Las esporas de la cepa expresando la recA-gen fusionado a YFP mostraron curvas de supervivencia similares a las esporas de...
Discusión
Esterilización de superficies con baja temperatura, baja presión de plasma es una alternativa prometedora distinta a los procedimientos de esterilización algo convencional como el tratamiento con radiaciones ionizantes radiación, productos químicos (por ejemplo, gases como el H2O2 o óxido de etileno) o calor seco y húmedo23. Métodos de esterilización normal sobre todo proporcionan una efectiva esterilización, pero se sabe que influyen en el material tratado...
Divulgaciones
No hay conflicto de interés declarado.
Agradecimientos
Los autores agradecen a Andrea Schröder por su excelente asistencia técnica durante las partes de este trabajo y Nikea J. Ulrich por su ayuda durante la sesión de video. También nos gustaría agradecer a Lyle A. Simmons por su generosa donación de las cepas de Bacillus subtilis : LAS72 y LAS24. Este trabajo fue financiado en partes por las subvenciones de la Fundación de investigación alemana (DFG) Paketantrag (PlasmaDecon PAK 728) a PA (AW, 7, 3-1) y RM (MO 2023/2-1) y el DLR conceden DLR-FuW-Projekt ISS vida, Programm RF-FuW, Teilprogramm 475 (a F.M.F, M.R. y R.M.). F.M.F.2001 fue apoyado por una beca de doctorado de la escuela de investigación de Ciencias de la vida de espacio Helmholtz (SpaceLife) en el Centro Aeroespacial Alemán (DLR) en Colonia, Alemania, que fue financiado por la Asociación de Helmholtz (Helmholtz-Gemeinschaft) durante un período de seis años ( Grant no. VH-Ko-300) y recibió fondos adicionales de la DLR, incluyendo Comité Ejecutivo aeroespacial y el Instituto de medicina aeroespacial. Los resultados de este estudio se incluirán en la tesis doctoral de Felix M. Fuchs.
Materiales
| Name | Company | Catalog Number | Comments |
| Two substance nozzle (model 970-8) | Schlick | 14,404 | 230 V, 50 Hz, D 4.484/8, 0.8 mm bore diameter |
| Luria Bertani Medium | Sigma Aldrich | 70122-100G | |
| Tube connectors | Festo | n/a | G 1/8 |
| Magnetvalve DO35-3/2NC-G018-230AC | Bosch Rexroth | 820005100 | |
| PLN Polyamid tube | Festo | 558206 | d = 6 mm |
| Glass slides | VWR | 48300-026 | |
| Electric Timer 550-2-C | Gefran | F000074 | 220 V |
| attofluor cell chamber | Menzel, Fisher Ref. | 3406816 | d=25 mm, round |
| MgSO4*7 H2O | Sigma Aldrich | 13152 | |
| Ca(NO3)2 | Sigma Aldrich | 202967 | |
| MnCl2 * 4 H2O | Sigma Aldrich | 244589 | |
| FeSO4 * 7H2O | AppliChem | 13446-34-9 | |
| Glucose | Merck | 215422 | |
| KCl | Sigma Aldrich | P9541-500G | |
| Nutrient Broth (NB) | Merck | 105443 | |
| Luria-Bertani (LB) | Merck | 110283 | |
| 96-wellplate | ThermoFisher | 243656 | |
| Zeiss LSM 780, Axio Observer Z1 | Carl Zeiss Microscopy GmbH | n/a | |
| Leo 1530 Gemini | Carl Zeiss Microscopy GmbH | n/a | |
| ZEN 2 and ZEN lite 2012 (Software) | Carl Zeiss Microscopy GmbH | n/a | |
| SigmaPlot, version 13.0 (Statistic software) | Systat GmbH, Erkrath, Germany | n/a | |
| Attofluor cell chamber | Invitrogen | A7816 | |
| µ-Dish 35 mm, high Grid-500 Glass Bottom | ibidi | 81168 |
Referencias
- Nicholson, W. L., Schuerger, A. C., Race, M. S. Migrating microbes and planetary protection. Trends Microbiol. 17, 389-392 (2009).
- COSPAR. COSPAR Planetery Protection Policy. Space Research Today, COSPAR's Information Bulletin. 193, 1-14 (2015).
- De Geyter, N., Morent, R. Nonthermal plasma sterilization of living and nonliving surfaces. Annu Rev Biomed Eng. 14, 255-274 (2012).
- Shimizu, S., et al. Cold atmospheric plasma - A new technology for spacecraft component decontamination. Planet. Space Sci. 90, 60-71 (2014).
- Lerouge, S., Fozza, A. C., Wertheimer, M. R., Marchand, R., Yahia, L. H. Sterilization by Low-Pressure Plasma: The Role of Vacuum-Ultraviolet Radiation. Plasma Polym. 5, 31-46 (2000).
- Rossi, F., Kylián, O., Rauscher, H., Gilliland, D., Sirghi, L. Use of a low-pressure plasma discharge for the decontamination and sterilization of medical devices. Pure Appl. Chem. 80, 1939-1951 (2008).
- Halfmann, H., Hauser, J., Awakowicz, P., Koller, M., Esenwein, S. A. A double inductively coupled low-pressure plasma for sterilization of medical implant materials. Biomed Tech (Berl). 53, 199-203 (2008).
- Halfmann, H., Denis, B., Bibinov, N., Wunderlich, J., Awakowicz, P. Identification of the most efficient VUV/UV radiation for plasma based inactivation of Bacillus atrophaeus spores. J. Phys. D: Appl. Phys. 40, 5907 (2007).
- Vaishampayan, P., et al. Bacillus horneckiae sp. nov., isolated from a spacecraft-assembly clean room. Int J Syst Evol Microbiol. 60, 1031-1037 (2010).
- Mandic-Mulec, I., Stefanic, P., van Elsas, J. D. Ecology of Bacillaceae. Microbiol Spectr. 3, (2015).
- Alekhova, T. A., et al. Diversity of bacteria of the genus Bacillus on board of international space station. Dokl Biochem Biophys. 465, 347-350 (2015).
- Claus, D., Bekerley, R. C. W., Sneath, P. A. Genus Bacillus Cohn 1872. Bergey's manual of systematic bacteriology. 2, 1105-1141 (1986).
- Setlow, P. Spore Resistance Properties. Microbiol Spectr. 2, (2014).
- Setlow, P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. J Appl Microbiol. 101, 514-525 (2006).
- Roth, S., Feichtinger, J., Hertel, C. Characterization of Bacillus subtilis spore inactivation in low-pressure, low-temperature gas plasma sterilization processes. J Appl Microbiol. 108, 521-531 (2010).
- Roth, S., Feichtinger, J., Hertel, C. Response of Deinococcus radiodurans to low-pressure low-temperature plasma sterilization processes. J Appl Microbiol. 109, 1521-1530 (2010).
- Setlow, B., Setlow, P. Role of DNA repair in Bacillus subtilis spore resistance. J Bacteriol. 178, 3486-3495 (1996).
- Schaeffer, P., Millet, J., Aubert, J. P. Catabolic repression of bacterial sporulation. Proc. Natl. Acad. Sci. 54, 704-711 (1965).
- Simmons, L. A., et al. Comparison of responses to double-strand breaks between Escherichia coli and Bacillus subtilis reveals different requirements for SOS induction. J Bacteriol. 191, 1152-1161 (2009).
- Raguse, M., et al. Improvement of Biological Indicators by Uniformly Distributing Bacillus subtilis Spores in Monolayers To Evaluate Enhanced Spore Decontamination Technologies. Appl Environ Microbiol. 82, 2031-2038 (2016).
- Horneck, G., et al. Protection of bacterial spores in space, a contribution to the discussion on Panspermia. Orig Life Evol Biosph. 31, 527-547 (2001).
- Opretzka, J., Benedikt, J., Awakowicz, P., Wunderlich, J., Keudell, A. v. The role of chemical sputtering during plasma sterilization of Bacillus atrophaeus. J. Phys. D: Appl. Phys. 40, 2826 (2007).
- Stapelmann, K., et al. Utilization of low-pressure plasma to inactivate bacterial spores on stainless steel screws. Int. J. Astrobiol. 13, 597-606 (2013).
- Raguse, M., et al. Understanding of the importance of the spore coat structure and pigmentation in the Bacillus subtilis spore resistance to low-pressure plasma sterilization. J. Phys. D: Appl. Phys. 49, 285401 (2016).
- Pandey, R., et al. Live cell imaging of germination and outgrowth of individual Bacillus subtilis spores; the effect of heat stress quantitatively analyzed with SporeTracker. PloS one. 8, e58972 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados