Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Utilizando el T-laberinto modificado para evaluar los resultados funcionales de la memoria después de un paro cardíaco
En este artículo
Resumen
Este protocolo describe el uso de un T-laberinto modificado para evaluar memoria aprendizaje funcional en isquemia cerebral paro cardíaco inducido por asfixia.
Resumen
Fondo: Evaluación de leve a moderado deterioro cognitivo en un modelo de isquemia cerebral global (es decir, paro cardíaco) puede ser difícil debido a la mala locomoción después de la cirugía. Por ejemplo, ratas que se someten a procedimientos quirúrgicos y están sometidas al laberinto acuático de Morris pueden no ser capaces de nadar, anulando así el experimento.
Nuevo método: Establecimos un test de T-laberinto modificado comportamiento alternancia espontánea. La principal ventaja del protocolo modificado de T-laberinto es su diseño relativamente simple que es lo suficientemente potente como para evaluar la memoria de aprendizaje funcional tras la isquemia. Además, el análisis de datos es sencillo. Se utilizó la T-laberinto para determinar déficit de aprendizaje/memoria de las ratas en la presencia o ausencia de leve a moderada (6 min) asphyxial cardiaco (ACA). Las ratas tienen una tendencia natural para la exploración y explorarán los brazos alternos en la T-laberinto, mientras que las ratas hipocampales lesionados tienden a adoptar una preferencia de lado dando lugar a relaciones de alternancia espontánea disminuida, revelando el hipocampo relacionadas con el aprendizaje/memoria funcional en la presencia o ausencia de ACA.
Resultados: Grupos ACA tienen cocientes más altos de preferencia de lado y alteraciones menores en comparación con el control.
Comparación con los métodos existentes: Morris el agua y el laberinto de Barnes son más importantes para evaluar la función de aprendizaje/memoria. Sin embargo, el laberinto acuático de Morris es más estresante que otros laberintos. El laberinto de Barnes es ampliamente utilizado para medir la memoria de referencia (largo plazo), mientras que déficit neurocognitivo inducida por ACA está más estrechamente relacionadas con memoria (corto plazo) de trabajo.
CONCLUSIONES: Hemos desarrollado una estrategia simple pero eficaz para delinear el trabajo de memoria (a corto plazo) a través de la T-Laberinto en nuestro modelo de isquemia cerebral global (ACA).
Introducción
Según la Asociación Americana del corazón (2017), cardiaco (CA)-mortalidad inducida se produce cada cuatro minutos y afecta a más de 400.000 personas por año en los Estados Unidos1. Está bien documentado que el CA puede causar daño neuronal cerebral como consecuencia de sangre insuficiente perfusión2,3,4. Lesión cerebral inducida por CA se produce en la región sensible a la isquemia del CA1 del hipocampo5,6,7, que afecta a las neuronas que son fundamentales para el aprendizaje y la memoria de8,9, 10,11,12. Por otra parte, la pérdida de la densidad de la espina dorsal dendrítica, bajo condiciones isquémicas en el hipocampo (es decir, las neuronas CA1), desempeña un papel crítico en el deterioro de memoria espacial13,14,15. Debido a estos cambios patológicos después de CA, trastornos conductuales tales como: ansiedad, depresión, trastorno de estrés postraumático y pérdida de la memoria son más frecuentes. Aunque ha habido avances en la tecnología médica (es decir, eficiente servicio ambulatorio) que correlacionan con mejores tasas de supervivencia de CA, la mayoría de los tratamientos neuroprotectores (excepto hipotermia) no mejora los resultados funcionales después de CA16 ,17. Sobrevivientes de CA típicamente tienen una pobre calidad de vida y cargan incremental médicos gasto16.
Evaluaciones del estado cognitivo de isquemia cerebral por medio de pruebas de comportamiento son importantes para determinar la eficacia de ambas drogas y finalmente desarrollar un ensayo clínico exitoso. En la década de 1940, Edward Tolman diseñó el primer ensayo de comportamiento para estudiar la memoria espacial basado en el hipocampo18. Posteriormente, se desarrollaron diferentes laberintos (laberinto acuático de Morris, laberinto radial, T - o laberinto o laberinto de Barnes) para evaluar el aprendizaje espacial basado en el hipocampo y la memoria en ratas19,20,21,22 ,23. Uno de la prueba de comportamiento más ampliamente utilizada es el laberinto acuático de Morris, que examina el aprendizaje espacial y memoria en la rata modelos24. Sin embargo, el laberinto acuático de Morris requiere la rata para nadar y ejercer control y función motora completa. Para los experimentos de isquemia como el modelo de asphyxial cardiaco (ACA, un modelo de rata de CA), canulación de la vena/arteria femoral deben obtener vital presión arterial, gasometría arterial e introducción de varias drogas. Puesto que la canulación de la arteria femoral vena puede inhibir la movilidad de la pierna representación capacidad de rata a nadar correctamente, el laberinto acuático de Morris no puede ser el más apropiado para poner a prueba las debilitaciones cognoscitivas bajo ACA.
El laberinto de Barnes es la otra prueba conductual utilizada para examinar el aprendizaje espacial y memoria en modelos de roedores. El laberinto de Barnes no requiere el ejercicio de la función completa motor y control y por lo tanto menos estresante que el laberinto de agua de Morris. En el pasado, se realizaron experimentos con el laberinto de Barnes para determinar si las diferencias de aprendizaje/memoria funcional ocurren entre control o sham versus ratas inducidas por ACA. Los datos obtenidos por el laberinto de Barnes no tuvo resolución para probar las debilitaciones cognoscitivas después de leve a moderada ACA debido a que el laberinto de Barnes es ampliamente utilizado para medir la memoria de referencia (largo plazo)25,26, mientras que Déficits neurocognitivos ACA-inducida más estrechamente relacionados con el trabajo (corto plazo) memoria27,28,29,30 sugiriendo que el laberinto de Barnes es menos viable para evaluar la función de memoria en nuestro ACA modelo.
Así desarrollamos un T-laberinto modificado con prueba de alternancia espontánea para evaluar la memoria (a corto plazo) de trabajo después de ACA. Ventaja importante de prueba modificada de alternancia espontánea de T-laberinto es su simplicidad y mínimo estrés de las ratas en comparación con otras pruebas de comportamiento debido a que el T-laberinto modificado no requiere formación previa del animal, como bien como pesado computacional Análisis o subrutinas (es decir, imágenes de video de la rata) como lo requiere el laberinto acuático de Morris y el laberinto de Barnes. Aquí mostramos que la prueba modificada de la alternancia espontánea de T-laberinto es un paradigma ensayo conductual simple y sin embargo altamente eficiente que ofrece suficiente resolución para detectar con precisión y evaluar la función del hipocampo en las enfermedades que causan pérdida de memoria a corto plazo (es decir, ACA).
Protocolo
Todos los procedimientos experimentales fueron realizados de conformidad con los lineamientos de los institutos nacionales de salud y aprobados por el cuidado institucional de animales y uso (centro de Ciencias de la salud LSU-Shreveport) para el uso de () ratas macho Sprague Dawley 300-350 g, 9-10 semanas de edad). Las ratas se mantuvieron en ayuno durante la noche antes de la cirugía ACA.
1. configuración y diseño de aparatos de T-laberinto
Nota: Base del diseño de T-Laberinto en el diácono y los Rawlins 2006 modelo31.
- Diseño 3D estructura del laberinto utilizando SketchUp32. Para crear una estructura 3D de la T-laberinto, construir el brazo de arranque con una longitud exterior de 200 mm, ancho de 165 mm y altura de 148 mm para adaptarse a las dimensiones de impresión de la impresora 3D. Utilizar un espesor de 5.5 mm y 8 mm de espesor piso.
- Imprimir el laberinto utilizando una impresora 3D (véase tabla de materiales)32. Si una impresora 3D no está disponible en el laboratorio, utilizar otros materiales como madera, fibra de madera de densidad media o un plástico (es decir, cloruro de polivinilo), que puede adquirirse en tiendas de mejoras para el hogar.
- Debido a las restricciones de altura en el área de impresión, construir las paredes del laberinto en dos impresiones 3D separadas y se unen al conjunto del laberinto (es decir, una segunda altura de la pared fue agregada a la sección del laberinto para aumentar la altura de 140 mm, para una altura total del muro, de 280 mm). Cada base de impresión 3D independiente figura una "T" en forma de mecanismo de bloqueo, donde una sección conectada a la siguiente.
- En el cruce del brazo de arranque con los brazos de la meta, crear una sección amplia de 165 mm para unirse a la anchura del brazo de inicio con eso de los brazos de la meta. Construcción de los brazos del objetivo utilizando un método de diseño similar como el brazo de arranque; sin embargo, reducir la anchura del brazo a 100 mm por el diseño de diácono y Rawlins.
- Por favor, vea la figura 1 para detallado esquema y dimensiones de la T-laberinto.
- Incluyen una partición central en el diseño en la Unión de la Inicio brazo y brazos de meta. Esta partición se extienden desde la pared posterior de la T-laberinto y 200 mm en el brazo de arranque para dividir los brazos de la meta. Esta partición había extendida también la altura del laberinto (figura 1).
2. asphyxial cardiaco (ACA)
- Herramientas quirúrgicas de autoclave (121 ° C durante 15 min) antes de la iniciación de la cirugía. Desinfectar la mesa quirúrgica por etanol al 70% durante 15 minutos afeitar el pelo en el sitio de la cirugía. Aplique una solución de betadine para las superficies de operación quirúrgica de la piel.
- Anestesia
- Anestesiar ratas con 4% isoflurano y 30:70 mezcla de O2 y N2O (300 mL/min O2 y 700 mL/min N2O) mediante mascarilla.
- Dar ratas intubación para ventilación mecánica (después de la intubación, las ratas fueron conectadas a un ventilador).
- Mantener anestesia bajando isoflurano del 4% al 2% con una mezcla de 30:70 de O2 y N2O. Utilice el método de pellizco-respuesta para determinar la profundidad de la anestesia.
- Aplicar ungüento en los ojos para evitar la sequedad mientras esté bajo anestesia. Regulae la temperatura del cuerpo por un roedor cojín de calefacción con una sonda anal como una referencia de temperatura.
- Intubación endotraqueal
- Colocar la rata en la cámara de inducción. Anestesiar las ratas con 4% isoflurano y 30:70 mezcla de O2 y N2O.
- Quite la rata de la cámara de inducción. Animal anestesiado de lugar en la posición supina con la cara de la rata hacia la máscara de la anestesia.
- Mueva suavemente la lengua hacia la izquierda o derecha del animal con el pulgar y el dedo índice.
- Un catéter intravenoso flexible de calibre 14 (49 mm de longitud) se deslizan sobre una aguja de punta Roma de calibre 17 pipeteo (93 mm de longitud con 10 grados de ángulo en la punta de la aguja). Inserte la aguja de punta Roma de calibre 17 pipeteo en la tráquea.
- Extraiga con cuidado la aguja de calibre 17 pipeteada de la tráquea. Conecte el conector del catéter calibre 14 al ventilador. Ajustar el volumen de movimiento del ventilador a 0,67 mL/100 g y la frecuencia respiratoria de 60 respiraciones/minuto.
- Mantener la cabeza y la temperatura corporal a 37 ° C durante todo el procedimiento por un roedor cojín de calefacción con sonda anal como una referencia de temperatura.
- Cateterismo arterial y venoso femoral
- Afeitar el pelo cerca de la zona inguinal (ambos lados) y aplicar betadine para las superficies de operación quirúrgica de la piel.
- Colocar la rata en la posición supina. Hacer una incisión (10 mm) en el área inguinal con tijeras quirúrgicas.
- Separar el tejido conectivo por pinzas de punta Roma hasta que quede expuesto el ligamento inguinal. Utilice una pinza hemostática para agarrar el ligamento inguinal. La arteria femoral y la vena son por debajo del ligamento inguinal.
- Use pinzas de punta Roma para separar los tejidos hasta que la arteria femoral y la vena.
- Separe suavemente el nervio femoral que discurre a lo largo de la arteria femoral mediante pinzas de punta fina. Cuidadosamente separe la arteria femoral y vena como una unidad a través de pinzas de punta fina.
- Use pinzas de punta fina para separar la vena de la arteria femoral.
- Colocar 2 piezas de 5-0 sutura de seda (uno hacia la pierna y la otra hacia el cuerpo) debajo de la vena.
- Haga un nudo flojo en la parte cerca del cuerpo. Utilizar una pinza y tirar de la sutura lo más lejos posible hacia los lados opuestos del cuerpo.
- Haga un nudo flojo en el lado cerca de la pierna. Sujetar y tirar de la sutura hacia la pierna a través de una pinza hemostática para permitir que las venas se llenen de sangre.
- Hacer una pequeña incisión en la vena (aproximadamente 0.1 mm) tijeras disección micro (a un ángulo de 45°). Empaparse de sangre con una gasa esterilizada.
- Conecte una jeringa de aguja de punta Roma (llenada de solución salina con heparina 20 de U/mL) a un catéter PE-50. Llene el catéter PE-50 con solución salina con heparina U/mL 20. Cortar el catéter PE-50 con tijeras de disección a un ángulo de 45° para crear un punto o el agudo final. Use pinzas de punta Roma para sostener el extremo del catéter PE-50. Inserte suavemente el catéter PE-50 en la vena femoral.
- Después de inserta totalmente el catéter, lentamente administrar 0,1 mL de heparina/solución salina para asegurar que no hay ninguna fuga. Haga nudos de sutura firme (nudo-) para estabilizar el catéter PE-50. Mantener el catéter PE-50 para inyección (IV) intravenosa continua de varias drogas.
- Uso una jeringa de 1 mL conectada con un 23 calibre Luer adaptador de trozo de administrar bromuro de vecuronio (0,67 mg/kg, administrados cada 10 minutos) a través de la vena femoral para inmovilizar la rata durante el procedimiento.
- Colocar 2 piezas de 5-0 sutura de seda (uno hacia la pierna y la otra hacia el cuerpo) debajo de la arteria.
- Haga un nudo flojo en el lado cerca de la pierna. Utilizar una pinza y tirar de la sutura lo más lejos posible hacia la pierna.
- Haga un nudo flojo en la parte cerca del cuerpo. Sujetar y tirar de la sutura hacia el cuerpo a través de una pinza hemostática para permitir que la arteria se llenen de sangre.
- Hacer una pequeña incisión en la arteria (aproximadamente 0.1 mm) tijeras disección micro (a un ángulo de 45°).
- Conecte una jeringa de aguja de punta Roma (llenada de solución salina con heparina 20 de U/mL) a un catéter PE-50. Llene el catéter PE-50 con solución salina con heparina U/mL 20. Cortar el catéter PE-50 con tijeras de disección en un ángulo de 45 grados para crear un punto o sostenido final. Use pinzas de punta Roma para sostener el extremo del catéter PE-50. Use pinzas de punta Roma para sostener el extremo del catéter PE-50. Inserte suavemente el catéter PE-50 en la arteria femoral.
- Después de inserta totalmente el catéter, lentamente tire hacia atrás la jeringa para asegurarse que el catéter está funcional. Haga nudos de sutura firme (nudo-) para estabilizar el catéter PE-50. Mantener el catéter PE-50 para registro continuo de presión arterial, gases de sangre.
- Asphyxial procedimiento cardiaco (ACA)
- Ajuste los parámetros fisiológicos (pO2, pCO2, presión arterial y valor de pH) según sea necesario mediante la modulación de volumen sistólico, O2 o N2O niveles. Utilizar los rangos fisiológicos normales de estos parámetros: pO2: 100 mmHg, pCO2: 35-40 mmHg, la presión arterial: 100 mmHg y pH: 7.4.
- Uso una jeringa de 1 mL conectada con un adaptador de trozo de Luer de 23 calibre para administrar bromuro de vecuronio (0,67 mg/kg, I.V.) a través de la vena femoral y esperar 2 minutos Asegúrese de que la presión arterial es en o alrededor de 100 mmHg antes de realizar ACA.
- Induce apnea (6 min) desconectando el tubo endotraqueal (calibre 14 eje del catéter) del ventilador. Además bloquear el tubo endotraqueal por una jeringa de 1 mL para apnea completado.
Nota: El tiempo de 6 min asfixia se define como el periodo de desconexión del ventilador y el inicio de la resucitación. Cardiaco completo se define como una presión arterial media inferior a 10 mmHg. - Durante el último minuto de la apnea, ajuste de la frecuencia respiratoria del ventilador a 80 respiraciones/minuto y aumentar O2 a 2 L/min con 0% N2O. Esta acción se sople cualquier restante isoflurano o N2O permanecer en el ventilador.
- min después de apnea, retirar jeringa de 1 mL del tubo endotraqueal. Vuelva a conectar el tubo endotraqueal al ventilador.
- Uso una jeringa de 1 mL conectada con un 23 calibre adaptador Luer trozo de administrar epinefrina (0,005 mg/kg, I.V.) a través de la vena femoral y administrar compresiones manuales por el pulgar, índice y dedos medios en el pecho del animal en un movimiento circular ligero en la x y eje z (200/min) hasta el retorno de la circulación espontánea (presión arterial media ≥ 50 mmHg)33,34,35.
- Usar otra jeringa de 1 mL conectada con un 23 calibre Luer adaptador de stub para administrar bicarbonato de sodio (1 meq/kg, I.V.) vía vena femoral inmediatamente después del retorno a circulación espontánea (50 mmHg o superior)33,34, 35 para aliviar la acidosis respiratoria.
- Sangre de medida de los gases otra vez 10 minutos después de la resucitación para determinar el estado ácido-base (pH después de ACA debe estar alrededor de 7,35 a 7,40)
- Utilizar una pinza para apretar la arteria femoral y la vena. Despacio y con cuidado retire los catéteres arteriales y venosos con unas pinzas de punta Roma. Ligar la arteria femoral vena con una sutura de seda 5-0 para evitar el sangrado. Cerca de la piel que cubre el sitio quirúrgico usando una sutura de seda 3-0. Use la técnica de sutura interrumpida para minimizar las posibilidades de la reapertura de la herida.
- Espere hasta que la rata se respira (generalmente 30 min a 60 min después de la resucitación), desconecte la rata del ventilador y quite con cuidado el tubo endotraqueal.
- Lugar la rata en la incubadora del bebé (27 ° C, 50% de humedad) durante la noche. Coloque la comida ablandada (hecho por inmersión en el agua) y agua en la incubadora del bebé durante la noche.
- La rata de transferencia a las jaulas individuales y retomar la rata de Animalario con chow regular y agua. Pruebas de T-laberinto iniciarán 3 días después de ACA.
3. T-laberinto
-
Preparación de animales
- El día antes de la cirugía (simulado o ACA), manejar cada rata durante 5 minutos. Nunca eleve las ratas de su jaula (480 mm x 250 mm x 200 mm, jaula de plástico transparente) cuando manejo (figura 2).
- Después de tocar la rata, suavemente Levante la rata por la cola con una mano con la otra mano apoyando sus ' piernas. Que ir de la mano a la jaula (100 mm de altura) 5 veces. Separe cada rata en jaulas individuales, por lo que no se dominan para alimentos o lucha.
- Tres días después de la farsa o ACA cirugía (figura 2), transfiera las ratas con la jaula en una habitación tranquila y oscura antes del inicio de la primera carrera. Sólo encender una lámpara de baja potencia y colóquelo en la esquina de la sala de pruebas para mantener la iluminación mínima. Permitir que la rata para adaptarse a la oscuridad durante 10 minutos.
- Realizar todos los experimentos en la tarde para evitar los efectos de la variación diurna en el desempeño de las ratas. No recomiendo el operador en que rata recibida simulado o cirugía ACA.
-
Alternancia espontánea
- Aplique una capa delgada de la ropa de cama (~ 10 mm de espesor) para cubrir todo el piso del laberinto. Lugar entonces la rata en el brazo de inicio (parte inferior de la "T"), que es el punto de partida de cada uno ejecute y permitir que cada uno rata 3 minutos para explorar el brazo derecho o izquierdo de la meta.
- Una vez que la rata se compromete a un brazo de objetivo particular (todos cuatro patas de la rata han entrado en el brazo de meta), bloquear al cruce en "T" entre el brazo de arranque y el brazo opuestos de meta (figura 1) para evitar que la rata en el brazo opuesto de meta. Deja la rata en el laberinto durante 30 segundos, luego coge la rata y coloque en su jaula durante un tiempo mínimo (30 segundos). Luego retire el cruce en "T" cuadra (125 mm X 230 mm X 65 mm, de una impresora 3D) de la T-laberinto.
- Colocar la rata en el brazo de salida y repita el 3.2.2. Alternancia se define como: cuando la rata entra en el otro brazo en comparación con el anterior ejecutar36. Tienen ratas realizar 4 carreras al día como sigue:
1st ejecutar
2nd run
descanso de 10 minutos
ejecutar 3rd
ejecutar 4th - Cambiar la ropa de cama durante el descanso de 10 minutos y entre los animales para eliminar el sesgo de aroma. Limpie el T-laberinto con etanol 75% seguido de agua destilada al final de cada día experimental.
- Repita los pasos 3.2.1. -3.2.4. dos días más (12 carreras en total) como en la figura 2.
-
Cálculos de tasa preferencia índice y lado de alternancia
- Calcular el % de alternancia y el % de preferencia de lado, donde
L: las ratas eligen el brazo izquierdo
R: las ratas eligen el brazo derecho
Correcta elección: 2nd correr es diferente de la 1st en un conjunto dado (cada juego contiene dos carreras)
Elección incorrecta: las ratas eligen el mismo brazo, similar a la anterior gestión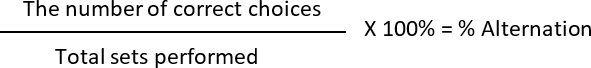
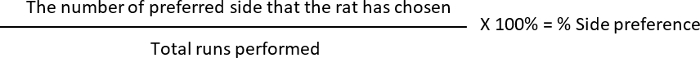
Ejemplo:
Día 1: L L / L L
Día 2: L L / L R
Día 3: R L / L L
Alternancia: 2 (decisiones correctas) 6 (sistemas total realizadas) * 100 = 33.33%
Preferencia lateral: 10 (L, lado preferido) 12 (corre total realizada) * 100 = 83.33%
- Calcular el % de alternancia y el % de preferencia de lado, donde
-
Cuidados postoperatorios:
- Dar ratas buprenorfina (0.01 mg/kg IP) cada 12 h durante 2 días después de la cirugía. Observar las ratas hasta 1 h después de un paro cardíaco.
- Fije las ratas el ventilador y la almohada hasta que ha recuperado la conciencia suficiente para mantener el recumbency esternal. Para mantener la temperatura corporal de los animales después de la cirugía, colocar la rata en una incubadora del bebé (fijado a 27 ° C, 50% de humedad).
- Proporcionar chow ablandada (hecho por remojo en agua) a los animales para las primeras 24 h después de la cirugía. Si las ratas no eran agua potable, administrar solución salina bacteriostática (100 mL/kg/día, I.P.) hasta que el animal se recupera y es agua potable libremente.
- Dar el antibiótico tópico de ratas con alivio del dolor (ungüento de bacitracina y lidocaína) en todas las heridas. Retroceder las ratas a un centro de animales después de que se recuperen completamente.
-
Método de eutanasia
- Use 5% isoflurano y 100% N2O eutanasia de los animales al final del experimento.
Resultados
ACA (isquemia cerebral global) causa principalmente trabajo (corto plazo) los déficits de memoria28,29. Para evaluar la función del aprendizaje y la memoria después de ACA, se utilizó el test de alternancia espontánea modificada para evaluar el trabajo de memoria (a corto plazo)30. Los resultados del test de alternancia espontánea sugieren que la tasa de la alternancia de tres días consecutivos en el...
Discusión
Las modificaciones fueron hechas en el presente estudio en comparación con el diácono y los Rawlins protocolo31. La impresora 3D se utilizó para construir la T-laberinto. La impresión 3D proporciona alternativas asequibles y rentables para T-laberinto comercializado. Para reducir la ansiedad de ratas durante la prueba, el T-laberinto se realizó en el cuarto oscuro con iluminación mínima. Una vez que la rata de uno de los brazos de la meta, nos bloquearon suavemente el brazo opuesto. Esto ev...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por los institutos de salud nacional Instituto Nacional de trastornos neurológicos y accidente cerebrovascular conceder 1R01NS096225-01A1, concede a la Asociación Americana del corazón AHA-13SDG1395001413, 17GRNT33660336 de AHA, AHA-17POST33660174, la Subvención de Universidad del estado de Louisiana en Consejo de investigación de ayuda, el Malcolm Feist beca de Investigación Cardiovascular y el Evelyn F. McKnight Brain Institute.
Materiales
| Name | Company | Catalog Number | Comments |
| 3D Printer | MakerBot | Replicator | Fifth generation |
| 3D Printer Filament | Hatchbox | PLA, 1.75 mm filament diameter | |
| 200 Proof Pure Ethanol | Koptec | V1005SG | |
| Sani-Chips | PJ Murphy-Forest Products | Size: 8 to 20 mesh; 2.2 cubic foot/package; autoclavable bags | |
| Rat | Charles River Laboratories | Sprague-Dawley | |
| Vecuronium bromide | Sun Pharmaceutical | 47335-931-40 | 10 mg |
| Epinephrine | Par Pharmaceutical | 42023-103-01 | Adrenalin Chloride Solution 1 mg/mL, 1:1000 |
| Buprenorphine Hydrochloride Injection | Pfizer | 00409-2012-32 | 0.3mg/mL |
| SketchUp | Trimble Inc. | 3D modeling software | |
| VentElite Small Animal Ventilator | Harvard Apparatus | 55-7040 | Animals raging in size from mouse to guinea pig (10g to 1kg) |
| PowerLab 8/35 | Adinstruments | PL3508 | 8 analog input channels – 4 of which can be used in differential mode. |
| Bio Amps | Adinstruments | FE132 | The Bio Amp is a galvanically isolated, high-performance differential bio amplifier optimized for the measurement of a wide variety of biological signals such as ECG, EMG and EEG recordings. |
| Quad Bridge Amp | Adinstruments | FE224 | A four-channel, non-isolated bridge amplifier designed to allow the PowerLab to connect to most DC bridge transducers. |
| LabChart 8 | Adinstruments | ||
| ABL80 FLEX CO-OX blood gas analyzer | Radiometer | pH / p CO2 / p O2 | |
| SURFLO Teflon I.V. Catheter | Terumo | sc-361556 | Only use the flexible thin wall catheter (49-mm long) |
| Pipet/Infusion Needle | Hamilton | 7748-03 | 17-gauge; 93-mm long; 10-degree angle |
| Classic T3 Vaporizer | SurgiVet | VCT302 | Classic T3 Isoflurane Funnel Fill |
| ENVIRO-PURE Charcoal Canister | SurgiVet | 32373B10 | Designed to absorb waste anesthetic gas |
| O2 single flowmeter | SurgiVet | 32375B1 | 0-1000 mL |
| N2O Flowmeter | VetEquip | 401721 | 0-4LPM |
| Clay Adams Intramedic Luer-Stub Adapter (Sterile) | Becton Dickinson | 427565 | 23 gauge |
| Micro Forceps | Black and Black surgical | B3FRC-18 RM-8 | 7 1/4" (18 cm), 8mm RH, counterweight w/ guide pin 2mm, platform 6 x .3 mm, curved. |
| Halstead Mosquito Forceps | Roboz | RS-7111 | Curved; 5" Length, 1.3 mm tip diameter, 2.1 mm jaw width |
| Mixter Forceps | Roboz | RS-7291 | 5.25" Curved Extra Delicate, 1.1 mm tips |
| Castroviejo Micro Dissecting Spring Scissors | Roboz | RS-5650 | Straight, Sharp Points; 9 mm Cutting Edge; 0.15 mm Tip Width; 3 1/2" Overall Length |
| Mayo-Stille Scissors | Roboz | RS-6891 | 5.5" Round Curved |
| Dumont #5 Forceps | Roboz | RS-5058 | 45 Deg Dumoxel Tip Size .10 x .06 mm |
| Olsen-Hegar Combination Scissor And Needle Holder | Roboz | RS-7884 | Cross Serration Tip; 5.5" Length |
| Moloney Forceps | Roboz | RS-8254 | Serrated; Slight Curve; 4.5" Length |
Referencias
- Writing Group, M., et al. Heart Disease and Stroke Statistics-2016 Update: A Report From the American Heart Association. Circulation. 133, e38-e360 (2016).
- Beuret, P., et al. Cardiac arrest: prognostic factors and outcome at one year. Resuscitation. 25, 171-179 (1993).
- Kim, Y. J., et al. Long-term neurological outcomes in patients after out-of-hospital cardiac arrest. Resuscitation. 101, 1-5 (2016).
- Earnest, M. P., Yarnell, P. R., Merrill, S. L., Knapp, G. L. Long-term survival and neurologic status after resuscitation from out-of-hospital cardiac arrest. Neurology. 30, 1298-1302 (1980).
- Cerchiari, E. L., Safar, P., Klein, E., Cantadore, R., Pinsky, M. Cardiovascular function and neurologic outcome after cardiac arrest in dogs. The cardiovascular post-resuscitation syndrome. Resuscitation. 25, 9-33 (1993).
- Petito, C. K., Feldmann, E., Pulsinelli, W. A., Plum, F. Delayed hippocampal damage in humans following cardiorespiratory arrest. Neurology. 37, 1281-1286 (1987).
- Schmidt-Kastner, R., Freund, T. F. Selective vulnerability of the hippocampus in brain ischemia. Neuroscience. 40, 599-636 (1991).
- Corkin, S. What's new with the amnesic patient H.M.?. Nat Rev Neurosci. 3, 153-160 (2002).
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. 1957. J Neuropsychiatry Clin Neurosci. 12, 103-113 (2000).
- Smith, T. D., Calhoun, M. E., Rapp, P. R. Circuit and morphological specificity of synaptic change in the aged hippocampal formation. Neurobiol Aging. 20, 357-358 (1999).
- Gage, F. H., Dunnett, S. B., Bjorklund, A. Spatial learning and motor deficits in aged rats. Neurobiol Aging. 5, 43-48 (1984).
- Tulving, E., Markowitsch, H. J. Episodic and declarative memory: role of the hippocampus. Hippocampus. 8, 198-204 (1998).
- Neigh, G. N., et al. Cardiac arrest with cardiopulmonary resuscitation reduces dendritic spine density in CA1 pyramidal cells and selectively alters acquisition of spatial memory. Eur J Neurosci. 20, 1865-1872 (2004).
- Volpe, B. T., Davis, H. P., Towle, A., Dunlap, W. P. Loss of hippocampal CA1 pyramidal neurons correlates with memory impairment in rats with ischemic or neurotoxin lesions. Behav Neurosci. 106, 457-464 (1992).
- Astur, R. S., Taylor, L. B., Mamelak, A. N., Philpott, L., Sutherland, R. J. Humans with hippocampus damage display severe spatial memory impairments in a virtual Morris water task. Behav Brain Res. 132, 77-84 (2002).
- Lee, R. H., et al. Fatty acid methyl esters as a potential therapy against cerebral ischemia. OCL. 23, D108 (2016).
- Lee, R. H., Porto, L. F., et al. Chapter 1. Palmitic acid: occurrence, biochemistry and health effects. , 1-15 (2014).
- Tolman, E. C., Gleitman, H. Studies in spatial learning; place and response learning under different degrees of motivation. J Exp Psychol. 39, 653-659 (1949).
- Koopmans, G., Blokland, A., van Nieuwenhuijzen, P., Prickaerts, J. Assessment of spatial learning abilities of mice in a new circular maze. Physiol Behav. 79, 683-693 (2003).
- Barnes, C. A. Memory deficits associated with senescence: a neurophysiological and behavioral study in the rat. J Comp Psychol. 93, 74-104 (1979).
- Paul, C. M., Magda, G., Abel, S. Spatial memory: Theoretical basis and comparative review on experimental methods in rodents. Behav Brain Res. 203, 151-164 (2009).
- Vorhees, C. V., Williams, M. T. Assessing spatial learning and memory in rodents. ILAR J. 55, 310-332 (2014).
- Sharma, S., Rakoczy, S., Brown-Borg, H. Assessment of spatial memory in mice. Life Sci. 87, 521-536 (2010).
- Poon, T. P., et al. Spinal cord toxoplasma lesion in AIDS: MR findings. J Comput Assist Tomogr. 16, 817-819 (1992).
- Sunyer, B., Patil, S., Höger, H., Lubec, G. Barnes maze, a useful task to assess spatial reference memory in the mice. Nat Protoc. 390, (2007).
- Shoji, H., Hagihara, H., Takao, K., Hattori, S., Miyakawa, T. T-maze forced alternation and left-right discrimination tasks for assessing working and reference memory in mice. J Vis Exp. , (2012).
- Seeger, T., et al. M2 muscarinic acetylcholine receptor knock-out mice show deficits in behavioral flexibility, working memory, and hippocampal plasticity. J Neurosci. 24, 10117-10127 (2004).
- Olton, D. S., Feustle, W. A. Hippocampal function required for nonspatial working memory. Exp Brain Res. 41, 380-389 (1981).
- Hayashida, K., et al. Hydrogen inhalation during normoxic resuscitation improves neurological outcome in a rat model of cardiac arrest independently of targeted temperature management. Circulation. 130, 2173-2180 (2014).
- Dember, W. N., Richman, C. L. . Spontaneous alternation behavior. , (1989).
- Deacon, R. M., Rawlins, J. N. T-maze alternation in the rodent. Nature protocols. 1, 7-12 (2006).
- Wong, K. V., Hernandez, A. A review of additive manufacturing. ISRN Mechanical Engineering. 2012, (2012).
- Lin, H. W., et al. Derangements of post-ischemic cerebral blood flow by protein kinase C delta. Neuroscience. 171, 566-576 (2010).
- Lin, H. W., et al. Fatty acid methyl esters and Solutol HS 15 confer neuroprotection after focal and global cerebral ischemia. Transl Stroke Res. 5, 109-117 (2014).
- Lee, R. H., et al. Interruption of perivascular sympathetic nerves of cerebral arteries offers neuroprotection against ischemia. Am J Physiol Heart Circ Physiol. 312, H182-H188 (2017).
- Bali, Z. K., et al. Differential effects of alpha7 nicotinic receptor agonist PHA-543613 on spatial memory performance of rats in two distinct pharmacological dementia models. Behav Brain Res. 278, 404-410 (2015).
- McDonald, J. H. . Handbook of biological statistics. 2, (2009).
- Castellano, M. A., Diaz-Palarea, M. D., Rodriguez, M., Barroso, J. Lateralization in male rats and dopaminergic system: evidence of right-side population bias. Physiol Behav. 40, 607-612 (1987).
- Andrade, C., Alwarshetty, M., Sudha, S., Suresh Chandra, J. Effect of innate direction bias on T-maze learning in rats: implications for research. J Neurosci Methods. 110, 31-35 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados