Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El efecto de la aplicación de aceite esencial de tomillo en la carga microbiana durante el secado de la carne
En este artículo
Resumen
Microorganismos como Escherichia coli que contaminan productos cárnicos causan enfermedades transmitidas por los alimentos. El uso de aceites esenciales en el proceso de secado de carne no ha sido estudiado profundamente. Aquí, presentamos un novedoso método de la aplicación de aceite esencial de tomillo a la carne durante el secado para reducir la carga microbiana en la carne seca.
Resumen
La carne es una comida de alto valor proteico que se utiliza en la elaboración de Cecina, un bocado de comida popular, donde la conservación y seguridad son importantes. Para asegurar la inocuidad de los alimentos y prolongar la vida útil de carne y productos cárnicos, el uso de conservantes sintéticos o naturales se han aplicado para controlar y eliminar bacterias transmitidas por los alimentos. Un creciente interés en la aplicación de aditivos alimenticios naturales para carne se ha incrementado. Microorganismos como Escherichia coli, contaminan la carne y productos cárnicos, que causan enfermedades transmitidas por los alimentos. Por lo tanto, es necesario mejorar el proceso de conservación de la carne. Sin embargo, el uso de los aceites esenciales cuando se se seca la carne no ha sido profundamente estudiado. En este sentido, es una oportunidad para aumentar el valor de la carne seca y reducir el riesgo de enfermedades transmitidas por los alimentos mediante la aplicación de aceites esenciales durante el proceso de secado. En este protocolo, se presenta un método novedoso de la aplicación de aceite esencial de tomillo (TEO) durante el secado, especialmente en forma de vapor directamente en una cámara de secado de la carne. Para la evaluación, utilizamos la concentración inhibitoria mínima (MIC) para detectar el número de bacterias dañinas en las muestras tratadas en comparación con las muestras crudas. Los resultados preliminares muestran que este método es una opción viable y alternativa a los preservativos sintéticos y que reduce significativamente la carga microbiana en la carne seca.
Introducción
Secado como un método tradicional para conservar los alimentos se ha utilizado desde la antigüedad. Hoy en día, existe un creciente interés en el secado como un método eficaz para la conservación de alimentos1,2,3. Se utiliza para hacer una variedad de carnes especialmente procesadas. Uno de los más conocidos es desigual.
Desiguales, uno de los métodos más antiguos para la conservación de la carne, se basan en el curado y secado a baja actividad de agua y por lo tanto, para extender su vida útil4. Hoy en día, cecina, una carne curada conservada sigue siendo muy popular, donde la seguridad alimentaria, el sabor y la textura son esenciales. Preparación desigual se puede utilizar para casi cualquier tipo de carne, incluyendo carne de res, cerdo, aves de corral o juego5, y se requiere picar la carne en tiras de magras y secarla. Generalmente, marinar la carne en una solución de curado o fumar se utilizan junto con el secado para dar la cecina su característico sabor6.
A pesar del gran interés de secado para realmente conservar los alimentos, el riesgo de transmitidas por los alimentos brotes por e. coli de la carne mal secada es crítico y debe ser controlado. Hay algunos estudios sobre brotes de gastroenteritis transmitidas por los alimentos especialmente con e. coli O157: H7, atribuido al calor inadecuado procesamiento durante el secado en casa. Casos similares han ocurrido incluso en preparados comercialmente desigual7,8,9. Levine et al. 10 propuestas que transmitidas por los alimentos microorganismos pueden sobrevivir a condiciones de secado moderadas (aproximadamente 60 ° C) utilizadas por los productores comerciales de desiguales. E. coli O157: H7 brotes de enfermedades transmitidas por alimentos en medio de la década de 1990 fueron atribuidos a tierra secada carne productos6,11. Curiosamente, en todos los casos anteriores, el principal riesgo es causado por bacterias patógenas reconocidos como viable pero no cultivable (VBNC). Bajo diferentes tensiones tales como cambios de temperatura o inanición, las células de e. coli podrían entrar en un estado especial denominado estado VBNC12,13. Las células VBNC pueden ser reanimadas a células cultivables por la exposición a las condiciones adecuadas y luego presentan una amenaza para la salud humana debido a la contaminación de los alimentos14,15. Esto significa que si la carne se consume inmediatamente después de secado el producto es seguro. Sin embargo, en el caso de almacenamiento inadecuada, tales como aumento de la humedad, existe un alto riesgo de reactivación de patógenos y crecimiento microbiano.
Además de métodos de secado y adobo, hay una alta demanda de los consumidores a utilizar productos naturales como alternativa a los aditivos para mejorar la calidad de alimentos16,17. Ha habido un interés particular en la aplicación de aditivos alimenticios naturales para carne en lugar de preservativos sintéticos clásicos18,19,20,21. A pesar de que hay una falta de suficiente evidencia experimental en el uso de aceites esenciales al secar la carne, la investigación temprana en este campo ya muestra resultados positivos22,23.
Desde la edad media, las personas han reconocido compuestos de aceites esenciales (ética) para sus características antimicrobianas, insecticidas y antiparasitarios24,25,26. Hoy en día, ética es parte de uno de los más importantes grupos de compuestos naturales bioactivos. Entre las diferentes ubicaciones, timol es uno de los más conocidos. Se compone de más del 85% de TEO23. Este fenol previene el deterioro microbiano y químico cuando se añade a los alimentos. Además, sus propiedades antibacterianas podrían mejorarse en combinación con otros conservantes naturales2,27,28,29,30. Hoy en día, tomillo (Thymus vulgaris), una hierba que pertenece a la familia Lamiaceae , ha sido reconocido como agente saborizante y una carne muy eficaz preservativo31. Un estudio realizado por García-Díez et al. 30 productos cárnicos encontró que TEO muestra un patrón de inhibición más ampliado contra los agentes patógenos de los alimentos en comparación con otros aceites esenciales. Por lo tanto, es una oportunidad para aumentar el valor de la carne seca y reducir el riesgo de enfermedades transmitidas por los alimentos mediante la aplicación de aceites esenciales durante el proceso de secado.
En este protocolo, se presenta un método novedoso de la aplicación de TEO durante el secado de la carne, específicamente en forma de vapor directamente en una sequedad del compartimiento. Para la evaluación, utilice el micrófono para determinar la ausencia de bacterias patógenas en muestras tratadas en comparación con los crudos. Los resultados preliminares muestran que este método es una alternativa muy eficaz a los preservativos sintéticos y que reduce significativamente la carga microbiana en la carne seca.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. preparación de la carne
- Obtener un corto lomo de carne de res (carne fresca de bíceps femoris) de una carnicería local y traslado al laboratorio.
Nota: Se recomienda para el transporte del lomo de vaca a temperatura ambiente (20-25 ° C), por un período no superior a 20 minutos en una bolsa de sellado hermética. - Para esterilizar la superficie externa del músculo de carne de res, en un gabinete, laminares de seguridad lavar el músculo rociando con etanol al 70% (v/v) durante 10 s con una botella del apretón de 500 mL. Aplicar 0,025 g de etanol por 1 cm2 de superficie del músculo.
- Retirar asépticamente la superficie exterior de la carne con un cuchillo para evitar etanol restante en el interior del músculo. Retire aproximadamente 3 mm del interior del músculo para mantener la uniformidad superficial del músculo.
- Paquete el músculo en una bolsa de plástico sellada y transferirlo a un congelador.
- Almacenar el músculo a-18 ° C por 1 día. Entonces, descongelar los músculos congelados a 4 ° C por 6 h.
Nota: Para descongelar, es aconsejable mover el músculo del congelador a la nevera. - En un gabinete de seguridad laminar, cortar cada músculo en rodajas de 0,5 cm con un cortador de carne. Luego, con un cuchillo córtalo en pequeños 5 × 2,5 cm2 muestras rectangulares.
- Paquete de las muestras de carne rectangular en bolsas de plástico y guárdelos en el congelador a-18 ° C para su uso posterior.
2. preparación del inóculo estandarizado y procedimiento de inoculación en un gabinete de seguridad Laminar
- Preparar el inóculo estandarizado (1,5 × 108 UFC/mL) de e. coli ATCC 25922 para inocular las muestras de carne.
- Para la preparación del inóculo de stock, dispensar primero el cultivo bacteriano liofilizado (entregado por el proveedor) en un tubo de 15 mL estéril Prellenado con 10 mL de esterilizado tampón Mueller Hinton caldo (BMHB). Cultivar esta suspensión durante 24 h a 37 ° C.
- Prepare la solución bacteriana como sigue: tomar aproximadamente 0,1 - 0,2 mL de suspensión bacteriana y diluída en un frasco de 20 mL cerrado con un tapón de caucho con un casquillo de aluminio previamente llenado con 15 mL de BMHB esterilizada. Cultivar esta suspensión durante 24 h a 37 ° C.
- Guarde dentro del refrigerador a 4 ° C para la preparación del inóculo estandarizado.
- De la solución (ver paso 2.1.1) de E. coli tomar aproximadamente 0,1 - 0,2 mL de suspensión bacteriana y diluir en 15 mL de plástico esterilizado tubo precargada con 10 mL de esterilizado tampón Mueller Hinton caldo (BMHB). Incubar el tubo a 37 º C durante 24 h.
- Para la preparación del inóculo estandarizado (1,5 × 108 UFC/mL), añadir pequeñas cantidades de esta suspensión en un tubo de 15 mL estéril Prellenado con 10 mL de BMHB esterilizada.
- Fondo vórtice la mezcla y medir la densidad óptica (OD) a 600 nm de un densitómetro de32.
- Repita los pasos 2.1.3 - 2.1.4 hasta el OD expresado como el valor de McFarland se incrementa de 0.5 comparado con el valor de BMHB limpio.
- Para la preparación del inóculo de stock, dispensar primero el cultivo bacteriano liofilizado (entregado por el proveedor) en un tubo de 15 mL estéril Prellenado con 10 mL de esterilizado tampón Mueller Hinton caldo (BMHB). Cultivar esta suspensión durante 24 h a 37 ° C.
- Para el procedimiento de inoculación, coloque las muestras de carne rectangular de dos hojas de aluminio diferentes (20 x 30 cm), uno para las muestras de control y el segundo para las muestras de carne inoculada.
- Sobre el segundo papel de aluminio, inocular las muestras de carne rectangular con 800 μl de suspensión de las bacterias de la cepa seleccionada (esto corresponde a 1,2 × 108 CFU por ejemplo carne) distribuyendo uniformemente el inóculo sobre la superficie.
- Pipetee 400 μL en un lado de la muestra y extender suavemente utilizando un separador celular estéril en la superficie. Deje secar durante 10 minutos repetir el mismo procedimiento para el resto de la suspensión en el otro lado de la muestra.
- Sobre el segundo papel de aluminio, inocular las muestras de carne rectangular con 800 μl de suspensión de las bacterias de la cepa seleccionada (esto corresponde a 1,2 × 108 CFU por ejemplo carne) distribuyendo uniformemente el inóculo sobre la superficie.
3. secado y aplicación de la TEO
- Transferencia de dos láminas de aluminio que contienen las muestras de carne rectangular desde el gabinete de seguridad laminar a la secadora: cubrir con papel de aluminio y luego colocar las muestras dentro de la secadora.
- Llevar a cabo el secado en un secador de laboratorio estándar.
Nota: en primer lugar, precalienta el horno a 55 ° C. Este procedimiento puede durar 20 minutos.- Secar las muestras de control de 6 h a 55 ° C, con valores de humedad relativa del aire oscilan entre 30-45% de secado.
Nota: Valores de humedad relativa de aire secado varían en tiempo dependiendo de la velocidad de evaporación del líquido de la carne.
- Secar las muestras de control de 6 h a 55 ° C, con valores de humedad relativa del aire oscilan entre 30-45% de secado.
- Calcular el volumen de TEO aplicado y expresar la concentración de aceite esencial como un volumen de TEO por secadora de volumen (mL/L de aire). Por ejemplo, la dosis de 1,5 mL de TEO en 53 L (volumen de la secadora) resulta en una concentración de 0,028 mL/L de aire. Para determinar la CMI de TEO para e. coli, se usan dosis de 1.5 mL (0,028 mL/L de aire), 1 mL (0,019 mL/L de aire) y 0,75 mL (0,014 mL/L de aire).
- Antes del secado, para la aplicación de la TEO vapores (con timol como el compuesto principal 79%), remoje un filtro de papel (12 x 20 cm) con una dosis de 1.5 mL de TEO y lugar dentro de la secadora delante del ventilador.
- Secar las muestras de carne TEO tratada utilizando el mismo procedimiento que las muestras de control (pasos 3.1 y 3.2).
Nota: Después de los extremos del proceso secado y las muestras se retiran, encienda el horno durante 3 horas a 80 ° C y establecer la indicación de la válvula de aire a la salida de aire del 100% para limpiar los residuos de aceite esencial del horno.
4. microbiana análisis
- Antes de la inoculación de la carne con bacterias, examinar las muestras de carne para cualquier adulteración. La aparición de limo y la detección de cualquier olor fuerte y picante son indicativas de deterioro de la carne. Si la textura se siente viscosa, las bacterias pueden han comenzado a multiplicarse en la superficie de la carne.
- Para evaluar la eficiencia de la inoculación, pruebe las muestras inoculadas crudas por la presencia de e. coli ATCC 25922 y compararlos con las muestras control sin inocular antes del procedimiento de secado. Para este propósito:
- Lave cada muestra de carne (2 muestras de control y 2 muestras inoculadas). Suspender cada muestra de carne en un frasco esterilizado con agua de peptona tamponada (8,5 g de NaCl, 1 g de peptona, 5 comprimidos de solución salina con tampón fosfato y 1 g de polisorbato 80 en 1 L de agua) en una proporción de 1:10 (p/v) con un rango de pH de 7-7.3. Agitar con un agitador a 140 rpm durante 10 min a temperatura ambiente.
Nota: Lave inmediatamente después del procedimiento de inoculación. - Evaluar el número de bacterias por un ajustado 6 × 6 procedimiento de placa gota por Chen, Nace y Irwin33 placa Count Agar (PCA) y Agar de MacConkey (MCA).
Nota: El método de caída de 6 × 6 utiliza el método de micro dilución en caldo para preparar diluciones seriadas 10 veces de la muestra investigada con una pipeta multicanal, que es menos mano de obra intensiva y más económico en comparación con el método convencional33, 34. - Cultivar las diluciones de muestra serial 10 veces por el procedimiento de placa gota de 6 × 6 para la evaluación de e. coli.
Nota: Particularmente para los 6 × 6 el método de caída, para cultivo uso seis 5 μl-gotas, de seis seleccionados diluciones de la muestra investigada con una pipeta multicanal. En platos de Petri debidamente secadas, las gotas se absorben rápidamente en el agar y la plantación de este método es muy conveniente y manejable34. - Incubar las cajas Petri a 37 ° C durante 24 h. Después del período de cultivo, evaluar el número de colonias de e. coli en los platos de Petri (UFC g-1 de carne seca) como se describe en la sección 5.
- Lave cada muestra de carne (2 muestras de control y 2 muestras inoculadas). Suspender cada muestra de carne en un frasco esterilizado con agua de peptona tamponada (8,5 g de NaCl, 1 g de peptona, 5 comprimidos de solución salina con tampón fosfato y 1 g de polisorbato 80 en 1 L de agua) en una proporción de 1:10 (p/v) con un rango de pH de 7-7.3. Agitar con un agitador a 140 rpm durante 10 min a temperatura ambiente.
- Después de secar, tomar dos muestras secadas inoculadas y compararlos con dos muestras de secado control no inoculado para viables e. coli, respectivamente. Para determinar la presencia o ausencia de e. coli de estos cuatro amplios s, llevar a cabo el proceso de enriquecimiento antes de cada muestra de carne como sigue:
- Suspender cada muestra de carne en un frasco esterilizado con agua de peptona tamponada (ver paso 4.2.1) y agitar con un agitador a 140 rpm durante 10 min a temperatura ambiente. Luego incubar cada frasco a 37 ° C durante 6 h para el enriquecimiento previo.
- Para la evaluación y el cultivo de las bacterias, siga el mismo procedimiento como se describe en pasos 4.2.2 - 4.2.4.
5. revisar los resultados
- Una vez finalizada la incubación, retirar los platos de Petri de la incubadora y revisar los resultados como sigue:
- Para evaluar el número total de colonias, examinar las placas para la presencia de bacterias aerobias mesófilas en PCA (puntos blancos) y el típico e. coli colonias (rojas a rosado oscuro) en MCA. Si el patógeno está ausente, tanto agares no presentan ningún crecimiento.
- Contar las colonias y determinar la cantidad de e. coli (UFC/g-1 de carne seca) presente.
Nota: Cuente el número de colonias (N) en dos diluciones consecutivas con 30 o menos colonias por cada gota (figura 1). El número N de UFC/g-1 de carne seca se determina como sigue35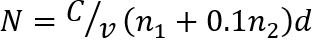
donde, C es la suma de las colonias sobre todo gotas contadas, v es el volumen de dilución de la muestra utilizada por cada gota (aquí, 0.05 mL), n1 es el número de gotas en la primera dilución, n2 es el número de gotas utilizado en la segunda dilución, y d representa la dilución que las primeras cuentas fueron capturadas.
- Para analizar los datos microbiológicos, convertir al número de colonias a log ufc g-1 y someterlas a análisis de varianza (ANOVA) para los principales efectos de tratamiento36.
- Realizar la prueba de diferencia significativa honesta de Tukey (Tukey HSD) para múltiples comparaciones de media36 y determinar las diferencias significativas entre tratamientos.
Access restricted. Please log in or start a trial to view this content.
Resultados
Primero habíamos desarrollado anteriormente este método mediante el uso de aceite esencial de orégano (OEO) para mejorar la seguridad alimentaria y aumentar el valor de la carne seca. En general, los experimentos anteriores demostraron que e. coli entra el estado VBNC durante el secado como una estrategia de supervivencia. Esto se demuestra por el hecho de que no había ningunas bacterias cultivables al terminar el secado22. Por lo tanto, el proceso de ...
Access restricted. Please log in or start a trial to view this content.
Discusión
Investigaciones anteriores han demostrado que los microorganismos que causan enfermedades transmitidas por los alimentos sobreviven secado10. Por lo tanto es necesario aplicar conservantes antes del secado para asegurar la inocuidad de los alimentos. En este estudio, nos centramos en el uso de TEO. La razón es doble: en primer lugar, hay una alta demanda de los consumidores a utilizar productos naturales como aditivos alternativos para mejorar la calidad de alimentos16; En...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por la Agencia de beca interna de la Facultad de AgriSciences Tropical, (proyecto número: 20175013) y el 20182023 de CIGA ambas subvenciones, de la Universidad de Ciencias de la vida de Checo.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Meat cutter | Kalorik | KP 3530 | from Miami Gardens, FL, USA |
| Laminar safety cabinet | Faster s.r.l | from Italy | |
| Squeeze bottle of 500 mL | Merci | 632 524 325 025 | from CZ |
| Standard laboratory drier UFE 400 | Memmert | DE 66812464 | from Germany |
| Incubator | BT 120 | N/A | from CZ |
| Refrigerator and Freezer | Bosch | KGN34VW20G | from DE |
| Densitometer | Biosan | 220 000 050 122 | Latvia; supplier Merci, CZ |
| Escherichia coli ATCC 25922 | Oxoid | CL7050 | from CZ |
| Vortex | Chromservis | 22008013 | from CZ |
| Sterilized plastic tubes 15 mL | Gama | 331 000 020 115 | from CZ, supplier Merci |
| 20 mL injection vial | Healthy vial | hvft169 | from China |
| 20 mm sterile butyl rubber stopper | Merci | 22008013 | from CZ |
| 20 mm aluminum cap | Healthy vial | N/A | from China |
| Thyme essential oil | Sigma Aldrich | W306509 | from St Louis, MO, USA |
| Mueller Hinton Broth | Oxoid | CM0337 | from CZ |
| NaCl | Penta | 16610-31000 | from CZ |
| Peptone | Oxoid | LP0034 | from CZ |
| Phosphate-buffered saline | Sigma Aldrich | P4417 | from CZ |
| Polysorbate 80 (Tween 80) | Roth | T 13502 | from DE, supplier P-lab |
| Shaker SHO-1D | Verkon | DH.WSR04020 | from CZ, 10 - 300 rpm. 350 x 350 mm with a platform for flasks |
| Ethanol 70% | Bioferm | N/A | from CZ |
| MacConkey Agar | Oxoid | CM007 | from CZ |
| Plate Count Agar | Oxoid | CM0325 | from CZ |
| Filter paper | Merci | 480 622 080 040 | from CZ |
| Erlenmeyer flasks 250 mL | Simax | 610 002 122 636 | from CZ; supplier Merci CZ |
| Multichannel pipette | Socorex | S852820 | from Switzerland; supplier P lab, CZ |
| Microtiter plate | Gamma | V400916 | CZ |
| Microlitre pipette 100-1000 μL | Eppendorf | 333 120 000 062 | from Germany; supplier Merci, CZ |
Referencias
- Eklund, M. W., Peterson, M. E., Poysky, F. T., Paranjpye, R. N., Pelroy, G. A. Control of bacterial pathogens during processing of cold-smoked and dried salmon strips. J. Food Prot. 67 (2), 347-351 (2004).
- Mahmoud, B. S. M., et al. Preservative effect of combined treatment with electrolyzed NaCl solutions and essential oil compounds on carp fillets during convectional air-drying. Int. J. Food Microbiol. 106 (3), 331-337 (2006).
- Rahman, M. S., Guizani, N., Al-Ruzeiki, M. H., Al Khalasi, A. S. Microflora Changes in Tuna Mince During Convection Air Drying. Dry. Technol. 18 (10), 2369-2379 (2000).
- Faith, N. G., et al. Viability of Escherichia coli O157: H7 in ground and formed beef jerky prepared at levels of 5 and 20% fat and dried at 52, 57, 63, or 68 C in a home-style dehydrator. Int. J. Food Microbiol. 41 (3), 213-221 (1998).
- Hierro, E., De La Hoz, L., Ordóñez, J. A. Headspace volatile compounds from salted and occasionally smoked dried meats (cecinas) as affected by animal species. Food Chem. 85 (4), 649-657 (2004).
- Nummer, B. A., et al. Effects of Preparation Methods on the Microbiological Safety of Home-Dried Meat Jerky. J. Food Prot. 67 (10), 2337-2341 (2004).
- Greig, J. D., Ravel, A. Analysis of foodborne outbreak data reported internationally for source attribution. Int. J. Food Microbiol. 130 (2), 77-87 (2009).
- Eidson, M., Sewell, C. M., Graves, G., Olson, R. Beef jerky gastroenteritis outbreaks. J. Environ. Health. 62 (6), 9-13 (2000).
- Allen, K., Cornforth, D., Whittier, D., Vasavada, M., Nummer, B. Evaluation of high humidity and wet marinade methods for pasteurization of jerky. J. Food Sci. 72 (7), (2007).
- Levine, P., Rose, B., Green, S., Ransom, G., Hill, W. Pathogen testing of ready-to-eat meat and poultry products collected at federally inspected establishments in the United States, 1990 to 1999. J. Food Prot. 64 (8), 1188-1193 (1990).
- Keene, W. E., et al. An outbreak of Escherichia coli O157:H7 infections traced to jerky made from deer meat. JAMA. 277 (15), 1229-1231 (1997).
- Oliver, J. D. The viable but nonculturable state in bacteria. J. Microbiol. 43, 93-100 (2005).
- Oliver, J. D. Recent findings on the viable but nonculturable state in pathogenic bacteria. FEMS Microbiol. Rev. 34 (4), 415-425 (2010).
- Khamisse, E., Firmesse, O., Christieans, S., Chassaing, D., Carpentier, B. Impact of cleaning and disinfection on the non-culturable and culturable bacterial loads of food-contact surfaces at a beef processing plant. Int. J. Food Microbiol. 158 (2), 163-168 (2012).
- Li, L., Mendis, N., Trigui, H., Oliver, J. D., Faucher, S. P. The importance of the viable but non-culturable state in human bacterial pathogens. Front. Microbiol. 5, 258(2014).
- Hernández, H., Claramount, D., Kučerová, I., Banout, J. The effects of modified blanching and oregano essential oil on drying kinetics and sensory attributes of dried meat. J. Food Process. Preserv. , (2016).
- García-Díez, J., et al. The Impact of Essential Oils on Consumer Acceptance of Chouriço de vinho - A Dry-Cured Sausage Made from Wine-Marinated Meat - Assessed by the Hedonic Scale, JAR Intensity Scale and Consumers' "Will to Consume and Purchase.". J. Food Process. Preserv. 41 (4), (2017).
- Govaris, A., Solomakos, N., Pexara, A., Chatzopoulou, P. S. The antimicrobial effect of oregano essential oil, nisin and their combination against Salmonella Enteritidis in minced sheep meat during refrigerated storage. Int. J. Food Microbiol. 137 (2-3), 175-180 (2010).
- Holley, R. A., Patel, D. Improvement in shelf-life and safety of perishable foods by plant essential oils and smoke antimicrobials. Food Microbiol. 22 (4), 273-292 (2005).
- Petrou, S., Tsiraki, M., Giatrakou, V., Savvaidis, I. N. Chitosan dipping or oregano oil treatments, singly or combined on modified atmosphere packaged chicken breast meat. Int. J. Food Microbiol. 156 (3), 264-271 (2012).
- Ballester-costa, C., Sendra, E., Viuda-martos, M. Assessment of Antioxidant and Antibacterial Properties on Meat Homogenates of Essential Oils Obtained from Four Thymus Species Achieved from Organic Growth. Foods. 6 (8), 59(2017).
- Hernández, H., et al. The effect of oregano essential oil on microbial load and sensory attributes of dried meat. J. Sci. Food Agric. 97 (1), 82-87 (2017).
- García-Díez, J., Alheiro, J., Falco, V., Fraqueza, M. J., Patarata, L. Chemical characterization and antimicrobial properties of herbs and spices essential oils against pathogens and spoilage bacteria associated to dry-cured meat products. J. Essent. Oil Res. 29 (2), 117-125 (2017).
- Cavanagh, H. M. A. Antifungal Activity of the Volatile Phase of Essential Oils: A Brief Review. Nat. Prod. Commun. 2 (12), 1297-1302 (2007).
- Tajkarimi, M. M., Ibrahim, S. A., Cliver, D. O. Antimicrobial herb and spice compounds in food. Food Control. 21 (9), 1199-1218 (2010).
- Nedorostova, L., Kloucek, P., Kokoska, L., Stolcova, M., Pulkrabek, J. Antimicrobial properties of selected essential oils in vapour phase against foodborne bacteria. Food Control. 20 (2), 157-160 (2009).
- Burt, S. Essential oils: Their antibacterial properties and potential applications in foods - A review. Int. J. Food Microbiol. 94 (3), 223-253 (2004).
- Ramanathan, L., Das, N. Studies on the control of lipid oxidation in ground fish by some polyphenolic natural products. J. Agric. Food Chem. 40 (1), 17-21 (1992).
- Yamazaki, K., Yamamoto, T., Kawai, Y., Inoue, N. Enhancement of antilisterial activity of essential oil constituents by nisin and diglycerol fatty acid ester. Food Microbiol. 21 (3), 283-289 (2004).
- García-Díez, J., Alheiro, J., Falco, V., Fraqueza, M. J., Patarata, L. Synergistic activity of essential oils from herbs and spices used on meat products against food borne pathogens. Nat. Prod. Commun. 12 (2), 281-286 (2017).
- Hussein Hamdy Roby, M., Atef Sarhan, M., Abdel-Hamed Selim, K., Ibrahim Khalel, K. Evaluation of antioxidant activity, total phenols and phenolic compounds in thyme (Thymus vulgaris L.), sage (Salvia officinalis L.), and marjoram (Origanum majorana L.) extracts. Ind. Crops Prod. 43, 827-831 (2013).
- Gouveia, A. R., et al. The Antimicrobial Effect of Essential Oils Against Listeria monocytogenes in Sous vide Cook-Chill Beef during Storage. J. Food Process. Preserv. 41 (4), (2017).
- Chen, C., Nace, G., Irwin, P. A 6 x 6 drop plate method for simultaneous colony counting and MPN enumeration of Campylobacter jejuni, Listeria monocytogenes, and Escherichia coli. J. Microbiol. Methods. 55 (2), 475-479 (2003).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- Greenwood, M., Roberts, D. Practical food microbiology. , Blackwell Pub. Available from: https://drive.google.com/file/d/0BzyVOLllJ0B1YmlEemZ5M1RZekU/view?ts=590d8019 (2003).
- Vaughan, G. M., Corballis, M. C. Beyond tests of significance: Estimating strength of effects in selected ANOVA designs. Am. Psychol. Assoc. 72 (3), Available from: http://dx.doi.org/10.1037/h0027878 204-213 (1969).
- Smith-Palmer, A., Stewart, J., Fyfe, L. Antimicrobial properties of plant essential oils and essences against five important food-borne pathogens. Lett. Appl. Microbiol. 26 (2), 118-122 (1998).
- Burt, S. a, Reinders, R. D. Antibacterial activity of selected plant essential oils against Escherichia coli O157:H7. Lett. Appl. Microbiol. 36 (3), 162-167 (2003).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados