Method Article
Protocolos de fabricación (EcoFAB) del ecosistema para la construcción de ecosistemas de laboratorio diseñado para estudiar las interacciones planta-microorganismo
En este artículo
Resumen
Este artículo describe protocolos detallados para la fabricación de ecosistema de dispositivos (EcoFABs) que permiten a los estudios de las plantas y las interacciones planta-microorganismo en condiciones muy controladas de laboratorio.
Resumen
Interacciones Beneficiosas Planta-Microogranismo ofrecen una solución biológica sostenible con potencial para impulsar la producción de alimentos y bioenergía de bajos insumos. Una mejor comprensión mecanicista de estas interacciones planta-microorganismo complejo serán crucial para mejorar la producción de planta como ecológica así como desempeño básico estudia investigar interacciones planta-microorganismo suelo. Aquí, se presenta una descripción detallada para la fabricación de ecosistema, usando tecnologías de impresión 3D ampliamente disponibles, crear hábitats controladas de laboratorio (EcoFABs) para el estudio de mecanismos de interacciones planta-microorganismo en específico ambiental condiciones. Dos tamaños de EcoFABs se describen que son adecuados para la investigación de las interacciones microbianas con varias especies de plantas, como Arabidopsis thaliana, Brachypodium distachyony Panicum virgatum. Estos dispositivos a través de flujo permiten control manipulación y muestreo de raíz microbiomes, química de la raíz así como proyección de imagen de la morfología de la raíz y localización microbiana. Este protocolo incluye los detalles para mantener las condiciones de esterilidad dentro de EcoFABs y montaje independiente sistemas de iluminación LED en EcoFABs. Métodos detallados para la adición de diferentes formas de medios de comunicación, incluyendo suelos, arena y medios de cultivo líquidos junto a la caracterización de estos sistemas usando proyección de imagen y metabolómica se describe. Juntos, estos sistemas permiten la investigación dinámica y detallada de la planta y consorcios microbianos planta incluyendo la manipulación de la composición del microbioma (incluyendo mutantes), el monitoreo del crecimiento de la planta, morfología de la raíz, composición del exudado, y localización microbiana bajo condiciones ambientales controladas. Esperamos que estos protocolos detallados servirá como un importante punto de partida para otros investigadores, idealmente, ayudar a crear sistemas experimentales estandarizados para la investigación de interacciones planta-microorganismo.
Introducción
La aplicación de microbios beneficiosos de la planta en la agricultura ofrece gran potencial para incrementar la producción de biocombustibles para proporcionar para una creciente población1,2,3,4y sostenible de alimentos. Una cantidad significativa de trabajo apoya la importancia de la planta microbiomes en absorción de nutrientes de la planta, tolerancia a las tensiones y la resistencia a la enfermedad5,6,7,8. Sin embargo, es difícil investigar los mecanismos de las interacciones planta-microorganismo en los ecosistemas de campo debido a la complejidad e irreproductibilidad asociada y la incapacidad para controlar precisamente la composición del microbioma y genética (por ej., usando mutantes microbianos)4,9,10.
Una estrategia es construir ecosistemas modelo simplificado para permitir controlados, experimentos de laboratorio repetidos investigar interacciones planta-microorganismo para generar ideas que pueden analizarse más en el campo10,11, 12. Este concepto se basa en los enfoques tradicionales de uso de las plantas cultivadas en macetas llenas de tierra o en placas de agar dentro de invernaderos o incubadoras13. Aunque estos probablemente serán siendo el más ampliamente utilizado enfoques, carecen de la capacidad para precisamente controlar y manipular entornos de crecimiento de la planta. Para estos fines, rhizoboxes y rhizotrons representan una gran mejora en la capacidad de estudiar procesos subterránea14,15y primeros protocolos fueron publicados para el análisis de metabolitos de la rizosfera en el suelo16. Más recientemente, para permitir el análisis de alto rendimiento, dispositivos microfluídicos avanzado13,17 como Chip de planta18,19, RootArray20RootChip21, han sido desarrollado como herramientas eficaces para el fenotipado de la planta con resolución espacial de la escala del micrómetro para supervisar las primeras etapas de crecimiento de la planta pequeña modelo Arabidopsis thaliana en medio líquido. Una plataforma de proyección de imagen de dos capas fue descrita recientemente, que permite la proyección de imagen de pelo de la raíz de Arabidopsis thaliana en plántula con una plataforma de microfluidos22.
Aquí, protocolos detallados para la construcción de aparatos de laboratorio controlados (EcoFABs) son siempre, para el estudio de las interacciones microbio de planta y mostrar que pueden ser utilizados para el estudio de diversas plantas como Arabidopsis thaliana, Brachypodium distachyon23, la importancia ecológica Avena Silvestre Avena barbata y los cultivos de bioenergía Panicum virgatum (virgatum). EcoFAB es una plataforma de crecimiento de la planta estéril que incluye dos componentes principales: el dispositivo de EcoFAB y envase transparente estéril tamaño de planta. Capas de EcoFAB dispositivo está hecho de un polidimetilsiloxano (PDMS), proceso que implica la fundición PDMS de fabricación de un molde plástico impreso 3D y capas PDMS en portaobjetos usando métodos anteriormente la vinculación registrados24,25 . Los procedimientos detallados de EcoFAB flujo de trabajo, tales como fabricación de dispositivo, esterilización, germinación de la semilla, trasplante de la plántula, microbio inoculación/cocultivation, preparación de muestras y análisis, se describen en el presente Protocolo (figura 1). Otras modificaciones del flujo de trabajo básico se describen, incluyendo la instalación de la computadora controlada llevó las luces grow y la utilización de sustratos sólidos. La utilización de técnicas para investigar la morfología de la raíz de imagen cambia, la colonización microbiana de las raíces, y la proyección de imagen espectroscópica masa de exudados de la raíz se describen. Esperamos que el diseño simple, barato, basado en materiales fácilmente disponibles, así como los protocolos detallados presentados aquí, convertirá la plataforma EcoFAB en un recurso comunitario, estandarizar los estudios de laboratorio planta microbioma.
Protocolo
PRECAUCIÓN: Este protocolo incluye el uso de productos químicos peligrosos, objetos cortantes, aparatos eléctricos, objetos calientes y otros peligros que pueden causar lesiones. Apropiado equipo de protección personal (PPE, por ejemplo., guantes resistentes a químicos, gafas de seguridad, bata de laboratorio, ropa larga, zapatos cerrados, etcetera.) se debe usar y los procedimientos de seguridad adecuados (seguridad, uso de una campana de humos, etcetera.) se deben seguir.
1. EcoFAB dispositivo fabricación: fundición en PDMS capas (figura 2 y figura 3)
- Construir los moldes de EcoFAB usando técnicas de impresión 3D (están disponibles en los archivos de diseño. Cada molde incluye tres partes: un marco de fundición, una base de molde recomendados y una inserción, como se muestra en la figura 2. Imprimir la base del molde y coloque de fotopolímeros opacos rígidos mediante una impresora 3D de plástico. Utilizar un mínimo de 100 μm de resolución e imprimir la estructura de bastidor con acrilonitrilo butadieno estireno (ABS).
- Mezclar 40 mL de elastómero de siloxano base con curado agente en un contenedor desechable de 1 L. Dependiendo de la experiencia deseada (los pasos 2.1 y 2.2), usar diferentes ratios (v/v) de elastómero agente (5:1, 15:1 o 30: 1) de base/endurecedor. Continúe con los pasos 1.3 a 1.8 para todo tipo de mezclas.
PRECAUCIÓN: Use guantes resistentes a químicos, gafas de seguridad y otros Epis. - Coloque el recipiente en una cámara de vacío por al menos 30 min eliminar las burbujas de aire de la mezcla de elastómeros.
- Vierta la mezcla en el molde plástico impreso 3D montado (Figura 3A) y mantener el molde en un bloque de calentamiento a 85 ° C durante 4 horas (figura 3B).
PRECAUCIÓN: Use PPE para evitar quemaduras. - Deje el molde enfriar durante 5 minutos. Retire el relleno del molde suavemente (figura 3) y luego lentamente Inserte un cuchillo entre el bastidor marco y PDMS (la mezcla solidificada elastómero) para separarlas (Figura 2D).
- Presione el molde base con PDMS para arriba del marco de fundición (figura 3E). Utilice un cuchillo u otras herramientas para separar suavemente la capa PDMS de la base del molde en los bordes (figura 3F) y luego despéguela lentamente de la superficie del molde (figura 3).
- Crear entrada y canales de salida en las capas PDMS por hacer ~1.6 mm agujeros para los puertos de entrada y salida con una 15 calibre aguja Roma (figura 3 H, I).
Nota: El molde del estándar tiene un puerto de entrada y salida, mientras que la salida de todo el molde sólo necesita el puerto de entrada (figura 3 H, I). - Utilizar tijeras para recortar los bordes de las capas PDMS.
Nota: Las capas recortadas de PDMS debe ≥76 x rectángulos de 51 mm para pequeños dispositivos de EcoFAB y ≥102 x rectángulos de 83 mm para dispositivos de EcoFAB grandes.
2. EcoFAB dispositivo fabricación: fijar químicamente PDMS capas sobre portaobjetos (figura 3 y figura 4)
- Permanentemente la vinculación las capas PDMS para portaobjetos de microscopio
- Enjuague el lado adhesivo de la capa PDMS (hecho de un elastómero de 15:1 base para mezcla de agente de curado) y 7.6 × 5 cm microscopio Deslice con metanol y luego golpe seco con aire comprimido o una pistola de nitrógeno ultra puro.
PRECAUCIÓN: El metanol es tóxico. Trabajar en una campana de humos y usar revestimiento de protección ocular, guantes y otros Epis. - Coloque el portaobjetos del microscopio y la capa PDMS en un plasma limpiador con su lado adhesivo hacia arriba (figura 3J). Si un limpiador de plasma no está disponible, vaya al paso 2.2.
- Cerrar la cámara y la válvula de purga de gas del plasma del limpiador y girar en el vacío y vaciado de la cámara durante 1 minuto.
- Encienda el generador de plasma y cambiar el nivel de radiofrecuencia (RF) a "HI" durante 1 minuto.
- Apague la bomba de vacío y la energía del plasma y purgar la cámara a la atmósfera.
- Sacar la capa PDMS y portaobjetos de la cámara plasma y rápidamente Pulse los cuatro bordes de la capa PDMS en la diapositiva con presión uniforme (figura 3 L). Asegúrese de que la región oval del centro de la capa PDMS (la cámara de la raíz) no toque el portaobjetos.
- Coloque el dispositivo sellado de EcoFAB sobre a 120 ° C calefacción bloque por 20 min garantizar aún más la vinculación permanente entre la capa PDMS y el portaobjetos.
- Deje el aparato enfriar por 5 min ajuste los bordes extra de la capa PDMS con un cuchillo.
- Enjuague el lado adhesivo de la capa PDMS (hecho de un elastómero de 15:1 base para mezcla de agente de curado) y 7.6 × 5 cm microscopio Deslice con metanol y luego golpe seco con aire comprimido o una pistola de nitrógeno ultra puro.
- Reversible cierre físico de las capas PDMS para portaobjetos de microscopio
- El reversible técnica de sellado utiliza un conjunto de medida abrazaderas (ya sea impresa por una impresora 3D de plástico o mecanizadas en metal, los dibujos se muestran en la figura 4).
- Coloque el portaobjetos en la abertura en la placa de la abrazadera inferior y luego alinear la capa PDMS (hecha de una base de elastómero de 5:1 para mezcla de agente de curado) encima de la diapositiva.
- Coloque la placa de la abrazadera superior sobre la capa PDMS. Asegure las placas inferior y superior usando cuatro tornillos de cabeza hexagonal orientando los tornillos para que las tuercas están roscadas en desde la parte superior de la abrazadera.
- PDMS adherido directamente al microscopio
- Coloque la capa PDMS (hecha de una base de elastómero de 30: 1 para mezcla de agente de curado) sobre un portaobjetos de microscopio.
- Presione la capa PDMS en la diapositiva. La capa PDMS suave, muy adhesiva (30: 1) si se pega a la diapositiva que crea un sello impermeable sin la permanente vinculación química o física Presione de una pinza (figura 3 L).
- El reversible técnica de sellado utiliza un conjunto de medida abrazaderas (ya sea impresa por una impresora 3D de plástico o mecanizadas en metal, los dibujos se muestran en la figura 4).
3. EcoFABs de esterilización
- Enjuague EcoFAB dispositivos con agua ultrapura.
- Un dispositivo de EcoFAB colóquelo en un recipiente de EcoFAB y añadir etanol al 70% hasta que el dispositivo está sumergido. Cierre la tapa del recipiente y agite suavemente para mojar todas las superficies dentro con etanol. Asegúrese de que la cámara de crecimiento de la raíz del dispositivo de EcoFAB se llena con etanol, con muy pocas o ningunas burbujas de aire.
- Después de la incubación de 30 min a temperatura ambiente, retirar etanol al 70% y repetir la incubación con etanol al 100% durante 5 minutos.
- Drenar de etanol e incubar el EcoFAB esterilizado durante 16 horas en una campana de flujo laminar para secarla completamente. Si está disponible, esterilizar el sistema encendiendo la UV luz en campana para 1 h.
PRECAUCIÓN: Use PPE apropiado cuando se trabaja con las luces UV. - Almacenar la EcoFABs esterilizado en una campana de estéril o bolsas de autoclave para uso futuro.
4. EcoFABs con LED crecen luces (figura 5)
- Conectar LED tiras en contenedores de EcoFAB
- Marcan las ubicaciones en el contenedor de EcoFAB 9 clips de LED. Comience con el primer clip 120 m m encima de la parte inferior del contenedor a lo largo de un borde (figura 5A) y proceder a marcar lugares de clips en una espiral alrededor del contenedor, con cada clip siguiente caída 10 mm. Una espiral de 9 clips que permite una tira de LED de 1 m envolver alrededor del envase dos veces.
- Pegamento caliente un LED clip a cada uno marcada posición añadiendo dos toques de pegamento caliente en el recipiente, alineado con la posición de los agujeros de montaje de los clips. Presione los orificios del clip en estos dos toques de pegamento, luego agregue otro poco de pegamento en la parte superior los agujeros. Repita el procedimiento para todos los clips hasta 9 clips forman una espiral (figura 5B).
PRECAUCIÓN: Use guantes y otros EPI cuando se trabaja con pegamento caliente para evitar quemaduras. - Pase la tira del LED a través de los clips en forma de espiral, con LEDs que enfrenta en el envase. La tira debe círculo alrededor dos veces (figura 5).
- Tiras de LED de conexión a la red con un controlador (figura 5 muestra una cámara de EcoFAB con luces iluminadas, la programación del controlador se describe en el paso 4.3).
PRECAUCIÓN: Peligro de choque eléctrico: Asegúrese de que la fuente de alimentación esté desenchufada al conectar los cables.- Conecte los terminales positivo y negativo de la fuente de alimentación a los terminales "entrada: V +" y "entrada: V-" del controlador con cable de 2 hilos (figura 5E muestra un dibujo esquemático de la configuración del controlador).
- Conecte el cable negativo desde el extremo pelado de un cable de mujer al desnudo a un canal de "Salida" en el controlador.
Nota: Hay cinco canales en el controlador que se utiliza en el presente Protocolo, así que puede apoyar hasta cinco tiras de LED de 1 m. - Conecte todos los cables positivo de los cables a un compacto empalme conector (si se necesitan más canales) y luego vincular este conector al terminal de "salida V +" del controlador.
- Enchufe cada tira de LED en el extremo hembra de los cables, por lo que cada LED tiene su propio canal para controlarse. Si lo desea, utilice cables de hembra a macho para ampliar el alcance.
- Programar el controlador para un ciclo de luz deseado según las instrucciones del fabricante,
5. cultivo de plantas en EcoFABs
- Esterilización de semillas y germinación
Nota: La esterilización de las semillas y todos los pasos siguientes con las plantas de semillero deben realizarse en condiciones estériles. El proceso de esterilización a continuación es conveniente para las semillas de Arabidopsis thaliana, Avena barbata, Brachypodium distachyony Panicum virgatum. Panicum virgatum semillas deben ser suspendidas en 60% de ácido sulfúrico durante 1 h antes del proceso de esterilización. Se aconseja preparar 1-2 semillas por dispositivo de EcoFAB, teniendo en cuenta la tasa de germinación y la homogeneidad de germinación.- Remoje las semillas en etanol al 70% por 2 min.
- Eliminar el etanol con una pipeta y enjuagar las semillas con agua destilada tres veces.
- Dejar las semillas en solución de cloro 10% durante 5 minutos.
- Retirar la solución de lejía y lave bien las semillas con agua estéril tres veces.
- Agregar agua estéril a las semillas e incubar el tubo de microcentrífuga en frigorífico de 4 º C durante 7 días.
- Uniformemente extender las semillas en medio Murashige & Skoog (MS) 0.5 0.6% de phytagel y sellar las placas con cinta de microporo.
- Crecer las plantas hasta una longitud de raíz de unos 5 mm para la transferencia de EcoFABs (figura 6A). Para los experimentos presentados aquí, se aplica un régimen de 16 h luz/8 h iluminación oscura en una cámara de crecimiento de 22 ° C e incubar las plantas 2-7 d antes de la transferencia de EcoFAB (2 días para Avena barbata y Brachypodium distachyon, 7 días para de Arabidopsis thaliana y Panicum virgatum).
- Transferencia de plántulas en EcoFABs con medio líquido (figura 6)
- Utilizando una jeringa estéril o una micropipeta, enjuague el compartimiento de la raíz de un dispositivo de EcoFAB con agua estéril por tres veces y luego llene la cámara de raíz con el medio de cultivo de interés, por ejemplo medio de 0,5 MS (Figura 6B, paso 5.1.6).
- Introduzca con cuidado una sola planta en el embalse de la central del dispositivo de EcoFAB (figura 6).
Nota: La raíz debe estar completamente sumergida dentro de la cámara de la raíz, con la sesión sobresale el depósito. - Añadir 3 mL de agua estéril en el envase, evitando el dispositivo de EcoFAB. Esto aumentará la humedad y reducir la evaporación del medio de la cámara de raíz.
- Cerrar el recipiente y selle la tapa con cinta de microporo (figura 6).
- Coloque el EcoFAB en una incubadora de plantas, o utilizar el sistema de EcoFAB iluminación en un ambiente de temperatura controlada adecuado para el crecimiento de la respectiva planta (paso 4). Para este estudio, ajuste la cámara a 24 ° C.
- Revise periódicamente la EcoFAB para llenar los medios de crecimiento dentro de la cámara de crecimiento de la raíz y agregar agua al contenedor. Realizar todos los pasos en condiciones estériles.
Nota: Para las primeras etapas de crecimiento de la planta, relleno de la cámara de crecimiento de la raíz es necesario cada 5 a 7 días. Para etapas posteriores del crecimiento, un relleno es necesario cada 2 a 3 días. Si lo desea, use una jeringa o pipeta para recoger la solución de raíz exudado de las cámaras de crecimiento de la raíz en un tubo de microcentrífuga y almacenar en un congelador de-80 ° C; Además, imagen de la morfología de la raíz con un formador de gel o un microscopio.
- Transferencia de plántulas en EcoFABs con sustratos sólidos
- Utilizar las cámaras de raíz fabricadas con una mezcla 5:1 de elastómero base para agente de curado si se utiliza un sistema de medida abrazaderas para sujetar a un portaobjetos (figura 3 K, figura 4); o seleccione que una capa PDMS sócalo de 30: 1 para mezcla de agente de curado si adherir capas PDMS para diapositivas directamente (tal como se describe en el paso 2.2).
- Esterilizar las cámaras EcoFAB, tal como se describe en el paso 3.
- Cuidadosamente añadir suelo/arena esterilizada en la cámara de raíz, invierta la capa PDMS y añadir el sustrato a la cámara de raíz. Evitar cualquier caída de partículas en el área que estará en contacto con el portaobjetos del microscopio, ya que esto reduce la adherencia.
- Coloque el portaobjetos sobre la capa PDMS y presione firmemente todos los bordes. Flip con cuidado el dispositivo de EcoFAB así que no suelo/arena cae en el depósito de apertura.
Nota: Para dispositivos de EcoFAB sócalo de 5:1 para mezcla de agente de curado, utilice una abrazadera personalizada para garantizar el sello. - El flujo de líquido o agua a través del canal de entrada o salida del dispositivo de EcoFAB y una planta de transferencia en su depósito planta, como se describe en el paso 3.3.
- Adición de microbios en EcoFABs
- Transferir una colonia microbiana a un tubo de incubación con 8 mL de caldo LB y crecer hasta OD 0.5 (aproximadamente 12 h).
- Transferir la solución de cultivo en un tubo de centrífuga de 15 mL y centrifugar a temperatura ambiente durante 5 minutos a 3000 x g a microbios de pellets.
- Quite el sobrenadante y añadir 8 mL de medio de crecimiento de la planta utilizado en el objetivo de EcoFAB. Suspender el sedimento de los microbios y centrifugar el tubo a temperatura ambiente durante 5 minutos a 3000 x g.
- Repetir el punto 5.4.3. dos veces para eliminar completamente cualquier rastro de nutrientes LB.
- Añadir medio de crecimiento de la planta a la pelotilla de microbio lavada hasta que su densidad óptica es de unos 0.5 a 600 nm.
- Añadir 20 μl de la solución de microbio en el compartimiento de la raíz a través de la salida de EcoFAB. Las cepas utilizadas en esta publicación viajaban a las raíces de la planta dentro de 2-3 días y las superficies de la raíz colonizadora comenzó.
- Para ingeniería de quimioluminiscencia, asegúrese de incluir el inductor (1 mM IPTG) en medio de crecimiento de la planta para inducir la expresión de luciferasa.
6. metabolito perfiles de exudados de la raíz de EcoFABs
- Base de preparación de muestras para LC/MS análisis metabolómica
- Poner los tubos de microcentrífuga con exudados de la raíz recogidos de EcoFABs en un liofilizador y encienda el liofilizador para quitar toda el agua de los tubos.
- Añadir 300 μL de metanol de grado LC-MS en cada tubo y someter a ultrasonidos durante 30 minutos.
PRECAUCIÓN: Use PPE cuando se trabaja con metanol. - Colocar los tubos en una centrífuga y centrifugue a 3000 x g durante 5 minutos.
- Transferir el sobrenadante soluciones en nuevos tubos de microcentrífuga y evaporar el metanol en un concentrador de vacío.
- Añadir 150 μL de metanol con normas internas de la LC-MS de 1 mM en cada tubo e incubar los tubos en un refrigerador de 4 ° C por 12 h.
- Centrifugar los tubos a 3000 x g durante 5 min y transferir el sobrenadante en tubos de filtro de 0,22 μm.
- Centrifugar los tubos de filtro y transferir las soluciones de filtrado en los frascos de LC/MS de 2.0 mL con 200 μL de insertos.
- Colocar los frascos dentro de un rack de LC/MS y carga la rejilla dentro de la LC/MS muestreador automático.
- Análisis de datos
- Acceder de metabolito Atlas y personalizado de secuencias de comandos Python26 o utilizar otro software de análisis de datos.
- Identificar metabolitos basados en m valores dez , tiempo de retención y los patrones de fragmentación compuesto utilizando una biblioteca de estándares del metabolito. 27
7. la proyección de imagen espectroscópica masa de raíces de la planta en EcoFABs (figura 7)
Nota: Dispositivos de EcoFAB hechos de un elastómero de 5:1 base para mezcla de agente de curado con medida abrazaderas (Figura 7A) se utilizan para estampar la raíz en la nanoestructura-iniciador espectrometría de masas (NIMS) chips,28,29,30 desde capas PDMS pueden ser reverso enlazadas a las superficies de chips de NIMS.
- Esterilizar una superficie del chip NIMS con luz UV de 1 h.
- Escoger un EcoFAB con una planta de crecimiento de la incubadora y coloque en una capilla de estéril.
- Abra el contenedor de EcoFAB y retire la placa superior de la abrazadera.
- Levante la capa PDMS junto con la planta dentro y con cuidado coloque la capa PDMS con la planta en un chip de NIMS (figura 7BD, E).
Nota: Una vez que la raíz toca la superficie del chip NIMS, no debe moverse. Esto evita el "aplastamiento" de los metabolitos de la raíz. - Presione suavemente hacia abajo en las raíces a través de la capa PDMS hasta las raíces en contacto con completamente la superficie de NIMS. Dejar las raíces en la superficie de NIMS por 20 min.
- Levante la capa PDMS incluyendo la planta de la viruta del NIMS, otra vez evitando mover la raíz a través de la superficie de NIMS. Devolver la planta a la pinza si lo desea.
- Coloque el chip de NIMS en un plato personalizado de MALDI y cargar la placa en un espectrómetro MALDI para masa (figura 7) la proyección de imagen.
- Utilice el programa OpenMSI para generar la imagen del NIMS de raíz metabolitos (figura 7-G)31.
Resultados
Cada sistema de EcoFAB incluye un dispositivo de EcoFAB y una planta de tamaño de envase de plástico transparente. Un dispositivo de EcoFAB tiene un embalse de la central, una cámara de crecimiento de la raíz, una entrada de flujo de 1,6 mm y una salida de 1,6 mm para dispositivo de EcoFAB estándar (Figura 2D y figura 3 H) o una salida de 10 mm para dispositivo de EcoFAB toda la salida (figura 2F y figura 3I ). El embalse de la central está diseñado en forma de trapecio que tiene una abertura superior de 6 mm y el inferior abertura de 3 mm, y este diseño reduce la posibilidad de fugas de flujo durante la inyección del líquido y también garantiza suficiente espacio para el crecimiento vegetal. La cámara de crecimiento de la raíz adopta una forma ovalada con profundidad de 2 mm para adaptarse a sistemas de la raíz de muchas de las plantas de la modelo, como se muestra en la figura 2 y E. Canales de entrada y salida de un dispositivo estándar de EcoFAB pueden ser conectados con tubería de PTFE para que soluciones nutritivas pueden fluir en la cámara de crecimiento de la raíz sin necesidad de abrir el envase de EcoFAB. El dispositivo de EcoFAB toda salida grandemente reduce la resistencia del flujo de la salida y se usa preferentemente al cultivo de plantas con sistemas de raíz gruesos o exudados de la raíz que periódicamente recoge después de complejos sistemas de la raíz se derivan de las plantas.
Los moldes de la fundición para la fabricación de capas PDMS de EcoFAB dispositivos se crean en un software de diseño, y luego 3D impreso en fotopolímeros opacos rígidos, como se muestra en la figura 2 y figura 3. Plantas de interior de EcoFABs pueden observarse directamente con un microscopio con una distancia de trabajo larga, asegurando que la esterilidad crece entorno (figura 8A, Archivo adicional 1). EcoFAB dispositivos con plantas también pueden caber en un escenario de microscopio de alta resolución que permite mayor resolución la proyección de imagen de interacciones planta-microorganismo (figura 8B, Archivo adicional 2). Esterilidad no se mantiene en este entorno, y proyección de imagen de alta resolución por lo tanto sólo es apto para mediciones de punto final.
EcoFABs están diseñados para permitir estudios sistemáticos de las plantas, como su morfología, metabolismo y las comunidades microbianas en sus diferentes etapas de crecimiento a través de sus ciclos de vida. Aquí, EcoFABs se analizaron como una plataforma general para estudiar una variedad de especies de plantas. Figura 8 -E muestra 7 - viejo thaliana de Arabidopsis, Brachypodium distachyony Panicum virgatum en EcoFABs. Todas las tres plantas se encontraron que crecen bien en el EcoFAB para más de un mes. Tanto la dicotiledóneas, Arabidopsis thaliana y la monocotiledóneas, Brachypodium distachyon fueron encontrados a la altura de sus etapas de reproducción en el EcoFABs.
Reversible sistema de sellado permite el uso de sustratos sólidos (ej., suelo) dentro de la EcoFABs (criterio 2.2). Este enfoque de sellado permite la carga de sustratos sólidos en cámaras de crecimiento de la raíz y reversible también permite la recogida de muestras de regiones específicas de la rhizospheres de la raíz. Figura 8F -H muestra un grupo de 14 días de edad Brachypodium distachyon creciendo en medio hidropónico, así como arena y tierra con medio hidropónico (arena) y agua (suelo). La capa delgada de sustrato sólido en cámaras de crecimiento de la raíz permite que la luz que penetran a través de la proyección de imagen microscópica del sistema radicular.
Morfología de la raíz se define como la configuración espacial y distribución de un sistema de raíces de la planta y ha sido aprobado como una respuesta de fisiología esenciales para ambientes de crecimiento diversos, tales como agua o nutrientes disponibilidad32,33, 34. EcoFABs proporcionan un método conveniente de estudiar la morfología de la planta con el tiempo o bajo diferentes condiciones de nutrientes. Figura 9A-F muestran un ejemplo de uso de EcoFABs para morfología de la raíz de Brachypodium distachyon de pista en las primeras tres semanas. Una plántula de Brachypodium distachyon fue transferida en el dispositivo de EcoFAB, y su estructura de raíz fue grabado por una cámara dentro de un formador de gel BIO-RAD. Programa de procesamiento de imagen, como imagen J, python y matlab, puede aplicarse además para cuantificar los cambios de la morfología de la raíz con el tiempo o en diferentes medio ambientes. La cuantificación del área total de la raíz a lo largo de tres semanas demostró un aumento gradual en la etapa temprana (< 1 semana) seguido de una tendencia de crecimiento lineal hasta el final de tres semanas, como se muestra en la figura 9.
Una motivación primaria para la construcción de la EcoFAB es investigar interacciones planta-microorganismo. Como se describe en el paso 5.4, los microorganismos se transfieren en cámaras de crecimiento de la raíz de EcoFAB dispositivos a través del canal de entrada. La figura 10 muestra, una EcoFAB contiene Pseudomonas simea (anteriormentefluorescens) WCS417 (WCS417), un crecimiento de la planta promoción de rizobacterias con etiquetas quimioluminiscente, fue agregado en los sistemas de raíz de planta con una concentración de 106 células por planta. La señal WCS417 se detectó con un formador de gel, que indica una distribución espacial distinta de microbios WCS417 en cámaras de crecimiento de la raíz. En tanto medio líquido MS con y sin sustrato sólido arena, WCS417 microbios colonizaron las superficies de todo el sistema de raíz con los microbios que se concentró alrededor de las áreas de punta de raíz, posiblemente debido a la producción de nutrientes activa de ápices (figura 10 & H)35. Por otra parte, los microbios WCS417 en sustrato de suelo acumulan en la región del embalse de planta en lugar de ápices (figura 10). Como los microbios fueron agregados a través del canal de salida, los microbios también fueron capaces de moverse en el sustrato suelo, pero no acumulan en la raíz, como se observa en medio líquido con o sin arena. Esto podría indicar que el suelo es una fuente suficiente de nutrientes, y los microbios emigraron al depósito de planta para las condiciones óptimas de respiración.
Para estudiar el perfil de metabolitos de exudados de raíces de la planta, así como la absorción de metabolitos y liberar de interacciones planta-microorganismo, las soluciones de exudado de las cámaras de crecimiento de la raíz fue recogida a través de varias etapas de crecimiento de plantas en EcoFABs. Como se describe en el paso 6, luego se extrajeron muestras de exudado para el análisis por LC-MS. Usando este método, se detectó una serie de metabolitos exudada por la planta y consumidos por los microbios, y el perfil de metabolitos relacionados de exudados de raíces con y sin colonización por microbios está actualmente bajo investigación.
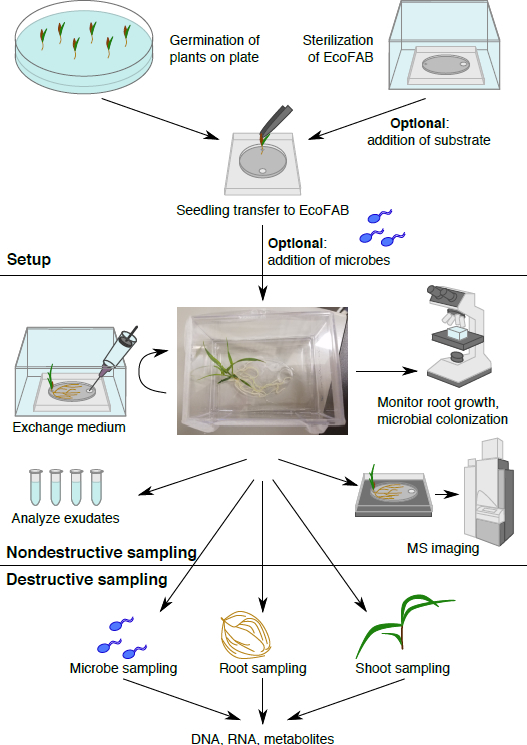
Figura 1: flujo de trabajo de EcoFAB la. Plantas son germinadas en placa y transferidas a esterilizada EcoFAB, microbios pueden agregarse. Muestreo no destructivo: exudados de la raíz pueden ser muestreados y reflejadas, y se puede visualizar la morfología de la raíz. Muestreo destructivo permite análisis de microbio, raíz y brote parámetros en detalle.
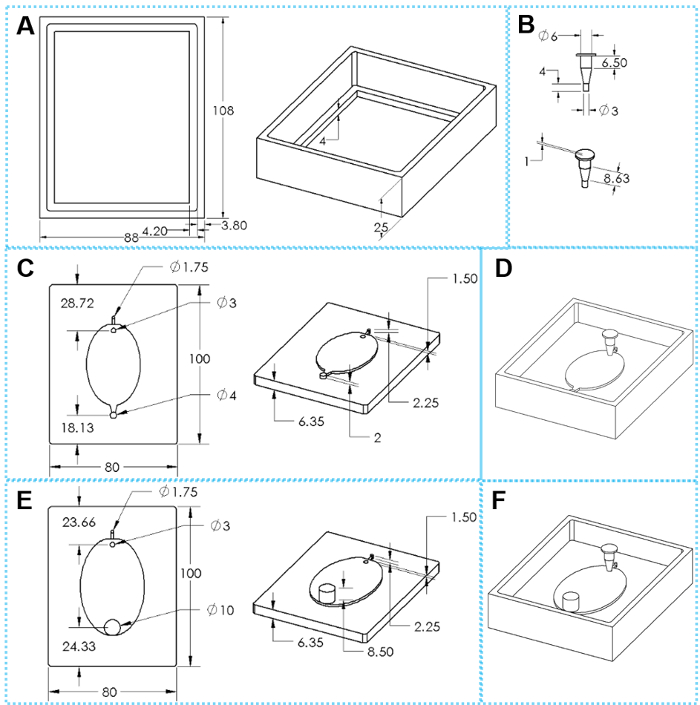
Figura 2: componentes de 3D impresión moldes para la fabricación del dispositivo de EcoFAB. (A) superiores e inclinados vistas de un bastidor de fundición. (B) inclinado y superiores vistas un inserto. (C) superior e inclinados vistas de una base de molde estándar. (E) superiores e inclinados vistas de una base de salida de todo el molde. (D, F) Montado moldes para la fabricación de dispositivos de EcoFAB estándar y toda la salida, respectivamente. Las dimensiones ovales son 51 mm x 34 mm para el molde pequeño de EcoFAB y 76 x 62 mm para el molde grande de EcoFAB. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: fabricación de dispositivo de EcoFAB. (A) verter la mezcla del agente de curado y base de elastómero en el molde. (B) calentar el molde con la mezcla a 85 ° C por 4 h. (C) retirar el relleno del molde. (D) separar el PDMS de la estructura del bastidor. (E) empuja el molde base del marco de fundición. (F) utilizando un cuchillo para separar el molde a lo largo de los bordes de los PDMS. (G) peeling de la capa PDMS lentamente de la base del molde. Agujeros de empujar (H) para los canales de entrada y salida de la capa estándar de PDMS. () Meter un agujero para el canal de la entrada de la capa PDMS de ancho de salida. Capa (J) el PDMS (hecho de un elastómero de 15:1 base para mezcla de agente de curado) y un portaobjetos de microscopio son enjuagadas y transferidos en un plasma limpiador para la vinculación. (K) usar abrazaderas para sujetar la capa PDMS (hecha de una base de elastómero de 5:1 para mezcla de agente de curado) sobre un portaobjetos de microscopio. (L) Presionar la capa PDMS (hecha de una base de elastómero de 30: 1 para mezcla de agente de curado) directamente sobre un portaobjetos de microscopio. Haga clic aquí para ver una versión más grande de esta figura.
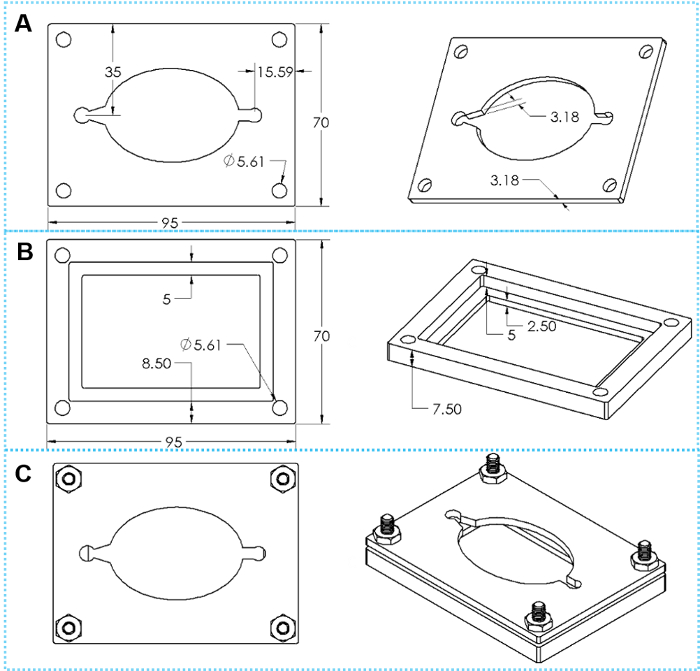
Figura 4: el diseño de medida abrazaderas. (A) vistas superiores e inclinadas de una tapa abrazadera placa. (B) vistas un fondo inclinadas y superiores Sujete la placa. (C) superior y vistas inclinados de abrazadera montada con cuatro juegos de tornillos de cabeza hexagonal. Haga clic aquí para ver una versión más grande de esta figura.
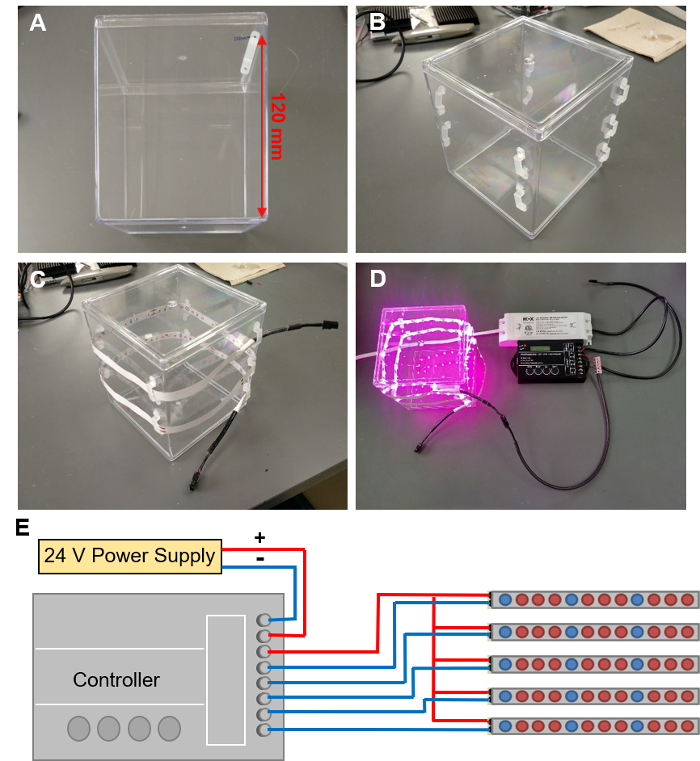
Figura 5: instalación de LED crecen luces. (A) marcado hacia fuera las localizaciones para 9 clips de LED en una espiral alrededor del contenedor de EcoFAB. (B) clips el LED conexión al contenedor de EcoFAB. (C) enhebrar una tira de LED a través de estos clips. (D) conectar la tira de LED a un regulador conectado a una fuente de alimentación de 24V. (E) el esquema de conexiones de cables al controlador. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: transferencia de plántulas en EcoFABs. (A) plantas de Brachypodium distachyon cultivadas durante 2 días en una placa de 0,5 MS. (B) llenado de la cámara de raíz con medio de crecimiento de la planta. (C) utilizando una pinza para insertar cuidadosamente la raíz en el embalse de la central. (D) sellado con cinta de microporo, el contenedor de EcoFAB después de agregar 3 mL de agua en el fondo del recipiente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: imagen del NIMS de planta raíces en EcoFABs. (A) Brachypodium distachyon creciendo en un EcoFAB estéril. (B) colocación de la capa PDMS con la planta en un chip de NIMS para 20 minutos (C) usando cobre cinta sujetar el chip NIMS en un plato personalizado de MALDI y cargar en un espectrómetro de masas MALDI. (D-G) 7 días - el viejo y uno 20 días de edad Brachypodium distachyon planta utilizada para la proyección de imagen del NIMS (D, E) y las correspondientes imágenes de NIMS (F, G). Los iones predominantes fueron resaltados en rojo, verde y azul. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: los usos generales de EcoFABs. (A) directamente capturar el crecimiento de las raíces de Brachypodium distachyon en un EcoFAB con una configuración de microscopio de larga distancia. (B) directamente observar interacciones microbio de raíz con la instalación de un microscopio de alta resolución. 7 - viejo (C-E) de Arabidopsis thaliana (C), Brachypodium distachyon (D) y Panicum virgatum (E) en medio hidropónico de 0,5 MS, (F-H) 14 días de edad Brachypodium distachyon cultivados en hidroponía de 0,5 MS (F), en la arena (G) y suelo (H) sustrato suministrado con medio de 0,5 MS y agua, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
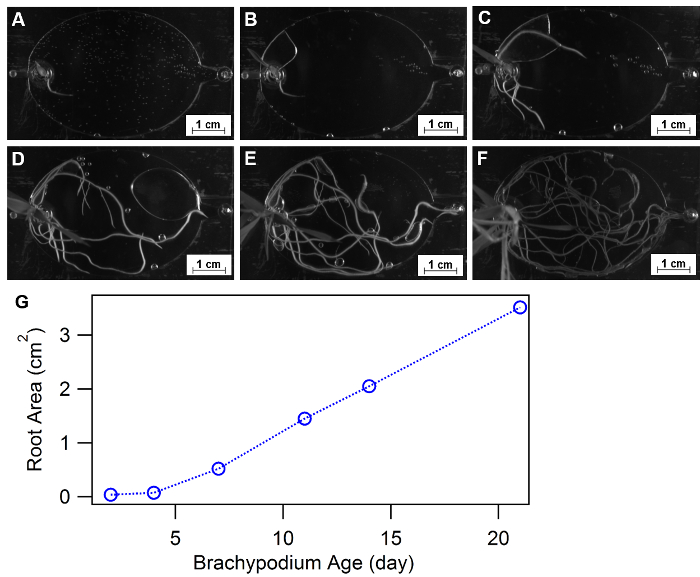
Figura 9: uso de EcoFABs para estudiar la morfología de la raíz. (A-F) Desarrollo de las raíces de Brachypodium distachyon creciendo en EcoFABs llena de medio de 0,5 MS durante las tres primeras semanas: (A) 2 días, (B) 4, (C) 7 días, (D) 11 días, e 14, f 21 días de crecimiento. (G) las superficies de la raíz promedio se estimaron por el software ImageJ. Haga clic aquí para ver una versión más grande de esta figura.
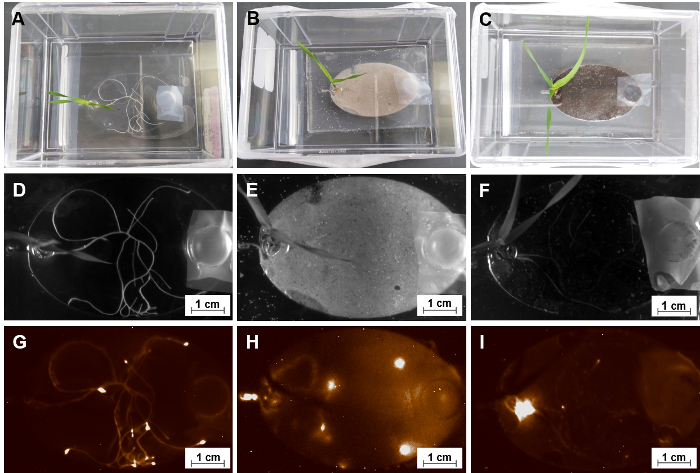
Figura 10: usando EcoFABs para estudiar las interacciones de la raíz-microbio. (A, B, C) Un grupo de 15 días de edad Brachypodium distachyon colonización con Pseudomonas fluorescens WCS417 en diversas formas de medios MS líquidos sustratos solución, arena y tierra. (D, E, F) Imágenes de campo claro de sus sistemas de raíces. (G, H, I) Las correspondientes imágenes quimioluminiscente de estos sistemas de la raíz después de la cultivación conjunta de 14 días. Haga clic aquí para ver una versión más grande de esta figura.
Archivo complementario 1. Uso de EcoFAB para capturar el crecimiento de la raíz. Haga clic aquí para descargar este archivo.
Archivo complementario 2. Uso de EcoFAB capturar interacciones de raíz-microbios. Haga clic aquí para descargar este archivo.
Discusión
Los protocolos registrados aquí para que uso de fabricación de ecosistema para crear que ecofabs proporciona recursos comunitarios para planta sistemática estudios de biología en condiciones muy controladas de laboratorio. Avances en la impresión 3D proporcionan tecnologías ampliamente accesibles para construir y refinar iterativamente EcoFAB diseños. La cámara de raíz presentada aquí se encuentra bien adaptada para la microscopia de la proyección de imagen y mantenimiento de esterilidad, permitiendo la adición controlada de microbios para investigar interacciones planta-microorganismo. La plataforma de EcoFAB es compatible con varias especies de plantas. Es importante reconocer los efectos fisiológicos de las plantas dentro de la cámara de raíz estrecha de crecimiento tal que experimentos adicionales se requerirá para generalizar los resultados a plantas que crecen en ambientes naturales.
El uso de cámaras estériles y LED crece la luz permite la investigación de los efectos de diversas condiciones de luz, incluyendo longitud de onda, intensidad y duración, el crecimiento de las plantas y los parámetros fisiológicos relacionados en paralelo. Cámaras de raíz de Unión reversible permiten el uso de sustratos sólidos, así como espacial recoger muestras sólidas para el análisis bioquímico y genético. Las aplicaciones de substratos sólidos, tales como suelos, arena y granos de cuarzo, ofrecen las posibilidades de utilizar EcoFABs para crear ecosistemas de laboratorio más ecológicamente pertinentes. Sin embargo, todos los sistemas presentados aquí uso líquido saturado (cultivos hidropónicos) que no son un reflejo preciso de la mayoría de suelos y será importante seguir perfeccionando estos diseños para mantener bolsas de aire en el suelo que mejor representan suelos naturales.
Se describe el uso de simples cámaras y microscopios para el desarrollo de la morfología del sistema radicular imagen a ambos a granel a niveles celulares. Esta aptitud para la proyección de imagen de morfología raíz monitoreo y cuantificación probablemente será útil para la comprensión de los mecanismos de regulación de señales de planta fisiológica y molecular desencadenadas por adaptaciones genotípicas de planta a las condiciones de crecimiento. Sin embargo, una limitación para el estudio de desarrollo de la raíz fisiológica es la colocación horizontal actual del dispositivo EcoFAB. En ambientes naturales, la respuesta de raíces gravitrópico conduce a un desarrollo predominantemente vertical del sistema radical. Así, el sistema horizontal presentado aquí probablemente difiere en algunos de los factores de un ambiente natural, y la fabricación de sistemas de EcoFAB con colocación vertical de la cámara de la raíz es un objetivo deseable para futuras versiones de EcoFAB. Aunque los dispositivos actuales de EcoFAB se colocan horizontalmente, el análisis de parámetros de morfología de raíz en varias condiciones, o en respuesta a microbios, es posible. Proyección de imagen de alta resolución se puede aplicar para captar la dinámica de colonización de raíces de aislamientos individuales o comunidades, proporcionando información acerca de que las plantas son colonizadas piezas en varias condiciones deficientes y suficientes nutrientes. Se prevé que dichos estudios proporcionen importantes nuevas ideas sobre cómo se construyen planta microbiomes, y cómo estas dinámicas cambian con el tiempo, por ejemplo como las raíces se desarrollan.
Dispositivos microfluídicos permiten proyección de imagen de plantas muy jóvenes, y la cantidad de metabolitos recogidos no es generalmente suficiente para el análisis LCMS. Sistemas basados en tierra, como rhizotrons, permiten la proyección de imagen de la morfología de la raíz cuando las plantas de ambos se transforman con construcción quimioluminiscente (Glo-root) o con métodos de NMR33,34. Extracción de metabolitos de estos sistemas es lentos debido a la gran volumen de muestras. EcoFABs son una combinación de ambas: la fabricación es similar a los dispositivos microfluídicos. EcoFABs fueron diseñados para ser simple y barato de reproducir, pero el tamaño de la cámara puede ajustarse para cultivar plantas con sistema radicular pequeño o grande, hasta sus etapas reproductivas. Observaciones simultáneas de los cambios de morfología de raíz y exudación de la raíz son posibles. El sistema es estéril, lo que permite la adición controlada de microbios específicos.
EcoFABs están diseñados para permitir la introducción controlada y toma de muestras de microbios y metabolitos. En concreto, las muestras recogidas de cámaras de crecimiento de la raíz se encuentran suficiente para perfilar metabolitos masa espectroscópica. La integración de la proyección de imagen de espectrometría de masas (e.g., NIMS técnica presentada aquí) proporciona un enfoque no-destructivo de estudiar la distribución espacial de metabolito de sistemas de la raíz. Esta técnica será útil en el futuro estable isótopo seguimiento experimentos y localización microbiana asignación a metabolitos específicos36. Si bien este protocolo se ha centrado en solo aislados, el mismo diseño puede utilizarse sin duda para comunidades más complejas. Los volúmenes de muestra y la biomasa dentro de la EcoFABs son probablemente más que suficiente para la mayor integración con tecnologías de secuenciación de ADN, que será importante para la caracterización y monitoreo de comunidad microbiana estructura y expresión genética.
En conclusión, este protocolo detalla la fabricación de los ecosistemas de laboratorio diseñado para la investigación de las interacciones planta-microorganismo, con énfasis en los métodos simples y accesibles que puede ser fácilmente implementado y extendido por los investigadores de todo el mundo. Los esfuerzos actuales se dirigen a demostrar la reproducibilidad entre laboratorios y la integración de un sistema de control de temperatura tal que cada EcoFAB independientemente habrá controlado por luz y temperatura. Un avance más del sistema será la integración del muestreo automatizado y llenado de las cámaras de EcoFAB raíz y el desarrollo de protocolos reproducibles para el establecimiento de planta correspondientes microbiomes dentro de EcoFABs.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por el programa de laboratorio dirigido investigación y desarrollo (LDRD) del laboratorio nacional de Lawrence Berkeley apoyado por la oficina de ciencia del Departamento de energía estadounidense bajo contrato no. DE-AC02-05CH11231 y un premio DE SC0014079 de los Estados Unidos Departamento de energía oficina de ciencia en Berkeley UC. Trabajo en la fundición Molecular fue financiado en los Estados Unidos Departamento de energía contrato no. DE-AC02-05CH11231. También agradecemos a Suzanne M. Kosina, Katherine Louie, Benjamin P. Bowen y Benjamin J. Cole en el laboratorio nacional Lawrence Berkeley por su ayuda.
Materiales
| Name | Company | Catalog Number | Comments |
| 3D printed custom mold | LBNL | STL files available here www.eco-fab.org; The EcoFABs molds described here were printed by FATHOM: http://studiofathom.com | |
| Dow sylgard 184 silicone elastomer clear kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| Air duster spray | VWR | 75780-350 | any compressed gas duster should work |
| 15 gauge blunt needle | VWR | 89166-240 | |
| 5 mL syringe with Luer-Lok Tip | VWR | BD309646 | |
| 3”x2” microscope glass slide | VWR | 48382-179 | |
| 1.75" x 2.56" x 3.56" EcoFAB box | Amazon | B005GAQ25Q | |
| 4” x 3 ¼” microscope glass slide | Ted Pella | 260231 | |
| 4.87" x 4.87" x 5.50" EcoFAB box | Amazon | B00P9QVOS2 | |
| Plasma Cleaner | Harrick Plasma | PDC-001 | |
| 3D printed custom clamp | LBNL | STL files available from Trent Northen's lab | |
| Sterile hood | AirClean Systems | AC600 Series PCR Workstations | |
| PTFE syringe tubing | Sigma-Aldrich | Z117315-1EA | |
| Ethanol | VWR | 89125-172 | |
| Bleach | |||
| Murashige and Skoog (MS) Macronutrient Salt Base | Phytotechnologies Laboratories | M502 | |
| Murashige and Skoog (MS) Micronutrient Salt Base | Phytotechnologies Laboratories | M554 | |
| Soil | Hummert International | Pro-Mix PGX | |
| Phytagel | Sigma-Aldrich | 71010-52-1 | |
| Arabidopsis thaliana | Lehle Seeds | WT-24 Col-4 Columbia wild type | |
| Brachypodium distachyon | LBNL | Standard Bd-21 line | Available from John Vogel's lab |
| Panicum virgatum | The Samuel Roberts Noble Foundation | Alamo switchgrass | |
| Micropore tape | VWR | 56222-182 | |
| LC-MS grade methanol | VWR | JT9830-3 | |
| Lyophilizer | LABCONCO | FreeZone 2.5 Plus | |
| SpeedVAC concentrator | Thermo Scientific | Savant™ SPD111 SpeedVac | |
| Ultrafree-MC GV Centrifugal Filter-0.22 µm | Millipore | UFC30GV00 | |
| Liquid chromotography system | Agilent | Agilent 1290 LC system | |
| Q Exactive mass spectrometer | Thermo Scientific | Q Exactive™ Hybrid Quadrupole-Orbitrap MS | |
| NIMS chip and custom MALDI plate | LBNL | For detailed protocol see: doi:10.1038/nprot.2008.110 | |
| MALDI mass spectrometer | AB Sciex | TOF/TOF 5800 MALDI MS | |
| Nano-coated LED grow light strip | LED World Lighting | HH-SRB60F010-2835 | |
| Power supply | LED World Lighting | MD45W24VA, LV100-24N-UNV-J | |
| TC420 controller | Amazon | B0197U7R8Q | |
| Silicone LED clips | Amazon | B00N9X1GI0 | |
| Hot glue gun | Amazon | B006IY359K | |
| Female-to-bare LED connector cable | LED World Lighting | HH-F05 | |
| Female-to-male LED connector extension cable | LED World Lighting | HH-MF1 | |
| 20AWG 2-wire cable | LED World Lighting | 6102051TFT4 | |
| WAGO 221-415 Splicing Connector | LED World Lighting | 221-415 |
Referencias
- Morrissey, J. P., Dow, J. M., Mark, G. L., O'Gara, F. Are microbes at the root of a solution to world food production. EMBO Rep. 5 (10), 922-926 (2004).
- Farrar, K., Bryant, D., Cope-Selby, N. Understanding and engineering beneficial plant-microbe interactions: plant growth promotion in energy crops. Plant Biotechnol J. 12 (9), 1193-1206 (2014).
- Singh, J. S., Abhilash, P. C., Gupta, V. K. Agriculturally Important Microbes in Sustainable Food Production. Trends Biotechnol. 34 (10), 773-775 (2016).
- Dubey, R. K., Tripathi, V., Dubey, P. K., Singh, H. B., Abhilash, P. C. Exploring rhizospheric interactions for agricultural sustainability: the need of integrative research on multi-trophic interactions. J Clean Prod. 115, 362-365 (2016).
- Hunter, P. Plant microbiomes and sustainable agriculture. EMBO Rep. 17 (12), 1696-1699 (2016).
- van der Heijden, M. G. A., Hartmann, M. Networking in the Plant Microbiome. PLoS Biol. 14 (2), e1002378(2016).
- Vessey, J. K. Plant growth promoting rhizobacteria as biofertilizers. Plant Soil. 255 (2), 571-586 (2003).
- Yang, J., Kloepper, J. W., Ryu, C. -M. Rhizosphere bacteria help plants tolerate abiotic stress. Trends Plant Sci. 14 (1), 1-4 (2009).
- Reynolds, H. L., Packer, A., Bever, J. D., Clay, K. GRASSROOTS ECOLOGY: PLANT-MICROBE-SOIL INTERACTIONS AS DRIVERS OF PLANT COMMUNITY STRUCTURE AND DYNAMICS. Ecology. 84 (9), 2281-2291 (2003).
- Finkel, O. M., Castrillo, G., Herrera Paredes, S., Salas González, I., Dangl, J. L. Understanding and exploiting plant beneficial microbes. Curr Opin Plant Biol. 38, 155-163 (2017).
- Northen, T. R., Zhang, Z., Gao, J., Swenson, T., Yoshikuni, Y. Advancing Our Understanding of the Chemistry of Soil Microbiomes. National Academies of Sciences, Engineering, and Medicine. 2017. The Chemistry of Microbiomes: Proceedings of a Seminar Series. , The National Academies Press. Washington, DC. (2017).
- Busby, P. E., et al. Research priorities for harnessing plant microbiomes in sustainable agriculture. PLOS Biology. 15 (3), e2001793(2017).
- Sanati Nezhad, A. Microfluidic platforms for plant cells studies. Lab Chip. 14 (17), 3262-3274 (2014).
- Oburger, E., et al. Evaluation of a novel tool for sampling root exudates from soil-grown plants compared to conventional techniques. Environ Exp Bot. 87, 235-247 (2013).
- Van Der Krift, T. A. J., Berendse, F. Root life spans of four grass species from habitats differing in nutrient availability. Funct Ecol. 16 (2), 198-203 (2002).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. P Natl. Acad. Sci. USA. 114 (17), 4549-4554 (2017).
- Sanati Nezhad, A., Naghavi, M., Packirisamy, M., Bhat, R., Geitmann, A. Quantification of cellular penetrative forces using lab-on-a-chip technology and finite element modeling. P Natl. Acad. Sci. USA. 110 (20), 8093-8098 (2013).
- Jiang, H., Xu, Z., Aluru, M. R., Dong, L. Plant chip for high-throughput phenotyping of Arabidopsis. Lab Chip. 14 (7), 1281-1293 (2014).
- Parashar, A., Pandey, S. Plant-in-chip: Microfluidic system for studying root growth and pathogenic interactions in Arabidopsis. Appl. Phys. Lett. 98 (26), 263703(2011).
- Busch, W., et al. A microfluidic device and computational platform for high-throughput live imaging of gene expression. Nat Methods. 9 (11), 1101-1106 (2012).
- Grossmann, G., et al. The RootChip: An Integrated Microfluidic Chip for Plant Science. Plant Cell. 23 (12), 4234-4240 (2011).
- Aufrecht, J. A., Ryan, J. M., Hasim, S., Allison, D. P., Nebenführ, A., Doktycz, M. J., Retterer, S. T. Imaging the Root Hair Morphology of Arabidopsis Seedlings in a Two-layer Microfluidic Platform. J. Vis. Exp. (126), (2017).
- Garvin, D. F., et al. Development of Genetic and Genomic Research Resources for Brachypodium distachyon, a New Model System for Grass Crop Research. Crop Sci. 48 (Supplement_1), S69-S84 (2008).
- Lisensky, G. C., et al. Replication and Compression of Surface Structures with Polydimethylsiloxane Elastomer. J. Chem. Educ. 76 (4), 537(1999).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502(2010).
- Yao, Y., et al. Analysis of Metabolomics Datasets with High-Performance Computing and Metabolite Atlases. Metabolites. 5 (3), 431-442 (2015).
- Sumner, L. W., et al. Proposed minimum reporting standards for chemical analysis Chemical Analysis Working Group (CAWG) Metabolomics Standards Initiative (MSI). Metabolomics. 3 (3), 211-221 (2007).
- Gao, J., de Raad, M., Bowen, B. P., Zuckermann, R. N., Northen, T. R. Application of Black Silicon for Nanostructure-Initiator Mass Spectrometry. Anal. Chem. 88 (3), 1625-1630 (2016).
- Gao, J., et al. Morphology-Driven Control of Metabolite Selectivity Using Nanostructure-Initiator Mass Spectrometry. Anal. Chem. 89 (12), 6521-6526 (2017).
- Woo, H. -K., Northen, T. R., Yanes, O., Siuzdak, G. Nanostructure-initiator mass spectrometry: a protocol for preparing and applying NIMS surfaces for high-sensitivity mass analysis. Nat. Protoc. 3 (8), 1341-1349 (2008).
- Rübel, O., et al. OpenMSI: A High-Performance Web-Based Platform for Mass Spectrometry Imaging. Anal. Chem. 85 (21), 10354-10361 (2013).
- López-Bucio, J., Cruz-Ramı́rez, A., Herrera-Estrella, L. The role of nutrient availability in regulating root architecture. Curr Opin Plant Biol. 6 (3), 280-287 (2003).
- Lynch, J. P. Steep, cheap and deep: an ideotype to optimize water and N acquisition by maize root systems. Ann. Bot. 112 (2), 347-357 (2013).
- Rellán-Álvarez, R., et al. GLO-Roots: an imaging platform enabling multidimensional characterization of soil-grown root systems. eLife. 4, e07597(2015).
- Kamilova, F., Validov, S., Azarova, T., Mulders, I., Lugtenberg, B. Enrichment for enhanced competitive plant root tip colonizers selects for a new class of biocontrol bacteria. Environ. Microbiol. 7 (11), 1809-1817 (2005).
- Klitgaard, A., Nielsen, J. B., Frandsen, R. J. N., Andersen, M. R., Nielsen, K. F. Combining Stable Isotope Labeling and Molecular Networking for Biosynthetic Pathway Characterization. Anal. Chem. 87 (13), 6520-6526 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados