Method Article
Variaciones negativas manchan métodos de microscopía electrónica: herramientas para afrontar un reto sistemas
En este artículo
Erratum Notice
Resumen
Tinción negativa de EM es una técnica poderosa para la visualización de estructura macromolecular, pero diferentes técnicas de tinción pueden producir resultados diferentes de una manera dependiente de la muestra. Aquí se describen varios métodos de tinción negativa en detalle para proporcionar un flujo de trabajo inicial para hacer frente a la visualización de sistemas difíciles.
Resumen
Tinción negativa la microscopia electrónica (EM) permite la observación relativamente simple y rápida de macromoléculas y complejos macromoleculares mediante el uso de contraste que realza el tinte reactivo. Aunque limitado en su resolución a un máximo de ~ 18-20 Å, mancha negativa EM es útil para una variedad de problemas biológicos y también proporciona un medio rápido de determinar muestras para microscopia del cryo-electrón (cryo-EM). Tinción negativa está el método directo; la muestra se adsorbe sobre un sustrato, luego una mancha se aplica, borrada y secada para producir una fina capa de mancha densa del electrón en el cual las partículas se encajan. Muestras individuales pueden, sin embargo, comportarse de manera marcadamente diferente bajo diferentes condiciones de tinción. Esto ha llevado al desarrollo de una gran variedad de técnicas de preparación de sustratos, reactivos y rejilla lavar y borrar las técnicas de tinción negativas. Determinar la técnica más adecuada para cada muestra individual se debe hacer sobre una base caso por caso y un microscopista debe tener acceso a una variedad de diferentes técnicas para lograr los resultados de tinción negativa más alta calidad. Cuentan con protocolos detallados para dos métodos de preparación de sustrato diferentes y tres diferentes técnicas Blot, y se muestra un ejemplo de una muestra que muestra resultados muy diferentes dependiendo del método utilizado. Además, se describe la preparación de algunos reactivos de tinción negativa común y dos novela basada en la serie de los lantánidos las manchas, con la discusión sobre el uso de cada uno.
Introducción
A pesar de la reciente atención a la resolución revolución resultantes de avances significativos en el cryo-Electrón microscopia1 (cryo-EM), negativo mancha EM sigue siendo una técnica poderosa y un componente crucial de la caja de herramientas de electrónica microscopistas. Tinción negativa sigue siendo el mejor método de evaluación rápida de una muestra antes de optimizar condiciones de cryo-red2. El alto contraste y la velocidad de preparación de red de muestras negativas de teñido es ideal para evaluar la pureza de la muestra, la concentración, la heterogeneidad y flexibilidad conformacional3. Muchas estructuras biológicamente informativas resultado de reconstrucciones de tinción negativa, a pesar de la resolución de la técnica se limita a ~ 18 Å de resolución4,5,6, y algunas muestras dan mejores resultados en la mancha que cryo-EM para una variedad de razones7.
En mancha negativa EM, la partícula de interés es fijado por adsorción sobre la superficie de una cuadrícula de EM y envueltos por una matriz amorfa de mancha densa del electrón compuesta. Se produce un alto contraste relativo entre el fondo y las partículas de interés, con la partícula siendo menos electrón denso que el circundante mancha8. Las partículas aparecen como áreas claras debido a su poder de dispersión de electrones bajo en comparación con la densa mancha circundante, que dispersa los electrones más y aparece más oscura. Características Lógicas subestructurales de partículas pueden deducirse de la examinación detallada de imágenes resultantes como mancha será penetrar en cualquier grieta y producir contraste irregular detalle9.
El proceso de tinción negativa comienza con la preparación de un sustrato de soporte en el que se capturan las partículas de la muestra y la capa de manchas secas apoyado. El sustrato de apoyo más utilizadas es una capa de carbono amorfo, a veces apoyada por una fina capa de polivinilo (e.g. Formvar) o polímero de nitrocelulosa (e.g. colodión). Estos sustratos pueden ser adquiridos comercialmente o preparados interno utilizando los protocolos que se describen a continuación.
Después se prepara el sustrato de apoyo, la muestra puede ser aplicada, y el exceso de solución de borrado de. Las muestras deben suspenderse en un tampón adecuado para la tinción negativa. Es mejor evitar el uso de tampón fosfato y altas concentraciones de sal, que pueden dar lugar a precipitados cristalinos que pueden ocultar a la muestra. Agentes reductores, detergentes, sacarosa, glicerol y altas concentraciones de nucleótidos deben evitarse también como también afectar a la tinción de calidad4. Cuando no se puede cambiar la composición del tampón, lavar la superficie de la rejilla de la EM con agua o un tampón más adecuado después de la adsorción y antes de la tinción puede reducir la formación de búfer relacionados con artefactos y mejorar en general el tinción de fondo. Si se sospechan de artefactos de búfer, puede ser informativo a la mancha un sólo buffer grid para determinar si los componentes del buffer son la fuente de los artefactos observados.
Después de la muestra es adsorbida y borrada y lavada si es necesario, se aplica un reactivo de tinción. Una variedad de reactivos se han encontrado para ser eficaces manchas negativas (tabla 1), pero la mancha debe ser elegida para la muestra. Un 'halo' de mancha formas alrededor de la partícula debido a ambos el desplazamiento de las moléculas de colorante por las regiones hidrofóbicas de la proteína y de repulsión por carga grupos. Por lo tanto, debe elegirse la mancha para que el estado de protonación de cualquier potencial grupos cargados en la proteína es la misma que la mancha en el pH de trabajo. Frente a las cargas en la superficie de la proteína puede contribuir a una tinción positiva del efecto, que aunque no es una técnica útil en la su propia derecha10 en el ámbito de este documento. Los reactivos de tinción negativa más comúnmente usados son acetato de uranilo y formato de uranilo. Estas manchas tienen un tamaño de grano relativamente fino (4-5 Å)9 y proporcionan imágenes de mayor resolución sobre otras manchas como fosfo-volframatos (Å tamaño de grano de 8-9)9,11, amonio molibdato11y algunos basados en la serie de los lantánidos las manchas12. Formiato y acetato de uranilo actúan también como un fijador, conservando muchas de las interacciones de proteínas en una escala de tiempo de milisegundos de13, aunque el pH bajo de la mancha y su propensión a precipitar a pH fisiológico puede ser perjudicial para algunas muestras14 . A pesar de su utilidad, las sales de uranilo también presentan retos logísticos que son tóxicos y ligeramente radiactiva, que puede requerir especial manipulación, el almacenamiento, y requisitos de la disposición, que lleva a algunos usuarios a buscar alternativas no radiactivas.
Hay una gran variedad de métodos descritos para la preparación de sustrato, aplicación de muestra y la coloración de rejillas EM. El método más adecuado a utilizar es dependiente de la muestra y puede ser difícil de determinar al abordar un nuevo sistema. Este manuscrito describe dos métodos de preparación de sustrato y tres métodos Blot; lado borrar cajón5y15de lavado rápido. Borrar de lado es el más simple de los métodos descritos. El método de cajón y el método de lavado rápido son más difíciles de implementar, pero limitar el tiempo de contacto de la muestra con la película de soporte antes de la fijación y se han demostrado para mejorar la formación de artefactos de tinción para algunas de las muestras5. El objetivo de este manuscrito es así para proporcionar un flujo de trabajo inicial para hacer frente a la visualización de sistemas un reto por tinción negativa EM.
Protocolo
1. preparación de grillas de EM
- Método de hoja del carbón
- Preparar una hoja de mica recién descamada.
- Suavemente inserte una aguja de jeringa de precisión o una hoja de afeitar en una esquina de la hoja de la mica, algunos milímetros entre las capas. Inserte la herramienta como cerca del centro vertical de la hoja como sea posible producir dos piezas de aproximadamente igual espesor.
- Cuidadosamente hacer palanca aparte las dos mitades de la hoja de la mica. Hacer esto puede por el ojo, o con un microscopio de disección.
- Cortar una de las esquinas de cada una de las hojas de mica recién exfoliados. En caso de que la hoja da la vuelta en el evaporador de carbono durante la liberación de vacío, puede identificarse la cara recubiertas de carbón de la hoja.
- Colocar la mica exfoliados hoja/s en la cámara de un evaporador de carbono, con la superficie recién troceados hacia arriba.
- Asegúrese de que el evaporador de carbono está configurada correctamente con un electrodo de carbono convenientemente preparada.
Nota: El método de preparación de las varillas de carbono variará dependiendo de las especificaciones del evaporador de carbono. Un protocolo para un instrumento es la siguiente hasta el paso 1.1.5.- Afilar una varilla de carbono con un sacapuntas tiene una punta muy afilada y luego pulirla con una toalla de papel para eliminar cualquier rebaba áspera.
- Usando papel de lija fino aplanar el extremo de una varilla segundo y nuevo pulimento suave con una toalla de papel.
- Coloque la varilla de carbono en el evaporador según instrucciones del fabricante. Asegúrese de que el extremo afilado de la primera varilla hace contacto con la cara aplastada de la segunda varilla.
- Coloque un pedazo pequeño de papel de filtro limpio y seco parcialmente debajo de la mica si el espesor de carbono va a evaluarse visualmente. Como alternativa, coloque un portaobjetos esmerilado blanco con un pequeño toque de grasa para vacío junto a la mica para medir espesor de carbono.
- Depósito de carbón sobre la mica según instrucciones del fabricante.
- El vacío de la bomba hacia abajo y espere hasta que esté a 10-5 mbar. Ajustar la tensión del electrodo 4.0 V (hasta 5 V puede ser requerida dependiendo de la fuente de la barra de carbono).
- Ejecutar múltiples pulsos cortos de aproximadamente 3.5 s en duración a través del electrodo para depositar evaporaciones grueso de 1-2 nm de carbono en la superficie de la mica.
Nota: Como corriente se aplica a la varilla de carbono rojo y luego blanco. No fije la vista en la luz brillante ya que podría dañar sus ojos. - Permita que el carbón depositar en la mica hasta que se alcanza el espesor deseado, según lo medido por el calibrador de grueso del evaporador de carbono o por observación visual del carbono depositado en el filtro de papel o diapositiva del microscopio. Asegúrese de que la capa de carbón final es 5-10 nm de espesor.
- Si el espesor de carbono es medir visualmente comparar la parte helada de lo portaobjetos recubierto con grasa de vacío en el área expuesta, se volverá más oscuro mientras más carbono se deposita.
Nota: No existe ningún método cuantitativo para determinar espesor de carbono cuando se utiliza este método.
- Si el espesor de carbono es medir visualmente comparar la parte helada de lo portaobjetos recubierto con grasa de vacío en el área expuesta, se volverá más oscuro mientras más carbono se deposita.
- La cámara de vacío de ventilación y quite la mica recubiertas de carbón del evaporador de carbono.
Nota: La mica recubiertas de carbón puede dejarse para colocar durante la noche antes de proceder a realizar los siguientes pasos - Utilice uno de los dos contenedores de agua para flotar la película de carbón sobre las rejillas de la EM: un recipiente con una válvula de drenaje en la parte inferior para que el agua puede drenarse hacia fuera y la capa de carbón bajó a las rejillas de espera o una plataforma de elevación que las rejillas pueden ser bajo el agua superficie, que posteriormente puede levantar las rejillas hasta la película de carbón en la superficie del agua.
- Llene el recipiente con agua destilada ultrapura para que la superficie del agua es aproximadamente 5 mm de la parte superior. Limpie la superficie del agua arrastrando una hoja o dos de papel sobre la superficie para eliminar cualquier partículas flotantes.
- Coloque un pedazo de malla de acero inoxidable limpio (1 pulgadas por 2,5 pulgadas es un tamaño apropiado) bajo la superficie del agua.
- Usando un par de Pinzas finas, pone la cara limpia y seca EM rejillas para arriba (según la descripción del fabricante) de la malla de acero inoxidable. Pack las rejillas juntos tan ajustadamente como sea posible, pero no permiten que se superponen.
- Una vez que las rejillas se arreglan, sujete firmemente la hoja de mica recubiertas de carbono en un par de pinzas o película radiográfica pinzas.
- Introducir la hoja de la mica en el agua. Asegúrese de que esto se hace en un ángulo muy bajo (~ 10 grados).
Nota: La mica debe romper la superficie del agua y sumergirse, mientras que la película de carbón debe separar la mica y flotan en la superficie del agua. Este paso no debe realizarse directamente sobre las rejillas, para evitar daños o contaminación.- Para minimizar la posibilidad de la voluntad de película de carbono no se separa de la hoja de la mica, cuenta alrededor del borde de la hoja de mica con una hoja de afeitar o cortar una esquina con pequeñas tijeras antes de introducirlo en el agua.
- Una vez que se ha desprendido la película de carbón, retire la hoja de la mica o dejarla caer hasta el fondo del recipiente.
- Con pinzas con punta finas, aplicar una presión muy suave y con movimientos lentos guía de la película de carbón sobre la parte superior de las rejillas.
- Traer la hoja de carbono en contacto con la superficie de las rejillas ya sea por drenaje el agua lentamente o levantar el anillo de elevación, dependiendo del tipo de aparato utilizado.
- Levante cuidadosamente la malla de acero inoxidable (ahora con rejillas recubiertas de carbón) del aparato y mecha a algunos de lo exceso de agua utilizando un trozo de papel de filtro. Asegúrese de que esto se hace por tocar el papel filtro al borde mismo de la malla de acero pero no entre en contacto con las rejillas o película de carbón.
- Colocar la malla de las redes en una placa Petri que contiene un pedazo seco de papel de filtro y dejar seco totalmente.
Nota: Esto mejor es afectado por sequía durante la noche a temperatura ambiente, pero el paso puede ser acelerado mediante la colocación de las rejillas en el horno a aproximadamente 60 ° C.
- Preparar una hoja de mica recién descamada.
- Flotador y capa (deposición de carbono directa). Este método se ha descrito en detalle previamente16
- Llene completamente un recipiente de vidrio limpio grande hasta el borde con agua destilada, por lo que forma un menisco en la parte superior.
- Aplique una sola gota de solución de colodión (nitrocelulosa en acetato de amilo) a la superficie del agua usando una pipeta pasteur limpias, deje que la gota a estirar y secar completamente. Una vez seco una fina capa de colodión flotando sobre la superficie del agua será visible.
- Quite con cuidado la capa de colodión usando un palillo de dientes para retirar polvo u otra contaminación de la superficie del agua.
- Aplicar una segunda gota de colodión al agua y permita que extendido y secar durante 2-3 minutos.
Nota: Repita los pasos 1.2.3-1.2.4 hasta obtener una hoja plana y arruga libre de colodión. - Con un par de Pinzas finas lugar EM redes bocabajo (según la descripción del fabricante) en la hoja flotante de colodión. Pack las rejillas juntos firmemente en un arreglo hexagonal, pero no permiten que se superponen.
Nota: Si una red está fuera de lugar o colocada boca abajo es generalmente mejor dejarlo en lugar en lugar de riesgo de dañar la lámina de colodión al tratar de moverlo. - Una vez que todas las rejillas se colocan, Coloque suavemente una hoja de papel de filtro sobre ellos. Permita que el papel se sature por capilaridad.
Nota: Cualquier tamaño o grosor del papel de filtro es apropiada si cubre totalmente las rejillas. - Utilice un palillo para quitar cualquier película de colodión que se extiende más allá del papel de filtro.
- Agarre el papel de filtro en el borde y la cáscara de la superficie del agua.
Nota: Las rejillas deben permanecer adheridas al papel. - Coloque el papel plano y colodión-cara arriba en una placa Petri y deje que se seque completamente.
- Colocar el papel filtro con las rejillas en la cámara de un evaporador de carbono con un electrodo de carbono debidamente preparada como se indica en 1.1.2.
- Siga el procedimiento de evaporación de carbono tal como se describe para el método de la hoja de carbono en
- Espere varios segundos entre pulsos para evitar sobrecalentamiento y dañar la hoja de nitrocelulosa.
Nota: Si se desea puede eliminarse la capa de polímero después de las rejillas de carbón cubierto, aunque este paso rara vez es necesario. Coloque el lado de carbono rejillas arriba en un fresco pedazo de papel de filtro y poner unas gotas de acetona sobre el libro cerca, pero no, las rejillas. Permitir que la acetona extendió debajo de las rejillas y disolver y absorber la capa de polímero.
2. preparación de los reactivos de tinción negativa
-
Preparación de acetato de uranilo
- Llevar un pequeño volumen de agua ultrapura a ebullición y déjelo hervir por 10 min a desgasificar bien. Deje que se enfríe un poco y luego usar para disolver el acetato de uranilo (UA) en 1-2% (w/v).
Nota: Realice este procedimiento en una vitrina y con equipo de protección personal. - Una vez enfriada la solución, filtrar a través de un filtro de jeringa de 0,2 μm o papel de filtro.
- Almacenar la UA protegida de la luz y a 4 ° c. La solución es estable por hasta 1 año.
- Llevar un pequeño volumen de agua ultrapura a ebullición y déjelo hervir por 10 min a desgasificar bien. Deje que se enfríe un poco y luego usar para disolver el acetato de uranilo (UA) en 1-2% (w/v).
-
Elaboración de formato de uranilo de polvo. Este método ha sido descrito en detalle previamente8
- Polvo de formiato (UF) de uranilo de 20 mg en 2 mL de agua ultrapura desgasificada hervida (como en el paso 2.1.1) se disuelven por agitación.
- Sin dejar de remover, añadir 8 μl de NaOH 5 de M, la solución debería cambiar a un color amarillo más oscuro, pero no precipitado debe formar.
- Filtrar la solución a través de un filtro de jeringa de 0,2 μm.
- Tienda la mancha UF protegida de la luz. Descarte que la mancha debe si precipita o decoloración de brown se observa. La solución sólo es estable durante 1-2 días.
-
Elaboración de formato de uranilo de acetato de uranilo
- Precipitado 1 mL de tintura UA 1% (p/v) mediante la adición de 100 μl de 1 M NaOH.
- Centrifugue la mezcla durante 2 min a máxima velocidad en una centrífuga de sobremesa.
- Deseche cualquier sobrenadante y disolver el precipitado en 100 μl de ácido fórmico al 5% (v/v) con un vórtex vigoroso.
- Diluir hasta un volumen final de 1 mL con 900 μl de agua ultrapura para producir el tinte de la UF en 0,5% (v/v) de ácido fórmico.
- Tienda la mancha UF protegida de la luz. Elimine la mancha si se observa cualquier decoloración marrón o precipitada.
-
Preparación de los otros reactivos de tinción
-
Preparación de acetato de lantánido manchas
- Disolver el acetato de samario (SmAc), acetato de gadolinio (GdAc), acetato de Tulio (TmAc) o acetato de Erbio (ErAc) en 1-2% (p/v) en agua ultrapura.
Nota: Si las muestras muestran coloración positiva o mala adherencia a la red cuando se utiliza estas manchas, pueden ser acidificados hasta 0.5% (v/v) ácido fórmico. Coloración positiva los resultados de la muestra que aparece como un objeto oscuro rodeado de un halo blanco. Mala adherencia a la red tendrá como resultado menos moléculas que el esperado se observa en la red.
- Disolver el acetato de samario (SmAc), acetato de gadolinio (GdAc), acetato de Tulio (TmAc) o acetato de Erbio (ErAc) en 1-2% (p/v) en agua ultrapura.
-
Preparación de molibdato de amonio y fosfotungstato de sodio
- Disolver la mancha en 1-3% (p/v) en agua ultrapura. Ajustar el pH a 7.0 con NaOH M 5 si lo desea.
-
Preparación de acetato de lantánido manchas
3. adsorción muestras al carbono sustrato y tinción
-
Preparación de la superficie de la rejilla para la aplicación de ejemplo por que lo hacen hidrofílico
- Coloque la parrilla hacia arriba en un portaobjetos de microscopio en una unidad de descarga de resplandor.
- Tratar la red por un mínimo de 30 s a 10 mA.
Nota: El método exacto de descarga del resplandor dependerá de las especificaciones de la pieza particular del equipo usado. - Alternativamente, esto se puede lograr por la irradiación UV por 10 minutos en lámpara UV benchtop4.
-
Borrar método. Este método ha sido descrito en detalle previamente8
- Agarre el borde de la red con un par de pinzas de presión negativa y 3-5 μl de muestra se aplican a la superficie de apoyo.
- La muestra fijar por adsorción a la superficie de la rejilla de 10 s a 1 min de optimizar el tiempo de adsorción debe para muestras individuales.
- Toque el borde de la cuadrícula en una hoja de papel de filtro y permita que la acción capilar sacar el líquido.
- Opcional: Lave la rejilla. Gotas de depositar 50 μl de agua ultrapura o tampón apropiado volátiles en una hoja de película de laboratorio. Suavemente toque la superficie del carbón de la rejilla a la caída y levante una pequeña gota sobre la superficie de la rejilla. Toque el borde de la cuadrícula en una hoja de papel de filtro y permita que la acción capilar sacar el líquido.
- Repita este paso de lavado tantas veces como se desee.
- Lugar dos 50 μl gotas de tinción reactivo en una hoja de película de laboratorio.
- Suavemente toque la superficie del carbón de la rejilla a la caída y levante una pequeña gota sobre la superficie superior de la rejilla.
Nota: Si la mancha migra a la parte posterior de la rejilla y la rejilla debe ser desechada. - Toque el borde de la cuadrícula en una hoja de papel de filtro y permita que la acción capilar extraer el líquido. Realizar este paso mancha dos veces.
- Permita que la parrilla al aire seco o seca debajo de una lámpara incandescente.
-
Método de cajón
- Agarre el borde de la red con un par de pinzas de presión negativa y 3-5 μl de muestra se aplican a la superficie de apoyo.
- Rápidamente con las pinzas en una mano, para que la red tiene un ángulo de aproximadamente 45 ° mirando lejos, flick la muñeca de esa mano a 'la película de' la mayoría de la gota que está encima de la red.
- Opcional: Utilizar un pipeta Pasteur de vidrio una gota de solución de lavado se aplica a la superficie de apoyo y chasquear apagado como en 3.2.2. Repita según sea necesario.
- Utilizando un pipeta Pasteur de vidrio, aplique una gota de tinción reactivo en la superficie de apoyo y chasquear apagado como en 3.2.2. Repetir 1 - 3 veces depende la mancha profundidad necesaria para la visualización de la muestra.
Nota: Este no es el único factor que se atribuye a la profundidad final de la mancha (ver discusión). - Eliminar exceso mancha tocando el borde desgarrado de un pedazo de papel de filtro en el borde de la cuadrícula.
- Permita que la parrilla al aire seco o seca debajo de una lámpara incandescente.
-
Método rápido de Flushing
- Dibujar 30-70 μl de colorante (1% UA normalmente utilizado) en la punta de una pipeta de 200 μL, gire el dial de volumen para elaborar 5 μl de aire y luego elaborar reactivo de lavado/mezcla (5-30 μL), si es necesario, seguido de otro pequeño boquete de aire y luego elaborar 5 μl de la muestra.
- Agarre el borde de una cuadrícula con un par de pinzas de presión negativa, con las pinzas para que la red tiene un ángulo de aproximadamente 45 ° hacia el investigador, expulsar todo el contenido de la pipeta en la cara de la rejilla de EM recubiertas de carbón.
- Eliminar exceso mancha tocando el borde desgarrado de un pedazo de papel de filtro en el borde de la cuadrícula.
- Permita que la parrilla al aire seco o seca debajo de una lámpara incandescente.
Nota: Todos los métodos es recomendable deslizar el borde desgarrado de una hoja de papel de filtro a lo largo de la pinza hasta que llegue la red, esto quita solución atrapado entre los dos lados de la pinza, que puede tirar la rejilla de secado en las mordazas de las pinzas una vez que se abierto. La red en las pinzas también puede colocarse en el borde de una campana de humos para secar. El flujo de aire constante puede ayudar a producir más manchas aún.
Resultados
Todos los reactivos de tinción probados producen Tinción negativa hasta cierto punto, con UF obtención de las muestras con el mayor contraste y partículas más nítidas y más detalladas. Para manchas de lantánido basado profundamente enraizadas de las muestras (figura 1) ErAc y TmAc producción Tinción negativa de calidad equivalente a UA según lo juzgado por el aparente contraste y la nitidez de las partículas teñidas, con TmAc produce más claro, más imágenes nítidas de ErAc. Aunque el mayor tamaño de grano de TmAc se hace evidente en la alta ampliación, cuando las partículas del Virus del mosaico del tabaco (TMV) se tiñeron con TmAc ~ 23 Å repetición de la partícula de la TMV el 1%17 todavía era claramente visible por el ojo y como una línea meridional en el Transformada de Fourier de la imagen raw. Ninguno de las otros lantánidos manchas probadas, ErAc, SmAc o GdAc, fueron capaces de resolver esta función. Medias de clase fueron generados por la extracción de segmentos superpuestos de las partículas TMV donde era visible la repetición helicoidal. Los segmentos extraídos entonces fueron alineados y clasificaron usando RELION18 para visualizar mejor la función periódica (figura 2).
Algunas muestras son especialmente sensibles al método de tinción, como el músculo había derivado C-proteína. Proteína C, que consiste en una cadena flexible de Ig y Fn-como dominios, produce imágenes significativamente diferentes por tinción negativa EM depende del método de tinción utilizado (figura 3). Cuando el método de lado-blotting, se derrumbó anillo-como las estructuras se observan, mientras que cuando manchado el rápido o sacudiendo métodos, proteína C se observa como una serie de dominios que se asemejan a cuentas en un hilo.
| Reactivo de | Concentración | pH | Tipo |
| Molibdato de amonio | 1 - 2% | 5 – 7 | Aniónicos |
| Acetato de Erbio (ErAc) | 1 – 2% | 6 | Catiónico |
| Acetato de gadolinio (GdAc) | 1 – 2% | 6 | Catiónico |
| Tungstato de metilamina | 2% | 6 – 7 | Aniónicos |
| Acetato de samario (SmAC) | 1% | 6 | Catiónico |
| Silicotungstate de sodio | 1 – 5% | 5 – 8 | Aniónicos |
| Fosfotungstato de sodio | 1 -3% | 5 – 8 | Aniónicos |
| Acetato de Tulio (TmAc) | 1 – 2% | 6 | Catiónico |
| Acetato de uranilo (UA) | 1 – 3% | 3-4 | Catiónico |
| Formato de uranilo (UF) | 0.75-1% | 3-4 | Catiónico |
Tabla 1: Algunos reactivos Tinción negativa común.

Figura 1: imágenes de ejemplo del Virus del mosaico del tabaco teñidas con diversos reactivos de tinción negativa (A) 1% UF (B) 2.5% TmAc (C) 2,5% ErAc. (D) 1% UA (E) 2.5% GdAc) y (F) 2.5% SmAc. Barras de escala son 100 nm. Imágenes representativas de múltiples repeticiones con múltiples áreas reflejadas por repetición. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Virus del mosaico del tabaco de tinción con acetato de Tulio (A) alta ampliación de área de una micrografía de TMV teñidas con 1% TmAc. Barra de escala es de 20 nm. (B) de la clase media de los segmentos extraídos de TMV. (C) transformada de Fourier de la imagen en reflejos de línea de capa panel A muestra en ~ 23 Å. haga clic aquí para ver una versión más grande de esta figura.
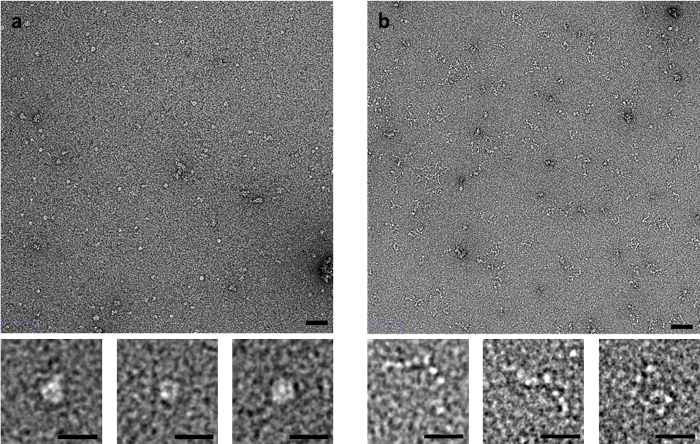
Figura 3: efectos de borrar el método en la conformación de la proteína C. (A) proteína C tinción con UA utilizando el método de la mancha blanca /negra de lado (B) método de cajón. Barra de escala del panel superior es de 50 nm, barra de escala inferior de panel es de 20 nm. Imágenes representativas de múltiples repeticiones con múltiples áreas reflejadas por repetición. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este manuscrito describe varios métodos para la tinción negativa de muestras para microscopía electrónica usando una variedad de coloración de reactivos, incluyendo dos reactivos lantánidos novela (TmAc y ErAc). Muchos de los pasos del proceso de tinción negativa deben ser optimizados para muestras individuales, incluyendo la elección de la mancha, la cantidad de lavado requerida si alguna y la técnica blot. Así, este manuscrito proporciona una base para microscopistas desarrollar sus propios flujos de trabajo para hacer frente a la tinción negativa de sistemas difíciles.
La elección de la mancha es altamente dependiente de la muestra. Las muestras que son especialmente sensibles a pH bajo pueden ser degradadas por UA o UF, a pesar de las propiedades de fijación de estas manchas19. En estos casos, el lantánido base manchas tales como TmAc o ErAc puede ser más apropiado, aunque el pH global de la preparación debe estar por debajo del punto isoeléctrico de la proteína de la muestra para evitar la coloración positiva. Esto se logra acidificando la tinción con ácido acético, si es necesario. Para las muestras sensibles especialmente bajo pH, aniónicos tungstato o molibdato de manchas pueden ser más eficaces. Aunque estas manchas se han encontrado para inducir la formación de artefactos en algunos casos, tales como la formación de rouleaux en lipoproteína de muestras20. Otra vez, el pH de la mancha puede necesitar ser ajustada, esta vez por encima del punto isoeléctrico de la muestra, para evitar la tinción positiva.
Lavado de la muestra antes de la tinción puede ser necesario si el búfer en el que se mantiene la muestra tiene un alto componente de sal o fosfato. En muchos casos, se puede realizar lavado con agua ultrapura pero para las muestras más sensibles, que pueden degradar o someterse a cambios estructurales cuando se expone a agua sola, puede necesitar lavado se realizará con un buffer volátil de baja fuerza iónica8. Incluso bajo condiciones cuidadosamente controladas, lavado puede resultar en un cambio estructural en la superficie de carbono21.
El método por el cual una cuadrícula está preparada en términos de adsorción de la muestra, el borrar y tinción también significativamente puede afectar lo que se observa. El método más adecuado es por lo tanto, una vez más, muy muestra dependiente. Proteína C, por ejemplo, se observa como una anillo-como la estructura globular tras tinción de lado-blot, pero esto parece ser un artefacto del proceso de tinción, según lo revelado cuando rejillas son preparadas por el método de cajón (o por el método de lavado rápido) (figura 3 ). En los métodos de lavado cajón y rápidos, el tiempo de que la muestra tiene que interactuar con el carbono superficie de apoyo antes de la fijación es mínimo15. La muestra también experimenta menos fuerzas de retroceso menisco a borrar antes de la fijación. Esto significa que los cambios estructurales en la muestra que podría ocurrir en el tiempo de absorción prolongada en la película de carbón o por capilaridad se minimizan. El método de lavado rápido puede utilizarse también para el análisis de tiempo-resolved de especímenes. La muestra puede ser mezclada con un ligando o aditivo en una punta de pipeta para un conjunto de período de tiempo antes de la aplicación a una red o sólo momentáneamente en la superficie de la rejilla antes de fijación dentro de milisegundos.
La profundidad de la mancha debe proporcionar imágenes óptimo de una muestra particular es otra vez dependiente de la muestra2. Si la mancha es demasiado superficial, las moléculas pueden ser dañadas por el haz de electrones, pero si la mancha es demasiado gruesa características estructurales se puede perder. Profundidad de la mancha está influenciada por múltiples factores como la hidrofilia de la superficie de la rejilla, uniformidad de la capa de carbón, la cantidad de tinción aplicada a la red, la duración de la mancha está en contacto con la red antes de borrar, la medida de borrar y el tiempo ta KES para la cuadrícula completamente seco. Una red nunca tendrá una distribución uniforme de la mancha en su totalidad y por tanto es necesario seleccionar cuidadosamente las áreas de la rejilla apropiada para la proyección de imagen. De hecho, rejillas a menudo varían en calidad incluso cuando se prepara el mismo día en las mismas condiciones. Un buen ejemplo de cómo variación en profundidad de la mancha afecta la apariencia de las moléculas y la profundidad de la mancha apropiada para la proyección de imagen se proporciona por Burgess et al.5.
A pesar de negativas tinción un método muy versátil, rápido y sencillo, no todas las muestras biológicas son susceptibles de visualización por este método. Asambleas frágil pueden contraer o desmontar sobre adsorción, manchas o sequedad en la EM la red22. Tinción negativa puede también conducir a aplanar de las moléculas e inducir recomendado: orientaciones de las moléculas el carbono soporte película7.
Tinción negativa es una valiosa herramienta para la evaluación de las muestras en sí mismo y también antes del análisis de cryo-EM pero muchas de las fuerzas físicas que se encuentra con la muestra durante el proceso son poco conocidos. Por lo tanto, el mejor método a utilizar se muestra altamente dependiente y debe determinarse por ensayo y error, en lugar de autodidacta siguiendo un protocolo fijo.
Divulgaciones
Los autores no declaran a intereses financieros en competencia.
Agradecimientos
Estamos muy agradecidos a Peter Knight para discusiones útiles y revisión crítica del manuscrito. Nos gustaría agradecer a todos los miembros de los laboratorios de Neil Ranson y de Stephen Muench y el personal del laboratorio de bioestructura Astbury para discusiones útiles. Este trabajo fue financiado por el Consejo Europeo de investigación (FP7/2007-2013) / ERC conceder acuerdo 322408. Proteína C fue producida utilizando recursos proporcionadas por una beca de la Fundación británica del corazón (BHF PG/13/83/30485). También agradecemos la confianza de Wellcome para el equipo de financiación para apoyar la microscopia electrónica en Leeds (090932/Z/09/Z y 094232/Z/10/Z). CS es financiado por una subvención de ISSF Wellcome Trust.
Materiales
| Name | Company | Catalog Number | Comments |
| 200 mesh copper EM grids | Sigma-Aldrich | G4776-1VL | Other materials and/or mesh sizes can also be used |
| Ammonium Molybdate | Sigma-Aldrich | 277908 | |
| Carbon evaporator | Ted Pella Inc. | 9620 | Cressington 208 or equivalent |
| Collodion solution 2% in amyl acetate | Sigma-Aldrich | 9817 | |
| Dumont #5 negative pressure tweezers | World Precision Instruments | 501202 | Or other tweezers as preferred |
| Erbium Acetate | Sigma-Aldrich | 325570 | |
| Gadolinium Acetate | Sigma-Aldrich | 325678 | |
| Mica Sheets. 75x25x0.15mm. | AGAR Scientific | AGG250-1 | |
| Microscope slides, white frosted | Fisher Scientific | 12607976 | Or equivalent |
| Parafilm | Fisher Scientific | 10018130 | Or equivalent |
| Pasteur pipette (glass) | Fisher Scientific | 10343663 | Or equivalent |
| Razor blade | Fisher Scientific | 11904325 | Or equivalent |
| Sandpaper | Hardware store | Wet and dry sandpaper with grit finer that 200 (600 suggested) | |
| Samarium Acetate | Sigma-Aldrich | 325872 | |
| Sodium Hydroxide | Sigma-Aldrich | 1.06462 | |
| Sodium Phosphotungstate | Sigma-Aldrich | P6395 | |
| Stainless Steel Mesh, 150x150 mm (cut to size). | AGAR Scientific | AGG252 | |
| Thulium Acetate | Sigma-Aldrich | 367702 | |
| Two Step Carbon Rod Sharper, for 1/4" rods | Ted Pella Inc. | 57-10 | Or equivalent for carbon evaporator used |
| Ultra pure water | |||
| Uranyl Acetate | Electron Microscopy Sciences | 22400 | |
| Uranyl Formate | Electron Microscopy Sciences | 22450 | |
| Vacuum grease | Fisher Scientific | 12719406 | Or equivalent |
| Whatman #1 Filter paper. | Fisher Scientific | 1001 090 | Or equivalent |
| Whatman #40 filter paper | Fisher Scientific | 10674122 | Or equivalent |
Referencias
- Merk, A., et al. Breaking Cryo-EM Resolution Barriers to Facilitate Drug Discovery. Cell. 165 (7), 1698-1707 (2016).
- De Carlo, S., Harris, J. R. Negative staining and cryo-negative staining of macromolecules and viruses for TEM. Micron. 42 (2), 117-131 (2011).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Ha, J. Y., et al. Molecular architecture of the complete COG tethering complex. Nat Struct Mol Biol. 23 (8), 758-760 (2016).
- Burgess, S. A., Walker, M. L., Thirumurugan, K., Trinick, J., Knight, P. J. Use of negative stain and single-particle image processing to explore dynamic properties of flexible macromolecules. J Struct Biol. 147 (3), 247-258 (2004).
- Fabre, L., Bao, H., Innes, J., Duong, F., Rouiller, I. Negative-stain single particle EM of the maltose transporter in nanodiscs reveals asymmetric closure of MalK2 and catalytic roles of ATP, MalE and maltose. J Biol Chem. , (2017).
- Zhang, L., et al. An optimized negative-staining protocol of electron microscopy for apoE4 POPC lipoprotein. J Lipid Res. 51 (5), 1228-1236 (2010).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biol Proced Online. 6 (1), 23-34 (2004).
- Haschemeyer, R. H., Myers, R. J. . Negative Staining in Principles and Techniques of Electron Microscopy. 2, 101-147 (1972).
- Massover, W. H. Positive staining of protein molecules for electron microscopy: polyiodination of the apoferritin shell in ferritin. Ultramicroscopy. 52, 383-387 (1993).
- Harris, J. R., Bhella, D., Adrian, M. Recent Developments in Negative Staining for Transmission Electron Microscopy. Microsc Microanal. 20, 17-21 (2006).
- Hosogi, N., Nishioka, H., Nakakoshi, M. Evaluation of lanthanide salts as alternative stains to uranyl acetate. Microscopy (Oxf). 64 (6), 429-435 (2015).
- Zhao, F., Craig, R. Capturing time-resolved changes in molecular structure by negative staining. J Struct Biol. 141, 43-52 (2003).
- Cao, B., Xu, H., Mao, C. Transmission electron microscopy as a tool to image bioinorganic nanohybrids: the case of phage-gold nanocomposites. Microsc Res Tech. 74 (7), 627-635 (2011).
- Imai, H., et al. Direct observation shows superposition and large scale flexibility within cytoplasmic dynein motors moving along microtubules. Nat Commun. 6, 8179 (2015).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: from grid preparation to image acquisition. J Vis Exp. (58), (2011).
- Kendall, A., McDonald, M., Stubbs, G. Precise determination of the helical repeat of tobacco mosaic virus. Virology. 369 (1), 226-227 (2007).
- Scheres, S. H. A Bayesian view on cryo-EM structure determination. J. Mol. Bio. 415 (2), 406-418 (2012).
- Bremer, A., Henn, C., Engel, A., Baumeister, W., Aebi, U. Has negative staining still a place in biomacromolecular electron microscopy?. Ultramicroscopy. 46, 85-111 (1992).
- Garewal, M., Zhang, L., Ren, G., Kleinschmidt, J. . Lipid-Protein Interactions. Methods Mol Biol (Methods and Protocols). 974, 111-118 (2012).
- Walker, M. L., et al. Two-headed binding of a processive myosin to F-actin. Nature. 405 (6788), 804-807 (2000).
- Orlova, E. V., Saibil, H. R. Structural Analysis of Macromolecular Assemblies by Electron Microscopy. Chem Rev. 111 (12), 7710-7748 (2011).
Erratum
Formal Correction: Erratum: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems
Posted by JoVE Editors on 1/30/2020. Citeable Link.
An erratum was issued for: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems. An author name was updated.
One of the authors' names was corrected from:
Matthew G. Iadaza
to:
Matthew G. Iadanza
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados