Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Replicación de la ordena, no redundante biblioteca de Pseudomonas aeruginosa cepa PA14 mutantes de inserción de transposones
* Estos autores han contribuido por igual
En este artículo
Resumen
Infección por Pseudomonas aeruginosa causa una morbilidad significativa en hosts vulnerables. La biblioteca mutantes de inserción de transposones no redundante de p. aeruginosa cepa PA14, designados como establece PA14NR, facilita el análisis de la funcionalidad del gen en numerosos procesos. Presentamos es un protocolo para generar copias de alta calidad de la biblioteca mutante PA14NR establecido.
Resumen
Pseudomonas aeruginosa es una bacteria gramnegativa fenotípicamente y genotípicamente diversa y adaptable ubicua en ambientes humanos. P. aeruginosa es capaz de formar biopelículas desarrollan resistencia a los antibióticos, producen factores de virulencia y evolucionar rápidamente en el curso de una infección crónica. Así p. aeruginosa puede causar agudo y crónico, difícil de tratar infecciones, dando lugar a una morbilidad significativa en ciertas poblaciones de pacientes. P. aeruginosa cepa PA14 es un aislante clínico humano con una estructura de genoma conservadas que infecta una variedad de mamíferos y a anfitriones haciendo PA14 una variedad atractiva para el estudio de este patógeno. En 2006, se generó una transposon no redundante inserción mutante biblioteca 5.459 mutantes correspondientes a 4.596 genes predichos de PA14. Desde entonces, distribución de la biblioteca de PA14 ha permitido a la comunidad de investigación comprender mejor la función de genes individuales y complejas vías de p. aeruginosa. Mantenimiento de la integridad de la biblioteca a través del proceso de replicación requiere técnicas de correcta manipulación y precisa. Para ello, este manuscrito presenta protocolos que describen en detalle los pasos involucrados en la replicación de la biblioteca, biblioteca de control de calidad y almacenamiento adecuado de los mutantes.
Introducción
Pseudomonas aeruginosa es una bacteria gramnegativa fenotípicamente y genotípicamente diversa y adaptable presente en suelo, agua y entornos más humanos, así como la microflora de la piel. Comparado a muchas especies bacterianas, p. aeruginosa tiene un genoma relativamente grande de 5.5-7 Mbp con alta G + C contenido (65-67%). Además, una proporción significativa de sus genes están implicada en la adaptación metabólica y forman parte de redes de regulación, permitiendo una gran flexibilidad en respuesta a estrés ambiental1. P. aeruginosa expresa una gran cantidad de factores de virulencia, exhibe la propensión de forma biofilms, posee la capacidad de coordinar las respuestas a través de múltiples quórum sensing vías y muestra una notable capacidad para desarrollar resistencia a los antibióticos y tolerancia2,3,4,5,6,7,8. Estos atributos presentan desafíos significativos para el tratamiento de infecciones causadas por p. aeruginosa.
Crónica infecciones de p. aeruginosa pueden ocurrir en numerosos Estados de la enfermedad. La fibrosis quística (FQ), una enfermedad genética causada por la mutación del gen Regulador de conductancia transmembrana de la Fibrosis Quística (CFTR) , resulta en secreciones inspissated, infectadas dentro de la vía aérea, bronquiectasia progresiva y, en última instancia, la muerte de insuficiencia respiratoria9. Por la edad adulta, la mayoría de los pacientes con FQ crónicamente infectada con p. aeruginosa, que juega un papel fundamental en la morbilidad y la mortalidad asociada con esta enfermedad10. Además, pacientes con quemaduras severas lesiones11, las traqueotomías12, reemplazo de la articulación13o residente catéteres14 están en riesgo de infección por p. aeruginosa relacionados con la capacidad de las bacterias para formar biofilms y escape host las respuestas inflamatorias15. Además, la colonización se produce sin competencia después de haber seleccionado una población tolerante o resistente a múltiples antibiótico a través de tratamiento antimicrobiano de amplio espectro, secuencial12,16,17 , 18. mejor comprensión de la patogenesia de p. aeruginosa tendrá implicaciones significativas para muchos Estados de enfermedad.
Varios aislados clínicos de p. aeruginosa , incluyendo cepas PAO1, PA103, PA14 y PAK, se han estudiado extensivamente para investigar diferentes aspectos de la patogenia de p. aeruginosa . Cepa PA14 es un aislante clínico que pertenece a uno de los grupos clónicos más común en todo el mundo19,20 y no ha sido extensivamente pasado en el laboratorio. PA14is altamente virulento en modelos de vertebrados de la infección, con una notable endotoxina perfil21, pili de la estructura22, patogenicidad de las islas23, tipo sistema de secreción III (TTSS), citotoxicidad hacia mamíferos células24 y perfiles de resistencia y persistencia antibiótico25. Además, también es altamente virulenta en numerosos sistemas de modelo huésped-patógeno PA14, incluyendo hoja de infiltración modelos26,27,elegans de Caenorhabditis infección modelos28, 29, insecto modelos30,31, así como neumonía de ratón modelos modelos de32,33 y quemaduras en la piel34.
Todo el genoma mutantes bibliotecas son colecciones de isogénicas mutantes en genes no esenciales que constituyen herramientas muy poderosas para entender la biología de un organismo permitiendo análisis de la función del gene en una escala genómica. Dos cerca de saturación transposon inserción mutante bibliotecas construidas en p. aeruginosa son actualmente disponibles para su distribución. Los sitios de inserción de los transposons han sido determinados para ambas bibliotecas. Estas bibliotecas no redundante supuestas facilitan estudios del genoma de las cepas bacterianas por disminuir considerablemente el tiempo y costo involucrados en investigación no caracterizados mutantes transposon al azar. La p. aeruginosa PAO1 transposon mutante biblioteca, construida en el MPAO1 aislar de la cepa PAO1 usando transposones esphoA/ hah eslacZy hah35, está comisariada por el laboratorio de Manoil, Universidad de Washington. La biblioteca consiste en una colección de mutantes de transposon 9.437 verificado de secuencia que ofrece una cobertura amplia de genoma e incluye a dos mutantes para la mayoría de los genes de36. Información sobre la biblioteca mutante de p. aeruginosa PAO1 transposón está disponible en la Web de laboratorio de Manoil, pública, accesible en la red, en http://www.gs.washington.edu/labs/manoil/libraryindex.htm. La p. aeruginosa cepa PA14 transposon no redundante inserción mutante biblioteca (conjunto PA14NR) construido en la cepa PA14 usando transposones MAR2xT7 y TnphoA37 actualmente es distribuido por el Departamento de Pediatría en el Hospital General de Massachusetts. El conjunto de PA14NR se compone de una colección de más de 5.800 mutantes con inserciones de transposones solo en genes no esenciales37. Detalles sobre la construcción del Set del PA14NR se describen en el sitio web público, accesible en la red http://pa14.mgh.harvard.edu/cgi-bin/pa14/home.cgi?section=NR_LIB, que también contiene una variedad de herramientas de búsqueda en línea para facilitar el uso de la PA14NR Conjunto.
El conjunto original de PA14NR compuesto por 5.459 mutantes, seleccionados a partir de una biblioteca de aproximadamente 34.000 transposon al azar inserción mutantes, que corresponden a 4.596 predijo genes PA14 representando el 77% de PA14 predijo todos los genes37. Desde la construcción de la biblioteca en el año 2006 se agregaron nuevos mutantes, y actualmente el PA14NR incluye más de 5.800 mutantes38 que representan aproximadamente 4.600 PA14 genes. La mayoría de los mutantes de transposon PA14 fueron generada en el fondo de tipo salvaje37. Detalles relativos a cada miembro de la biblioteca de mutantes, incluyendo antecedentes genéticos, están disponibles mediante una búsqueda en la base de datos en línea o descargando la hoja de cálculo de la biblioteca no redundante, ambas características en la Web de PA14 (http:// PA14.MGH.Harvard.edu/cgi-bin/PA14/Home.cgi). La mayoría de los mutantes fueron creada usando el MAR2xT7 transposon (MrT7), con un pequeño grupo creado con el TnPhoA (phoA) transposón37. Cada transposón tiene una cinta de resistencia a los antibióticos, que permite la selección de mutantes con gentamicina (MrT7) o kanamicina (phoA). El conjunto PA14NR de mutantes se almacena en placas de 96 pocillos de sesenta y tres e incluye control de 96 pozos adicionales dos placas, que consisten en de tipo salvaje PA14 inoculadas y sin inocular pozos intercalan en un patrón preestablecido. El formato de la placa de 96 pocillos junto con las herramientas de búsqueda en línea grandemente facilita el desarrollo personalizado de investigación ensayos que permiten a los usuarios a identificar genes asociados a fenotipos mutantes. Las herramientas de búsqueda en línea también facilitan la búsqueda y selección de mutantes relevantes adicionales necesarios para estudios posteriores.
La PA14 PAO1 transposon mutante bibliotecas son recursos muy importantes para la comunidad científica, y se complementan en la validación de la función de genes desconocidos y las vías de este patógeno bacteriano. Coincidentemente, desde la construcción de las bibliotecas de mutación de transposon PAO1 y PA14, completo genoma DNA que ordenaba análisis de numerosos aislamientos de p. aeruginosa ha demostrado que PAO1 y PA14 pertenecen a diferentes grandes subclados de la P. aeruginosa filogenia7,39,40,41. Debido a aislamientos clínicos de p. aeruginosa se encuentran distribuidos a lo largo de la filogenia, el hecho de que PAO1 y PA14 pertenecen a p. aeruginosa de diferentes subgrupos aumenta el valor de las dos bibliotecas de mutación de transposon de comparativo estudios.
Publicaciones que describen la construcción y proyección de las bibliotecas mutantes bacterianas incluyendo p. aeruginosa bibliotecas35,37,42, están disponibles en la literatura. Sin embargo, al mejor de nuestro conocimiento, sin protocolos publicados que describen procedimientos y técnicas que se utilizan para la replicación, mantenimiento y validación de bibliotecas mutantes bacterianas están disponibles.
La metodología que se describe en esta publicación describe un conjunto de tres protocolos que faciliten el uso y mantenimiento de la PA14NR. El primer protocolo describe la replicación de la biblioteca como se recomienda a los destinatarios de la PA14NR. El segundo protocolo incluye directrices para rayas, cultivo y almacenamiento de mutantes individuales identificados usando el conjunto de PA14NR. El tercer Protocolo describe técnicas de control de calidad, incluyendo la amplificación por PCR de fragmentos de mutantes de transposon y secuenciación posterior para confirmar identidad mutante. Este conjunto de protocolos también puede ser adaptado para la replicación y el mantenimiento de otras colecciones o bibliotecas mutantes bacterianas. La replicación bacterianas mutantes bibliotecas o colecciones se recomienda altamente para preservar la integridad de la "copia maestra" (copia original recibido). Replicación de varias copias del juego de PA14NR para uso de laboratorio de rutina reduce al mínimo la probabilidad de contaminación interwell de la copia maestra.
Protocolo
PRECAUCIÓN: Utilizar las medidas de seguridad BSL-2 estándar manejo de p. aeruginosa, un patógeno humano. Si usted es un individuo inmunocomprometido o tiene cualquier condición médica que aumenta su susceptibilidad a la infección bacteriana, tenga cuidado especial cuando se trabaja con el P. aeruginosa. Consulte con la oficina de seguridad de la biotecnología en su institución y obtener la aprobación de su médico antes de trabajar con la PA14 NR Set o bibliotecas mutantes de bacterias patógenas.

Figura 1: Resumen del Protocolo I: replicación de la PA14NR conjunto. Día 1: Replicar congeladas culturas mutantes de "copia maestra" de PA14NR en medio LB Agar y crecer a mutantes durante la noche a 37 ° C. Día 2: Traslado crecimiento mutante del medio LB Agar al profundo bien bloques que contienen caldo líquido LB, crecer durante la noche a 37 ° C con agitación a 950 rpm. Día 3: Mezclar culturas LB durante la noche con glicerol, luego transferir a placas de 96 pocillos destino para almacenamiento a largo plazo. Placas de lugar 96 pocillos en congelador de-80 ° C. Haga clic aquí para ver una versión más grande de esta figura.
Figura 2: recomienda configuración. Esterilidad y suave flujo de trabajo deben ser mantenidas mediante el uso de las precauciones apropiadas. Haga clic aquí para ver una versión más grande de esta figura.
1. Protocolo I: sistema de replicación de la PA14NR
Nota: La replicación de la biblioteca puede lograrse dividiendo el conjunto de PA14NR en cuatro subconjuntos de dieciséis placas cada que pueden procesarse en cuatro semanas consecutivas. Generación de copias de 1 a 6 se adhiere al flujo de trabajo semanal que se indica en la tabla 1, mientras que la generación de más de 6 copias sigue el flujo de trabajo semanal que se indica en la tabla 2. Para generar 12 copias del Set del PA14NR, inoculan el mismo subconjunto de PA14NR en medio LB líquido el día 2 y otra vez en 3 días (desde el mismo conjunto de placas de agar replicado en día 1) y la transferencia de noche mutantes culturas en placas copia el día 3 y día 4 respectivamente.
| Día 0 | Día 1 | Día 2 | Día 3 |
| Día de la preparación | Crecimiento de mutantes PA14NR establecer en medios de agar LB | Crecimiento de PA14NR conjunto de mutantes en medio LB líquido | Transferencia de culturas mutantes PA14NR configurar placas de destino |
Tabla 1: calendario para la replicación de 1 a 6 copias de la PA14NR. Réplica de un pequeño número de copias puede adherirse a un flujo de trabajo semanal.
| Día 0 | Día 1 | Día 2 | Día 3 | Día 4 |
| Día de la preparación | Crecimiento de mutantes PA14NR establecer en agar LB | Crecer de PA14NR conjunto de mutantes en medio LB líquido | Transferencia de culturas mutantes día 3 para generar 1 juego de 6 copias de PA14NR | Transferencia de culturas mutantes día 4 para generar 2 º conjunto de 6 copias de PA14NR |
| Crecimiento de PA14NR conjunto de mutantes en medio LB líquido |
Tabla 2: calendario de replicación de hasta 12 ejemplares de la PA14NR. Replicación de un mayor número de copias requiere capas dentro de un flujo de trabajo semanal.
- Día 1: Crecimiento de copia Master Set PA14NR en placas de agar LB
- Utilizar guantes, bata y máscara para manejar el conjunto de PA14NR.
- Claro el Banco y limpie la superficie con etanol al 70%.
- Preparar LB agar media43 y esterilizar en autoclave por medios fresco 25 minutos a 55 ° C en agua del baño y agregar o gentamicina 15 μg/mL, de mutantes que contienen inserciones de transposones MAR2xT7 o kanamicina 200 en μg/mL, para mutantes con TnphoA inserciones.
- Vierte fundido LB agar en placas rectangulares con aproximadamente 60 mL de medio por placa. Placas secas en una campana estéril durante aproximadamente 1 hora antes de usan. No Asegúrese de condensación de agua sobre la superficie del agar. Almacenar las placas a 4 ° C, si es necesario.
- Crear un campo estéril con un mechero de Bunsen en etanol-limpiar mesa y configurar contenedores con soluciones adecuadas para la esterilización de pin de replicator (ver paso 1.1.9). Uso abrir envases de plástico (5.25" L x 4.25" W x 1.75 «H tamaño aproximado) para la esterilización de pin de replicator. Envases de plástico de autoclave antes de su uso.
Nota: El calor de la llama del mechero de Bunsen crea una corriente de convección que calienta el espacio por encima de la llama y levanta cualquier partículas en el aire para arriba y lejos del aire fresco de debajo, manteniendo la zona de trabajo estéril. - Extraer un máximo de cuatro placas de maestro PA14NR establecer el congelador de-80 ° C (para evitar la descongelación innecesaria) y coloque en hielo seco en la bandeja de hielo de 4 L.
- Tomar la placa de 96 pocillos maestra para replicarse de hielo seco y colocarlo en el Banco para permitir descongelar breve, que sólo se tomará el tiempo necesario para la esterilización de los pasadores de replicator (aproximadamente 3-4 min) (ver paso 1.1.8). Marque la posición de la coordenada de A1 en la placa de agar antes de sellado. Alinee la placa principal y la placa de agar con la coordenada A1 de ambas placas en la esquina superior izquierda.
- Esterilizar el replicator "pins", siguiendo los pasos descritos a continuación. Grifo de replicator ligeramente después de cada paso para eliminar el exceso de líquido.
- Sumerja los pernos en 250 mL de 0.3-0.5% hipoclorito de sodio (blanqueador doméstico 10%) durante 30 segundos. Minimizar el contacto con solución de hipoclorito de sodio, que puede conducir al daño de pernos. Sumerja pins en ddH estéril de 250 mL2O o agua ultrapura estéril durante 10 segundos, luego en etanol al de 70% 250 mL durante 30 segundos, luego en 250 mL de etanol al 95% por 2 min.
- Llama esterilizar pernos replicator manteniendo replicator perpendicular a la llama del mechero de Bunsen, lentamente al fuego hasta que se encienda el etanol, y retirarla inmediatamente del fuego. La llama apaga una vez todos etanol quemaduras apagado. Mantenga una tapa o un recipiente similar cerca para sofocar la quema de etanol, si es necesario.
Nota: Tenga mucho cuidado cuando se trabaja con etanol cerca de una llama. NO sostenga el replicator directamente sobre la llama. - Pasadores frescos por fijación a una placa rectangular estéril contiene medios de agar LB por 30 segundos.
- Brevemente aluminio caliente placa del sello del maestro PA14NR conjunto con la mano antes de pelar apagado. Hacer esto mientras se enfría pins de replicator. Quite el sello de aluminio con cuidado para evitar el sello de retoque la placa. Utilice unas pinzas para pelar apagado cualquier restos de sello de aluminio.
- Inserte las clavijas de replicator en la placa principal, empujando suavemente y replicador de balanceo en las cuatro direcciones para asegurarse de que los pernos en contacto con cultivos bacterianos congeladas en cada uno de los 96 pozos. Prestamos especial atención a pozos localizados en el borde exterior de la placa presionando alfileres replicator contra culturas congeladas en los pozos localizados en el borde de la placa.
- Suavemente Coloque pins de replicator en la superficie de la placa de agar. Replicator se mueven en un movimiento circular ligero en forma de mini-césped de aproximadamente 4-5 mm para cada cepa mutante. Evitar la posibilidad de que los mini-jardines pueden superponerse, para evitar la contaminación cruzada.
- Sello de placa principal PA14NR Set con un nuevo sello de aluminio estéril. No tocar la parte adhesiva del sello de aluminio en cualquier momento para evitar la contaminación. Asegúrese de que cada pozo y los bordes de la placa están completamente sellados usando un rodillo de la placa. Placa de retorno 96 pocillos para hielo seco.
- Repita el procedimiento para cada placa principal.
- Limpie todas las superficies de trabajo con etanol al 70% después de haber tocado el conjunto de PA14NR.
- Transferir las placas de agar replicados a incubadora de 37 ° C e incubar durante la noche.
- Día 2: Crecimiento de la copia Master Set PA14NR en caldo líquido LB
- Preparar LB caldo líquido43 que contiene o gentamicina 15 μg/mL, para mutantes que contienen inserciones de transposones MAR2xT7 o kanamicina 200 en μg/mL, para mutantes que contienen inserciones dephoA Tn.
- Limpiar campana de flujo laminar de equipo innecesario y encender ventilador de campana durante un mínimo de 10 minutos antes de comenzar a trabajar. Limpie las superficies de la campana y cualquier elemento colocado en la campana con etanol al 70%.
- Rellenar bloques de pozo profundo de 2 mL con 525 μl de LB caldo líquido que contiene los antibióticos apropiados en campana de flujo laminar con una pipeta de 50-1200 μl 12 canales electrónicos. Luego, se transfieren bloques de pozo profundo lleno de medios de comunicación a etanol-limpiar mesa. Reutilizar consejos mientras se mantienen las condiciones de esterilidad.
- Usar guantes, bata y máscara para establecer PA14NR.
- Claro el Banco y limpie la superficie con etanol al 70%.
- Traer las placas de agar con cepas mutantes cultivadas durante la noche a la mesa.
- Crear un campo estéril con un mechero de Bunsen en etanol-limpiar mesa y configurar contenedores con soluciones adecuadas para la esterilización de pin de replicator (ver siguiente paso).
- Esterilizar el replicator "pins" siguiendo los pasos descritos a continuación. Grifo de replicator ligeramente después de cada inmersión para eliminar exceso de líquido.
- Sumerja los pernos en 250 mL de 0.3-0.5% hipoclorito de sodio durante 30 segundos. Minimizar el contacto de pin replicator con solución de hipoclorito de sodio, que puede conducir al daño de pernos. Luego, sumerja pins en ddH estéril de 250 mL2O o agua ultrapura durante 10 segundos, luego en 250 mL de etanol al 70% durante 30 segundos, entonces en 250 mL de etanol al 95% por 2 min.
- Llama esterilizar pernos replicator, entonces frescos clavijas de fijación en la placa rectangular sin usar que contiene medios de agar LB por 30 segundos.
Nota: Tenga mucho cuidado cuando se trabaja con etanol cerca de una llama (ver 1.1.8).
- Suavemente Coloque pins de replicator en placa de agar con crecimiento mutante y compruebe que los pernos están en contacto con todos los mutantes de 96 sobre placa de agar, luego sumerja pins en pozos profundos que contienen caldo líquido LB. Evite tocar los lados de los pocillos con las clavijas.
- Cierre el bloque de pozo profundo con una membrana estéril de sellado transpirable. Use un rodillo de la placa para asegurar que cada bien se sella correctamente.
- Repita el procedimiento para cada placa de agar.
- Limpie todas las superficies de trabajo con etanol al 70% después de haber tocado el conjunto de PA14NR.
- Crecen las culturas líquidas inoculadas para 15-16 h a 37° C a 950 rpm usando un agitador de alta velocidad, si está disponible.
Nota: Si un agitador de alta velocidad no está disponible, es posible incubación de bloques bien profunda en coctelera a 250-300 rpm. Sin embargo, existe una mayor posibilidad de pequeña colonia variantes (SCVs)25 emergentes en condiciones de baja oxigenación. Por lo tanto, es recomendable mantener la incubación tiempos menores de 15-16 h cuando culturas en bloques de pozos profundo a velocidades más bajas de la coctelera. Proliferación no deseada de SCVs en pozos mutantes puede alterar fenotipos mutantes cuando se utiliza la biblioteca para realizar pantallas de genéticas.
Ciertos pozos en el conjunto de PA14NR contengan a crecimiento/no-lenta mutantes, clones, de falta o sin inocular los medios de comunicación. La ubicación de estos pozos ha sido grabada y puede encontrarse en el archivo de información suplementaria a la PA14NR establecer pozos incluido en esta publicación.
- Día 3: Transferencia de culturas durante la noche PA14NR establecer en placas de destino
- Limpiar campana de flujo laminar y encender ventilador de campana durante un mínimo de 10 minutos antes de comenzar a trabajar. Limpie las superficies de la campana y cualquier elemento colocado en la campana con etanol al 70%.
- Imprimir etiquetas adhesivas impermeables (ver archivo suplementario PA14NR establecer etiquetas de plantilla). Placas de quitar 96 pocillos de plástico envuelven dentro de una campana de flujo laminar. Placa de peel-off de la etiqueta y colocarla a lo largo del borde de la placa más cercana a A1 a H1 los pocillos de la placa de destino. Levante la tapa de la placa de destino levemente y coloque la etiqueta en el borde inferior para mostrar la etiqueta cuando la placa se cubre con la tapa.
- 3.5 L de 60% de glicerol (v/v) de preparar y esterilizar 20 minutos en autoclave.
- Utilizar guantes, bata y máscara para manejar el conjunto de PA14NR. Retire los bloques profundos de agitador de alta velocidad o coctelera regular.
- Transferencia de bloques de pozo profundo para campana de flujo laminar estéril y extraiga con cuidado la membrana selladora transpirable. Reemplácelo con un sello de aluminio. Desactivación de los bloques de pozo profundo a muy baja velocidad para recoger la condensación (30 segundos a 50-150 x g, luego desacelerar quicky por tener freno centrífuga en).
- Transferencia de bloques de pozo profundo a campana estéril y utilizando una pipeta de 50-1200 μl 12 canales electrónicos y puntas estériles filtradas añadir 525 μl de mezcla de glicerol/LB caldo líquido (partes iguales LB líquido caldo y el 60% solución de glicerol) a cada pocillo. Mezclar suavemente pipetear 300 μL hacia arriba y hacia abajo 3 veces pipeta electrónica. Tocar con las puntas al lado del pozo antes de la expulsión de consejos para evitar que gotee. Consejos de expulsión y continuar con la siguiente fila hasta que esté listo con todo bloque bien profunda.
- Utilizando la pipeta repetitiva electrónica 12 canales y consejos filtradas, para evitar la contaminación interwell durante tomar, tire hacia arriba de 900 μl de cultivo mutante y dispensar 150 μL en cada placas de 96 pocillos destino para generar 6 copias de la placa de la biblioteca. Prevenir goteos por contacto con la pared de los pozos con consejos antes de comenzar la transmisión de la cultura en placas de destino. Si ninguna pipeta de repetición está disponible, utilice una pipeta multicanal para dispensar 150 μL en cada una de las seis placas de 96 pozos, utilizando la técnica descrita arriba para evitar que gotee.
- Utilice sellos de aluminio estéril para cubrir las placas y un rodillo de la placa totalmente bordes de la placa de sello y todos los pozos. Asegúrese de no cubrir el identificador de la etiqueta con el sello de aluminio. No sacuda las placas, como la cultura puede salpicar en los lados de los pocillos y sello de aluminio.
- Retire las placas de sellado de placas campana y lugar en un plano de superficie uniforme en el congelador de-80 ° C.
- Limpie todas las superficies de trabajo con etanol al 70% después de tocar la biblioteca.
- Realizar controles de calidad después de la replicación de la biblioteca y después de usar la biblioteca para realizar pantallas genéticas (ver Protocolo III).
2. Protocolo II: Manipulación y almacenamiento de mutantes individuales del conjunto PA14NR
-
Día 1: Mutante de racha de interés
- Identificar la ubicación de los mutantes de interés a través de la PA14NR establecer enlace http://pa14.mgh.harvard.edu/cgi-bin/pa14/search.cgi?searchType=SEARCH_PLATE_POSITIONS o utilizando el archivo Library.xls no redundante descargado desde el enlace http:// PA14.MGH.Harvard.edu/cgi-bin/PA14/downloads.cgi). Tome nota de los antibióticos necesarios para seleccionar a cada mutante particular (gentamicina o kanamicina).
- Preparar medios de agar LB, esterilizar en autoclave durante 20-25 minutos y enfríe a 55 ° C en baño de agua. Añadir gentamicina μg/mL 15 para mutantes que contienen inserciones de transposones MAR2xT7 y 200 de μg/mL kanamicina para mutantes que contienen inserciones de transposones TnphoA . Vierta media LB agar en placas (placas redondas o rectangulares son adecuadas). Placas secas en campana estéril de aproximadamente 30 min a 1 h antes de usan.
- Autoclave de todos los utensilios de plástico y materiales no estériles antes de su uso.
- Utilizar guantes, bata y máscara para manejar el conjunto de PA14NR. Claro el Banco y limpie la superficie con etanol al 70% antes de trabajar con el PA14NR.
- Crear un campo estéril con un mechero de Bunsen.
- Quitar PA14NR Set placa de 96 pocillos con mutantes de interés del congelador de-80 ° C colocar en hielo seco, toma el contenedor de hielo seco para el Banco y brevemente colocar placa de 96 pocillos sobre Banco para permitir leve deshielo (aproximadamente 1-2 min).
Nota: Mantenga un registro de todos PA14NR configurar placas de 96 pocillos accedido a mutantes individuales de racha, como mayor acceso a las placas de la biblioteca se correlaciona con un mayor riesgo de contaminación interwell. - Sello de aluminio calientes con la mano antes de pelar, teniendo cuidado de evitar que el sello de retoque la placa. Utilice unas pinzas para pelar apagado cualquier restos de sello de aluminio.
- Ubicar a los mutantes de interés en la placa de 96 pocillos. Utilice el palillo de madera estéril o pipeta estéril a recoger una pequeña cantidad de cultura congelada de la persona bien con los mutantes de interés.
- Congelados cultura sobre placa de agar las colonias mutantes solo como sigue de racha: suavemente se diseminan las bacterias sobre una sección de la placa para crear racha 1, utilizando un fresco, estéril madera palillo o pipeta, arrastre a través de la franja 1 y las bacterias en una segunda sección de la placa, para crear racha 2. Mediante una tercera madera del palillo o pipeta de punta estéril, arrastre a través de raya 2 y trasmitir las bacterias sobre la última sección de la placa, para crear la racha de 3.
- Sello de placa de fuente con un nuevo sello de aluminio estéril. No toque la parte adhesiva del sello de aluminio en cualquier momento para evitar la contaminación. Asegúrese de que cada pozo y los bordes de la placa están completamente sellados usando un rodillo de la placa. Placa de retorno 96 pocillos a hielo seco y luego el congelador de-80 ° C.
- Incubar la placa de agar en incubadora de 37 ° C durante la noche.
- Limpie todas las superficies de trabajo con etanol al 70% después de tocar la biblioteca.
-
Día 2: Crecimiento de mutantes de interés en caldo líquido LB
- Preparar el caldo LB líquido que contienen 15 μg/mL gentamicina o kanamicina 200 de μg/mL, según la inserción de transposones.
- Utilizar guantes, bata y mascarilla para p. aeruginosa.
- Claro el Banco y limpie la superficie con etanol al 70%. Crear un campo estéril con un mechero de Bunsen.
- Transferencia de 3 a 5 mL de LB caldo con antibiótico apropiado en tubo de cultivo estéril con tapa.
- Mediante un aplicador estéril o una pipeta estéril, tomar una sola Colonia de la cepa mutante e inocular en medio LB.
- Incubar durante una noche las culturas líquidas LB a 37 ° C en un agitador a 225-250 rpm.
- Limpie todas las superficies de trabajo con etanol al 70% después de la manipulación de p. aeruginosa.
-
Día 3: Almacenar mutante de interés en el congelador de-80 ° C
- Cryovial etiqueta con nombre mutante, antibiótico añadido al caldo LB y fecha de almacenamiento.
- Preparar 500 mL 50% glicerol (v/v) y esterilizar en autoclave.
- Utilizar guantes, bata y mascarilla para p. aeruginosa.
- Banco de claro o inundación laminar campana y limpie la superficie con etanol al 70%.
- Quitar el tubo que contiene el cultivo mutante de la coctelera.
- Preparar un recipiente con hielo seco.
- Utilice una campana de flujo laminar o crear un campo estéril en mesa de limpiar de etanol con hornilla de Bunsen.
- Añadir cantidades iguales de cultivo bacteriano y glicerol al 50% a la cryovial marcada con las condiciones de esterilidad y mezclar suavemente con pipeta (volumen final 1-2 mL/vial dependiendo del tamaño de los crioviales utilizado). Lugar cryovial en hielo seco para quick-freeze.
- Lugar cryovial en la caja etiquetada en congelador de-80 ° C.
- Limpie todas las superficies de trabajo con etanol al 70% después de manipular p. aeruginosa.
3. Protocolo III: Control de calidad de conjunto de PA14NR
- Seleccione al azar de mutantes de placas recién replicadas para detectar posibles contaminaciones interwell (pruebas de las mutantes se recomienda de 30-40).
Nota: En casos donde es necesario confirmar la identidad de un mutante se utiliza para la caracterización de un gen específico, se recomienda realizar amplificaciones de PCR usando las cartillas gene-específico diseñados para la conocida secuencia del gen que contiene la inserción de transposones. Aunque más difícil, los beneficios del uso arbitrario cebadores de la PCR en lugar de cartillas de la polimerización en cadena de gene específico cuando amplificadores ADN fragmentos de mutantes de transposones incluyen facilidad de confirmación mutante a gran escala y la capacidad de detectar la presencia de potencial contaminantes. Para fines de control de calidad, no es necesario obtener datos de la secuencia de PCR de alta calidad para todo al azar slected mutantes, como un número suficiente de mutantes es evaluado para determinar la tasa de error. - Seguir "Protocolo II" para la raya y crecer cepas mutantes.
- Autoclave de todos los utensilios de plástico y materiales no estériles antes de su uso.
- Aislar ADN genómico por método preferido. Para el análisis descrito en este trabajo, se utilizó un kit de aislamiento de DNA genómico siguiendo los protocolos del fabricante. Múltiples cepas mutantes pueden analizarse simultáneamente.
- Medir la concentración de DNA genomic usando un espectrofotómetro microvolume. Ajustar la concentración de DNA genómica a aproximadamente 100 ng/μl.
- Utilizar la DNA genomic como plantilla para ejecutar "PCR1 reacción" como se describe en el paso 1 del cuadro 3, generando Arb1 PCR fragmentos (figura 3). Imprimaciones para este paso se enumeran en la tabla 4.
- Añadir 0,5 μl de 10 x cargando buffer 5 μl de reacción PCR1, carga en un gel de agarosa al 1.5-2% y correr el gel a 80-150 V.
Nota: La longitud de un fragmento específico o un rango determinado fragmento no se espera, y más que una banda puede estar presente como el primer arbitrario puede obligar a varias ubicaciones. - Usar ADN de reacción PCR1 como plantilla para ejecutar "PCR2 reacción" como se describe en el paso 2 del cuadro 3, generando fragmentos de Arb2 PCR (figura 3). Imprimaciones para este paso se enumeran en la tabla 4.
- Añadir 0,5 μl de 10 x cargando buffer 5 μl de reacción PCR2, cargar en un gel de agarosa al 1.5-2% y correr el gel a 80-150 V.
Nota: La longitud de un fragmento específico o un rango determinado fragmento no se espera, y más que una banda puede estar presente como el primer arbitrario puede obligar a varias ubicaciones. - Enviar reacción PCR2 junto con apropiado primer transposon-específico para la secuencia.
- Analizar la secuencia byBLASTing de resultados ellos contra el genoma completo de PA14 usando el enlace de explosión proporcionados en el sitio web de la biblioteca de PA14NR (http://pa14.mgh.harvard.edu/cgi-bin/pa14/blast.cgi) o arruinándolos directamente contra la secuencia del gen específico de los mutantes de interés.
Nota: Puede encontrarse información sobre mutantes seleccionados buscando en la web PA14NR Set (buscar http://pa14.mgh.harvard.edu/cgi-bin/pa14/search.cgi?searchType=SEARCH_PLATE_POSITIONS o descarga Library.xls no redundante de archivo desde el enlace http:/ / pa14.mgh.harvard.edu/cgi-bin/pa14/downloads.cgi).
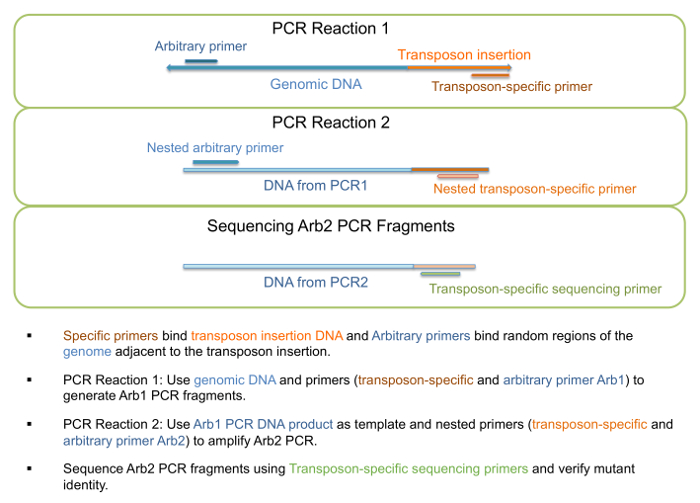
Figura 3: PCR amplificación y secuenciación de mutantes de inserción de transposones. Vista esquemática de los pasos implicados en la amplificación por PCR y secuenciación para la verificación de la identidad mutante. Haga clic aquí para ver una versión más grande de esta figura.
| Configuración de la reacción de PCR | |
| Paso 1 | Paso 2 |
| PCR1 reacción: | Reacción de PCR2 : |
| 23.25 μl de agua (grado de Biología Molecular) | 19.15 μl de agua (grado de Biología Molecular) |
| 3µL polimerasa de Taq 10 x Buffer | 5 μl 10 x Buffer Taq polimerasa |
| 0.5µL Taq polimerasa | 0,6 μl de Taq polimerasa |
| 0,625 μl 20 μm primer Arb1D (tabla 4) | 0,625 μl 20 μm primer Arb2A (tabla 4) |
| Μl de 0,625 μm 20 transposon específicos cartilla (PMFLGM. 3a de GB o Tn5Ext) (tabla 4) | Cartilla de Transposon específicos 0,625 mL 20 μm (PMFLGM. 2a de GB o Tn5Int2) (tabla 4) |
| 1 μl 10 mM dNTPs | 1 μl 10 mM dNTPs |
| 1 μl de ADN genómico, 100 ng | Reacción de PCR1 5 μl |
| Volumen de reacción final de 30 μl | Volumen de reacción final de 30 μl |
| Configuración de la reacción de PCR | |
| PCR1 Condiciones del termociclador: | PCR2 Condiciones del termociclador: |
| 95 ° C, 2 min | 95 ° C, 2 min |
| 5 ciclos de repetición: | 30 ciclos de repetición: |
| 95 ° C-30 s | 95 ° C-30 s |
| 30 ° C, 1 min | 54 ° C, 30 s |
| 72 ° C, 1 min | 72 ° C, 1,5 min |
| 30 ciclos de repetición: | 72 ° C – 10 min |
| 95 ° C-30 s | 4 ° C – Hold |
| 45 ° C, 30 s | |
| 72 ° C, 1 min | |
| 72 ° C – 10 min | |
| 4° C – Hold |
Tabla 3: condiciones de instalación y termociclador de la reacción de PCR utilizadas para PCR arbitraria. Arbitrarias reacciones de PCR se realizaron secuencialmente, y fragmentos generados durante la reacción PCR1 se utilizan como plantilla en PCR2 reacción. Configuración de Termociclador específico se utiliza para cada conjunto de reacciones.
| Primer nombre | Primer secuencia |
| MAR2xT7 cartillas de Transposon-específicas | |
| PMFLGM. GB-3a | TACAGTTTACGAACCGAACAGGC |
| PMFLGM. GB-2a | TGTCAACTGGGTTCGTGCCTTCATCCG |
| MAR2xT7 Transposon secuencia cartilla | |
| PMFLGM. GB-4a | GACCGAGATAGGGTTGAGTG |
| Cartillas dephoA específicos de transposón TN | |
| Tn5Ext | GAACGTTACCATGTTAGGAGGTC |
| Tn5Int2 | GGAGGTCACATGGAAGTCAGATCCTGG |
| TNphoA Transposon secuencia cartilla | |
| Tn5Int | CGGGAAAGGTTCCGTTCAGGACGC |
| Primers arbitrarios | |
| ARB1D | GGCCAGGCCTGCAGATGATGNNNNNNNNNNGTAT |
| ARB2A | GGCCAGGCCTGCAGATGATG |
Tabla 4: lista de los Primers utilizados en el Control de calidad Experimentos. Cebadores utilizados para la amplificación por PCR y secuenciación de mutantes de inserción de transposones para confirmar identidad mutante.
Resultados
Doce nuevas copias de la PA14NR se replicaron utilizando el Protocolo I y una evaluación de control de calidad de los ejemplares nuevos generados fue realizado usando Protocolo III.
PA14NR Set mutantes placas junto con el Control de placas, que consisten en de tipo salvaje PA14 inocularon y sin inocular pozos intercalados en un patrón preestablecido (Figura 4A), se replicaron siguiendo la metodolo...
Discusión
El P. aeruginosa PA14NR se encuentra un recurso valioso para la comunidad científica. Según el conjunto de datos marzo de 2017 de base de datos de indicadores fundamentales de la ciencia Clarivate Analytics, Liberati et al. (2006) ocupa el puesto 37, que describe la construcción del Set del PA14NR, en el 1% de las publicaciones de Microbiología. Google Scholar reporta más de 600 citas de Liberati et al. (2006) el manuscrito original a partir de agosto de 20...
Divulgaciones
Los autores no divulgan conflictos de intereses financieros. Eliana Drenkard y Frederick Ausubel participan en la creación de la biblioteca mutante PA14 transposon no redundante. Bryan Hurley y Lael Yonker actualmente de la casa y distribuyen la biblioteca mutante como parte del Departamento de Pediatría en el Hospital General de Massachusetts.
Agradecimientos
Nos gustaría agradecer a Lisa Philpotts de la Biblioteca Virtual de Treadwell de MGH para su orientación en la búsqueda de la base de datos. Este trabajo fue financiado por la Fundación de la Fibrosis Quística (YONKER16G0 y HURLEY16G0) y NIH NIAID (HBP y ADE: R01 A1095338).
Materiales
| Name | Company | Catalog Number | Comments |
| Materials for Library Replication | |||
| Sterile 96-well Tissue-culture treated, case of 50 | Corning Life Sciences | 353072 | via Fisher Scientific |
| Sterile 96 Well Clear V-Bottom 2000μL Deep Well Plates, case of 25 | Corning Life Sciences | 3960 | via Fisher Scientific |
| Nunc OmniTray (rectangular plates), case of 60 | Thermo Scientific Rochester | 242811 | via Fisher Scientific |
| Rectangular Ice Pan, Midi (4L) | Corning Life Sciences | 432104 | via Fisher Scientific |
| Secure-Gard Cone Mask, case of 300 | Cardinal Health | AT7509 | via Fisher Scientific |
| AluminaSeal, pack of 100 | Diversified Biotech | ALUM-100 | via Fisher Scientific |
| Breathe-Easy membrane, pack of 100 | Diversified Biotech | BEM-1 | via Sigma-Aldrich |
| Sterile, individually wrapped, 50mL Solution Trough/Reagent Reservoir, case of 100 | Sorenson | S50100 | via Westnet Incorporated |
| Plate roller | VWR | 60941-118 | via VWR |
| Cryo Laser Labels - CRYOLAZRTAG 2.64" x 0.277", pack of 16 sheets | GA International | RCL-11T1-WH | via Labtag.com (template for printing also available from Labtag.com) |
| 96-well replicator | V & P Scientific, Inc. | Custom 407C, 3.18mm pin diameter, 57mm long | via V & P Scientific, Inc. |
| Multitron Pro, 3mm Shaking incubator | Infors HT | l10003P | via Infors HT |
| Picus 12 Channel 50-1200μL Electronic Pipette | Sartorius | 735491PR | via Sartorius |
| Filter Tips 50-1200μL, pack of 960 | Biohit | 14-559-512 | via Fisher Scientific; use electronic multichannel-compatible tips |
| Dry Ice | User-specific vendor | ||
| Materials for Individual Mutant Storage | |||
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| Pipettes (P1000, P200, P20, P2) | Gilson | F167370 | via Gilson |
| Materials for Quality Control PCR | |||
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| NanoDrop | Thermo Scientific | ND-2000 | via ThermoFisher |
| PCR Thermocycler | |||
| Omnistrips PCR Tubes with domed lids | Thermo Scientific | AB0404 | via Fisher Scientific |
| ART Barrier low-retention pipette tips (10 uL, 100 uL, 1000 uL) | Molecular BioProducts, Inc. | Z676543 (10 uL), Z676713 (100 uL), Z676802 (1000 uL) | via Sigma-Aldrich |
| Pipettes (P1000, P200, P20, P2) | Gilson | F167370 | via Gilson |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| MasterPure DNA Purification Kit | Epicentre | MCD85201 | via Epicentre Technologies Corp |
| GeneRuler 1 kb Plus DNA Ladder, ready-to-use | Thermo Scientific | SM1333 | via ThermoFisher |
| RediLoad Loading Buffer | Invitrogen | 750026 | via ThermoFisher |
| Chemicals | |||
| Chemicals for Library and Individual Mutant Storage | |||
| Glycerol MB Grade, 1L | Sigma Aldrich | G5516 | via Sigma-Aldrich |
| LB Broth | Per 1L dH2O: 10g tryptone, 5g yeast extract, 5g NaCl, 1ml 1N NaOH (Current Protocols in Molecular Biology. Wiley, 1994.) | ||
| Tryptone | Sigma Aldrich | T7293 | via Sigma-Aldrich |
| Yeast Extract | Sigma Aldrich | Y1625 | via Sigma-Aldrich |
| Sodium Chloride | Sigma Aldrich | S7653 | via Sigma-Aldrich |
| Sodium Hydroxide | Sigma Aldrich | S8045 | via Sigma-Aldrich |
| LB agar | See preparation above, add 15g Bacto Agar | ||
| Bacto Agar | Sigma Aldrich | A5306 | via Sigma-Aldrich |
| Gentamicin sulfate, 10g | BioReagent | 1405-41-0 | via Sigma-Aldrich |
| Kanamycin sulfate | Gibco | 11815024 | via ThermoFisher |
| Ethanol, 190 proof | Decon | 04-355-221 | via Fisher Scientific |
| Chemicals for Quality Control PCR | |||
| Primers | User-preferred vendor | See primers listed in Table 3 | |
| Corning cellgro Molecular Biology Grade Water | Corning | 46000CV | via Fisher Scientific |
| Taq Polymerase Buffer | Invitrogen | 10342020 | via ThermoFisher |
| Taq DNA Polymerase, recombinant | Invitrogen | 10342020 | via ThermoFisher |
| dNTPs | Invitrogen | 10297018 | via ThermoFisher |
| Agarose | Sigma | A9539 | via Sigma-Aldrich |
Referencias
- Moradali, M. F., Ghods, S., Rehm, B. H. Pseudomonas aeruginosa lifestyle: A paradigm for adaptation, survival, and persistence. Front Cell Infect Microbiol. 7, 39 (2017).
- Bleves, S., et al. Protein secretion systems in Pseudomonas aeruginosa: A wealth of pathogenic weapons. Int J Med Microbiol. 300 (8), 534-543 (2010).
- Breidenstein, E. B., de la Fuente-Nunez, C., Hancock, R. E. Pseudomonas aeruginosa: all roads lead to resistance. Trends Microbiol. 19 (8), 419-426 (2011).
- Flynn, K. M., et al. Evolution of ecological diversity in biofilms of Pseudomonas aeruginosa by altered cyclic diguanylate signaling. J Bacteriol. 198 (19), 2608-2618 (2016).
- Hazan, R., Maura, D., Que, Y. A., Rahme, L. G. Assessing Pseudomonas aeruginosa persister/antibiotic tolerant cells. Methods Mol Biol. 1149, 699-707 (2014).
- Klockgether, J., et al. Genome diversity of Pseudomonas aeruginosa PAO1 laboratory strains. J Bacteriol. 192 (4), 1113-1121 (2010).
- Mathee, K., et al. Dynamics of Pseudomonas aeruginosa genome evolution. Proc Natl Acad Sci U S A. 105 (8), 3100-3105 (2008).
- Taylor, P. K., Yeung, A. T., Hancock, R. E. Antibiotic resistance in Pseudomonas aeruginosa biofilms: towards the development of novel anti-biofilm therapies. J Biotechnol. 191, 121-130 (2014).
- Flume, P. A., Van Devanter, D. R. State of progress in treating cystic fibrosis respiratory disease. BMC Med. 10, 88 (2012).
- . Cystic Fibrosis Foundation Patient Registry 2015 Annual Data Report Available from: https://www.cff.org/Our-Research/CF-Patient-Registry/2015-Patient-Registry-Annual-Data-Report.pdf (2016)
- Church, D., Elsayed, S., Reid, O., Winston, B., Lindsay, R. Burn wound infections. Clin Microbiol Rev. 19 (2), 403-434 (2006).
- Sadikot, R. T., Blackwell, T. S., Christman, J., Prince, A. Pathogen-host interactions in Pseudomonas aeruginosa pneumonia. Am J Respir Crit Care Med. 171 (11), 1209-1223 (2005).
- Song, Z., et al. Prosthesis infections after orthopedic joint replacement: the possible role of bacterial biofilms. Orthop Rev (Pavia). 5 (2), 65-71 (2013).
- National Nosocomial Infections Surveillance, S. National Nosocomial Infections Surveillance (NNIS) System Report, data summary from January 1992 through June 2004, issued October 2004. Am J Infect Control. 32 (8), 470-485 (2004).
- Cohen, T. S., Parker, D., Prince, A. . Pseudomonas aeruginosa Host Immune Evasion. 7, 3-23 (2014).
- Fernandes, A., Dias, M. The microbiological profiles of infected prosthetic implants with an emphasis on the organisms which form biofilms. J Clin Diagn Res. 7 (2), 219-223 (2013).
- Khosravi, A. D., Ahmadi, F., Salmanzadeh, S., Dashtbozorg, A., Montazeri, E. A. Study of Bacteria Isolated from Orthopedic Implant Infections and their Antimicrobial Susceptibility Pattern. Res J of Microbiol. 4 (4), 6 (2009).
- Roemhild, R., Barbosa, C., Beardmore, R. E., Jansen, G., Schulenburg, H. Temporal variation in antibiotic environments slows down resistance evolution in pathogenic Pseudomonas aeruginosa. Evol Appl. 8 (10), 945-955 (2015).
- Fischer, S., et al. Intraclonal genome diversity of the major Pseudomonas aeruginosa clones C and PA14. Environ Microbiol Rep. 8 (2), 227-234 (2016).
- Wiehlmann, L., et al. Population structure of Pseudomonas aeruginosa. Proc Natl Acad Sci U S A. 104 (19), 8101-8106 (2007).
- Lam, J. S., Taylor, V. L., Islam, S. T., Hao, Y., Kocincova, D. Genetic and functional diversity of Pseudomonas aeruginosa lipopolysaccharide. Front Microbiol. 2, 118 (2011).
- Choi, J. Y., et al. Identification of virulence genes in a pathogenic strain of Pseudomonas aeruginosa by representational difference analysis. J Bacteriol. 184 (4), 952-961 (2002).
- He, J., et al. The broad host range pathogen Pseudomonas aeruginosa strain PA14 carries two pathogenicity islands harboring plant and animal virulence genes. Proc Natl Acad Sci U S A. 101 (8), 2530-2535 (2004).
- Mikkelsen, H., McMullan, R., Filloux, A. The Pseudomonas aeruginosa reference strain PA14 displays increased virulence due to a mutation in ladS. PLoS One. 6 (12), e29113 (2011).
- Drenkard, E., Ausubel, F. M. Pseudomonas biofilm formation and antibiotic resistance are linked to phenotypic variation. Nature. 416 (6882), 740-743 (2002).
- Rahme, L. G., et al. Common virulence factors for bacterial pathogenicity in plants and animals. Science. 268 (5219), 1899-1902 (1995).
- Rahme, L. G., et al. Use of model plant hosts to identify Pseudomonas aeruginosa virulence factors. Proc Natl Acad Sci U S A. 94 (24), 13245-13250 (1997).
- Kirienko, N. V., Cezairliyan, B. O., Ausubel, F. M., Powell, J. R. Pseudomonas aeruginosa PA14 pathogenesis in Caenorhabditis elegans. Methods Mol Biol. 1149, 653-669 (2014).
- Mahajan-Miklos, S., Tan, M. W., Rahme, L. G., Ausubel, F. M. Molecular mechanisms of bacterial virulence elucidated using a Pseudomonas aeruginosa-Caenorhabditis elegans pathogenesis model. Cell. 96 (1), 47-56 (1999).
- Limmer, S., et al. Pseudomonas aeruginosa RhlR is required to neutralize the cellular immune response in a Drosophila melanogaster oral infection model. Proc Natl Acad Sci U S A. 108 (42), 17378-17383 (2011).
- Miyata, S., Casey, M., Frank, D. W., Ausubel, F. M., Drenkard, E. Use of the Galleria mellonella caterpillar as a model host to study the role of the type III secretion system in Pseudomonas aeruginosa pathogenesis. Infect Immun. 71 (5), 2404-2413 (2003).
- Coleman, F. T., et al. Hypersusceptibility of cystic fibrosis mice to chronic Pseudomonas aeruginosa oropharyngeal colonization and lung infection. Proc Natl Acad Sci U S A. 100 (4), 1949-1954 (2003).
- Pazos, M. A., et al. Pseudomonas aeruginosa ExoU augments neutrophil transepithelial migration. PLoS Pathog. 13 (8), e1006548 (2017).
- Maura, D., Hazan, R., Kitao, T., Ballok, A. E., Rahme, L. G. Evidence for direct control of virulence and defense gene circuits by the Pseudomonas aeruginosa quorum sensing regulator, MvfR. Sci Rep. 6, 34083 (2016).
- Jacobs, M. A., et al. Comprehensive transposon mutant library of Pseudomonas aeruginosa. Proc Natl Acad Sci U S A. 100 (24), 14339-14344 (2003).
- Held, K., Ramage, E., Jacobs, M., Gallagher, L., Manoil, C. Sequence-verified two-allele transposon mutant library for Pseudomonas aeruginosa PAO1. J Bacteriol. 194 (23), 6387-6389 (2012).
- Liberati, N. T., et al. An ordered, nonredundant library of Pseudomonas aeruginosa strain PA14 transposon insertion mutants. Proc Natl Acad Sci U S A. 103 (8), 2833-2838 (2006).
- Feinbaum, R. L., et al. Genome-wide identification of Pseudomonas aeruginosa virulence-related genes using a Caenorhabditis elegans infection model. PLoS Pathog. 8 (7), e1002813 (2012).
- Stewart, L., et al. Draft genomes of 12 host-adapted and environmental isolates of Pseudomonas aeruginosa and their positions in the core genome phylogeny. Pathog Dis. 71 (1), 20-25 (2014).
- Thrane, S. W., et al. The widespread multidrug-resistant serotype O12 Pseudomonas aeruginosa clone emerged through concomitant horizontal transfer of serotype antigen and antibiotic resistance gene clusters. MBio. 6 (5), e01396-e01315 (2015).
- van Belkum, A., et al. Phylogenetic Distribution of CRISPR-Cas Systems in Antibiotic-Resistant Pseudomonas aeruginosa. MBio. 6 (6), e01796-e01715 (2015).
- Lewenza, S., et al. Construction of a mini-Tn5-luxCDABE mutant library in Pseudomonas aeruginosa PAO1: a tool for identifying differentially regulated genes. Genome Res. 15 (4), 583-589 (2005).
- . . Current Protocols in Molecular Biology. , (1994).
- Breidenstein, E. B., Khaira, B. K., Wiegand, I., Overhage, J., Hancock, R. E. Complex ciprofloxacin resistome revealed by screening a Pseudomonas aeruginosa mutant library for altered susceptibility. Antimicrob Agents Chemother. 52 (12), 4486-4491 (2008).
- Musken, M., Di Fiore, S., Dotsch, A., Fischer, R., Haussler, S. Genetic determinants of Pseudomonas aeruginosa biofilm establishment. Microbiology. 156 (Pt 2), 431-441 (2010).
- Schurek, K. N., et al. Novel genetic determinants of low-level aminoglycoside resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother. 52 (12), 4213-4219 (2008).
- Oumeraci, T., et al. Comprehensive MALDI-TOF biotyping of the non-redundant Harvard Pseudomonas aeruginosa PA14 transposon insertion mutant library. PLoS One. 10 (2), e0117144 (2015).
- Yeung, A. T., et al. Swarming of Pseudomonas aeruginosa is controlled by a broad spectrum of transcriptional regulators, including MetR. J Bacteriol. 191 (18), 5592-5602 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados