Method Article
Preparación, purificación y uso de liposomas que contienen ácidos grasos
* Estos autores han contribuido por igual
En este artículo
Resumen
Liposomas que contienen cadena simple Anfífilos, particularmente los ácidos grasos, presentan propiedades distintas en comparación con ésos que contienen diacylphospholipids debido a las propiedades químicas únicas de Anfífilos de cadena única. Aquí describimos las técnicas para la preparación, la purificación y el uso de liposomas, formado en parte o totalidad de estos Anfífilos.
Resumen
Liposomas que contienen cadena simple Anfífilos, particularmente los ácidos grasos, presentan propiedades distintas en comparación con los que contienen diacylphospholipids debido a las propiedades químicas únicas de estos Anfífilos. En particular, liposomas de ácido graso mejoran carácter dinámico, debido a la relativamente alta solubilidad de Anfífilos de cadena simple. Del mismo modo, liposomas que contienen ácidos grasos libres son más sensibles a los cationes divalentes y sal, debido a las fuertes interacciones entre los grupos cabeza de ácido carboxílico y los iones del metal. Aquí ilustran técnicas de preparación, purificación y uso de liposomas, formado en parte o totalidad de Anfífilos de cadena única (p. ej., ácido oleico).
Introducción
Liposomas y vesículas – compartimientos limitados por membranas bicapa de lípidos anfifílicos - han encontrado uso en numerosas aplicaciones biomédicas como vehículos de entrega para los productos farmacéuticos, los modelos de las membranas celulares y para el desarrollo de sintético células. Nosotros y otros hemos empleado también liposomas como modelos de membranas de la célula primitivas en los primeros años de vida. 1 , 2 , 3 , 4 por lo general, en tales sistemas, empleamos Anfífilos de cadena simple que contiene cola de hidrocarburo de solo lípidos (p. ej., ácido oleico), estas moléculas son más simples sintetizar sin la ventaja de las enzimas proteína codificada que emplean las células modernas.
Liposomas de lípidos de cadena simple son similares a las que se formaron de diacylphospholipids (p. ej., 1-palmitoil-2-oleoil -sn- glycero-3-fosfocolina o POPC) en que el límite se compone de las membranas de bicapa. Liposomas formados de cualquier clase de lípidos puede retener una carga disuelta y pueden ser reducidas y purificadas mediante diferentes técnicas. Varias diferencias importantes derivan de las únicas características químicas de los lípidos de cadena simple. Vesículas formadas por fosfolípidos son estables en un rango de pH amplio, mientras que las vesículas de ácidos grasos sólo son estables a pH neutro a ligeramente básico (ca. 7-9), que requiere ciertas tampón de pH para la preparación de la vesícula. Mayoría de las veces, este buffer también puede contener moléculas solubles específicas para la encapsulación de la vesícula, que puede ser cualquiera de los dos materiales funcionales (por ejemplo, RNA) para reacciones bioquímicas compartimentadas o tintes fluorescentes simples (e.g., calceína ) para la caracterización de la vesícula.
La presencia de sólo una cadena de hidrocarburo solo produce una membrana que es tanto más permeable a los solutos, así como más dinámica. Además, el ácido carboxílico principal grupo presente en los resultados de los ácidos grasos en vesículas que son más sensibles a la presencia de cationes divalentes y sal (p. ej., Mg2 +). El magnesio es uno de los más importantes cationes divalentes para catalizar las reacciones bioquímicas en protocélulas estudios del origen de la vida. En los primeros años de vida, antes de la evolución de las enzimas proteína sofisticada, RNA pudo haber sido el polímero dominante, debido a su doble capacidad de autoreplicarse y de realizar catálisis. Un ejemplo representativo de un RNA que requieren magnesio relacionado reacción es no enzimático ARN copia demostró por primera vez en la década de 1960. 5 cuando los nucleótidos de RNA químicamente activados (es decir, 2-methylimidazolide nucleótidos) se unen a un complejo de primer plantilla preexistente, el grupo 3'-hidroxilo de la cartilla ataca el fosfato 5' de un monómero activada junto a desplazar el grupo (es decir, 2-Metilimidazol) dejando y formas un nuevo fosfodiéster enlace. Esta química de copiar RNA requiere una alta concentración de Mg2 +, que deba estar quelatado para que sea compatible con ácido graso protocélulas. 6 otro Mg2 +-dependiente reacción es catalizada por la ribozima de cabeza de martillo, que es tal vez el mejor caracterizado RNA catalítico. Esta ribozima, que puede ser reconstituida de dos oligonucleótidos cortos, realiza una reacción de auto-escote que es conveniente controlar mediante un cambio de gel. Como tal, se emplea con frecuencia como una ribozima modelo en estudios del origen de la vida. 7 debido a un requisito de este ribozyme de magnesio unliganded, liposomas se construyen típicamente por una mezcla de ácidos grasos y ésteres de glicerol de ácidos grasos, que son más estables al magnesio. 8 , 9 en este protocolo, se presentan técnicas que han desarrollado para la preparación, la manipulación, la caracterización de estas vesículas y demostrar la aplicación de estas vesículas como protocélulas host no enzimática RNA copia y hammerhead ribozyme catálisis.
Protocolo
1. preparación vesícula
-
Preparación de películas delgadas
- Usar jeringas tight gas para transferir cierta cantidad de lípidos como se describe en la tabla 1.1 a cloroformo en un frasco de vidrio.
- Evaporar la solución resultante con un chorro de nitrógeno o argón en la campana.
- Exponga la película fina resultante a vacío de la casa por al menos 2 h para eliminar cualquier residuo de cloroformo. Los lípidos pueden dejarse bajo vacío durante la noche en este punto.
-
Rehidratación de las vesículas
- Preparar 10 mL de tampón de hidratación 5 mM calceína 250 mM tris-HCl pH 8.0 disolver 31 mg de polvo de calceína en 2,5 mL de tampón de 1 M tris-HCl pH 8.0 y añadiendo otro 7,5 mL de agua desionizada (DI).
- Pipetear 250 μl de sobre el buffer de la hidratación en un tubo vacío y agregar 1.875 μl de 10 M NaOH para un final base de 75 mM (equivalente ½ del total de ácidos grasos). Transferir la solución a la película delgada de lípidos seco a vesículas de forma con una concentración total de lípidos de 0,15 M.
- Uso de alta velocidad (> 3000 rpm) Vortex a vórtice la mezcla resultante para 4-5 s.
- Dejar la mezcla de lípidos-buffer en un agitador rotatorio de baja velocidad (aprox. 30 rpm) a rehidratar, por lo menos durante la noche.
-
Tamaño de las vesículas (opcionales)
- Con unas pinzas, aplicar un soporte de filtro en toda la superficie interior de los puertos de la jeringa de la extrusora.
- Moje cada soporte del filtro con 250 mM tris-HCl, pH 8.
- Con unas pinzas, una pista grabada 100 nm policarbonato membrana se aplica a uno de la extrusora O-rings y soportes del filtro. Teniendo cuidado de no rasgar o perforar la membrana, empuje suavemente la membrana en la junta tórica para hacer buen contacto entre las dos superficies.
- Montar el estirador, teniendo cuidado de no para desplazar los soportes de membrana y filtro.
- Llene una jeringa de extrusora con aprox. 0.5 mL de 250 mM tris-HCl, pH 8. Inserte esta jeringa en un lado de la extrusora.
- Inserte una jeringuilla vacía en el otro lado de la extrusora.
- A mano, empuje el émbolo de la jeringa que contiene tampón lentamente (≤ 50 μl/s) y comprobar que se siente resistencia, indicando que la membrana pista-graba al agua fuerte está intacta y el lugar. Es útil para la práctica de este paso sin una membrana en el lugar con el fin de medir el nivel esperado de la resistencia.
- Retire y vacíe las dos jeringas. No es necesario limpiar las dos jeringas en esta etapa ya que contienen buffer de idéntica composición a la preparación de liposomas.
- Cargar la preparación de liposomas en una de las dos jeringas.
- Vuelva a la extrusora con la jeringa que contiene la muestra de la vesícula en el lado izquierdo y la jeringa vacía a la derecha.
- A mano, empuje el émbolo de la jeringa que contiene la muestra vesícula muy lentamente (10-25 μl/s).
- Observar cuidadosamente la jeringa en el lado derecho de la extrusora; claro búfer inicialmente entrará en el lado derecho de la extrusora (aprox. 50 μL, esto es debido al volumen muerto de la extrusora), seguido por un pequeño penacho de liposomas extruidos. Inmediatamente deja de empujar en este punto, retire la jeringa del lado derecho de la extrusora y descartar esta solución.
- Vuelva a colocar la jeringa en el lado derecho de la extrusora y saca hasta que la jeringa izquierda está vacía.
- Cambiar la orientación de la extrusora y repita el paso 13. Continuar por el número de ciclos (normalmente 7, 9 u 11); se utiliza siempre un número impar para liposomas sin extrusión no se recogen de la jeringa al principio que contiene la preparación de liposomas de reducción previa.
- Dispensar el contenido de la jeringa derecha en un tubo Eppendorf y coloque el tubo en un agitador giratorio de velocidad baja (ca. 30 rpm) de alrededor de 0,5 h suavemente.
- Proceder a la depuración de la vesícula, como se describe en la sección 2. Vesículas extruidas deben utilizar dentro de 24 h o volver a sacado antes de usarlo de vez.
2. purificación de vesícula
-
Preparación de fase móvil de purificación de vesícula
- Preparar 5 mL de tampón de 250 mM tris-HCl pH 8 hidratación añadir 1,25 mL de tampón de 1 M tris-HCl pH 8, 3,75 mL de agua desionizada a un tubo Falcon de 15 mL. Luego añadir 37.5 μl de NaOH M 10 (equivalente a ½ de base en relación con ácidos grasos unesterified) en el búfer de hidratación. Pipetee 235 μl de ácido oleico puro directamente en el tubo del halcón dando por resultado una solución de vesícula con 0,15 M de lípidos totales.
- Uso de alta velocidad (> 3000 rpm) Vortex a vórtice la mezcla para 4-5 s, luego seque una coctelera durante al menos 2 h de rotación a baja velocidad. La preparación lipídica puede dejarse toda la noche en el agitador rotativo en este punto. Filtrar la fase móvil a través de la unidad de filtro μm 0.22 de la jeringa antes de su uso para eliminar cualquier potencial agregados.
-
Purificación de vesículas en sefarosa
- Eliminar aprox. 5 mL de etanol Sepharose 4B mezcla de la botella con una pipeta. Aplicar esto a una columna de cromatografía desechables 10 mL.
- Permiten la mezcla a colocar y paso etanol hasta parte superior de la capa de resina acerca a etanol.
- Aplicar 5 mL de agua desionizada a la parte superior de la resina y dejar fluir-por lavar residuos de etanol.
- Aplicar 250 mM tris-HCl, pH 8 en porciones de 1-2 mL para la parte superior de la resina, aplicar una porción nuevo cada vez que el nivel del líquido acerca a la parte superior de la capa de resina. Repita para el 3 - 5 veces.
- La columna de la abrazadera en el soporte de la retorta, luego conecte la punta de la columna con conector de llave de paso y tubo con el colector de la fracción. Agregar otra porción de buffer flush el tubo, cierre la llave de paso cuando el nivel del líquido en la columna acerca a la parte superior de la resina.
- Aplicar las vesículas extrusionadas de sección 1 a la parte superior de la resina utilizando una pipeta de 200 μL, teniendo cuidado de aplicar la preparación de la vesícula tan uniformemente como sea posible a la resina sin tocar la pared de la cama o columna de resina.
- Abra la llave de paso para iniciar el flujo y comenzar a recoger fracciones en una placa de 96 pocillos. Fase móvil de purificación de vesícula se aplican a la parte superior de la capa de resina en 0.5-1 mL porciones como el búfer de agota, teniendo cuidado de no permitir que la capa de la resina se seque. Recoger en la caída de cinco fracciones, que recoge al menos 36 pozos (tres filas de una placa de 96 pocillos).
-
Caracterización de la fluorescencia de las fracciones de purificación
- Tomar la placa de 96 pocillos de la sección anterior y leerlo en un lector de placas (λex= 485 nm, λem= 515 nm).
- Parcela los datos resultantes de la fluorescencia como fluorescencia vs número de fracción. Las vesículas elución primero, seguido por la fracción unencapsulated (figura 1).
-
Repurification de vesículas para monitorear la salida de la vesícula
- Repita los pasos de purificación y caracterización en las secciones 2.2 y 2.3. Las vesículas que han conservado su contenido no presenta ningún pico de unencapsulated soluto (o uno muy pequeño de aprox. 5-10% de la intensidad del pico de vesícula).
3. uso de vesículas en presencia de magnesio
-
Uso de magnesio unliganded
- Preparar y purificar las vesículas como se describe en los puntos 1, 2.1 y 2.2.
- Preparar 1 mL de 50 mM MgCl2 solución de tampón de 250 mM tris-HCl pH 8.0 mediante la adición de 250 μl de tampón de 1 M tris-HCl pH 8.0 y 50 μl de MgCl de 1 M2 a 700 μl de DI agua. Vortex para mezclar bien.
- Para dar la concentración deseada de magnesio de 5 mM, 0.9 mL de vesículas purificadas y 100 μl de solución de magnesio de la mezcla y revuelva rápidamente para minimizar las interrupciones de la vesícula por la exposición transitoria de las vesículas a alta concentración local de magnesio.
Nota: Mezcla rápida de solución de magnesio es fundamental para la estabilidad de la vesícula. Si magnesio y vesículas no se mezclan rápidamente con un vórtex inmediato, algunas vesículas estarán expuestos a altas concentraciones de magnesio, dando lugar a resultados inconsistentes de muestra a muestra. - Dejar la muestra de la vesícula en un vaso por lo menos 30 minutos antes de repurification como se describe en el 2.4 para comprobar fugas del contenido. Añadir la misma concentración de magnesio en la muestra de la vesícula a la fase móvil repurification.
-
Uso de magnesio liganded
- Preparar y purificar las vesículas como se describe en los puntos 1, 2.1 y 2.2.
Nota: Utilice ½ equivalentes KOH en lugar de NaOH a deprotonate los ácidos grasos; se ha encontrado que esto produce más estables liposomas en quelato MgCl2 sistemas. - Preparar solución de citrato de potasio de 2 M y ajuste el pH a 8.0 con KOH.
- Mezcla preparada de antemano MgCl2 y potasio citrato en la proporción especificada (aprox. 1:4 para ácido oleico estable vesículas) en tampón de 250 mM tris-HCl pH 8.0.
- Añadir solución de citrato de magnesio premezclado a la muestra de la vesícula, brevemente vortex.
Nota: Siempre mezcle la solución de magnesio y ligando. No exponga nunca las vesículas a la solución de unchelated de magnesio solo. - Dejar la muestra de la vesícula en un vaso por lo menos 30 minutos antes de repurification como se describe en 2.4. Añadir la misma concentración de magnesio y citrato como en el ejemplo de vesícula a la fase móvil repurification.
- Preparar y purificar las vesículas como se describe en los puntos 1, 2.1 y 2.2.
4. no-enzimático ARN copia en vesículas
-
Preparación de monodispersa RNA encapsulado vesículas
- Preparar una película seca ácido oleico como se describe en el punto 1.1.
- Preparar el tampón de rehidratación de vesícula con cebador de RNA etiquetado fluorescente 50 μm, plantilla de RNA de 150 μm y 250 mM tris-HCl pH 8,0 conteniendo KOH ½ equivalente en relación con el ácido oleico.
- Añadir 250 μl de tampón de rehidratación a la película lipídica y siga el paso 1.2.2 y 1.2.3 hacer vesículas con concentración total de lípidos de 0,15 M.
- Para hacer unilaminar pequeña vesículas monodispersa, sigue sección 1.3 para la protuberancia de la vesícula.
-
Purificación de adición y de la vesícula de citrato de magnesio
- Mezcla preparada de antemano las acciones de magnesio y citrato y luego mezcle con la muestra de la vesícula a una concentración final del lípido de 0.1 M.
- Purificar las vesículas en sefarosa 4B tamaño exclusión columna con 250 mM tris-HCl pH 8.0, lípidos de 0,1 M y magnesio y citrato como fase móvil.
- Recoger fracciones de vesícula por la siguiente sección 2.3.
-
Reacción de extensión de la cartilla
- Prepare 200 mM 2-MeImpG (2-methylimidazolide de la 5'-monofosfato de guanosina) solución con 250 mM tris-HCl pH 8.0. (Nota: siga anterior publicado protocolo10 para síntesis de 2-MeImpG.)
- Para iniciar la reacción de extensión de la cartilla, transferencia 150 μL de solución stock 2-MeImpG a 450 μl de muestra de vesículas para alcanzar una concentración final de lípidos 75 mM y 50 mM activado monómero. Inicio el temporizador y la reacción de la muestra cayendo todo el tiempo.
- (Opcional) Para la alimentación continua monómero fresco, transferir 300 μL de solución de reacción a una cámara de un laboratorio construido liposomas de pequeño volumen dialyzer11 y poner 300 μL solución en la otra cámara de alimentación. La solución de alimentación debe contener todos los ingredientes en la misma concentración como en la solución de reacción, salvo sustitución de RNA que contienen vesículas con vesículas vacías. Cada ronda de diálisis toma 1-24 h, dependiendo del analito y de membrana utilizado.
- Para estudios cinéticos, tomar 100 μl alícuota en cada momento y repurify la alícuota a través de una columna de exclusión de tamaño de Sepharose 4B con 250 mM tris-HCl pH 8.0 como fase móvil.
- Recoger las fracciones de la vesícula en un tubo eppendorf de 1,5 mL.
- Pipetee Triton a las fracciones de vesícula a un final alrededor del 0.1% v/v.
- Añadir 0,5 mL de etanol frío al tubo e incubar a-20 ° C durante al menos 2 h.
- Centrifugar todas las muestras en 16.1 × 1000 rcf (16,1 x g) por 10 minutos y suavemente la pipeta hacia fuera los líquidos. Lavado del RNA de las pelotillas con etanol al 70% frío y centrifugar nuevamente por 5 min elimine el líquido y poner el tubo con el pellet de RNA en un bloque de calor de 80 ° C por 2 min evaporar el etanol residual. Disolver los pellets en 50 μl de 8 M Urea con tampón de carga 1xTBE.
-
Análisis de la página
- Preparar 20% gel página al mezclar 200 mL de UreaGel concentrado de 25 mL de diluyente, del sistema de UreaGel, 25 mL de tampón 10xTBE, 80 μl de TEMED y 250 mg de persulfato de amonio. Rápidamente verter la mezcla de gel entre las placas con gel (35 cm x 45 cm) e inserte el peine. Espere al menos 30 minutos hasta la polimerización completa.
- Montar la placa de gel en el soporte del gel y llenan las cajas de gel 1xTBE gel buffer de corriente. Retire el peine y lavar los pocillos con jeringa. Funcionamiento previo el gel con 60 W durante 30 minutos.
- Calentar las muestras en bloque de calor de 80 ° C por 2 min y 5 μl de cada muestra por pozo de carga.
- Active gel caja de alimentación y ajuste el gel con vatios constante a 2,5 h de 60 W.
- Desmontar la placa del gel del gel de soporte, limpie el cristal y la placa entera en gel escáner para iniciar la exploración de gel.
- Cuantificar el gel con análisis de 1D ImageQuant TL. Trazar el logaritmo natural del cociente de la cantidad de la cartilla en un momento dado a la cantidad inicial de la cartilla vs tiempo, ajuste a una línea y calcular la velocidad de reacción orden pseudo-primer (figura 2).
5. martillo uno mismo ARN escote en vesículas
- Preparación y purificación de ribozyme encapsulado en vesículas
- Preparar una película delgada de lípidos (OA: OMG = 9:1) como en la sección 1.1 con componentes como en tabla 1.2. Nota: OMG caliente a menos de 60 ° C para derretir completo antes de usar.
- Preparar el tampón de rehidratación de vesícula con 5 μm de cada filamento de ribozyme del hammerhead y 250 mM tris-HCl pH 8.0.
- Añadir 250 μl de tampón de rehidratación a la película lipídica y seguir la concentración de lípidos pasos 1.2.2 y 1.2.3 hacer vesículas con 0.15 M total.
- Para hacer unilaminar pequeña vesículas monodispersa, sigue sección 1.3 para la protuberancia de la vesícula.
- Purificar las vesículas en una columna de exclusión de tamaño de Sepharose 4B, con 250 mM tris-HCl pH 8.0, 0.15 M mezclada lípidos como fase móvil.
-
Reacción de Hammerhead ribozyme self-escote
- Preparar solución de magnesio y mezclar con las vesículas purificadas como se describe en la sección 3.1 para iniciar la reacción de uno mismo-escote.
- Para estudios cinéticos, tomar 100 μl de la mezcla en cada momento y directamente repurify esta alícuota a través de una columna de exclusión de tamaño de Sepharose 4B con 250 mM tris-HCl pH 8.0 como fase móvil. Recoger la fracción de la vesícula.
-
Análisis de la página
- Siga los pasos 4.3.6 a 4.3.8 para preparar carga muestra de RNA.
- Coloque gel de TBE Urea 15% comercialmente casted en gel caja y llene la caja de gel con gel de 1xTBE buffer de corriente.
- Calentar las muestras en bloque de calor de 80 ° C por 1 min y 5 μl de cada muestra por pozo de carga.
- Correr el gel con constante de 200 V durante alrededor de 1 hora.
- El gel de la exploración.
- Cuantificar el gel con un software de análisis, como ImageQuant TL D 1, para medir el grado de hendidura comparando la intensidad de la restante banda de RNA substrato y exfoliado RNA fragmento banda (figura 3).
6. las vesículas de ácidos grasos gigante para microscopía
-
Preparación de las vesículas de ácidos grasos gigante
- Seguir sección 1.1 y 1.3 tabla para preparar una película delgada de ácido oleico con 0,2 mol % de lípido marcado fluorescente para mejor observación de la membrana.
- Rehidratar la película lipídica con 500 μl 250 mM tris-HCl pH 8.0 para hacer los lípidos de vesícula muestra 10 mM en total. El buffer puede contener colorantes fluorescentes o moléculas de ARN si se desea. Deje la vesícula muestra cayendo durante la noche.
- Para preparar 150 mL de buffer de diálisis puro ácido graso con 10 mM lípidos totales 470 μl de ácido oleico y 150 mL de 250 mM tris-HCl pH 8,0 con NaOH equivalente ½ de mezcla.
- Sacar la muestra de la vesícula a través de una membrana de policarbonato μm 10 para eliminar grandes agregados.
- Transferir la muestra de la vesícula en cassettes de diálisis de poro grande de 1 μm, como se describió anteriormente. 12
- Coloque el cartucho de diálisis en un vaso de precipitados de 100 mL que contenga 30 mL de tampón de diálisis. Agitar el vaso suavemente en una coctelera de mesa a 80-100 rpm.
- Cambiar el buffer de diálisis cada 30 minutos por 5 veces eliminar tintes gratis o RNA y pequeñas vesículas.
- Cuidadosamente retire la muestra de la vesícula de los cassettes de diálisis con una jeringa y una transferencia a un tubo Eppendorf.
-
Observación de la microscopia
- Pipetear 10 μl de vesículas sobre un portaobjetos limpio estándar y coloque un cubreobjetos de vidrio sobre la muestra. Sello cubierta vidrio con esmalte de uñas transparente.
- Observar las vesículas con un 60 X dispersión de aceite o similar objetivo mediante microscopía confocal utilizando la fuente láser apropiada para membrana marcada con fluorescencia, RNA o tinte encapsulado (figura 4).
Resultados
Normalmente realizamos purificaciones de liposomas en columnas de exclusión de tamaño. Preparaciones típicas liposomas contienen un fluoróforo de algún tipo. Cuando liposomas son generados y extruidos, las especies que se encapsula están presentes tanto dentro como fuera de los liposomas. Purificando liposomas en una resina de exclusión de tamaño (Sepharose 4B) solutos unencapsulated son retenidos dentro de los poros de la resina, mientras que los liposomas más grandes no son y elución primero (figura 1A). Recoger fracciones y trazando fluorescencia vs número de fracción (figura 1B) típicamente produce un seguimiento máximo de dos, con las fracciones liberador de principios correspondientes a los liposomas, que son recogidos y utilizados en aplicaciones posteriores.
Examinamos con frecuencia reacciones de extensión cartilla no enzimáticas, que eran un medio probable de la replicación del RNA antes de la aparición de ribozyme y basados en proteínas Polimerasas del RNA. Estas reacciones suelen emplean una cartilla fluorescencia marcada (figura 2A), que se extiende por monómeros activados. Estas reacciones pueden ser monitoreadas por electroforesis en gel (figura 2B) y la resultante electropherograms integrado para obtener constantes de velocidad para una condición dada la reacción (figura 2).
Para demostrar que el RNA puede funcionar dentro de protocélulas, empleamos hammerhead ribozyme self-escote (Figura 3A) como una modelo RNA catalítico la reacción. Esta reacción requiere libre Mg2 + para facilitar la catálisis, y por lo tanto utilizamos las vesículas OA/OMG ya que son estables en presencia de 5 mM Mg2 +. Similar a las reacciones de extensión de la cartilla, la reacción de uno mismo-escote hammerhead ribozyme también puede ser por electroforesis en gel (figura 3B) y posteriormente analizados para obtener la constante de velocidad bajo condiciones específicas (figura 3).
Imagen de liposomas que emplean ambos fluorescencia y transmite la luz. Liposomas pueden etiquetarse lípidos fluorescentes, que dan un sello de membrana (Figura 4A), o utilizando un soluto fluorescente dentro de su lumen (Figura 4B). Luz transmitida también puede ser utilizada para observar las vesículas (que también se muestra en la Figura 4B).
| Tabla 1.1 ácido oléico puro en cloroformo | |||
| Componente | Stock | Cantidad | |
| Ácido oleico | > 99% | 11.7 ΜL | |
| Cloroformo | 1 mL | ||
| Tabla 1.2 ácido oleico y monooleato de glicerol (9:1) en cloroformo | |||
| Componente | Stock | Cantidad | |
| Ácido oleico | > 99% | 10.5 ΜL | |
| Monooleato de glicerol | > 99% | 1,4 ΜL | |
| Cloroformo | 1 mL | ||
| Tabla 1.3 ácido oleico con rodamina-PE 0.2mol% en cloroformo | |||
| Componente | Stock | Cantidad | |
| Ácido oleico | > 99% | 1.6 ΜL | |
| Rodamina-PE en cloroformo | 10 mM | 20 ΜL | |
| Cloroformo | 1 mL | ||
Tabla 1. Soluciones de cloroformo ácidos grasos.
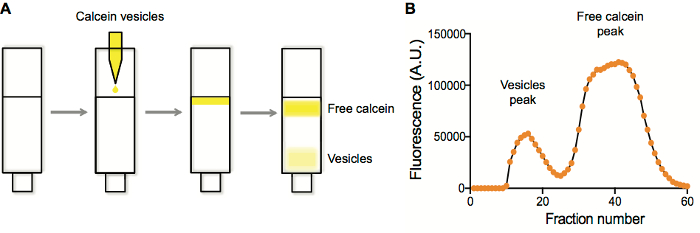
Figura 1. Caracterización de purificación y de la fluorescencia de vesícula de fracción de purificación. A. separación de las vesículas que contienen calceína de calceína gratis en una columna de sefarosa 4B. B. vesícula y detección de pico de calceína libre mediante el trazado de la fluorescencia en cada pozo vs número de bien después de la recolección de la fracción. Haga clic aquí para ver una versión más grande de esta figura.
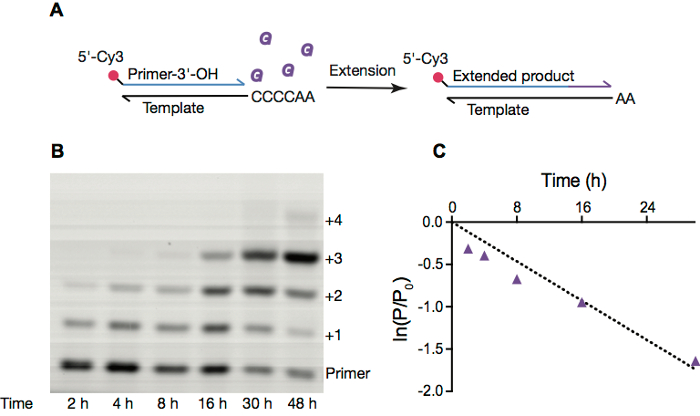
Figura 2. Replicación de RNA no-enzimático dentro de las vesículas de la OA. A. plan de extensión de la cartilla de RNA no enzimática. B. imagen de página de una reacción de primer extensión dentro de las vesículas de ácido oleico puro, con condiciones como en sección 4. C. lineal ajuste del logaritmo natural del cociente de la cantidad de primer restante en dado momento a la cantidad inicial de la cartilla vs tiempo, más de 30 h. tarifa de la reacción, calcula a partir de la pendiente del tiempo de ln (P/P0) vs, es 0,058 h-1. Haga clic aquí para ver una versión más grande de esta figura.
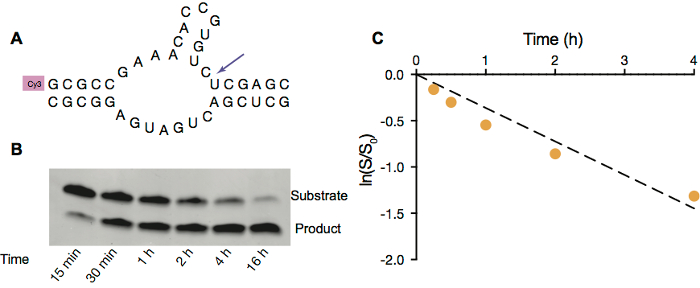
Figura 3. Escote de ribozima Hammerhead en vesículas OA/GMO. A. esquema de escote de ribozima hammerhead de filamento de sustrato fluorescente etiquetado (arriba). B. imagen de la página de escote de ribozyme del hammerhead dentro de vesículas OA/OMG con 5 mM Mg2 +. C. actividad de Ribozyme dentro de vesículas. Ajuste lineal del logaritmo natural del cociente de cantidad de substrato restante en dado momento a la cantidad inicial de sustrato vs tiempo en h. 4 primera reacción tasa, calculada a partir de la cuesta del tiempo vs ln (s/s0) es 0,36 h-1. Haga clic aquí para ver una versión más grande de esta figura.
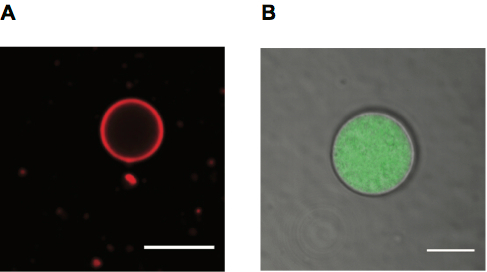
Figura 4. Vesículas de ácidos grasos gigante para microscopía. A. imagen de Microscopía Confocal de un PE de rodamina etiquetados ácido oleico vesícula, escala de la barra 10 μm. B. imagen de Microscopía Confocal de la vesícula de ácido oleico que contiene Alexa488 etiquetados RNA con membrana que se muestra en el canal de transmisión detector (TD), escala de la barra 5 μm.
Discusión
Liposomas formados de los ácidos grasos se han sugerido como posibles modelos para las células primitivas, debido a su alta permeabilidad y propiedades dinámicas. El grupo cabeza carboxílico de los ácidos grasos de cadena simple sólo permite uno mismo-Asamblea en las membranas en un rango de pH restringido, y las membranas resultantes son muy sensibles a la presencia de sales. Como resultado, las vesículas de ácidos grasos requieren diferente preparación y manejo de métodos en comparación con vesículas de fosfolípidos.
En este protocolo, aunque utiliza ácido oleico como ejemplo para la formación de liposomas, otra larga cadena de ácidos grasos no saturados (C14) y sus derivados (ca. myristoleic acid, ácido palmitoleico y los correspondientes alcoholes y ésteres de glicerol) también forman vesículas siguiendo el método de rehidratación de película delgada como la concentración total de lípidos es superior a la cmc y el pH del buffer de hidratación está cerca de lo pKa de los ácidos grasos dentro de la membrana. De tampón tris-HCl utilizado en este protocolo, se informaron otros sistemas tampón (ca. bicina, fosfato, borato) para apoyar la formación de vesículas de ácidos grasos, aunque las vesículas formadas en tampón fosfato o borato son generalmente absolutamente agujereado13. Las vesículas de ácidos grasos resultantes después de la rehidratación son polidispersas y multilamellar, pero fácilmente se convierten en vesículas de propiedades de pequeño monodispersa por extrusión como se describe. Comparado con la sonicación como método alternativo para la generación de pequeñas vesículas, extrusión proporciona más opciones para el control de tamaño de la vesícula mediante la aplicación de membranas de tamaño de poro diferentes. Las vesículas después de extrusión suelen ser ligeramente más grandes que el tamaño del poro de la membrana, pero al aumentar el número de ciclos de extrusión, se pueden obtener vesículas con una estrecha distribución de tamaño y un tamaño promedio cerca del tamaño de poro de la membrana.
Para sintetizar funcional protocélulas, las vesículas de ácidos grasos necesitan host específicos bioquímicos las reacciones derivadas de la encapsulación de RNA o de otros bloques de construcción. El método de rehidratación de película fina proporciona una manera fácil a vesículas de forma que contienen materiales encapsulados deseados. Sin embargo, la eficiencia de encapsulación es relativamente baja y una gran parte de materiales preciosos como el RNA se pierden normalmente durante el proceso de purificación. En algunos casos la eficiencia de encapsulación se puede mejorar modestamente por ciclos repetidos de congelación y descongelación antes de extrusión. Métodos de microfluidos para la preparación de alto rendimiento de liposomas de fosfolípidos permiten casi eficiencia de encapsulación del 100%, sin embargo análogos métodos aún no han sido desarrollados para las vesículas de ácidos grasos.
Cuando manejo protocélulas con quelato o libre Mg2 +, purificación después de la adición de solución de magnesio y repurification antes de cada punto del tiempo garantiza la eliminación de filtrado encapsulado material que pudiera afectar la exactitud de la velocidad de reacción mediciones dentro de vesículas. Puesto que cada purificación tiene por lo menos 10 minutos para lograr buena separación y para recoger fracciones de vesícula, es difícil el análisis de reacciones rápidas, y la reacción debe ser detenida antes de repurification de columna.
El protocolo que presentamos aquí es idóneo para la construcción de liposomas de ácido graso que reacciones imitando a aquellos que pudieran ocurrir en las células primitivas. Nuestros protocolos permiten aplicaciones potenciales en el desarrollo de sistemas biomédicos y biorreactores para otras reacciones bioquímicas.
Divulgaciones
Los autores declaran que no tienen intereses financieros que compiten.
Agradecimientos
J.W.S. es un investigador del Howard Hughes Medical Institute. Este trabajo fue financiado en parte por una subvención (290363) de la Fundación Simons a J.W.S. A.E.E. y K.P.A. reconocen apoyo de fondos de puesta en marcha de la Universidad de Minnesota.
Materiales
| Name | Company | Catalog Number | Comments |
| sephorose 4B | SIGMA-ALDRICH INC | 4B200 | |
| calcein | SIGMA-ALDRICH INC | C0875-10G | |
| tris-HCl pH8.0 1M | LIFE TECHNOLOGIES CORP | AM9851 | |
| citric acid | SIGMA-ALDRICH INC | 251275-500G | |
| sodium hydroxide | SIGMA-ALDRICH INC | 71690-250G | |
| potassium hydroxide | Sigma | 30614 | |
| oleic acid | Nu-Chek | U-46-A | |
| glycerol monooleate | Nu-Chek | M-239 | |
| Liss Rhodamine-PE | LIFE TECHNOLOGIES CORP | L1392 | |
| magnesium chloride | Fisher/Thermo Fisher Scientific | AM9530G | |
| sequagel concentrate | National Diagnostics | EC-830 | |
| sequagel DILUENT | National Diagnostics | EC-840 | |
| 15% TBE-UREA GEL | Thermo Fisher Scientific | EC68852BOX | |
| urea | Sigma Aldrich | U6504-500G | |
| titon-100x | SIGMA-ALDRICH INC | T9284-100ML | |
| RNA primer | IDT | 5'Cy3-GCG UAG ACU GAC UGG | |
| RNA template | IDT | 5'-AAC CCC CCA GUC AGU CUA CGC | |
| hammerhead substrate strand | IDT | 5'Cy3-GCG CCG AAA CAC CGU GUC UCG AGC | |
| hammerhead ribozyme strand | IDT | 5'GGC UCG ACU GAU GAG GCG CG | |
| vesicle extruder set | AVANTI POLAR LIPIDS | 610000 | |
| fraction collector | Gilson, Inc. | 171041 | |
| 96-well plates | Fisher | NC9995941/675 | |
| plate reader | Molecular Devices | SpectraMax i3 | |
| confocal microscope | Nikon | Nikon A1R MP Confocal | |
| gel scanner | GE Healthcare Life Sciences | Typhoon 9410 scanner |
Referencias
- Hanczyc, M. M., Fujikawa, S. M., Szostak, J. W. Experimental Models of Primitive Cellular Compartments: Encapsulation, Growth, and Division. Science. 302, 618-622 (2003).
- Mansy, S. S., Schrum, J. P., Krishnamurthy, M., Tobé, S., Da Treco, ., Szostak, J. W. Template-directed synthesis of a genetic polymer in a model protocell. Nature. 454 (7200), 122-125 (2008).
- Apel, C. L., Deamer, D. W., Mautner, M. N. Self-assembled vesicles of monocarboxylic acids and alcohols: conditions for stability and for the encapsulation of biopolymers. Biochim. Biophys. Acta. 1559 (1), 1-9 (2002).
- Walde, P., Wick, R., Fresta, M., Mangone, A., Luisi, P. L. Autopoietic Self-Reproduction of Fatty Acid Vesicles. J. Am. Chem. Soc. 116 (26), 11649-11654 (1994).
- Sulston, J., Lohrmann, R., Orgel, L. E., Todd Miles, H. Nonenzymatic Synthesis of Oligoadenylates on a Polyuridylic Acid Template. Proc. Natl. Acad. Sci. U. S. A. 59 (3), 726-733 (1967).
- Adamala, K., Szostak, J. W. Nonenzymatic template-directed RNA synthesis inside model protocells. Science. 342 (6162), 1098-1100 (2013).
- Uhlenbeck, O. C. A small catalytic oligoribonucleotide. Nature. 328 (6131), 596-600 (1987).
- Chen, I. A., Salehi-Ashtiani, K., Szostak, J. W. RNA catalysis in model protocell vesicles. J. Am. Chem. Soc. 127 (38), 13213-13219 (2005).
- Adamala, K. P., Engelhart, A. E., Szostak, J. W. Collaboration between primitive cell membranes and soluble catalysts. Nat. Commun. 7, 1-7 (2016).
- Joyce, G. F., Inoue, T., Orgel, L. E. RNA Template-directed Synthesis on Random Copolymers. J. Mol. Biol. 176, 279-306 (1984).
- Adamala, K., Engelhart, A. E., Kamat, N. P., Jin, L., Szostak, J. W. Construction of a liposome dialyzer for the preparation of high-value, small-volume liposome formulations. Nat. Protoc. 10 (6), 927-938 (2015).
- Zhu, T. F., Szostak, J. W. Preparation of large monodisperse vesicles. PloS one. 4 (4), e5009 (2009).
- Zhu, T. F., Budin, I., Szostak, J. W. Vesicle extrusion through polycarbonate track-etched membranes using a hand-held mini-extruder. Methods Enzym. 533, (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados