Method Article
Procedimiento de ARN Pull-down para identificar dianas de ARN de un ARN largo no codificante
En este artículo
Resumen
Este método de pull-down del RNA permite identificar los objetivos de RNA de un ARN largo no codificante (lncRNA). Basado en la hibridación de caseros, diseñadas anti-sentido oligonucleótidos sondas de ADN específicas para este lncRNA en un tejido adecuadamente fijo o línea celular, permite la captura de todos los objetivos de la lncRNA RNA eficientemente.
Resumen
Largo no codificante del RNA (lncRNA), que son secuencias de más de 200 nucleótidos sin un marco de lectura definida, pertenecen a familia del regulador no codificante del RNA. Aunque sus funciones biológicas siguen siendo en gran parte desconocidos, ha aumentado el número de estos lncRNAs y ahora se estima que los seres humanos pueden tener más de 10.000 tales transcripciones. Algunos de estos son conocidos por estar involucrados en importantes vías reguladoras de la expresión génica que ocurren a nivel transcripcional, sino también en diferentes pasos de RNA co - y maduración postranscripcional. En estos casos, RNAs que se dirigen por el lncRNA deban identificarse. Esa es la razón por qué es útil desarrollar un método que permite la identificación de RNAs asociados directamente o indirectamente con un lncRNA de interés.
Este protocolo, que fue inspirado por protocolos previamente publicados que permite el aislamiento de un lncRNA junto con sus secuencias de cromatina asociada, fue adaptado para permitir el aislamiento de ARN asociado. Se determinó que dos pasos son fundamentales para la eficacia de este protocolo. La primera es el diseño de anti-sentido DNA oligonucleotide sondas específicas capaces de hibridar a lncRNA de interés. Para ello, la estructura secundaria lncRNA fue predicha por Bioinformática y sondas de oligonucleótidos anti-sentido fueron diseñadas con una fuerte afinidad por regiones que muestran una baja probabilidad de vinculación interna de la base. El segundo paso crucial del procedimiento depende de las condiciones de fijación del tejido o células cultivadas que tienen que preservar la red entre todos los asociados moleculares. Junto con la secuencia de RNA de alto rendimiento, este protocolo de desplegable de RNA puede proporcionar el interactoma RNA toda de un lncRNA de interés.
Introducción
El objetivo general del método descrito aquí es identificar a socios moleculares de RNA de un ARN largo codifica (lncRNA). LncRNA corresponden a secuencias de más de 200 nucleótidos sin un marco de lectura definida. Algunos de ellos han demostrado estar involucrados en regulación de expresión génica a nivel transcripcional, sino también en diferentes pasos de RNA co - y maduración postranscripcional. En estos casos, los socios moleculares de la lncRNA son RNAs que se van a identificar. Sería esencial para el desarrollo de un método que permite la identificación de RNAs asociados directamente o indirectamente con un lncRNA de interés.
Previamente publicado métodos, tales como aislamiento de la cromatina por la purificación del ARN (ChIRP)1,2 y captura hibridación análisis de ARN blancos (carta)3,4, permite el descubrimiento de alto rendimiento de Las proteínas RNA-limite y sitios de unión de genomic de un lncRNA específico. En estos dos métodos, lncRNA de interés fue primero cruzado por hibridación de oligonucleótidos complementarios biotinilado y el complejo fue aislado usando granos de estreptavidina. La principal diferencia entre estas dos técnicas se relaciona con el diseño de sondas que lncRNAs. ChIRP, la estrategia inspirada por ARN, consistió en diseñar un conjunto de sondas de oligonucleótidos complementarios corto de ADN a toda la longitud de la lncRNA. Por el contrario, en la carta, los autores adaptaron un análisis de asignación de Rnasa H en lncRNAs a sitios de hibridación de la sonda.
El procedimiento propuesto aquí para diseñar el anti-sentido ADN biotinilado de oligonucleótidos utiliza sondas bioinformática modelado de lncRNA estructura secundaria5 para seleccionar las puntas de prueba con una fuerte afinidad por regiones que muestran una baja probabilidad de interna base de sincronización. Este procedimiento tiene la ventaja de ser menos costosos que los basados en piscinas de mosaico del oligonucleótido sondas de2 y menos desperdiciador de tiempo que los basados en Rnasa H sensibilidad4.
Como hay un creciente cuerpo de evidencia para la regulación postranscripcional de genes por lncRNAs6, es muy útil para desarrollar un enfoque que permite la captura de ARNs que son objeto de un lncRNA. Además, para ser utilizable para la mayoría de las aplicaciones, el enfoque se ha optimizado tanto en extractos de tejidos y células cultivadas.
Protocolo
Todos los procedimientos se realizaron estrictamente de acuerdo con la Comunidad Económica Europea para el cuidado y uso de animales de experimentación (86/609/CEE y 2010/63/UE) y bajo una licencia concedida a D. Becquet (Préfecture des Bouches-du-Rhône, autorización Nº 13-002).
1. diseño de la sonda
-
Utilizando la secuencia primaria de la lncRNA de interés, genera su estructura secundaria en el "RNAstructure Webserver"5.
Nota: En este sitio, pueden utilizarse algoritmos diferentes. Las herramientas de predicción de tres que le dan los mejores resultados para los diseños de sonda son: "Doble" (estructura de energía libre más baja), "MaxExpect" (pares de bases altamente probables) y "Probnot" (pares de bases probables incluyendo pseudoknots). Estos tres análisis pueden ser realizados y comparados. Otros servidores web, como el ARN de Viena websuite7, también pueden ser utilizados.- Seleccione las regiones que muestra una baja probabilidad de vinculación interna de la base y las puntas de prueba del oligonucleótido anti-sentido de 25 bases con una fuerte afinidad por estas regiones.
Nota: El contenido de GC de estas sondas debe compuesto por entre 40 y 60%. Utilizando una herramienta de búsqueda de alineación (Blast), asegúrese de que las sondas de oligonucleótidos anti-sentido seleccionado no reconocen secuencias de nucleótidos en otros ARN expresado en el sistema celular elegido.
- Seleccione las regiones que muestra una baja probabilidad de vinculación interna de la base y las puntas de prueba del oligonucleótido anti-sentido de 25 bases con una fuerte afinidad por estas regiones.
- Diseño también una sonda de oligonucleótidos de DNA no específico de 25 bases que muestra ni afinidad lncRNA de interés ni de otras secuencias de RNA en el genoma de interés.
- Pedir las sondas con la biotina en el extremo 3'.
Nota: Para reducir el impedimento estérico, la distancia entre oligonucleótidos y biotina debe aumentarse con un espaciador de triethyleneglycerol. Para un resultado óptimo y para ser capaces de evaluar la especificidad de los resultados del desplegable, se recomienda diseño de 3 diferentes sondas de oligonucleótidos anti-sentido y entonces comparar experimentalmente su eficacia.
2. cross-linking
-
Cultivo de células del cross-linking
- Cultura la GH4C1 sommatolactotroph pituitarias células F10 suplementado Ham con suero de caballo de 15% y 2% de suero de ternero fetal. Crecen las células hasta la confluencia de2 placas 78,5 cm. Esto corresponde aproximadamente a 1 x 107 células.
- Retire el medio de cultivo celular de una placa de cultivo confluente de GH4C1 78.5 cm2 , luego enjuague con 1 x el volumen medio de fosfato tampón salino (PBS)
- Fijar las células con una solución de paraformaldehído al 1% en PBS (10 mL para un platos de 78,5 cm2 ); Esta solución debe ser recién preparada de una solución madre de paraformaldehído al 4%. Reaccione en agitación por 10 min a temperatura ambiente (RT).
PRECAUCIÓN: Paraformaldehido (PFA) es tóxica y debe manipularse con precaución. - Apagar la acción del paraformaldehido añadiendo 1/10 volumen de glicina 1,25 M (1 mL por 10 mL de solución de paraformaldehído); agitar 5 min a TA.
- Desechar los medios de comunicación por la aspiración y enjuague dos veces (5 min) con 1 X el volumen medio de PBS.
- Añadir un volumen de PBS correspondiente a 1/10 del volumen de los medios de comunicación, recoger las células con un raspador celular y entonces transfiéralo a un tubo de centrífuga.
- Vuelta a 510 g a 4 ° C durante 5 minutos.
- Quite tanta sobrenadante como sea posible.
- Almacenar pellets indefinidamente según sea necesario a-80 ° C.
-
Cross-linking de tejido
- 5 mg de tejido de hipófisis de ratón recién obtenido en una solución de paraformaldehído al 1% diluido en PBS (aproximadamente 10 veces el volumen del tejido), agitar durante 10 min a TA.
- Apagar la acción del paraformaldehido añadiendo una solución de glicina de 1,25 M (1 mL por 10 mL de solución de paraformaldehído) y agitar 5 min a TA.
- Desechar los medios de comunicación por la aspiración y enjuague dos veces con PBS (aproximadamente 10 veces el volumen del tejido). Quite tanta sobrenadante como sea posible.
- Almacenar el tejido reticulado indefinidamente a-80 ° C.
3. la célula o tejido lisis
- Preparar el tampón de lisis (50 mM Tris-HCl de pH 7.0, 10 mM EDTA, 1% SDS, complementado con 200 U/mL de una solución de inhibidor de la Rnasa y un cóctel de proteasas inhibidores 5 μl/mL).
- Para obtener las muestras sometidas a lisis sin descongelación previa, Resuspender el pellet de células o tejidos reticulados con este tampón (aproximadamente 1 mL por 100 mg de precipitado de células o tejido). Un pellet celular Obtenido de 1 x 107 células dan lugar a una muestra sometidas a lisis que contiene aproximadamente 20 mg de proteína.
Nota: Dependiendo del tejido utilizado, debe agregarse un paso de interrupción mecánica. En este caso, es importante evitar el calentamiento de las muestras durante este paso adicional.
4. sonicación
-
Optimización de las condiciones de la sonicación
- Programa el sonicador con 2 a 5 series de 30 s ON y 30 s apagado.
- Realizar pruebas para optimizar las condiciones de la sonicación en muestras sometidas a lisis (factor de dilución 1/2 o ¼ corresponde a aproximadamente 10 o 5 mg de proteína). Diluir las muestras sometidas a lisis en el baño de agua de 4 ° C y comenzar la serie de sonicación.
- Purificar ARN con un kit de purificación de RNA o con un reactivo de aislamiento de RNA (p. ej., Trizol).
- Cargar la totalidad del ARN purificado en una electroforesis en agarosa al 1% en buffer TBE, Compruebe la longitud de fragmentos de ARN. Esta longitud debe estar comprendida entre 200 y 800 PB.
Nota: Dependiendo del tamaño del fragmento de RNA, la eficacia de las sondas de oligonucleótidos anti-sentido puede variar. Se recomienda entonces para comprobar la eficacia de las sondas en diferentes condiciones de sonicación.
-
Sonicación de las muestras sometidas a lisis
- Muestras de lugar lisada correspondiente a 20 mg de proteínas (obtenido tras el paso 3.2) en el 4 ° C baño de agua y comienzan la serie de sonicación optimizado en el paso 4.1.
- Inmediatamente después de la sonicación, centrifugar durante 5 min a 12.000 g a 4 ° C. Transferencia de sobrenadantes en tubos de centrífuga de nuevo.
Nota: Para asegurar la homogeneidad, replicadas sobrenadantes pueden ser agrupados y redistribuidos en este paso.
5. RNA Pull-down
-
Día 1 – paso de hibridación
- Añadir 2 volúmenes de tampón de hibridación (50 mM Tris-HCl pH 7.0, 750 mM NaCl, 1 mM EDTA, 1% SDS, de 15% formamida añadió espontáneamente) a sobrenadantes recogidos después del paso de sonicación. Vortex.
- 20 μl de cada muestra en un tubo de centrífuga (entradas muestras) de transferir y almacenar a-20 ° C.
- Añadir 100 pmol de sondas de oligonucleótidos biotinilados (específicos o no específicos; ver tabla 1) a cada muestra. Incubar de 4 a 6 h en agitación moderada en un tubo de los rotadores a TA.
- Añadir 50 μl de estreptavidina magnético granos complementados con 200 U/mL de una solución de inhibidor de la Rnasa y un cóctel de proteasas inhibidores 5 μl/mL.
- Incubar durante una noche en moderada agitación en el rotador de tubos a TA.
-
Día 2 – paso de aislamiento de RNA
- Utilice el soporte magnético para separar granos de lisado de células, eliminar el sobrenadante y lavar los granos con 900 μl de tampón de lavado (SDS 0,5%, SSC 2 x). Repetir 5 veces entremezclado con 5 min de agitación en el rotador a TA.
- Después del último lavado decantar una última vez y agregue 95 μl de tampón de Proteinease K (10 mM Tris-HCl pH 7.0, 100 mM NaCl, 1 mM EDTA, 0,5% SDS) y 5 μl de proteinasa K (20 mg/mL) a las muestras.
- En el hielo, descongelar las muestras de entrada (20 μL) y añadir 75 μl de tampón de Proteinease K y 5 μl de proteinasa-K (20 mg/mL).
- Incubar las muestras con proteinasa K por 45 min a 50 ° C después de 10 min a 95 ° C.
- Enfriar la muestra en hielo por 3 minutos antes de separar los granos de RNAs con el soporte magnético. Mantenga el sobrenadante y desechar los granos.
- Purificar ARN con un kit de purificación de RNA, que debe incluir un paso de la digestión de ADN. RNAs de tienda a-80 ° C.
- Realizar qPCR de transcripción inversa (RT-qPCR) usando un kit de RT seguido de qPCR utilizando iniciadores específicos (tabla 1).
- La construcción de dos bibliotecas de ADN correspondientes a las dos piscinas de RNA obtenidas con cada una de las sondas específicas de Neat1 (tabla 1). Realizar la secuencia en un sistema de secuenciación de próxima generación.
Resultados
Varios estudios recientes han demostrado que lncRNAs juegan un papel esencial en casi cada proceso biológico importante y que esta función se logra a través del control de la expresión génica que ocurren tanto en el transcripcional y postranscripcional niveles mostrando en este último caso que RNAs pueden ser el blanco de lncRNAs6.
La transcripción abundante enriquecido nucleares de lncRNA 1 (Neat1) está implicada en diversas neuropatologías como demencia frontotemporal, la esclerosis lateral amiotrófica o la epilepsia8,9,10y también es misregulated en diferentes tipos de cáncer11,12.
Este lncRNA también es conocido que el componente estructural de cuerpos nucleares específicos, los paraspeckles y que intervienen en la regulación circadiana postranscripcional de expresión de gen13. Paraspeckles que se encuentran en cada núcleo de la célula y se forman alrededor no sólo Neat1, que es necesario para su formación, pero también alrededor de varios enlace RNA proteínas (RBP)14, de hecho se sabe que son capaces de retener objetivos de RNA en el núcleo15 . La formación de paraspeckles se logra a través de la Asociación de los diferentes componentes. Esta formación fue demostrada para exhibir un patrón rítmico circadiano conducir una rítmica retención nuclear del RNA objetivos13. La retención nuclear de objetivos de RNA por paraspeckles puede ocurrir mediante el enlace a las prácticas comerciales restrictivas o directamente a través de la Asociación de RNA ARN, pero el grado de RNAs de paraspeckles tuvo que ser determinado. Para identificar el ARN dirigido directamente o indirectamente por Neat1, un protocolo de desplegable de RNA fue diseñado que permite el aislamiento y la identificación de todos los objetivos de Neat1 ARN en células cultivadas, así como en muestras de tejido (véase la figura 1 para un gráfico presentación de la técnica).
El protocolo fue aplicado también con éxito para la identificación de dianas de RNA de una lncRNA otra metástasis pulmón Adenocarcinoma transcripción 1 asociada (Malat1). Malat1 es un lncRNA altamente conservado y expresado en los puntos nucleares junto con varios RNA splicing factores. Malat1 se sabe para ser implicado en la regulación del splicing del pre-mRNA naciente varios16,17.
Las puntas de prueba del oligonucleótido inespecífico (NSO) y específicos (SO) se generaron utilizando la estrategia de diseño de la sonda descrita aquí. Esta estrategia se basa en la selección de las regiones que muestran una baja probabilidad de emparejamiento de base interna como la estructura secundaria de la lncRNA y en el diseño de sondas específicas con una fuerte afinidad por estas regiones. Como un resultado representativo de esas predicciones de bioinformática, una imagen de la estructura secundaria predicha de una secuencia de Neat1 (nucleótidos 1.480 a 2.000) junto con la posición de dos diseñados de modo que las puntas de prueba se dan en la figura 2.
Las sondas diseñadas fueron dirigidas a la rata Neat1 o Malat1 para las células GH4C1 cultivadas y ratón Neat1 de extractos de tejido hipofisario (tabla 1). Se calculó el enriquecimiento relativo en Neat1 o Malat1 de sondas no específicas y específicas en relación con las muestras de entrada. La figura 3 muestra la eficacia de las sondas específicas a Neat1 hacia abajo en la línea de GH4C1 pituitarios de la célula (Figura 3A) de rata y en ratón tejido pituitario extractos (figura 3B). Cuando se utiliza el protocolo de diseño de la sonda para generar oligonucleótidos específicos (así que) las puntas de prueba dirección a Malat1, una sonda eficiente fue obtenida mientras que el otro no era lo suficientemente eficiente y descarta (Figura 4A).
Después de un RNA desplegable procedimiento seguido por los experimentos de RT-qPCR, algunos RNAs con iniciadores específicos (tabla 1) fueron demostrados para ser asociado a Neat1 o Malat1 en extractos GH4C1. Los RNAs asociados con Neat1 en los extractos de células GH4C1 también fueron demostrados para ser asociado con Neat1 en los extractos de tejido hipofisario. De hecho, después de ARN Neat1 desplegable, Malat1 fue encontrado a Neat1 en la línea de células GH4C1 y en extractos de tejido pituitario ratón (figura 5A). Recíprocamente, Neat1 fue enriquecida significativamente después de ARN Malat1 desplegable realizado con una sonda específica en células GH4C1 (Figura 4B). Poniendo de relieve la estrecha relación entre los dos lncRNAs, estos resultados son consistentes con el potencial papel correguladores de Neat1 y Malat1 sugerido por ratones knockout de Malat1 que muestran variaciones en la expresión de ARN Neat118, 19. las transcripciones de dos principales hormonas hipofisarias, la hormona del crecimiento (Gh) (figura 5B) y prolactina (Prl) (figura 5) se enriquecieron considerablemente después de Neat1 ARN desplegable con sondas específicas en células GH4C1 y pituitaria extractos, lo que sugiere una posible regulación de las dos hormonas de Neat1. Al comparar las dos sondas específicas, parece ser que su eficacia puede variar dependiendo el destino de RNA considerado (figura 5B y figura 5). Estos resultados destacan la necesidad de diseñar varias sondas específicas con el fin de seleccionar aquellos mostrando no sólo la mejor eficiencia en el enriquecimiento de la lncRNA hacia abajo, sino también el mejor rendimiento en el enriquecimiento de sus objetivos de RNA.
El método de desplegable de RNA también seguido de secuenciación de alto rendimiento de RNA para obtener la lista completa de destinos de RNA de un lncRNA de interés13. Un análisis de RNA-seq en las células GH4C1 pituitarias después de Neat1 ARN hacia abajo con las dos sondas específicas descritas anteriormente se realizó. Cabe señalar que el control negativo utilizando un NSO también podría someterse a análisis de RNA-seq, si el nivel de ARN recuperado después de que el RNA desplegable con NSO es suficiente para permitir la construcción de bibliotecas. Esto no ocurría en la anterior experiencia13. Las bibliotecas que se generaron después de uso de sondas específicas fueron analizados utilizando mancuernas de Tophat tubería20 y sólo transcripciones con valores del fragmento por kilobase por millones de lecturas asignadas (FPKM) mayores que 1 se tomaron en cuenta. Las listas obtienen con las dos sondas específicas dirigidas a Neat1 (tabla 1) fueron cruzados para evaluar la especificidad de los resultados. 4.268 genes se encontraron asociados a paraspeckles, que representaron el 28% de las transcripciones expresados en de células GH4C113. Consistentes con los resultados obtenidos mediante análisis de qPCR (Figura 5A-C), las transcripciones de Gh, Prl y Malat1 fueron encontradas para ser asociados con Neat1. Por lo tanto el método pull-down de RNA ha demostrado ser una herramienta eficaz para explorar la interacción entre lncRNAs y sus objetivos de RNA.
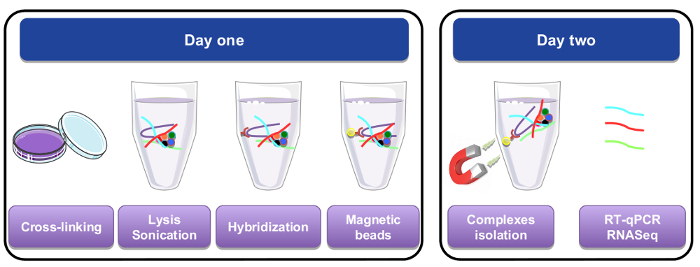
Figura 1: representación gráfica del ARN bajar procedimiento. El primer día, las células o los tejidos se reticulado con paraformaldehido, lisis y sonicados antes del paso de hibridación que se realizó mediante la adición de sondas específicas biotiniladas. Granos magnéticos estreptavidina se agregaron luego para separar material específico del resto de la célula del lisado. En el segundo día, granos fueron aislados por un imán y lavados varias veces. Un paso de reticulación permite recuperación de RNAs que fueron purificados y se usa para RT-qPCR o análisis de RNA-seq. Haga clic aquí para ver una versión más grande de esta figura.
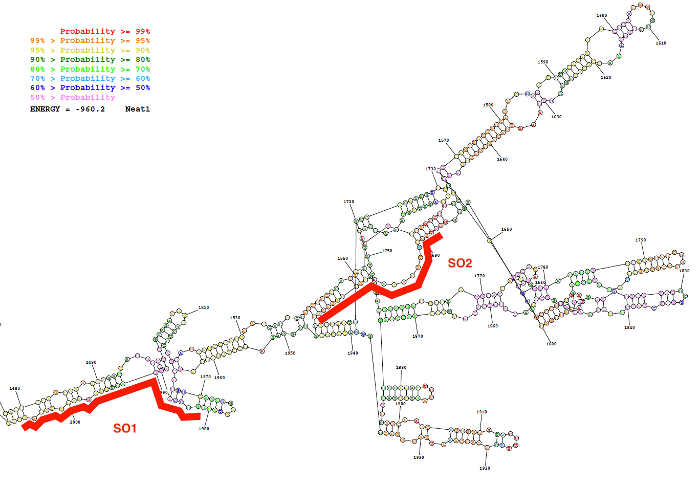
Figura 2: estructura secundaria de una secuencia Neat1 (nucleótido 1.480 a 2.000) como recurso de Bioinformática (el servidor Web de RNAstructure; estructura de energía libre más baja). La estructura es de color según el grado de probabilidad de la base que se aparea. Las dos sondas de oligonucleótidos (SO1 y SO2) en rojo se colocan a lo largo de la estructura del ARN Neat1. Haga clic aquí para ver una versión más grande de esta figura.
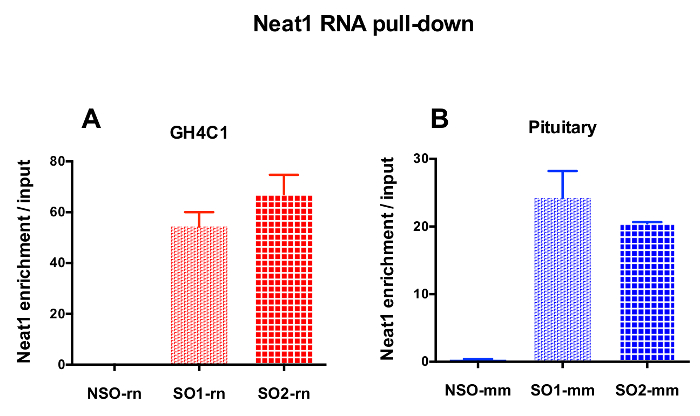
Figura 3: validación de qPCR de enriquecimiento Neat1 versus entrada. validación de qPCR de enriquecimiento Neat1 versus entrada después de ARN Neat1 tire hacia abajo por dos diferentes sondas específicas (SO1-rn y rn de SO2 para las células GH4C1 y SO1-mm y SO2-mm de tejido hipofisario) en comparación con los no específicos (NSO-rn para células GH4C1 y NSO-mm para tejido hipofisario) en las células GH4C1 rata (A) y en la hipófisis de ratón tejido extrae (B). Los resultados son media ± SEM obtenido en experimentos de 3 a 10. Haga clic aquí para ver una versión más grande de esta figura.
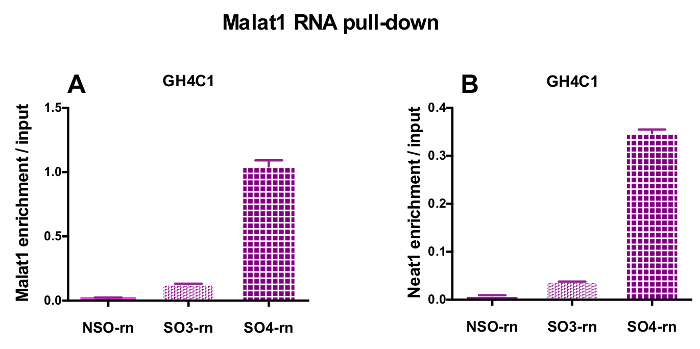
Figura 4: validación de qPCR de enriquecimiento Malat1 y Neat1 versus entrada después de ARN Malat1 tire hacia abajo. validación de la qPCR de Malat1 (A) y Neat1 (B) enriquecimiento frente entrada después de ARN Malat1 tire hacia abajo por dos diferentes sondas específicas (SO3-rn y rn SO4) en comparación con los no específicos uno (One-rn) en las células GH4C1 rata. Los resultados son media ± SEM obtenida en 3 experimentos. Haga clic aquí para ver una versión más grande de esta figura.
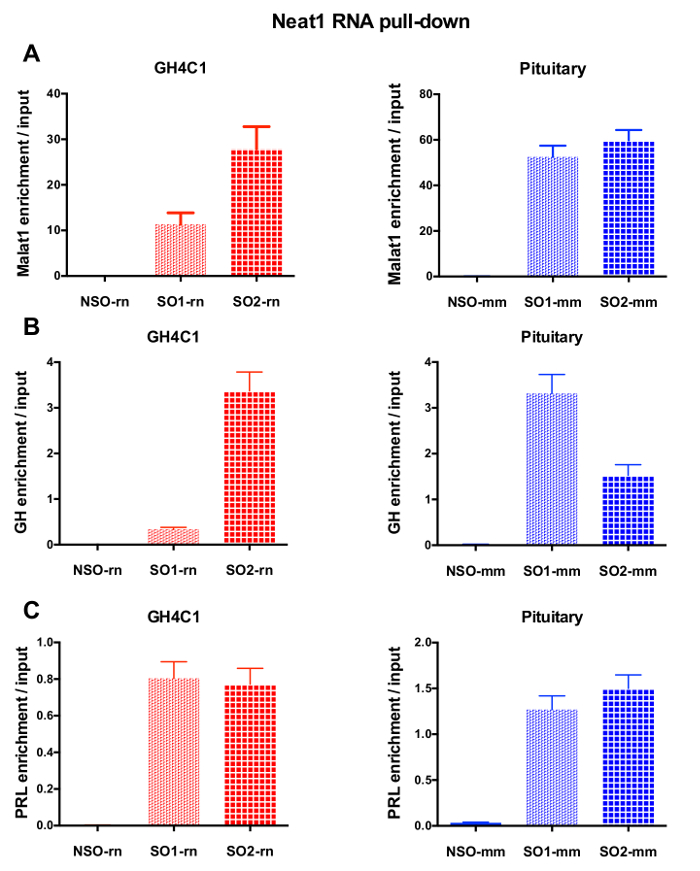
Figura 5: validación de qPCR de Malat1, Gh, Prl enriquecimiento frente entrada después de que baje la ARN Neat1. validación de la qPCR de Malat1 (A), Gh (B), Prl (C) enriquecimiento frente entrada después de ARN Neat1 tire hacia abajo usando sondas específicas diferentes en comparación con una inespecífica en las células GH4C1 rata y los extractos de tejido hipofisario de ratón. Los resultados son media ± SEM obtenido en experimentos de 3 a 8. Haga clic aquí para ver una versión más grande de esta figura.
| NOMBRES DE LA SONDA | Secuencias de | |
| NSO-Rn | TAAAATACCATTTGATGTTTGAAATTAT | |
| SO1-Rn | CTCCACCATCATCAATCCTCTGGAC | |
| SO2-Rn | GCCTTCCCACATTTAAAAACACAAC | |
| SO3-Rn | AACTCGTGGCTCAAGTGAGGTGACA | |
| SO4-Rn | AAGACTCTCAGGCTCCTGCTCATTC | |
| NSO-mm | GTTTGTGGTTTAACAGTGGGAAGGC | |
| SO1-mm | GCCTTCCCACTGTTAAACCACAAAC | |
| SO2-mm | CTCACCCGCACCCCGACTCCTTCAA | |
| qPCR cartillas: | ||
| Rattus norvegicus | ||
| Neat1 | AAGGCACGAGTTAGCCGCAAAT | |
| TGTGCACAGTCAGACCTGTCATTC | ||
| Malat1 | GAAGGCGTGTACTGCTATGCTGTT | |
| TCTCCTGAGGTGACTGTGAACCAA | ||
| Gh1 | CCGCGTCTATGAGAAACTGAAGGA | |
| GGTTTGCTTGAGGATCTGCCCAAT | ||
| PRL | TGAACCTGATCCTCAGTTTGGT | |
| AGCTGCTTGTTTTGTTCCTCAA | ||
| Mus musculus | ||
| Neat1 | TGGGCCCTGGGTCATCTTACTAGATA | |
| CACAGCTGTTCCAATGAGCGATCT | ||
| Gh1 | CTCGGACCGTGTCTATGAGAAACTGA | |
| TTTGCTTGAGGATCTGCCCAACAC | ||
| PRL | TGAACCTGATCCTCAGTTTGGT | |
| AGCTGCTTGTTTTGTTCCTCAA | ||
Tabla 1: Secuencias de sondas de oligonucleótidos de DNA y las cartillas de qPCR
Discusión
Larga noncoding RNAs (lncRNAs) por su número y diversidad representan un gran campo de la investigación y la mayoría de sus papeles son todavía por descubrir. Muchos de estos lncRNAs tienen una localización nuclear y entre ellos, algunos están implicados en las vías de regulación de la expresión génica a través de mecanismos transcripcionales o postranscripcional. Uno de los retos actuales en este campo es entender la importancia de los lncRNAs en el procesamiento postranscripcional del ARN. Para ello, RNAs destinados lncRNAs tienen que identificarse. Inspirado por los estudios anteriores que se centró en la Asociación de lncRNAs con cromatina, hemos desarrollado un procedimiento que permite la identificación de los RNAs asociados con un lncRNA. El éxito de este protocolo, llamado RNA desplegable, depende principalmente de dos pasos cruciales, a saber, el diseño de anti-sentido, sondas de oligonucleótidos de ADN que tienen que hibridar específicamente y exclusivamente con el lncRNA de interés y las condiciones del tejido o fijación de la célula que tienen que preservar la integridad de la red entre todos los asociados moleculares.
Han publicado protocolos proporcionados procedimientos para aislar un lncRNA junto con sus secuencias de cromatina asociada (ChIRP1,2,3,tabla4). En los protocolos, se emplearon diferentes estrategias al diseño de que los oligonucleótidos de anti-sentido ADN biotinilado sondas. En el procedimiento de ChIRP, los autores utilizaron un conjunto de sondas de oligonucleótidos de ADN biotinilado abarcando toda la longitud de la lncRNA de interés después de la exclusión de todas las sondas redundante y no específica1,2. En el protocolo de la carta, los autores identificaron las regiones de la lncRNA que son más accesibles para la hibridación y había diseñado captura oligonucleótidos dirigidos a estas regiones. Estas regiones fueron seleccionadas por su sensibilidad de Rnasa H. De hecho, utilizando la propiedad de la Rnasa H para hidrolizar RNAs en los sitios de unión de ARN-ADN, los oligonucleótidos que hibridan a sitios accesibles de la lncRNA producen híbridos ARN-ADN y llevan a la ruptura enzimática de la lncRNA. Los autores tres de estos oligonucleótidos de captura del candidato seleccionaron y utilizaban en un coctel3,4.
El procedimiento se utilizó para diseñar las sondas de oligonucleótidos anti-sentido ADN biotinilado estaba cerca que utiliza en el protocolo de la carta, pero las regiones disponibles hibridación de lncRNA deseado no fueron seleccionadas en base a su sensibilidad de la Rnasa H, pero de acuerdo a su baja probabilidad de base que se aparea interna determinada por bioinformática modelado de la estructura secundaria lncRNA. Debe ser notado que diferentes estructuras secundarias se puede predecir utilizando diferentes algoritmos y sondas a elegir deben ser aquellos que hibridan a secuencias disponibles de lncRNA en el mayor número de estructuras secundarias predicha. Los mismos resultados se obtuvieron utilizando un cóctel de tres diseñado, sondas específicas o una sola punta de prueba individualmente. Esto incitó el uso de dos sondas separadas, específicos y la consideración de los resultados positivos como aquellos que son comunes a estas dos sondas. Por último, por lo tanto se recomienda al principio del desarrollo del método, para un resultado óptimo y ser capaces de evaluar la especificidad de los resultados de pull-down para el diseño de 3 diferentes oligonucleótidos anti-sentido gratis sondas y luego comparar experimentalmente su eficacia, especialmente desde que la eficiencia de la sonda puede ser alterado por la preparación de lisado de células. Sin embargo, el procedimiento de diseño de la sonda basada en Bioinformática modelado de lncRNA secundaria estructura que hemos utilizado seguía siendo menos costosa que en piscinas de mosaico de sondas de oligonucleótidos2base, y ésta era menos desperdiciador de tiempo que el método basado en Rnasa H sensibilidad4.
Un control negativo debe realizarse también utilizando como sondas de oligonucleótidos de captura negativa ya sea el sentido ADN biotinilado de oligonucleótidos o revueltos sondas de oligonucleótidos u oligonucleótidos dirigidos contra un RNA sin relación. Debido a la existencia de lncRNAs natural transcritos antisentido, uso de sondas de oligonucleótidos de sentido a veces puede ser insuficiente. Independientemente de la sonda de oligonucleótidos seleccionada para el control negativo, es necesario comprobar por la explosión que no hibridan con un RNA conocido y tenga en cuenta que este oligonucleótido puede hibridar a un lncRNA aún no anotado.
Los lysates de la célula utilizados en estos experimentos de desplegable de RNA se obtuvieron 106 107 células cuando se trabaja con células cultivadas y de 1 a 10 mg cuando se trabaja con el tejido. La preparación de lysates de la célula debe ser adaptado según el tipo de tejido o células con dos pasos principales que tienen que ser optimizados: a saber, el paso Cross-linking que permite la formación de enlaces covalentes entre el lncRNA y sus asociados moleculares y la paso de sonicación que reduce la viscosidad por trituración de cromatina.
El objetivo del cross-linking paso es para asegurarse de que todos los objetivos de RNA permanecen cerrados a la lncRNA induciendo la formación de una red entre todos los asociados moleculares. Un paso de tratamiento de paraformaldehido que forma enlaces covalentes entre el lncRNA y sus socios permite que la red sea reticulado. En el protocolo de la carta, se sugirió si en conjunto trabajando con lncRNA nuclear, para realizar un primer tratamiento con paraformaldehido celular lisado y un segundo tratamiento en la fracción nucleicos aislados3,4. Observamos que este paso suplementario redujo la eficacia de las sondas, probablemente reduciendo la accesibilidad lncRNA en las células. Por lo tanto, el grado de reticulación por paraformaldehído tiene que ser adaptado teniendo en cuenta la célula o tipo de tejido utilizado, la localización de la lncRNA de interés y la eficacia de las sondas diseñadas.
Lisis de las células, la cromatina se libera en el lisado y aumenta su viscosidad; es entonces necesario para purgar la cromatina por sonicación para aumentar la fluidez de las muestras y por lo tanto, facilitar la accesibilidad de los oligonucleótidos sondas a lncRNA de interés. Sin embargo, sonicación también destruir el ARN extraído con el lncRNA de interés. Es importante minimizar el tiempo de sonicación de tal manera que mientras que eficientemente reduce la viscosidad del lisado, también permite que la obtención de RNA fragmentos con una longitud comprendida entre 200-800 BP tenga en cuenta que el tiempo de sonicación será altamente depende de la cantidad y el tipo de tejido o células cultivadas.
En conclusión, el procedimiento aquí descrito permite en 2-3 días la captura de los objetivos de RNA de una lncRNA deseada. Junto con RT-qPCR, estos métodos le permitirá buscando una asociación específica y regulación de un mRNA por el deseado lncRNA como candidato. Un enfoque de todo el genoma, experimentos de desplegable de RNA pueden ser analizados por secuenciación RNA de alto rendimiento que permite la recuperación de los RNAs asociados con la deseada lncRNA. Sea cual sea la estrategia analítica elegida, el procedimiento de desplegable de RNA debe proporcionar nuevos conocimientos significativos sobre regulación de RNA por lncRNAs.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Universidad de Aix-Marsella y CNRS y financiado por una donación de laboratorios Pfizer.
Materiales
| Name | Company | Catalog Number | Comments |
| Bioruptor Plus | Diagenode | B01020001 | Sonicator |
| Dynabeads My One | Thermo-Fisher | 65001 | Magnetic streptavidin beads |
| Formamide | Thermo-Fisher | 15515-026 | |
| Gel electrophoresis apparatus | Advance | Mupid-One | Gel electrophoresis apparatus |
| Proteinase K | Sigma | P2308 | |
| RNA XS purification kit | Macherey-Nagel | 740902 | RNA purificationkit |
| RNAseOUT | Thermo-Fisher | 10777-019 | RNAse inhibitor |
| Trizol | Thermo-Fisher | 15596018 | RNA purification |
| Tube Rotator | Stuart | SB2 | Eppendorf tube rotator |
| RNA to DNA | Thermo-Fisher | 4387405 | Reverse transcription kit |
| iTaq Universal SYBR Green Supermix | BioRad | 1725124 | qPCR reagent |
| Applied 7500 Fast | Thermo-Fisher | 4351107 | qPCR apparatus |
| Illumina TruSeq Stranded mRNA Sample Preparation kit | Illumina | 20020594 | DNA library construction kit |
| Illumina NextSeq 500 | Illumina | SY-415-1002 | NGS system |
Referencias
- Chu, C., Qu, K., Zhong, F. L., Artandi, S. E., Chang, H. Y. Genomic maps of long noncoding RNA occupancy reveal principles of RNA-chromatin interactions. Mol Cell. , 667-678 (2011).
- Chu, C., Quinn, J., Chang, H. Y. Chromatin isolation by RNA purification (ChIRP). J Vis Exp. , e3912(2012).
- Simon, M. D., Wang, C. I., Kharchenko, P. V., West, J. A., Chapman, B. A., Alekseyenko, A. A., Borowsky, M. L., Kuroda, M. I., Kingston, R. E. The genomic binding sites of a noncoding RNA. Proc Natl Acad Sci U S A. , 20497-20502 (2011).
- Simon, M. D. Capture hybridization analysis of RNA targets (CHART). Curr Protoc Mol Biol. , Unit 21.25 (2013).
- Reuter, J. S., Mathews, D. H. RNAstructure: software for RNA secondary structure prediction and analysis. BMC Bioinformatics. 11, 129(2010).
- Sun, X., Haider Ali, M. S. S., Moran, M. The role of interactions of long non-coding RNAs and heterogeneous nuclear ribonucleoproteins in regulating cellular functions. Biochem J. , 2925-2935 (2017).
- Gruber, A. R., Lorenz, R., Bernhart, S. H., Neuböck, R., Hofacker, I. L. The Vienna RNA websuite. Nucleic Acids Res. , W70-W74 (2008).
- Tollervey, J. R., Curk, T., Rogelj, B., Briese, M., Cereda, M., Kayikci, M., König, J., Hortobágyi, T., Nishimura, A. L., Zupunski, V., Patani, R., Chandran, S., Rot, G., Zupan, B., Shaw, C. E., Ule, J. Characterizing the RNA targets and position-dependent splicing regulation by TDP-43. Nat Neurosci. , 452-458 (2011).
- Riva, P., Ratti, A., Venturin, M. The long non-coding RNAs in neurodegenerative diseases: novel mechanisms of pathogenesis. Curr Alzheimer Res. (27338628), (2016).
- Barry, G., Briggs, J. A., Hwang, D. W., Nayler, S. P., Fortuna, P. R., Jonkhout, N., Dachet, F., Maag, J. L., Mestdagh, P., Singh, E. M., Avesson, L., Kaczorowski, D. C., Ozturk, E., Jones, N. C., Vetter, I., Arriola-Martinez, L., Hu, J., Franco, G. R., Warn, V. M., Gong, A., Dinger, M. E., Rigo, F., Lipovich, L., Morris, M. J., O'Brien, T. J., Lee, D. S., Loeb, J. A., Blackshaw, S., Mattick, J. S., Wolvetang, E. J. The long non-coding RNA NEAT1 is responsive to neuronal activity and is associated with hyperexcitability states. Sci Rep. , 40127(2017).
- Adriaens, C., Standaert, L., Barra, J., Latil, M., Verfaillie, A., Kalev, P., Boeckx, B., Wijnhoven, P. W., Radaelli, E., Vermi, W., Leucci, E., Lapouge, G., Beck, B., van den Oord, J., Nakagawa, S., Hirose, T., Sablina, A. A., Lambrechts, D., Aerts, S., Blanpain, C., Marine, J. C. p53 induces formation of NEAT1 lncRNA-containing paraspeckles that modulate replication stress response and chemosensitivity. Nat Med. , (2016).
- Fang, J., Qiao, F., Tu, J., Xu, J., Ding, F., Liu, Y., Akuo, B. A., Hu, J., Shao, S. High expression of long non-coding RNA NEAT1 indicates poor prognosis of human cancer. Oncotarget. , (2017).
- Torres, M., Becquet, D., Blanchard, M. P., Guillen, S., Boyer, B., Moreno, M., Franc, J. L., François-Bellan, A. M. Circadian RNA expression elicited by 3'-UTR IRAlu-paraspeckle associated elements. Elife. , (2016).
- Fox, A. H., Lamond, A. I. Paraspeckles. Cold Spring Harbor Perspectives in Biology. , Available from: http://cshperspectives.cshlp.org/content/2/7/a000687.long (2010).
- Chen, L. L., DeCerbo, J. N., Carmichael, G. G. Alu element-mediated gene silencing. EMBO J. , 1694-1705 (2008).
- Tripathi, V., Ellis, J. D., Shen, Z., Song, D. Y., Pan, Q., Watt, A. T., Freier, S. M., Bennett, C. F., Sharma, A., Bubulya, P. A., Blencowe, B. J., Prasanth, S. G., Prasanth, K. V. The nuclear-retained noncoding RNA MALAT1 regulates alternative splicing by modulating SR splicing factor phosphorylation. Mol Cell. , 925-938 (2010).
- Engreitz, J. M., Sirokman, K., McDonel, P., Shishkin, A. A., Surka, C., Russell, P., Grossman, S. R., Chow, A. Y., Guttman, M., Lander, E. S. RNA-RNA Interactions Enable Specific Targeting of Noncoding RNAs to Nascent Pre-mRNAs and Chromatin Sites. Cell. , 188-199 (2014).
- Nakagawa, S., Ip, J. Y., Shioi, G., Tripathi, V., Zong, X., Hirose, T., Prasanth, K. V. Malat1 is not an essential component of nuclear speckles in mice. RNA. , (2012).
- Zhang, B., Arun, G., Mao, Y. S., Lazar, Z., Hung, G., Bhattacharjee, G., Xiao, X., Booth, C. J., Wu, J., Zhang, C., Spector, D. L. The lncRNA Malat1 is dispensable for mouse development but its transcription plays a cis-regulatory role in the adult. Cell Rep. , 111-123 (2012).
- Trapnell, C., Roberts, A., Goff, L., Pertea, G., Kim, D., Kelley, D. R., Pimentel, H., Salzberg, S. L., Rinn, J. L., Pachter, L. Differential gene and transcript expression analysis of RNA-seq experiments with TopHat and Cufflinks. Nat Protoc. , 562-578 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados