Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cuantificación espacial de fármacos en lesiones de Tuberculosis pulmonar por Laser Capture Microdissection líquido cromatografía espectrometría de masas (LCM-LC/MS)
En este artículo
Resumen
Aquí, describimos un protocolo usando el microdissection de la captura del laser juntada con el análisis por LC/MS para cuantificar espacialmente la distribución de drogas dentro de granulomas de la tuberculosis pulmonar. El enfoque tiene amplia aplicabilidad para cuantificar concentraciones de medicamentos en los tejidos de alto detalle espacial.
Resumen
La tuberculosis sigue siendo una causa importante de morbilidad y mortalidad en todo el mundo. Mejoras en los regímenes de fármacos existentes y el desarrollo de nuevas terapias son urgentemente necesarios. La capacidad de los medicamentos dosificados para alcanzar y para esterilizar bacterias dentro de regiones necróticas poco vascularizado (caseum) de granulomas pulmonares es crucial para la intervención terapéutica exitosa. Regímenes terapéuticos eficaces deben contener fármacos con propiedades de penetración de caseum favorable. Los métodos actuales de LC/MS para cuantificar los niveles de fármaco en tejidos biológicos tienen una limitada capacidad de resolución espacial, lo que dificulta determinar con exactitud las concentraciones de la droga absoluta dentro de los compartimientos pequeños de tejido como las que se encuentran dentro de granulomas necróticos. Aquí presentamos un protocolo con microdissection de la captura del laser (LCM) de regiones de tejido patológico distinto de cuantificación LC/MS. Esta técnica proporciona la cuantificación absoluta de drogas dentro de granuloma caseum, que rodea la lesión celular y tejido pulmonar y, por lo tanto, determina con exactitud si se están alcanzando concentraciones bactericidas. Además de la investigación de la tuberculosis, la técnica tiene muchas aplicaciones potenciales para cuantificar espacialmente resueltos de fármacos en los tejidos enfermos.
Introducción
La capacidad de resolver espacial y cuantificar niveles de drogas es un requisito crucial para determinar si los medicamentos contra la tuberculosis llegar a subpoblaciones bacterianas dentro de las lesiones pulmonares en concentraciones1de esterilización. De especial importancia es determinar penetración de drogas en la base necrótica de la lesión (llamada caseum), que normalmente contiene el mayor número de bacilos y puede acceso a los medicamentos debido a la ausencia de vascularización.
Los métodos tradicionales para evaluar la penetración de la lesión, que implican la homogeneización de las lesiones pulmonares suprimidas seguido de extracción por solvente y análisis de cromatografía líquida espectrometría de masas (LC/MS), son altamente sensibles y selectivos para las drogas de interés. Sin embargo, estos métodos ofrecen poca información espacial, limitado al tamaño del tejido homogeneizado original. Métodos de imagen basados en espectrometría de masa, como desorción del láser asistida por matriz (MALDI) de ionización2,3, desorción electrospray ionización (DESI)4 o extracción superficial mejorada de líquido5, 6 ofrecen capacidades de proyección de imagen altamente espacialmente resuelto, pero cuantificación directa puede ser extremadamente difícil o imposible debido a los efectos de supresión de iones heterogéneos y diferentes eficiencias de extracción del analito de la célula diferentes o7tipos de tejido. Además, más directa tejido MS imagen enfoques son inherentemente menos sensibles que la LC/MS debido a la falta de separación cromatográfica de especies endógenas que compiten por la ionización y la baja eficiencia de extracción por solvente de la droga del tejido.
Microdissection de la captura del laser (LCM) combinado con el análisis por LC/MS ha sido aplicada sistemáticamente para aislar y caracterizar regiones de distintos tejidos para estudios de proteómica8,9 y recientemente utilizados para la cuantificación de la droga en dosis tejidos animales10. Aquí presentamos un protocolo optimizado aplicando LCM combinado con el análisis por LC/MS (LCM-LC/MS) para cuantificar drogas anti-TB en compartimentos distintos granuloma. En el proceso de microdisección de captura láser, un láser UV se centra a través del objetivo de microscopio en la sección de tejido, que corta y aísla la zona de tejido deseada siguiendo una ruta definida por el usuario. Para LCM asistida por gravedad (la técnica utilizada para esta investigación), la sección del tejido se monta en una diapositiva de membrana de polímero delgada (PET o pluma) y el tejido es capturado en un tubo de tapón de colección situado debajo de la diapositiva. Las drogas se extraen del tejido suprimido y cuantificaron usando métodos estándar de la LC/MS. La cantidad de tejido necesaria para recogerse en última instancia depende de la concentración esperada de la droga presente en el tejido y la sensibilidad del método LC/MS. Para la mayoría de los análisis de drogas dosis niveles terapéuticos y analizados usando un espectrómetro de masas cuadrupolo triple rutina, 3 millones de μm2 (2de 3 mm) de tejido superficie es suficiente.
Este protocolo describe la poderosa combinación de perfil espacial y cuantificación completa ofrecido por LCM-LC/MS, proporcionando concentraciones de la droga absoluta en todos los compartimientos de granulomas TB. La técnica también puede aplicarse para determinar las concentraciones de drogas en muchos diversos tejidos enfermos proporcionando información de descubrimiento y desarrollo de medicamentos vitales.
Protocolo
Todos los estudios animales se llevaron a cabo con arreglo a la guía para el cuidado y uso de animales de laboratorio de los institutos nacionales de salud con la aprobación de la atención institucional de Animal y el Comité uso de NIAID (NIH), Bethesda, MD.
1. animales de experimentación y colección de tejido
Esta sección del protocolo describe los procedimientos animales y recolección de muestras en condiciones de bioseguridad nivel 3 (BSL3). Protocolos detallados de la tuberculosis de la micobacteria aerosol infección procedimiento drogas administración y protocolos en conejos han sido describen previamente11,12.
- Infectar conejos Nueva Zelanda blanco (machos y hembras a 4-5 meses de edad) con HN878 de M. tuberculosis mediante un sistema de aerosol de la nariz-sólo, como se describió anteriormente11.
- Administrar los medicamentos solicitados (etambutol en el ejemplo presentado aquí) por la vía preferente y eutanasia a los animales en 2, 6 y 24 h después de la administración. En primer lugar, anestesiar al conejo por la inyección intramuscular de ketamina de 35 mg/kg y xilacina en 5 mg/kg. Espere diez minutos y confirmar la correcta anestesia pellizcando la cola y tocar suavemente el ojo. Si no hay reacción, eutanasia por administración intravenosa de pentobarbital y fenitoína (véase Tabla de materiales) en 1 mL/4,5 kg en solución salina estéril de 2 mL.
Nota: Estos horarios son óptimos para cubrir el perfil farmacocinético de etambutol y requieran ajuste/optimización de otros medicamentos de estudio. - Utilizando pinzas, tijeras o bisturí, quitar los pulmones de la cavidad torácica, resecar biopsias del pulmón que contiene grandes granulomas necróticos encajados tejido de pulmón ajeno (como se describe anteriormente3). Aparecen granulomas necróticos amarillento en color y por lo general sobresalen ligeramente del pulmón circundante de color rojo/rosa. Para facilitar la cryosectioning fácil, asegúrese de que las biopsias son no mayores de 2 x 1.5 x 1.5 cm.
- Utilizando pinzas, coloque la biopsia sobre una bandeja de cryomold previamente etiquetado con la superficie de corte deseada en contacto directo con la base de la bandeja. Después de congelar, esto proporcionará una superficie plana de la cual se cortarán cryosections.
- Congelación de la biopsia en vapores de nitrógeno líquido. Llenar un recipiente de poliestireno a una profundidad de 2 pulgadas con nitrógeno líquido y colocar un bastidor de tubo de alambre de metal. La rejilla debe sobresalir por encima de la superficie del nitrógeno líquido, proporcionando una superficie plana en la cual se colocan las bandejas de tejido. Coloque la tapa en el envase de espuma de poliestireno y deja los tejidos durante 10 minutos se congelen completamente.
- Retire las bandejas de tejido, rápidamente envolver en film de aluminio y coloque en individualmente con la etiqueta de sello y bolsas de plástico resellables. Traslado al congelador de-80 ° C para el almacenamiento.
Nota: Los pasos 1.1-1.6 son realizados en condiciones de BSL3 (incluyendo todos los trabajos de animales y manejo de la infección de órganos y tejidos). Gamma irradiar las biopsias de pulmón en 3 Megarads para permitir la manipulación fuera de contención BSL3. Microdissection de la captura del laser sobre el tejido no esterilizado puede realizarse dentro de la BLS3 instalación si aprueba protocolos de seguridad están en su lugar. Sin embargo, el resto de este protocolo describe procesamiento aguas abajo en una facilidad BSL-2.
2. tejido seccionado
- Ajuste el criostato a la temperatura deseada. Transferencia de la biopsia del pulmón irradiado gamma de-80 ° C almacenamiento al criostato y dejar por 30 minutos para equilibrar la temperatura del tejido. Nota: -20 a-22 ° C es óptimo para las biopsias de la lesión TB.
- Con unas pinzas, fije la biopsia a la tirada de criostato usando una pequeña cantidad de pegamento de temperatura corte óptimo (OCT) a la base del tejido a la tirada. Oriente el tejido para que la superficie plana (que estaba en contacto con la base de la cryomold) es la superficie expuesta para el corte. Asegúrese que el OCT no contamina la superficie del tejido, esto podría interferir con el análisis de espectrometría de masas posteriores.
- Tres secciones de tejido en 25 μm de grosor de corte y montaje en transparencias de membrana de PET. Suavemente toque la membrana a la sección del tejido y retirar. Si se aplica demasiada presión, puede romperse la membrana fina.
- Evite el manejo excesivo de las diapositivas antes de montar ya que ello en la membrana de PET ser cargado y pobre adhesión de las secciones de tejido. Asegúrese de que la diapositiva de membrana se mantiene a temperatura ambiente para permitir el deshielo-montaje y éxito la adherencia del tejido a la membrana.
- Quitar la corredera de criostato y deje que se seque al aire durante 3 minutos. Si LCM-LC/MS/MS no se realizará inmediatamente, sello de la diapositiva en una pequeña bolsa plástica con cierre hermético y traslado al almacenamiento de-80 ° C hasta que se para la disección.
- Corte una sección adyacente de 10-12 μm y deshielo-montaje en un portaobjetos de vidrio estándar de hematoxilina y eosina (H & E) coloración y referencia. Pueden cortar secciones adicionales en este momento para otras manchas de histoquímica deseada (tales como Ziehl-Niellsen para la visualización de Mycobacterium tuberculosis (MTB)).
3. microdisección
- Retirar la bolsa sellada que contiene la diapositiva de-80 ° C almacenamiento y permiten para alcanzar la temperatura ambiente durante 5 minutos.
Nota: Si la diapositiva frío inmediatamente se expone a la atmósfera del laboratorio, el tejido va ser cubierto con condensación y puede verse comprometida la integridad espacial de la droga. - Encienda el microscopio y láser (láser requiere 5-10 minutos de calentamiento antes de corte puede iniciar). Cargar tubos PCR de 0,20 mL de tapa plana en el soporte.
- Quitar la corredera de la bolsa y toma una imagen óptica de la sección de tejido en la diapositiva de la PET utilizando un escáner plano.
- Coloque el portaobjetos en el soporte de diapositivas (tejido hacia abajo) y asignar tubos independientes a las regiones de granuloma específico de interés utilizando el software del microscopio. Normalmente, estos serán 'pulmón ajeno,' 'granuloma de celular' y 'caseum' (centro necrótico), pero puede variar dependiendo de la patología específica de la biopsia del granuloma.
- Se centran en el tejido usando el 5 X objetivo de microscopio. Este aumento debe proporcionar una buena visión general de los tejidos que contienen ambas áreas granuloma necrótico y celular. En el software, seleccione el tubo señalado «caseum» moverse en posición bajo el tejido.
- Introduzca los parámetros deseados de la disección. Configuración típica para una sección de pulmón gruesa 25 μm es potencia de láser 30, velocidad 15 y apertura 35 (unidades arbitrarias). Sin embargo, éstos se diferencian dependiendo del microscopio y la potencial disminución de la energía debido a la antigüedad del láser.
- Seleccione la herramienta 'draw gratis' y, usando un ratón o pantalla táctil pluma, contornear la región deseada para la disección. La superficie de la región se mostrarán en el software. Regiones seleccionadas en 500.000 μm2 (0,5 mm2) para facilitar la disección más fácil de mantener. Repita la disección hasta 3 millones de μm2 (2de 3 mm) se han recogido en total en la tapa del tubo.
- En ocasiones, la región disecada puede permanecer pegada a la membrana circundante (por ejemplo debido a la atracción estática) y no caer en la tapa de la colección. Quitar estas regiones de la superficie acumulada total seleccionando y eliminando manualmente dentro del software.
- Seleccione la tapa de 'lesión celular' y recoger 3 millones μm2 de tejido usando el mismo proceso como se indica en el paso 3.7.
- Seleccione la tapa de 'pulmón ajeno' y recoger 3 millones μm2 de tejido usando el mismo proceso como se indica en el paso 3.7. Tenga en cuenta que el tejido pulmonar contiene muchos bronquiolos y espacios alveolares. Prestar especial atención al excluir a éstos de las regiones de tejido definido para la disección.
- Retire el soporte de la tapa cuidadosamente desenganche, sellar y etiquetar cada tubo. Proteger los tejidos disecados de los disturbios del aire (tales como interrupción del flujo de aire de una puerta). Analizar los tejidos disecados inmediatamente o almacenar a-80 ° C y descongelar a antes de su procesamiento y análisis LCMS.
4. extracción y análisis LCMS
- Preparar la solución de la extracción de acetonitrilo/metanol de 1:1 con estándar interno d-10 etambutol. Al seleccionar un patrón interno, uso una forma estable de la etiqueta de la droga de analito (como EMB marcado con deuterio utilizado en esta demostración) con desplazamiento de masa suficiente para evitar el isótopo Cruz hablar entre el analito drogas y estándar (generalmente un mínimo de 4 daltons) .
Nota: Crear estándares en homogenado de cada tipo de tejido respectivo es difícil porque hay un control muy limitado tejido con el que crear normas de homogeneizado. Como una alternativa para hacer estándares de una muestra de homogeneizado con picos, un estándar puede crearse mediante la adición de tejido en blanco y compuesto de prueba junto y extracción. Un volumen de tejido de control en un homogeneizado que coincide con el volumen de destino de las secciones de tejido de muestra de estudio se combina directamente con la cantidad de la sustancia de ensayo que estaría presente en una concentración determinada. - Calcular el volumen de tejido específicos basado en la superficie y el espesor de la sección de tejido y determinar el factor de dilución necesario para el homogeneizado mediante el volumen de homogeneizado que será añadida a las estándar y las muestras de control de calidad. Cálculos se ilustran a continuación para un área de blanco disecado μm 3 millones2 (3 m m2) con 25 μm de grosor y volumen 2 μl de homogenado.
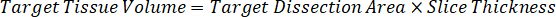
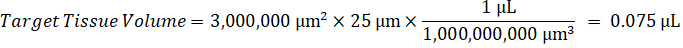
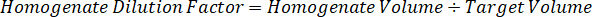

- Asumiendo una densidad de tejido de 1 g/mL, preparar el material homogeneizado por 50 mg de tejido de control de pesaje y adición de tampón PBS para diluir (utilizando el factor de dilución de 26.67 homogenado calculado en el paso 4.2, el diluyente es 1,283 mL). Homogeneizar por grano a tejido pulmonar y tampón PBS durante 5 minutos a 1750 rpm en un homogenizador de grano.
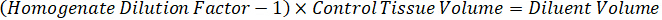
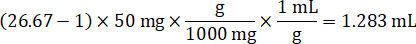
- Diluir la concentración de las existencias del fármaco de 1 mg/mL en acetonitrilo/agua de 1:1 para crear la curva estándar clavar soluciones. Determinar clavar las concentraciones estándar basadas en el volumen de pico y el volumen de tejido blanco. El ejemplo ilustrado es para un 100 ng/mL estándar usando un volumen de espiga 10 μl.
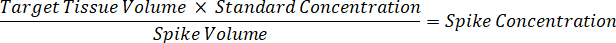
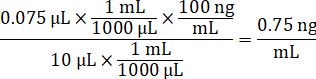
- Retirar los tubos que contienen los tejidos microdissected de-80 ° C almacenamiento y permiten para alcanzar la temperatura ambiente durante 5 minutos.
- Añadir 10 μl de solución de acetonitrilo/agua 1:1 y 2 μl de tampón PBS en los tubos que contienen tejido microdissected.
- Para la curva estándar y los tubos de control de calidad, añadir 10 μl de la solución a 2 μl de homogenado de pulmón control de clavar.
- Añadir 50 μl de solución de extracción para cada tubo.
- Vortex cada tubo por 5 minutos, someter a ultrasonidos durante 5 minutos y centrifugar a 5000 RPM durante 5 minutos para formar un pellet de tejido en cada tubo y película.
- Transferir 50 μl del sobrenadante a una placa de 96 pozos pozos profundos y diluir con un adicional 50 μl de agua desionizada en cada pozo.
- Realizar análisis de LC/MS/MS usando parámetros instrumento optimizado para etambutol y etambutol-d10 estándar interno (como se ha descrito en detalle12).
- Utilizar un factor de dilución para corregir la cantidad exacta de tejido disecado para cada muestra.
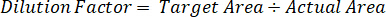
5. método validación
- Crear un homogeneizado de tejido pulmonar de control combinando 1 parte del pulmón, 2 piezas PBS y bolas de acero de 3-4. Bata tejido pulmonar y el tampón PBS durante 5 minutos a 1750 rpm utilizando un homogenizador de grano.
- Spike el homogeneizado mediante la adición de 10 μl de 1 mg/mL stock de DMSO de etambutol en 990 μl homogeneizado para crear una concentración final de 10.000 ng/mL (10 mg/mL) y agitar durante 1 minuto.
- Crear un bloque de homogeneizado congelado verter el homogeneizado en un cryomold y congelar rápidamente en hielo seco durante 5 minutos.
- Prepare secciones gruesas de 25 μm del bloque homogeneizado como se describe en los pasos 2.1-2.5.
- Disecar el área de tejido de destino especificada en pasos 3.2-3.10.
- Añadir 10 μl de 1:1 acetonitrilo/agua y 2 μl de tampón PBS en los tubos que contienen tejido microdissected.
- Añadir 50 μl de solución de extracción para cada tubo. Siga los pasos 4.9-4.12 para crear una curva estándar y determinar la concentración del fármaco en el bloque de homogeneizado de tejido.
- Calcular la eficiencia de la extracción utilizando la siguiente fórmula:
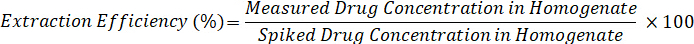
Resultados
Un resumen del enfoque LCM-LC/MS se muestra en la figura 1. Después de la esterilización del tejido por irradiación gamma, todos los pasos posteriores (de tejido a partir de seccionamiento) llevará a cabo fuera de las condiciones de BSL3. La figura 2 muestra la lesión secciones de biopsia antes y después del aislamiento de tejido por LCM. Áreas necróticas y celulares de las lesiones de TB fácilmente identificadas y aisla...
Discusión
Cuantificación espacialmente resueltos de drogas dentro de las lesiones pulmonares de TB es necesaria para determinar si exposición alcanza concentraciones esterilización de poblaciones bacterianas que reside dentro de los compartimientos diferentes de la lesión. El método de LCM-LC/MS que se describe aquí permite la cuantificación absoluta de drogas anti-TB en todos los compartimientos de la lesión, incluyendo el caseum ricos en bacterias, usando solamente secciones de tejido de 1-3 en total. Homogeneización de...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Paul O'Brien, Marizel Mina y Isabella Freedman para experimentos con animales, Jacquie Gonzalez y Danielle Weiner del NIH/NIAID para ayuda con la irradiación gamma de tejidos de conejo antes de microdisección de captura láser y Jansy Sarathy para manuscrito pensamientos y consejos. Este trabajo fue apoyado por fondos de la cuenta y Melinda Gates Foundation (OPP1174780) y la instrumentación de NIH compartido concesión de 1S10OD018072. Agradecemos a Eliseo A. Eugenin acceso al microscopio Leica LMD 6500 e intercambio de conocimientos y consejos. La compra y apoyo continuo, la 6500 de LMD fue financiado por la subvención del Instituto Nacional de Salud Mental, MH096625, Instituto Nacional de trastornos neurológicos y accidente cerebrovascular, NS105584, PHRI financiación (E.A.E) y GSK Aportesala (E.A.E).
Materiales
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Covance | N/A | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| Acetonitrile (LC-MS grade) | Fisher | A955-212 | |
| Methanol (LC-MS grade) | Fisher | A456-212 | |
| Formic Acid (LC-MS grade) | Fisher | A117-50 | |
| Water (LC-MS grade) | Fisher | W6212 | |
| 0.2 mL flat-cap PCR tubes | Corning | 07-200-392 | |
| Steel frames, PET-membrane | Leica | 11505151 | |
| Premium Frosted Microscope Slides | Fisher | 12-544-2 | |
| 96 Deep well plate 2.0ML PP RB | Fisher | NC0363259 | |
| Zorbax SB-C8 column (4.6 by 50 mm; particle size, 3.5 μm) | Agilent | 820631-001D | |
| "Zipper” Seal Sample Bags | Fisher | 01-816-1B | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| CM1850 cryostat | Leica | Discontinued | Leica CM1860 is the current model |
| Laser Microdissection System 6500 | Leica | Discontinued | Leica LMD 6 is the current model |
| Agilent 1260 Infinity II HPLC | Agilent | ||
| API 4000 QTRAP Mass Spectrometer | Sciex |
Referencias
- Dartois, V. The path of anti-tuberculosis drugs: From blood to lesions to mycobacterial cells. Nat Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
- Roscioli, K. M., et al. Desorption electrospray ionization (DESI) with atmospheric pressure ion mobility spectrometry for drug detection. Analyst. 139 (7), 1740-1750 (2014).
- Prideaux, B., et al. Mass spectrometry imaging of levofloxacin distribution in TB-infected pulmonary lesions by MALDI-MSI and continuous liquid microjunction surface sampling. Int J Mass Spectrom. 377, 699-708 (2015).
- Griffiths, R. L., Randall, E. C., Race, A. M., Bunch, J., Cooper, H. J. Raster-mode continuous-flow liquid microjunction mass spectrometry imaging of proteins in thin tissue sections. Anal Chem. 89 (11), 5683-5687 (2017).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J Proteomics. 75 (16), 4999-5013 (2012).
- Dilillo, M., et al. Mass spectrometry imaging, laser capture microdissection, and LC-MS/MS of the same tissue section. J Proteome Res. 16 (8), 2993-3001 (2017).
- Xu, B. J. Combining laser capture microdissection and proteomics: methodologies and clinical applications. Proteomics Clin Appl. 4 (2), 116-123 (2010).
- Cahill, J. F., Kertesz, V., Van Berkel, G. J. Laser dissection sampling modes for direct mass spectral analysis. Rapid Commun Mass Spectrom. 30 (5), 611-619 (2016).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: A failed host immune response. Open Biol. 1 (4), 110016 (2011).
- Zimmerman, M., et al. Ethambutol partitioning in tuberculous pulmonary lesions explains its clinical efficacy. Antimicrob Agents Chemother. 61 (9), (2017).
- Kempker, R. R., et al. Cavitary penetration of levofloxacin among patients with multidrug-resistant tuberculosis. Antimicrob Agents Chemother. 59 (6), 3149-3155 (2015).
- Zhao, Y., et al. Unraveling drug penetration of echinocandin antifungals at the site of infection in an intra-abdominal abscess model. Antimicrob Agents Chemother. , (2017).
- Pascal, J., et al. Mechanistic modeling identifies drug-uptake history as predictor of tumor drug resistance and nano-carrier-mediated response. ACS Nano. 7 (12), 11174-11182 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados