Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Protocolo experimental para el uso de Drosophila como sistema modelo de invertebrado para ensayos de toxicidad en el laboratorio
En este artículo
Resumen
En este trabajo, proporcionamos un protocolo detallado para la exposición de especies en el género Drosophila a contaminantes con el objetivo de estudiar el impacto de la exposición en un rango de salidas fenotípicas en diferentes etapas de desarrollo y para más de una generación.
Resumen
Propiedades emergentes y factores externos (interacciones a nivel de población y ecosistema, en particular) desempeñan importantes funciones en la mediación de las terminales de importancia ecológica, aunque se consideran raramente en estudios toxicológicos. D. melanogaster se perfila como un modelo de toxicología para el impacto conductual, neurológico y genético de sustancias tóxicas, para nombrar unos pocos. Más importante aún, se pueden utilizar especies en el género Drosophila como sistema modelo para un enfoque marco integrador incorporar propiedades emergentes y responder preguntas ecológicamente relevantes en la investigación de Toxicología. El objetivo de este trabajo es proporcionar un protocolo para la exposición de especies en el género Drosophila a contaminantes para ser utilizado como sistema modelo para una gama de salidas fenotípicas y ecológicamente pertinentes preguntas. Más específicamente, este protocolo permite 1) enlazar múltiples niveles biológicos de organización y entender el impacto de sustancias tóxicas en ambos fitness nivel de individuo y población; 2) prueba el impacto de sustancias tóxicas en las diferentes etapas de la exposición del desarrollo; 3) consecuencias multigeneracionales y evolutivo prueba de contaminantes; y 4) probar simultáneamente múltiples contaminantes y estresantes.
Introducción
Cada año, aproximadamente 1.000 nuevos productos químicos son introducidos por la industria química1,2; sin embargo, los impactos ambientales de sólo un pequeño porcentaje de estos productos químicos son probados antes de distribución2,3. Aunque catástrofes a gran escala son poco comunes, subletal y crónica de la exposición a una gran variedad de contaminantes están muy extendidos en los seres humanos y vida silvestre4,5. El enfoque histórico de toxicología ambiental y Ecotoxicología fue probar la mortalidad, sola exposición a sustancias químicas, la exposición aguda y los efectos fisiológicos de la exposición, como un medio de medir el impacto de los contaminantes sobre supervivencia6, 7 , 8 , 9 , 10. aunque hay un cambio hacia enfoques éticos y no invasivo para los ensayos con animales, enfoques actuales limitan debido al papel que desarrollo, propiedades emergentes y factores externos (como el nivel de población y interacciones a nivel de ecosistema) juegan en la mediación de extremos importancia ecológica8. Por lo tanto, hay una necesidad de métodos que incorporan un enfoque más holístico sin sacrificar la vida silvestre y vertebrados en el laboratorio.
Los sistemas modelo de invertebrado, como Drosophila melanogaster, son una atractiva alternativa para abordar la necesidad de un enfoque más holístico para ensayos de toxicidad. D. melanogaster, fue originalmente desarrollado como un sistema modelo de invertebrado para humanos relacionados con la investigación genética sobre hace un siglo11. D. melanogaster ahora prominente se utiliza como una alternativa de modelo vertebrados por varias razones: 1) la conservación de genes y rutas entre D. melanogaster y los seres humanos; 2) tiempo de generación corta en comparación con los modelos de vertebrados; 3) costo bajo costo de mantenimiento; 4) facilidad en la generación de tamaños de muestra grandes; y 5) gran cantidad de puntos finales fenotípica y ecológica-relevante disponibles para la prueba11,12,13,14,15,16,17 .
Varios laboratorios11,15,16,17,18,19,20,21,22, 23 , 24 , 25 ahora utilizan D. melanogaster como una alternativa de modelo vertebrados para ensayos de toxicidad para entender los impactos de la contaminación en los seres humanos. Especies silvestres de Drosophila pueden ser utilizadas, así como modelos de toxicidad para la fauna (y humanos) responder a ecológico-, su comportamiento-y evolutivamente relevantes cuestiones en múltiples niveles biológicos de organización. Utilizando especies dentro del género Drosophila como modelo, varios criterios de valoración cuantificables son posibles11,15,16,18,19,20 ,21,22,23,24,25. In addition, utilizando el modelo de Drosophila , toxicólogos pueden: 1) enlace éticamente efectos en múltiples niveles biológicos de la organización; 2) incorporar el papel de los factores emergentes y desarrollo; 3) estudio de extremos ecológicamente importantes (además de extremos médicamente importantes); 4) prueba de estresores múltiples simultáneamente. 5) y prueba a largo plazo multigeneracional (e.g. evolutiva y transgeneracional) implicaciones de estresores. Por lo tanto, usando Drosophila como sistema modelo permite una multitud de enfoques, que no se limita a estudiar los enfoques mecanicistas con cepas endogámicas de D. melanogaster en el laboratorio.
En este trabajo, presentamos los métodos para la cría y recolección de Drosophila para responder diversas cuestiones toxicológicas. Más específicamente, se describe la metodología para 1) cría de Drosophila en medio con uno o más contaminantes; 2) recogida de Drosophila en desarrollo (p. ej. larvas de tercer estadio pupas casos, recién eclosed adultos y adultos maduros que vaga); y 3) cría de Drosophila en el medio contaminado a prueba intergeneracional y transgeneracional transmisión, así como implicaciones evolutivas de la exposición a largo plazo de sustancias tóxicas. Usando este protocolo, los anteriores autores18,19,20,21,22,23,24,25 han publicado diferentes efectos fisiológicos, genéticos y conductuales del desarrollo (Pb2 +) exposición al plomo. Este protocolo permite toxicólogos utilizar un enfoque más holístico de toxicológico, que es esencial para entender cómo los contaminantes son factores de riesgo para los seres humanos y vida silvestre en un ambiente cada vez cada vez más contaminado.
Access restricted. Please log in or start a trial to view this content.
Protocolo
El siguiente protocolo es un protocolo experimental que se utiliza para criar especies en el género Drosophila en medio contaminado cuando la ingestión de una toxina es apropiada; otras formas de exposición son posibles usando Drosophila modelo11,15,16,26. Los métodos descritos en este protocolo se han descrito previamente por Hirsch et al. 19 y Peterson et al. 23 , 24 , 25.
1. establecer acciones poblaciones de Drosophila en el laboratorio de investigación
- Establecer una incubadora ambientalmente controlado (o habitación) a poblaciones stock casa de Drosophila mediante el establecimiento de las incubadoras para una temperatura constante, ciclo luz: oscuridad y humedad, dependiendo de las preferencias de la especie estudiada.
Nota: Recomendado: condiciones ambientales variarán según la ecología natural de la especie elegida para el estudio. Por ejemplo, D. melanogaster es nativo de África subsahariana27 y se mantiene normalmente a 25 ° C, 12:12 luz: oscuridad ciclo y aproximadamente 60% humedad16,18,19,20 , 21 , 22 , 23 , 24 , 25 , 28 , 29 , 30. por otra parte, D. montana se extiende en la mayor parte de Canadá y los E.e.u.u. cercano oeste, una región mucho más frío; por lo tanto, montana D. normalmente se mantiene en 19 – 20 ° C y a veces un régimen de luz de 24 horas para simular las condiciones durante el acoplamiento de la temporada31. Para una descripción más detallada de las gamas geográficas de varias especies de Drosophila, ver los patrones de especiación de Drosophila Web32. -
Obtener un recomendado: especies de Drosophila o línea consanguínea de ya sea un centro común (véase tabla de materiales), otro laboratorio de investigación sobre pedido o recoger salvaje, poblaciones genéticamente variables del campo.
Nota: Los siguientes pasos explican los métodos para recoger las poblaciones silvestres, genéticamente variables de Drosophila para mantener en el laboratorio de investigación. Estos métodos se han modificado de Markow y O'Grady33 y Werner y Jaenike34 para recoger la más amplia diversidad de especies a la vez, en lugar de especies particular con una fuente de cebo.- Congelar una docena plátanos maduros en el congelador durante la noche y descongelar antes de colocar las trampas de cebo.
- Prepare múltiples L 1-2 botellas de plástico cortando una abertura en forma de u en el frente de la botella para permitir que vuela ser capturado en la botella de cebo y no escape. Tapa las botellas de plástico con sus tapas de las botellas para que las moscas no se escapen a través de las tapas.
- Añadir el plátano descongelado a la parte inferior de las botellas para que la parte inferior de las botellas contiene aproximadamente una pulgada de plátano. Colocar una rodaja de tomate maduro en la botella. Añadir una mezcla de levadura (la levadura sobrante desde el proceso de elaboración de cerveza) para el plátano en la parte inferior de la botella para que el plátano es sumergirlo en la mezcla de levadura.
- Agregar los palillos de madera (en posición vertical vertical) a la botella para que las moscas tienen un substrato limpio a alejarse en la mezcla de levadura y plátano.
La figura 1 muestra el producto final de estos métodos. - Colgar carnada botellas en árboles durante la noche y comprobar que cada aspirada de boca 24 h. vuela fuera de botellas y colocar individualmente las hembras en frascos con medio de crear líneas de iso-mujer.
Nota: Líneas múltiples femeninas pueden crear, sin embargo, sólo si las hembras de cada especie pueden ser claramente identificadas. Además, vuela dentro del género Drosophila ocupa nichos ecológicos diferentes y tendrá diferentes necesidades dietéticas dependiendo de esos nichos (Werner y Jaenike34); Ver Werner y Jaenike34 recomendaciones de dieta y recetas de comida. - Examinar la descendencia de1 F adulto bajo el microscopio de disección para identificar la especie de la recogida de Drosophila (véase Markow y O'Grady33 y34 del Werner y Jaenike para asistencia en la identificación de varias especies ).

Figura 1 : Representación pictórica de trampas y cebos utilizados para recoger las poblaciones silvestres de Drosophila en el campo. (A) mosca atrapa el conjunto en un sitio de campo local en Colorado. (B) una vista más cercana de la mosca atrapa el sistema en este sitio de campo. Haga clic aquí para ver una versión más grande de esta figura.
- Mantener la hembra iso o las líneas múltiples femeninas en una incubadora controlada ambientalmente o una habitación con temperatura constante, el ciclo luz: oscuridad y humedad. Para ello, casa vuela en frascos o botellas en prefirieron medio y permitir que las hembras grávidas ponen huevos en el medio. Vigilar los frascos de la presencia de larvas y pupas.
Nota: Moscas dentro del género Drosophila ocupan nichos ecológicos diferentes y tienen diferentes necesidades dietéticas y preferencias abióticos ambientales dependiendo de esos nichos33,34. Preferencias ambientales y recomendaciones dietéticas (y más instrucción en la cría de mosca) se pueden encontrar en Elgin y Miller28, Shaffer et al. 29, stocker y Galán30, Markow y o ' Grady33y Werner y Jaenike34. Si utiliza especies capturados, las condiciones ambientales locales pueden ser simuladas en las incubadoras hasta que la especie puede ser identificada. - Transferencia de acciones con frecuencia a medio fresco, descarte frascos antiguos, para mantener líneas saludables y evitar la infección de ácaros.
Nota: La frecuencia de transferencia dependerá del ciclo de vida de la especie. Por ejemplo, transferencia de Drosophila melanogaster cada 2 semanas a medio fresco. Para más información sobre mantenimiento de líneas en el laboratorio, vea Rand et al. 16, Elgin y Miller28, Shaffer et al. 29, stocker y Galán30, Greenspan35y Ciencias de la educación36de base de datos.
2. parte posterior de Drosophila en el medio contaminado
Nota: Si pruebas de Drosophila en el laboratorio por primera vez o con un nuevos contaminantes, determinar la dosis letal (véase Castañeda et al. 37 y Massie et al. 38 métodos) y la DL50 (ver Castañeda et al. 37 y Akins et al. 39 métodos) primera. A continuación, ejecute una curva dosis-respuesta para identificar concentraciones biológicamente relevantes para la deseada salida fenotípica; Ver Hirsch et al. 19 y Zhou et al. 40 para los métodos.
- Preparar las soluciones madre del medio contaminado en el deseado concentraciones, dependiendo de la química del contaminante.
Nota: por ejemplo, para preparar las soluciones madre de PbAc: preparar soluciones de acetato de plomo (PbAc) medio agregando contaminantes al agua destilada (dH20) hasta medio hecho con agua de contaminante alcanza concentración deseada. Por ejemplo, una solución madre de 1.000 μm PbAc, puede ser preparado agregando PbAc a dH20 hasta llegar a 1.000 μm PbAc. Además, diluir la solución (por ejemplo, los 1.000 solución del PbAc de μm) hasta la concentración deseada (como 500 μm PbAc) y mantener estas soluciones como así. - Preparar el medio, las pautas del fabricante siguientes para servir como medio de control. Preparar medio adicional, las directrices del fabricante siguientes; sin embargo, suplemento contaminantes solución preparada para dH20.
Nota: por ejemplo, si utiliza un instante medio Drosophila , agregar aproximadamente una cucharada medio instantáneo a un frasco de plástico. Añadir aproximadamente 5 – 5.5 mL dH20 a la media. Esparcir algunos granos de levadura viva para preparar el medio de control. Para preparar el medio experimental, complementar la solución (como 500 μm PbAc) para dH20. -
Transferencia viables reproductivamente maduros machos y hembras de las poblaciones comunes en el control y el experimental medio.
Nota: La eclosión posterior de tiempo a la madurez reproductiva es diferente entre las especies Drosophila del41.- Golpee suavemente el frasco de las moscas comunes hacia abajo con la mano dominante. Asegúrese de que las moscas se desplazan automáticamente a la parte inferior del frasco. Con la otra mano, retire la tapa del frasco al golpear ligeramente el frasco y colocar un vial nuevo de control o medio contaminado en la parte superior del frasco con las moscas. Mantenga los frascos juntos y voltearlas, golpear ligeramente suavemente, para que las moscas automáticamente se transfieren al frasco de dulce de control o medio contaminado. Mientras todavía golpear ligeramente el frasco con las moscas, tapa el frasco.
- Repita con viales más, asegurándose de que estandarizar el número de moscas en cada frasco.
Nota: El número total de adultos había transferido a a través de una transferencia o anestesia dependerá del tamaño de los frascos para evitar hacinamiento. - Incubar a adultos en condiciones ambientales estándar (es decir, una incubadora) y permitir que los adultos se aparean y ponen huevos en el medio de 24-96 h.
- Después de 24-96 h, descartar adultos en un depósito de cadáveres (un frasco lleno de aceite mineral y tapado con un embudo ajustada) dejando tras de sí fertilizan huevos (que más tarde se convierten en los sujetos experimentales) para madurar durante la prueba. Coloque los frascos en la incubadora para permitir que los huevos se desarrollan.
- Vigilar los frascos para larvas de estadio que vaga buscando las larvas que emergen del medio.
3. recolectar a sujetos experimentales en diversas etapas del desarrollo
Nota: Sujetos experimentales pueden ser recogidos en cualquier etapa del desarrollo, situado en el ciegos codificados tubos cónicos de 15 mL y probado para la acumulación. Métodos de prueba de la acumulación de contaminantes dependerá del contaminante en estudio. Por ejemplo, acumulación de PbAc puede probarse usando Inductively-Coupled espectrometría de Plasma (ICP-MS)42. Además, sujetos experimentales pueden ser recogidos en cualquier etapa del desarrollo a probar para una variedad de efectos fenotípicos de los contaminantes. La figura 2 ilustra el ciclo de vida de Drosophila 43. La figura 3 ilustra el protocolo experimental para la exposición y las diferentes etapas de desarrollo de colección.
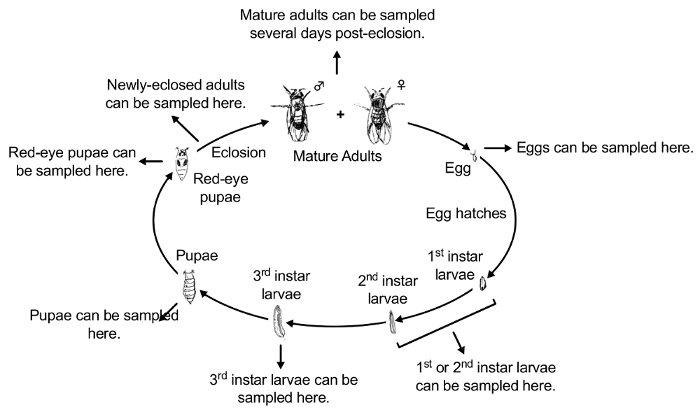
Figura 2 : Resumen conceptual del ciclo de vida de D. melanogaster (el más utilizado sistema de modelo de Drosophila ). Las etapas del ciclo de vida de la Drosophila son: 1) huevo, 2) primer estadio larva, larva de segundo estadio de 3), 4) tercera-instar de la larva, 5) por la larva de tercer estadio, pupa 6) White-Eye, pupa 7) rojos, 8) recién-eclosed adulto y adulto 9) maduro. Haga clic aquí para ver una versión más grande de esta figura.
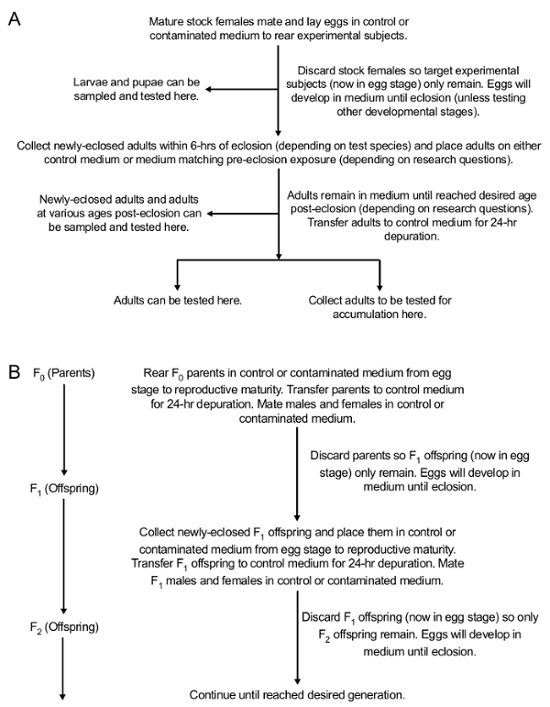
Figura 3 : Resumen conceptual de los métodos para la exposición oral de Drosophila al medio contaminado en el parental (F0) y generaciones posteriores (F1 y). (A) métodos de exposición oral durante el desarrollo en la generación expuesta. (B) métodos para probar a la transferencia de contaminantes a la descendencia (F1 , a la generación deseada). Esta figura ha sido modificada de Peterson et al. 24 Haga clic aquí para ver una versión más grande de esta figura.
-
Recoger larvas errantes-tercer estadio
- Comience a controlar los frascos cuando se enciende en la incubadora, ya que las larvas se emerge desde el medio y mover hacia arriba en el lado el frasco dentro de una horas después de que se enciende en la incubadora. Dentro de este h, quitar las larvas de estadio de tercera vagar por los lados de la cubeta con cuidado utilizando un palito de madera o pinzas.
Nota: El número de larvas disponibles para la recogida dependerá de la cantidad de huevos puestos en "2.3.4". - Para quitar el exceso medio de las larvas, coloque las larvas en un pequeño vaso con dH2O. Pour la dH2O fuera del vaso y coloque las larvas en un limpiador de tarea delicada. Usando un limpiador de tarea delicada, suavemente Quite el exceso de dH2O de las larvas.
- Mantener poblaciones experimentales en una incubadora con ambiente controlado.
- Comience a controlar los frascos cuando se enciende en la incubadora, ya que las larvas se emerge desde el medio y mover hacia arriba en el lado el frasco dentro de una horas después de que se enciende en la incubadora. Dentro de este h, quitar las larvas de estadio de tercera vagar por los lados de la cubeta con cuidado utilizando un palito de madera o pinzas.
-
Recoger nuevamente eclosed adultos
- Viales de monitor para eclosión mediante la observación de la coloración de las pupas a lo largo de los lados de los frascos.
Nota: Pupas se oscurecerán durante el desarrollo. Tiempo de desarrollo, particularmente de la eclosión, depende de las especies probadas. - Cuando los primeros adultos eclose, volcado y deseche a estos adultos en una morgue que contiene aceite mineral.
- Cuando la luz se prende en la incubadora a la mañana siguiente, la descarga y descartar a cualquier adulto de edad desconocida (o virginidad) que tenga eclosed durante la noche o durante las luces morningbefore en.
- Aproximadamente 4 h más tarde, anestesiar cualquier adulto que recién eclosed adultos con una pistola de CO2 en los frascos. Lugar de adultos en una placa de2 CO bajo un microscopio de disección. Adultos sexo buscando sexo peines en los miembros anteriores de los machos y huevecillos de las hembras.
Nota: D. melanogaster deberán recogerse dentro de las 6 h de eclosión para evitar el apareamiento pero otras especies pueden tener más desarrollo veces (y por lo tanto, no es necesario ser recogidos dentro de este marco de tiempo). - Adultos separados en la placa de CO2 utilizando un palo de madera. Suavemente la transferencia de adultos en grupos específicos de sexo usando un palo a la media historia preexistente que empareja.
- Viales de monitor para eclosión mediante la observación de la coloración de las pupas a lo largo de los lados de los frascos.
-
Recoger la eclosión de adultos maduros
- Permitir que adultos en la medio exposición correspondiente antes de la eclosión de la etapa de huevo a la eclosión posterior de edad deseada en una incubadora con ambiente controlado.
- Solo transferencia de adultos en el medio de control de 24 h antes de la prueba para permitir a adultos para exceso medio contaminado sus cuerpos.
4. sujetos experimentales para probar los efectos de múltiples generaciones o la exposición del Transgenerational de la trasera.
- Posterior a la generación parental (a.k.a el P0 e F0 generación), transferencia de adultos de poblaciones acciones para el control y el experimental medio siguiendo los pasos de "2.1" "2.3" y "3.1" para "3.3".
- Cuando los adultos están reproductivamente maduros (ver Pitnick et al. 41), solo un frasco de machos a un vial nuevo de control o medio experimental de transferencia (según lo indicado en 2.3.1). Solo transferencia de un vial de hembras al frasco de dulce que contiene ahora los machos. Permitir que a adultos mate y endecha huevos en el medio de 24-96 h. descarga y deseche a adultos en un depósito de cadáveres que contengan aceite mineral y volver a incubar viales para permitir que los hijos a desarrollar.
- Repita los pasos 4.1 a 4.2 según el número de generaciones.
Access restricted. Please log in or start a trial to view this content.
Resultados
Exponiendo oralmente Drosophila a contaminantes en todo el desarrollo, se pueden probar diversas cuestiones toxicológicas exponiendo Drosophila en los diferentes niveles de organización biológica. Esta sección presenta resultados representativos obtenidos utilizando este protocolo en artículos previamente publicados23,24. En particular, este protocolo fue utilizado previamente para evaluar la acumulación, l...
Access restricted. Please log in or start a trial to view this content.
Discusión
Drosophila melanogaster se ha establecido como un poderoso modelo para una variedad de procesos biológicos debido a la amplia conservación de genes y rutas de D. melanogaster y los seres humanos13,14. Por las mismas razones que es un potente modelo para la ciencia médica, la Drosophila ha surgido como modelo adecuado para estudiar el impacto de la contaminación antropogénica en una gama de puntos finales toxicológicos. Varios labo...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta publicación fue apoyada por una beca del Departamento de Educación (Premio PR #P031C160025-17, título del proyecto: 84,031 C) a las comunidades de Colorado State University-Pueblo (CSU-Pueblo) al compromiso de construir activos tallo (BASE C). Agradecemos a Zoología actual y Elsevier para proporcionar los derechos para utilizar los resultados representativos publicados en trabajos previos, así como los editores de Zeus por habernos brindado la oportunidad de publicar este protocolo. También nos gustaría agradecer al programa de BASE de C, Dr. Brian Vanden Heuvel (C-BASE y Departamento de biología, CSU-Pueblo), Departamento de Biología de CSU-Pueblo, Thomas Graziano, Dr. Bernard Possidente (Departamento de biología, Universidad de Skidmore) y la doctora Claire Varian Ramos (Departamento de biología, Colorado State University-Pueblo) por su apoyo y ayuda.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Carolina Biological Instant Drosophila Medium Formula 4-24 | Carolina Biological | 173204 | |
| Drosophila vials, Narrow (PS), Polystyrene, Superbulk, 1000 vials/unit | Genessee Scientific | 32-116SB | Used to store flies |
| Flugs Closures for vials and bottles, Narrow plastic vials | Genessee Scientific | 49-102 | Used to store flies |
| Cardboard trays, trays only, narrow | Genessee Scientific | 32-124 | Used to organize populations of flies |
| Cardboard trays, dividers only, narrow | Genessee Scientific | 32-126 | Used to organize populations of flies |
| Thermo Scientific Nalgene Square Wide-Mouth HDPE Bottles with Closure | Fischer Scientific | 03-312D | Useful for storage of contaminants |
| Thermo Scientific Nalgene Color-Coded LDPE Wash Bottles | Fischer Scientific | 03-409-17C | Useful for storage of contaminants |
| Eppendorf Repeater M4 Manual Handheld Pipette Dispenser | Fischer Scientific | 14-287-150 | Used to prepare medium |
| Combitips Advanced Pipetter Tips - Standard, Eppendorf Quality Tips | Fischer Scientific | 13-683-708 | Used to prepare medium |
| Flypad, Standard Size (8.1 X 11.6cm) | Genessee Scientific | 59-114 | Used to anesthetize flies |
| Flystuff foot valve | Genessee Scientific | 59-121 | Used to anesthetize flies |
| Tubing, green (1 continguous foot/unit) | Genessee Scientific | 59-124G | Used to anesthetize flies |
| Mineral Oil, Light, White, High Purity Grade, 500 mL HDPE Bottle | VWR | 97064-130 | Used to make a morgue |
| Glass Erlenmeyer Flask Set - 3 Sizes - 50, 150 and 250ml, Karter Scientific 214U2 | Walmart | Not applicable | Used to make a morgue |
| BGSET5 Glass Beaker Set Of 5 | Walmart | ||
| Inbred or wildtype line of Drosophila | Bloomington Drosophila Stock Center at Indiana University | https://bdsc.indiana.edu | |
| Wild popultions of Drosophila | UC San Diego Drosophila Stock Center | https://stockcenter.ucsd.edu/info/welcome.php |
Referencias
- Postel, S. Defusing the Toxics Threat: Controlling Pesticides and Industrial Waste. , Worldwatch Institute. Washington, DC. (1987).
- Vitousek, P. M., Mooney, H. A., Lubchenco, J., Melillo, J. M. Human domination of earth's ecosystems. Science. 277, 494-499 (1997).
- United Nations Environment Program (UNEP). Saving Our Planet: Challenges and Hopes. , UNEP. Nairobi. (1992).
- Hansen, L. J., Johnson, M. L. Conservation and toxicology: Integrating the disciplines. Conservation Biology. 13, 1225-1227 (1999).
- Johnston, E. L., Mayer-Pinto, M., Crowe, T. P. REVIEW: Chemical contaminant effects on marine ecosystem functioning. Journal of Applied Ecology. 52, 140-149 (2015).
- Dell'Omo, G. Behavioral ecotoxicology. , John Wiley & Sons, LTD. West. Sussex, UK. (2002).
- Clotfelter, E. D., Bell, A. M., Levering, K. R. The role of animal behaviour in the study of endocrine-disrupting chemicals. Animal Behaviour. 68, 665-676 (2004).
- Peterson, E. K., Buchwalter, D. B., Kerby, J. L., LeFauve, M. K., Varian-Ramos, C. W., Swaddle, J. P. Integrative behavioral ecotoxicology: bringing together fields to establish new insight to behavioral ecology, toxicology, and conservation. Current Zoology. 63, 185-194 (2017).
- Scott, G. R., Sloman, K. A. The effects of environmental pollutants on complex fish behaviour: Integrating behavioural and physiological indicators of toxicity. Aquatic Toxicology. 68, 369-392 (2004).
- Zala, S. M., Penn, D. J. Abnormal behaviors induced by chemical pollution: A review of the evidence and new challenges. Animal Behaviour. 68, 649-664 (2004).
- Abolaji, A. O., Kamdem, J. P., Farombi, E. O., Rocha, J. B. T. Drosophila melanogaster as a promising model organism in toxicological studies. Archives of Basic & Applied Medicine. 1, 33-38 (2013).
- Jennings, B. H. Drosophila-a versatile model in biology and medicine. Materials Today. 14, 190-195 (2011).
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacology Reviews. 63, 411-436 (2011).
- Rubin, G. M., et al. Comparative genomics of the eukaryotes. Science. 287, 2204-2215 (2000).
- Rand, M. D. Drosophotoxicology: The growing potential for Drosophila in neurotoxicology. Neurotoxicol Teratol. 32, 74(2010).
- Rand, M. D., Montgomery, S. L., Prince, L., Vorojeikina, D. Developmental toxicity assays using the Drosophila model. Current Protocols in Toxicology. 59, 1.12.1-1.12.20 (2015).
- Burke, M. K., Rose, M. R. Experimental evolution with Drosophila. American Journal of Physiology: Regulatory, Integrative and Comparative Physiology. 296, R1847-R1854 (2009).
- He, T., Hirsch, H. V. B., Ruden, D. M., Lnenicka, G. A. Chronic lead exposure alters presynaptic calcium regulation and synaptic facilitation in Drosophila larvae. NeuroToxicology. 30, 777-784 (2009).
- Hirsch, H. V., et al. Behavioral effects of chronic exposure to low levels of lead in Drosophila melanogaster. NeuroToxicology. 24, 435-442 (2003).
- Hirsch, H. V. B., et al. Variations at a quantitative trait locus (QTL) affect development of behavior in lead-exposed Drosophila melanogaster. NeuroToxicology. 30, 305-311 (2009).
- Morley, E. J., Hirsch, H. V. B., Hollocher, K., Lnenicka, G. A. Effects of chronic lead exposure on the neuromuscular junction in Drosophila larvae. NeuroToxicology. 24, 35-41 (2003).
- Ruden, D. M., et al. Genetical toxicologenomics in Drosophila identifies master- modulatory loci that are regulated by developmental exposure to lead. NeuroToxicology. 30, 898-914 (2009).
- Peterson, E. K., et al. Accumulation, elimination, sequestration, and genetic variation of lead (Pb2+) loads within and between generations of Drosophila melanogaster. Chemosphere. 181, 368-375 (2017).
- Peterson, E. K., et al. Asymmetrical positive assortative mating induced by developmental lead (Pb2+) exposure in a model system, Drosophila melanogaster. Current Zoology. 63, 195-203 (2017).
- Peterson, E. K. Consequences of developmental lead (Pb2+) exposure on reproductive strategies in Drosophila. , University at Albany-State University of New York. Dissertation (2016).
- Chifiriuc, M. C., Ratiu, A. C., Popa, M., Ecovolu, A. A. Drosophotoxicology: An emerging research area for assessing nanoparticles interaction with living organisms. International Journal of Molecular Sciences. 17, 36(2016).
- Lachaise, D., Cariou, M. L., David, J. R., Lemeunier, F., Tsacas, L., Ashburner, M. Historical biogeography of the Drosophila melanogaster species subgroup. Evolutionary Biology. 22, 159-225 (1988).
- Elgin, C. R., Miller, D. W. Mass rearing of flies and mass production and harvesting of embryos. The Genetics and Biology of Drosophila. Ashburner, M., Wright, T. R. F. 2a, 112-121 (1978).
- Shaffer, C. D., Wuller, J. M., Elgin, C. R. Chapter 5: Raising large quantities of Drosophila for biochemical experiments. Methods in Cell Biology. 44, 99-108 (1994).
- Stocker, H., Gallant, P. Getting started: an overview on raising and handling Drosophila. Methods in Molecular Biology. 420, 27-44 (2008).
- Jennings, J. H., Etges, W. J., Schmitt, T., Hoikkala, A. Cuticular hydrocarbons of Drosophila montana: geographic variation, sexual dimorphism and potential roles as pheromones. Journal of Insect Physiology. 61, 16-24 (2014).
- Drosophila Speciation Patterns. , http://www.drosophila-speciation-patterns.com/rangemaps.html. (2018).
- Markow, T. A., O'Grady, P. M. Drosophila: A Guide to Species Identification and Use. , Academic Press. London. (2005).
- Werner, T., Jaenike, J. Drosopholids of the midwest and northeast. , River Campus Libraries, University of Rochester. Rochester NY. (2017).
- Greenspan, R. J. The basics of doing a cross. Fly Pushing: The theory and practice of Drosophila genetics. , 2nd, Cold Spring Harbor Laboratory Press, Cold Spring Harbor. New York. 3-24 (1997).
- JoVE Science Education Database. . Biology I: yeast, Drosophila and C. elegans. Drosophila Maintenance. , JoVE. Cambridge, MA. (2018).
- Castañeda, P. L., Muñoz, G. L. E., Durán, D. A., Heres, P. M. E., Dueñas, G. I. E. LD50 in Drosophila melanogaster. fed on lead nitrate and lead acetate. Drosophila Information Service. 84, 44-48 (2001).
- Massie, H. R., Aiello, V. R., Whitney, S. J. P. Lead accumulation during aging of Drosophila and effect of dietary lead on life span. Age. 15, 47-49 (1992).
- Akins, J. M., Schroeder, J. A., Brower, D. L., Aposhian, H. V. Evaluation of Drosophila melanogaster as an alternative animal for studying the neurotoxicity of heavy metals. BioMetals. 5, 111-120 (1992).
- Zhou, S., et al. The genetic basis for variation in sensitivity to lead toxicity in Drosophila melanogaster. Environmental Health Perspectives. 124, 1062-1070 (2016).
- Pitnick, S., Markow, T. A., Spicer, G. S. Delayed male maturity is a cost of producing large sperm in Drosophila. Proceedings of National Academy of Sciences USA. 92, 10614-10618 (1995).
- Beauchemin, D. Inductively Coupled Plasma Mass Spectrometry. Analytical Chemistry. 82, 4786-4810 (2010).
- Tyler, M. S. Development of the fruit fly Drosophila melanogaster. Developmental Biology, a Guide for Experimental Study. Tyler, M. S. , 2nd, Sinauer Associates Inc. Sunderland, MA, USA. 8-27 (2000).
- Ortiz, J. G., Opoka, R., Kane, D., Cartwright, I. L. Investigating arsenic susceptibility from a genetic perspective in Drosophila reveals a key role for glutathione synthetase. Toxicological Sciences. 107, 416-426 (2009).
- Bonilla, E., Contreras, R., Medina-Leendertz, S., Mora, M., Villalobos, V., Bravo, Y. Minocycline increases the life span and motor activity and decreases lipid peroxidation in manganese treated Drosophila melanogaster. Toxicology. 294, 50-53 (2012).
- Guarnieri, D. J., Heberlein, U. Drosophila melanogaster, a genetic model system for alcohol research. International Review of Neurobiology. 54, 199-228 (2003).
- Posgai, R., Cipolla-McCulloch, C. B., Murphy, K. R., Hussain, S. M., Rowe, J. J., Nielsen, M. G. Differential toxicity of silver and titanium dioxide nanoparticles on Drosophila melanogaster development, reproductive effort, and viability: size, coatings and antioxidants matter. Chemosphere. 85, 34-42 (2011).
- Gupta, S. C., et al. Adverse effect of organophosphate compounds, dichlorvos and chlorpyrifos in the reproductive tissues of transgenic Drosophila melanogaster: 70kDa heat shock protein as a marker of cellular damage. Toxicology. 238, 1-14 (2007).
- Wasserkort, R., Koller, T. Screening toxic effects of volatile organic compounds using Drosophila melanogaster. Journal of Applied Toxicology. 17, 119-125 (1997).
- Markow, T. A., O'Grady, P. O. Reproductive ecology of Drosophila. Functional Ecology. 22, 747-759 (2008).
- Dev, K., Chahal, J., Parkash, R. Seasonal variations in the mating-related traits of Drosophila melanogaster. Journal of Ethology. 31, 165-174 (2013).
- Salminen, T. S., Vesala, L., Laiho, A., Merisalo, M., Hoikkala, A., Kankare, M. Seasonal gene expression kinetics between diapause phases in Drosophila virilus group species and overwintering differences between diapausing and non-diapausing females. Nature Scientific Reports. 5, 11197(2015).
- Miller, R. S., Thomas, J. L. The effects of larval crowding and body size on the longevity of adult Drosophila melanogaster. Ecology. 39, 118-125 (1958).
- Peterson, E. K., Ghiradella, H., Possidente, B., Hirsch, H. Transgenerational epigenetic effects of lead exposure on behavior in Drosophila melanogaster. Abstracts of the IBANGS Genes, Brain and Behavior Meeting, May 16-19, 2012, Boulder, CO, 11, Genes, Brain & Behavior 492-493 (2012).
- Soares, J. J., et al. Continuous liquid feeding: New method to study pesticides toxicity in Drosophila melanogaster. Analytical Biochemistry. 537, 60-62 (2017).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados