Method Article
Protocolos para las pruebas de la toxicidad de la novela química insecticida para mosquitos
En este artículo
Resumen
Se describen los protocolos para la evaluación de la toxicidad de los químicos a los mosquitos inmaduros y adultos para el desarrollo como nuevas clases de larvicidas, adulticidas y endectocidas. Los protocolos permiten pruebas de alto rendimiento de múltiples químicos en dosis de un solo punto y posterior evaluación por análisis de respuesta de dosis para determinar toxicidad en contacto o por ingestión.
Resumen
Nuevas clases de insecticidas con nuevos modos de acción son necesarios para el control de poblaciones resistentes a insecticidas de los mosquitos que transmiten enfermedades como la malaria, el dengue y Zika. Ensayos para el rapid, se presentan análisis de alto rendimiento de química novela velado contra mosquito larvas y adultos. Describimos protocolos de punto-dosis única y dosis respuesta ensayos para evaluar la toxicidad de la química de la molécula pequeña para el vector Aedes aegypti de Zika, dengue y fiebre amarilla, el vector de la malaria, Anopheles gambiae y el norte mosquitos de la casa, Culex quinquefasciatus, contacto y por ingestión. Por ejemplo, se evaluó la toxicidad de amitriptilina, un antagonista de la pequeña molécula de G proteína-juntó los receptores, por medio de larvas, adultos tópico y adultos alimentan de sangre análisis. Los protocolos proporcionan un punto de partida para investigar el potencial insecticida. Los resultados se discuten en el contexto de experimentos adicionales para explorar las aplicaciones de productos y mecanismos para la entrega.
Introducción
Los mosquitos transmiten los agentes causativos de las enfermedades infecciosas que afectan la salud humana a nivel mundial1. Los tres géneros más importantes de mosquitos que afectan a la salud humana son Aedesy Anopheles, Culex. Especies de mosquitos Aedes vector el arbovirus causantes de Zika, dengue, fiebre amarilla y chikungunya. Especies de Anopheles vectores parásitos de la malaria y las especies Culex transmiten virus del Nilo Occidental y de nematodos filarial2. La Organización Mundial de la salud (OMS) ha llamado para la erradicación de diez desatendidas tropicales enfermedades (NTD) por 20203 e identifican el control de mosquitos como la estrategia más viable. Insecticidas son poderosas herramientas para controlar los mosquitos y reducir enfermedades transmisión4,5. Sin embargo, la aparición de poblaciones resistentes a insecticidas del mosquito amenaza el control continuo de muchas enfermedades6,7,8. El consorcio innovador de Control de vectores (IVCC) ha lanzado el primer esfuerzo dedicado a desarrollar insecticidas de recambio para mosquito control9. Nuevos insecticidas con nuevos modos de acción (MoA) son necesarias para que cumplir objetivos y lograr el control de la enfermedad. El descubrimiento y desarrollo de nuevas clases de insecticidas con novela MDA requieren ensayos de todo organismo para análisis rápido de alto rendimiento de químicos y en comparación con los estándares de la industria10.
Varios ensayos están disponibles para evaluar la repelencia y la toxicidad de los insecticidas a las larvas y los mosquitos adultos, y algunos son adecuados para la evaluación de nuevos químicos formulados o velados. El WHO protocolo11 es un ensayo de contacto utilizado para probar productos contra larvas cuarto estadio. Los estudios publicados describen también una variedad de análisis larvales utilizada para probar la toxicidad de los químicos de la molécula pequeña a las larvas de Aedes aegypti, Anopheles gambiae y Culex quinquefasciatus10,12, 1314,de,15,16. Los centros para el Control de enfermedades y prevención de enfermedades (CDC) prueba de botella se utiliza para evaluar la resistencia a los insecticidas en poblaciones de campo capturado de mosquitos adultos a través de la evaluación de la concentración letal (LC) y el tiempo letal (LT) en comparación con un estándar diagnóstico dosis de un insecticida comercial17. La prueba de sensibilidad WHO ofrece otro enfoque para evaluar la resistencia a los insecticidas de los mosquitos adultos, por el que los mosquitos están expuestos a papel impregnado de insecticidas dentro de frascos de vidrio para 1 h y se evalúa la mortalidad a las 24 h18. Otros ensayos de rociar formulaciones dentro de jaulas selladas y la caída récord del mosquito y la muerte en los puntos de tiempo deseado19. Aplicación tópica en el tórax del mosquito se ha utilizado para evaluar la potencia de diferentes plaguicidas20. El establecimiento de pruebas de insecto de Liverpool (LITE)21 emplea procedimientos de operaciónevaluar la bioactividad de la química a los mosquitos adultos. El análisis tópico adultos LITE aplica un pequeño volumen de producto de prueba en el tórax de los mosquitos adultos con mortalidad en 48 h. El ensayo permite la cuantificación de la dosis recibida por cada mosquito21. El ensayo tarsal LITE evalúa la toxicidad del producto de prueba a los mosquitos adultos que descanse sobre una superficie tratada químicamente y se utiliza para identificar sustancias químicas con potencial de desarrollo como aerosoles residuales interiores (IRS) o utilizar mosquiteros mosquiteros (MTI) para el control de los mosquitos Anopheles .
La OMS y CDC ensayos tienen limitaciones para probar químicos nuevos, velados, y el objetivo de la prueba de la botella de CDC es la evaluación de susceptibilidad durante períodos de ensayo corto (dos horas) en lugar de toxicidad22,23. Además, ensayos para la evaluación de la toxicidad de los químicos entregan en la harina de sangre y se carecen de potencial para el desarrollo de productos de acción sistémica (es decir, endectocidas). Aquí, describimos a los ensayos para probar la actividad de mosquitocidal de nuevos químicos que son solubles en agua o uno de varios solventes orgánicos contra las larvas y adultos de Aedes, Anopheles y Culex. En primer lugar, demostramos un análisis larval previamente descrita por nuestro grupo10,12,13,16y realiza aquí como (1) dosis de una pantalla para rápidamente evaluar múltiples químicos en punto, y (2) un análisis de respuesta de dosis para determinar la concentración letal (p. ej., LC50, LC75 o90,de la LC) de una química única. A continuación, Describimos dos adultos ensayos para determinación de dosis letal (LD). La primera de ellas es una adaptación del protocolo LITE para la prueba de la química de aplicación tópica, la novela contra los mosquitos adultos en comparación con un control positivo. El segundo es un ensayo de alimentación para la evaluación de químicos entregados systemically a través de la comida de sangre.
Protocolo
Nota: Todas las cepas y reactivos necesarios para el trabajo describen en los siguientes protocolos y proveedores están listados en la Tabla de materiales.
1. cultura del Mosquito larvas y adultos
Nota: Cepas susceptibles de insecticidas de los mosquitos están disponibles de la investigación de la Malaria y repositorio de referencia de reactivos. Recomienda las cepas son las siguientes: tensión de Liverpool (LVP) Aedes aegypti , Anopheles gambiae Kisumu (KISUMU1) cepa y cepa de Johannesburgo (JHB) de Culex quinquefasciatus .
- Larvas de mosquitos de la cultura de los huevos en una noche h 12 h día/12 ciclo a 28 ° C y 75-85% de humedad relativa (RH) en bandejas de plástico de 25 cm x 40 cm (~ 400 larvas por bandeja) descrito por Nuss29. Alimentar las larvas tierra gerbil (a. aegypti y gambiae y) o alimentos de peces de escama (C. quinquefasciatus). Para análisis larvales, recolectar las larvas en la tercera etapa de estadio larval (L3).
- Posterior de los mosquitos adultos de pupas que han sido transferidos a vasos de plástico y coloque dentro de jaulas de 20 L en un insectario bajo las condiciones descritas anteriormente. Mantener los mosquitos en la solución de azúcar de 20% como se describe en otra parte29. Recoger a adultos en 3-5 días post emergencia.
2. larva ensayo contacto (punto de monodosis o dosis respuesta ensayo)
Nota: El ensayo puede realizarse con químicos que son solubles en agua o dimetil sulfóxido (DMSO), siempre que la concentración final de DMSO en los pozos de prueba no exceda del 1%. Solventes alternativos pueden ser una opción, pero es esencial para confirmar primero que la concentración final no hace más que 10% de mortalidad en post exposición de 72 h. El ensayo puede realizarse como un único punto dosis o ensayo de dosis respuesta. Si realizando este último, se recomienda probar un rango de concentraciones (mínimo cinco), que abarca el esperado LC50.
- Los pocillos de una placa de tejido claro 24-bien la etiqueta como se muestra en la figura 1.
- Prepare una solución de la prueba de química en un tubo de 1,5 mL.
- Pesar cada química utilizando una balanza analítica y dependiendo de las características de solubilidad, vuelva a suspender en ddH estéril2O, DMSO u otro solvente orgánico adecuado de elección (ver figura 2).
Nota: Cálculos deben tomar en cuenta la pureza de la química. Por ejemplo, para la química que es 99% puro, disolver 10,1 mg en 1000 μl de acetona para obtener una solución al 1%. Sello con la película de parafina y almacenar a-20 ° C.
- Pesar cada química utilizando una balanza analítica y dependiendo de las características de solubilidad, vuelva a suspender en ddH estéril2O, DMSO u otro solvente orgánico adecuado de elección (ver figura 2).
- Determinar la concentración final de la prueba química que será evaluada y prepara diluciones seriadas de la solución madre en consecuencia, utilizar el disolvente adecuado.
Nota: La concentración y el volumen de la química y solvente pueden ser calculados usando la fórmula C1* V1= C2* V2 donde C1= concentración de la muestra 1, C2= concentración de la muestra 2, V1= volumen de de la muestra 1 y V2= volumen de muestra de 2. Ver el ejemplo que se muestra en la figura 2 y tabla 1.- Preparar una solución stock de 10 mM y diluciones seriadas según sea necesario para obtener concentraciones de ensayo deseada (Tabla 1B).
- Mediante una pipeta de transferencia plástica ancha, transferir cinco larvas L3 al pozo de una placa de ensayo de cultivo de tejidos; Las larvas L3 pueden ser reconocidas por su longitud (~ 2,5-3,5 mm) y ancho de la cápsula de la cabeza ~ 0,025 mm24. Suavemente Quite el agua con una pipeta de 1 mL y reemplácelo con el volumen deseado de ddH2O (véase abajo). Repetir para obtener n = 4 técnicos repeticiones por tratamiento (es decir, 20 larvas totales por tratamiento).
- Añadir el volumen adecuado de la prueba química a cada uno de los cuatro pozos de replicar en la placa de 24 pocillos de prueba y agite suavemente la placa para asegurar una mezcla uniforme de la química. Colocar la placa en una cámara de prueba o de crecimiento bajo condiciones constantes (por ejemplo, 25 ° C y ~ 75-85% RH es recomendado y un oscuro 12 h luz/12 h ciclo si es posible).
Nota: Para la reproducibilidad entre experimentos, asegúrese de posteriores ensayos se realizan bajo las mismas condiciones ambientales. - Registrar el número de muertos/no responde larvas en cada pozo en 30 min, 1, 1.5, 2, 3, 24, 48 y 72 h post exposición (o puntos del tiempo alternativo) en la hoja de puntuación (tabla 2). Golpee suavemente el costado de la placa. Si no se observa ningún movimiento, toque suavemente la larva con un palillo estéril. Puntuación de larvas que no responden a táctil tocando como "muerto".
Nota: Otros fenotipos morfológicos y de comportamiento pueden ser observados y pueden grabarse. - Corregir para la mortalidad de control utilizando la fórmula de Abbott modificada si se desea, como sigue:
Mortalidad (%) = (X-Y) * 100/(100-Y),
donde X = la mortalidad porcentual en la muestra tratada y Y = la mortalidad por ciento en el control. - Resultados de la gráfica como un histograma o curva logarítmica utilizando el software de elección como Graph pad Prism 6 o similar y calcular los valores de concentración letal (LC) con respecto al control.
- Repetir el ensayo utilizando un lote independiente de mosquito para obtener n = repeticiones de 3 o más biológicos.
3. adulto tópico ensayo (punto de monodosis o dosis respuesta ensayo)
Nota: El análisis de tópico adultos se lleva a cabo utilizando acetona como solvente. Solventes alternativos pueden ser una opción, pero es esencial para confirmar primero que la concentración final no hace más que 10% de mortalidad en post exposición de 48 h. El ensayo puede realizarse como un solo punto de ensayo de respuesta de dosis o dosis y se utiliza para determinar la dosis letal (LD). Si realizando este último, se recomienda probar un rango de concentraciones (mínimo cinco), que abarca el esperado LD50.
- Determinar el número de mosquitos adultos femeninos necesarios para completar el ensayo.
Nota: Un ensayo de dosis de punto con una química solo requiere un mínimo de 90 mosquitos (30 para el control positivo, 30 para el control negativo sólo acetona y 30 para la prueba de química). - 3 a 5 días de edad los mosquitos hembras adultos de la cultura y pasar a un cubo de plástico separadas 20 mL utilizando un aspirador (figura 3).
- Etiqueta 9 oz tazas de papel con el nombre y la concentración de la prueba de química. Dejar de lado cuadrados de malla 10 cm x 10 cm y bandas de goma por cada taza (ver figura 4).
- Seleccionar un insecticida existente como un control positivo (por ejemplo, los piretroides sintéticos, bifenthrin) y preparar una solución stock de 1% (10 μg/μl) en acetona.
Nota: Cálculos deben tomar en cuenta la pureza de la química. Por ejemplo, para la química que es 99% puro, disolver 10,1 mg en 1000 μl de acetona para obtener una solución al 1%. Sello con la película de parafina y almacenar a-20 ° C. - Usando el mismo procedimiento que el anterior, prepare una solución de la prueba de química.
Nota: Muchas pruebas químicas son altamente lábiles y soluciones preferentemente deben hacerse fresco cada vez que se realiza la prueba biológica. - Preparar diluciones seriadas de control positivo y pruebas químicas de soluciones como se muestra en la figura 5 , utilizando frascos de vidrio de 20 mL previamente lavados con acetona.
- Purgar una jeringa de vidrio de 1 mL con acetona, llene con acetona y garantizar en el micro-aplicador ajustado para proporcionar un volumen de 0.25 μl.
- Trabajar en lotes de diez, quite 3 - 5 - día viejos mosquitos hembra adultos de jaulas con un aspirador y anestesiar hasta cinco min a 4 ° C en un refrigerador o en hielo. A continuación, transferir mosquitos a un plato de Petri y el lugar en hielo por 10 min.
- Trabajando rápidamente, quitar una sola hembra con una pinza fina y 0.25 μl de solución de ensayo se aplica en el tórax dorsal con el micro-aplicador de jeringa. Confirman entrega de química por la observación con un microscopio de disección para cada mosquito recibe el volumen apropiado de la prueba de química.
- Transferir el mosquito a una taza de papel etiquetado descansando en el hielo y repetir nueve veces para obtener n = 10 mosquitos tratados. Sello de los mosquitos en la Copa con una malla cuadrada fijados con una goma elástica y traslado a una cámara de tina o crecimiento plástico bajo condiciones constantes de 28 ° C y 75-85% RH (en 12 h día/12 h noche ciclo es preferible).
- Repite el experimento anterior dos veces para obtener n = 3 repeticiones técnicas (es decir, 30 total de mosquitos) por grupo de tratamiento o control.
- Repita los pasos 3.7-3.10 primero con la química de la prueba y luego del control positivo.
Nota: Otro control útil incluir si se dispone de suficientes mosquitos es un "en blanco" de 30 mosquitos anestesiados que no recibe prueba de química o solvente. - Registrar el número de mosquitos "muerto/no responde" en 30 min, 60 min, 2, 24 y 48 h post exposición (o puntos del tiempo alternativo) utilizando la hoja de puntuación (tabla 3). Puntuación de los mosquitos "muerto/no responde" si demuestran falta de movimiento, definida como poner a un lado o en la parte posterior y con la incapacidad de volar.
- Si lo desea, corregir para la mortalidad de control utilizando la fórmula de Abbott modificada como sigue:
Mortalidad (%) = (X-Y) * 100/(100-Y),
donde X = la mortalidad porcentual en la muestra tratada y Y = la mortalidad por ciento en el control. - Mostrar los resultados como un histograma o una curva exponencial. Para un ensayo de dosis respuesta, calcular la DL50, LD75 o LD90 valor para la prueba de química con respecto al control.
- Repetir el análisis al menos dos veces con diferentes lotes de mosquitos para obtener n = repeticiones de 3 o más biológicos.
4. adultos alimentan de sangre análisis (punto de monodosis o dosis respuesta ensayo)
- Recogemos aproximadamente 150 4-5-día viejo hembra mosquitos adultos y traslado a una jaula aparte. Repita el procedimiento para obtener 6 jaulas si se realiza un ensayo de dosis respuesta. Retire la fuente de antes de la 1-24 h de azúcar para el ensayo de alimentación.
- Prepare una solución de química como se describe anteriormente, representa la pureza de la química (una solución típica es de 80 mM en agua o tampón salino) y posteriormente preparar diluciones seriadas en agua tampón como sea necesario.
- Agregar 40 μl de cada una de las diluciones a 960 μl de sangre de conejo desfibrinado para obtener la concentración deseada de la prueba. Película de la membrana se aplica a una unidad de alimentación y sellarlo con un anillo de goma. Transferir 1 mL de sangre a través de pipeta y coloque la unidad de alimentación a una unidad de calefacción.
- Suavemente hisopo de la membrana de la superficie con recién hecho solución 10% de ácido láctico y el lugar la unidad de alimentación en la jaula de los mosquitos adultos. Cubrir la jaula con un paño oscuro o una bolsa de basura negra y deje que los mosquitos alimentar durante una hora.
- Repita los pasos 4.2-4.4 para el resto de soluciones de prueba y el control negativo (sangre solamente).
- Al término de la alimentación, colocar baldes a 4 ° C en un refrigerador durante 5 min anestesiar los mosquitos. Eliminar mosquitos macho y los mosquitos hembras no alimentados y contar y registrar el número total de alimentó y alimenta parcialmente los mosquitos por la examinación del abdomen.
- Mantener los mosquitos hembras alimentados parcialmente y totalmente, con el objetivo de un mínimo de 50 mosquitos alimentados con sangre por dosis.
- Transferencia de cubos a una cámara de tina o crecimiento plástico bajo condiciones constantes de 28 ° C y 75-85% RH (en 12 h día/12 h noche ciclo es preferible).
- Registrar el número total de mosquitos muertos/no responde en 0.5, 1, 1.5, 2, 24, 48 y 72 h (o momentos alternativos como deseado) usando la puntuación de la hoja (tabla 4).
- En el tercer día post sangre alimentación, introducir una taza de huevo en la jaula y recoger los huevos en un periodo de 72 h. Contar el número total de huevos producidos por tratamiento con un microscopio de disección.
- Calcular el porcentaje mortalidad y fecundidad en función del número total de mosquitos alimentados para cada grupo de tratamiento y el control. Mortalidad de control utilizando la fórmula de Abbott modificada si se desea corregir.
- Mostrar los datos de toxicidad y la fecundidad como una trama de histograma o curva exponencial (si se realiza un análisis de respuesta de dosis) utilizando el software de elección. Si se realiza un ensayo de dosis respuesta, calcular la DL50, LD75 o LD90 valor para la prueba de química con respecto al control.
- Repetir el análisis al menos dos veces con diferentes lotes de mosquitos para obtener n = repeticiones de 3 o más biológicos.
Resultados
La figura 6 muestra la mortalidad porcentaje de L3 Ae. aegypti después de la exposición a cinco dosis de la antagonista del receptor de dopamina, amitriptilina en comparación con el agua solamente (negativo) control a las 24, 48 y 72 h. En este ejemplo, los datos recogidos en cada uno de los puntos del tiempo muestra una típica curva logarítmica y revelan un efecto dependiente de la dosis de amitriptilina en la mortalidad larval. El valor de50 LC disminuye a lo largo del tiempo del experimento y se puede calcular utilizando los datos de 72 h (es decir, punto medio de la curva logarítmica).
La figura 7 muestra la mortalidad porcentaje de 3 - 5 días de edad las hembras Ae. aegypti después de la exposición a una dosis de 400 μm (10 μg/μl) de la antagonista del receptor de dopamina, amitriptilina y en comparación con los piretroides sintéticos, bifenthrin-positive control (grado técnico; 500 pg/μL), sólo acetona negativo y mosquitos sin tratar (en blanco). En este ejemplo, amitriptilina y Bifentrina causan mortalidad de adultos significativa en relación con el control negativo. Tenga en cuenta que la mortalidad de adultos disminuye con el tiempo, probablemente debido a la desintoxicación metabólica de la prueba de química.
La figura 8 muestra la mortalidad porcentaje (eje izquierdo) de la hembra adulta de 3-5 días Ae. aegypti alimentados con una comida de sangre una de cuatro dosis del antagonista del receptor de dopamina, amitriptilina y la fecundidad (eje derecho; huevo promedio cuenta / hembra) la primera exposición de post ciclo gonotrophic en comparación con los mosquitos de control (sólo alimentados con sangre; control negativo). Los datos revelan que no existe ningún efecto significativo de la amitriptilina en la mortalidad de adultos en relación con el control pero demostrar que amitriptilina aumenta significativamente la fecundidad a la dosis más alta (400 μm).
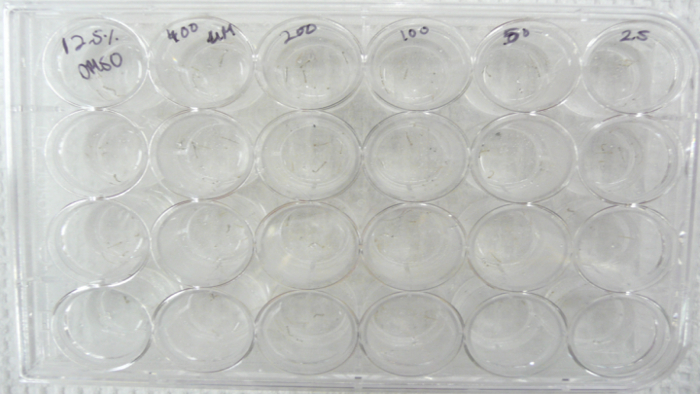
Figura 1 . Configuración del análisis larval dosis respuesta. Imagen que muestra la configuración del análisis de respuesta de dosis larvas realizada con larvas de Aedes aegypti L3 en la placa de 24 pozos.
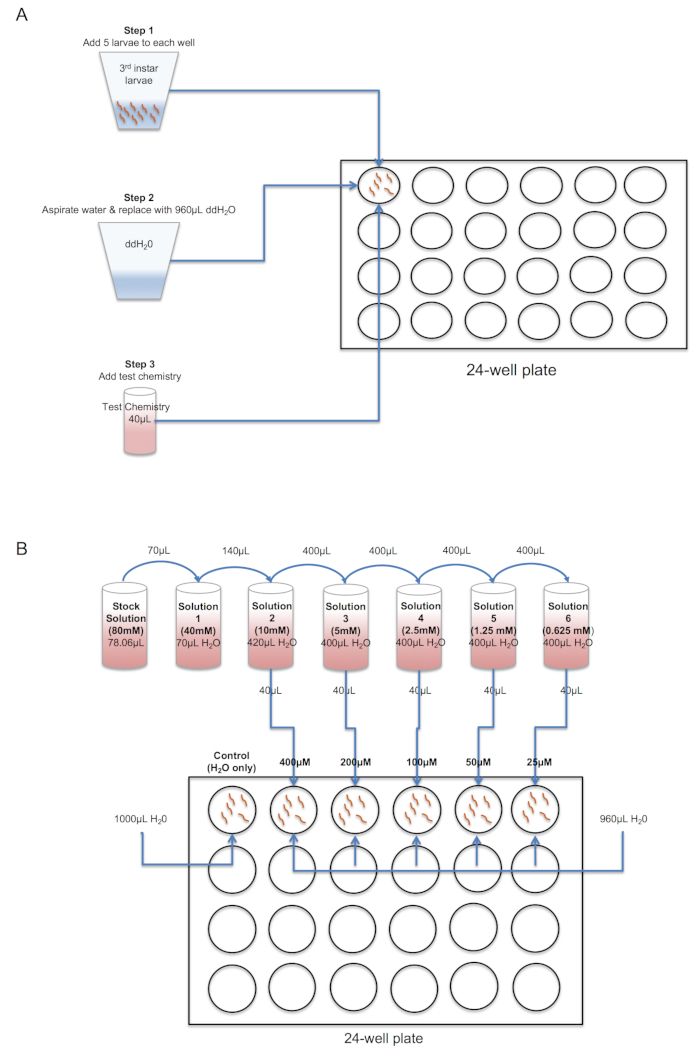
Figura 2 . Esquema muestra procedimiento para el sistema del punto (A) única dosis o análisis larval de respuesta (B) dosis en placa de 24 pozos. Tras traslado de cinco larvas L3 de a pozos, exceso de agua se extrae mediante pipeta suavemente y reemplazado con ddH fresco, estéril2O. A continuación, stock diluciones seriadas de la prueba química preparadas y agregar a un volumen final de 1 mL/pozo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3 . Cultura de los mosquitos adultos. Imagen que muestra 20 L cubo de plástico utilizado para el cultivo de mosquitos adultos y uso de un aspirador para eliminar los mosquitos.

Figura 4 . Adultos tópico ensayo realizado con hembra de 4-5 días Aedes aegypti. Después del tratamiento con química o solventes, adultos de mosquitos se colocan en vasos de papel y transferidos a una cámara de prueba para la duración del ensayo.
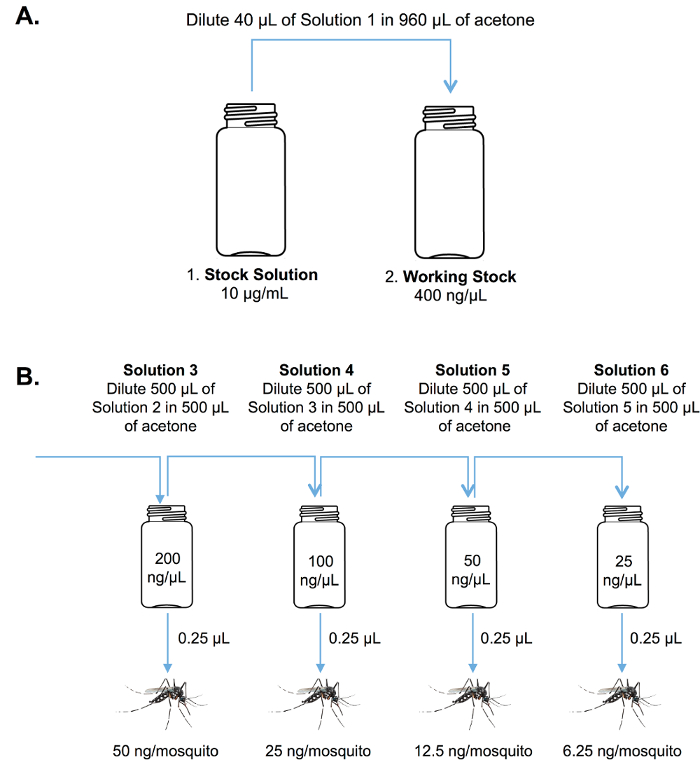
Figura 5 . Stock y diluciones seriadas. Diagrama esquemático mostrando el procedimiento para la preparación de la acción (A) y (B) prueba de serie soluciones para el análisis de tópico de adultos. Haga clic aquí para ver una versión más grande de esta figura.
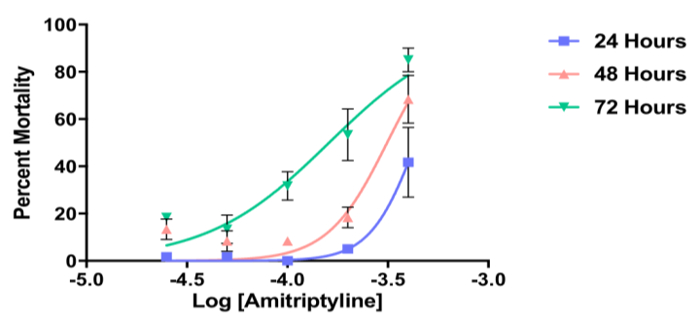
Figura 6 . Datos representativos de un ensayo de respuesta larvas dosis contacto. Datos representativos de un ensayo de respuesta de dosis contacto larvas mostrando por ciento mortalidad de larvas de Aedes aegypti L3 luego del contacto con el antagonista del receptor de dopamina, amitriptilina en 24, 48 y 72 h. Cada punto representa la media en μm ± SEM. datos representan n = 3 réplicas biológicas.
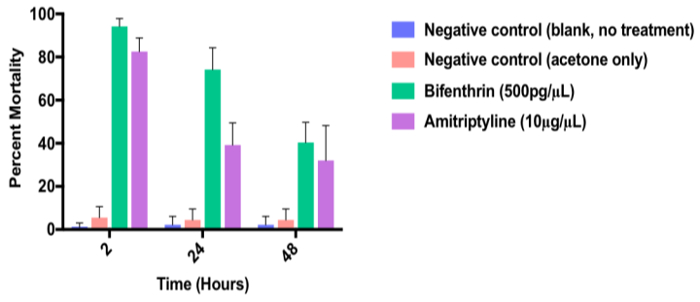
Figura 7 . Datos representativos de un ensayo de respuesta del adulto dosis tópica. Datos representativos de un ensayo de respuesta de dosis tópica adultos mostrando toxicidad del antagonista del receptor de dopamina, amitriptilina (10 μg/μl) a 3-5 días vieja hembra Aedes aegypti en relación con el piretroide sintético, bifenthrin (500 pg/μL) positivo control) y control (sólo vehículos de acetona) en la 2, 24 y 48 h. negativo Los datos representan n = 3 réplicas biológicas. Barras de error indican SEM.
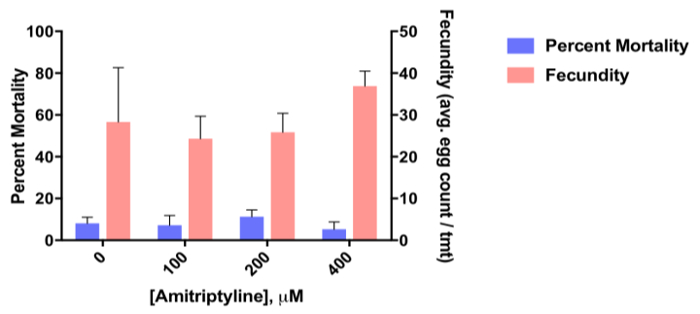
Figura 8 . Datos representativos de un ensayo de ingestión adultos. Datos representativos de un ensayo de ingestión adultos mostrando toxicidad del antagonista del receptor de dopamina, amitriptilina a 100 μm, 200 μm y μm 400 dosis 3-5 día vieja hembra adulto Aedes aegypti e impacto en la fecundidad (expresado como el huevo total promedio cuenta por hembra en el primer ciclo de gonotrophic). Los datos representan n = 3 réplicas biológicas ± SEM.
| A. ensayos de dosis monopunto con tres químicos | |||||
| Química | Concentración (400 uM) | ||||
| Amitriptilina | 80 mM Stock: 2 mg de amitriptilina X 98% (pureza de polvo) X 0,001 g / 1 mg X 1 mol de 313,86 g X 1 L/0,08 mol X 106 μl/L = 78.06 μl de agua. | ||||
| Diluciones seriadas: Diluir 1:2 acciones con ddH2O y luego 1:4 para alcanzar 10 mM. Agregar 40 μl del stock de 10 mM que bien que contiene 960 μl de ddH20 para lograr una concentración final de 400 μm/pozo. Preparar diluciones seriadas de acción 1:2 hasta alcanzar 5 mM, 2,5 mM, 1,25 mM y las poblaciones de 0,625 mM de 10 mM. | |||||
| CIS-(z)-flupentixol | 80 mM Stock: 2 mg de cis (z) flupentixol X 98% (pureza de polvo) X 0,001 g / 1 mg X 1 mol/507.44 g cis (z) flupentixol L/0.08 X 1 mol X 106 μl/L = 48.28 μl de agua. | ||||
| Diluciones seriadas: Como arriba. | |||||
| Amitraz | 80 mM Stock: 2 mg de Amitraz X 0,001 g / 1 mg X 1 mol/293,4 g de amitraz L/0.08 X 1 mol X 106 μL/1 L = 85.21 μl de DMSO (Nota: Amitraz es solamente soluble en DMSO). | ||||
| Diluciones seriadas: Como arriba. | |||||
| Ensayo de respuesta B. dosis | |||||
| Química | Dosis 1 | Dosis 2 | Dosis 3 | Dosis 4 | Dosis 5 |
| 400 ΜM | 200 ΜM | 100 ΜM | 50 ΜM | 25 ΜM | |
| por ejemplo, amitriptilina, cis-(Z)-flupentixol o amitraz | 40 ΜL | 40 ΜL | 40 ΜL | 40 ΜL | 40 ΜL |
| stock de 10 mM | stock de 5 mM | stock de 2,5 mM | acción de 1,25 mM | 0,625 mM Stock | |
Tabla 1. Cálculos de ejemplo para Aedes aegypti L3 larvas (A) único punto ensayo dosis y (B) dosis respuesta análisis.
Tabla 2. Hoja de puntuación de ejemplo utilizada para grabar datos desde el análisis de respuesta de dosis larvas de mosquito. Control, sólo agua o agua con DMSO 1% u otro solvente solamente. Dosis típicas usadas para probar químicos de antagonista de molécula pequeña como la amitriptilina son 25 μm, 50 μm, 100 μm, 200 μm y μm 400.
| Análisis de tópicos mosquito adulto (3-5 días) | ||||||
| Fecha de inició: | ||||||
| Investigador: | ||||||
| Especie, cepa: | ||||||
| Tipo de ensayo: Respuesta de dosis, dosis de punto único | ||||||
| A. mortalidad (Nº de mosquitos muertos) | ||||||
| Tiempo (horas) | Dosis 1 | Dosis 2 | Dosis 3 | Dosis 4 | Dosis 5 | Control |
| 0.5 | ||||||
| 1 | ||||||
| 1.5 | ||||||
| 2 | ||||||
| 2.5 | ||||||
| B. % mortalidad | ||||||
| Tiempo (horas) | Dosis 1 | Dosis 2 | Dosis 3 | Dosis 4 | Dosis 5 | Control |
| 0.5 | ||||||
| 1 | ||||||
| 1.5 | ||||||
| 2 | ||||||
| 2.5 | ||||||
Tabla 3. Hoja de puntuaciones del ejemplo utilizada para registrar datos de ensayo adultos dosis tópica respuesta.
| Ensayo de ingestión mosquito adulto (3-5 días) | ||||||
| Fecha de inició: | ||||||
| Investigador: | ||||||
| Especie, cepa: | ||||||
| Tipo de ensayo: Respuesta de dosis, dosis de punto único | ||||||
| A. número alimentado los mosquitos | ||||||
| Dosis 1 | Dosis 2 | Dosis 3 | Dosis 4 | Dosis 5 | Control | |
| Alimentados con | ||||||
| No Fed | ||||||
| Total | ||||||
| % Reserva | ||||||
| % No Fed | ||||||
| B. mortalidad (Nº de mosquitos muertos) | ||||||
| Tiempo (horas) | Dosis 1 | Dosis 2 | Dosis 3 | Dosis 4 | Dosis 5 | Control |
| 2 | ||||||
| 24 | ||||||
| 48 | ||||||
| 72 | ||||||
| C. % mortalidad | ||||||
| Tiempo (horas) | Dosis 1 | Dosis 2 | Dosis 3 | Dosis 4 | Dosis 5 | Control |
| 2 | ||||||
| 24 | ||||||
| 48 | ||||||
| 72 | ||||||
Tabla 4. Hoja de puntuaciones en el ejemplo se utiliza para registrar los datos de ensayo adultos de alimentan de sangre. Dosis típicas usadas para probar químicos de antagonista de molécula pequeña como la amitriptilina son 400 μm, 200 μm, 50 μm y 100 μm.
Discusión
Insecticidas son herramientas poderosas para combatir enfermedades transmitidas por mosquitos como la malaria25, dengue y Zika26. Insecticida de amplio uso ha producido las poblaciones de mosquitos que son resistentes al control químico, líder en el desarrollo de resistencia a los insecticidas, que se considera la amenaza más grande para continuado control de la enfermedad. La última década ha visto un aumento dramático en las poblaciones de Anopheles spp resistentes a piretroides sintéticos (SPs) utilizados en mosquiteros en África7. Poblaciones de Aedes albopictus, un vector del dengue y Zika, se han divulgado en la Florida y Nueva Jersey que son resistente a organofosforados6. Asimismo, se ha documentado resistencia al DDT y piretroides en poblaciones de Anopheles y Aedes spp. en Colombia27,28. Hay necesidad urgente de desarrollar nuevos larvicidas y adulticidas que se unen a diversos orthosteric o sitios alostéricos en dianas moleculares conocidos o que afectar nuevos objetivos (es decir, nuevos químicos de MoA)29,30 y tienen un impacto ambiental mínimo. Existe también un creciente reconocimiento del potencial alrededor de endectocidas para el control de mosquitos31,32,33.
Para facilitar el rápido desarrollo de estos productos, describimos una serie de protocolos diseñados para evaluar la toxicidad de los químicos de la molécula pequeña mosquito larvas y adultos a través de dos rutas de entrega - contacto e ingestión. Protocolos como la prueba de susceptibilidad de la WHO y el ensayo de la botella de CDC son de uso común para evaluar la toxicidad y repelencia de formulaciones insecticidas existentes1,2. Sin embargo, estos ensayos tienen limitaciones para el análisis de entidades químicas nuevas veladas (NCEs) y no son susceptibles de probar gran cantidad de químicos en rendimiento moderado o alto.
Aquí describimos un análisis larval estándar para evaluar rápidamente NCEs en dosis del único punto que pueden escalar para análisis de alto rendimiento. También se describe una adaptación de un análisis desarrollado por la LITE21 para evaluar la toxicidad de contacto de la química de la molécula pequeña a los mosquitos adultos. Finalmente, describimos un ensayo de ingestión para evaluar toxicidad de NCEs entregado por medio de la harina de sangre a los mosquitos hembra adultos y explorar potenciales endectocida. Estos análisis larvales y adulto pueden realizarse en un rango de dosis para determinar valores de LC y LD, respectivamente, y ensayos de contacto tanto larvas como adultos se pueden realizar en comparación con uno o más formulaciones químicas existentes. El análisis de tópico adultos también permite el cálculo de los valores de LD por mosquitos individuales. Los protocolos se pueden realizar con especies de Aedes, Anopheles y Culex16,29 y podrían modificarse para adaptarse a las características biológicas específicas de una especie, si así lo desea. En nuestra experiencia, mosquitocidal químicas exhiben típicamente amplia actividad a través de estos tres géneros16,29, pero no hay valor para la evaluación de la selectividad de especies.
Los ensayos son un punto de partida para detectar rápidamente múltiples químicos para actividad insecticida. Los químicos que presentan toxicidad en uno o más ensayos podrían ser seleccionados para mayores análisis mediante análisis secundarios y terciarios. Los ejemplos incluyen el ensayo tarsal LITE y azúcar alimentación análisis34,35. La selección de ensayos adicionales se determina típicamente por consideraciones alrededor de mercado esperado y aplicación, con resultados proporcionando penetraciones a los modos de entrega de producto posible. En los resultados representativos que se muestra a continuación, exploramos la toxicidad de amitriptilina, un antagonista de los receptores de dopamina mamíferos e invertebrados que se ha evaluado para potencial como una novela MoA insecticida10,12, 13 , 16. amitriptilina exhibe toxicidad en larvas y adultos de Ae. aegytpi en el rango de μg sugiriendo larvicidos y actividad adulticidal y establecer el fundamento para una exploración de una serie de química basados en amitriptilina para identificar análogos con alta potencia. Se observó ningún efecto significativo sobre la mortalidad o fecundidad en Ae. aegypti expuestos a amitriptilina en la harina de sangre. Aunque no se conoce la estabilidad de la química en desfibrinado sangre y la dosis efectiva recibida por mosquito, notables limitaciones del ensayo, los datos sugieren que amitriptilina y otros compuestos activos de GPCR pueden tener poco potencial como endectocidas, en por lo menos en estado velado.
Las precauciones para limitar la variación biológica entre ensayos son esenciales. Todos los ensayos deben realizarse bajo condiciones estándar de temperatura y humedad, preferiblemente en una cámara de crecimiento de insectos, para garantizar la reproducibilidad. Es imperativo estandarizar procedimientos para marcar los extremos fenotípicos como estos pueden ser muy subjetivos, conduce a una variación significativa en los datos registrados por el personal de laboratorio diferentes. El análisis larval es más adecuado para la evaluación de químicos que son solubles en agua, aunque el ensayo se puede realizar usando disolventes orgánicos como el DMSO siempre que la concentración final es de menos del 1% por pozo. Se reconocen varias limitaciones para el análisis de tópico adultos. En primer lugar, es necesario trabajar rápidamente durante la preparación de diluciones seriadas y aplicar dosis como portador (acetona) es altamente volátil y evaporación puede producir variación en la cantidad de química entregado. En segundo lugar, se debe tener cuidado para limitar el período de anestesia ya que esto puede contribuir a la mortalidad. Debe señalarse también que solventes tales como acetona pueden producir un efecto "knock-down" rápido en las primeras horas varios del análisis de tópico, que no se debe confundir con efectos debido a la química de la prueba. Observamos que el volumen de la comida de sangre del mosquito varía entre individuos, que complica la evaluación de la dosis recibida por adulto en el análisis de la ingesta de adultos. Por último, análisis de datos no deben considerarse en casos donde la mortalidad en el control negativo supera el 10%.
Productos que actúan de forma sinérgica son cada vez más reconocidos por su potencial para ampliar la utilidad de los productos existentes y proporcionar control de las poblaciones de plagas resistentes al insecticida15,16,36. Análisis larvales se han utilizado para examinar el sinergismo entre el pesticida de formamidine, amitraz y una variedad de químicos que alteran la octopamina invertebrados receptores14,15. El análisis larval y adulto tópico ensayo descrito son adecuados para la evaluación de efectos aditivos o sinérgicos entre combinaciones de pruebas químicas. Observamos que los sinergistas tales como el butóxido de piperonilo (PBO) pueden ser incorporados en cada uno de los tres ensayos aquí descritos.
Los ensayos anteriormente descritos proporcionan una serie experimental estandarizada para la evaluación de fármacos de molécula pequeña, velado contra etapas de la vida de mosquitos acuáticos y terrestres. Estos ensayos están diseñados para evaluar toxicidad y ofrecen varias ventajas sobre los existentes de ensayos en común uso. Importante, los ensayos son susceptibles a la automatización y pueden realizarse a escala industrial para permitir la evaluación de miles de compuestos de la prueba. Por último, como el campo considera el desarrollo de productos que actúan mediante el nuevo modelo, incluyendo vía la interrupción de nuevas dianas moleculares y las vías bioquímicas, será fundamental para marcar los extremos fenotípicos múltiples además de aquellos como la mortalidad y parálisis. Los análisis anteriores permiten tales investigaciones, dando un paso hacia tecnologías insecticida altamente innovadoras del mañana.
Divulgaciones
Los autores no declaran conflictos de interés.
Agradecimientos
Los autores agradecen a H. Ranson, Liverpool School of Tropical Medicine para ayuda con ensayo desarrollo y provisión del protocolo LITE, y M. Scharf, Universidad de Purdue para asesoramiento en análisis de diseño.
Materiales
| Name | Company | Catalog Number | Comments |
| Insecticide susceptible mosquito strains | Malaria Research and Reagent Reference Repository | https://www.beiresources.org/MR4Home.aspx; Recommended strains: Aedes aegypti Liverpool (LVP) strain, Anopheles gambiae Kisumu (KISUMU1) strain and Culex quinquefasciatus Johannesburg (JHB) strain | |
| Acetone | Mallinckrodt Chemical | CAS 67-64-1 | Use for dilutions and control |
| Amitraz | Sigma-Aldrich | CAS 33089-61-1 | Requires dilution in DMSO |
| Amitriptyline | Sigma-Aldrich | CAS: 549-18-8 | Can be diluted in acetone |
| Bifenthrin | Sigma-Aldrich | CAS: 51529-01-2 | Synthetic pyrethorid used as positive control |
| Cis-(Z)-flupenthixol | Sigma-Aldrich | CAS: 51529-01-2 | Pharmacologically tested as disruptor of dop-like receptors |
| Defibrinated rabbit blood | Hemostat | DRB0100 | Blood source for adapted mosquitoes to artificial feeding |
| Dimethylsulphoxide (DMSO) | Sigma-Aldrich | MKBF2985 | Organic solvent used to disolve amitraz |
| Hemotek membrane feeding system | Hemotek Ltd | Serial no. 1303 | Used for feeding mosquitoes |
| Micro-applicator | Burkard Manufacturing Co. | - | Tool needed for topical application experiments |
| 24-well cell culture plate with lid | Corning Incorporated | 3526 | - |
| Advantage rubber bands | Alliance Rubber Co. | - | Used to seal the paper cups |
| Glass syringe (1 ml) | Becton Dickinson and Co. | 512004 | Needed for the micro-applications. Glass is better than plastic |
| Disposable scintillation vials (20 ml) | Fisher Scientific | 74505-20 | Glass vials prevent evaporation |
| Tulle fabric, white | Walmart | - | - |
| Paper cups | Dixie Consumer Products LLC. | PF15675/13D | Used to keep adult mosquitoes in adult topical assays |
| Petri dishes (150 mm) | Corning Life Sciences | - | Used to maintain the mosquitoes "slept" on cold without direct contact with ice |
| Transfer pipettes | Fisher Scientific | 13-711-7M | Used to sort larvae |
| Stereo microscope | Olympus | SZ6045 | Used to score larval assays and perform micro-applications |
| Tweezers (fine) | Fontax | - | Used to handle adult mosquitoes |
Referencias
- World Health Organization. A global brief on vector-borne diseases. , Available from: www.who.int/about/Licensing/copyright_form/en (2014).
- World Health Organization. Vector-borne diseases. , Available from: http://www.who.int/mediacentre/factsheets/fs387/en (2016).
- World Health Organization. Report by the Secretariat. Neglected tropical diseases; Prevention, control, elimination and eradication. , Available from: http://www.who.int/neglected_diseases/A66_20_Eng.pdf (2013).
- Tolle, M. A., et al. Mosquito-borne diseases. Curr Probl Pediatr Adolesc Health Care. 39 (4), 97-140 (2009).
- Chen, C. D., et al. Dengue vectors surveillance in endemic areas in kuala lumpur city centre and selangor state, malaysia. Dengue Bulletin. 30, (2006).
- Marcombe, S., et al. Insecticide resistance status of united states populations of Aedes albopictus and mechanisms involved. PLoS ONE. 9 (7), e101992(2014).
- Ranson, H., et al. Pyrethroid resistance in African anopheline mosquitoes: what are the implications for malaria control? Trends in Parasitology. , 1-8 (2010).
- Hemingway, J., Ranson, H. Insecticide resistance in insect vectors of human disease. Annual Review of Entomology. 45, 371-391 (2000).
- Hemingway, J., Beaty, B. J., Rowland, M., Scott, T. W., Sharp, B. L. The Innovative Vector Control Consortium: improved control of mosquito-borne diseases. Trends in Parasitology. 22 (7), 308-312 (2006).
- Meyer, J. M., et al. A "genome-to-lead" approach for insecticide discovery: Pharmacological characterization and screening of Aedes aegypti D 1-like dopamine receptors. PLOS Neglected Tropical Diseases. 6 (1), e1478(2012).
- World Health Organization. Instructions for determining the susceptibility or resistance of mosquito larvae to insecticides. , Available from: http://apps.who.int/iris/handle/10665/69615 (1981).
- Hill, C. A., et al. Re-invigorating the insecticide discovery pipeline for vector control: GPCRs as targets for the identification of next gen insecticides. Pestide Biochemistry and Physiology. 106 (3), 141-148 (2013).
- Conley, J. M., et al. Evaluation of AaDOP2 Receptor antagonists reveals antidepressants and antipsychotics as novel lead molecules for control of the yellow fever mosquito, Aedes aegypti. Journal of Pharmacology and Experimental Therapeautics. 352 (1), 53-60 (2015).
- Ahmed, M. A. I., Matsumura, F. Synergistic actions of formamidine insecticides on the activity of pyrethroids and neonicotinoids against Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology. 49 (6), 1405-1410 (2012).
- Ahmed, M. A. I., Vogel, C. F. A. Synergistic action of octopamine receptor agonists on the activity of selected novel insecticides for control of dengue vector Aedes aegypti (Diptera: Culicidae) mosquito. Pesticide Biochemistry and Physiology. 120, 51-56 (2015).
- Hill, C. A., et al. Comparative pharmacological characterization of D1-like dopamine receptors from Anopheles gambiae, Aedes aegypti and Culex quinquefasciatus suggests pleiotropic signaling in mosquito vector lineages. Parasites Vectors. 9 (1), 192(2016).
- Centers for Disease Control and Prevention. Guideline for evaluating insecticide resistance in vectors using the CDC bottle bioassay. , Available from: https://www.cdc.gov/malaria/resources/pdf/fsp/ir_manual/ir_cdc_bioassay_en.pdf (2011).
- World Health Organization. Test procedures for insecticide resistance monitoring in malaria vector mosquitoes. , Available from: http://apps.who.int/iris/bitstream/10665/250677/1/9789241511575-eng.pdf (2013).
- Geneva: World Health Organization. Guidelines for efficacy testing of insecticides for indoor and outdoor ground-applied space spray applications control of neglected tropical diseases who pesticide evaluation scheme. , Available from: http://www.who.int/iris/handle/10665/70070 2-53 (2009).
- Pridgeon, J. W., et al. Susceptibility of Aedes aegypti, Culex quinquefasciatus Say, and Anopheles quadrimaculatus Say to 19 pesticides with different modes of action. Journal of Medical Entomolog. 45 (1), 82-87 (2008).
- Liverpool Insect Testing Establishment. , Available from: http://www.lite-testing-facility.com (2018).
- Aïzoun, N., et al. Comparison of the standard WHO susceptibility tests and the CDC bottle bioassay for the determination of insecticide susceptibility in malaria vectors and their correlation with biochemical and molecular biology assays in Benin, West Africa. Parasites Vectors. 6, 147(2013).
- Owusu, H. F., Jančáryová, D., Malone, D., Müller, P. Comparability between insecticide resistance bioassays for mosquito vectors: time to review current methodology? Parasites Vectors. 8, 357(2015).
- Savignac, R., Maire, A. A simple character for recognizing second and third instar larvae of five Canadian mosquito genera (Diptera: Culicidae). , (1981).
- Bhatt, S., et al. Coverage and system efficiencies of insecticide-treated nets in Africa from 2000 to 2017. eLife. 4, 174(2015).
- Zaim, M., et al. Alternative insecticides: an urgent need. Trends in Parasitology. 18 (4), 161-163 (2002).
- Fonseca, I., Quinoñes, M. L. Resistencia a insecticidas en mosquitos (Diptera: Culicidae): mecanismos, deteccion y vigilancia en salud publica. Revista Colombiana de Entomologia. 31 (2), 107-115 (2005).
- Fonseca-Gon Alez, I., Qu, M. L., Lenhart, A., Brogdon, W. G. Insecticide resistance status of Aedes aegypti (L.) from Colombia. Pest Management Science. 67, 430-437 (2011).
- Nuss, A. B., et al. Dopamine receptor antagonists as new mode-of-action insecticide leads for control of Aedes and Culex mosquito vectors. PLOS Neglected Tropical Diseases. 9 (3), 1-19 (2015).
- Shidrawi, G. R. A WHO Global Programme for monitoring vector resistance to pesticides. Bulletin of the World Health Organization. 68 (4), 403(1990).
- Sylla, M., Kobylinski, K. C., Foy, B. D. Gates grand challenges explorations award: endectocides for controlling transmission of mosquito-borne diseases. Malariaworld Journal. 4 (5), (2013).
- Foy, B. D., Kobylinski, K. C., da Silva, I. M., Rasgon, J. L., Sylla, M. Endectocides for malaria control. Trends in Parasitology. 27 (10), 423-428 (2011).
- Chaccour, C. J., et al. Ivermectin to reduce malaria transmission: a research agenda for a promising new tool for elimination. Malaria Journal. 12 (1), 153(2013).
- Olson, D. M., Fadamiro, H., Lundgren, J. G., Heimpel, E. Effects of sugar feeding on carbohydrate and lipid metabolism in a parasitoid wasp. Physiol Entomol. 25, 17-26 (2000).
- World Health Organization. Report of the WHO Informal Consultation. Evaluation and testing of insecticides. , Available from: http://www.who.int/whopes/resources/ctd_whopes_ic_96.1/en/ (1996).
- Huang, Q., Deng, Y., Zhan, T., He, Y. Synergistic and antagonistic effects of piperonyl butoxide in fipronil-susceptible and resistant rice stem borrers, Chilo suppressalis. Journal of Insect Science. 10, 182(2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados