Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
In Situ Microscopía para la determinación en tiempo real de la morfología de una sola célula en bioprocesos
En este artículo
Resumen
Se desarrolló un dispositivo fotoóptico de microscopía in situ para monitorear el tamaño de las células individuales directamente en la suspensión celular. La medición en tiempo real se lleva a cabo mediante el acoplamiento de la sonda esterilizable fotoóptica a un análisis de imagen automatizado. Los cambios morfológicos aparecen con dependencia del estado de crecimiento y las condiciones de cultivo.
Resumen
La monitorización in situ en bioprocesos microbianos se limita principalmente a las propiedades químicas y físicas del medio(por ejemplo,el valor de pH y la concentración de oxígeno disuelto). Sin embargo, la morfología de las células puede ser un indicador adecuado para condiciones óptimas, ya que cambia con dependencia del estado de crecimiento, acumulación de productos y estrés celular. Además, la distribución del tamaño de una sola célula proporciona no sólo información sobre las condiciones de cultivo, sino también sobre la heterogeneidad de la población. Para obtener dicha información, se desarrolló un dispositivo fotoóptico de microscopía in situ 1 para permitir el seguimiento de la distribución del tamaño de una sola célula directamente en la suspensión celular en biorreactores. Un análisis de imagen automatizado se acopla a la microscopía basada en un modelo de red neuronal, que se entrena con imágenes anotadas por el usuario. Varios parámetros, que se obtienen de las capturas del microscopio, están correlacionados con el proceso de características relevantes de las células, como su actividad metabólica. Hasta ahora, la serie de sondas de microscopía in situ presentadas se aplicaba para medir el tamaño del pellet en suspensiones de hongos filamentosos. Se utilizó para distinguir el tamaño de una sola célula en el cultivo de microalgas y relacionarlo con la acumulación de lípidos. La forma de las partículas celulares estaba relacionada con el brote en los cultivos de levadura. El análisis de microscopía generalmente se puede dividir en tres pasos: (i) adquisición de imágenes, (ii) identificación de partículas y (iii) análisis de datos, respectivamente. Todos los pasos tienen que ser adaptados al organismo, y por lo tanto se requiere información específica anotada para lograr resultados confiables. La capacidad de monitorear los cambios en la morfología celular directamente en línea o en línea (en un by-pass) permite valores en tiempo real para la supervisión y el control, en el desarrollo de procesos, así como en la escala de producción. Si los datos fuera de línea se correlacionan con los datos en tiempo real, las tediosas mediciones actuales fuera de línea con influencias desconocidas en el tamaño de la celda se vuelven innecesariamente.
Introducción
Las características morfológicas de las células a menudo están relacionadas con el estado fisiológico, existe una conexión entre la forma y la función para muchas aplicaciones. La morfología de una sola célula está influenciada por el estado de crecimiento, la edad de la célula, las tensiones osmóticas y otras posibles tensiones celulares o la acumulación de productos. Los cambios morfológicos de las células son a menudo una medida de la vitalidad de crecimiento de una cultura. La síntesis de productos intracelulares, la acumulación de lípidos en las algas y la formación del cuerpo de inclusión en bacterias, entre otros, también están relacionados con el tamaño de la célula. La aglomeración celular puede ser otro factor que vale la pena investigar como se resume recientemente2.
Las heterogeneidades de la población se pueden cuantificar en función de las características morfológicas de las células individuales. Los estudios demostraron que la heterogeneidad dentro de un cultivo podría ser significativa, por ejemplo,en condiciones de producción a gran escala3 el rendimiento global podría verse afectado por un bajo rendimiento de las subpoblaciones4.
Por lo general, la evaluación de las características morfológicas de las células se realiza mediante muestreo manual o con una cámara de flujo de derivación acoplada a un dispositivo fotoóptico. Esto conduce a varias restricciones: la cantidad limitada de datos adquiridos difícilmente puede proporcionar mediciones estadísticamente confiables; el retraso de tiempo entre el muestreo y la accesibilidad de los resultados puede ser demasiado largo en comparación con la dinámica del proceso; y lo más importante, el procedimiento de muestreo (ubicación del puerto de muestreo, pretratamiento de la muestra antes de la medición, condiciones desfavorables en el muestreo o tubo de derivación) puede desencadenar un error sesgado ya que el procedimiento de la muestra en sí ya puede afectar a la célula Morfología. Por último, siempre existe un alto riesgo de contaminación durante el muestreo o en soluciones de derivación, si no son esterilizables en su lugar.
La aplicación de microscopía in situ (ISM) puede eludir varios de estos problemas. Si las células se detectan automáticamente, se puede examinar una identificación correcta de sus características morfológicas5. Hasta ahora, las principales limitaciones de este método eran (i) el tiempo de evaluación de las imágenes, que era demasiado largo para las aplicaciones in situ, y (ii) la mala resolución de las imágenes, especialmente en densidades de células altas. Aunque las primeras soluciones de ISM incluían muestreo mecánico, dilución de la sonda, o estaban restringidas a un sistema de derivación6,7, enfoques adicionales permiten la captura de la suspensión celular directamente8.
Los avances recientes en ISM permiten el monitoreo en línea o en línea de las células sobre una sola célula, lo que proporciona la distribución de parámetros morfológicos en tiempo real directamente en suspensiones celulares a concentraciones celulares considerablemente altas. A través de análisis fuera de línea de los parámetros clave de las células, se pueden identificar correlaciones con la información proporcionada por la detección automatizada de células acopladas y el ISM. A continuación, se logran nuevos diseños de sensores blandos, en los que se estima un parámetro inconmensurable con la morfología de una sola célula.
En este informe, el ISM se lleva a cabo mediante el acoplamiento de una sonda fotoóptica a un análisis de imagen automatizado. El ISM consiste en una sonda de sensor de varilla única que permite la captura de imágenes dentro de un rango de enfoque conocido en una brecha de medición ajustable con una cámara CCD de alta resolución [MM-Ho - CCD GT2750 (2750x2200) y MM 2.1 - CMOS G507c (2464x2056)]. La iluminación de la luz del flash se lleva a cabo por transmisión. Por lo tanto, la luz se origina en el lado opuesto de la cámara9 y su intensidad se puede ajustar. Las células pasan continuamente a través de este hueco con el flujo de líquido. Por lo tanto, se obtiene una población de muestra representativa. La sonda se puede montar directamente en el biorreactor para que llegue a la suspensión celular, o se puede utilizar en un by-pass esterilizable. La carcasa del sensor está conectada al sistema antes de la esterilización, las piezas ópticas se montan posteriormente en la cáscara.
Hasta ahora, se investigaban con este o similar el diámetro de los hongos filamentosos (diámetro de hasta 200 m), microalgas heterotróficas Crypthecodinium cohnii (diámetro celular medio de 20 m) y la levadura Saccharomyces cerevisiae (diámetro celular medio de 5 m), que se describe en breve.
Los hongos filamentosos tienden a formar pellets bajo ciertas condiciones de cultivo. Estos son de un tamaño de hasta varios cientos de m. Las hifas de las células fúngicas desarrollan diferentes longitudes en dependencia a la tensión hidrodinámica en la fase fluida. Esto tiene una influencia en la actividad metabólica y de crecimiento, la toma de sustratos y la liberación del producto. ISM se aplicó para identificar la distribución del tamaño del pellet y la anchura de las zonas de menor densidad de biomasa en los bordes de los pellets (datos propios no publicados).
El tamaño de C. cohnii se altera entre 15 y 26 m cuando las células acumulan el ácido graso poliinsaturado docosahexaenoico (DHA) bajo limitación de nitrógeno. Este proceso biotecnológico de producción de DHA consta de dos partes, la fase de crecimiento, en la que las células se dividen y se hacen más pequeñas, y la fase de producción, en la que las células acumulan el producto y se hacen así más grandes. Por lo tanto, el tamaño de celda se utilizó para determinar el estado del proceso, en el que el crecimiento o la producción de DHA era favorable. Por último, se encontró una correlación entre el tamaño de celda y el contenido de DHA. En este caso, ISM permite monitorear la acumulación de DHA intracelular en tiempo real sin el requisito de muestreo, interrupción celular, y el análisis de cromatografía de gases común10.
La levadura en ciernes suele tener un tamaño de entre 3 y 8 m. La proporción de células que se encuentran en estado de maduración a la vez, como se describe con el índice en ciernes (BI), proporciona información sobre la vitalidad del crecimiento11,12, e incluso una relación con la secreción de proteína recombinante13. Con la ayuda de ISM, las células de levadura en ciernes y no en ciernes (células con y sin brote) se distinguieron14. Las condiciones de estrés también pueden conducir a una variación más amplia del tamaño de la célula dentro de una población de levadura, como se ha demostrado recientemente en los cultivos de reducción de escala, en los que las condiciones de los cultivos de lotes alimentados con nutrientes limitados a gran escala fueron imitadas3.
Por lo tanto, ISM tiene el potencial de monitorear la vitalidad del crecimiento y la formación de productos a nivel de una sola célula durante todas las etapas de un bioproceso para la identificación de condiciones óptimas de cultivo, o con el propósito de control del proceso. Los métodos descritos aquí se centran en aplicaciones microbianas con células individuales, pero también son aplicables a partículas más grandes como células humanas y animales, aglomerados celulares y pellets de organismos filamentosos.
Protocolo
NOTA: Los siguientes pasos son necesarios para adaptar los parámetros a las respectivas condiciones de microorganismo y cultivo. El ajuste de la configuración de la sonda dura unos 20 minutos para un usuario experimentado. En el manual de la sonda correspondiente de SOPAT GmbH se proporciona una descripción detallada de las herramientas y los pasos. En general, se necesitan las herramientas que se presentan en el siguiente protocolo: (i) Controlador de sonda para ajustes de sonda y adquisición de imágenes; (ii) Fiji (ImageJ) para anotaciones en imágenes adquiridas; (iii) Soporte SOPAT para el entrenamiento de redes neuronales artificiales (ANN) y la creación de flujos de trabajo; (iv) Batcher para el procesamiento por lotes de datos utilizando imágenes ya adquiridas con un flujo de trabajo; (v) Analizador de resultados para la visualización y evaluación de resultados en imágenes procesadas por lotes; y (vi) Monitor para la medición automatizada en tiempo real y visualización de resultados.
1. Configuración de parámetros de hardware
- Preparar un cultivo con la concentración celular más alta que podría lograrse durante el experimento o centrífuga y resuspender el pellet para lograr esta concentración. En este caso, se eligieron 65 gL-1 de concentración de biomasa seca para los cultivos de S. cerevisiae.
- Preparar diferentes diluciones, que van desde la concentración más alta a la más baja para que el rango esperado esté completamente cubierto. Se recomienda un mínimo de 4 concentraciones diferentes.
- Identificar el rango de tamaño celular del microorganismo con microscopía convencional. Defina el diámetro máximo esperado (dmax) de las celdas respectivas. Este valor se establece en 8 m en el caso de S. cerevisiae.
- Elija dos espacios de medición de 5x y 10x del dmax esperado de las células.
- Elija la intensidad máxima del estroboscopio. Elija intensidades de estroboscopio para ambos huecos con la concentración celular más alta para que las celdas sigan siendo visibles en las imágenes con la intensidad de luz más baja (imágenes más oscuras).
- Elija la intensidad mínima del estroboscopio y, a continuación, elija intensidades de estroboscopio para ambos huecos para que las celdas sigan siendo visibles en las imágenes con la intensidad de luz más alta (imágenes más brillantes). Utilice la concentración celular más baja, que probablemente aparece durante el período de medición.
- Elija una posición de enfoque, que produzca las imágenes más nítidas para cada brecha de medición, tanto para las intensidades del estroboscopio como para el rango de concentración que necesita ser probado (consulte el paso 2 para obtener más información sobre el enfoque). Enfoque las celdas de forma adecuada para que los datos de la imagen se puedan anotar después (consulte el paso 4).
- Mida la serie de dilución previamente preparada de la concentración celular (ver paso 2) con anchos de hueco e intensidades de estescopio.
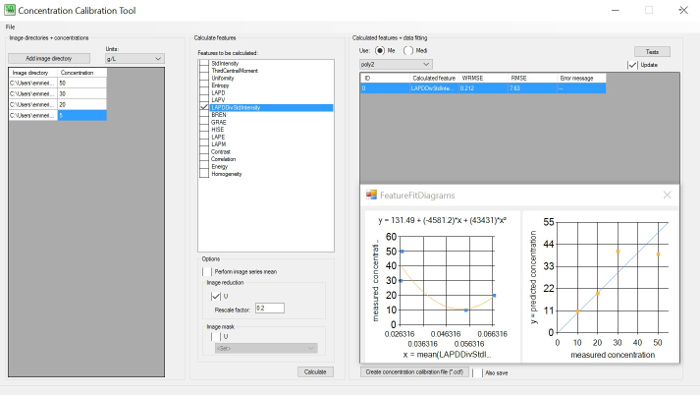
Figura 1: Herramienta de calibración de concentración. GUI izquierda: establecer directorios de imagen (mínimo de 3) con concentraciones conocidas; GUI central: elija las características que se calcularán en el directorio de la imagen; GUI derecha: elija el error cuadrado medio de la raíz ponderada (WRMSE) para identificar el mínimo. WRMSE y la mejor correlación entre cualquier entidad de imagen y la concentración de celdas. Haga clic aquí para ver una versión más grande de esta figura.
- Evalúe el experimento de la serie de dilución.
- Utilice la herramienta Calibración de concentración (CoCa) (consulte la figura 1) para identificar la correlación óptima entre las entidades de imagen extraídas (brillo o nitidez) y las concentraciones previamente medidas proporcionadas por el usuario, por ejemplo,biomasa seca o recuentos de células. Siga las instrucciones del manual del software para obtener más detalles.
- Identifique la correlación óptima entre la información extraída de las entidades de imagen en varias concentraciones en comparación con cualquier medición fuera de línea. Vea la leyenda de la Figura 1.
- Elija la brecha de medición más razonable y las intensidades de esterascopio bajo consideración de la curva de correlación de concentración con las características que dan como resultado el error cuadrado medio de raíz ponderada más pequeño (WRMSE).
NOTA: La brecha de medición se fija durante el experimento, mientras que la intensidad del estescopio se puede adaptar de acuerdo con la concentración celular.
2. Medición fuera de línea
- Ajuste la separación de medición deseada de acuerdo con el paso 1 con la ayuda de un medidor de espesor.
- Abra la interfaz gráfica de usuario Control de sondas en el panel DE CONTROL DE SOPAT.
- Conecte la sonda deseada al amplificador en la subsección de software Acciones y pulse Conectar.
- Pulse el botón Reproducir para iniciar la transmisión (Live View).
- Limpie la brecha de medición rociando etanol en el hueco y limpie cuidadosamente cualquier polvo o suciedad con un papel óptico. Compruebe que el cristal del sensor está libre de partículas con la Vista en vivo en el CamControl.
NOTA: Las mediciones de perturbación de partículas y polvo y la identificación automática de células. - Coloque un papel óptico seco en la brecha de medición. Abra la pestaña Control de sonda y ajuste la intensidad del estescopio para visualizar el papel. Gire el tornillo de unión hasta que las fibras individuales del papel se ven claramente.
- Llene un tubo con caldo de cultivo. Sumerja el microscopio en el caldo de cultivo para que la brecha esté completamente cubierta con suspensión celular. Abra la pestaña Control de sonda y ajuste la intensidad deseada del estroboscopio de acuerdo con la sección 1. Concéntrese en las células ajustando el tornillo de unión de enfoque. El enfoque ya no debe cambiarse durante el experimento
NOTA: 5-6 mL de caldo de cultivo se añaden a un tubo centrífugo cónico de 50 ml para flotar la brecha de medición lo suficiente. - Defina el número de tramas por punto de tiempo [-] en la interfaz de usuario en el menú Activación en las tramasGUI por desencadenador . Establezca el número de fotogramas en 200 fotogramas por disparador.
NOTA: El número de fotogramas se puede reducir al valor más bajo, lo que es necesario para obtener un resultado fiable estadístico. Esto depende del tamaño de la muestra necesario para obtener una distribución representativa del tamaño morfológico de la célula (véase también el paso 5). - Defina la velocidad de fotogramas [Hz] en el menú Activación en la velocidad de fotogramasGUI . Elija una velocidad de fotogramas que garantice que las partículas en movimiento de un fotograma anterior no aparecerán en el fotograma siguiente.
NOTA: Esto se puede probar con un disparador de prueba con 200 fotogramas. Inspeccione las imágenes en busca de partículas, que se capturan repetidamente. Si este es el caso, disminuya la velocidad de fotogramas. Para mediciones fuera de línea, se recomienda 1 Hz. - Establezca el directorio en el que se guardarán las imágenes adquiridas, en el menú General.
- Realice una adquisición de imagen activando el botón Iniciar adquisición del disparador de imagen. Mueva el tubo con suspensión de cultivo suavemente hacia arriba y hacia abajo para inducir un flujo a través de la brecha de medición.
- Repita el paso 2.5 después de cada medición.
- Compruebe las imágenes adquiridas. Las celdas tienen que ser lo suficientemente nítidas para la anotación. Inspeccione las imágenes en busca de partículas, que se capturan repetidamente. Si este es el caso, disminuya la velocidad de fotogramas.
- Guarde la configuración seleccionando la siguiente ruta: C:-Archivos de programa-SOPAT GmbH-monitoringPrograms-camcontrol y pulse Guardar.
3. Identificación de partículas
- Anotar partículas para el entrenamiento de la red neuronal artificial (ANN) (conjunto de entrenamiento).
- Cargue las imágenes adquiridas en la herramienta de anotación "Fiji, ImageJ" arrastrando y soltando el archivo en la ventana principal "ImageJ" (consulte GUI "Fiji" herramienta en la Figura 2)
- Abra el Administrador de ROI seleccionando: Analizar . Herramientas ? ROI Manager.
- Elija una herramienta de selección. Se recomiendan las selecciones de varita (rastreo), a mano alzada, ovalada o elíptica.
- Dibuje un círculo alrededor de la partícula que se anotará con las herramientas de selección mencionadas anteriormente y luego refinarlo con la herramienta de pincel.
- Añada la anotación al Administrador de ROI pulsando Añadir [t].
- Marque todos los objetos de interés (células a identificar) en unas 15 imágenes.
NOTA: Para cubrir toda la información necesaria, es decir, diferentes formas, tamaños, concentración de celdas, brillo, etc.,utilice cinco imágenes desde el principio, cinco imágenes de entre ellas y cinco imágenes del final del experimento. - Decida si las celdas necesitan clasificarse en diferentes subclases debido a su forma(por ejemplo,diferentes fases de un ciclo de células), o si todas las celdas son de la misma clase.
- Cambie el nombre de cada partícula seleccionada en consecuencia. Establezca un nombre o abreviatura para cada clase y un contador para cada partícula de la clase(porejemplo, , cell_1, cell_2, etc.).). Anote al menos 50 partículas por clase.
- No anote objetos, que no deben detectarse, porque no son relevantes para el proceso, como burbujas de gas u otras partículas como componentes de medios no disueltos.
NOTA: Estos eventos no se incluirán en el procedimiento de formación de la ANN y se considerarán antecedentes. - No anote celdas que estén desenfocadas.
- Anote las imágenes de la forma más coherente posible. Si hay dudas, se puede aplicar la etiqueta Ignorar. Es muy recomendable no abusar de su uso, ya que el ANN sólo reconocerá las estructuras etiquetadas.

Figura 2: Interfaz de usuario de la herramienta Fiji. Se crea un conjunto de entrenamiento con las imágenes anotadas. Se muestra una anotación manual que consta de dos clases, la lista de partículas anotadas se muestra en el Administrador de ROI. Se pueden establecer diferentes nombres y colores para diferentes clases. Haga clic aquí para ver una versión más grande de esta figura.
- Guarde los objetos anotados y la imagen en un formato ZIP y envíe el archivo a la red de entrenamiento, ya sea a través de la carga a la plataforma o enviando el archivo ZIP por correo electrónico.
NOTA: Por lo general, se necesitan varias rondas de entrenamiento iterativo para identificar predicciones adecuadas de los objetos clasificados en las imágenes. Cada ronda de entrenamiento conduce a un flujo de trabajo devuelto por el programa. - Utilice el flujo de trabajo (*.wf) con el algoritmo de reconocimiento de objetos entrenados para analizar imágenes de prueba con el programa de progreso del lote de datos Batcher que se puede iniciar en el panel.
- Compruebe la detección de objetos en las imágenes de prueba mediante la cuantificación de eventos falsos positivos y negativos.
- Cuantificar la detección de eventos falsos positivos: partículas detectadas erróneamente como células, celdas que no están clasificadas correctamente y celdas de las que el contorno no ha sido bien identificado.
- Cuantifique los eventos falsos negativos (células que no se reconocen como tales).
- Visualice los resultados en el analizador de resultados de la herramienta iniciando el programa en el panel.
- Importe los archivos de resultados deseados con Archivo . Importar archivo o archivo ? Importar carpetas.
- Visualizar los resultados por gráficos de gráficos . Cree el gráfico en la GUI de gráficos.
- Seleccione una de las siguientes opciones: Gráfico de distribución, Gráfica de sensibilidad, Característica a lo largo del tiempo, Característica sobre puntos de topografía y Característica frente a entidad.
NOTA: Un manual sobre la utilización del analizador de resultados viene con el sistema y también está disponible en el soporte. - Si los resultados son aceptables, ejecute el flujo de trabajo en Batcher en todas las imágenes adquiridas del experimento. Al mismo tiempo, el programa de supervisión se puede crear combinando la configuración guardada desde el controlador de sondeo (*.pcfg) con el flujo de trabajo (*.wf), consulte también el manual.
NOTA: El flujo de trabajo también se puede utilizar para supervisar futuros experimentos para este medio de referencia cultural. - Si los resultados no son aceptables, compruebe la anotación en el conjunto de entrenamiento y/o continúe con otra ronda de entrenamiento iterativo (consulte el paso 4.2).
4. Cuantificación del tamaño de la muestra
- Establezca la desviación estándar ( ) , que es aceptable entre las partículas detectadas.
NOTA: La desviación estándar cambia en paralelo a la homogeneidad del tamaño de celda. La desviación estándar máxima indica la muestra con el mayor grado de heterogeneidad de tamaño. - Establezca la amplitud del intervalo de confianza o la precisión deseada en relación con la varianza esperada de las mediciones (e).
- Establezca el error admitido (o) entre el 5% (z1--/2 a 1,96) y el 10% (z1--/2 a 1,64).
- Calcule el número de celdas que se identificarán de cada clase a partir de la ecuación 1.
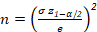 [Ecuación 1]
[Ecuación 1]
NOTA: En función del número de celdas, se puede definir el número de imágenes que se deben adquirir para cada punto de datos. - Realizar un análisis de sensibilidad en puntos de tiempo aleatorios del experimento para comprobar que el análisis de n partículas conduce a una variabilidad del diámetro medio de Feret y el Dv90 de menos del 5%. Se puede calcular automáticamente en el Analizador de resultados.
5. En línea (by-pass) o en medición en línea
- Realice primero el procedimiento de medición fuera de línea (véase el paso 2) para establecer los ajustes de hardware y software en función del organismo y el proceso (concentración o medios).
- Cargue la configuración guardada de la sección anterior seleccionando el botón Cargar y seleccione la siguiente ruta: C:-Archivos de programa-SOPAT GmbH-monitoringPrograms-camcontrol.
- Conecte la sonda a la célula de flujo o al biorreactor.
NOTA: Las mediciones in situ se pueden realizar con una brida de pellizcar. - Realizar la esterilización.
NOTA: Sólo el material humedecido por sonda del instrumento es esterilizable a través de la esterilización por vapor. La longitud mojada de la sonda puede ir de 6 a 222 mm(Figura 3).
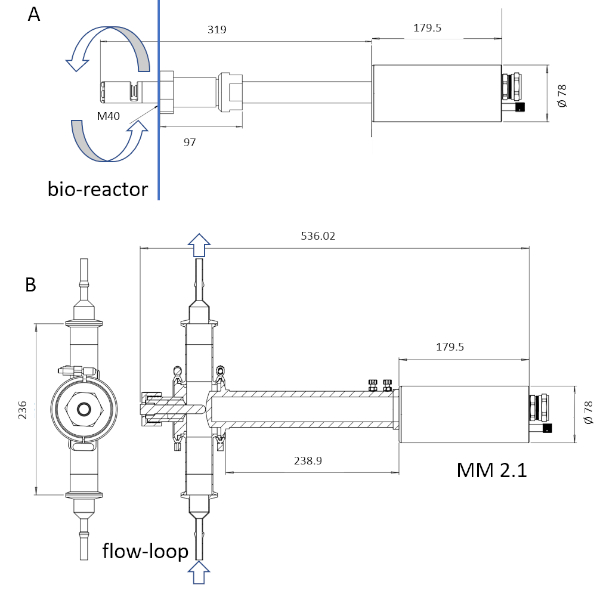
Figura 3: Boceto de los dispositivos ISM. La sonda MM-Ho (A) se puede instalar directamente en el biorreactor, mientras que la sonda MM 2.1 (B) se puede utilizar como derivación. La circulación de caldo de cultivo está marcada con flechas en cada imagen. Los factores de conversión son 0.166 ám pix-1 para MM-Ho y 0.087 ám pix-1 para MM 2.1. Haga clic aquí para ver una versión más grande de esta figura.
- Defina la velocidad de adquisición de imágenes en la activación GUI en el campo Intervalo de desencadenador [s].
NOTA: Dependiendo de la dinámica del proceso, se puede adaptar la tasa de adquisición de imágenes. Por ejemplo, si se espera un retraso en la fase de 3 horas, la tasa de adquisición puede ser menor, que si se controlará un cambio de metabolismo o la acumulación de un producto. Por lo general, esto requiere un tiempo de adquisición mucho más corto en el rango de minutos. Por ejemplo, una secuencia de adquisición de imágenes entre 5 y 10 minutos durante un cultivo de levadura por lotes proporciona información suficiente para capturar la dinámica del proceso. - Defina la velocidad de fotogramas como se explica en el paso 2.10.
NOTA: En las mediciones en línea y en línea, la velocidad de fotogramas se puede aumentar, ya que la agitación mecánica puede aumentar el caudal a través de la brecha. - Inicie la adquisición de imágenes activando el botón Iniciar transmisión de la sonda seleccionada.
- Detener la adquisición cuando el experimento haya terminado con el botón Detener transmisión de la sonda seleccionada.
NOTA: Para la1a carrera, inicie la adquisición justo antes de la inoculación de la referencia cultural y continúe con el paso 4. Para las siguientes ejecuciones, abra el programa Supervisión en el panel y seleccione el flujo de trabajo creado (consulte el paso 4). Inicie la supervisión justo antes de la inoculación de la referencia cultural pulsando el botón Reproducir.
Resultados
La detección del tamaño de la célula en cultivos de levadura con el ISM y la detección automatizada de imágenes para distinguir entre células en ciernes y no en ciernes se llevó a cabo con éxito. Tanto la intensidad del estescopio como la elección de la brecha de medición tienen un rango de tolerancia, en el que la identificación de partículas no se ve afectada. Por ejemplo, las células de S. cerevisiae se midieron con varias intensidades de estroboscopio dentro de u...
Discusión
El ISM presentado aquí con los mismos o muy similares dispositivos se utilizó para medir la dinámica morfológica de hongos, microalgas y células de levadura, lo que permitió la determinación de la actividad de crecimiento, y en el caso de las algas, la acumulación de productos intracelulares. El sensor no tiene piezas móviles y es directamente aplicable en cualquier biorreactor de tanque agitado estándar, ya sea a través de un puerto estándar o en un by-pass esterilizable. Dado que la levadura es mucho más p...
Divulgaciones
Los autores no tienen nada que declarar.
Agradecimientos
Los autores están agradecidos por el apoyo del Ministerio Federal de Economía y Energía de Alemania en el marco ZIM-Koop, proyecto "Smart Process Inspection", concesión no. ZF 4184201CR5.
Materiales
| Name | Company | Catalog Number | Comments |
| Sensor MM 2.1 - MFC | SOPAT GmbH, Germany | n.a. | Inline Monocular Microscopic probe Version 2.1 with a Mirco Flow Cell |
| Sofware version v1R.003.0092 | SOPAT GmbH, Germany | n.a. | |
| Thickness gauge | n.n. | It can be any supplier, DIN 2275:2014-03 | |
| Ethanol 70% | n.n. | It can be any supplier | |
| SOPAT manual Version 2.0.5 | SOPAT GmbH, Germany | ||
| Optical lense paper | VWR | 470150-460 | |
| Fiji, ImageJ | open source | ||
| 50 mL conical centrifuge tubes | It can be any supplier |
Referencias
- Maaß, S., Rojahn, J., Hänsch, R., Kraume, M. Automated drop detection using image analysis for online particle size monitoring in multiphase systems. Computers & Chemical Engineering. 45, 27-37 (2012).
- Lemoine, A., Delvigne, F., Bockisch, A., Neubauer, P., Junne, S. Tools for the determination of population heterogeneity caused by inhomogeneous cultivation conditions. Journal of biotechnology. 251, 84-93 (2017).
- Marbà-Ardébol, A. M., Bockisch, A., Neubauer, P., Junne, S. Sterol synthesis and cell size distribution under oscillatory growth conditions in Saccharomyces cerevisiae scale-down cultivations. Yeast. 35 (2), 213-223 (2017).
- Xiao, Y., Bowen, C. H., Liu, D., Zhang, F. Exploiting nongenetic cell-to-cell variation for enhanced biosynthesis. Nature chemical biology. 12 (5), 339-344 (2016).
- Beutel, S., Henkel, S. In situ sensor techniques in modern bioprocess monitoring. Applied microbiology and biotechnology. 91 (6), 1493 (2011).
- Belini, V. L., Wiedemann, P., Suhr, H. In situ microscopy: A perspective for industrial bioethanol production monitoring. Journal of microbiological methods. 93 (3), 224-232 (2013).
- Havlik, I., et al. Monitoring of microalgal cultivations with on-line, flow-through microscopy. Algal Research. 2 (3), 253-257 (2013).
- Suhr, H., Herkommer, A. M. In situ microscopy using adjustment-free optics. Journal of biomedical optics. 20 (11), 116007 (2015).
- Panckow, R. P., Reinecke, L., Cuellar, M. C., Maaß, S. Photo-Optical In-Situ Measurement of Drop Size Distributions: Applications in Research and Industry. Oil Gas Sci. Technol. - Rev. IFP Energies. 72 (3), 14 (2017).
- Marbà-Ardébol, A. -. M., Emmerich, J., Neubauer, P., Junne, S. Single-cell-based monitoring of fatty acid accumulation in Crypthecodinium cohnii with three-dimensional holographic and in situ microscopy. Process Biochemistry. 52, 223-232 (2017).
- Porro, D., Vai, M., Vanoni, M., Alberghina, L., Hatzis, C. Analysis and modeling of growing budding yeast populations at the single cell level. Cytometry. Part A : the journal of the International Society for Analytical Cytology. 75 (2), 114-120 (2009).
- Brauer, M. J., et al. Coordination of growth rate, cell cycle, stress response, and metabolic activity in yeast. Molecular biology of the cell. 19 (1), 352-367 (2008).
- Puxbaum, V., Gasser, B., Mattanovich, D. The bud tip is the cellular hot spot of protein secretion in yeasts. Applied microbiology and biotechnology. 100 (18), 8159-8168 (2016).
- Marbà-Ardébol, A. M., Emmerich, J., Neubauer, P., Junne, S. Vol. P2. Prozessmesstechnik. , 222-225 (2017).
- Marbà-Ardébol, A. -. M., Emmerich, J., Muthig, M., Neubauer, P., Junne, S. Real-time monitoring of the budding index in Saccharomyces cerevisiae batch cultivations with in situ microscopy. Microbial cell factories. 17 (1), 73 (2018).
- Marquard, D., Schneider-Barthold, C., Düsterloh, S., Scheper, T., Lindner, P. Online monitoring of cell concentration in high cell density Escherichia coli cultivations using in situ Microscopy. Journal of biotechnology. 259, 83-85 (2017).
- Marquard, D., et al. In situ microscopy for online monitoring of cell concentration in Pichia pastoris cultivations. Journal of biotechnology. 234, 90-98 (2016).
- Camisard, V., Brienne, J., Baussart, H., Hammann, J., Suhr, H. Inline characterization of cell concentration and cell volume in agitated bioreactors using in situ microscopy: application to volume variation induced by osmotic stress. Biotechnology and bioengineering. 78 (1), 73-80 (2002).
- Böhm, A., Ücker, A., Jäger, T., Ronneberger, O., Falk, T. ISOODL: Instance segmentation of overlapping biological objects using deep learning. , 1225-1229 (2018).
- Davey, H. M. Life, Death, and In-Between: Meanings and Methods in Microbiology. Applied and environmental microbiology. 77 (16), 5571-5576 (2011).
- Lodolo, E. J., Kock, J. L., Axcell, B. C., Brooks, M. The yeast Saccharomyces cerevisiae-the main character in beer brewing. FEMS yeast research. 8 (7), 1018-1036 (2008).
- Albertin, W., et al. Population size drives industrial Saccharomyces cerevisiae. alcoholic fermentation and is under genetic control. Applied and environmental microbiology. 77 (8), 2772-2784 (2011).
- Gomes, J., Chopda, V. R., Rathore, A. S. Integrating systems analysis and control for implementing process analytical technology in bioprocess development. Journal of Chemical Technology and Biotechnology. 90 (4), 583-589 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados