Method Article
Análisis de la función de célula Beta usando proyección de imagen de resolución sola célula calcio en islotes de pez cebra
En este artículo
Resumen
Funcionalidad de la célula beta es importante para la homeostasis de la glucosa en sangre, que es evaluada en unicelulares resolución usando un reportero genéticamente codificado para la afluencia del calcio.
Resumen
Las células beta pancreáticas responden al aumentar las concentraciones de glucosa de la sangre secretando la hormona insulina. La disfunción de las células beta conduce a hiperglucemia y consecuencias graves, potencialmente mortales. Entender cómo las células beta funcionan bajo condiciones fisiológicas y qué factores genéticos y ambientales podrían causar su disfunción podría conducir a mejores opciones de tratamiento para los pacientes diabéticos. La capacidad de medir niveles de calcio en las células beta es un indicador importante de la función de células beta, como la afluencia de calcio iones desencadena la liberación de insulina. Aquí se describe un protocolo para el monitoreo de la afluencia del calcio estimulada por la glucosa en las células beta pez cebra utilizando GCaMP6s, un sensor genéticamente codificado de calcio. El método permite el control de la dinámica del calcio intracelular con resolución unicelular en islotes ex vivo montado. La respuesta de la glucosa de las células beta en el mismo islote puede capturar simultáneamente con concentraciones diferentes de glucosa, que sugiere la presencia de heterogeneidad funcional entre las células beta de pez cebra. Además, la técnica proporciona alta resolución temporal y espacial, que revela la naturaleza oscilatoria de la afluencia del calcio sobre el estímulo de glucosa. Nuestro enfoque abre las puertas para utilizar el pez cebra como modelo para investigar la contribución de factores genéticos y ambientales en función de las células beta y la disfunción.
Introducción
Nuestra glucosa en sangre se mantiene en un margen estrecho, en gran parte debido a la función del páncreas endocrino. La función endocrina del páncreas se realiza por los islotes de Langerhans, que contienen células secretoras de hormonas. Las células beta secretoras de insulina están responsables de reducir los niveles de glucosa en sangre después de una comida que contiene hidratos de carbono. Secreción inadecuada de insulina de células beta puede resultar en diabetes1, que se caracteriza por glucemia alta sostenida. Tipo 1 y tipo 2 Diabetes, que actualmente afecta a más de 400 millones de personas en todo el mundo, conduce a la morbilidad y la mortalidad2. Investigando los factores moleculares y ambientales que contribuyen a la disfunción de células beta, entenderemos mejor cómo diabetes tipo 2 se inicia y progresa. Además, la capacidad de diferenciar células madre humanas en células beta funcionales en vitro puede proporcionar una fuente de nuevas células beta para terapias de reemplazo celular en la Diabetes de tipo 1. Para ello, es importante estudiar la función de células beta y la maduración en organismos modelo genética con el fin de adquirir los conocimientos necesarios para hacer funcional de las células beta en un plato.
Funcionalidad de la célula beta puede controlarse en el plano de conjunto-islote mediante la cuantificación de la cantidad total de insulina secretada en respuesta al estímulo de glucosa. Este enfoque acumulativo estudia el islote como un único grupo de células sin diferenciar propiedades individuales de la célula. Sin embargo, el análisis de las respuestas de glucosa de células beta individuales reveló una diversidad en las propiedades funcionales de las células beta y la presencia de heterogeneidad3. Para evaluar la función de individual de las células beta, es posible monitorizar los cambios intracelulares que conducen a la secreción de insulina4. La secreción de insulina es precedida por una entrada de la glucosa en las células beta. La glucosa que entra en las células beta se metaboliza rápidamente a ATP. Altas concentraciones de ATP intracelulares disminuyen la probabilidad abierta de los canales de ion de potasio ATP-sensibles a la despolarización de la célula beta. Despolarización abre los canales de iones de calcio sensibles al voltaje y aumenta el calcio intracelular. A su vez, calcio desencadena la exocitosis de la insulina, que se libera en la circulación y reduce los niveles de glucosa promoviendo la utilización de la glucosa5,6,7.
Varias estrategias se han aplicado para investigar la función de las células beta, incluyendo el monitoreo del potencial de la membrana8, la visualización directa de la insulina-vesículas exocitosis9y cuantificación de Ca intracelular2 + afluencia como un proxy para glucosa respuesta10. Entre ellos, la proyección de imagen de Ca intracelular2 + proporciona la ventaja de la ampliación del análisis a varias células individuales en el mismo islote11,12, lo que permite la comparación directa de la capacidad de respuesta de glucosa entre individuales-las células beta. Concentración de Ca2 + intracelular puede controlarse usando colorantes fluorescentes sensibles a calcio13 o calcio genéticamente codificado indicadores (GECIs)14. Mientras que la especificidad de tipo de la célula falta calcio indicador tintes, GECIs puede expresarse en un tipo de célula específica por promotores específicos. Además, la nueva generación de GECIs, como GCaMP6, proporciona mejor relación de señal a ruido junto con el más rápido de la dinámica temporal15. Aquí describimos la utilidad de la nueva generación de GECIs, en particular GCaMP6s, para visualizar calcio en las células beta en resolución unicelular. Aplicamos este método al islote principal del pez cebra como modelo de elección. Durante el desarrollo embrionario, las células beta en el islote principal originan la dorsal y ventral páncreas yemas16. El islote principal está situado en una posición anatómica estereotipada en el páncreas de pez cebra, lo que permite su fácil identificación y el aislamiento. Las células beta en el islote principal son necesarias para la regulación de la glucosa, como la ablación genética conduce a hiperglucemia17,18. Además, estas células beta se convierten en glucosa responden durante temprano pez cebra desarrollo19. Este protocolo puede aplicarse también a la proyección de imagen los islotes secundarios, que forman durante las etapas post-embrionarias. El protocolo permite imagen beta de células ex vivo, en etapas posteriores de desarrollo y en las concentraciones de glucosa definida.
Protocolo
Todos los procedimientos incluyendo temas animal han sido aprobados por la ley de Bienestar Animal y con el permiso de la Landesdirektion Sachsen, Alemania (AZ 24-9168.11-1/2013-14, T12/2016).
1. preparación
Nota: Este protocolo es para ex vivo la proyección de imagen de pez cebra islote principal doble transgénicos TG (ins:nls-Renilla-mKO2; cryaa:CFP); TG (ins:GCaMP6s; cryaa:mCherry) 19 de pez cebra. En esta línea transgénica, el promotor de la insulina (ins) unidades de expresión específica de células beta de los dos transgenes: nls-Renilla-mKO2, que marca el núcleo de las células beta con monomérica Kusabira naranja 2 (mKO2) fluorescencia; y GCaMP6s15, que emite fluorescencia verde en respuesta al aumento en los niveles de calcio intracelular. La expresión específica de la célula beta de GCaMP6s permite estudiar la capacidad de respuesta de la glucosa de las células beta sin interferencia de los cambios del calcio en los alrededores de tipos celulares.
- Preparar caldo fresco de fibrinógeno (10 mg/mL) disolviendo 10 mg de fibrinógeno bovino en 1 mL de Ca2 +/Mg2 +-que contiene solución de sal equilibrada de Hanks (HBSS) en un tubo de centrífuga de 1.5 mL. Vortex vigorosamente hasta que el polvo de fibrinógeno se disuelva completamente. Mantener la solución a temperatura ambiente durante al menos 15 minutos más.
Nota: La población puede conservarse a temperatura ambiente durante 2-3 h. descarte la acción si la solución comienza a polimerizar y se vuelve viscosa. - Preparar la solución de trabajo de fibrinógeno (3,3 mg/mL) diluir la acción del fibrinógeno triple en HBSS. Por ejemplo, mezclar 300 μL del stock de fibrinógeno en 600 μl de HBSS para preparar 900 μl de solución de trabajo de fibrinógeno.
- Preparar solución de trombina (10 U/mL) disolviendo 10 unidades de trombina en 1 mL de HBSS o fosfato tampón salino (PBS).
Nota: Esta solución puede ser preparada de antemano, alícuotas en 50 partes de μl y congelada a-20 ° C. - Preparar 200 mM solución de D-glucosa mediante la disolución de 1,8 g de D-glucosa en 50 mL de agua. Mantenga en 4 ° C para almacenamiento a largo plazo.
- Para preparar 300 mM solución de KCl, disolver 1,1 g de KCl en 50 mL de agua. Mantenga en 4 ° C para almacenamiento a largo plazo.
- Adquirir 35 mm platos de fondo de cristal de diámetro para el montaje de los islotes.
- Para la disección y montaje del islote, usar un microscopio estéreo equipado con lámpara de fluorescencia y filtro rojo cubo (TRITC: excitación: 532 – 554 nm, emisión: 613 – 570 nm; o Texas-rojo: excitación: 540-580 nm, emisión: 592 – 667 nm).
- Para la proyección de imagen la afluencia del calcio en las células beta, uso un microscopio confocal invertido (Zeiss LSM 780 o similar) con 20 X (0.8 NA) objetivo de aire y equipada con un soporte de placa para los platos de fondo de cristal de 35 mm de diámetro.
- Preparar una solución de 200 mg/L de Metanosulfonato sulfonato de metano (MS222) para euthanizing el pez cebra.
- Adquirir platos de Petri de 90 mm para la disección del pez cebra.
2. pez cebra primaria islote disección y montaje
- Eutanasia a un pez con incubación prolongada en MS222. Para esto, suavemente quitar los peces de la pecera con una red de pesca e incubar en una placa Petri que contiene la solución MS222 hasta que el animal no muestre ningún movimiento opercular (branquias); Normalmente, esto toma 5 minutos de traslado de los peces a una placa Petri que contiene la solución HBSS con Ca2 +/Mg2 +.
-
Microscopio estéreo equipado con una lámpara de fluorescencia y filtro rojo cubo, disecar la piel que cubre el lado derecho del abdomen del animal para aislar el páncreas.
- Para ello, cortar la piel del pez cebra de boca a la aleta anal con unas pinzas afiladas. Retire la piel cortada para exponer el abdomen; Este recortes expone los órganos internos. Mediante el uso de la fluorescencia roja de mKO2 expresión en las células beta, determinar la localización de los islotes por examen visual bajo el microscopio. Si es necesario, retire los lóbulos del hígado, como podría cubrir el islote, lo que es difícil de encontrar.
Nota: El islote principal está situado cerca de la región anterior del abdomen, generalmente en el lado derecho.
- Para ello, cortar la piel del pez cebra de boca a la aleta anal con unas pinzas afiladas. Retire la piel cortada para exponer el abdomen; Este recortes expone los órganos internos. Mediante el uso de la fluorescencia roja de mKO2 expresión en las células beta, determinar la localización de los islotes por examen visual bajo el microscopio. Si es necesario, retire los lóbulos del hígado, como podría cubrir el islote, lo que es difícil de encontrar.
- Limpie el islote principal retirando cuidadosamente tejido circundante como hígado y adipocitos. Tomar la precaución de no dañar o meter el islote; después de la limpieza de los tejidos circundantes, las células individuales en la superficie del islote ser discernibles.
- Tomar con pipeta una gota de 30 μl de HBSS en el centro de un plato de fondo de cristal. Transferir el islote disecado a esta caída.
- Lave cuidadosamente el islote una vez con HBSS y una vez con 30 μl de la solución de trabajo de fibrinógeno (3,3 mg/mL). Asegúrese de evitar que se sequen del islote durante los pasos de lavado, porque hacerlo así resulta en la muerte celular.
- Despacio y con cuidado añadir 10 μl de la solución de trombina (10 U/mL). Dejar el islote y el plato sin tocar durante 15 – 20 minutos observa que la caída del fibrinógeno trombina será ligeramente opaco y viscoso en este punto.
3. Ex Vivo vivo-proyección de imagen de GCaMP intensidad de fluorescencia en islotes de pez cebra primaria
- Añadir 200 μL de HBSS, en la parte superior del molde y coloque con cuidado el plato en el sostenedor de la placa del microscopio confocal. Usar objetivo 20 X, 0.8 NA, aire para la proyección de imagen confocal. Localice el islote con la opción de brightfield.
- Utilizando el filtro de la fluorescencia roja para ver la fluorescencia mKO2 nuclear de las células beta, se centran en el islote. Núcleos individuales deben ser claramente visibles.
- Ubicar un plano de proyección de imagen claro cambiando manualmente el plano focal del microscopio confocal para moverse a través del espesor de la isla a lo largo de su eje z. Asegúrese de que el plano de proyección de imagen contiene un número suficiente (50-100) de las células beta para la proyección de imagen y el brillo de la fluorescencia nuclear mKO2 es uniforme, especialmente en el centro del islote.
- Configurar una adquisición secuencial para GCaMP6s y mKO2 fluorescencia con la siguiente configuración en el "menú inteligente": GCaMP6s, excitación: 488 nm, emisión: 500 – 555 nm, falso-color: verde (seleccione "GFP"); mKO2, excitación: 561 nm (mCherry), emisión: 570-630 nm, falso-color: rojo (seleccione "mCherry").
Nota: Con esta configuración, el canal rojo registra la posición de los núcleos de la célula beta, mientras que el canal verde será registrar la intensidad de la fluorescencia GCaMP. - En el "modo de adquisición" configure la resolución de la imagen a 1.024 x 1.024 píxeles, la velocidad en 10 y un promedio de 1. Iniciar una continua grabación seleccionando la opción para "Series de tiempo", y ajuste de la "duración" para los 500 ciclos, con tiempo de la adquisición de aproximadamente 2 s cada fotograma.
Nota: Los primeros 50 marcos de la serie de tiempo corresponden a la actividad de las células beta en la concentración de glucosa de 5 mM. Esta es la respuesta de la línea de base. Una célula beta respuesta mostrará encerando y disminuyendo la intensidad de la fluorescencia verde con el tiempo. Hemos observado que algunos (1 – 5%) de las células beta oscilan en 5 mM de glucosa. -
Mantener un ojo en el ciclo de proyección de imagen. Después de los primeros 50 marcos, aumentar la concentración de glucosa de la solución circundante a 10 mM, sin detener la grabación.
- Sin perturbar la adquisición de la imagen, pipetee suavemente 5 μl de la solución de D-glucosa sobre el gel con el islote de 200 mM. Adquirir 150 fotogramas a 10 mM de glucosa.
Nota: El aumento de la concentración de glucosa aumentará el número de las células beta que experimentan oscilaciones fluorescentes GCaMP en el canal verde. - Asegúrese de que los núcleos de las células permanecen estables durante el proceso. Si el islote está sacudiendo extensivamente durante la adquisición y los núcleos se mueven fuera del plano focal, deseche la muestra (si es necesario).
- Esperar un período suficiente de tiempo para permitir la polimerización del molde trombina fibrinógeno con el fin de asegurar la estabilidad de las muestras subsecuentes.
- Sin perturbar la adquisición de la imagen, pipetee suavemente 5 μl de la solución de D-glucosa sobre el gel con el islote de 200 mM. Adquirir 150 fotogramas a 10 mM de glucosa.
- En 200 marcos, aumentar aún más la concentración de la solución a 20 mM por suavemente Pipetear 10 μl de la solución de D-glucosa de 200 mM. Adquisición de 150 marcos para la concentración de 20 mM.
- Después de 350 cuadros, despolarizar el islote con 30 mM de KCl. Para ello, añadir 20 μl de la solución madre de KCl de 300 mM. En esta etapa, se observa que las oscilaciones de la fluorescencia GCaMP6s parará y arreglar a una alta intensidad; las células beta que no respondieron a la glucosa también pueden mostrar un aumento en la intensidad de la fluorescencia verde con adición de KCL.
4. cuantificación de GCaMP fluorescencia traza para cada de las células Beta
Nota: Para localizar y cuantificar las respuestas de células beta individuales a diferentes niveles de la glucosa, cuantificar la intensidad de fluorescencia de GCaMP durante todo el período de proyección de imagen. La cuantificación se realiza en celulares de resolución. Para ello, usar FIJI20 para extraer los valores de intensidad de fluorescencia de GCaMP de las imágenes (pasos 4.1-4.6) y software de hoja de cálculo o R21 para llevar a cabo análisis (pasos 4.8-4.9).
- Abra el archivo de imagen en FIJI utilizando la "caja de herramientas de LSM". Para ello, seleccione "Plugin | LSM Toolbox | Mostrar herramientas LSM". En la "LSM caja de herramientas", haz clic en "Open LSM" y seleccione el archivo de imagen.
Nota: Para formatos no soportados por la "caja de herramientas de LSM", convertirlos primero a tiff para el análisis. - Extracto de las respuestas de las células mediante la herramienta de región de interés (ROI) en FIJI. Abra el "Administrador de retorno de la inversión" en el menú "Analizar" en "Herramientas". Dibujar manualmente el ROI con la "herramienta de selección de polígono" situada en la barra de herramientas.
- Dibujar el retorno de la inversión en el canal rojo en el que los núcleos de la célula beta son accesibles. Seleccione el ROI que cubre un área que es más grande que el núcleo de la célula con el fin de incluir algunas de citoplasma de la célula. Asegurarse de que la posición de retorno de la inversión es constante entre marcos y ajuste la posición si es necesario.
- Añadir el ROIs seleccionados al "Administrador de ROI" haciendo clic en el botón "Agregar [t]". Seleccione y agregue ROIs múltiples para el retorno de la inversión para la obtención de datos en varias celdas.
- A continuación, en el menú "Analizar", seleccione "Establecer medidas". Seleccione "Densidad integrada" para especificar la extracción de la intensidad de fluorescencia total dentro del área.
- Cambio al canal verde que contiene la fluorescencia GCaMP y seleccione "Multi medida" en el "Administrador de ROI".
Nota: Esto le dará las mediciones de intensidad de las células a lo largo de la serie de tiempo. - En el caso de la posición de retorno de la inversión necesita ser ajustado debido al movimiento del islote, compilar manualmente las medidas de intensidad en diferentes marcos. Copiar y pegar los valores a una hoja de cálculo separada.
- Obtener las marcas de hora de los marcos de imagen de"LSM". Uso "aplicar sellos | Aplique sellos t | Nombre de archivo | Volcado a archivo de texto"para obtener las marcas de hora. Guardar las marcas de tiempo utilizando la opción "Guardar como" o copiar en la hoja de cálculo.
- A recopilación de los valores de intensidad para todas las células, realizar el análisis una célula en un momento o automáticamente (por ejemplo, usando fórmulas de Excel o R).
-
Análisis de células individuales en dos pasos.
- En el primer paso, calcular la intensidad de fluorescencia por encima de la línea de base. Para ello, calcular la intensidad de línea de base fluorescente (F0) como el promedio de las intensidades de fluorescencia para los primeros 50 marcos (glucosa 5 mM). Luego restar toda la serie de tiempo la línea de base (F0) (F – F0).
Nota: algunas células pueden mostrar claro GCaMP las oscilaciones bajo glucosa basal, que suele seguir estimulación con concentraciones más altas. Para tales células, sólo es posible estimar F0 tomando la intensidad media de los fotogramas iniciales en el que las células mostraron una caída en fluorescencia. - En el segundo paso del análisis, obtener la intensidad de fluorescencia de GCaMP final la normalización de la intensidad de fluorescencia.
Nota: Esto se realiza para eliminar las diferencias entre islotes de diferentes animales. Islotes individuales muestran diferentes niveles de emisión de fluorescencia sobre el estímulo de glucosa. - Normalizar la intensidad de fluorescencia dividiendo con el valor más alto de intensidad. Para ello, calcular la intensidad máxima (Fmax F0) y dividir los valores de referencia restado intensidad máxima a la intensidad de fluorescencia de GCaMP final (F-F0) / (Fmax F0).
- En el primer paso, calcular la intensidad de fluorescencia por encima de la línea de base. Para ello, calcular la intensidad de línea de base fluorescente (F0) como el promedio de las intensidades de fluorescencia para los primeros 50 marcos (glucosa 5 mM). Luego restar toda la serie de tiempo la línea de base (F0) (F – F0).
- Deseche las células que no presentan un cambio en intensidad Tras estimulación de KCl, que sean insalubres o dañadas.
- Para realizar el análisis (pasos 4.9-4.10) en R, use el script de R (plotcelltrace. R) proporcionado con este manuscrito.
Resultados
Utilizando el protocolo descrito anteriormente, se analizaron las respuestas de la glucosa de las células beta en un islote de un pez cebra después fertilización (dpf) de 45 días. Para ello, el islote principal fue disecado de un sacrificio animal y montado en el molde de trombina fibrinógeno en un plato de fondo de cristal. El islote estaba inmerso en HBSS que contiene 5 mM de glucosa. Aumentó la concentración de glucosa de manera escalonada a 10 mM y 20 mM. Se registraron las respuestas de las células beta a las crecientes concentraciones de glucosa. Por último, las células beta se despolarizado con 30 mM KCl (figura 1). La despolarización con KCl induce la entrada de calcio en la salud de las células beta.
Uso de FIJI y un software de análisis de datos, la intensidad de fluorescencia de GCaMP6s de individual de las células beta se extrae y normalizó (figura 2). Vista desde el rastro de la intensidad de la fluorescencia, individual de las células beta mostrarán oscilaciones de GCaMP6s Fluorescencia Tras estimulación con glucosa, que se detiene sobre el estímulo de KCl. La técnica proporciona una solución celular glucosa-capacidad de respuesta de la célula beta y una ventana en su funcionalidad.
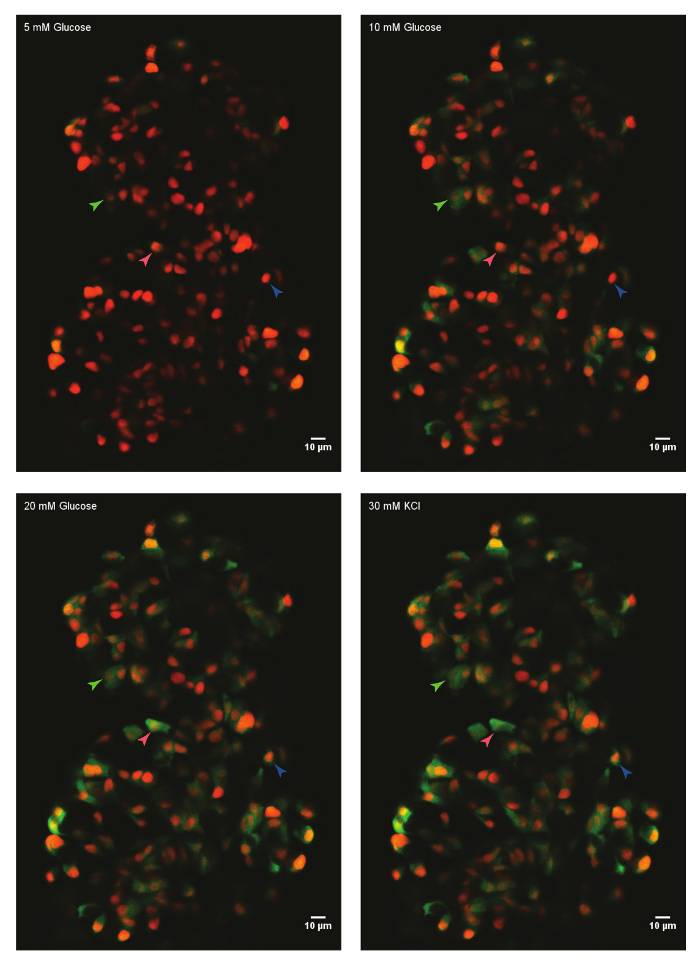
Figura 1: Ex vivo vivo-proyección de imagen del influjo de calcio mediante GCaMP6s en pez cebra células beta. Un islote principal de Tg(ins:nls-Renilla-mKO2); TG(ins:GCaMP6s) pez cebra (45 PD) fue montado en molde de trombina fibrinógeno e incubada con glucosa de 5 mM (basal). Las células beta fueron etiquetadas con un marcador rojo nuclear, mientras que la fluorescencia de GCaMP6s está presente en el canal verde. El islote era estimulado con una rampa de glucosa que consiste en la incubación secuencial con 10 mM y 20 mM D-glucosa y despolarizado mediante la adición de 30 mM que KCl. puntas marcan beta-células individuales cuya actividad era analizada. Haga clic aquí para ver una versión más grande de esta figura.
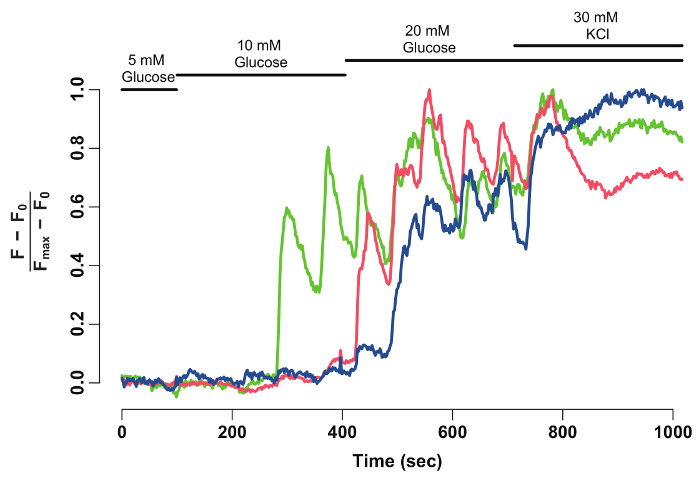
Figura 2: normalizado GCaMP6s fluorescencia intensidad-rastro de células beta individuales. Normalizado GCaMP6s fluorescencia intensidad-rastro de las células beta con puntas de flecha en la figura 1. El eje x indica el tiempo en segundos. En la parte superior, barras representan la concentración de glucosa y KCl en el medio HBSS. El eje y indica la intensidad de fluorescencia normalizado durante la serie de tiempo. Para ello, intensidad de línea de base (F0) se calcula como la intensidad media durante la incubación en 5 mM de glucosa. Esto se resta de los datos de series de tiempo completos (F - F0). Intensidad de base se normaliza por la intensidad máxima de la célula (F - F0) / (Fmax- F0). El rastro normalizado muestra una respuesta oscilatoria de las células beta a la glucosa, que se estabiliza cuando las células son despolarizadas con 30 mM de KCl. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí se demuestra una técnica para la cuantificación de la capacidad de respuesta de glucosa células beta en resolución unicelular. Esto es posible mediante el control de la concentración de calcio intracelular mediante un indicador de calcio codificado genéticamente, GCaMP6s. La actividad de la célula beta es capturado ex vivo montando el islote en un molde de trombina fibrinógeno. Un paso fundamental del protocolo es la estabilidad del molde. Tiempo suficiente se debe prestar para que el fibrinógeno disolver en la solución HBSS. Sin esto, el molde no polimerizar suficientemente para proporcionar estabilidad durante la sesión de imágenes. Un islote montadas en molde de trombina fibrinógeno e inmersos en medios de cultivo celular puede permanecer viable durante por lo menos una semana (datos no mostrados). Alternativas para el molde del fibrinógeno trombina, como la agarosa de la bajo-derretir, pueden ser utilizadas para montar el islote22. Otro parámetro importante es la disección del islote. Durante este paso, el tejido que rodea el islote debe removerse sin dañar o meter el islote. Una hábil disección viene con la práctica.
Una limitación del Protocolo de imagen es la restricción a un solo plano confocal del islote. Esto se hace para capturar la dinámica de la afluencia del calcio dentro de las individuales de células beta. Una pila de Z a través de todo el espesor de la isla conduce a bajas velocidades de imagen y la pérdida de señal oscilatoria de células individuales. Esta limitación podría mejorarse mediante el uso de medios más rápidos-proyección de imagen confocal como microscopía de disco giratorio, para capturar la dinámica del calcio en 3 dimensiones. Otra frontera sería en vivo calcio imagen12. La naturaleza transparente del embrión de pez cebra o el uso de cepas menos pigmento de pez cebra adultos23 podría abrir la posibilidad de que en vivo la proyección de imagen en el futuro.
La proyección de imagen de la actividad de células beta en la alta resolución espacial y temporal permite para investigar la heterogeneidad funcional entre individuales de las células beta. Este enfoque puede ayudar a arrojar luz sobre la existencia de subpoblaciones de células beta. Recientemente, varios estudios han demostrado la existencia de subpoblaciones en la nominalmente homogénea de las células beta24,25,26. Ex vivo la proyección de imagen puede combinarse con reporteros genéticas para la caracterización de la respuesta de la sub-población a la glucosa. Además, la combinación de la configuración de imagen con estimulación farmacológica permite para la detección de compuestos que podrían mejorar la funcionalidad de la célula beta.
En Resumen, la técnica presentada aquí permite la cuantificación y la comparación de la capacidad de respuesta de glucosa para cada de las células beta. Proporciona una ventana directa a la funcionalidad de la célula beta, un parámetro importante en el desarrollo de la diabetes.
Divulgaciones
Los autores no declaran a intereses financieros en competencia.
Agradecimientos
Agradecemos a miembros del laboratorio Ninov para comentarios sobre el manuscrito, los miembros del centro de Dresde de terapias regenerativas (CRTD) pescado y microscopía para asistencia técnica. N.N. es apoyado por fondos de la DFG-CRTD, racimo de la excelencia en TU Dresden, Fundación de investigación alemana (DFG) y del centro alemán de investigación de la Diabetes (DZD).
Materiales
| Name | Company | Catalog Number | Comments |
| Transgenic Zebrafish line: Tg(ins:nls-Renilla-mKO2; cryaa:CFP); Tg(ins:GCaMP6s; cryaa:mCherry) | By request from authors | ||
| Stereo microscope | ZEISS | 495015-0001-000 | SteREO Discovery.V8 |
| Fluorescence lamp | ZEISS | 423013-9010-000 | Illuminator HXP 120 V |
| Red Filter Cube | ZEISS | 000000-1114-462 | Filter set 45 HQ TexasRed |
| Confocal Microscope | ZEISS | LSM 780 | |
| Bovine fibrinogen | Sigma | F8630 | |
| HBSS (Hanks' Balanced Salt solution) | ThermoFisher | 14025092 | |
| Thrombin | Sigma | T4648 | |
| D-Glucose | Sigma | G8270 | |
| KCl | Sigma | P9333 | |
| 35 mm diameter glass-bottom dishes | ThermoFisher | 150680 | |
| tricaine methane sulfonate | Sigma | E10521 | |
| Fine Forceps | Fine Science Tools | 11445-12 | |
| FIJI, using ImageJ Version: 2.0.0-rc-43/1.50e | https://fiji.sc/ | ||
| R, version 3.2.4 | https://www.r-project.org/ | ||
| RStudio | https://www.rstudio.com/ | ||
| plotcelltrace.R | A custom script provided with the manuscript |
Referencias
- Kahn, S. E. The relative contributions of insulin resistance and beta-cell dysfunction to the pathophysiology of Type 2 diabetes. Diabetologia. 46 (1), 3-19 (2003).
- Ogurtsova, K., et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract. 128, 40-50 (2017).
- Pipeleers, D. G. Heterogeneity in pancreatic beta-cell population. Diabetes. 41 (7), 777-781 (1992).
- MacDonald, P. E., Joseph, J. W., Rorsman, P. Glucose-sensing mechanisms in pancreatic beta-cells. Philos Trans R Soc Lond B Biol Sci. 360 (1464), 2211-2225 (2005).
- Hellman, B., et al. Glucose induces oscillatory Ca2+ signalling and insulin release in human pancreatic beta cells. Diabetologia. 37, S11-S20 (1994).
- Bergsten, P., Grapengiesser, E., Gylfe, E., Tengholm, A., Hellman, B. Synchronous oscillations of cytoplasmic Ca2+ and insulin release in glucose-stimulated pancreatic islets. J Biol Chem. 269 (12), 8749-8753 (1994).
- Wollheim, C. B., Pozzan, T. Correlation between cytosolic free Ca2+ and insulin release in an insulin-secreting cell line. J Biol Chem. 259 (4), 2262-2267 (1984).
- Pace, C. S., Price, S. Electrical responses of pancreatic islet cells to secretory stimuli. Biochem Biophys Res Commun. 46 (4), 1557-1563 (1972).
- Ohara-Imaizumi, M., Nakamichi, Y., Tanaka, T., Ishida, H., Nagamatsu, S. Imaging exocytosis of single insulin secretory granules with evanescent wave microscopy: distinct behavior of granule motion in biphasic insulin release. J Biol Chem. 277 (6), 3805-3808 (2002).
- Soria, B., Martin, F. Cytosolic calcium oscillations and insulin release in pancreatic islets of Langerhans. Diabetes Metab. 24 (1), 37-40 (1998).
- Kenty, J. H. R., Melton, D. A. Testing pancreatic islet function at the single cell level by calcium influx with associated marker expression. PLoS One. 10 (4), e0122044 (2015).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Bootman, M. D., Rietdorf, K., Collins, T., Walker, S., Sanderson, M. Ca2+-sensitive fluorescent dyes and intracellular Ca2+ imaging. Cold Spring Harb Protoc. 2013 (2), 83-99 (2013).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Hesselson, D., Anderson, R. M., Beinat, M., Stainier, D. Y. R. Distinct populations of quiescent and proliferative pancreatic beta-cells identified by HOTcre mediated labeling. Proc Natl Acad Sci U S A. 106 (35), 14896-14901 (2009).
- Pisharath, H., Rhee, J. M., Swanson, M. A., Leach, S. D., Parsons, M. J. Targeted ablation of beta cells in the embryonic zebrafish pancreas using E. coli nitroreductase. Mech Dev. 124 (3), 218-229 (2007).
- Curado, S., Stainier, D. Y. R., Anderson, R. M. Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies. Nat Protoc. 3 (6), 948-954 (2008).
- Singh, S. P., et al. Different developmental histories of beta-cells generate functional and proliferative heterogeneity during islet growth. Nat Commun. 8 (1), 664 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676 (2012).
- R Core Team. . R: A Language and Environment for Statistical Computing. , (2016).
- Friedman, R. S., et al. An evolving autoimmune microenvironment regulates the quality of effector T cell restimulation and function. Proc Natl Acad Sci. 111 (25), 9223-9228 (2014).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Bader, E., et al. Identification of proliferative and mature β-cells in the islets of Langerhans. Nature. 535 (7612), 430-434 (2016).
- Dorrell, C., et al. Human islets contain four distinct subtypes of β cells. Nat Commun. 7, 11756 (2016).
- Johnston, N. R., et al. Beta Cell Hubs Dictate Pancreatic Islet Responses to Glucose. Cell Metab. 24 (3), 389-401 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados