Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
In Vitro Cría de las abejas solitarias: una herramienta para evaluar factores de riesgo larvas
En este artículo
Resumen
Pulverizaciones de fungicidas en plantas con flores pueden exponer a las abejas solitarias a altas concentraciones de residuos de fungicida transmitidas por el polen. Mediante experimentos en laboratorio en vitro-larvas de abeja criados, este estudio investiga los efectos interactivos de consumir polen tratados con fungicida derivado de plantas huésped y anfitrión no.
Resumen
Aunque las abejas solitarias servicios de polinización crucial para cultivos silvestres y manejados, este grupo de especies ha sido en gran parte pasado por alto en estudios de reglamentación de pesticidas. El riesgo de exposición a los residuos del fungicida es probable que sea especialmente alto si el aerosol se produce en o cerca de plantas huésped mientras que las abejas recolectan polen para sus nidos. Para especies de nomada que consumen polen de un selecto grupo de plantas (oligolecty), la incapacidad de utilizar el polen de plantas no hospederas puede aumentar su factor de riesgo para toxicidad relacionada con el fungicida. Este manuscrito describe protocolos utilizados para criar con éxito a oligolectic mason abejas, Osmia ribifloris sensu lato, de huevo a la etapa prepupal en placas de la célula bajo condiciones estandarizadas de laboratorio. El en vitro-abejas criadas se utilizan posteriormente para investigar los efectos de la exposición y polen fuente de fungicida en fitness de la abeja. Basado en un diseño factorial 2 × 2 totalmente cruzado, el experimento examina los efectos principales e interactivos de fungicida exposición y polen fuente en larvas fitness, cuantificado por biomasa prepupal, el tiempo de desarrollo larval y la supervivencia. Una gran ventaja de esta técnica es que en vitro-criadas abejas reduce la variabilidad natural de fondo y permite la manipulación simultánea de varios parámetros experimentales. El protocolo descrito presenta una herramienta versátil para las hipótesis de prueba que implica el conjunto de factores que afectan la salud de las abejas. Para que esfuerzos de conservación para cumplir con éxito significativo, duradero, tales ideas sobre la compleja interacción de factores fisiológicos y ambientales abeja disminución de conducción será crítica.
Introducción
Dado su papel como el grupo dominante de insectos polinizadores1, la pérdida global de las poblaciones de abejas amenaza la seguridad alimentaria y el ecosistema estabilidad2,3,4,5,6 ,7. La tendencia descendente en ambas poblaciones de abejas manejadas y silvestres se han atribuido a varios factores de riesgo compartidos, incluyendo la fragmentación del hábitat, emergentes de parásitos y patógenos, pérdida de diversidad genética y la introducción de especies invasoras3 ,4,7,8,9,10,11,12. En particular, el dramático incremento en el uso de plaguicidas, (por ejemplo, neonicotinoides) ha sido relacionado con efectos perjudiciales entre las abejas13,14,15. Varios estudios han demostrado que el sinergismo entre neonicotinoides y fungicidas (EBI) inhibición de biosíntesis de ergosterol puede llevar a elevada mortalidad a través de múltiples abejas especies16,17,18 , 19 , 20 , 21 , 22. sin embargo, fungicidas, considerados durante mucho tiempo ser 'bee-safe', continúan ser aplicados en cultivos de in bloom sin mucho escrutinio23. Las abejas libadoras se han documentado para llevar habitualmente cargas de polen contaminadas con residuos de fungicida24,25,26. El consumo de esto fungicidas-ladenpollen puede causar alta mortalidad larval abejas27,28,29,30y una suite de efectos subletales entre abejas adultas16 , 31 , 32 , 33 , 34. un estudio reciente sugiere que los fungicidas pueden causar pérdidas de abejas alterando la comunidad microbiana dentro de polen almacenado de colmena, interrumpiendo así las simbiosis fundamentales entre abejas y polen transmitidas por microbios35.
Aunque las abejas solitarias son vitales para la polinización de plantas silvestres y agrícolas varios36,37,38, este grupo diverso de polinizadores ha recibido mucha menos atención en estudios de monitoreo de pesticidas. El nido de una hembra solitaria adulta contiene 5-10 cámaras de cría selladas, cada uno abastecido con una masa finita de maternal recogen polen y néctar y un huevo individual39. Después de la eclosión, las larvas se basan en el suministro de polen asignado y la microbiota asociada transmitidas por el polen para obtener una nutrición adecuada40,41. Porque carecen de los beneficios de un estilo de vida social, las abejas solitarias pueden ser más vulnerables a los pesticidas de exposición42. Por ejemplo, mientras déficits en abejas sociales siguiendo un aerosol puede ser compensada a algunos extienden por trabajadores y emergentes cría, la muerte de una sola hembra adulta solitaria termina toda actividad reproductiva43. Tales diferencias en la susceptibilidad resaltan la necesidad de incorporar taxones diversos abeja en estudios ecotoxicológicos para asegurar una protección adecuada para las abejas silvestres y manejadas por igual. Sin embargo, aparte de un puñado de estudios, las investigaciones sobre los efectos de la exposición de fungicida se ha enfocado principalmente en abejas sociales18,23,32,44,45 ,46,47,48,49.
Las abejas solitarias pertenecientes al género Osmia (figura 1) se han utilizado en todo el mundo como eficientes polinizadores de varias importantes frutos y tuerca cultivos39,50,51,53, 53. como con otros polinizadores gestionado grupos de24,54,55,56,57,58, abejas adultas nomada son rutinariamente expuestos a fungicidas en cultivos en floración44. Hembras adultas alimentándose en los cultivos recientemente pulverizados pueden acumular y almacenar sus cámaras de cría con polen cargados de fungicida, que más tarde forma la dieta única para las larvas en desarrollo. Consumiendo las provisiones de polen contaminados posteriormente puede exponer las larvas a fungicida residuos42. El riesgo de exposición puede ser mayor entre las especies de oligolectic que alimentan solamente en algunos host relaciona plantas59,60,61. Por ejemplo, ciertas abejas megachilid, parecen forraje preferencial de polen de Asteraceae de baja calidad, como una forma de reducir el parasitismo62. Sin embargo, la medida que fungicidas impactan fitness larvas entre las abejas solitarias oligolectic no sido empíricamente cuantificada. El objetivo de este estudio es desarrollar un protocolo para prueba de la cañería y efectos interactivos de la fuente de exposición y polen de fungicida en la aptitud de in vitro criaban abejas solitarias. Para investigar, huevos de o. ribifloris sensu lato (s.l.) se pueden obtener comercialmente (tabla de materiales). Esta población es ideal debido a su importancia como un polinizador nativo y su fuerte predilección por el rico néctar de Mahonia aquifolium (uvas de Oregón) encontrado dentro de la región53,63,64 (Figura 2).

Figura 1. Una foto de alta resolución de un adulto Osmia ribifloris. Foto crédito Dr. Jim Cane, entomólogo de la investigación, USDA-ARS haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Phragmite nidos juncos de Osmia ribifloris (s.l.) con una hembra de anidación en el primer plano. Particiones de cámara y tapones terminales para las cañas están construidas de hojas masticados. Foto cortesía Sr. Kimball Clark, NativeBees.com por favor haga clic aquí para ver una versión más grande de esta figura.
El primer objetivo de este estudio es evaluar el efecto del consumo de polen tratados con fungicida en larvas fitness (medido en términos de tiempo de desarrollo y biomasa prepupal). Mientras que la exposición al Propiconazol fungicida aplicado comúnmente se ha relacionado con aumento de la mortalidad entre abejas adultas a través de varias especies 23,24,32,44,45, 54,55,56,57,58,65,66,67, su impacto en las abejas larvas es menor conocido. El segundo objetivo de este estudio es evaluar los efectos del consumo de polen no host en fitness larval. Estudios previos indican que las larvas de las abejas oligolectic no desarrollar cuando obligado a consumir polen de host no68. Estos resultados pueden atribuirse a variaciones en la abeja fisiología69, polen bioquímica70y el microbioma benéfico asociados con polen natural disposiciones71. El tercer objetivo de este estudio es evaluar los efectos interactivos de polen dietético y tratamiento fungicida en fitness larval.
Numerosos rasgos biológicos incluyendo el tamaño del cuerpo materno, aprovisionamiento ritmo, estrategia de forrajeo y polen cantidad72,73,74,75 se saben que afectan larvas fitness entre las abejas solitarias. Estos factores pueden introducir variabilidad significativa entre Cañas, que plantea un desafío en el desarrollo de diseños experimentales defendibles cuando se evalúan salud de larvas. Por otra parte, dado que el desarrollo larvario se produce dentro de cañas de anidación selladas, los efectos de tal variabilidad en la descendencia son difíciles de visualizar y cuantificado sin utilizar técnicas no letales (figura 3). Para superar este desafío, todas las hipótesis en este estudio se analizan utilizando larvas criadas fuera de sus nidos juncos. El diseño experimental representa una totalmente cruzado 2 x 2 factorial configuraciones, con cada factor que consta de 2 niveles; Factor 1: Exposición fungicida (fungicida; Sin fungicida); Factor 2: Fuente de polen (Host polen, polen no-host). Las abejas se levantan de lo huevo a la etapa prepupal en placas pocillos estériles de la célula bajo condiciones controladas de laboratorio. Cada bien individualmente está equipado con una cantidad estandarizada de provisión de polen y un solo huevo. Después de la eclosión, la larva se alimenta de polen asignado dentro del pozo, completa el desarrollo larvario e inicia la pupación. Estudios anteriores han demostrado que la mortalidad inexplicada es menor entre las abejas planteadas dentro de este ambiente de crianza artificial que encontró en el salvaje49,76. El uso de vitro-abejas criadas tiene varias ventajas sobre los estudios de campo: 1) minimiza los efectos de confusión de la variabilidad natural y factores no controlados típicamente asociados con estudios en el campo; 2) que permite varios niveles de manipulación para cada factor de interés a probarse simultáneamente en los grupos de tratamiento; 3) el número de repeticiones puede ser predeterminado, y factores experimentales para cada repetición pueden manipularse individualmente; 4) variables de respuesta larvas pueden ser fácilmente visualizadas y grabadas independientemente sin inquietantes larvas adyacentes; 5) el protocolo puede ser modificado para adaptarse a diseños experimentales más complejos que involucra múltiples factores y variables de respuesta.

Figura 3. Contenidos dentro de una caña de anidación natural de Osmia ribifloris (s.l.). Cerca de (A) una caña disecada que muestran las cámaras, provisiones de polen y (B) y particiones recién cosechadas provisiones de polen y los huevos asociados (indicados con un círculo negro). Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Preparar soluciones de Propiconazol fungicida exposición experimentos
- Preparar 0.1 x solución fungicida disolviendo volúmenes apropiados de comercialmente comprados propiconazole 14.3% en agua estéril el día del experimento. Asegúrese de que la única solución fungicida recién preparado se utiliza para todos los tratamientos.
- Añadir 23 μl de 0,1 x solución de fungicida por gramo de provisión de polen para obtener la concentración máxima de propiconazole previamente divulgado del polen de abeja-recogido24 (0,361 PPM o μg del principio activo g-1 de polen).
2. cosecha de huevos y provisiones de polen Host de Osmia Cañas
- Con un bisturí esterilizado, diseccionar recién conectado anidación cañas de Osmia, dividir en dos partes a lo largo de la longitud de la caña para exponer las cámaras individuales.
Nota: Cada nido puede contener entre 8 y 14 cámaras y un solo huevo dentro de una cámara. - Inspeccione las cañas visualmente para identificar las cámaras que contienen huevos macho basados en directrices previamente publicado77. Uso esterilizado agujas despuntadas para quitar cada provisión de polen junto con el huevo asociado de la caña de anidación y colocar en un peso barco.
- Suavemente separa el huevo de la prestación con un pincel limpio fino y registrar el peso fresco de la provisión de polen y de huevo con una balanza de laboratorio estándar. Calcular el peso promedio de las disposiciones del polen masculino.
- Realice los pasos siguientes con retardo mínimo para reducir las posibilidades de daño al huevo de la exposición a exceso de temperatura y la deshidratación.
3. preparar provisiones de polen de planta huésped
- Inspeccione visualmente el polen de las plantas de anfitrión maternal recogidos de las cámaras de anidamiento para asegurar que no hay parásitos presentes78. Con el fin de reducir cualquier sesgo potencial maternal, combinar las disposiciones de polen en una sola masa en una placa Petri estéril y mezclar bien con una aguja esterilizada.
- Dividir la masa combinada de nuevas provisiones de polen, asegurando que el peso de cada disposición reconstituido es aproximadamente igual al peso promedio de una disposición naturalmente asignado masculino (promedio ± SE de 0,35 ± 0,01 g, N = 42).
Nota: Porque Osmia sp. asigna más pequeñas provisiones de polen a la descendencia masculina, esto se traduce en menor peso corporal de las larvas macho comparada con la de las mujeres77. Para evitar tal sesgo resultante de las diferencias de sexo, solamente use huevos masculinos en los experimentos.
4. preparar la disposición de polen de planta no huésped
- Pulverizar comercialmente comprado miel abeja recoge polen a un polvo fino usando un molino de bolas de laboratorio estándar.
- Basado en el contenido de humedad de las disposiciones acogida maternal recogen polen (~ 20%), hidratar el polvo del polen usando adecuados volúmenes de solución de azúcar 40% esterilizado79 y mezcla bien para formar una consistencia de masa.
- Se dividen en masas de polen individuales, cada uno pesa aproximadamente lo mismo que el peso medio de una disposición masculina naturalmente asignado.
Nota: Grado de humedad del polen de acogida maternal recogen disposiciones pueden estandarizarse en previos comparando el peso fresco y seco de provisiones de polen de 30 cámaras hombres seleccionados al azar80. Para obtener el peso seco, provisiones de polen deben ser liofilizados en un liofilizador (1.5 Pa durante 72 h).
5. preparar platos para cultivo celular pocillos
- Línea de pozos individuales de la placa de cultivo de 48 pozos estériles con autoclave tazas de lata (5 × 9 cm). Utilizando pinzas estériles, toque suavemente hacia fuera el borde superior de la cápsula de manera que puede contener el suministro de polen.
- Coloque una sola masa de anfitrión o host no provisión de polen dentro de la taza lata utilizando herramientas estériles basados en el grupo de tratamiento.
Nota: Para evitar la contaminación cruzada, utilizar placas separadas por grupos de tratamiento y control.
6. Añadir fungicidas
- Hacer una depresión centralmente colocada dentro de la masa de polen usando un palillo de madera estéril. Utilice un palillo nuevo para cada suministro de polen.
- Añadir volúmenes adecuados de solución fungicida (para tratamiento), o agua estéril (para controles) en la depresión. Pellizcar la apertura de la depresión usando pinzas estériles para minimizar la superficie de contacto entre el fungicida / estéril agua y el huevo.
- Asegúrese de que la configuración factorial del diseño experimental se alinea con el representado en la representación esquemática (figura 4).
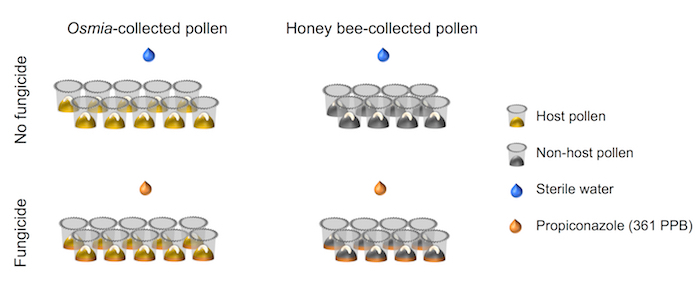
Figura 4. Representación esquemática de la disposición experimental. El experimento representa un totalmente cruzado 2 x 2 factorial configuraciones. El factor 1 representa exposición fungicida y consta de 2 niveles: (i) ningún fungicida (N = 10) y (ii) fungicida (N = 10). Factor 2 representa la fuente de polen y consta de 2 niveles: polen (i) Host (N = 8) y (ii) no-host polen (N = 8). Haga clic aquí para ver una versión más grande de esta figura.
7. posterior y observar las larvas
- Colocar un huevo masculino seleccionado al azar en la parte superior de la provisión de polen con un pincel limpio fino. Una vez que los huevos han sido colocados en todas las disposiciones, vuelva a colocar la tapa de la placa de cultivo celular, asegurándola con cinta en las esquinas de etiquetado.
- Coloque las placas bien en una bandeja limpia y cubrirla con un paño oscuro para obstruir el contacto con la luz directa. Lugar un pozo 6 de la placa que contiene 30 mL de agua estéril dentro de la bandeja para evitar desecación. Deje las bandejas de incubación sin perturbaciones dentro de una incubadora a temperatura ambiente.
- Observar las placas bien diariamente bajo un microscopio de disección sin quitar la tapa de las placas bien. Asegúrese de que las larvas están vivas comprobando el movimiento. Si se detecta ningún movimiento, deseche la taza lata con larvas muertas y la provisión de polen restante. Permita que todas las larvas sobrevivientes a desarrollar sin perturbaciones dentro de las placas bien hasta llegar a la etapa prepupal.
- Eliminar la larva de la Copa de lata una vez que alcanza la etapa prepupal41. Utilice un cepillo para limpiarlas defecar desde el capullo de seda. Cuidadosamente corte el capullo de seda utilizando un microscopio de disección y extraer la prepupa con pinzas de goma.
- La prepupa suavemente para asegurar que las herramientas no perforar el cuerpo suave de la manija. Registrar el peso fresco de la prepupa (prepupal biomasa) y el tiempo de desarrollo de huevo a la etapa prepupal (tiempo de desarrollo larval).
Nota: Cualquier larva muerta debe ser desechada inmediatamente para evitar el crecimiento microbiano indeseable en el cadáver y disposición de restos de polen. Esto reduce el riesgo de infección a las larvas sanas restantes.
Resultados
Fitness larval se cuantificó usando tres tiempo de desarrollo (i) larvas de métricas (ii) prepupal biomasa y supervivencia (iii) por ciento. Se llevó a cabo un ANOVA de dos vías con exposición de fungicida (dos niveles: ningún fungicida, fungicida) y fuente de polen (dos niveles: Host polen, polen no-host) como variables independientes y tiempo de desarrollo larval como variable dependiente. El principal efecto para la exposición de fungicida (F1,28 = 1,24, ...
Discusión
Cría de abejas fuera de sus naturales desove Cañas, bajo condiciones de laboratorio, permite la prueba de hipótesis múltiples sobre larvas fitness. En la medida en que factores no identificados continúan causan mortalidad de las abejas, estudios de evaluación de riesgos en vitro experimentos pueden ayudar a identificar posibles amenazas e informar las prácticas de manejo para este grupo de especies de polinizadores silvestres 12 ,38,
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen Kimball Clark y Tim Krogh para proporcionar Cañas anidación Osmia , Meredith Nesbitt y Molly Bidwell para asistencia en el laboratorio, los doctores Cameron Currie, Christelle Guédot, Terry Griswold, Michael Branstetter y tres revisores anónimos sus útiles observaciones que mejoraron el manuscrito. Este trabajo fue apoyado por fondos de USDA-Agricultural Research Service apropiado (actual investigación sistema de información #3655-21220-001), Departamento de agricultura de Wisconsin, el comercio y la protección de los consumidores (#197199), National Science Foundation (bajo Grant no. DEB-1442148), el DOE grandes lagos bioenergía Research Center (Oficina de DOE de ciencia BER DE-FC02-07ER64494).
Materiales
| Name | Company | Catalog Number | Comments |
| eggs of O. ribifloris sensu lato (s.l.) | Kaysville, Davis County, Utah, USA | ||
| Osmia reeds | Nativebees.com | NA | Freshly plugged reeds |
| Dissection set | VWR | 89259-964 | Sterilize before use |
| Long Nose Pliers | Husky | 1006 | |
| 6 well culture plates | VWR | 10062-892 | Sterile sealed |
| 48 well culture plates | VWR | 10062-898 | Sterile sealed |
| Petri dishes | VWR | 25373100 | Sterile sealed |
| Square Weighing Boats | VWR | 10770-448 | |
| Camel Hair Brush | Bioquip | 1153A | |
| Tin capsules | EA Consumables | D1021 | Sterilize before use |
| Sucrose | VWR | 470302-808 | |
| Propiconazole 14.3 | Quali-Ppro | 60207-90-1 | Propiconazole 14.3% |
| Honey bee pollen | Bee energised | 897098001244 | Untreated, natural, raw pollen |
| Microbalance | VWR | 10204-990 | |
| Pulverisette | LAB SYNERGY INC. | 30334913 | |
| Wooden sticks | VWR | 470146908 | Sterilize before use |
| Sealing tape | VWR | 89097-912 | |
| Microscope | VWR | 89403-384 | |
| Planting tray | VWR | 470150-632 | |
| Ethanol | VWR | BDH1158-4LP | |
| Centrifuge tube | VWR | 21008936 | |
| Microsyringe | Cole-Palmer | UX-07940-07 | |
| Rubber tweezer | Amazon | B0135HWPN4 | |
| Syringe needles | VWR | 89219-334 | |
| Freeze drier | Labcono | LFZ-1L | |
| Statistical software | SPSS | Version 21.0 |
Referencias
- Klein, A. -. M., et al. Importance of pollinators in changing landscapes for world crops. P Roy Soc Lond B Bio. 274 (1608), 303-313 (2007).
- Biesmeijer, J. C. J., et al. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science. 313 (5785), 351-354 (2006).
- Potts, S. G., Biesmeijer, J. C., Kremen, C., Neumann, P., Schweiger, O., Kunin, W. E. Global pollinator declines: Trends, impacts and drivers. Trends Ecol Evol. 25 (6), 345-353 (2010).
- Cameron, S. A., et al. Patterns of widespread decline in North American bumble bees. P Natl Acad Sci USA. 108 (2), 662-667 (2011).
- Gallai, N., Salles, J. M., Settele, J., Vaissière, B. E. Economic valuation of the vunerability of world agriculture confronted with pollinator decline. Ecol Econ. 68 (3), 810-821 (2009).
- Fontaine, C., Dajoz, I., Meriguet, J., Loreau, M. Functional diversity of plant-pollinator interaction webs enhances the persistence of plant communities. Plos Biol. 4 (1), 0129-0135 (2006).
- Kluser, S., Peduzzi, P. . Global pollinator decline: a literature review. , (2007).
- Brown, M. J. F., Paxton, R. J. The conservation of bees: a global perspective. Apidologie. 40 (3), (2009).
- Lebuhn, G., et al. Detecting insect pollinator declines on regional and global scales. Conserv Biol. 27 (1), (2013).
- Vanengelsdorp, D., Meixner, M. D. A historical review of managed honey bee populations in Europe and the United States and the factors that may affect them. J Invertebr Pathol. , S80-S95 (2010).
- Pettis, J. S., Delaplane, K. S. Coordinated responses to honey bee decline in the USA. Apidologie. 41 (3), 256-263 (2010).
- Sandrock, C., Tanadini, L. G., Pettis, J. S., Biesmeijer, J. C., Potts, S. G., Neumann, P. Sublethal neonicotinoid insecticide exposure reduces solitary bee reproductive success. Agr Forest Entomol. 16 (2), (2014).
- Van der Sluijs, J. P., Simon-Delso, N., Goulson, D., Maxim, L., Bonmatin, J. M., Belzunces, L. P. Neonicotinoids, bee disorders and the sustainability of pollinator services. Curr Opin Env Sust. 5 (3), (2013).
- Goulson, D., Nicholls, E., Botías, C., Rotheray, E. L. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science. 347 (6229), (2015).
- Johnson, R. M., Ellis, M. D., Mullin, C. A., Frazier, M. Pesticides and honey bee toxicity - USA. Apidologie. 41 (3), (2010).
- Iwasa, T., Motoyama, N., Ambrose, J. T., Roe, R. M. Mechanism for the differential toxicity of neonicotinoid insecticides in the honey bee, Apis mellifera. Crop Protection. 23 (5), 371-378 (2004).
- Glavan, G., Bozic, J. The synergy of xenobiotics in honey bee Apis mellifera: mechanisms and effects. Acta Biol. Slov. 56, 11-27 (2013).
- Biddinger, D. J., et al. Comparative toxicities and synergism of apple orchard pesticides to Apis mellifera (L.) and Osmia cornifrons (Radoszkowski). PLoS ONE. 8 (9), e72587 (2013).
- Thompson, H. M., Fryday, S. L., Harkin, S., Milner, S. Potential impacts of synergism in honeybees (Apis mellifera) of exposure to neonicotinoids and sprayed fungicides in crops. Apidologie. 45 (5), 545-553 (2014).
- Jansen, J. -. P., Lauvaux, S., Gruntowy, J., Denayer, J. Possible synergistic effects of fungicide-insecticide mixtures on beneficial arthropods. IOBC-WPRS Bulletin. 125, 28-35 (2017).
- Robinson, A., Hesketh, H., et al. Comparing bee species responses to chemical mixtures: Common response patterns?. PLoS ONE. 12 (6), (2017).
- Sgolastra, F., Medrzycki, P., et al. Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species. Pest Management Science. 73 (6), 1236-1243 (2017).
- Ladurner, E., Bosch, J., Kemp, W. P., Maini, S. Assessing delayed and acute toxicity of five formulated fungicides to Osmia lignaria and Apis mellifera. Apidologie. 36 (3), 449-460 (2005).
- Mullin, C. A., et al. High levels of miticides and agrochemicals in North American apiaries: implications for honey bee health. PloS one. 5 (3), e9754 (2010).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R., Vanengelsdorp, D. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS one. 8 (7), e70182 (2013).
- David, A., et al. Widespread contamination of wildflower and bee-collected pollen with complex mixtures of neonicotinoids and fungicides commonly applied to crops. Environ Int. 88, 169-178 (2016).
- Zhu, W., Schmehl, D. R., Mullin, C. A., Frazier, J. L. Four common pesticides, their mixtures and a formulation solvent in the hive environment have high oral toxicity to honey bee larvae. PloS one. 9 (1), e77547 (2014).
- Simon-Delso, N., Martin, G. S., Bruneau, E., Minsart, L. A., Mouret, C., Hautier, L. Honeybee colony disorder in crop areas: The role of pesticides and viruses. PLoS ONE. 9 (7), (2014).
- Park, M. G., Blitzer, E. J., Gibbs, J., Losey, J. E., Danforth, B. N. Negative effects of pesticides on wild bee communities can be buffered by landscape context. P Roy Soc B-Biol Sci. 282 (1809), 20150299-20150299 (2015).
- Bernauer, O. M., Gaines-Day, H. R., Steffan, S. A. Colonies of bumble bees (Bombus impatiens) produce fewer workers, less bee biomass, and have smaller mother queens following fungicide exposure. Insects. 6 (2), 478-488 (2015).
- Williamson, S. M., Wright, G. A. Exposure to multiple cholinergic pesticides impairs olfactory learning and memory in honeybees. J Exp Biol. 216 (10), 1799-1807 (2013).
- Artz, D. R., Pitts-Singer, T. L. Effects of fungicide and adjuvant sprays on nesting behavior in two managed solitary bees, Osmia lignaria and Megachile rotundata. PLoS ONE. 10 (8), e0135688 (2015).
- Pilling, E. D., Bromleychallenor, K. A. C., Walker, C. H., Jepson, P. C. Mechanism of synergism between the pyrethroid insecticide lambda-cyhalothrin and the imidazole fungicide prochloraz, in the honeybee (Apis mellifera L). Pestic Biochem Phys. 51 (1), 1-11 (1995).
- Johnson, R. M., Wen, Z., Schuler, M. A., Berenbaum, M. R. Mediation of pyrethroid insecticide toxicity to honey bees (Hymenoptera: Apidae) by cytochrome P450 monooxygenases. J. Econ. Entomol. 99 (4), 1046-1050 (2006).
- Steffan, S. A., Dharampal, P. S., Diaz-Garcia, L. A., Currie, C. R., Zalapa, J. E., Hittinger, C. T. Empirical, metagenomic, and computational techniques illuminate the mechanisms by which fungicides compromise bee health. JoVE. (128), e54631 (2017).
- Batra, S. W. T. Solitary bees. Sci Am. 250 (2), 120-127 (1984).
- Linsley, E. G. The ecology of solitary bees. Hilgardia. 27 (19), 543-599 (1958).
- Garibaldi, L. A., et al. Wild Pollinators Enhance Fruit Set of Crops Regardless of Honey Bee Abundance. Science. 339 (6127), 1608-1611 (2013).
- Bosch, J., Kemp, W. P. . How to manage the blue orchard bee. , (2001).
- Keller, A., Grimmer, G., Steffan-Dewenter, I. Diverse microbiota identified in whole intact nest chambers of the red mason bee Osmia bicornis (Linnaeus 1758). PLoS ONE. 8 (10), e78296 (2013).
- Bosch, J., Kemp, W. P. Development and Emergence of the Orchard Pollinator Osmia lignaria (Hymenoptera: Megachilidae). Environmental Entomology. 29 (1), 8-13 (2000).
- Brittain, C., Potts, S. G. The potential impacts of insecticides on the life-history traits of bees and the consequences for pollination. Basic and Applied Ecology. 12 (4), 321-331 (2011).
- Arena, M., Sgolastra, F. A meta-analysis comparing the sensitivity of bees to pesticides. Ecotoxicology. 23 (3), 324-334 (2014).
- Ladurner, E., Bosch, J., Kemp, W. P., Maini, S. Foraging and nesting behavior of Osmia lignaria (Hymenoptera: Megachilidae) in the presence of fungicides: cage studies. J Econ Entomol. 101 (3), 647-653 (2008).
- Huntzinger, A. C. I., James, R. R., Bosch, J., Kemp, W. P. Fungicide tests on adult alfalfa leafcutting bees (Hymenoptera: Megachilidae). J Econ Entomol. 101 (4), 1088-1094 (2008).
- Tsvetkov, N., et al. Chronic exposure to neonicotinoids reduces honey bee health near corn crops. Science. 356 (6345), 1395-1397 (2017).
- Mao, W., Schuler, M. A., Berenbaum, M. R. Disruption of quercetin metabolism by fungicide affects energy production in honey bees (Apis mellifera). P Natl Acad Sci. 114 (10), 2538-2543 (2017).
- Blacquière, T., Smagghe, G., Van Gestel, C. A. M., Mommaerts, V. Neonicotinoids in bees: A review on concentrations, side-effects and risk assessment. Ecotoxicology. 21 (4), 973-992 (2012).
- Sgolastra, F., Tosi, S., Medrzycki, P., Porrini, C., Burgio, G. Toxicity of spirotetramat on solitary bee larvae, Osmia cornuta (Hymenoptera: Megachilidae), in laboratory conditions. Journal of Apicultural Science. 59 (2), 73-83 (2015).
- Mader, E., Spivak, M., Evans, E. . Managing Alternative Pollinators. , (2010).
- Bosch, J., Kemp, W. P. Developing and establishing bee species as crop pollinators: the example of Osmia spp.(Hymenoptera: Megachilidae) and fruit trees. B Entomol Res. 92 (1), 3-16 (2002).
- Sampson, B. J., Rinehart, T. A., Kirker, G. T., Stringer, S. J., Werle, C. T. Phenotypic variation in fitness traits of a managed solitary bee, Osmia ribifloris (Hymenoptera: Megachilidae). J Econ Entomol. 108 (6), 2589-2598 (2015).
- Sampson, B. J., Cane, J. H., Kirker, G. T., Stringer, S. J., Spiers, J. M. Biology and management potential for three orchard bee species (Hymenoptera: Megachilidae): Osmia ribifloris Cockerell, O. lignaria (Say) and O.chalybea Smith with emphasis on the former. Acta Hort. 810, 549-555 (2009).
- Hladik, M. L., Vandever, M., Smalling, K. L. Exposure of native bees foraging in an agricultural landscape to current-use pesticides. Sci Total Environ. 542, 469-477 (2016).
- Long, E. Y., Krupke, C. H. Non-cultivated plants present a season-long route of pesticide exposure for honey bees. Nat Commun. 7, (2016).
- Krupke, C. H., Hunt, G. J., Eitzer, B. D., Andino, G., Given, K. Multiple routes of pesticide exposure for honey bees living near agricultural fields. PLoS ONE. 7 (1), e29268 (2012).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS ONE. 8 (10), e77550 (2013).
- Sánchez-Bayo, F., Goulson, D., Pennacchio, F., Nazzi, F., Goka, K., Desneux, N. Are bee diseases linked to pesticides? - A brief review. Environ Int. 89, 7-11 (2016).
- Steffan-Dewenter, I., Klein, A. -. M., Gaebele, V., Alfert, T., Tscharntke, T. Bee diversity and plant-pollinator interactions in fragmented landscapes. Specialization and generalization in plant-pollinator interactions. , 387-410 (2006).
- Kremen, C., Ricketts, T. Global perspectives on pollination disruptions. Conserv Biol. 14 (5), 1226-1228 (2000).
- Memmott, J., Waser, N. M., Price, M. V. Tolerance of pollination networks to species extinctions. P Roy Soc B-Biol Sci. 271 (1557), 2605-2611 (2004).
- Spear, D. M., Silverman, S., Forrest, J. R. K. Asteraceae pollen provisions protect Osmia mason bees (Hymenoptera: Megachilidae) from brood parasitism. The American Naturalist. 187 (6), 797-803 (2016).
- Rust, R. W. Biology of Osmia (Osmia) ribifloris Cockerell (Hymenoptera: Megachilidae). J Kansas Entomol Soc. 59, 89-94 (1986).
- Torchio, P. F. Osmia ribifloris, a native bee species developed as a commercially managed pollinator of highbush blueberry (Hymenoptera: Megachilidae). J Kansas Entomol Soc. 63 (633), 427-436 (1990).
- Sanchez-Bayo, F., Goka, K. Pesticide residues and bees - A risk assessment. PLoS ONE. 9 (4), e94482 (2014).
- Kasiotis, K. M., Anagnostopoulos, C., Anastasiadou, P., Machera, K. Pesticide residues in honeybees, honey and bee pollen by LC-MS/MS screening: Reported death incidents in honeybees. Sci Total Environ. 485 (1), 633-642 (2014).
- Stanley, J., Sah, K., Jain, S. K., Bhatt, J. C., Sushil, S. N. Evaluation of pesticide toxicity at their field recommended doses to honeybees, Apis cerana and A. mellifera through laboratory, semi-field and field studies. Chemosphere. 119, 668-674 (2015).
- Praz, C. J., Müller, A., Dorn, S. Specialized bees fail to develop on non-host pollen: Do plants chemically protect their pollen?. Ecology. 89 (3), 795-804 (2008).
- Sedivy, C., Müller, A., Dorn, S. Closely related pollen generalist bees differ in their ability to develop on the same pollen diet: Evidence for physiological adaptations to digest pollen. Funct Ecol. 25 (3), 718-725 (2011).
- Williams, N. M. Use of novel pollen species by specialist and generalist solitary bees (Hymenoptera: Megachilidae). Oecologia. 134, (2003).
- Graystock, P., Rehan, S. M., McFrederick, Q. S. Hunting for healthy microbiomes: determining the core microbiomes of Ceratina, Megalopta, and Apis bees and how they associate with microbes in bee collected pollen. Conserv Genet. 18 (3), 1-11 (2017).
- Bosch, J., Vicens, N. Relationship between body size, provisioning rate, longevity and reproductive success in females of the solitary bee Osmia cornuta. Behav Ecol Sociobiol. 60 (1), 26-33 (2006).
- Bosch, J., Vicens, N. Body size as an estimator of production costs in a solitary bee. Ecol Entomol. 27 (2), 129-137 (2002).
- Radmacher, S., Strohm, E. Factors affecting offspring body size in the solitary bee Osmia bicornis (Hymenoptera, Megachilidae). Apidologie. 41 (2), 169-177 (2010).
- Seidelmann, K. Open-cell parasitism shapes maternal investment patterns in the Red Mason bee Osmia rufa. Behav Ecol. 17 (5), (2006).
- Becker, M. C., Keller, A. Laboratory rearing of solitary bees and wasps. Insect Science. 23 (6), 918-923 (2016).
- Bosch, J. The nesting behaviour of the mason bee Osmia cornuta (Latr) with special reference to its pollinating potential (Hymenoptera, Megachilidae). Apidologie. 25, 84-93 (1994).
- Krunić, M., Stanisavljević, L., Pinzauti, M., Felicioli, A. The accompanying fauna of Osmia cornuta and Osmia rufa and effective measures of protection. B Insectol. 58 (2), 141-152 (2005).
- Elliott, S. E., Irwin, R. E., Adler, L. S., Williams, N. M. The nectar alkaloid, gelsemine, does not affect offspring performance of a native solitary bee, Osmia lignaria (Megachilidae). Ecol Entomol. 33 (2), 298-304 (2008).
- Hendriksma, H. P., Härtel, S., Steffan-Dewenter, I. Honey bee risk assessment: New approaches for in vitro larvae rearing and data analyses. Methods Ecol and Evol. 2 (5), 509-517 (2011).
- Aupinel, P., et al. Improvement of artificial feeding in a standard in vitro method for rearing Apis mellifera larvae. B Insectol. 58 (2), 107-111 (2005).
- Beekman, M., Ratnieks, F. L. W. Long-range foraging by the honey-bee, Apis mellifera L. Funct Ecol. 14 (4), 490-496 (2000).
- Gathmann, A., Tscharntke, T. Foraging ranges of solitary bees. J Anim Ecol. 71 (5), 757-764 (2002).
- Greenleaf, S. S., Williams, N. M., Winfree, R., Kremen, C. Bee foraging ranges and their relationship to body size. Oecologia. 153 (3), 589-596 (2007).
- . Bee Pollen Supplement - Bee Rescued Available from: https://beerescued.com/product/bee-rescued-bee-pollen-supplement/ (2018)
- Cane, J. H., Griswold, T., Parker, F. D. Substrates and Materials Used for Nesting by North American Osmia Bees (Hymenoptera: Apiformes: Megachilidae). Annals of the Entomological Society of America. 100 (3), 350-358 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados